RESUMEN
La enfermedad pulmonar obstructiva crónica (EPOC) incluye a los pacientes con bronquitis crónica y/o enfisema que tienen en común a presencia de una obstrucción crónica y progresiva al flujo aéreo, con clínica de disnea y cuya historia natural se ve modificada por episodios agudos de exacerbaciones. La exacerbación (EAEPOC) se define como un episodio agudo de inestabilidad clínica caracterizado por un empeoramiento mantenido de síntomas respiratorios. Es necesario distinguir una nueva EAEPOC de un fracaso terapéutico previo o de una recaída. Las EAEPOC se hacen con el tiempo más frecuentes e intensas deteriorando la función pulmonar y la calidad de vida. El diagnóstico de una EAEPOC consta de 3 pasos esenciales: a) diagnóstico diferencial; b) establecer la gravedad, y c) identificar su etiología. La principal causa las agudizaciones es la infección, tanto bacteriana como viral. Los antibióticos están especialmente indicados en las EAEPOC grave y la presencia de esputo purulento. Los betalactámicos (amoxicilina-clavulánico y cefditoreno) y las fluoroquinolonas (levofloxacino) son los antimicrobianos más utilizados. Esta revisión realiza una actualización del problema de la exacerbación aguda con origen infeccioso desde una perspectiva de la etiología, resistencias a los antimicrobianos, estudios microbiológicos, la estratificación del riesgo y el manejo antimicrobiano. Se analiza el riesgo, pronóstico y características de los pacientes con EPOC que desarrollan COVID19.
Palabras clave: EPOC, Exacerbación, Antimicrobianos, Resistencias, Cefditoreno, Fluoroquinolonas, COVID-19
ABSTRACT
COPD (chronic obstructive pulmonary disease) includes patients with chronic bronchitis and / or emphysema who have in common the presence of a chronic and progressive airflow obstruction, with symptoms of dyspnea and whose natural history is modified by acute episodes of exacerbations. Exacerbation (EACOPD) is defined as an acute episode of clinical instability characterized by a sustained worsening of respiratory symptoms. It is necessary to distinguish a new EACOPD from a previous treatment failure or a relapse. EACOPD become more frequent and intense over time, deteriorating lung function and quality of life. The diagnosis of EACOPD consists of 3 essential steps: a) differential diagnosis; b) establish the severity, and c) identify its etiology. The main cause of exacerbations is infection, both bacterial and viral. Antibiotics are especially indicated in severe EACOPD and the presence of purulent sputum. Beta-lactams (amoxicillin-clavulanate and cefditoren) and fluoroquinolones (levofloxacin) are the most widely used antimicrobials. This review updates the problem of acute exacerbation with infectious origin from the perspective of etiology, antimicrobial resistance, microbiological studies, risk stratification, and antimicrobial management. The risk, prognosis and characteristics of COPD patients who develop COVID19 are analyzed.
Keywords: COPD, Exacerbation, Antimicrobials, Resistance, Cefditoren, Fluoroquinolones, COVID-19
INTRODUCCIÓN
La enfermedad pulmonar obstructiva crónica (EPOC) es un cuadro clínico y funcional grave, en general progresivo y cuya evolución crónica natural se ve modificada por la aparición de exacerbaciones, que a su vez representan una causa frecuente de hospitalización y muerte [1]. Los datos más recientes del estudio EPISCAN II, realizado en España, muestran que entre un 9-10% de la población mayor de 40 años sufre la enfermedad [2-3] y que la EPOC representa la cuarta causa de mortalidad en el mundo [1]. La historia natural de la EPOC está condicionada por la existencia de tos, expectoración y, sobre todo, disnea progresiva, e incluye episodios repetidos de exacerbación, que modifican y agravan estos síntomas. La agudización grave es infrecuente en los estadios precoces de la EPOC, pero representa una característica habitual de la enfermedad cuando está en un estadio más evolucionado. El deterioro de la función respiratoria (FEV1) y sufrir una primera exacerbación moderada o grave son marcadores importantes indicativos de que el paciente va a continuar presentando nuevas exacerbaciones. Las exacerbaciones son responsables de una importante morbimortalidad, utilización de recursos sanitarios y de costes socioeconómicos. Los enfermos exacerbadores frecuentes tienen peor calidad de vida, una disminución más rápida de la función pulmonar y una mayor posibilidad de sufrir reingresos hospitalarios. La mortalidad intrahospitalaria varía entre un 4-30% y su presencia se asocia con la gravedad de la exacerbación, especialmente el desarrollo de insuficiencia respiratoria, la edad avanzada, la malnutrición y la presencia de comorbilidades [1].
En la literatura hay publicadas guías y consensos sobre el tratamiento y manejo de las exacerbaciones, tanto en el contexto global de la enfermedad [5-6] y como otras más específicas, sobre la utilización de antibióticos en los casos de agudización infecciosa [7-8]. La aparición en diciembre del 2019 de la pandemia por la COVID19 ha cambiado la perspectiva de las exacerbaciones en el sentido por un lado de una disminución de estas, que puede ser atribuido al efecto mascarilla y el aislamiento social; y por otra parte ha surgido un debate en la literatura acerca de si la EPOC supone un mayor riesgo de contraer la COVID19 y de fallecer como consecuencia de esta [8-10]. La edad avanzada de estos pacientes, el deterioro de la función pulmonar, las comorbilidades y la historia de tabaquismo suponen ya de por si un factor de peor evolución en cualquier infección respiratoria [11], y la infección por SARS-CoV-2 representa sin duda un factor determinante.
CONCEPTO
La agudización o exacerbación de la EPOC (EAEPOC) se define como un episodio agudo de inestabilidad clínica que acontece en el curso natural de la enfermedad y se caracteriza por un empeoramiento mantenido en el tiempo de los síntomas respiratorios. Desde el punto de vista fisiopatológico, las EAEPOC son eventos complejos habitualmente relacionados con un incremento de la inflamación local y sistémica, aumento de la producción de moco y un marcado atrapamiento aéreo. Estos cambios contribuyen a la aparición de síntomas, como el empeoramiento de la disnea, la tos, el incremento del volumen y/o los cambios en el color del esputo [5,7]. Otros síntomas posibles en las exacerbaciones más graves son la presencia de taquicardia, taquipnea, sibilantes, intolerancia al ejercicio, sensación de opresión torácica, fiebre, somnolencia y confusión (hipercapnia y acidosis respiratoria)
FRECUENCIA Y GRAVEDAD
Existe una gran variabilidad individual en la frecuencia de exacerbaciones entre los pacientes con EPOC y es mayor a medida que la enfermedad progresa. En promedio, los pacientes con EPOC experimentan entre 1 y 4 exacerbaciones/año. Sin embargo, la distribución es muy variable, pues mientras algunas personas no presentan estos episodios, otras lo hacen de forma repetida (fenotipo agudizador). En bastantes ocasiones, estos episodios se observan agrupados y continuados, lo que plantea la duda de si realmente son nuevas exacerbaciones o son resoluciones incompletas del episodio precedente. De hecho, guías como GesEPOC han establecido en su clasificación la existencia del fenotipo exacerbador [12,13] a la hora de pautar un determinado tratamiento, y han introducido los conceptos de fracaso terapéutico, recaída y recurrencia, que analizaremos posteriormente.
El factor más importante para el desarrollo de las EAEPOC es la gravedad de la obstrucción (FEV1) y el condicionante de riesgo de mortalidad son las hospitalizaciones previas [15]. La relación función pulmonar y riesgo de EAEPOC no es estrictamente lineal e intervienen otros factores, como los antecedentes de agudizaciones previas, edad avanzada, años de evolución de la enfermedad, hipersecreción de moco con la tos, uso de antibióticos o corticoides sistémicos en el último año y enfermedades asociadas como cardiopatía isquémica, insuficiencia cardiaca, diabetes, osteoporosis, depresión, cáncer de pulmón o enfermedad por reflujo gastroesofágico. Se ha señalado que el fenotipo agudizador frecuente (presentan dos o más exacerbaciones graves al año) tienen peor pronóstico en cuanto a mortalidad y descenso anual acelerado del FEV1 (GOLD 2021) [5].
La gravedad de las EAEPOC se relaciona con el grado funcional basal o previo, presencia de comorbilidad y número de exacerbaciones previas [5].
Leve: si solo requiere de tratamiento con broncodilatadores de acción corta (salbutamol).
Moderada, si requiere además utilización de antibióticos y/o corticoides orales.
Grave, si precisa de hospitalización y, en estos casos es frecuente que se acompañen de insuficiencia respiratoria
DIAGNÓSTICO
El diagnóstico de la EAEPOC es fundamentalmente clínico, aunque se espera que en un futuro próximo estén disponibles algunos marcadores biológicos que aumenten la precisión diagnóstica [5,6,12,13]. Se recomienda realizar una anamnesis que incluya el diagnóstico de confirmación previo de EPOC mediante espirometría, historia de exacerbaciones anteriores, gravedad de los síntomas respiratorios en función de su situación basal previa, exposición al humo del tabaco u a otros tóxicos ambientales y la presencia de comorbilidad.
Los pacientes que han recibido tratamiento de agudización en las cuatro semanas previas se considera que no presentan una EAEPOC como tal, puesto que esta situación indica recaída, fracaso terapéutico o recurrencia [12,13]. Para la valoración diagnóstica y de la gravedad, dependiendo de si la consulta se produce en atención primaria u hospitalaria, se recomienda realizar una serie de exploraciones complementarias. En el ámbito de la atención primaria es necesario medir la presión arterial, temperatura, frecuencia respiratoria y saturación de oxígeno con pulsioxímetro, identificar la presencia de taquipnea, edemas periféricos y observar si existe uso de musculatura accesoria. En el ámbito de urgencias hospitalarias, el estudio debe considerar además realización de analítica sanguínea que incluye dímero D, péptido natriurético tipo B (BNP) y troponinas (en función de datos clínicos), radiografía de tórax, gasometría arterial, ECG (detectar presencia de arritmias o cardiopatía isquémica), y ecocardiograma. Un cultivo de esputo está indicado solo en exacerbaciones frecuentes, graves o muy graves, necesidad de ventilación mecánica o en aquellas que no hayan respondido al tratamiento antibiótico empírico inicial. Por último, hay que valorar la realización de hemocultivos en pacientes con fiebre.
ANTIBIOTICOS EN LA EXACERBACION DE LA EPOC
Las infecciones del tracto respiratorio inferior son la primera causa de EAEPOC. Estas exacerbaciones representan una importante carga asistencial para la atención médica en los ámbitos de atención primaria y hospitalaria, especialmente durante el periodo invernal. Un elevado porcentaje de casos de exacerbación son de origen vírico, incluida la gripe y el virus respiratorio sincitial (VRS). El aspecto más importante estriba en el diagnóstico y tratamiento de las posibles infecciones bacterianas, para las que se requiere una indicación adecuada del tratamiento antibiótico. Esta decisión implica realizar una prescripción exclusiva del mismo en los casos necesarios, eficaz para evitar el fracaso terapéutico y con la duración adecuada para no incrementar las resistencias bacterianas ni los efectos adversos en el huésped.
En los pacientes que presentan una EAEPOC, la decisión del tratamiento antimicrobiano se realiza en general sin esperar a los resultados microbiológicos, atendiendo a la gravedad del episodio y de la propia enfermedad y a datos clínicos. Se han publicado recomendaciones terapéuticas y consensos para el manejo antibiótico de la EAEPOC, siempre basadas en la evidencia científica disponible o en opiniones de expertos cuando ésta no existe [4-6]. Los objetivos de estas recomendaciones y sus actualizaciones, es reducir la heterogeneidad, proporcionar ayuda en la toma de decisiones clínicas para disminuir la morbi-mortalidad y desarrollar estrategias preventivas.
Dos aspectos claves para considerar en la EAEPOC de causa bacteriana son la elección del antibiótico y de su vía de administración. En la elección del antimicrobiano deben tenerse en cuenta las tasas de curación demostradas en la práctica clínica, la tolerabilidad y el posible impacto en la selección de mecanismos de resistencia, tanto sobre los patógenos infectantes como en los microorganismos que integran la microbiota en cualquier localización. De forma general, la vía oral se emplea en pacientes no hospitalizados, que representan la mayor parte de los episodios de neumonía comunitaria y de exacerbaciones de los pacientes con EPOC. Además, los anti-bióticos orales se utilizan en la terapia secuencial tras el tratamiento endovenoso que, en la mayoría de las ocasiones, suele iniciarse en el propio hospital durante el ingreso [16].
En este apartado abordaremos tres aspectos básicos para la adecuada selección de antibióticos orales en las EAEPOC que son la efectividad, los efectos adversos y el impacto sobre la microbiota, incluyendo la emergencia y selección de resistencias [16,17].
a) Efectividad del antibiótico. Hablar de efectividad del antibiótico obliga a conocer cuáles son los microorganismos frente a los cuales nos enfrentamos con mayor frecuencia, de que antimicrobianos disponemos y cuál es la situación de las resistencias frente a ellos y tener en cuenta la denominada terapia secuencial, que permite un paso rápido desde tratamiento parenteral a oral (Tabla 1).
Tabla 1.
Efectividad antibiótico exacerbación EPOC: factores implicados
| 1.-Microorganismos implicados H. influenzae, S. pneumonia, M. catarrhalis, P aeruginosa |
| 2.-Resistencias antibióticas Betalactámicos Macrólidos Quinolonas |
| 3.-Terapia secuencial Mismo antibiótico Antibiótico misma clase y equivalencia Diferente antibiótico |
1. Microorganismos frecuentes en EAEPOC. Un tercio de las exacerbaciones se deben a infecciones víricas y otro 20%, e incluso más en el caso de exacerbaciones graves, presentan una etiología mixta, vírica y bacteriana. En las exacerbaciones leves y moderadas, las bacterias más habitualmente encontradas son Haemophilus influenzae (20-30%), Streptococcus pneumoniae (10-15%) y Moraxella catarrhalis (10-15%) [6,7,18]. En el caso de las exacerbaciones graves, hay un aumento de microorganismos gramnegativos entéricos y específicamente de Pseudomona aeruginosa (Tablas 2 y 3). Los factores de riesgo para la infección por P. aeruginosa, son la hospitalización reciente, la institucionalización, la administración de antibióticos en los 3 meses previos o más de 4 veces al año, la existencia de un FEV1 <30% (Tabla 3), el tratamiento previo con corticoides orales, la presencia de bronquiectasias y la colonización o aislamiento previo de P. aeruginosa [19].
Tabla 2.
Microrganismos implicados en la exacerbación de la EPOC en función de la gravedad y antibióticos indicados
| Gravedad de la agudización | Microorganismos | Antibiótico de elección | Alternativa |
|---|---|---|---|
| Agudización leve |
H. influenzae
S. pneumonaiae M. catarrhalis |
Amoxicilina-ácido clavulánico Cefditoreno |
Levofloxacinob Moxifloxacinob |
| Agudización moderada | Añadir S. pneumoniae resistente a penicilina y Enterobacterias |
v.o. | |
| Cefditoreno Amoxicilina-ácido clavulánico |
Levofloxacinob Moxifloxacinob |
||
| Agudización grave-muy grave SIN riesgo de infección por Pseudomonas | i.v. | ||
| Amoxicilina-ácido clavulánico Ceftriaxona Cefotaxima |
Levofloxacinob Moxifloxacinob |
||
| Agudización grave-muy grave CON riesgo de infección por Pseudomonas | Añadir al anterior P. aeruginosa | β-lactámico con actividad antipseudomónicaa | Quinolonas con actividad antipseudomónicac |
Se recomienda siempre que aparezca un cambio en el color del esputo. En la agudización moderada o grave también estará indicado cuando, en ausencia de purulencia, haya increento de la disnea y del volumen del esputo.
aCeftazidima, piperacilina-tazobactam, imipenem o meropenem, cefepima, ceftalozano-tazobactan
bFDA y EMA recomiendan evitar fluoroquínolonas si existe alternativa terapéutica debido a sus efectos adversos
cCiprofloxacino 500-700 mg cada 12 horas o levofloxacino 500 mg cada 12 horas
Tabla 3.
Microorganismos implicados en la exacerbación de la EPOC en función del grado de obstrucción (FEV1)
| FEV1% | Microorganismos | |
|---|---|---|
| Leve- Moderado | >50% |
H. influenzae
M. catarrhalis S. pneumoniae M. pneumoniae |
| Grave | 30-50% |
H. influenzae
M. catarrhalis S. pneumoniae(sensibilidad reducida a penicilina) P.aeruginosa Enterobacterias |
| Muy grave | <30% |
H. influenzae
S. pneumoniaeresistente Enterobacterias multirresistente P. aeruginosamultirresistente |
FEV1 volumen espiratorio forzado en el primer segundo expresado como porcentaje del valor teórico de referencia.
La situación postcovid no parece haber modificado esta flora, aunque como ya hemos comentado si se ha puesto de manifiesto una disminución de EAEPOC, que deberá irse “normalizando” conforme se vaya controlando la pandemia y se vuelva a una situación epidemiológica y social más cerca de la normalidad.
2. Resistencia antimicrobianos. En este apartado se revisa el espectro bacteriano de los antibióticos orales frente a los microorganismos habituales en infecciones respiratorias y las resistencias a los mismos.
Streptococcus pneumoniae. El desarrollo de resistencia a los antimicrobianos en el neumococo ha sido en estos años motivo de preocupación y ha dado lugar a múltiples estudios para su vigilancia epidemiológica [20,21]. Éstos también han sido propiciados por el interés derivado del uso de vacunas frente a S. pneumoniae para prevenir la infección neumocócica invasiva. El porcentaje de aislados con sensibilidad reducida a la penicilina en España en 2017, publicado en el informe del European Antimicrobial Resistance Surveillance Network fue de un 25% [22]. Frente a los macrólidos también se encuentra un elevado porcentaje de resistencia (21,8%) así como a penicilinas y macrólidos simultáneamente (12,4%). De entre las cefalosporinas orales, cefditoreno tiene mayor actividad que cefuroxima y cefixima frente a neumococo [23]. De hecho, cefditoreno es la única cefalosporina oral incluida en las recomendaciones españolas para el manejo de la EPOC [6] y de la neumonía comunitaria [24].
Haemophilus influenzae. La resistencia de H. influenzae a ampicilina y amoxicilina oscila en España entre un 20-25%, debido tanto a un mecanismo de resistencia no mediado por betalactamasas como a la producción de estas enzimas. En cepas que presentan los mecanismos de resistencia anteriores, puede haber menor sensibilidad también a las cefalosporinas orales como cefaclor o cefuroxima, aunque no frente a cefditoreno. Las tasas de resistencia a cefalosporinas de 2ª generación (cefuroxima y cefaclor) varía entre 5-15% y es <1% para las de 3ª generación (ceftriaxona, cefotaxima y cefditoreno) y las fluoroquinolonas [25].
Moraxella catarrhalis. La mayoría de las cepas (75-95%) son productoras de betalactamasas, por lo que son resistentes a las aminopenicilinas. Sin embargo, estos aislados son sensibles en un 99% a las fluoroquinolonas, amoxicilina-clavulánico y cefalosporinas de 3ª generación, porcentaje que es ligeramente inferior en las cefalosporinas de 2ª generación. En referencia a los macrólidos, la resistencia a claritromicina es menor que la de H. influenzae, teniendo azitromicina mejor actividad in vitro [25].
3. Tratamiento secuencial. La terapia secuencial consiste en realizar el paso del tratamiento parenteral a la vía oral y puede hacerse con el mismo fármaco (se4quential therapy), con otro antibiótico de la misma clase y equivalente (switch therapy) o bien con un antibiótico diferente (step-down therapy) [26]. En las EAEPOC que precisan atención hospitalaria, la vía inicial de administración del fármaco es intravenosa, ya que proporciona un comienzo rápido del efecto del antibiótico y evita el paso del fármaco por el sistema gastrointestinal. Para que la terapia secuencial sea adecuada conviene que los antibióticos orales sean de la misma familia que los endovenosos y de hecho, la mayoría de los antibióticos utilizados en la EAEPOC disponen de formulación intravenosa y oral (Tabla 4). Como puede apreciarse, la biodisponibilidad oral de las quinolonas es excelente por lo que se recomienda utilizarlas en tratamiento oral siempre que sea posible.
Tabla 4.
Tratamiento secuencial recomendado según antibiótico
| Antibiótico iv | Antibiótico oral | Biodisponibilidad (%) |
|---|---|---|
| Igual fármaco / similar AUC | ||
| Levofloxacino 500 mg/ 24 h | Levofloxacino 500 mg/ 24 h | 100 |
| Moxifloxacino 400 mg/ 24 h | Moxifloxacino 400 mg/ 24 h | 90 |
| Clindamicina 600-900 mg/ 8 h | Clindamicina 450-600 mg/ 8 h | 90 |
| Igual fármaco / menor AUC | ||
| Amox-clav 1-2 g/125 mg/ 8 h | Amox-clav 875 mg/125 mg/ 8 h | 75 |
| Claritromicina 500 mg/ 12 h | Claritromicina 500 mg/ 12 h | 50 |
| Azitromicina 500 mg/ 24 h | Azitromicina 500 mg/ 24 h | 40 |
| Diferente fármaco/ diferente AUC | ||
| Ceftriaxona 1-2 g/24 h | Cefditoreno 400 mg/ 12 h | - |
AUC: área bajo la curva. Amox-clav: amoxicilina-clavulánico Modificada de la referencia 16
En el caso de amoxicilina-clavulánico y fluoroquinolonas existen presentaciones del mismo antibiótico para ambas vías de administración. En el caso de las cefalosporinas intravenosas de 3ª generación, la terapia secuencial más adecuada es cefditoreno por presentar similar espectro y actividad intrínseca [27]. Los beneficios de la estrategia secuencial son directos tanto para el paciente (mayor confort, alta precoz y menor riesgo de infección nosocomial), como para el sistema sanitario (reducción de la estancia hospitalaria y de los costes) [17]. Para cumplir este doble objetivo es preciso asegurar varios puntos: similar espectro bacteriano, buena biodisponibilidad, tolerancia gastrointestinal y baja selección de mutantes resistentes en el tubo digestivo. No obstante, cuando se realiza un tratamiento secuencial es conveniente valorar la posibilidad de proceder a un desescalado (reducción del espectro antibacteriano) respecto al tratamiento empírico inicial.
Es recomendable pasar a un tratamiento oral cuando el paciente ha alcanzado una estabilidad clínica o buena respuesta. Los pacientes en tratamiento intravenoso con amoxicilinaclavulánico, fluoroquinolonas o macrólidos deben continuar con el mismo antibiótico vía oral y si recibían cefalosporinas endovenosas de 3ª generación, cefditoreno oral es el fármaco de elección al disponer de un espectro similar [6].
4. Indicación adecuada del tratamiento antibiótico. Aunque la causa más frecuente de EAEPOC es la infección bacteriana del árbol traqueobronquial, existen otras etiologías (virus, contaminación tromboembolismo, insuficiencia cardiaca, etc), por lo que la identificación de la causa que provoca esta EAEPOC es de gran importancia de cara a la planificación de un tratamiento adecuado. Sin embargo, en aproximadamente un tercio de los casos la etiología no se llega a conocer.
El incremento progresivo de las resistencias bacterianas se ha considerado como una emergencia sanitaria. Entre los principales factores implicados se incluye el uso repetido y prolongado de los antimicrobianos. Por lo tanto, es importante discriminar a los pacientes que puedan tratarse de manera segura sin antibióticos y optimizar el tratamiento en aquellos que lo precisan. Se han descrito marcadores como la PCR y la procalcitonina, pero no se ha determinado la utilidad sistemática de su realización en los casos de EAEPOC y su uso se reserva para determinados casos [14].
Los criterios clásicos de Anthonisen [18], basados en los datos clínicos de cambios en la sintomatología, aumento de la disnea de la tos y del esputo, y sobre todo cambio en la coloración de este, con todas las posibles críticas siguen estando presentes en nuestro día a día. La guía GesEPOC [14] en una reciente actualización mostró un enfoque muy novedoso sobre exacerbaciones que analizaremos en otro apartado de esta revisión.
En una revisión de la Cochrane 2018 [28], los autores señalan que el uso de antibióticos en exacerbaciones leves puede reducir el fracaso terapéutico desde los 7 días hasta el mes de tratamiento. Tickoo et al. [29] encontraron que el uso de un panel diagnóstico de virus en las exacerbaciones leves /moderadas de la EPOC reducía el uso de antibióticos del 77 al 63% al alta de los pacientes. Blasi et al. [30] compararon cefditoreno (5 días 200 mg/día) frente a levofloxacino (7 días 500 mg/día) en la exacerbación de EPOC, encontrando similar tasa de curación clínica, erradicación microbiológica y respuesta inflamatoria. Este estudio incluso señala que con el betalactámico los niveles de IL-6 descienden entre los días 6-9.
b) Seguridad y efectos secundarios de los anti-bióticos. La administración de antibióticos, como sucede con cualquier otro medicamento, puede ocasionar la aparición de efectos adversos. La incidencia no se conoce bien, aunque algunos trabajos indican que puede alcanzar el 20% [31,32]. Los efectos adversos más comunes de los antibióticos son reacciones alérgicas y daños orgánicos, y en su desarrollo intervienen: 1) la asociación con otros fármacos, 2) el empleo de altas dosis, y 3) factores relacionados con el huésped, como la gravedad y la comorbilidad
En la tabla 5, tomada de Menéndez et al [16,24] se resumen los efectos secundarios más importantes relacionados con la administración de los antibióticos más frecuentemente utilizados en las infecciones respiratoria. Una llamada de atención debido a su amplia utilización y que hay que destacar son los efectos musculoesqueléticos y vasculares relacionados con la utilización de quinolonas. También la utilización de macrólidos, puede producir una prolongación del intervalo QT, y hay querecordar su amplia difusión en los casos de la COVID19 de la primera oleada pandémica, cuando se valoró un posible efecto frente al virus, que luego no se confirmó.
Tabla 5.
Principales efectos adversos de los antibióticos orales más usados en las infecciones respiratorias
| Efectos adversos | Betalactamicos | Macrolidos | Fluoroquinolonas | |
|---|---|---|---|---|
| Reacciones alergicas | + + | + | + | |
| Gastrointestinales | + + | + + | + + | |
| Hepatobiliares | ++a | + | + | |
| Neurologicos | + | + | + + | |
| Nefrotoxicidad | + | + | + + | |
| Cardiacos | + | + + | + + + | |
| Hematologicos | + | + | + | |
| Musculoesqueleticos | - | - | + + | |
| Oticos | - | + | - | |
| Embarazo | - | + | + | |
| Interacciones medicamentosas- | + + | - | ||
aAmoxicilina-clavulánico
c) Desarrollo de resistencias. El uso de un antimicrobiano en cualquier tipo de infección tiene como objetivo la eliminación del microrganismo causante de la misma. No obstante, condicionado por un efecto darwiniano de selección, los antimicrobianos pueden determinar el desarrollo de resistencias, no solo en el propio microorganismo infectante sino también en los microrganismos que integran la microbiota del paciente. Ambas situaciones pueden producirse simultánea o separadamente durante el curso del tratamiento antimicrobiano. Puesto que las infecciones respiratorias constituyen una de las patologías más prevalentes y que la demanda de antimicrobianos en estas infecciones es elevada, sobre todo en números absolutos en el ámbito extrahospitalario, su potencial impacto en el desarrollo de resistencias es muy elevado [33].
Se ha documentado ampliamente el desarrollo de resistencia durante el tratamiento de procesos respiratorios crónicos como los que se incluyen en la denominada colonización o infección bronquial crónica. Es habitual que los pacientes con este tipo de infección, como la que se produce en el contexto de la EPOC, la bronquitis crónica o las bronquiectasias, precisen durante las exacerbaciones la utilización de diferentes ciclos de tratamiento con antimicrobianos [34,35]. En la neumonía comunitaria el proceso de selección es menos probable y depende del tipo de antimicrobiano, la dosis o la duración del tratamiento [36].
En un apartado anterior se ha analizado la situación actual de resistencias de los principales patógenos implicados en la EAEPOC.
ABORDAJE INTEGRAL POSTCOVID DE LA EXACERBACION INFECCIOSA DE LA EPOC
Aunque seguimos con sucesivas oleadas pandémicas de la COVID19, la vacunación progresiva de la población hace que sea esperable una disminución progresiva de la incidencia y que se transforme en una infección endémica. Es momento de hacer una aproximación esquemática a las exacerbaciones infecciosas que presentan los pacientes con EPOC [14]. En este esquema conoceremos las diferentes definiciones relacionadas con la exacerbación, el diagnóstico de causa bacteriana y la utilización de antibióticos.
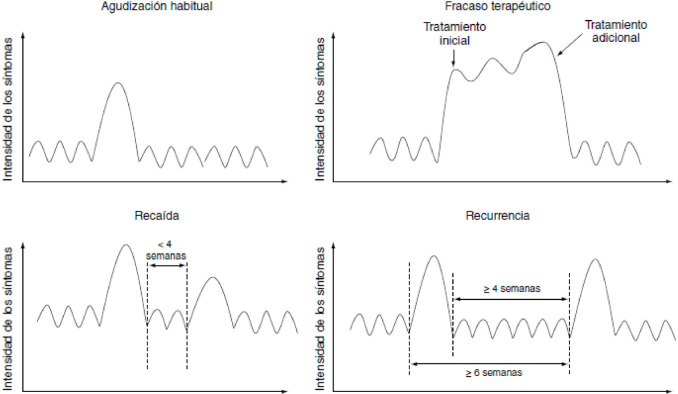
Definiciones. En primer lugar, una vez conocido que entendemos por EAEPOC, es importante establecer, siguiendo las recomendaciones de GesEPOC [14] las siguientes definiciones relacionadas con estas y que se recogen de forma gráfica en la figura 1:
Figura 1.
Evolución exacerbaciones EPOC
GesEPOC adaptada de la referencia 14
Fracaso terapéutico: se define como un empeoramiento de síntomas que sucede durante la propia agudización y que requiere un tratamiento adicional6. La recuperación media después de experimentar una agudización es de aproximadamente 2 semanas. No obstante, algunos pacientes no se recuperan de forma completa hasta las 4-6 semanas.
Recaída: cuando se produce un nuevo empeoramiento de síntomas entre la finalización del tratamiento de la agudización y las 4 semanas posteriores.
Recurrencia: se produce cuando los síntomas reaparecen en un plazo inferior a un año desde la agudización precedente, después de un período de relativo buen estado de salud. Para ello se establece que deben haber transcurrido al menos 4 semanas después de completar el tratamiento de la agudización previa o bien 6 semanas desde que se iniciaron los síntomas6. Las recurrencias son nuevas agudizaciones que se producen en un mismo año. Se considerarán precoces si aparecen entre 4 y 8 semanas tras el episodio anterior, y tardías si aparecen después de este intervalo de tiempo.
Etiologia bacteriana. En segundo lugar, hay que establecer el diagnóstico y la gravedad de esta. En este articulo nos referimos solo a la etiología infecciosa bacteriana y reconocerla es fundamental. Los datos clínicos establecidos por Anthonisen et al [18] que figuran en la tabla 6 siguen siendo los únicos que disponemos en la actualidad. Reconocer la etiología de la agudización no resulta sencillo. El análisis del esputo (tinción de Gram y cultivo) estará especialmente indicado en los pacientes con agudizaciones graves o muy graves que presenten frecuentes agudizaciones, necesidad de ventilación asistida o ante un fracaso del tratamiento antibiótico. Sin embargo, en la mayoría de los casos la aproximación diagnóstica será clínica. Anthonisen et al [18] demostraron que la administración de antibióticos en la EPOC era más eficaz que el placebo enlas agudizaciones que cumplían al menos dos de los siguientes tres criterios: aumento de disnea, purulencia en el esputo o aumento del volumen del esputo. Sin embargo, de los tres criterios recomendados, el que mejor predice la infección bacteriana es el cambio en la coloración del esputo (purulencia) [37]. Por el contrario, el esputo mucoso pocas veces se asocia a infección bacteriana [38] y en estos casos hay que considerar virus, contaminación u otros factores como el tromboembolismo pulmonar.
Tabla 6.
Criterios de Anthonisen
| Síntomas cardinales | Tipo de exacerbación |
|---|---|
| Aumento de disnea | Tipo I: los tres síntomas |
| Aumento expectoración | Tipo II: dos de los tres síntomas |
| Aumento purulencia *cambio de color |
Tipo III: uno de los tres síntomas |
Modificado de Anthonisen et al [18], Se recomienda utilización de antibióticos en agudización tipo I y en la de tipo II cuando existe purulencia del esputo
Existe una gran actividad de investigación sobre biomarcadores de infección bacteriana en las agudizaciones. En un metaanálisis reciente se sugiere que la procalcitonina podría ser de utilidad para disminuir la prescripción de antibióticos, sin que afecte a la tasa de fracasos terapéuticos, la duración de hospitalización, la recurrencia o la mortalidad [39]. Sin embargo, debido a limitaciones metodológicas, la evidencia todavía es baja o moderada, por lo que de momento no se puede establecer una recomendación general de uso de este biomarcador para establecer la etiología de una agudización.
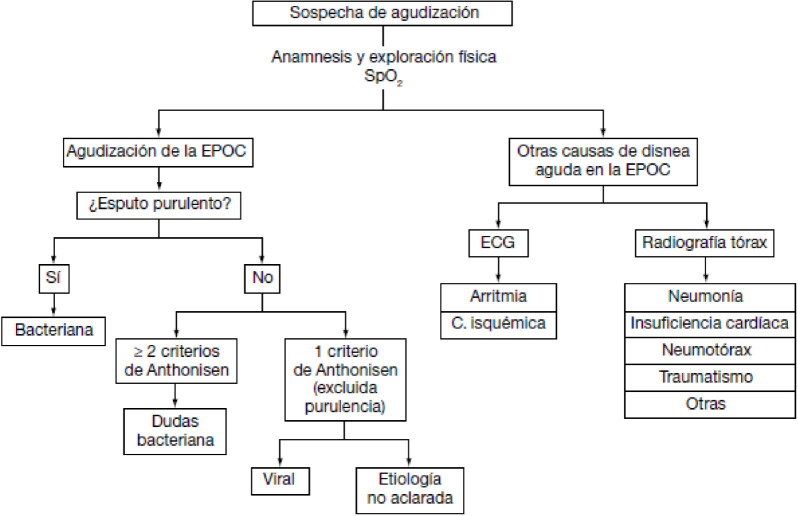
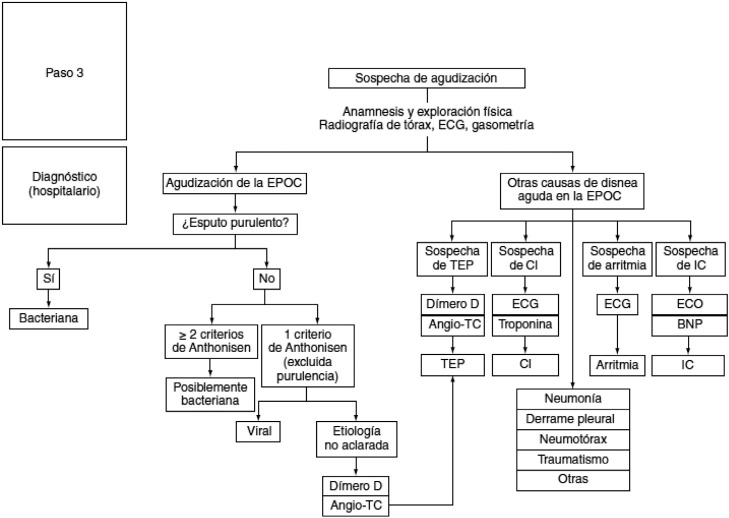
Para tratar de identificar la causa de la agudización y establecer adecuadamente el diagnóstico diferencial, GesEPOC [14] propone una aproximación diferente según el nivel asistencial donde se atienda la descompensación. Las figuras 2 y 3 resumen de forma gráfica el proceso diagnóstico que se debe realizar en el ámbito ambulatorio y en el hospitalario.
Figura 2.
Diagnóstico ambulatorio de la etiología de la agudización de la EPOC.
C. isquémica: cardiopatía isquémica; ECG: electrocardiograma; SpO2: saturación arterial periférica de oxígeno. GesEPOC adaptada de la referencia 14
Utilización de antibióticos. En tercer lugar, se recomienda utilizar antibióticos durante una agudización siempre que aparezca un cambio en el color del esputo, como expresión indirecta de posible infección bacteriana. La reciente normativa de la ERS/ATS recomienda el uso ambulatorio de antibióticos, en especial si hay cambios en el color del esputo [27].
En la agudización leve estará indicado el uso de antibióticos en presencia de esputo purulento [40-42].
En la agudización moderada o grave, también estará indicado cuando, en ausencia de purulencia, exista incremento de la disnea y del volumen del esputo.
En las agudizaciones muy graves, cuando el paciente requiere asistencia ventilatoria, la cobertura antibiótica es obligada, ya que ha demostrado reducir la incidencia de neumonía secundaria y también reducir de forma significativa la mortalidad [43,44].
Los antibióticos recomendados con la dosis, duración y vía están recogidos en las tablas 2 y 4 y de forma esquemática se expone a continuación:
1º) En situaciones de EAEPOC moderada y sin factores de riesgo para la infección por pseudomona está indicado iniciar tratamiento empírico con amoxicilina/clavulánico a dosis de 875/125 mg vía oral cada 8 horas durante 5 días o cefditoreno 400 mg/12 horas durante 5 días.
En pacientes con alergia a la penicilina o en una agudización moderada sin respuesta favorable al tratamiento empírico anterior, se recomienda levofloxacino 500 mg vía oral cada 24 horas durante 7 días o moxifloxacino 400 mg vía oral cada 24 horas durante 5 días.
2º) Pacientes con EAEPOC grave o muy grave, sin riesgo de infección por pseudomona la indicación será de tratamiento con levofloxacino 500 mg vía oral cada 24 horas durante 7 días o cefditoreno 400 mg/12 horas por via oral durante 5 días.
3º) En los casos de pacientes con EAEPOC grave o muy grave y factores de riesgo para infección por pseudomona (que requieran ventilación mecánica, hospitalización reciente, administración de antibióticos al menos en cuatro ocasiones en el último año, FEV1 <50 del predicho, presencia de bronquiectasias, o su aislamiento en una exacerbación previa o en fase estable) se recomienda tratar con ciprofloxacino 750 mg vía oral cada 12 horas durante 10 días o levofloxacino 500 mg vía oral cada 24 horas durante 7 días.
Debido a la falta de actividad de cefixima en grampositivos (neumococo) y a la deficiente concentración que la cefuroxima alcanza en pulmón a la dosis comercializada, ninguna de las dos opciones es aconsejable. Por estas razones, la cefalosporina oral recomendada para patología respiratoria es cefditoreno a 400mg cada 12h.
En los enfermos hospitalizados se puede considerar el inicio del antibiótico por vía intravenosa y valorar, en cuanto sea posible, el paso a vía oral, siguiendo las recomendaciones efectuadas en el apartado dedicado a terapia secuencial (tabla 4).
EPOC Y COVID-19
Una investigación del Registro SEMI-Covid-19 de la Sociedad Española de Medicina Interna (SEMI) que describe las características clínicas y pronóstico de personas con EPOC hospitalizados en España debido a la infección por SARS-CoV-2, señala que la tasa de mortalidad en estos pacientes es del 38,3%, el doble que la de pacientes COVID-19 hospitalizados que no presentaban EPOC (19,2%). Aunque cabrían esperar cifras más elevadas, solamente un 7,16 % de los pacientes hospitalizados por COVID19 y analizados en el estudio (n=10.420) tenían EPOC como patología previa en el momento del ingreso. No obstante, pese a esta baja prevalencia, en caso de contraer la infección, los pacientes COVID19 con EPOC tienen una enfermedad más grave y con peor pronóstico. Además, se encontró que los pacientes con EPOC hospitalizados por infección COVID19 tenían mayor edad que aquellos sin la enfermedad (77 años frente a 68 años) y más comorbilidades (hipertensión, hiperlipidemia, diabetes mellitus, fibrilación auricular, insuficiencia cardiaca, enfermedad vascular periférica, enfermedad isquémica o fallo renal), con un mayor índice de Charlson [45]. Las causas para explicar esta menor prevalencia pueden deberse a un cumplimiento más estricto de las medidas preventivas por parte de los pacientes con EPOC, el posible infradiagnóstico o pobre reconocimiento de la EPOC en pacientes diagnosticados de COVID19, el efecto protector por respuesta inmunitaria o el beneficio potencial de los tratamientos inhalados (protector). Teóricamente los pacientes con EPOC tienen mayor susceptibilidad a la infección por SARS-CoV-2 dado que este virus utiliza como vía de entrada el receptor de la ECA-2 y la expresión en esta enzima está incrementado en estos enfermos [46,47].
Figura 3.
Diagnóstico hospitalario de la etiología de la agudización de la EPOC.
Angio-TC: angiografía por tomografía computarizada; BNP: péptido natriurético tipo B; CI: cardiopatía isquémica; ECG: electrocardiograma; ECO: ecocardiografía; IC: insuficiencia cardíaca; TEP: tromboembolia pulmonar.
GesEPOC adaptada de la referencia 14
La posibilidad de que el tratamiento inhalado influya en el riesgo de infección por SARS-CoV-2 no se basa solo en datos de prevalencia en ingresados con COVID19. En modelos in vitro, los corticoides inhalados (solos o en combinación con broncodilatadores) han sido capaces de suprimir la replicación de coronavirus y la producción de citocinas. Por tanto, quizá podría plantearse también la posibilidad de evaluar un potencial papel protector frente al SARS-CoV-2 del uso de estos fármacos [48,49].
En estudio observacionales retrospectivos se ha visto que los pacientes con EPOC y COVID19 desarrollaron mayor probabilidad de coinfecciones bacterianas o fúngicas (20% frente a 5,9%), síndrome de dificultad respiratoria aguda (SDRA) (20% frente a 7,3%), shock séptico (14% frente a 2,3%) e insuficiencia renal aguda (12% frente a 1,3%). Estos pacientes con EPOC y COVID19 también tienen mayor riesgo de ingreso en intensivos (UCI) y uso de ventilación mecánica (HR 2,17; IC 95% 1,4-3,38; P = 0,001) o de muerte (HR: 2,28; IC 95%: 1,15-4,51; P = 0,019) [50].
En revisiones sistemáticas, que incluyen pacientes con EPOC y COVID-19, se la prevalencia de EPOC y tabaquismo fue del 2% (IC 95% 1-3) y 9% (IC 95% 4-14), respectivamente. Cuando se compararon los pacientes COVID-19 con EPOC con aquellos que no tuvieron EPOC, se demostró que los primeros tenían un riesgo más alto de enfermedad severa 63% frente a 33,4% (RR 1,88; IC 95% 1,4-2,4), además de mortalidad más elevada (60%). Los fumadores activos y los exfumadores presentaron complicaciones graves en el 22% y 46%, de los casos respectivamente. El riesgo de tener complicaciones severas en los fumadores, comparado con los no fumadores, fue 1,45 veces mayor, con IC 95% 1,03-2,04 [51,52].
En resumen, la aparición de la pandemia de COVID19 debe priorizar el diagnóstico y manejo de la EAEPOC, y diferenciar las exacerbaciones agudas infecciosas y no infecciosas, para evitar la sobreutilización de antibióticos en los casos en los que no es necesario. En la situación actual de SARS-CoV-2, esta infección viral pudiese ser una de las causas de agudización y es necesario descartarla en cualquier enfermo, más si es EPOC, que consulta por síntomas respiratorios de nueva aparición o empeoramiento de los existentes.
CONFLICTOS DE INTERES
Este manuscrito ha sido redactado por los autores como parte de un programa de formación financiado por Meiji Pharma Spain,S.A.
References
- 1.Sadatsafavi M, Xie H, Etminan M, Johnson K, FitzGerald JM; Canadian Respiratory Research Network. The association between previous and future severe exacerbations of chronic obstructive pulmonary disease: Updating the literature using robust statistical methodology. PLoS One. 2018;13:e0191243. DOI: 10.1371/journal.pone.0191243 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Alfageme I, de Lucas P, Ancochea J, Miravitlles M, Soler-Cataluña JJ, Francisco García-Río F, et al. Nuevo estudio sobre la prevalencia de la EPOC en España: resumen del protocolo EPISCAN II, 10 años después de EPISCAN. Arch Bronconeumol 2019;55: 38-47. doi: 10.1016/j.arbres.2018.05.011. [DOI] [PubMed] [Google Scholar]
- 3.Soriano JB, Alfageme I, Miravitlles M, de Lucas P, Soler-Cataluña JJ, Francisco García-Río F, et al. Prevalencia y determinantes de la EPOC en España:EPISCAN II. Arch Bronconeumol 2021;57: 61-69. DOI: 10.1016/j.arbres.2020.07.024. [DOI] [PubMed] [Google Scholar]
- 4.Miravitlles M, Soler-Cataluña JJ, Calle M, Molina J, Almagro P, Quintano JA, et al. Guía española de la EPOC (GesEPOC). Actualización 2014. Arch Bronconeumol 2014;50:1-16. doi: 10.1016/s0300-2896(14)70070-5. [DOI] [Google Scholar]
- 5.Halpin DMG, Criner GJ, Papi A, Singh D, Antonio Anzueto A, Martinez FJ,. Agusti AA , on behalf of the GOLD Science Committee Global Initiative for the Diagnosis, Management, and Prevention of Chronic Obstructive Lung Disease. The 2020 GOLD Science Committee Report on COVID-19 and Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med. 2021. Jan 1; 203(1): 24–36. Published online 2021 Jan 1. doi: 10.1164/rccm.202009-3533SO. PMCID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.González Del Castillo J, Candel FJ, de la Fuente J, Gordo F, Martín-Sánchez FJ, Menéndez R, et al. Manejo integral del paciente con exacerbación aguda de la enfermedad pulmonar obstructiva crónica. Rev Esp Quimioter 2018;31:461-84. PMid: . [PMC free article] [PubMed] [Google Scholar]
- 7.Costa Ribas C, Castiñeira Pérez C, Peñin España S. Guía Fisterra exacerbaciones aguda de la EPOC 2020. Disponible en https://www.fisterra.com/guias-clinicas/exacerbaciones-agudas-epoc
- 8.Lee SC, Son KJ, Han CH, Park SC, Jung JY. Impact of COPD on COVID-19 prognosis: A nationwide population-based study in South Korea. Sci Rep. 2021;11(1):3735. Published 2021 Feb 12. doi: 10.1038/s41598-021-83226-9 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Gülsen A, König IR, Jappe U, Drömann D. Effect of comorbid pulmonary disease on the severity of COVID-19: A systematic review and meta-analysis. Respirology. 2021;26(6):552-565. doi: 10.1111/resp.14049 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Higham A, Mathioudakis A, Vestbo J, Singh D. COVID-19 and COPD: a narrative review of the basic science and clinical outcomes. Eur Respir Rev. 2020;29(158):200199. Published 2020 Nov 5. doi: 10.1183/16000617.0199-2020 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Guan WJ, Liang WH, Shi Y, Gan LX, Wang HB, He JX, Zhong NS. Chronic Respiratory Diseases and the Outcomes of COVID-19: A Nationwide Retrospective Cohort Study of 39,420 Cases. J Allergy Clin Immunol Pract. 2021. Jul;9(7):2645-2655.e14. doi: 10.1016/j.jaip.2021.02.041. Epub 2021 Mar 6. PMid: ; PMCID: . [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Miravitlles M, Soler-Cataluña JJ, Calle M, Molina J, Almagro P, Quintano JAet al. A new approach to grading and treating COPD based on clinical phenotypes: summary of the Spanish COPD guidelines (GesEPOC). Prim Care Respir J. 2013;22(1):117-121. doi: 10.4104/pcrj.2013.00016 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Miravitlles M, Calle M, Molina J, Almagro P, Gómez JT, Trigueros JAet al. Spanish COPD Guidelines (GesEPOC) 2021: Updated Pharmacological treatment of stable COPD. Arch Bronconeumol 2021. on line DOI: 10.1016/j.arbres.2021.03.005 [DOI] [PubMed] [Google Scholar]
- 14.Clinical Practice Guideline for the Diagnosis and Treatment of Patients with Chronic Obstructive Pulmonary disease (COPD)–the Spanish COPD Guideline (GesEPOC) . 2017 Version Working group of the GesEPOC Arch Bronconeumol 2017;53(Supl 1):2-64 [Google Scholar]
- 15.Soler-Cataluña JJ, Martínez-García MA, Román Sánchez P, Salcedo E, Navarro M, Ochando R. Severe acute exacerbations and mortality in patients with chronic obstructive pulmonary disease. Thorax. 2005;60(11):925-931. doi: 10.1136/thx.2005.040527 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Menendez R, Canton R, Garcia-Caballero A, Barberán J. Tres claves para seleccionar el antibiotico oral adecuado en las infecciones respiratorias. Rev Esp Quimioter 2019;32(6): 497-515. [PMC free article] [PubMed] [Google Scholar]
- 17.Cantón R. Aspectos microbiológicos actuales de la infección respiratoria comunitaria más allá de la COVID-19 Rev Esp Quimioter 2021;34(2): 81-92. doi: 10.37201/req/049.2021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.18-Anthonisen NR, Manfreda J, Warren CP, Hershfield ES, Harding GK, Nelson NA. Antibiotic therapy in exacerbations of chronic obstructive pulmonary disease. Ann Intern Med. 1987;106:196-204. [DOI] [PubMed] [Google Scholar]
- 19.Gallego M, Pomares X, Espasa M, Castañer E, Solé M, Suárez D, et al. Pseudomonas aeruginosa isolates in severe chronic obstructive pulmonary disease: Characterization and risk factors. BMC Pulm Med 2014;14:103. doi: 10.1186/1471-2466-14-103. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Fenoll A, Granizo JJ, Giménez MJ, Yuste J, Aguilar L. Secular trends (1990-2013) in serotypes and associated non-susceptibility of S.pneumoniae isolates causing invasive disease in the pre-/postera of pneumococcal conjugate vaccines in Spanish regions without universal paediatric pneumococcal vaccination. Vaccine 2015;33:5691-9. doi: 10.1016/j.vaccine.2015.08.009. [DOI] [PubMed] [Google Scholar]
- 21.Fenoll A, Aguilar L, Giménez MJ, Vicioso MD, Robledo O, Granizo JJ, et al. Variations in serotypes and susceptibility of adult noninvasive Streptococcus pneumoniae isolates between the periods before (May 2000-May 2001) and 10 years after (May 2010-May 2011) introduction of conjugate vaccines for child immunisation in Spain. Int J Antimicrob Agents 2012;40:18-23. doi: 10.1016/j.ijantimicag.2012.03.001. [DOI] [PubMed] [Google Scholar]
- 22.European Centre for Disease Prevention and Control . Surveillance of antimicrobial resistance in Europe Annual report of the European Antimicrobial Resistance Surveillance Network (EARS-Net) 2017. 2018. doi: 10.2900/230516 https://www.ecdc.europa.eu›documents›AMR-surveillance-EARS-Net-2017 (accedido 20 noviembre 2019) [DOI] [Google Scholar]
- 23.Cantón R, Morosini M, Loza E, Gomez G, de la Pedrosa EGG. Infecciones comunitarias. Patrones de sensibilidad a los antimicrobianos utilizados por vía oral de los microorganismos más comunes. Rev Clin Esp. 2008;208:S3-11. [Google Scholar]
- 24.24-Menéndez R, Torres A, Aspa J, Capelastegui A, Prat C, Rodríguez de Castro F. Neumonía adquirida en la comunidad. Nueva normativa de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR). Arch Bronconeumol 2010;46:543-58. doi: 10.1016/j.arbres.2010.06.014. [DOI] [PubMed] [Google Scholar]
- 25.Jimenez AJ, Candel Gonzalez FJ, Piñra Salmeron P, Gonzalez del Castillo J, Moya Mir M, Martinez Ortiz de Zarate M. Recomendaciones de INFURG-SEMES: Manejo de la infeccion respiratoria de vías bajas en urgencias. Rev Científica la Soc Española Med Urgencias y Emergencias 2009;3:23. [Google Scholar]
- 26.Menendez R, Montull B, Mendez R. Antibiotic choice, route and duration: Minimising the harm associated with antibiotics. Eur Respir Monogr 2014;63:155-67. doi: 10.1183/1025448x.10004113. [DOI] [Google Scholar]
- 27.Wedzicha JA, Miravitlles M, Hurst JR, Calverley PMA, Albert RK, Anzueto A, et al. Management of COPD exacerbations: A European Respiratory Society/American Thoracic Society guideline. Eur Respir J 2017;50:1600791. doi: 10.1183/13993003.00791-2016. [DOI] [PubMed] [Google Scholar]
- 28.Vollenweider DJ, Frei A, Steurer-Stey CA, Garcia-Aymerich J, Puhan MA. Antibiotics for exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2018;2018:CD010257. doi: 10.1002/14651858.CD010257.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Tickoo M, Ruthazer R, Bardia A, Doron S, Andujar-Vazquez GM,Gardiner BJ, et al. The effect of respiratory viral assay panel on antibiotic prescription patterns at discharge in adults admitted with mild to moderate acute exacerbation of COPD: A retrospective before-after study. BMC Pulm Med 2019;19:118. doi: 10.1186/s12890-019-0872-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Blasi F, Tarsia P, Mantero M, Morlacchi LC, Piffer F. Cefditoren versus levofloxacin in patients with exacerbations of chronic bronchitis: Serum inflammatory biomarkers, clinical efficacy, and microbiological eradication. Ther Clin Risk Manag 2013;9:55-64. doi: 10.2147/TCRM.S41131. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Shehab N, Patel PR, Srinivasan A, Budnitz DS. Emergency Department Visits for Antibiotic-Associated Adverse Events. Clin Infect Dis 2008;47:735-43. doi: 10.1086/591126. [DOI] [PubMed] [Google Scholar]
- 32.Tamma PD, Avdic E, Li DX, Dzintars K, Cosgrove SE. Association of adverse events with antibiotic use in hospitalized patients. JAMA Intern Med 2017;177:1308-15. doi: 10.1001/jamainternmed.2017.1938. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Guitor AK, Wright GD. Antimicrobial Resistance and Respiratory Infections. Chest 2018;154:1202-12. doi: 10.1016/j.chest.2018.06.019. [DOI] [PubMed] [Google Scholar]
- 34.Miravitlles M. Exacerbations of chronic obstructive pulmonary disease:when are bacteria important? Eur Respir J 2002;36:9s-19s. DOI: 10.1183/09031936.02.00400302 [DOI] [PubMed] [Google Scholar]
- 35.Miravitlles M, Anzueto A. Chronic respiratory infection in patients with chronic obstructive pulmonary disease: What is the role of antibiotics? Int J Mol Sci 2017;18:E1344. doi: 10.3390/ijms18071344. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Wunderink RG, Yin Y. Antibiotic Resistance in Community-Acquired Pneumonia Pathogens. Semin Respir Crit Care Med 2016;37:829-38. doi: 10.1055/s-0036-1593753. [DOI] [PubMed] [Google Scholar]
- 37.Miravitlles M, Moragas A, Hernández S, Bayona C, Llor C. Is it possible to identify exacerbations of mild to moderate COPD that do not require antibiotic treatment? Chest. 2013; 44:1571-7. [DOI] [PubMed] [Google Scholar]
- 38.Soler N, Agustí C, Angrill J, Puig de la Bellacasa J, Torres A. Bronchoscopic validation of the significance of sputum purulence in severe exacerbations of chronic obstructive pulmonary disease. Thorax. 2007;62:29-35. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Mathioudakis AG, Chatzimavridou-Grigoriadou V, Corlateanu A, Vestbo J. Procalcitonin to guide antibiotic administration in COPD exacerbations: a meta-analysis. Eur Respir Rev. 2017. Disponible en: doi: 10.1183/16000617.0073-2016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.35.Vollenweider DJ, Jarret H, Steurer-Stey CA, Garcia-Aymerich J, Puhan MA. Antibiotics for exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2012;(12):CD010257. [DOI] [PubMed]
- 41.Llor C, Moragas A, Hernández S, Bayona C, Miravitlles M. Efficacy of antibiotic therapy for acute exacerbations of mild to moderate chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2012;186:716-23. [DOI] [PubMed] [Google Scholar]
- 42.Echevarria C, Steer J, Heslop-Marshall K, Stenton SC, Hickey PM, Hughes R, et al. Validation of the DECAF score to predict hospital mortality in acute exacerbations of COPD. Thorax. 2016;71:133-40. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Nouira S, Marghli S, Belghith M, Besbes L, Elatrous S, Abroug F. Once daily oral ofloxacin in chronic obstructive pulmonary disease exacerbation requiring mechanical ventilation: a randomised placebo-controlled trial. Lancet. 2001;358:2020-5. [DOI] [PubMed] [Google Scholar]
- 44.Miravitlles M, Monsó E, Mensa J, Aguarón Pérez J, Barberán J, Bárcena Caamaño M, et al. Tratamiento antimicrobiano de la agudización de EPOC: Documento de Consenso 2007. Arch Bronconeumol. 2008;44:100-8. [DOI] [PubMed] [Google Scholar]
- 45.Gómez Antúnez M, Muiño Míguez A, Bendala Estrada AD, Maestro de la Calle GDaniel MongeMonge Det al. Clinical Characteristics and Prognosis of COPD Patients Hospitalized with SARS-CoV-2. International Journal of Chronic Obstructive Pulmonary Disease 2020:15 3433–3445. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Leung JM, Yang CX, Tam A, Shaipanich T, Hackett TL, Singhera GK, et al.ACE-2 Expression in the Small Airway Epithelia of Smokers and COPD Patients: Implications for COVID-19.Eur Respir J 2020, pp. 2000688. doi: 10.1183/13993003.00688-2020 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Halpin DMG, Faner F, Sibila O, Badia JR, Agusti A. Do chronic respiratory diseases or their treatment affect the risk of SARS-CoV-2 infection?. Lancet Respir Med, S2213–2600 (2020), pp. 30167-30173 doi: 10.1016/S2213-2600(20)30167-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Yamaya M, Nishimura H, Deng X, Sugawara M, Watanabe O, Nomura K, et al. Inhibitory effects of glycopyrronium, formoterol, and budesonide on coronavirus HCoV-229E replication and cytokine production by primary cultures of human nasal and tracheal epithelial cells. Respir Investig., S2212–5345 (2020), pp. 30005-30008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.García-Pachón E, Zamora-Molina L, Soler-Sempere M, Baeza-Martínez C, Grau-Delgado J, Padilla-Navas Iet al. Asthma and COPD in hospitalized COVID-19 patients Bronconeumol.2020;56(9):596–610. doi: 10.1016/j.arbres.2020.05.007 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Wu F, Zhou Y, Wang Z, Xie M, Shi Z, Tang Z, et al. Clinical characteristics of COVID-19 infection in chronic obstructive pulmonary disease: a multicenter, retrospective, observational study. J Thorac Dis. 2020;12(5):1811-23. doi: 10.21037/jtd-20-1914. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Alqahtani JS, Oyelade T, Aldhahir AM, Alghamdi SM, Almehmadi M, Alqahtani AS, et al. Prevalence, severity and mortality associated with COPD and smoking in patients with COVID-19: a rapid systematic review and meta-analysis. PLoS ONE. 2020;15(5):e0233147. doi: doi: 10.1371/journal.pone.0233147. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Zhao Q, Meng M, Kumar R, Wu Y, Huang J, Lian N, et al. The impact of COPD and smoking history on the severity of COVID-19: a systemic review and meta-analysis. J Med Virol. 2020: 10.1002/jmv.25889. [DOI] [PMC free article] [PubMed] [Google Scholar]