Abstract
Les vaccins contre le SRAS-CoV-2 sont administrés dans le monde entier. La plupart des effets secondaires sont légers et spontanément résolutifs, avec peu de cas signalés de réactions graves. Nous rapportons un cas de vascularite leucocytoclasique avec insuffisance rénale aiguë à la suite d’un vaccin à SARS-CoV-2 inactivé, unique pour sa présentation visuelle spectaculaire et sa réponse rapide au traitement. Il s’agit d’un homme âgé de 58 ans présentant de la fièvre, des arthralgies et un purpura vasculaire au niveau des quatre membres, le tout associé à une insuffisance rénale aiguë nécessitant une hémodialyse neuf jours après la vaccination anti-COVID-19. La biopsie cutanée a révélé une vascularite leucocytoclasique et la biopsie rénale une néphrite tubulo-interstitielle aiguë. Le purpura vasculaire s’est résolu 7 jours après le début du traitement par prednisone, mais le patient a conservé une insuffisance rénale chronique modérée. L’analyse et les enquêtes sur les complications et les événements indésirables induits par les vaccins anti-COVID-19 pourraient améliorer notre compréhension de la pathogenèse sous-jacente.
Mots clés: Vaccin COVID-19, Vascularite leucocytoclasique, Néphrite interstitielle aiguë
Abstract
SARS-CoV-2 vaccines are being administered worldwide. Most side effects are mild and self-limiting with few reported cases of severe reactions. We report a case of leukocytoclastic vasculitis with acute kidney failure following aninactivated SARS-CoV-2 vaccine, unique for its dramatic visual presentation and its rapid response to treatment. This is the case of a 58 years-old man presenting with fever, arthralgias and vascular purpura on his limbs associated with acute kidney failure requiring hemodialysis nine days after anti-COVID-19 vaccination. Skin biopsy revealed a leukocytoclastic vasculitis and a renal biopsy showed an acute tubulointerstitial nephritis. The vascular purpura resolved 7 days after initiating treatment with prednisone but the patient remains in chronic renal failure. The analysis and investigation of the complications and adverse events induced by anti-COVID-19 vaccines could increase our understanding of the underlying pathogenesis.
Keywords: Acute interstitial nephritis, COVID-19 vaccine, Leukocytoclastic vasculitis
1. Introduction
La pandémie COVID-19 s’est propagée à travers le monde avec des millions de personnes infectées et de décès [1]. Par conséquent, il y avait une demande urgente de développer des vaccins.
Actuellement, trois principaux types de vaccins COVID-19 sont utilisés, le vaccin à ARN messager (ARNm), les vaccins à vecteur adénoviral et les vaccins SARS-CoV-2 inactivé [2], [3], [4]. Alors que les vaccinations de masse contre la COVID-19 sont administrées dans le monde entier, des rapports d’événements indésirables apparaissent [5], [6], [7]. Aussi, la pharmacovigilance des vaccins COVID-19 semble importante pour déterminer l’incidence des complications potentielles.
Contrairement aux vaccins à ARNm, le procédé de fabrication des vaccins à SARS-CoV-2 inactivé est plus traditionnel et déjà utilisé pour divers vaccins tels que le vaccin contre la grippe, les hépatites A et B.
Nous rapportons un cas de vascularite leucocytoclasique avec insuffisance rénale aiguë suite à un vaccin à SARS-CoV-2 inactivé, le CoronaVac® (produit en Chine par Sinovac).
2. Présentation du cas
Un homme âgé de 57 ans se présente aux urgences avec un purpura vasculaire étendu, des arthralgies diffuses, des nausées et de la fièvre, neuf jours après une première dose du vaccin anti-COVID-19 de Sinovac.
Ses antécédents médicaux ne comprenaient qu’une hypertension artérielle, et ses seuls médicaments étaient des inhibiteurs calciques et des inhibiteurs de l’enzyme de conversion de l’angiotensine (ECA) qu’il prenait depuis 4 ans. Il n’y a pas eu d’épisodes antérieurs d’éruption cutanée, d’arthralgies, d’hématurie ou d’antécédents familiaux d’allergie, de vascularite ou de troubles auto-immuns. À l’examen, le patient a une température de 37,8 °C. Il présente un purpura vasculaire avec des lésions nécrotiques par endroits, impliquant les mains, les bras, les cuisses et les pieds (Fig. 1 ).
Fig. 1.
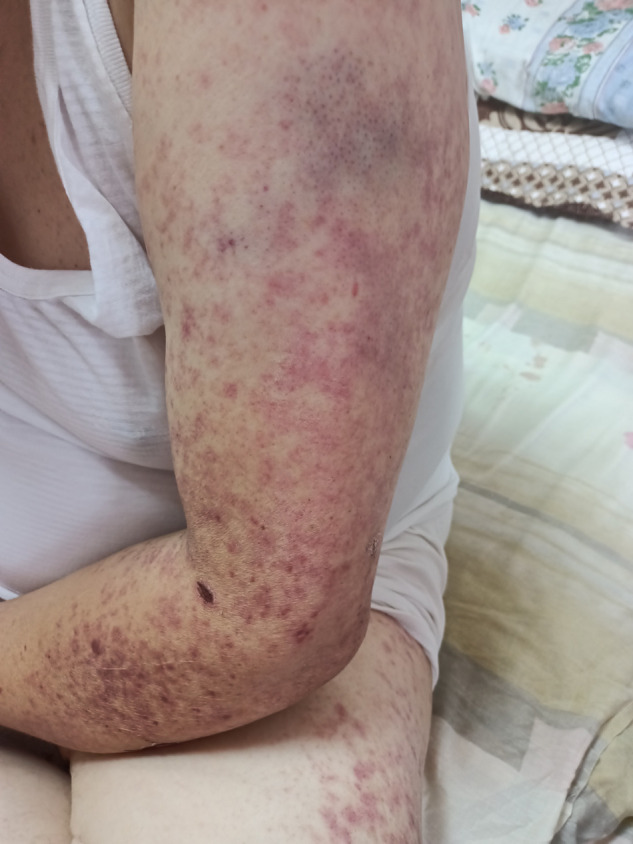
Purpura vasculaire avec des lésions nécrotiques.
L’analyse sanguine montre une leucocytose de 14,5 × 109/L, sans hyperéosinophilie, une numération plaquettaire normale, une protéine C réactive élevée à 50 mg/L et une vitesse de sédimentation des érythrocytes à 86 mm/h.
Une augmentation de la créatininémie à 791,19 μmol/L et de l’urée sanguine à 54,6 mmol/L est mise en évidence, sachant qu’un bilan antérieur remontant à 3 mois avant l’admission objectivait un bilan rénal normal, d’où la nécessité d’une épuration extra-rénale par hémodialyse et l’arrêt des inhibiteurs de l’ECA. L’analyse des urines révèle une protéinurie à 0,24 g/24 heures, une hématurie et une leucocyturie. Le test d’éosinophilurie n’a pas pu être réalisé faute de réactif. Le bilan est négatif pour le facteur rhumatoïde, les anticorps anti-cytoplasme des neutrophiles (ANCA), la cryoglobuline et les anticorps antinucléaires. La sérologie est également négative pour les hépatites A, B, et C, le virus d’Epstein–Barr ou le cytomégalovirus. L’électrophorèse des protéines sériques suivie de l’immunoélectrophorèse sont normales, et le dosage de chaînes légères libres sériques (free lite) est négatif.
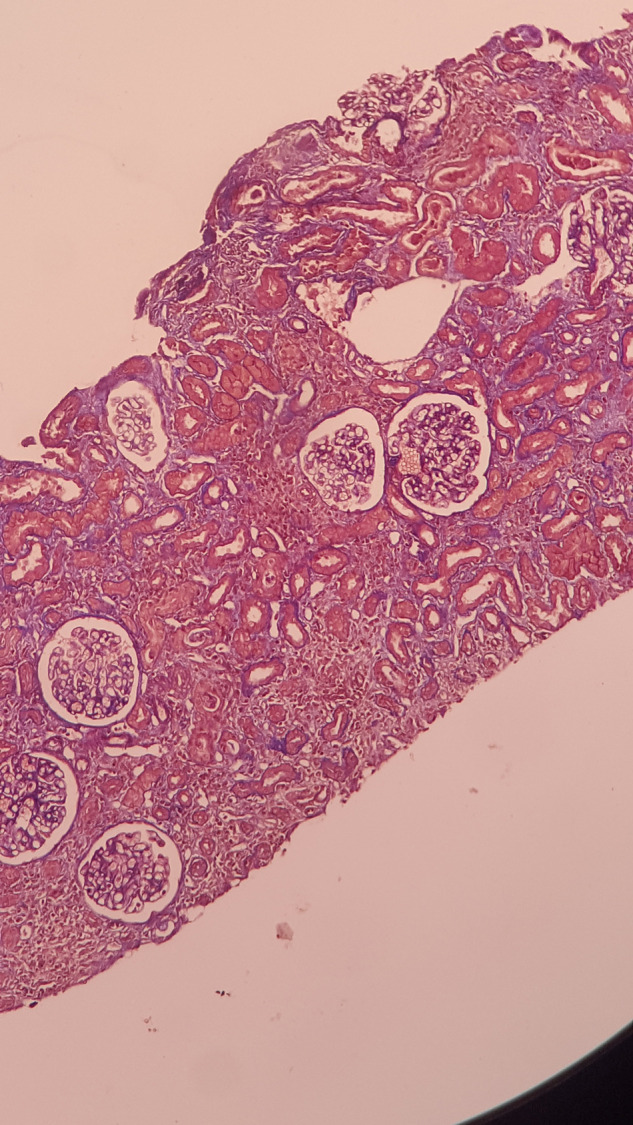
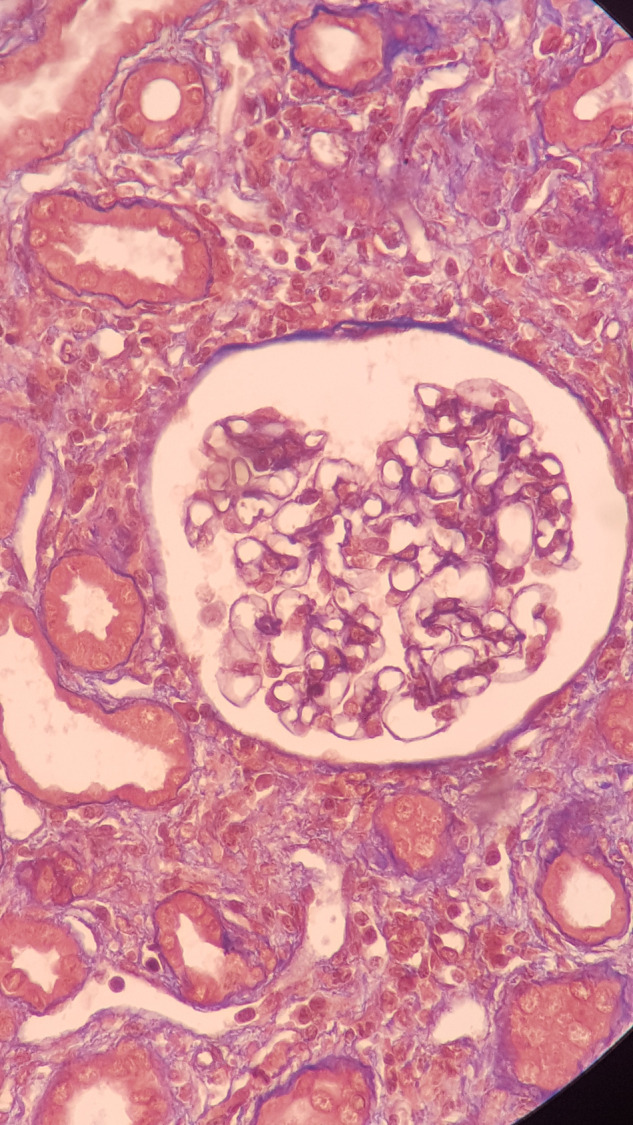
Une biopsie cutanée à cheval sur une peau saine et une lésion purpurique sur le bras gauche du patient montre une vascularite leucocytoclasique avec immunofluorescence négative (Fig. 2 ). Une biopsie rénale révèle une néphrite tubulo-interstitielle aiguë (Fig. 3, Fig. 4 ), sans lésions glomérulaires (Fig. 5 ), ainsi que des dépôts interstitiels en immunofluorescence pour les immunoglobulines G et le C3.
Fig. 2.
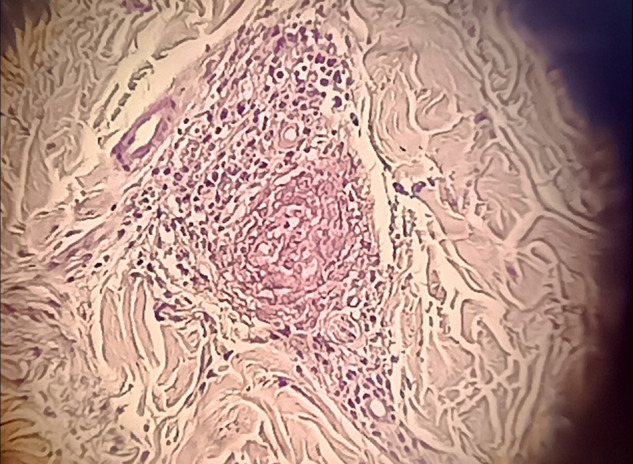
Biopsie cutanée à cheval sur une peau saine et une lésion purpurique sur le bras gauche du patient, révélant une vascularite leucocytoclasique avec immunofluorescence négative.
Fig. 3.
Biopsie rénale : infiltrat interstitiel inflammatoire mononucléé.
Fig. 4.
Carotte de biopsie rénale au moyen grossissement révélant un infiltrat inflammatoire massif de l’interstitium rénal.
Fig. 5.
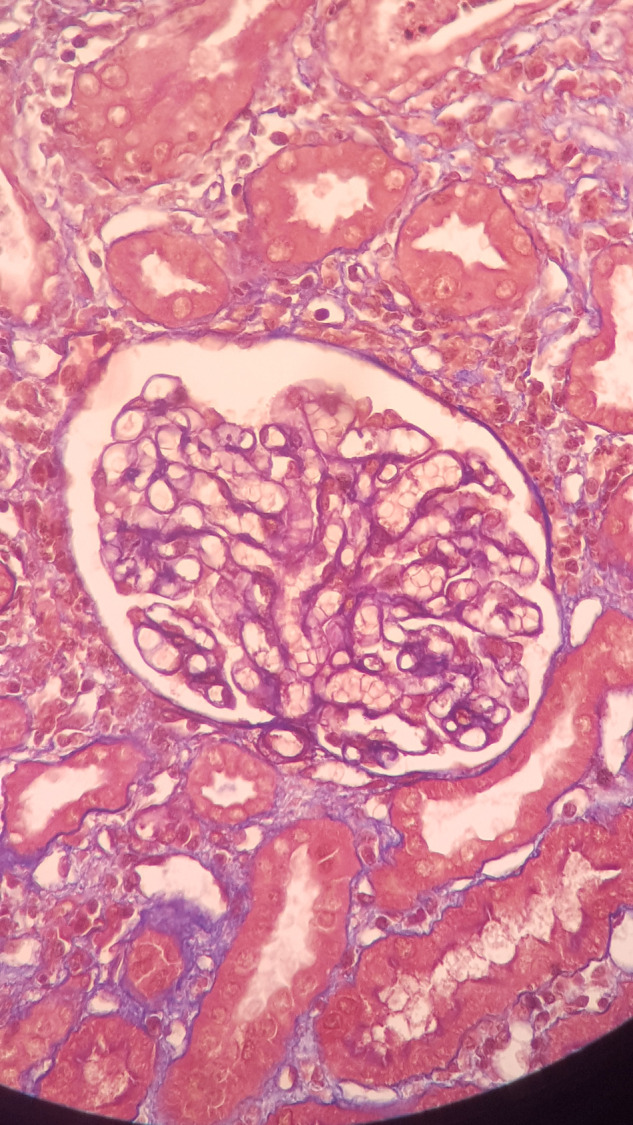
Absence de lésions glomérulaires.
Un traitement par stéroïdes est débuté avec 3 bolus de méthylprednisone, suivis de prednisone 1 mg/kg par jour.
Les lésions cutanées s’estompent après 7 jours de traitement et la fonction rénale s’améliore progressivement à partir du 20e jour, mais le patient conserve une insuffisance rénale modérée à 3 mois (créatinine à 248 μmol/L). Le traitement par prednisone est ensuite réduit à une dose de 20 mg par jour sur une période de 6 semaines.
3. Discussion
Nous décrivons un cas de vascularite leucocytoclasique associé à une insuffisance rénale aiguë nécessitant une épuration extra-rénale après vaccination anti-COVID-19 avec le vaccin à SARS-CoV-2 inactivé, le CoronaVac® (produit en Chine par Sinovac).
L’exploration étiologique négative, la faible probabilité que le traitement antihypertenseur prescrit durant 4 ans soit à l’origine de ce tableau clinique et la coïncidence avec la vaccination anti-COVID-19 soutiennent fortement une relation causale entre le vaccin et la symptomatologie.
La procédure de fabrication du vaccin SARS-CoV-2 inactivé est traditionnelle et déjà utilisée pour divers vaccins tels que le vaccin contre la grippe, l’hépatite A et l’hépatite B, ce qui suggère une certaine similitude des effets secondaires potentiels.
Des vascularites leucocytoclasiques avec ou sans symptomatologie rénale ont été décrites comme effets secondaires de plusieurs vaccins tels que celui du virus de la grippe, le virus de l’hépatite B (VHB), le bacille Calmette–Guérin (BCG) et le virus du papillome humain (VPH) [8], [9], [10], [11]. Cependant, ces observations étaient mal documentées, principalement en matière d’histologie rénale, et le lien de causalité reste à déterminer.
Le virus SARS-CoV-2 est connu pour provoquer des réactions immunologiques conduisant à une vascularite. En effet, plusieurs rapports ont décrit des lésions vasculaires inflammatoires induites par des dépôts de complexes immuns avec une infiltration périvasculaire de monocytes et de lymphocytes [12], [13]. De plus, ce coronavirus est capable d’affecter directement ou indirectement d’autres organes, notamment les reins dont l’analyse histologique décrit des cas de néphrite interstitielle aiguë [14], [15].
Les antigènes du SRAS-CoV-2 et les protéines vaccinales partagent des similitudes structurelles. Plusieurs observations de vascularite leucocytoclasique ont été décrites comme effet secondaire des trois types de vaccin anti-COVID-19 [16], [17].
Les glomérulopathies représentent la lésion rénale la plus fréquemment associée aux vaccins anti-COVID-19 à ARN messager et à vecteur adénoviral [18]. Cependant, deux cas de néphrite interstitielle aiguë ont été rapportés après vaccin à ARN messager [19], [20].
À notre connaissance, nous rapportons le premier cas associant une vascularite leucocytoclasique et une néphrite interstitielle aiguë documentée par une biopsie. Les constatations pathologiques dans notre cas sont pertinentes, même s’il est toujours difficile de postuler une causalité dans les cas de néphrite interstitielle aiguë d’origine médicamenteuse.
4. Conclusion
Malgré le succès indéniable de la vaccination, la pharmacovigilance est un sujet d’intérêt croissant. L’analyse et les enquêtes sur les complications et les événements indésirables induits par les vaccins anti-COVID-19 pourraient améliorer notre compréhension de la pathogenèse sous-jacente. Néanmoins, ces complications sont extrêmement rares et le bénéfice de la vaccination l’emporte sur les risques potentiels.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Références
- 1.Dong E., Du H., Gardner L. An interactive Web-based dashboard to track COVID-19 in real time. Lancet Infect Dis. 2020;20:533–534. doi: 10.1016/S1473-3099(20)30120-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Polack F.P., Thomas S.J., Kitchin N., Absalon J., Gurtman A., Lockhart S., et al. Safety and efficacy of the BNT162b2 mRNA COVID-19 vaccine. N Engl J Med. 2020;383:2603–2615. doi: 10.1056/NEJMoa2034577. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Mendonça S., Lorincz R., Boucher P. Adenoviral vector vaccine platforms in the SARS-CoV-2 pandemic. NPJ Vaccines. 2021;6:97. doi: 10.1038/s41541-021-00356-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Jara A., Undurraga E., González C., Paredes F., Fontecilla T., Jara G., et al. Effectiveness of an inactivated SARS-CoV-2 vaccine in Chile. N Engl J Med. 2021;385:875–884. doi: 10.1056/NEJMoa2107715. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Sekar A., Campbell R., Tabbara J., Rastogi P. ANCA glomerulonephritis after the Moderna COVID-19 vaccination. Kidney Int. 2021;100:473–474. doi: 10.1016/j.kint.2021.05.017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Terracina K.A., Tan F.K. Flare of rheumatoid arthritis after COVID-19 vaccination. Lancet Rheumatol. 2021;3:e469–e470. doi: 10.1016/S2665-9913(21)00108-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Obeid M., Fenwick C., Pantaleo G. Reactivation of IgA vasculitis after COVID-19 vaccination. Lancet Rheumatol. 2021;3:e617. doi: 10.1016/S2665-9913(21)00211-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Bonetto C., Trotta F., Felicetti P., Alarcón G.S., Santuccio C., Bachtiar N.S., et al. Vasculitis as an adverse event following immunization – systematic literature review. Vaccine. 2016;34:6641–6651. doi: 10.1016/j.vaccine.2015.09.026. [DOI] [PubMed] [Google Scholar]
- 9.Ulm S., Hummel M., Emig M., Barreto M., Back W., Reiter A., et al. Leukocytoclasticvasculitis and acute renal failure after influenza vaccination in an elderly patient with myelodysplastic syndrome. Onkologie. 2006;29:470–472. doi: 10.1159/000095412. [DOI] [PubMed] [Google Scholar]
- 10.Tavadia S, Drummond A, Evans CD, Wainwright NJ. Leucocytoclastic vasculitis and influenza vaccination. Clin Exp Dermatol. 2003;28:154–156. doi: 10.1046/j.1365-2230.2003.01188.x. [DOI] [PubMed] [Google Scholar]
- 11.Schattner A. Consequence or coincidence? The occurrence, pathogenesis and significance of autoimmune manifestations after viral vaccines. Vaccine. 2005;23:3876–3886. doi: 10.1016/j.vaccine.2005.03.005. [DOI] [PubMed] [Google Scholar]
- 12.Xu Z., Shi L., Wang Y., Zhang J., Huang L., Zhang C., et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med. 2020;8:420–422. doi: 10.1016/S2213-2600(20)30076-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Yao X.H., Li T.Y., He Z.C., Ping Y.F., Liu H.W., Yu S.C., et al. A pathological report of three COVID-19 cases by minimally invasive autopsies. Zhonghua Bing Li Xue Za Zhi. 2020;49:411–417. doi: 10.3760/cma.j.cn112151-20200312-00193. [DOI] [PubMed] [Google Scholar]
- 14.Erpicum P., Grosch S., Bouquegneau A., Huart J., Résimont G., Bovy C., et al. Kidney injury in COVID-19. Rev Med Liege. 2020;75(Sup. 75):109–114. [PubMed] [Google Scholar]
- 15.Bouquegneau A., Grosch S., Erpicum P., Huart J., Delvenne P., Misset B., et al. Corrélation anatomoclinique de l’atteinte rénale de la COVID-19. Nephrol Ther. 2020;16:245–246. [Google Scholar]
- 16.Cohen S.R., Prussick L., Kahn J.S., Gao D.X., Radfar A., Rosmarin D. Leukocytoclastic vasculitis flare following the COVID-19 vaccine. Int J Dermatol. 2021;60:1032–1033. doi: 10.1111/ijd.15623. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Vaxzevria® vaccine pharmacovigilance survey Report no 13: period from May 21, 2021 to June 3, 2021 CRPV d’Amiens – CRPV Rouen.
- 18.Jeong H.L., Homme H., Yong J.K., Mee Seon K., Hee Y.J., Ji Jeune C., et al. New-onset nephrotic syndrome after Janssen COVID-19 vaccination: a case report and literature review. J Korean Med Sci. 2021;36:e218. doi: 10.3346/jkms.2021.36.e218. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.De la Flor Merino J.C. Un caso de nefritistubulointersticialagudadespués de la vacunación con Pfizer-BioNTech COVID-19. Nefrologia. 2021 doi: 10.1016/j.nefro.2021.05.004. [DOI] [Google Scholar]
- 20.DatasetCase Series Drug Analysis Print Name: COVID-19 mRNAPfizer-BioNTechvaccine analysis print. Report Run Date: 16-Mar-2021. Data Lock Date: 07-Mar-2021 19:00:03.


