Abstract
Objetivo
Estudiar la evolución del consumo de antibióticos en población adulta en el ámbito de Atención Primaria (AP) del Servicio de Salud del Principado de Asturias (SESPA) durante 2014-2020.
Diseño
Estudio observacional retrospectivo.
Emplazamiento
AP del SESPA.
Participantes
Población de la base de datos de Tarjeta Sanitaria Individual.
Intervenciones
Se recogieron datos de prescripción de antibióticos, realizada en las consultas de medicina de familia, dispensados en las oficinas de farmacia con cargo al SESPA. Se analizaron variables de uso y consumo de antibióticos mediante modelos de regresión lineal.
Mediciones principales
Prevalencia de uso de antibióticos (porcentaje población); tasa de consumo de antibióticos de uso sistémico (DTD), consumo relativo de antibióticos de espectro reducido (porcentaje DDD).
Resultados
La prevalencia media del uso de antibióticos del periodo 2014-2019 fue de 32,2% y 23,9% en 2020. La tasa de consumo de antibióticos de uso sistémico pasó de 21,4 DTD en 2014 a 12,7 DTD en 2020. El consumo de antibióticos de espectro reducido se mantuvo estable (19,4% DDD en 2014 y 19,3% DDD en 2020) (IC95: -0,10, 0,26). En el periodo de marzo a diciembre de 2020, el consumo de antibióticos se redujo un 28,6% respecto al mismo periodo de 2019.
Conclusiones
En 2014-2020 el consumo de antibióticos disminuyó, especialmente a partir de la pandemia por COVID-19, con estabilización del consumo de antibióticos de espectro reducido respecto al total. Existe variabilidad en el consumo por subgrupos terapéuticos.
Palabras clave: Antibacterianos, Prescripciones de medicamentos, Programas de monitoreo de medicamentos recetados, Atención primaria de salud
Abstract
Trend study of the consumption of systemic antibiotics in the adult population in of Primary Care of the Health Service of the Principality of Asturias (SESPA) during the period 2014̶2020. Retrospective observational study. SESPA, Primary Care. Population from the Individual Health Card database. Data were collected on the prescription of antibiotics, carried out in the family medicine consultations, dispensed in the pharmacy offices with charge of SESPA. Antibiotic use and consumption variables were analyzed using linear regression models. Prevalence of antibiotic use (population percentage); consumption rate of systemic antibiotics (DTD), relative consumption of narrow-spectrum antibiotics (percentage DDD). The average prevalence of the use of antibiotics for the 2014̶2019 period was 32.2% and 23.9% in 2020. The rate of consumption of systemic antibiotics decreased from 21.4 DTD in 2014 to 12.7 DTD in 2020. The consumption of narrow-spectrum antibiotics remained stable (19.4% DDD in 2014 and 19.3% DDD in 2020) (CI95: −0.10, 0.26). In the period from March to December 2020, the consumption of antibiotics decreased by 28.6% compared to the same period in 2019. In 2014̶2020, the consumption of antibiotics decreased, especially since the COVID-19 pandemic, with stabilization of the consumption of narrow-spectrum antibiotics compared to the total. There is variability in consumption by therapeutic subgroups.
Keywords: Anti-bacterial agents, Drug prescriptions, Prescription Drug Monitoring Programs, Primary Health Care
Introducción
La resistencia a antibióticos es una de las mayores amenazas tanto para la salud como para la seguridad alimentaria y el desarrollo económico mundial. Puede afectar a cualquier persona y, a pesar de que se trata de un fenómeno natural, el uso inadecuado de antibióticos está acelerando el proceso. Existe una relación lineal entre el uso de antimicrobianos y el aumento de microorganismos resistentes a éstos1, 2.
La prescripción prudente de antimicrobianos es una estrategia fundamental para frenar la amenaza global que representan las resistencias bacterianas. Por prescripción prudente se entiende evitar la innecesaria, promover el uso de antibióticos de espectro reducido, optimizar la duración del tratamiento y utilizar cuando sea posible la prescripción diferida3.
Se ha estimado que el 90% del consumo de antibióticos se genera en Atención Primaria (AP), donde una tercera parte de las consultas están relacionadas con enfermedades infecciosas4. Monitorizar el consumo de antibióticos es indispensable para conocer la presión que el uso de los mismos ejerce en la aparición de resistencias5, 6.
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), publicó en 2014 el Plan estratégico y de acción para reducir el riesgo de selección y diseminación de resistencia a los antibióticos7, cuyo objetivo es desarrollar las acciones necesarias para reducir este riesgo, preservando de manera sostenible el arsenal terapéutico existente.
La Organización Mundial de la Salud (OMS) expresó en junio de 2020 su temor a que esta tendencia se acelerase por el uso inapropiado de antibióticos durante la pandemia por COVID-198.
Según datos del Plan Nacional frente a la Resistencia a Antibióticos (PRAN), durante la primera ola de la pandemia la tasa de consumo de antibióticos bajó un 40% en AP y subió un 40% en hospitales. En el período 2014-2019 la tendencia había sido decreciente de forma global, y en el ranking europeo de consumo de antibióticos España se encontraba en el quinto puesto en el ámbito comunitario y la catorceava en hospitales9.
Desde antes del periodo COVID-19, una de las estrategias del PRAN ha sido seleccionar una batería de indicadores destinados a medir el consumo de antimicrobianos en AP, permitiendo analizar la calidad (o selección adecuada de determinados antibióticos), las tasas de consumo o la exposición individual a los mismos.
Se han seleccionado una serie de indicadores, de los propuestos por el PRAN10, con los objetivos:
-
•
Estudiar su evolución en población adulta asturiana, en el ámbito de AP durante el periodo 2014-2020, identificando la tendencia de mejora de los mismos.
-
•
Estudiar los cambios en el consumo de antibióticos que tuvieron lugar en 2020, por la pandemia por COVID-19.
-
•
Comparar los resultados con los de otras Comunidades Autónomas (CCAA)11, 12, 13.
Material y métodos
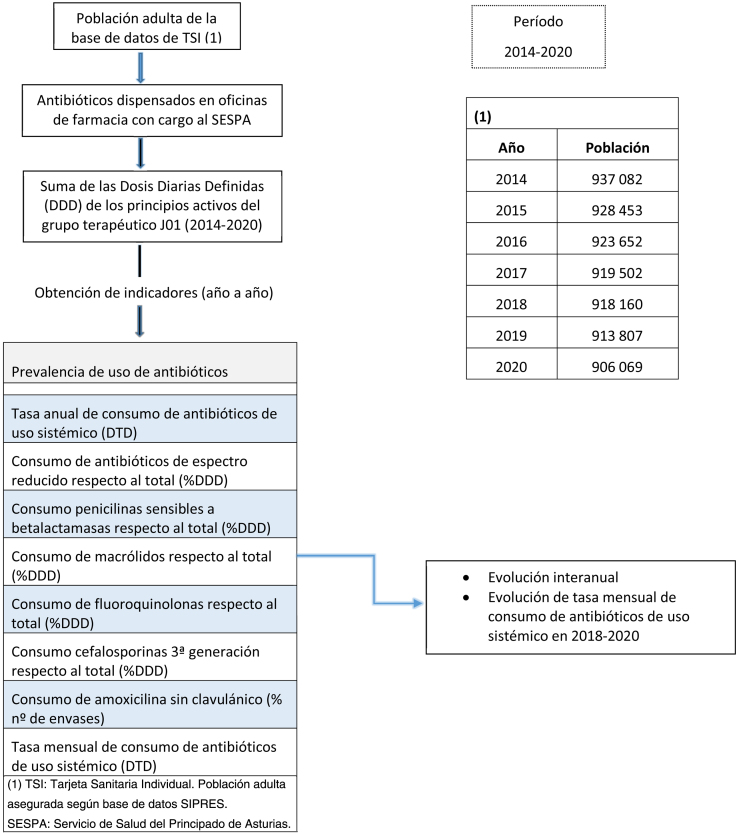
Para estudiar la evolución del consumo de antibióticos en población adulta (≥ 14 años) durante 2014-2020, se seleccionaron los indicadores más representativos de los propuestos por el PRAN10. Las fórmulas y definiciones de los indicadores se muestran en tabla 1.
Tabla 1.
Definiciones, unidades de medida y fórmulas de los indicadores de consumo de antibióticos en población ≥ 14 años
| Definición | Unidad de medida | Fórmula |
|---|---|---|
| Prevalencia de uso de antibióticos o porcentaje de población que consume antibióticos en un año | % población | N° de habitantes que han consumido antibióticos de uso sistémico (J01) * 100/ población adulta asegurada * 12 meses |
| Tasa anual de consumo de antibióticos de uso sistémico | *DTD | DDD antibacterianos de uso sistémico (J01) * 1.000 / población adulta asegurada * 365 días |
| Consumo de antibióticos de espectro reducido respecto al total | %DDD | DDD antibióticos de Espectro reducido** / DDD antibacterianos de uso sistémico (J01) * 100 |
| Consumo penicilinas sensibles a betalactamasas respecto al total | %DDD | DDD penicilinas sensibles a betalactamasas (J01CE) * 100 / DDD antibacterianos de uso sistémico (J01) |
| Consumo de macrólidos respecto al total | %DDD | DDD macrólidos (J01FA) * 100 / DDD antibacterianos uso sistémico (J01) |
| Consumo fluoroquinolonas respecto al total | %DDD | DDD fluoroquinolonas (J01MA) * 100 / DDD antibacterianos uso sistémico (J01) |
| Consumo cefalosporinas de tercera generación respecto al total | %DDD | DDD cefalosporinas tercera generación (J01DD) * 100 / DDD antibacterianos uso sistémico (J01) |
| Consumo de amoxicilina sin clavulánico | % n.° envases | N° Envases amoxicilina (J01CA04) * 100 / envases amoxicilina (J01CA04) + envases amoxicilina clavulánico (J01CR02) |
| Tasa mensual de consumo antibióticos de uso sistémico | *DTD | DDD antibacterianos de uso sistémico (J01) * 1.000 / población adulta asegurada * 30 días |
Tabla tomada y modificada del documento del PRAN3.
DTD: es una variante de la Dosis Diaria Definida Habitante Día (DHD) en la que se sustituye el n° de habitantes (población INE) por población adulta asegurada, lo que nos proporciona información del número de personas con tarjeta sanitaria por cada 1.000 habitantes, que en cada año de estudio están consumiendo una dosis terapéutica diaria de un antibacteriano de uso sistémico (J01).
Antibióticos de espectro reducido: penicilinas de espectro ampliado (J01CA), penicilinas sensibles a betalactamasas (J01CE), penicilinas resistentes a betalactamasas (J01CF), fosfomicina (J01XX01).
Los datos necesarios fueron aportados por la sección de farmacia de la Subdirección de Infraestructuras y Servicios Técnicos del Servicio de Salud del Principado de Asturias (SESPA).
Los datos se extrajeron de la cinta de facturación de recetas que envía el Colegio Oficial de Farmacéuticos (COF) mensualmente al SESPA y que contiene toda la información incluida en una receta, como puede ser: número de envases dispensados, cantidad de principio activo en cada forma farmacéutica, número de formas farmacéuticas por envase, código nacional de la especialidad y fecha de facturación de las recetas, de cualquier principio activo incluido en el subgrupo terapéutico J01 (antibacterianos de uso sistémico) de la clasificación Anatomical Therapeutic Chemical (ATC)14, 15, 16.
En cada código de principio activo, se engloban todas aquellas especialidades farmacéuticas con códigos nacionales diferentes que contienen el mismo principio activo, lo que resulta útil para agrupar la información por principio activo.
Se incluyeron los datos de las prescripciones de antibióticos realizadas en las consultas de medicina de familia, dispensados en las oficinas de farmacia de las ocho Áreas Sanitarias con cargo al SESPA, desde enero 2014 hasta diciembre de 2020. No se incluyeron prescripciones del ámbito hospitalario, de mutuas o de receta médica privada.
Se han seguido las recomendaciones del PRAN en lo que respecta a las unidades técnicas de medida:
-
•
La tasa de consumo anual de antibióticos de uso sistémico se expresó, en dosis diaria definida (DDD) por 1.000 habitantes con tarjeta sanitaria individual (TSI) y día (DTD), que es una variante de la DDD por 1.000 habitantes y día (DHD). Se calculó mediante la fórmula:
-
•
DTD anual = DDD antibacterianos de uso sistémico (J01) * 1.000/población adulta asegurada * 365 días.
-
•
Para el dato de población en el denominador, se utilizó la población ≥14 años con TSI activa en el Sistema de Información de Población y Recursos Sanitarios (SIPRES), para cada año de estudio.
-
•
Se ha considerado utilizar la población adulta asegurada en vez de la del padrón municipal, ya que el objetivo del estudio es el análisis de las prescripciones de antibióticos desde las consultas de medicina de familia y en este sentido el uso del dato poblacional podría incorporar sesgos, ya que no todos los habitantes de una zona son atendidos por el SESPA.
-
•
Para el resto de indicadores, los datos se expresaron en porcentaje DDD, porcentaje de envases, porcentaje de población que consume antibióticos en un año y DTD mensual.
Se ajustó un modelo de regresión lineal simple para cada uno de los indicadores, considerando como variable dependiente la DTD, porcentaje DDD o porcentaje envases, y como variable independiente el año de estudio. Se presentaron los valores de coeficientes de regresión (b), intervalos de confianza del 95% (IC 95%) y los coeficientes de determinación (R2).
Se realizaron descripciones de valores absolutos y variaciones porcentuales de la evolución de los indicadores en el periodo estudiado.
Se utilizó el paquete estadístico R 4.1.0 (The R Foundation, Viena, Austria. https://cran.r-project.org)17.
El protocolo del estudio ha sido aprobado por el Comité de Ética de la Investigación del Principado de Asturias.
Esquema general del estudio.
Resultados
A partir de los datos mostrados en la tabla 2, la prevalencia media del uso de antibióticos fue de 32,2% en 2014 y de 23,9% en 2020, lo que supuso un descenso relativo del 25,8%.
Tabla 2.
Prevalencia de uso de antibióticos en población adulta (≥ 14 años) de Asturias (2014-2020)
| Año | Adultos que consumieron antibióticos (AP) | Población adulta asegurada (1) | Prevalencia (%) |
|---|---|---|---|
| 2014 | 269.749 | 937.082 | 28,79 |
| 2015 | 311.416 | 928.453 | 33,54 |
| 2016 | 315.151 | 923.652 | 34,12 |
| 2017 | 300.642 | 919.502 | 32,70 |
| 2018 | 295.363 | 918.160 | 32,17 |
| 2019 | 290.384 | 913.807 | 31,78 |
| 2020 | 216.186 | 906.069 | 23,86 |
(1) SIPRES - Población asegurada INSS/SNS.
En la tabla 3 se representan los datos de la suma de las DDD de los principios activos del subgrupo terapéutico J01, para cada año estudiado.
Tabla 3.
Suma de las dosis diarias definidas (DDD) de los principios pctivos (PA) del grupo terapéutico J01 (2014-2020)
| Año/PA | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|---|---|
| J01AA02 Doxiciclina | 170.745,00 | 170.187,00 | 167.875,00 | 180.799,00 | 182.980,00 | 179.899,00 | 170.167,00 |
| J01AA079 Tetraciclina | 1.272,00 | 428,00 | 24,00 | 4,00 | |||
| J01AA08 Minociclina | 23.502,00 | 18.720,00 | 15.732,00 | 14.514,00 | 12.978,00 | 12.978,00 | 13.068,00 |
| J01AA92 Doxiciclina combinaciones | 3.851,46 | 901,98 | 6.398,00 | 812,00 | |||
| J01CA01 Ampicilina | 3.883,75 | 3.397,50 | 3.587,00 | 3.445,00 | 3.295,00 | 3.441,58 | 3.060,16 |
| J01CA04 Amoxicilina | 1.095.115,00 | 1.128.642,50 | 1.090.002,00 | 1.062.086,50 | 1.041.451,00 | 719.745,90 | 496.609,97 |
| J01CE01 Bencilpenicilina | 4,27 | 2,43 | 5,45 | 3,06 | 4,31 | 2,19 | 0,52 |
| J01CE02 Fenoximetilpenicilina | 25.661,14 | 22.033,13 | 25.820,64 | 31.080,65 | 31.106,30 | 39.027,54 | 24.696,26 |
| J01CE08 Benzatina bencilpenicilina | 154,17 | 136,77 | 168,96 | 146,87 | 159,79 | 145,42 | 115,42 |
| J01CE09 Penicilina procaína | 45,00 | 52,50 | 31,25 | 40,63 | 15,00 | 32,50 | 15,63 |
| J01CE10 Fenoximetilpenicilina benzatina | 67,19 | 50,00 | 54,69 | 43,75 | 42,19 | 14,06 | 4,69 |
| J01CE30 Combinaciones | 41,15 | 53,16 | 17,53 | 18,13 | 22,67 | 26,39 | 7,08 |
| J01CF02 Cloxacilina | 44.453,55 | 40.431,00 | 39.890,25 | 37.137,00 | 31.452,50 | 33.999,50 | 30.714,75 |
| J01CR02 Amoxicilina e inhibidores betalactamasa | 2.848.851,25 | 2.944.848,50 | 2.806.654,10 | 2.662.587,75 | 2.586.757,85 | 1.588.084,07 | 1.201.386,40 |
| J01DB01 Cefalexina | 412,00 | 469,00 | 546,00 | 532,00 | 448,00 | 1.120,00 | 1.435,00 |
| J01DB04 Cefazolina | 1,33 | 16,33 | 51,67 | 35,33 | 46,33 | 11,67 | |
| J01DB05 Cefadroxilo | 27,00 | 91,00 | 45,00 | 220,00 | 275,00 | 3.354,50 | 5.377,00 |
| J01DC02 Cefuroxima | 537.581,80 | 626.054,55 | 657.317,00 | 639.884,60 | 645.635,30 | 657.799,70 | 537.822,65 |
| J01DC04 Cefaclor | 1.094,00 | 460,00 | 505,00 | 505,00 | 855,00 | 890,00 | 465,00 |
| J01DC06 Cefonicida | 3.131,50 | 3.251,00 | 294,50 | 1,00 | |||
| J01DD01 Cefotaxima | 8,50 | 3,50 | 7,50 | 0,25 | 3,25 | 4,00 | |
| J01DD02 Ceftazidima | 60,00 | 26,50 | 15,75 | 16,75 | 20,25 | 3,50 | 7,25 |
| J01DD04 Ceftriaxona | 109,25 | 88,63 | 164,13 | 177,25 | 56,63 | 94,63 | 71,38 |
| J01DD08 Cefixima | 23.434,50 | 23.260,00 | 21.570,00 | 20.500,50 | 19.936,00 | 26.758,50 | 30.105,50 |
| J01DD13 Cefpodoxima | 18,00 | ||||||
| J01DD14 Ceftibuteno | 176,70 | 184,00 | 162,40 | 50,00 | |||
| J01DD16 Cefditoreno | 54.520,00 | 61.300,00 | 56.820,00 | 50.980,00 | 44.080,00 | 31.300,00 | 22.700,00 |
| J01DE01 Cefepima | 8,00 | ||||||
| J01DF01 Aztreonam | 20,00 | 20,75 | 8,25 | 2,50 | |||
| J01EA01 Trimetoprima | 31,20 | 36,80 | 93,60 | 224,00 | 44,80 | 6,40 | 44,80 |
| J01EC02 Sulfadiazina | 2.116,67 | 2.466,67 | 1.633,33 | 1.283,33 | 483,33 | 600,00 | 2.500,00 |
| J01EE01 Sulfametoxazol y trimetoprima | 138.041,30 | 129.335,10 | 131.143,95 | 136.612,60 | 139.447,60 | 157.766,30 | 164.936,25 |
| J01FA01 Eritromicina | 15.612,00 | 15.597,50 | 16.307,00 | 12.829,50 | 9.192,50 | 7.237,50 | 5.497,50 |
| J01FA02 Espiramicina | 3.392,00 | 5.516,00 | 5.012,00 | 4.400,00 | 2.928,00 | 1.876,00 | 1.108,00 |
| J01FA06 Roxitromicina | 2.962,00 | 2.904,00 | 3.047,00 | 2.650,00 | 2.858,00 | 2.857,00 | 1.466,00 |
| J01FA07 Josamicina | 930,00 | 640,00 | 757,50 | 680,00 | 552,50 | 615,00 | 260,00 |
| J01FA09 Claritromicina | 193.066,00 | 222.581,00 | 207.245,00 | 199.883,00 | 187.473,00 | 183.377,00 | 96.303,00 |
| J01FA10 Azitromicina | 439.799,14 | 533.821,06 | 556.016,30 | 522.125,60 | 507.647,45 | 496.013,20 | 319.127,61 |
| J01FA11 Miocamicina | 25.942,00 | 27.726,00 | 26.796,00 | 20.735,00 | 17.949,00 | 14.555,00 | 10.619,00 |
| J01FA15 Telitromicina | 165,00 | 25,00 | 25,00 | 25,00 | 15,00 | ||
| J01FF01 Clindamicina | 22.500,00 | 27.324,00 | 30.606,00 | 30.678,33 | 32.688,00 | 32.994,00 | 37.548,00 |
| J01FF02 Lincomicina | 86,67 | 133,33 | 60,00 | 46,67 | 20,00 | 6,67 | 20,00 |
| J01GA01 Estreptomicina | 118,00 | 97,00 | 95,00 | 130,00 | |||
| J01GB01 Tobramicina | 91,46 | 109,38 | 72,50 | 109,17 | 96,46 | 62,08 | 55,21 |
| J01GB03 Gentamicina | 767,67 | 841,00 | 765,50 | 655,83 | 602,67 | 479,50 | 484,33 |
| J01GB06 Amikacina | 270,50 | 221,25 | 258,50 | 315,50 | 210,00 | 110,00 | 92,00 |
| J01MA01 Ofloxacino | 2.033,00 | 161,00 | 313,00 | 392,00 | 406,00 | 371,00 | 56,00 |
| J01MA02 Ciprofloxacino | 306.635,50 | 311.529,00 | 313.936,50 | 311.793,50 | 286.371,50 | 236.963,00 | 221.842,50 |
| J01MA06 Norfloxacino | 147.301,00 | 140.903,00 | 139.664,00 | 132.643,00 | 134.904,00 | 101.311,00 | 88.074,00 |
| J01MA12 Levofloxacino | 147.061,00 | 188.062,00 | 185.529,00 | 186.013,00 | 178.352,00 | 152.756,00 | 94.542,00 |
| J01MA14 Moxifloxacino | 153.088,00 | 171.366,00 | 159.254,00 | 144.739,00 | 115.414,00 | 79.414,00 | 39.000,00 |
| J01MB04 Acido pipemídico | 4.395,00 | 3.900,00 | 3.185,00 | 2.400,00 | 2.205,00 | 340,00 | |
| J01RA04 Espiramicina, combinaciones | 30.460,00 | ||||||
| J01XA01 Vancomicina | 19,00 | 32,00 | 2,50 | 10,50 | 6,00 | ||
| J01XC01 Acido fusídico | 728,67 | 731,67 | 605,00 | 508,33 | 631,67 | 396,67 | 286,67 |
| J01XE01 Nitrofurantoína | 96.796,75 | 98.633,05 | 86.354,50 | 46.614,80 | 44.442,05 | 46.427,05 | 36.286,75 |
| J01XX01 Fosfomicina | 129.634,37 | 136.085,34 | 147.961,63 | 164.319,04 | 175.347,99 | 183.766,33 | 186.918,98 |
| Total general | 6.702.285,38 | 7.065.879,54 | 6.910.472,04 | 6.628.456,55 | 6.441.897,87 | 4.999.068,00 | 3.844.909,91 |
Los datos de la evolución de los indicadores fueron (tabla 4):
-
•
La tasa de consumo de antibióticos de uso sistémico disminuyó una media de 1,39 DTD por año (IC 95%: -2,50 a -0,27), pasando de 21,42 DTD en 2014, a 12,70 en 2020 (disminución del 40,70%). La reducción de dicha tasa en el año 2020 respecto a 2019 fue del 23,63%.
Tabla 4.
Evolución de los indicadores de consumo de antibióticos en población ≥14 años de Asturias (2014-2020)
| 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | *R2 | **b | ***IC 95%* | |
|---|---|---|---|---|---|---|---|---|---|---|
| Tasa antibióticos uso sistémico (DTD) | 21,42 | 22,43 | 22,23 | 21,48 | 21,11 | 16,63 | 12,70 | 67,20% | -1,39 | -2,50 a -0,27 |
| Antibióticos espectro reducido (% DDD) | 19,38 | 18,84 | 18,92 | 19,59 | 19,91 | 19,61 | 19,30 | 21,10% | 0,08 | -0,10 a 0,26 |
| Penicilinas sensibles a beta lactamasas (% DDD) | 0,39 | 0,32 | 0,38 | 0,47 | 0,49 | 0,79 | 0,65 | 72,00% | 0,07 | 0,02 a 0,11 |
| Macrólidos (% DDD) | 10,17 | 11,45 | 11,8 | 11,52 | 11,31 | 14,13 | 11,30 | 28,10% | 0,29 | -0,25 a 0,84 |
| Fluoroquinolonas (% DDD) | 11,28 | 11,49 | 11,56 | 11,7 | 11,11 | 11,42 | 11,54 | 0,40% | 0,01 | -0,10 a 0,11 |
| Cefalosporinas tercera generación (% DDD) | 1,17 | 1,2 | 1,14 | 1,08 | 0,99 | 1,16 | 1,38 | 7,00% | 0,01 | -0,05 a 0,07 |
| Amoxicilina sin clavulánico (% envases) | 28,47 | 28,65 | 28,16 | 28,42 | 28,25 | 30,38 | 28,47 | 12,90% | 0,13 | -0,25 a 0,51 |
R2: Coeficiente de determinación
b: Coeficiente de regresión lineal
IC 95% de la pendiente de la regresión lineal (b).
No se ha apreciado una tendencia de descenso estadísticamente significativa en el consumo de antibióticos de espectro reducido (b: 0,08 IC95%: -0,10 a 0,26); siendo el porcentaje de DDD de 19,38 en 2014 y 19,30 en 2020 (descenso del 0,41%).
-
•
El consumo de penicilinas sensibles a betalactamasas presentó un incremento estadísticamente significativo, a una media de 0,07% DDD por año (IC 95%: 0,02 a 0,11); el porcentaje de DDD fue de 0,39 en 2014 y 0,65 en 2020 (incremento relativo del 66,66%).
-
•
No se han observado incrementos estadísticamente significativos en los porcentajes de DDD de macrólidos, fluoroquinolonas y cefalosporinas de tercera generación con respecto al total de antibióticos (incrementos del 11,11%, 2,30% y 17,94%, respectivamente).
-
•
El porcentaje de envases de amoxicilina sin clavulánico tampoco presentó tendencias estadísticamente significativas (b: 0,13 IC 95%: -0,25 a 0,51; p valor = 0,4) (28,47% en 2014 y 28,47% en 2020).
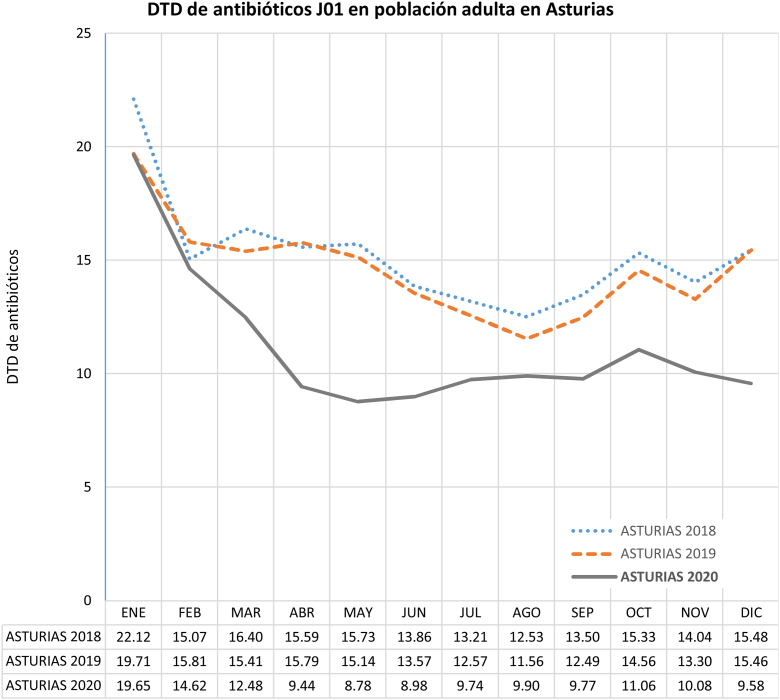
La figura 1 muestra la comparativa de la tasa de consumo de antibióticos mensual durante 2018-2020, apreciándose que la media de la tasa de consumo entre los meses de marzo-diciembre de 2020 se reduce de forma estadísticamente significativa (p < 0,001) respecto a la del año previo, de 13,98 (IC 95%: 12,92 a 15,04) en 2019 a 9,98 (IC 95%: 9,21 a 10,75) en 2020 (descenso del 28,64%).
Figura 1.
Evolución de la tasa mensual de consumo de antibióticos de uso sistémico en población adulta de Asturias (2018-2020).
Discusión
Los datos muestran que, al igual que en el conjunto de España, la tasa de consumo de antibióticos de uso sistémico ha ido disminuyendo de forma gradual en los últimos años, siendo el descenso más pronunciado en el año 2020 en el que se produce una reducción importante a partir del mes de marzo (el 14 de marzo el Gobierno decretó el estado de alarma ante la pandemia por COVID-19).
Según datos publicados por el PRAN11, 13, la caída del número de DHD de antibióticos de uso sistémico en el sector comunitario en receta oficial fue del 23,64% en 2020 frente a 2019, para el conjunto de España, lo que pudo ser debido al impacto de las medidas aplicadas por la COVID-19: confinamientos, uso de mascarillas, descenso de la circulación de virus respiratorios y reducción de consultas médicas presenciales.
Según la misma fuente, la reducción en DHD en Asturias fue del 24,4%, algo mayor que la obtenida en nuestro estudio. La diferencia puede estar en que nuestros cálculos no incluyen prescripciones del ámbito de la atención especializada ni de población pediátrica, y por otra parte hemos utilizado la población de TSI en lugar de la del padrón municipal, al considerar que esta es más idónea para identificar el origen de la prescripción que, incluyendo la población no asegurada al Sistema Nacional de Salud (mutualistas, o aquellos que han recibido prescripción en medicina privada).
Si además de lo prescrito con receta oficial tenemos en cuenta los antibióticos prescritos en mutuas y en receta médica privada en el ámbito comunitario, para el conjunto nacional el consumo de antibióticos se redujo un 21,7% en 2020, respecto a 201911. En nuestro estudio, la prescripción de mutuas y de receta médica privada no se ha podido cuantificar al no disponer de información ni ser parte de los objetivos del estudio, por lo que el consumo real será necesariamente mayor que el obtenido.
Es interesante reseñar que, en el ámbito nacional, la curva publicada por el PRAN11 muestra los mayores descensos interanuales en los meses de abril y mayo y de octubre a noviembre, donde no tuvo lugar el pico invernal característico. En Asturias, la evolución de consultas totales de medicina de familia en los centros de salud sufrió un importante cambio, tanto en lo cuantitativo como en lo cualitativo. En este último aspecto, destaca un gran incremento de las consultas no presenciales (telefónicas), con una reducción de las presenciales, especialmente en la primera ola. En cuanto al número total de consultas, éstas se redujeron respecto al año previo entre los meses de marzo y mayo, sufriendo un incremento progresivo entre los meses de junio y diciembre, superando claramente las del mismo periodo del año 2019. En el cómputo global, los datos recogidos del Sistema de Información de AP (SIAP) muestran un incremento de 4.524.566 a 4.671.870 consultas totales de enero a diciembre de 2020 (3,25%).
Esta tendencia se detecta en otros países, como Reino Unido o Portugal18, 19, con un sistema sanitario parecido al nuestro y en otros continentes20, 21, 22. En un estudio del ámbito de AP18, la prescripción se redujo un 15,48% en el periodo de abril a agosto de 2020 respecto al mismo periodo de 2019, aunque, teniendo en cuenta el descenso experimentado en el número de consultas, consideran que el número de prescripciones fue un 6,71% mayor que el esperado.
En el estudio realizado en Nueva Zelanda20 se concluye que, a pesar de la marcada reducción en la dispensación comunitaria de antibióticos observada durante la implementación de intervenciones de salud pública no farmacológicas para frenar la COVID-19, no hubo un aumento en las tasas de hospitalización por infecciones centinela que el uso de antibióticos en la comunidad podrían prevenir.
No hemos encontrado datos publicados de los indicadores de consumo de antibióticos diferenciados para población adulta en España que nos permitan comparar nuestros resultados, por lo que creemos que son necesarios más estudios, así como el desarrollo de indicadores que permitan obtener datos homogéneos, con el fin de que el PRAN pueda presentar los datos desagregados por rangos de edad y CCAA23, 24.
A pesar del descenso de la tasa de consumo de antibióticos, hemos observado variabilidad en los resultados por subgrupos terapéuticos, aunque las diferencias por lo general no fueron estadísticamente significativas.
Consideramos que no supone un buen resultado el hecho de que la utilización de antibióticos de espectro reducido no haya disminuido de forma estadísticamente significativa. En este indicador se monitoriza el uso relativo de estos antibióticos, indicados en un alto porcentaje de infecciones respiratorias, urinarias, de piel y de partes blandas que se tratan en AP. En estos escenarios clínicos, los antibióticos de amplio espectro deben ser evitados en la medida de lo posible y reservarse para situaciones en las que aquellos de espectro reducido no sean eficaces25.
Por otra parte, el consumo de fluoroquinolonas, macrólidos, cefalosporinas de tercera generación y amoxicilina sin clavulánico, se mantuvo estable.
Los macrólidos no son antibióticos de primera línea en AP, y deben reservarse para casos concretos (alergias a betalactámicos, infecciones respiratorias por gérmenes atípicos o infección por B. pertussis)26. El posicionamiento terapéutico de azitromicina en el tratamiento de casos por COVID-19 en las primeras semanas de la pandemia no parece haber modificado la tendencia del consumo de macrólidos, aunque no se ha analizado la prescripción de ese principio activo de forma específica.
Dado los altos niveles de resistencias de microorganismos como E. coli a las fluoroquinolonas27, 28, su uso en infecciones respiratorias y urinarias en AP debe restringirse a pacientes seleccionados tras fallo terapéutico con otros antibióticos de menor espectro. Su uso está asociado con la posibilidad de reacciones adversas graves que afectan a los sistemas musculoesquelético y nervioso, y al aumento del riesgo de infección por C. difficile26.
Las cefalosporinas de tercera generación son antibióticos considerados para el ámbito hospitalario dado su gran espectro de acción, y reservados para usos muy justificados en medio ambulatorio, puesto que se asocian con un incremento de las resistencias y riesgo de infección por C. difficile29.
Amoxicilina-clavulánico solo debe utilizarse cuando el agente etiológico probable sea productor de betalactamasas. Un alto porcentaje de infecciones en AP son producidas por microorganismos no productores de betalactamasas (como neumococo o S. pyogenes). Su uso está asociado a un aumento del riesgo de infección por C. difficile, que aumenta con la duración del tratamiento y en pacientes de riesgo como por ejemplo personas de edad avanzada. Además, el daño hepático y colestático es más frecuente que con otros antibióticos30.
No obstante, el consumo de penicilinas sensibles a betalactamasas aumentó de forma estadísticamente significativa. Estos antibióticos permiten tratar infecciones causadas por bacterias sensibles con un menor impacto sobre el resto de la flora y por ello disminuyen la selección de cepas resistentes.
Por último, resulta llamativa la reducción de la tasa de consumo de antibióticos relacionada con el periodo de pandemia por COVID-19 en Asturias, a pesar de que según datos del SIAP, las consultas de Medicina de Familia aumentaron un 4,04% en ese periodo. Además, esa reducción influye de forma importante en la evolución de la tasa de consumo anual durante 2014-2020. Este comportamiento del consumo de antibióticos en el periodo de pandemia se describe también en estudios de otros países18, 19, 20, 21, 22, y puede tener relación con cambios cuantitativos y cualitativos en la accesibilidad, en el perfil epidemiológico de las infecciones respiratorias, y en la propia práctica profesional.
En suma, los resultados obtenidos nos llevan a destacar que la obtención de indicadores de consumo y de prevalencia de uso de antibióticos es imprescindible para estudiar la evolución de estos a lo largo del tiempo, informar a los profesionales de los distintos ámbitos del sistema sanitario, detectar áreas de mejora e implementar las intervenciones necesarias.
Puntos clave
-
•
Existe una tendencia a la baja en el consumo de antibióticos en la población adulta de Asturias en el periodo 2014-2020.
-
•
La reducción de la tasa de consumo de antibióticos es más pronunciada en el periodo de pandemia por COVID-19, especialmente a partir de marzo de 2020.
-
•
Esta tendencia en la comunidad autónoma es coherente con la observada en el territorio nacional.
-
•
La evaluación y publicación de datos de consumo de antibióticos es fundamental para la información de profesionales y población general, y para establecer las medidas correctoras oportunas.
Financiación
Esta investigación ha sido financiada por la Consejería de Salud del Principado de Asturias, con cargo a los fondos para el desarrollo del Programa de medidas para mejorar la eficiencia y la sostenibilidad del Sistema Nacional de Salud 2021-2023.
Conflictos de interés
Todos los autores declaran no tener ningún conflicto de interés.
Agradecimientos
Al Doctor Mauricio Telenti Asensio, por su aportación científica en la revisión del manuscrito y a Evaristo Bayón Castaño, por su colaboración en la recogida de datos.
Bibliografía
- 1.Alós J.-I. Resistencia bacteriana a los antibióticos: una crisis global. Enferm Infecc Microbiol Clin. 2015;33:692–699. doi: 10.1016/j.eimc.2014.10.004. [DOI] [PubMed] [Google Scholar]
- 2.Bengtsson-Palme J., Kristiansson E., Larsson D.G.J. Environmental factors influencing the development and spread of antibiotic resistance. FEMS Microbiol Rev. 2018;42:fux053. doi: 10.1093/femsre/fux053. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Rather I.A., Kim B.-C., Bajpai V.K., Park Y.-H., Self-medication antibiotic resistance: Crisis, current challenges, prevention Saudi J Biol Sci. 2017;24:808–812. doi: 10.1016/j.sjbs.2017.01.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Llor C., Uso prudente de antibióticos: propuestas de mejora desde la atención primaria Enferm Infecc Microbiol Clin. 2010;28:17–22. doi: 10.1016/S0213-005X(10)70037-9. [DOI] [PubMed] [Google Scholar]
- 5.Fernández-Urrusuno R., Flores-Dorado M., Vilches-Arenas A., Serrano-Martino C., Corral-Baena S., Montero-Balosa M.C. Adecuación de la prescripción de antibióticos en un área de atención primaria: estudio descriptivo transversal. Enferm Infecc Microbiol Clin. 2014;32:285–292. doi: 10.1016/j.eimc.2013.05.004. [DOI] [PubMed] [Google Scholar]
- 6.Fernández-Urrusuno R., Flores-Dorado M., Moreno-Campoy E., Montero-Balosa M.C. Selección de indicadores para la monitorización continúa del impacto de programas de optimización de uso de antimicrobianos en Atención Primaria. Enferm Infecc Microbiol Clin. 2015;33:311–319. doi: 10.1016/j.eimc.2014.07.011. [DOI] [PubMed] [Google Scholar]
- 7.Agencia Española de Medicamentos y Productos Sanitarios. Plan estratégico y de acción para reducir el riesgo de selección y diseminación de la resistencia a los antibióticos; 2015. [consultado 5 Ago 2021]. Disponible en: https://www.aemps.gob.es/publicaciones/publica/plan-estrategico-antibioticos/v2/docs/plan-estrategico-antimicrobianos-AEMPS.pdf.
- 8.World Health Organization. Record number of countries contribute data revealing disturbing rates of antimicrobial resistance [Internet]. WHO. [actualizado 1 Jun 2020; consultada 5 Ago 2021]. Disponible en: https://www.who.int/news/item/01-06-2020-record-number-of-countries-contribute-data-revealing-disturbing-rates-of-antimicrobial-resistance.
- 9.Agencia Española de Medicamentos y Productos Sanitarios (Notas Informativas). El consumo de antibióticos en España recupera la tendencia decreciente pre-pandemia [Internet]. AEMPS; [actualizada 18 Nov 2020; consultada 5 Ago 2021]. Disponible en: https://www.aemps.gob.es/informa/notasinformativas/ministerio-de-sanidad/el-consumo-de-antibioticos-en-espana-recupera-la-tendencia-decreciente-pre-pandemia/.
- 10.Agencia Española de Medicamentos y Productos Sanitarios. Plan Nacional Resistencia Antibióticos. Indicadores de uso de antibióticos en Atención Primaria; 2017 [consultada 5 Ago 2021]. Disponible en: https://resistenciaantibioticos.es/en/node/368.
- 11.Consumos Antibióticos Sector Comunitario. PRAN. Mapas de consumo en salud humana [Internet]. Plan Nacional Resistencia Antibióticos (PRAN). [consultada 5 Ago 2021]. Disponible en: https://resistenciaantibioticos.es/es/profesionales/vigilancia/mapas-de-consumo/consumos-antibioticos-en-atencion-primaria.
- 12.Agencia Española de Medicamentos y Productos Sanitarios. Memoria 2020; 2021 [consultada 5 Ago 2021]. Disponible en: https://www.aemps.gob.es/informa/notasInformativas/laAEMPS/2021/docs/memoria-2020.pdf?x46962.
- 13.Mapas de consumo en salud humana. PRAN. Mapas de consumo en salud humana [Internet]. Plan Nacional Resistencia Antibióticos (PRAN); [consultada 5 Ago 2021]. Disponible en: https://resistenciaantibioticos.es/es/profesionales/vigilancia/mapas-de-consumo/consumo-antibioticos-humana.
- 14.Real Decreto 1348/2003, de 31 de Oct, por el que se adapta la clasificación anatómica de medicamentos al sistema de clasificación ATC. Boletín Oficial del Estado, número 264 (4 de noviembre de 2003). [consultada 5 Ago 2021]. Disponible en: https://www.boe.es/eli/es/rd/2003/10/31/1348.
- 15.Bränd Persson K, Strøm H. The Anatomical Therapeutic Chemical (ATC) classification and its use in the Nordic countries (document WHO/GPE/CAS/C/02.49). Meeting of Heads of WHO Collaborating Centres for the Classification of Diseases. Brisbane (Australia). Published online 2002.
- 16.WHO Collaborating Centre for Drug Statistics Methodology [Internet]. WHO [consultada 5 Ago 2021]. Disponible en: https://www.whocc.no/.
- 17.R Core Team. R: The R Project for Statistical Computing [Internet]. [consultada 5 Ago 2021]. Disponible en: https://www.r-project.org/.
- 18.Armitage R., Nellums L.B. Antibiotic prescribing in general practice during COVID-19. Lancet Infect Dis. 2021;21:e144. doi: 10.1016/S1473-3099(20)30917-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Magalhães Silva T., Estrela M., Rebelo Gomes E., Piñeiro-Lamas M., Figueiras A., Roque F., et al. The Impact of the COVID-19 Pandemic on Antibiotic Prescribing Trends in Outpatient Care: A Nationwide Quasi-Experimental Approach. Antibiotics (Basel). 2021;10:1040. doi: 10.3390/antibiotics10091040. Disponible en: https://pubmed-ncbi-nlm-nih-gov.translate.goog/34572622/ [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Duffy E., Thomas M., Hills T., Ritchie S. The impacts of New Zealand's COVID-19 epidemic response on community antibiotic use and hospitalisation for pneumonia, peritonsillar abscess and rheumatic fever. Lancet Reg Health West Pac. 2021;12:100162. doi: 10.1016/j.lanwpc.2021.100162. Epub 2021 Jun 9. D. Disponible en: https://www.thelancet.com/journals/lanwpc/article/PIIS2666-6065(21)00071-7/fulltext. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Ryu S., Hwang Y., Ali S.T., Kim D.S., Klein E.Y., Lau E.H.Y., et al. Decreased Use of Broad-Spectrum Antibiotics During the Coronavirus Disease 2019 Epidemic in South Korea. J Infect Dis. 2021;224:949–955. doi: 10.1093/infdis/jiab208. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33856455/ [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.King L.M., Lovegrove M.C., Shehab N., Tsay S., Budnitz D.S., Geller A.I., et al. Trends in US Outpatient Antibiotic Prescriptions During the Coronavirus Disease 2019 Pandemic. Clin Infect Dis. 2021;73:e652–e660. doi: 10.1093/cid/ciaa1896. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33373435/ [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Palop Larrea V., Melchor Penella A., Martínez Mir I. Reflexiones sobre la utilización de antibióticos en atención primaria. Aten Primaria. 2003;32:42–47. doi: 10.1016/S0212-6567(03)78855-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Baos Vicente V., Barbero González A., Diogène Fadini E., Eguilleor Villena A., Eyaralar Riera T., Ibáñez Fernández J.ET-AL>. Documento de consenso sobre la utilización de antibióticos en atención primaria. Aten Primaria. 2006;38:174–177. doi: 10.1157/13090983. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Fernández Urrusumo R (coord.), Grupo de Trabajo de la Guía. Guía de Terapéutica Antimicrobiana Del Área Aljarafe, 3 a Edición. Sevilla. Distrito Sanitario Aljarafe-Sevilla Norte y Hospital San Juan de Dios Del Aljarafe. 3 a. Distrito Sanitario Aljarafe-Sevilla Norte y Hospital San Juan de Dios del Aljarafe; 2018 [consultada 5 Ago 2021]. Recuperado de: https://portal.guiasalud.es/wp-content/uploads/2018/12/GPC_578_Antimicrobianos_Aljarafe_2018.pdf.
- 26.Tarrazo Suárez J, González González C. Tratamiento antibiótico empírico de las principales infecciones bacterianas de los adultos en Atención Primaria y Centros Residenciales. Comisión de Uso Racional de Medicamentos y Productos Sanitarios. 2019 [consultada 5 Ago 2021]. Disponible en: https://www.astursalud.es/documents/35439/38364/2019%20Tratamiento%20antibi%C3%B3tico%20empirico/0aa66f3e-01c3-1d54-b67b-980e9d479f91.
- 27.Rodríguez-Martínez J.M. Mecanismos de resistencia a quinolonas mediada por plásmidos. Enferm Infecc Microbiol Clin. 2005;23:25–31. doi: 10.1157/13070406. [DOI] [PubMed] [Google Scholar]
- 28.Briales A., Rodríguez-Martínez J.M., Velasco C., Díaz de Alba P., Rodríguez-Baño J., Martínez-Martínez L., et al. Prevalence of plasmid-mediated quinolone resistance determinants qnr and aac (6’)-Ib-cr in Escherichia coli and Klebsiella pneumoniae producing extended-spectrum β-lactamases in Spain. Int J Antimicrob Agents. 2012;39:431–434. doi: 10.1016/j.ijantimicag.2011.12.009. [DOI] [PubMed] [Google Scholar]
- 29.Bujanda L., Cosme Á. Diarrea asociada a Clostridium difficile. Gastroenterol Hepatol. 2009;32:48–56. doi: 10.1016/j.gastrohep.2008.02.003. [DOI] [PubMed] [Google Scholar]
- 30.Agencia Española de Medicamentos y Productos Sanitarios (Notas Informativas). Uso de la asociación amoxicilina-ácido clavulámico y riesgo de hepatotoxicidad [Internet]. AEMPS; [actualizada 13 Mar 2006; consultada 5 Ago 2021]. Disponible en: https://www.aemps.gob.es/informa/notasinformativas/medicamentosusohumano-3/seguridad-1/2006/ni_2006-01_amoxicilina/.