Abstract
目的
探讨儿童Delta变异株新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)的流行病学及临床特征,分析其与儿童普通COVID-19的差异。
方法
回顾性选取2021年8~9月确诊的Delta变异株COVID-19和2020年2~3月确诊COVID-19的14岁以下儿童16例为研究对象。将16例患儿按照病毒变异情况分为变异组(n=11)与普通组(n=5),对两组流行病学、临床特征及实验室检查资料进行比较。
结果
临床症状发生比例在变异组与普通组间比较差异无统计学意义(P>0.05)。白细胞计数、淋巴细胞计数和血小板计数在两组间比较差异无统计学意义(P>0.05);变异组中性粒细胞计数低于普通组(P<0.05);两组均没有淋巴细胞减少病例。变异组肌酸激酶同工酶增高比例较普通组多见(P<0.05);而乳酸脱氢酶、D-二聚体、C-反应蛋白、白细胞介素-6增高比例与普通组比较差异无统计学意义(P>0.05)。9例变异组患儿在入院第2周有5例检测出IgM抗体阳性,均检测出IgG抗体阳性;入院第3周9例患儿IgM抗体水平呈下降趋势,8例患儿IgG抗体水平呈下降趋势。
结论
Delta变异株感染性增强,对儿童心肌的损害高于普通COVID-19。儿童感染Delta变异株后,IgG抗体出现时间与IgM抗体基本相同。
Keywords: COVID-19, Delta变异株, 临床特征, 儿童
Abstract
Objective
To study the epidemiological and clinical features of children with coronavirus disease 2019 (COVID-19) caused by Delta variant infection and their differences from children with ordinary COVID-19 (non-Delta variant infection).
Methods
Eleven children aged <14 years, who were diagnosed with COVID-19 caused by Delta variant infection from August to September 2021 were enrolled (variant group). Five children aged <14 years who were diagnosed with ordinary COVID-19 from February to March 2020 served as the control group. The epidemiological data, clinical features, and laboratory examination results were compared between the two groups.
Results
There was no significant difference in the proportion of children with clinical symptoms between the two groups (P>0.05). There were no significant differences in white blood cell count, lymphocyte count, and platelet count between the two groups (P>0.05), while the variant group had a lower neutrophil count than the control group (P<0.05). Lymphocytopenia was not observed in either group. Compared with the control group, the variant group had a higher proportion of children with an increase in creatine kinase isoenzyme (P<0.05), while there were no significant differences in the proportion of children with an increase in lactate dehydrogenase, D-Dimer, C-reactive protein or interleukin-6 between the two groups (P>0.05). Among the 9 children in the variant group, 5 tested positive for IgM antibody at week 2 after admission, and all children tested positive for IgG antibody. At week 3 after admission, the level of IgM antibody tended to decrease in 9 children, and the level of IgG antibody tended to decrease in 8 children.
Conclusions
Delta variant is more infectious. COVID-19 caused by Delta variant infection may cause more serious myocardial damage than ordinary COVID-19 in children. In children infected with Delta variant, IgG antibody appears at almost the same time as IgM antibody.
Keywords: COVID-19, Delta variant, Clinical feature, Child
新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)是一种由β属RNA冠状病毒所引起的急性呼吸道传染病,其传染性强,人群普遍易感[1]。开始认为患者主要为成人[2],但随着病原的变异及病原学检测的进一步开展,儿童感染的病例逐渐增多。尤其是今年Delta变异株COVID-19在国内不时有局部传播的报道。在此次传播中,与去年国内COVID-19疫情相比,Delta变异株COVID-19儿童病例明显增多。本文回顾性分析了荆门地区2020年2月1日至2020年3月10日确诊的5例儿童COVID-19及2021年8月6日至2021年9月19日在荆门市第一人民医院确诊的11例儿童Delta变异株COVID-19病例的流行病学特点和临床特征,希望能对儿童Delta变异株COVID-19的诊断和治疗提供一些参考。
1. 资料与方法
1.1. 资料
回顾性选取2021年8月6日至2021年9月19日在荆门市第一人民医院确诊Delta变异株COVID‐19和2020年2月1日至2020年3月10日在荆门地区确诊COVID-19的14岁以下儿童16例为研究对象。COVID-19的诊断标准参考《新型冠状病毒肺炎诊疗方案(试行第八版修订版)》[3]。其中Delta变异株COVID-19患儿11例(变异组),包括男5例,女6例,年龄1岁4个月至10岁1个月,平均年龄(5.7±4.3)岁;COVID-19患儿5例(普通组),包括男2例,女3例,年龄9个月至8岁4个月,平均年龄(4.6±3.8)岁。所有患儿均无基础性疾病。
1.2. 研究方法
分析两组患儿流行病学及临床特征,包括发热、咳嗽、鼻塞、流涕、咽痛、乏力、肌痛等,并进行血常规、乳酸脱氢酶(lactate dehydrogenase,LDH)、肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)、D-二聚体(D-Dimer,D-D)、C-反应蛋白(C-reactive protein,CRP)、白细胞介素-6(interleukin-6,IL-6)、新型冠状病毒抗体检查;对变异组与普通组数据进行统计学分析。
1.3. 统计学分析
采用SPSS 22.0软件对数据进行分析,计量资料以均数±标准差( )表示,两组间比较采用两样本t检验;计数资料以例数和百分率(%)表示,两组间比较采用Fisher确切概率法。P<0.05为差异有统计学意义。
2. 结果
2.1. 流行病学资料
荆门地区2021年8月份疫情中,有58例确诊,其中11例儿童(19%),均属武汉沌口工地同一传播链,已被病毒基因测序证实是新型冠状病毒Delta变异株,其中2例无症状,2例轻型,7例普通型。4例患儿家属没有发病,但同小区有确诊人员存在,具体接触史不清;另7例均属于家庭聚集发病。这些儿童均是在核酸筛查过程中查出阳性,有1例9岁女孩,在结束14 d酒店隔离期后,居家隔离2 d后才查出核酸阳性。2020年2月份疫情中,荆门地区共有872例确诊病例,其中5例儿童(0.6%),均为普通型,都属于家庭聚集发病。
2.2. 临床症状
患儿发热、咳嗽、鼻塞及流涕、咽痛、乏力及肌肉酸痛等临床症状发生比例在两组间比较差异均无统计学意义(P>0.05),见表1。
表1.
变异组和普通组患儿的临床症状比较 [例(%)]
| 组别 | n | 发热 | 咳嗽 | 鼻塞及流涕 | 咽痛 | 乏力及肌肉酸痛 |
|---|---|---|---|---|---|---|
| P值 | 0.431 | 0.062 | 0.346 | 0.253 | 0.253 | |
| 普通组 | 5 | 4(80) | 4(80) | 1(20) | 1(20) | 1(20) |
| 变异组 | 11 | 8(73) | 6(55) | 3(27) | 2(18) | 2(18) |
2.3. 实验室检查
两组患儿白细胞计数、淋巴细胞计数、血小板计数、中性粒细胞计数均是选择谷值(多次测量的最小值)进行比较。白细胞计数、淋巴细胞计数和血小板计数在两组间比较差异无统计学意义(P>0.05)。变异组患儿中性粒细胞计数低于普通组(P<0.05)(表2)。两组患儿均没有出现淋巴细胞减少的病例,但变异组有2例发热时间相对长的幼儿出现中性粒细胞缺乏。
表2.
两组患儿白细胞、淋巴细胞、血小板、中性粒细胞计数比较 ( ,×109/L)
| 组别 | n | 白细胞计数 | 淋巴细胞计数 | 血小板计数 | 中性粒细胞计数 |
|---|---|---|---|---|---|
| 普通组 | 5 | 5.3±3.1 | 3.5±1.8 | 202±114 | 3.1±1.3 |
| 变异组 | 11 | 5.5±2.7 | 3.2±2.0 | 190±103 | 1.3±1.0 |
| t值 | -0.131 | 0.286 | 0.209 | 3.050 | |
| P值 | 0.357 | 0.146 | 0.178 | 0.016 |
变异组患儿CK-MB增高比例较普通组患儿多见(P<0.05);而LDH、D-D、CRP、IL-6增高比例与普通组比较差异无统计学意义(P>0.05)。见表3。
表3.
两组患儿LDH、CK-MB、D-D、CRP、IL-6增高比例比较 [例(%)]
| 组别 | n | LDH | CK-MB | D-D | CRP | IL-6 |
|---|---|---|---|---|---|---|
| P值 | 0.086 | 0.028 | 0.247 | 0.236 | 0.092 | |
| 普通组 | 5 | 4(80) | 1(20) | 3(60) | 1(20) | 2(40) |
| 变异组 | 11 | 7(64) | 8(73) | 6(55) | 2(18) | 3(27) |
注:[LDH]乳酸脱氢酶;[CK-MB]肌酸激酶同工酶;[D-D]D-二聚体;[CRP]C-反应蛋白;[IL-6]白细胞介素-6。
2.4. 变异组患儿新型冠状病毒抗体水平变化
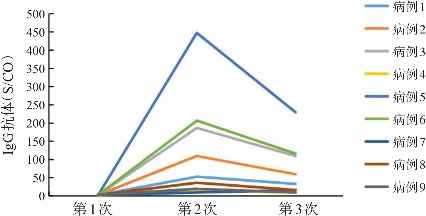
因荆门去年疫情发生时,资源紧张,早期许多病人无法检测新型冠状病毒抗体水平,故普通组没有抗体结果。变异组有9例患儿病程中查了3次新型冠状病毒抗体。其IgM和IgG抗体水平见图1和2。9例患儿入院时(第1次)查新型冠状病毒IgM和IgG抗体均为阴性,入院第2周(第2次)检出5例IgM抗体阳性(≥1.0 S/CO);从入院第2周开始所有患儿检出IgG抗体呈阳性(≥1.0 S/CO)。9例患儿入院第3周(第3次)IgM抗体水平均呈下降趋势;除了有1例患儿第3周IgG抗体水平稍有增高以外,8例患儿第3周IgG抗体水平呈下降趋势。
图1. 9例变异组患儿IgM抗体水平变化 第1次检测时间为入院时,第2次检测时间为入院后(9.6±1.3)d,第3次检测时间为入院后(17.4±2.1)d。.

图2. 9例变异组患儿IgG抗体水平变化 第1次检测时间为入院时,第2次检测时间为入院后(9.6±1.3)d,第3次检测时间为入院后(17.4±2.1)d。.
3. 讨论
新型冠状病毒是单股正链RNA病毒,该病毒基因组约由29 903个核苷酸构成,编码4种结构蛋白:核蛋白、包膜、基质蛋白、刺突蛋白,以及RNA依赖性RNA聚合酶[3-4]。新型冠状病毒变异可以影响病毒与人体细胞的亲和力,改变病毒的传染性和致病性。随着病毒变异的发生,截至2021年7月15日,已在超过99个国家流行[5-6]。我国虽然一直采取严格防控措施,但Delta变异株从境外输入,仍出现了短时区域性流行。
随着新型冠状病毒疫苗研制并在世界范围内逐步广泛应用,未接种疫苗的儿童和青少年人群病例的增加值得关注。本研究中,在荆门地区Delta变异株疫情中,儿童病例发生率为19%,而去年疫情儿童病例发生率仅为0.6%,并且这些儿童发病多以家庭聚集发病为主。Delta变异株关键突变在L452R、T478K和P681R,其中T478K位于S蛋白与血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE2)受体的相互作用域内,该突变可能会影响病毒与人类细胞的亲和性,造成传染性增强[7]。所以,加强家庭内部防护措施,避免高风险人员与儿童的密切接触、及时隔离高风险人员等,对预防儿童病例的增加可起到积极作用。
本研究中,变异组和普通组在临床症状方面,差异并无统计学意义。这也说明Delta变异株引起的临床症状与普通COVID-19并没有明显改变。两组病例中均没有淋巴细胞减少病例,与文献报道COVID-19感染患者多以淋巴细胞减少的病毒感染血常规特征不同[8-9]。但Guan等[10]研究提出淋巴细胞计数降低与COVID-19严重感染有相关性。本研究中两组病例没有淋巴细胞减少可能与病情相对较轻有关,也可能与儿童天然免疫发育不完善有关,其相关机制仍值得深入研究。变异组中有2例发热时间相对长的幼儿出现中性粒细胞缺乏,在病毒感染的急性期,大多数病毒可引起一过性中性粒细胞减少症[11]。而儿童Delta变异株病例出现中性粒细胞缺乏是不是发热时间的高危因素,还需要更多病例研究。
本研究结果显示,变异组儿童CK-MB增高比例较普通组儿童多见,差异有统计学意义。而两组LDH、D-D、CRP、IL-6增高比例差异均无统计学意义。心脏是病毒性肺炎最常受损的肺外脏器,尤其是婴幼儿的心肌更易损伤[12]。而Delta变异株其中的关键突变之一L452R残基位于S蛋白RBD的疏水结构中,该突变不直接接触ACE2受体,但可导致RBD结构变化,可稳定S蛋白与人体ACE2受体之间的相互作用,增强病毒感染性[13]。这也提示Delta变异株对心肌的损害可能高于普通COVID-19,与本研究的结果是相符的。
多项研究发现,部分新型冠状病毒感染者发病后第2周,特异性IgM抗体水平上升达到峰值状态,阳性率增加至59.7%~86.7%;自发病后第3或4周开始,特异性IgM抗体水平开始下降[14-16]。本研究中,变异组在第2周新型冠状病毒IgM抗体水平为峰值,但只有56%(5/9)儿童阳性,从第3周IgM抗体水平开始下降,这与其他研究是相符的。而罗效梅等[17]检测101例COVID-19患者,发现在发病后8 d IgM抗体阳性率最高,28 d后IgM开始下降,而IgG抗体阳性率随着病程延长逐渐升高,IgM总体呈现先升后降,IgG呈现持续上升的变化趋势。但也有研究显示,新型冠状病毒感染确诊病例的IgG抗体几乎与IgM抗体同时产生[14]。本研究结果显示,变异组IgG抗体出现时间基本与IgM抗体相同,而且9例儿童全部产生IgG抗体,峰值基本在第2~3周。
综上,本研究显示,Delta变异株传染性增强,儿童多为家庭聚集发病,需加强家庭内部防护措施,避免高风险人员与儿童的密切接触。儿童感染COVID-19很少出现淋巴细胞减少,与成人不符。Delta变异株感染性增强,对儿童心肌的损害高于普通COVID-19。儿童感染Delta变异株后IgG抗体出现时间与IgM抗体基本相同,第2周IgM抗体水平为峰值,IgG抗体峰值在第2~3周。由于本文儿童病例样本量少,对儿童Delta变异株COVID-19的流行病学及临床特征等描述存在一定的局限性,今后需要开展更为深入及大样本的研究。
参考文献
- 1. Yang Y, Lu QB, Liu MJ, et al. Epidemiological and clinical features of the 2019 novel coronavirus outbreak in China[J].medRxiv, 2020. DOI: 10.1101/2020.02.10.20021675. [DOI] [Google Scholar]
- 2. Munster VJ, Koopmans M, van Doremalen N, et al. A novel coronavirus emerging in China—key questions for impact assessment[J].N Engl J Med, 2020, 382(8): 692-694. DOI: 10.1056/NEJMp2000929. [DOI] [PubMed] [Google Scholar]
- 3. 中华人民共和国国家卫生健康委员会 . 新型冠状病毒肺炎诊疗方案(试行第八版修订版)[J].中华临床感染病杂志, 2021, 14(2): 81-88. DOI: 10.3760/cma.j.issn.1674-2397.2021.02.001. [DOI] [Google Scholar]
- 4. Wu F, Zhao S, Yu B, et al. A new coronavirus associated with human respiratory disease in China[J].Nature, 2020, 579(7798): 265-269. DOI: 10.1038/s41586-020-2008-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. PANGO Lineages. Latest epidemiological lineages of SARS-CoV-2[EB/OL]. [2021-07-16].https://cov-lineages.org/global_report.html.
- 6. Outbreak . info. B.1. 617. 2 lineage report[EB/OL]. [2021-07-27]. https://outbreak.info/situation-reports?pango=B.1.617.2. [Google Scholar]
- 7. Di Giacomo S, Mercatelli D, Rakhimov A, et al. Preliminary report on severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) spike mutation T478K[J].J Med Virol, 2021, 93(9): 5638-5643. DOI: 10.1002/jmv.27062. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. Chan JFW, Yuan SF, Kok KH, et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster[J].Lancet, 2020, 395(10223): 514-523. DOI: 10.1016/S0140-6736(20)30154-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Huang CL, Wang YM, Li XW, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J].Lancet, 2020, 395(10223): 497-506. DOI: 10.1016/S0140-6736(20)30183-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Guan WJ, Ni ZY, Hu Y, et al. Clinical characteristics of coronavirus disease 2019 in China[J].N Engl J Med, 2020, 382(18): 1708-1720. DOI: 10.1056/NEJMoa2002032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. 师晓东, 罗丹青. 儿童中性粒细胞减少症的最新分类与治疗进展[J].中华实用儿科临床杂志, 2018, 33(3): 173-176. DOI: 10.3760/cma.j.issn.2095-428X.2018.03.004. [DOI] [Google Scholar]
- 12. 代艳, 唐宁宁, 徐帆, 等. 广西儿童新型冠状病毒肺炎11例临床分析[J].中国临床新医学, 2020, 13(11): 1149-1152. DOI: 10.3969/j.issn.1674-3806.2020.11.18. [DOI] [Google Scholar]
- 13. McCallum M, Bassi J, Marco AD, et al. SARS-CoV-2 immune evasion by variant B.1.427/B.1.429[J].bioRxiv, 2021. DOI: 10.1101/2021.03.31.437925. Epub ahead of printDOI: 10.1101/2021.03.31.437925. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Guo L, Ren LL, Yang SY, et al. Profiling early humoral response to diagnose novel coronavirus disease (COVID-19)[J].Clin Infect Dis, 2020, 71(15): 778-785. DOI: 10.1093/cid/ciaa310. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. Lou B, Li TD, Zheng SF, et al. Serology characteristics of SARS-CoV-2 infection after exposure and post-symptom onset[J].Eur Respir J, 2020, 56(2): 2000763. DOI: 10.1183/13993003.00763-2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Zhao JJ, Yuan Q, Wang HY, et al. Antibody responses to SARS-CoV-2 in patients with novel coronavirus disease 2019[J].Clin Infect Dis, 2020, 71(16): 2027-2034. DOI: 10.1093/cid/ciaa344. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. 罗效梅, 王静, 张娅, 等. 全血SARS-CoV-2特异性抗体检测对2019-冠状病毒病的临床应用价值分析[J].西南大学学报(自然科学版), 2020, 42(3): 30-34. DOI: 10.13718/j.cnki.xdzk.2020.03.005. [DOI] [Google Scholar]


