Abstract
睾丸横纹肌肉瘤较为罕见,本文回顾性分析北京大学第三医院自1994年5月至2019年2月收治的4例睾丸横纹肌肉瘤的患者资料,主要治疗方案为睾丸根治性切除联合腹膜后淋巴结清扫,根据情况行术后辅助化疗。4例睾丸横纹肌肉瘤患者平均年龄17.5岁(14~21岁),平均住院时间22.0 d(17~31 d),平均体重指数19.6 kg/m2(14.7~25.8 kg/m2),平均肿瘤最大径为10.0 cm(4.5~15.0 cm)。中位血清绒毛膜促性腺激素(chorionic gonadotropin,HCG)0.20 IU/L(0.06~0.86 IU/L),中位血清甲胎蛋白(alpha-fetoprotein,AFP)1.03 g/L(0.65~1.66 g/L),均为正常。睾丸横纹肌肉瘤患者预后较差,多数在两年内复发。推荐行睾丸根治性切除合并腹膜后淋巴结清扫,腹膜后淋巴结转移是重要的预后不良因素,术后辅助化疗的患者可获得较长生存时间。
Keywords: 睾丸肿瘤, 横纹肌肉瘤, 睾丸切除术, 淋巴结切除术
Abstract
Testicular rhabdomyosarcoma is relatively rare in testicular tumors, but the age of patient is relatively young and the degree of malignancy is high. Therefore, this article introduces 4 cases of testicular rhabdomyosarcoma who were admitted to Peking University Third Hospital from May 1994 to February 2019, and reviews the literature to improve the diagnosis and treatment of this disease. The average age of the 4 patients was 17.5 years (14-21 years), the average hospital stay was 22.0 d (17-31 d), and the average body mass index was 19.6 kg/m2 (14.7-25.8 kg/m2). All the patients underwent routine preoperative blood and urine routine, biochemical tests, as well as serum tumor markers. Preoperative examinations also included chest radiograph, electrocardiogram, ultrasound of the scrotum and groin, and abdominal enhanced CT. Lung CT or other examinations were performed if necessary. The median serum human chorionic gonadotropin (HCG) of the 4 patients was 0.20 IU/L (0.06-0.86 IU/L) (all normal), and the median serum alpha-fetoprotein (AFP) was 1.03 g/L (0.65-1.66 g/L) (all normal). The average maximum diameter of the tumor was 10.0 cm (4.5-15.0 cm). Testicular rhabdomyosarcoma was mainly diagnosed by pathology. The main treatment was radical orchiectomy combined with retroperitoneal lymph node dissection, with or without postoperative adjuvant chemotherapy. The clinical manifestations of the patients with testicular rhabdomyosarcoma had no specific characteristics, but most patients were young at onset with mainly painless masses in the testicles, which were already large when they were found. Patients with testicular rhabdomyosarcoma have a poor prognosis, most of whom recur within two years. Because of the small number of cases of testicular rhabdomyosarcoma, there is no standard treatment currently. It is recommended that patients with testicular rhabdomyosarcoma undergo radical testicular resection combined with retroperitoneal lymph node dissection. Retroperitoneal lymph node metastasis is an important prognostic factor, and patients with postoperative adjuvant chemotherapy can still survive for a longer time. If local recurrence or limited metastasis is found after operation, local resection and salvage radiotherapy are feasible.
Keywords: Testicular neoplasms, Rhabdomyosarcoma, Orchiectomy, Lymph node excision
睾丸肿瘤在我国发病率为1/10万左右,占男性全部恶性肿瘤的1%~2%,占泌尿系统恶性肿瘤的3%~9%[1],列在15~34岁男性全部恶性肿瘤发病率之首[2]。目前睾丸肿瘤的治愈率高达97%,其主要取决于早期发现和综合治疗[3]。睾丸横纹肌肉瘤在睾丸肿瘤中较为罕见[4-5],国内外文献中多为个案报道,其发病年龄偏小且恶性度很高[6-9]。本文介绍4例睾丸横纹肌肉瘤并进行文献复习,以提高对该病的认识和诊疗水平。
1. 资料与方法
1.1. 一般资料
回顾性分析北京大学第三医院1994年5月至2019年2月收治的4例病理诊断为睾丸横纹肌肉瘤的患者临床资料,并对其进行门诊或电话随访,随访终点为2020年7月。
1.2. 术前准备
所有患者均行术前血/尿常规、生化检验及肿瘤标志物筛查,包括人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)、甲胎蛋白(alpha-fetoprotein,AFP)和乳酸脱氢酶(lactic dehydrogenase,LDH)等;术前检查包括胸部X线片、心电图、阴囊和腹股沟超声、腹盆腔增强CT,必要时行肺CT等检查。
1.3. 手术方法
1.3.1. 睾丸根治性切除
椎管内麻醉后,常规消毒铺巾。取腹股沟内环口到外环口连线切口,因睾丸及肿瘤体积较大,向阴囊侧延长3~5 cm以防止肿瘤拉出时因挤压而破裂。切开皮肤及腹外斜肌腱膜后,注意勿损伤髂腹股沟神经和髂腹下神经。将腹内斜肌用拉勾拉开,找到精索并游离至内环口,于腹股沟内环口水平(尽量高位)分束缝扎精索血管、输精管及其他组织,必要时双重结扎。逐渐将阴囊内容物拉出切口,切断睾丸引带血管后完整取出标本,如果肿瘤侵犯阴囊皮肤则需一并切除。严密止血后,将腹内斜肌与联合肌腱间断缝合在腹股沟韧带上以加强腹股沟前壁。留置橡皮引流条,逐层关闭切口。
1.3.2. 腹腔镜腹膜后淋巴结清扫术
取侧卧位,适当倾斜与手术床呈60°左右。取3个穿刺点:脐旁2 cm置入11 mm穿刺器,髂前上棘上方3~5 cm置入13 mm穿刺器,腋中线肋缘下3~5 cm置入5 mm穿刺器。沿Toltd线打开后腹膜,向下越过髂血管分叉,向上左侧切断脾结肠韧带,右侧切断肝结肠韧带,将结肠游离至腹中线。沿肾下极水平找到输尿管并游离,上至肾门,下至跨越髂血管,找到生殖腺静脉并将内环口以下的精索残端切除,游离肾动静脉,清除肾静脉下方淋巴结组织,沿肾静脉向内侧游离腔静脉和主动脉,并将两者中间及腹主动脉前方的淋巴结组织切除。再从下腔静脉分离至脊柱之间的淋巴结,最后将髂总动脉向下至髂外动脉的髂总旁淋巴结组织清除。两侧清扫范围略有不同,右侧清扫的范围是上达右肾静脉上缘,下达同侧髂血管分叉处的髂动脉外侧,右侧达输尿管内侧缘,左侧达腹主动脉前中部,至肾下极稍下方水平;左侧清扫的范围是上达左肾静脉上缘,下达左髂总动脉下段,左侧至输尿管内侧缘,右侧达腔静脉前方,至肾下极稍下方水平,以及肠系膜下动脉以下的腹主动脉、髂总动脉前外侧。常规留置腹腔引流管一根。
1.4. 统计学方法
采用SPSS 20.0统计软件进行分析,正态分布计量资料用平均数(最小值~最大值)表示,非正态分布计量资料均采用中位数(最小值~最大值)表示。
2. 结果
2.1. 一般情况
4例睾丸横纹肌肉瘤患者平均年龄为17.5岁(14~21岁),平均住院时间22.0 d(17~31 d),平均体重指数19.6 kg/m2(14.67~25.83 kg/m2),肿瘤平均最大径10.0 cm(4.5~15.0 cm)。中位血清HCG为0.20 IU/L(0.06~0.86 IU/L),中位血清AFP为1.03 μg/L(0.65~1.66 μg/L),均为正常。
2.2. 各病例具体情况
病例1为19岁男性。2001年5月行经腹股沟切口右侧睾丸根治术,病理结果提示睾丸胚胎型横纹肌肉瘤,免疫组织化学染色显示结蛋白(desmin)(++),肿瘤侵及附睾、精索及阴茎根部。电话回访得知,患者术后于当地未行常规复查,3年后死亡。
病例2为16岁男性,2002年3月行经腹股沟切口右侧睾丸根治术,病理提示睾丸多形型横纹肌肉瘤,未侵及白膜。免疫组织化学染色显示:结蛋白(+++)、波形蛋白(vimentin)(±)。术后11个月于当地医院复查超声发现阴囊内花生大小肿块,予以完整切除后确认为复发,术后于当地常规检查,长期存活。
病例3为14岁男性,2013年6月行经腹股沟切口左侧睾丸根治术,病理提示睾丸胚胎型横纹肌肉瘤,免疫组织化学染色显示:结蛋白(部分+)、肌红蛋白(myoglobin)(少数弱+)、肌细胞生成素(myogenin)(部分+)。于左侧睾丸根治术后3周行腹腔镜左侧腹膜后淋巴结清扫术,术后病理结果显示各组淋巴结情况如下:左腔静脉和主动脉之间见淋巴结1枚,左主动脉旁见淋巴结7枚,左髂总静脉旁见淋巴结1枚,其内均未见肿瘤累及;精索断端也未见肿瘤累及。根治术后3个月于外院行一个周期化疗(环磷酰胺:750 mg/m2;阿霉素:50 mg/m2;长春新碱:1.4 mg/m2),因胃肠道副反应大而自行放弃进一步化疗。术后常规复查:于左侧睾丸根治术后17个月发现左阴囊内肿物及皮肤肿物,行肿物局部切除,提示横纹肌肉瘤复发;于左侧睾丸根治术后41个月发现左髂窝肿物,肿物切除后提示横纹肌肉瘤复发;于左侧睾丸根治术后52个月发现腹腔内肿物,行增强CT提示腹腔内转移瘤合并出血,病变较前明显进展,周围结构受累,考虑腹腔广泛转移,腹盆腔积液、积血。患者及家属放弃进一步治疗后在当地医院予以对症支持营养治疗,最终于睾丸根治性切除术后55个月死于全身肿瘤转移。
病例4为21岁男性,2015年5月行经腹股沟切口左侧睾丸根治术,病理提示睾丸腺泡状横纹肌肉瘤,未侵及白膜。免疫组织化学显示:结蛋白(+)、MyoD1(+)、肌细胞生成素(+)、CD99(+)、B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)(少数+)。睾丸根治术后27 d行腹腔镜左侧腹膜后淋巴结清扫术,术后病理结果提示各组淋巴结情况如下:主动脉前见淋巴结2枚,其内未见肿瘤累及;腹主动脉旁见淋巴结12枚,其内未见肿瘤累及;主动脉旁送检为结缔组织,未见淋巴结;精索断端未见肿瘤累及。患者于睾丸根治术后2个月开始进行化疗,化疗方案如下:表阿霉素100 mg、异环磷酰胺12 g、美司钠12 g,每21天为一个周期。4周期后患者于当地开始每半年复查一次,至今未见肿瘤复发。
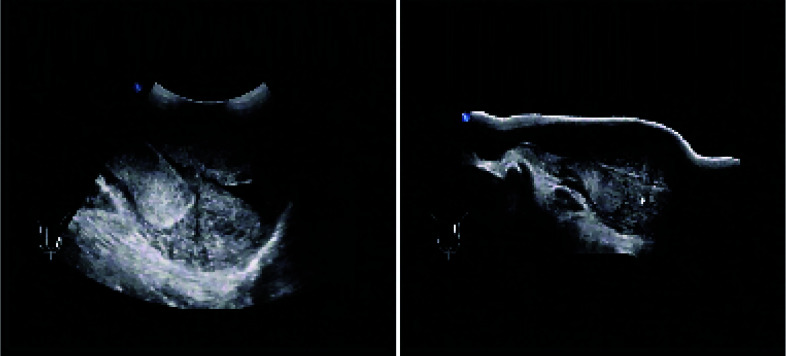
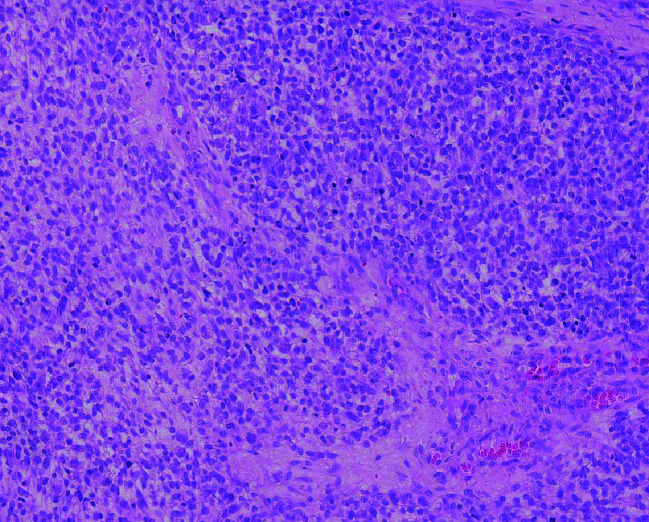
各病例的基本资料和围术期情况见表 1,超声和病理表现见图 1和图 2。
表 1.
睾丸横纹肌肉瘤患者的基本资料
Basic data of the patients of testicular rhabdomyosarcoma
| Items | Case 1 | Case 2 | Case 3 | Case 4 |
| BMI, body mass index; HCG, human chorionic gonadotropin; AFP, alpha-fetoprotein; LDH, lactic dehydrogenase; RPLND, retroperitoneal lymph node dissection. | ||||
| Basic data | ||||
| Age/years | 19 | 16 | 14 | 21 |
| Hospital stay/d | 21 | 17 | 31 | 19 |
| BMI/(kg/m2) | 22.03 | 16.02 | 25.83 | 14.67 |
| Side | Right | Right | Left | Left |
| Chief complain | Palpable mass in the right scrotum for 1 month | Palpable mass in the right scrotum for 6 months | Painful mass in the left testis for 2 months | Palpable mass in the left scrotum for 2 weeks |
| Perioperative data | ||||
| HCG/(IU/L) | 0.2 | 0.86 | 0.06 | |
| AFP/(μg/L) | 0.65 | 0.76 | 1.30 | 1.65 |
| LDH/(U/L) | NA | NA | 0.68 | 146.00 |
| Maximum dialater/cm | 10.0 | 15.0 | 10.5 | 4.5 |
| Approach | Inguinal | Inguinal | Inguinal | Inguinal |
| Surgery | Radical orchiectomy | Radical orchiectomy | Radical orchiectomy | Radical orchiectomy |
| RPLND | No | No | Yes | Yes |
| Follow-up | Died 3 years later | Relapse after 11 months | Relapse twice after 17 months and 41 months | Alive without relapse |
图 1.
睾丸横纹肌肉瘤的超声表现
Ultrasonography of testicular rhabdomyosarcoma
图 2.
睾丸横纹肌肉瘤的病理表现(HE ×200)
Pathology of testicular rhabdomyosarcoma(HE ×200)
3. 讨论
睾丸横纹肌肉瘤相对罕见,约占睾丸肿瘤的1%~3%[6-9],本组病例中睾丸横纹肌肉瘤占同期本单位收治的睾丸肿瘤患者的2.4%。睾丸横纹肌肉瘤的起源仍不太清楚,可能与畸胎瘤或睾丸样原始生殖细胞的过度生长有关[7, 10],也可能起源于组织发生早期移位的胚胎性肌组织。
睾丸横纹肌肉瘤患者的临床表现无特异性特征,但大多数患者发病年龄偏小,主要为睾丸无痛性肿块,肿块发现时已经较大,平均直径可达10 cm左右[9, 11]。触诊时应同时检查睾丸和双侧腹股沟区,超声是判断阴囊及腹股沟区淋巴结是否侵犯的首选方法,其在超声下表现为形状不规则、边界模糊、较大的无回声或低回声肿物,患者的AFP、HCG和LDH等血清肿瘤标记物一般不升高[9, 11],需行腹盆腔的增强CT扫描以明确有无腹膜后淋巴结的肿大。传统诊断方法难以准确地对睾丸横纹肌肉瘤进行术前诊断,明确的诊断取决于术后病理检查,同时大体标本及显微镜下的观察是确定肿瘤起源的关键[12]。免疫组织化学染色是睾丸横纹肌肉瘤的最佳诊断方法,通常会出现一种或多种肌肉特异性标记阳性:如结蛋白、肌肉特异性肌动蛋白(muscle-specific actin)、肌红蛋白或肌细胞生成素等[13-14]。本组患者平均年龄17.5岁,基本为无痛性睾丸肿物,超声可见边界模糊的较大的无回声或低回声肿物,平均直径为10.0 cm,肿瘤标记物均未见升高,与文献报道相符。
明确睾丸横纹肌肉瘤主要依靠病理诊断[13-14],一般分为胚胎型、腺泡型、多形型和梭形细胞型,睾丸内以胚胎型多见。病理大体可见肿瘤切面呈灰白色,质地偏软,可呈鱼肉样,一般较少坏死。镜下肿瘤细胞形态与其分化程度密切相关:分化较原始的肿瘤细胞大小更为一致,细胞胞质较少,核小,核分裂象多见;分化较好的肿瘤细胞与横纹肌母细胞类似,大小形态多种多样,具有丰富的胞质,核分裂象多见[15]。本组患者术后病理均提示为睾丸横纹肌肉瘤,2例为胚胎型横纹肌肉瘤,1例为多形型横纹肌肉瘤,1例为腺泡型横纹肌肉瘤。
因为睾丸横纹肌肉瘤病例数少,目前尚无标准治疗方式[13],可参考国际横纹肌肉瘤研究小组(intergroup rhabdomyosarcoma study group,IRSG)根据其病理学界限和淋巴结转移状况推荐的针对性的治疗方法[16]。首先,经腹股沟区睾丸根治性切除术是基础治疗,需要注意的是务必高于内环口高位断扎精索。对于影像学提示有腹膜后淋巴结明显肿大的患者推荐行腹膜后淋巴结清扫,但对于影像学检查未见腹膜后淋巴结肿大的患者是否推荐行腹膜后淋巴结清扫仍存在一定争议。有研究报道,对于接受根治性睾丸切除术的腹膜后淋巴结未见肿大患者进行化疗,只有16.7%发生了局部复发[15]。相反,也有学者发现睾丸横纹肌肉瘤患者的CT扫描通常会低估局部肿瘤的腹膜后转移,因此,影像学阴性的青少年患者仍应接受腹膜后淋巴结清扫,以进一步评估淋巴结受累情况并指导后续治疗[17]。IRSG建议将辅助化疗作为睾丸横纹肌肉瘤患者的标准治疗方法,临床上常用的化疗方案为VAC方案(长春新碱、表柔比星和环磷酰胺)[11],还可根据IRSG分类选择特定的化疗方案。放疗的适应症较少,一般仅对于具有残留肿瘤组织和/或转移部位的患者进行放疗,如果术后局部复发或局限转移可行局部再次切除合并补救性放疗[4]。
睾丸横纹肌肉瘤的预后较差,与阴囊内横纹肌肉瘤类似[4],1年总生存率为68%,5年总生存率为30%[18]。腹膜后淋巴结转移是重要的预后因素,没有腹膜后淋巴结转移的患者的5年无病生存率为97%,而有转移的患者为42%[17, 19]。
综上所述,睾丸横纹肌肉瘤患者预后较差,推荐行睾丸根治性切除,根据情况选择腹膜后淋巴结清扫,术后辅助化疗可以延长患者生存时间。
Funding Statement
北大医学青年科技创新培育基金(BMU2018PYB008)和北京大学第三医院临床重点项目(BYSY2018047)
Supported by the Peking University Medicine Fund of Fostering Young Scholars' Scientific & Technological Innovation (BMU2018PYB008) and the Key Clinical Projects of Peking University Third Hospital (BYSY2018047)
References
- 1.黄 健, 王 建业, 孔 垂泽, et al. 中国泌尿外科和男科疾病诊断治疗指南. 北京: 科学出版社; 2020. p. 145. [Google Scholar]
- 2.Motzer RJ, Jonasch E, Agarwal N, et al. Testicular cancer, version 2.2015. J Natl Compr Canc Netw. 2015;13(6):772–799. doi: 10.6004/jnccn.2015.0092. [DOI] [PubMed] [Google Scholar]
- 3.Albers P, Albrecht W, Algaba F, et al. Guidelines on testicular cancer: 2015 Update. Eur Urol. 2015;68(6):1054–1068. doi: 10.1016/j.eururo.2015.07.044. [DOI] [PubMed] [Google Scholar]
- 4.Yi J, Zhou DA, Huo JR, et al. Primary intratesticular rhabdomyosarcoma: A case report and literature review. Oncol Lett. 2016;11(2):1016–1020. doi: 10.3892/ol.2015.3987. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Lovric E, Hizak DB, Balja MP, et al. An unusual mixed germ cell tumor of the testis consisting of rhabdomyosarcoma, mature teratoma and yolk sac tumor. Asian J Androl. 2010;12(3):451–452. doi: 10.1038/aja.2010.2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Korski K, Breborowicz D, Filas V, et al. A case of primary testi-cular germ cell tumor with rhabdomyosarcoma metastases as an example of applying the FISH method to diagnostic pathology. APMIS. 2007;115(11):1296–1301. doi: 10.1111/j.1600-0643.2007.00582.x. [DOI] [PubMed] [Google Scholar]
- 7.Erbay ME, Tarhan F, Barisik NO, et al. A case of testicular rhabdomyosarcoma. Int Urol Nephrol. 2004;36(1):73–75. doi: 10.1023/B:UROL.0000032671.74121.d3. [DOI] [PubMed] [Google Scholar]
- 8.Gow KW, Murphy JR, Wu JK, et al. Metastatic testicular rhabdomyosarcoma: A report of two cases. J Pediatr Surg. 2003;38(8):E1–E3. doi: 10.1016/S0022-3468(03)00288-4. [DOI] [PubMed] [Google Scholar]
- 9.Liu ZW, Zhang XQ, Hou GL, et al. Primary adult intratesticular rhabdomyosarcoma: Results of the treatment of six cases. Int J Urol. 2011;18(2):171–174. doi: 10.1111/j.1442-2042.2010.02685.x. [DOI] [PubMed] [Google Scholar]
- 10.Banfield GK, Brookstein R. Rhabdomyosarcoma arising in teratoma of the testis. J R Army Med Corps. 1995;141(3):167–168. doi: 10.1136/jramc-141-03-07. [DOI] [PubMed] [Google Scholar]
- 11.Kelly B, Lundon D, Rowaiye B, et al. Embryonal rhabdomyosarcoma of the testis. Can Urol Assoc J. 2011;5(1):E7–E10. doi: 10.5489/cuaj.10047. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Nakagawa R, Aoyama S, Urata S, et al. Testicular rhabdomyosarcoma after chemotherapy for metastatic germ cell tumors. Int Cancer Conf J. 2019;8(4):175–180. doi: 10.1007/s13691-019-00378-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Ishiguro N, Motoi T, Osaki M, et al. Immunohistochemical analysis of a muscle ankyrin-repeat protein, Arpp, in paraffin-embedded tumors: Evaluation of Arpp as a tumor marker for rhabdomyosarcoma. Hum Pathol. 2005;36(6):620–625. doi: 10.1016/j.humpath.2005.04.014. [DOI] [PubMed] [Google Scholar]
- 14.Kumar S, Perlman E, Harris CA, et al. Myogenin is a specific marker for rhabdomyosarcoma: An immunohistochemical study in paraffin-embedded tissues. Mod Pathol. 2000;13(9):988–993. doi: 10.1038/modpathol.3880179. [DOI] [PubMed] [Google Scholar]
- 15.Walterhouse D, Watson A. Optimal management strategies for rhabdomyosarcoma in children. Paediatr Drugs. 2007;9(6):391–400. doi: 10.2165/00148581-200709060-00006. [DOI] [PubMed] [Google Scholar]
- 16.Breitfeld PP, Meyer WH. Rhabdomyosarcoma: New windows of opportunity. Oncologist. 2005;10(7):518–527. doi: 10.1634/theoncologist.10-7-518. [DOI] [PubMed] [Google Scholar]
- 17.Wiener ES, Anderson JR, Ojimba JI, et al. Controversies in the management of paratesticular rhabdomyosarcoma: Is staging retroperitoneal lymph node dissection necessary for adolescents with resected paratesticular rhabdomyosarcoma? Semin Pediatr Surg. 2001;10(3):146–152. doi: 10.1053/spsu.2001.24695. [DOI] [PubMed] [Google Scholar]
- 18.Urgun DA, Bista B, Krishnam M. Unusual presentation of testicular rhabdomyosarcoma metastases to the right ventricle papillary muscle and tricuspid valve. Radiol Case Rep. 2020;15(9):1562–1565. doi: 10.1016/j.radcr.2020.05.075. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Ferrari A, Casanova M, Massimino M, et al. The management of paratesticular rhabdomyosarcoma: A single institutional experience with 44 consecutive children. J Urol. 1998;159(3):1031–1034. doi: 10.1016/S0022-5347(01)63830-8. [DOI] [PubMed] [Google Scholar]