Abstract
目的
研究17β-雌二醇(E2)对髁突软骨细胞增殖调节的影响,并初步探讨磷酸化雷帕霉素哺乳动物靶标(p-mTOR)在该调节过程中发挥的作用。
方法
取6周龄雌性SD大鼠髁突软骨细胞进行原代培养,从第二代分别给予不同浓度的E2和/或雷帕霉素(RAPA);CCK8法检测不同给药条件下,髁突软骨细胞在第24、48、72小时的增殖情况;逆转录聚合酶链式反应(RT-PCR)检测软骨细胞中雌激素受体α(ERα)、雌激素受体β(ERβ)、自噬相关基因6(Beclin-1)、自噬相关基因5(ATG-5)、Ⅱ型胶原(COLⅡ)相关基因的表达;蛋白印迹(Western blot)法检测软骨细胞中ERα、ERβ、Beclin-1、脂质化轻链蛋白3B(LC3-Ⅱ)、p-mTOR相关蛋白的表达及加入雌激素受体拮抗剂后各组细胞p-mTOR的表达。
结果
E2可显著促进体外培养的髁突软骨细胞增殖,并在10−8 mol·L−1 浓度下达到峰值;RAPA可以显著抑制细胞增殖。10−8 mol·L−1 E2上调软骨细胞ERα、COLⅡ基因表达(P<0.01)和ERα、p-mTOR蛋白表达(P<0.05),下调软骨细胞Beclin-1、ATG-5基因表达(P<0.05)和Beclin-1、LC3-Ⅱ蛋白表达(P<0.05);RAPA可以上调细胞Beclin-1和LC3-Ⅱ蛋白水平(P<0.01),下调p-mTOR的表达(P<0.01);ERα拮抗剂可以显著降低细胞中p-mTOR的表达(P<0.01)。
结论
E2在浓度为10−8 mol·L−1时可有效通过ERα-p-mTOR途径激活mTOR的磷酸化,抑制自噬,提高髁突软骨细胞增殖速度。
Keywords: 颞下颌关节骨关节病, 17β-雌二醇, 雷帕霉素, 磷酸化雷帕霉素哺乳动物靶标, 髁突软骨细胞
Abstract
Objective
To study the effects of 17β-estradiol (E2) on the regulation of the proliferation of condylar chondrocytes and provide a preliminary discussion on the role of phosphorylate-mammalian target of rapamycin (p-mTOR) in this regulatory process.
Methods
Condylar chondrocytes were isolated from 6-week-old female rats for primary culture. Drug treatment with different concentrations of E2 and/or rapamycin (RAPA) was carried out on second-generation cells. Cell Counting Kit 8 was used to measure the cell viability of condylar chondrocytes after culture for 24, 48, or 72 h, and reverse transcription-polymerase chain reaction (RT-PCR) was applied to detect the relative gene expression of estrogen receptor alpha (ERα), estrogen receptor beta (ERβ), collagen type Ⅱ (COL Ⅱ), autophagy-related gene 6 (Beclin-1), and autophagy-related gene 5 (ATG-5). Western blot was employed to determine the relative protein expression of ERα, ERβ, Beclin-1, lipid-modified light chain 3B (LC3-Ⅱ), and p-mTOR.
Results
E2 could significantly promote the proliferation of chondrocytes cultured in vitro, and maximum promotion was achieved at a concentration of 10−8 mol·L−1. RAPA could significantly inhibit cell proliferation. E2 at aconcentration of 10−8 mol·L−1 could greatly improve the gene expression levels of ERα and COL Ⅱ (P<0.01) with the protein levels of ERα and p-mTOR (P<0.05), and decrease the gene expression levels of Beclin-1 and ATG-5 (P<0.05) with the protein levels of Beclin-1 and LC3-Ⅱ (P<0.05). RAPA could also enhance the relative protein expression of Beclin-1 and LC3-Ⅱ (P<0.01), and reduce the expression of p-mTOR (P<0.01). Treatment with the ERα antagonist significantly reduced the expression of p-mTOR in cells (P<0.01).
Conclusion
At a concentration of 10−8 mol·L−1, E2 could effectively activate the phosphorylation of mTOR through the ERα-p-mTOR pathway, inhibit cell autophagy, and promote the proliferation of condylar chondrocytes.
Keywords: temporomandibular joint osteoarthritis, 17β-estradiol, rapamycin, phosphorylated-mammalian target of rapamycin, condylar chondrocyte
颞下颌关节骨关节病(temporomandibular joint osteoarthritis,TMJOA)作为一种退行性关节疾病,其特征是软骨成分的退变以及软骨下骨的异常改建[1]。TMJOA的发病人群主要集中于女性,影像学表现为髁突表面磨损变平或变尖、骨赘形成、囊样变等,髁突表面软骨细胞死亡,软骨基质降解是造成TMJOA的重要原因之一[2]–[3]。
由于女性易患TMJOA,雌激素在TMJOA发生发展过程中的作用引起关注。在自然TMJOA模型中,17β-雌二醇(17β-estradiol,E2)的应用能有效缓解关节软骨退变,表明E2对关节软骨存在保护作用,然而该保护作用机制尚未明确[4]–[5]。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)广泛存在于各种细胞中,在细胞自噬活动中发挥重要调节作用。mTOR通过磷酸化能够活化并能有效抑制自噬关键标志物脂质化轻链蛋白3B(lipid modified of light chain 3B,LC3-Ⅱ)的形成,从而抑制细胞自噬。近期研究[6]表明,mTOR信号在细胞生长增殖过程中也起到重要作用。
雷帕霉素(rapamycin,RAPA)是一种自噬诱导剂,也是特异性mTOR抑制剂,可以抑制mTOR的磷酸化。研究[7]表明,颞下颌关节损伤模型中的软骨退变会伴有软骨内自噬水平的降低,而RAPA的应用可以特异性提高软骨内自噬水平,提高软骨细胞抗损伤能力并延缓关节软骨的退变进程。
本实验通过检测E2在不同条件下对髁突软骨细胞增殖及自噬相关指标的影响,来探讨E2影响髁突软骨细胞增殖能力的机制。
1. 材料和方法
1.1. 实验动物
6周龄雌性SD大鼠20只(北京斯贝福公司),动物使用符合我国关于动物保护管理委员会相关规定。
1.2. 主要试剂
总RNA快速提取试剂盒(Omega公司,美国),高效率逆转录试剂盒(Thermo公司,美国),SP-9000试剂盒(上海生工生物工程有限公司),无酚红培养基(天津可典生物科技有限公司),雌激素受体α(estrogen receptor alpha,ERα)单克隆抗体(Abcam公司,英国),β-actin单克隆抗体、雌激素受体β(estrogen receptor beta,ERβ)单克隆抗体、LC3-Ⅱ单克隆抗体(Proteintech公司,美国),E2、RAPA、ERβ拮抗剂PHTPP、ERα拮抗剂AZD9496(MCE公司,美国),磷酸化雷帕霉素哺乳动物靶标(phosphorylate-mammalian target of rapamycin,p-mTOR)单克隆抗体(CST公司,美国)。
1.3. 方法
1.3.1. 大鼠髁突软骨细胞的分离和培养
取大鼠髁突软骨,剪碎后于15 mL离心管中以0.25%胰酶消化30 min,终止消化后离心弃去上清液,以0.2%Ⅱ型胶原酶消化5 h后,接种到含20%胎牛血清和1%双抗的无酚红高糖DMEM培养基中,于37 °C,5%CO2细胞培养箱中培养,每3 d进行换液。后续实验以含10%胎牛血清和1%双抗的无酚红高糖DMEM培养基进行细胞培养。细胞传代使用胰蛋白酶消化贴壁细胞,DMEM终止消化并接种于培养皿中,次日换液。
1.3.2. 软骨细胞的观察和鉴定
运用倒置显微镜观察并分析各代髁突软骨细胞形态、胞间连接及胞膜表面是否出现细胞突起。取第3代细胞进行Ⅱ型胶原免疫细胞化学染色,取6孔板圆形空白细胞爬片置于100 mm培养皿中,设置3个重复板,滴加细胞悬液并没过爬片,放入细胞培养箱中培养过夜,待细胞贴壁后,以4%多聚甲醛固定20 min,PBS冲洗后于0.5% TritonX-100中室温孵育20 min,按照SP-9000试剂盒说明进行染色,并孵育Ⅱ型胶原一抗稀释液,于4 °C环境下过夜,次日依次加入生物素标记山羊抗兔IgG及辣根酶标记链霉卵白素工作液孵育,使用DAB/AEC显色液,室温孵育5~8 min后行复染,梯度乙醇脱水封片,显微镜下观察,判读,观察细胞胞浆染色变化,深染为阳性改变,如无深染则为阴性改变,对照组细胞使用成纤维细胞。
1.3.3. 髁突软骨细胞的实验分组
第一部分实验:E2对髁突软骨细胞增殖及自噬的影响。将第二代髁突软骨细胞分为4组:空白对照组(培养基中仅含等浓度DMSO)、10−6 mol·L−1 E2组(实验组1)、10−8 mol·L−1 E2组(实验组2)、10−10 mol·L−1 E2组(实验组3)。
第二部分实验:E2 及RAPA共同作用对髁突软骨细胞增殖及自噬的影响。将第二代髁突软骨细胞分为8组:空白对照组(培养基中仅含等浓度DMSO)、10−6 mol·L−1 E2组(实验组1)、10−8 mol·L−1 E2组(实验组2)、10−10 mol·L−1 E2组(实验组3)、10−9 mol·L−1 RAPA组(实验组4)、10−6 mol·L−1 E2+10−9 mol·L−1 RAPA组(实验组5)、10−8 mol·L−1 E2+10−9 mol·L−1 RAPA组(实验组6)、10−10 mol·L−1 E2+10−9 mol·L−1 RAPA组(实验组7)。
第三部分实验:E2、RAPA及ERα拮抗剂AZD9496或ERβ拮抗剂PHTPP共同作用对髁突软骨细胞p-mTOR表达的影响。将第二代髁突软骨细胞分为6组:空白对照组(培养基中仅含等浓度DMSO)、10−9 mol·L−1 RAPA组(实验组1)、10−8 mol·L−1 E2组(实验组2)、10−8 mol·L−1 E2+10−9 mol·L−1 RAPA组(实验组3)、10−8 mol·L−1 E2+10−6 mol·L−1 AZ-D9496组(实验组4)、10−8 mol·L−1 E2+10−6 mol·L−1 PHTPP组(实验组5)。
1.3.4. CCK8实验
第一部分实验和第二部分实验进行CCK8实验。取第二代髁突软骨细胞以每孔2×103个的密度进行铺板(96孔板),次日换液给药,分组按照上述第一部分和第二部分实验分组执行,每组设置6个复孔,实验重复3次;培养时间分为24、48、72 h。于各培养时间点换液后每孔加入10 µL CCK8溶液,置于37 °C,5%CO2培养箱中孵育2 h;处理结束后于全波长扫描酶标仪(BioTek公司,美国)在波长450 nm下测定各孔光密度(optical density,OD)值。
1.3.5. 逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)检测髁突软骨细胞自噬及增殖相关基因表达
第一部分实验进行RT-PCR实验。取第二代髁突软骨细胞以每孔2×104个的密度进行铺板(24孔板),次日换液给药,分组按照上述第一部分实验分组执行,每组设置3个复孔,实验重复3次;培养第48小时收集细胞。总RNA快速提取试剂盒提取细胞总RNA;高效率逆转录试剂盒进行细胞总RNA逆转录;2×SYBN Green qPCR Kit(上海生工生物工程有限公司)检测ERα、ERβ、Ⅱ型胶原(collagen type Ⅱ,COLⅡ)、自噬相关基因6(autophagy-related gene 6,ATG-6/Beclin-1)、自噬相关基因5(autophagy-related gene 5,ATG-5)基因表达水平;以β-actin作为内部参照基因,采用2−ΔΔCT法进行统计。本实验所采用的RT-PCR引物序列见表1。
表 1. 引物序列.
Tab 1 Primer sequences
| 目的基因 | 引物序列(5′-3′) |
| β-actin | F:TCAGGTTACTGGTTCGGTCTG |
| R:ACCAGAGGCATACAGGGACAG | |
| COLⅡ | F:CTCAAGTCGCTGAACAACCA |
| R:CAGTAGTCTCCGCTCTTCCA | |
| ERα | F:TCTGCCAAGGAGACTCGCTACT |
| R:GGTGCATTGGTTTGTAGCTGGAC | |
| ERβ | F:GGTCATGTGAAGGATGTAAGGC |
| R:TAACACTTGCGAAGTCGGCAGG | |
| Beclin-1 | F:CAGCCTCTGAAACTGGACACGA |
| R:CTCTCCTGAGTTAGCCTCTTCC | |
| ATG-5 | F:CTTGCATCAAGTTCAGCTCTTCC |
| R:AAGTGAGCCTCAACCGCATCCT |
1.3.6. 蛋白印迹(Western blot)检测髁突软骨细胞自噬及增殖相关蛋白表达
各部分实验均进行Western blot实验。取第二代髁突软骨细胞以每孔2×105个的密度进行铺板(6孔板),次日换液给药,分别按照以上对应实验部分进行分组,每组设置3个复孔,实验重复3次;第一部分实验于培养24、48、72 h后收集细胞;第二、三部分实验于培养48 h后收集细胞。RIPA裂解细胞提取蛋白;BCA法测定蛋白浓度;十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE)法分离蛋白;聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜转膜;5%牛奶室温封闭1 h后加入一抗液(ERα、ERβ、Beclin-1、LC3-Ⅱ、p-mTOR,1︰1 000稀释)于4 °C环境下孵育过夜;次日,TBST荡洗5次,随后加入二抗液(HRP标记的山羊抗兔IgG,3︰1 000稀释、HRP标记的山羊抗小鼠IgG,1︰1 000稀释)室温孵育2 h;TBST荡洗3次后采用电化学发光(electrochemiluminescence,ECL)液显影,Image-J分析条带灰度值,计算相对表达量。
1.4. 统计学处理
采用SPSS 22.0软件进行统计分析。计量资料以x±s表示,对所测结果进行正态性及方差齐性检验,组间比较采用t检验,多组间比较采用单因素方差分析。当P<0.05时认为实验数据差异有统计学意义。
2. 结果
2.1. 髁突软骨细胞的培养和鉴定
接种后,原代细胞表现为较小的三角形形态,散在分布;第一代到第三代软骨细胞表现为典型“铺石路”样,且生长较快,胞核明显,状态较好;第五代到第七代软骨细胞可见成纤维样细胞成分开始有所增加,但主体仍为软骨细胞,生长状态较好;第九代软骨细胞中,细胞形态全部转化为成纤维型,并有多个突起,增殖能力显著下降(图1A)。第三代软骨细胞Ⅱ型胶原免疫组织化学染色后,可见软骨细胞胞浆呈棕褐色改变,显示为阳性变化;非软骨细胞胞浆无深染,呈阴性变化(图1B)。
图 1. 髁突软骨细胞形态及其Ⅱ型胶原免疫组织化学染色.
Fig 1 The morphology and immunohistochemical staining of type Ⅱ collagen of condylar chondrocytes
A:髁突软骨细胞形态 光学显微镜 × 40;B:髁突软骨细胞(上)及成纤维细胞(下)形态 Ⅱ型胶原免疫组织化学染色 × 40。
2.2. 髁突软骨细胞在不同浓度E2作用下的增殖变化
不同E2浓度下,检测软骨细胞在给药后24、48、72 h的增殖水平(图2)。由图2可见,给予E2后,髁突软骨细胞的增殖速度显著加快,并存在明显的中间最优浓度及双向性作用,表现为在E2浓度为10−8 mol·L−1时,髁突软骨细胞增殖最快(P<0.05),而低于或高于该浓度会不同程度地降低E2对髁突软骨细胞增殖的促进作用。同时各组细胞数量均在第48小时达到顶峰,在第72小时达到平台期并发生下降。
图 2. E2对髁突软骨细胞增殖的影响.
Fig 2 The effect of E2 on the proliferation of condylar chondrocytes
2.3. E2对髁突软骨细胞增殖、自噬相关靶标表达的影响
RT-PCR结果显示在培养第48小时,各组细胞中ERα和ColⅡ的基因表达水平随E2浓度的增加而先升高后降低,呈现“倒V形”,并在浓度为10−8 mol·L−1时达到峰值(P<0.01),ERβ的基因水平则无明显变化。同时,Beclin-1和ATG-5的基因水平在低浓度E2处理组(10−10、10−8 mol·L−1)中显著低于对照组(P<0.05)(图3A~E)。
图 3. E2对髁突软骨细胞增殖、自噬相关靶标表达的影响.
Fig 3 The effects of E2 on the expression of targets related to proliferation and autophagy of condylar chondrocytes
A~E:分别为RT-PCR检测ATG-5、Beclin-1、ColⅡ、ERα、ERβ基因表达;F、G:Western blot检测结果,1~4分别为0、10−10、10−8、10−6 mol·L−1 E2。*与对照组相比,P<0.05。
Western blot实验结果与RT-PCR实验结果趋于相同,如图3F所示,在培养第48小时,与空白对照组相比,E2处理组中p-mTOR表达显著升高,Beclin-1和LC3-Ⅱ表达降低,其中p-mTOR蛋白在10−8 mol·L−1 E2组中表达量最高(P<0.05);同时,在10−8 mol·L−1 E2组中,ERα表达量达到最高(P<0.05),ERβ的表达则没有明显变化(P>0.05)。
10−8 mol·L−1 E2组在第24、48、72小时各蛋白表达量的表达结果见图3G。在第48小时,细胞中p-mTOR和ERα的表达量最高,高于第24、72小时相应蛋白表达量(P<0.05);在第72小时,相较于第24、48小时,细胞中Beclin-1、LC3-Ⅱ、ERβ的表达量明显升高,p-mTOR和ERα的水平显著下降(P<0.05)。
2.4. p-mTOR在E2促进髁突软骨细胞增殖中的作用
为验证E2对髁突软骨细胞增殖的促进作用是否涉及p-mTOR,实验中应用mTOR特异性抑制剂RAPA,结果见图4A~C,CCK8实验结果表明,用RAPA处理髁突软骨细胞后,在各培养时间点,细胞增殖水平均显著低于单纯E2组(P<0.05)。Western blot实验结果显示,RAPA能够抑制对照组和实验组细胞中p-mTOR的表达,促进Beclin-1和LC3-Ⅱ的表达(P<0.01),但对ERα和ERβ表达的影响不具有统计学意义(P>0.05)(图4D)。
图 4. RAPA对E2促进髁突软骨细胞增殖的影响.
Fig 4 The effect of RAPA on the proliferation ability of condylar chondrocytes with different E2 levels
A~C:分别为培养24、48、72时,RAPA对E2促进下髁突软骨细胞增殖的影响;D:RAPA对E2处理的髁突软骨细胞中ERα、ERβ、Beclin-1、LC3-Ⅱ、p-mTOR相关蛋白的表达,1~4分别为空白对照组、10−9 mol·L−1 RAPA组、10−8 mol·L−1 E2组、10−8 mol·L−1 E2+10−9 mol·L−1 RAPA组。
2.5. 雌激素受体抑制剂对E2作用下髁突软骨细胞中p-mTOR蛋白表达的影响
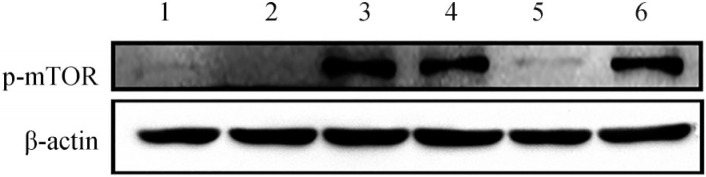
在10−8 mol·L−1 E2处理组中,加入AZD9496后,软骨细胞中p-mTOR的表达明显降低,接近对照组水平(P<0.01),而加入PHTPP后,与单纯10−8 mol·L−1 E2处理组相比,p-mTOR的表达差异无统计学意义(P>0.05)(图5)。
图 5. 雌激素受体抑制剂对各组软骨细胞中p-mTOR蛋白表达的影响.
Fig 5 The effect of estrogen receptor inhibitors on the p-mTOR expression of chondrocytes
1:空白对照组;2:10−9 mol·L−1 RAPA组;3:10−8 mol·L−1 E2组;4:10−8 mol·L−1 E2+10−9 mol·L−1 RAPA组;5:10−8 mol·L−1 E2+10−6 mol·L−1 AZD9496组;6:10−8 mol·L−1 E2+10−6 mol·L−1 PHTPP组。
3. 讨论
TMJOA是一种发生于软骨和软骨下骨的渐进性退行性疾病,软骨的退变核心在于软骨细胞的死亡以及软骨基质的降解破坏。既往研究表明,E2的应用能有效缓解关节软骨退变[4]–[5],对体外培养的髁突软骨细胞起到双向调节作用(低浓度促进细胞增殖,高浓度抑制细胞增殖),并在10−8 mol·L−1浓度下对体外培养的人胚或兔髁突软骨细胞具有最显著的促增殖作用[8]。在本实验中,10−10、10−8 mol·L−1 E2处理后的大鼠髁突软骨细胞增殖活力明显高于对照组,也验证了E2对髁突软骨细胞具有促增殖作用。然而E2对髁突软骨细胞的作用机制尚未明确。
自噬是一种细胞内部调节过程,起到双向作用。一方面,自噬是一种细胞在应激状态下的适应性反应,促进细胞存活;另一方面,过度自噬会引发Ⅱ型程序性细胞死亡,参与疾病的发生发展。mTOR信号分子是细胞中广泛存在的调节因子,在细胞自噬及增殖活动中发挥重要作用[7]。髁突软骨作为下颌骨生长发育及负重中心[9],其细胞中mTOR的作用机制可能更加复杂。既往研究[10]表明,mTOR的磷酸化状态受到抑制后,细胞会激活本体自噬反应,并可观察到细胞生长速度减缓。因此本研究旨在探讨自噬反应是否参与了E2对髁突软骨细胞增殖活动的调节。
以往相关研究发现,E2作用于不同细胞系后,细胞中的自噬反应变化不同[11]–[12],有结果显示E2可以促进人永生化软骨细胞系p-mTOR表达,抑制其自噬活动[11];而同样有结果显示E2作用于人子宫内膜癌细胞后会抑制细胞中p-mTOR表达,促进其自噬活动[12]。本研究中Western blot结果显示,在E2处理的髁突软骨细胞中,p-mTOR表达量升高,Beclin-1和LC3-Ⅱ的表达量降低,细胞自噬受到抑制,并且这种变化呈现出剂量依赖性的特点,表现为当E2浓度为10−8 mol·L−1时,p-mTOR升高最明显,而高于或低于该浓度,p-mTOR的水平都会相对降低,提示E2对细胞增殖活动的调节中可能涉及p-mTOR分子。
RAPA是一种特异性mTOR抑制剂及自噬诱导剂,可特异性抑制mTOR的磷酸化修饰[13]。本实验中,RAPA的应用显著降低了细胞中p-mTOR水平,并降低了细胞增殖活性,这可能是由细胞自噬活动增强,自身相对稳态增加,同时抑制自身有丝分裂活动所导致的[13]。该结果进一步验证mTOR的磷酸化形式在细胞增殖过程中具有重要作用。而RAPA对关节损伤模型中软骨的保护作用可能是通过促进软骨细胞自噬活动,将更多蛋白质用以修复细胞损伤而实现的,从而能够延缓关节软骨退变进程。
大量早期实验均提及到E2主要通过两大核受体ERα、ERβ发挥其生物学效能,如调节细胞凋亡等[14]。在本研究中,ERα在软骨细胞中的表达随着E2处理浓度的升高而变化,并在10−8 mol·L−1的浓度下达到峰值,并与细胞中p-mTOR水平呈现出明显正相关性,此外,p-mTOR和ERα的表达量变化也呈现出与培养时间相关的一致性,表现为在第48小时,p-mTOR和ERα蛋白表达量最高,并与该浓度下,细胞的增殖变化趋势一致。表明E2可能通过ERα激活mTOR并发挥作用。为验证E2是否通过雌激素受体进而调节mTOR的磷酸化修饰,实验中应用了ERα拮抗剂AZD9496和ERβ拮抗剂PHTPP,结果显示,当应用AZD9496后,细胞中mTOR 的磷酸化水平明显降低,并接近对照组水平;而应用PHTPP后,细胞中p-mTOR水平未有明显变化。说明E2至少可以通过ERα而非ERβ改变细胞中p-mTOR水平并进而影响细胞增殖活力。
以上研究表明,E2可以通过ERα-p-mTOR通路抑制细胞自噬,促进细胞增殖,提示E2-ERα-p-mTOR通路在TMJOA的发生发展中可能发挥作用。值得注意的是,本实验在第一阶段(雌激素处理阶段),发现在E2处理后第48小时,高浓度E2(10−6 mol·L−1)条件下,细胞中自噬相关标志物在基因水平上高于对照组,但在蛋白水平上低于对照组,提示高浓度E2对髁突软骨细胞中自噬的调节可能存在时效性及双向性作用,即初期抑制细胞自噬,后期促进细胞自噬。并且,Xiang等[15]研究表明E2对乳腺癌细胞自噬的调节确实存在双向性作用,能够将细胞中自噬水平维持在一个稳定的范围内,而自噬水平的失衡可能会导致细胞增殖活性的改变;此外,何磊等[12]实验中用于处理细胞的E2浓度远超10−6 mol·L−1,而结果显示该条件下,细胞的自噬作用增强,这些结果均说明不同浓度E2对同种细胞或不同细胞的效应具有差别,甚至作用相反。因此,关于高浓度E2 对于髁突软骨细胞中p-mTOR及自噬的调节机制和意义尚需进一步研究。
综上所述,本实验阐明在10−8 mol·L−1 E2条件下,E2能通过ERα途径促进p-mTOR的表达,并在体外培养的髁突软骨细胞增殖活动中发挥正向调节作用,该研究或可为探究E2与TMJOA之间的关系提供一个新的思考方向,然而鉴于本实验所采用的E2浓度的局限性以及体外细胞实验具有的偏差性,E2与p-mTOR和细胞或组织之间的具体作用机制还需进一步研究。
Funding Statement
[基金项目] 天津市自然科学基金重点项目(18JCZDJC3200)
Supported by: Key Project of Tianjin Natural Science Foundation (18JCZDJC3200).
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Wang XD, Zhang JN, Gan YH, et al. Current understanding of pathogenesis and treatment of TMJ osteoarthritis[J] J Dent Res. 2015;94(5):666–673. doi: 10.1177/0022034515574770. [DOI] [PubMed] [Google Scholar]
- 2.Larheim TA, Abrahamsson AK, Kristensen M, et al. Temporomandibular joint diagnostics using CBCT[J] Dentomaxillofac Radiol. 2015;44(1):20140235. doi: 10.1259/dmfr.20140235. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Musumeci G, Castrogiovanni P, Trovato FM, et al. Biomarkers of chondrocyte apoptosis and autophagy in osteoarthritis[J] Int J Mol Sci. 2015;16(9):20560–20575. doi: 10.3390/ijms160920560. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Xu X, Li X, Liang Y, et al. Estrogen modulates cartilage and subchondral bone remodeling in an ovariectomized rat model of postmenopausal osteoarthritis[J] Med Sci Monit. 2019;25:3146–3153. doi: 10.12659/MSM.916254. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Robinson JL, Soria P, Xu M, et al. Estrogen promotes mandibular condylar fibrocartilage chondrogenesis and inhibits degeneration via estrogen receptor alpha in female mice[J] Sci Rep. 2018;8(1):8527. doi: 10.1038/s41598-018-26937-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Ben-Sahra I, Manning BD. mTORC1 signaling and the metabolic control of cell growth[J] Curr Opin Cell Biol. 2017;45:72–82. doi: 10.1016/j.ceb.2017.02.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Yang H, Wen Y, Zhang M, et al. MTORC1 coordinates the autophagy and apoptosis signaling in articular chondrocytes in osteoarthritic temporomandibular joint[J] Autophagy. 2020;16(2):271–288. doi: 10.1080/15548627.2019.1606647. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.庞 磊, 张 跃蓉, 刘 忠林. 雌激素对人胚髁突软骨细胞增殖分化的影响[J] 华西口腔医学杂志. 2013;31(6):628–632. [PubMed] [Google Scholar]; Pang L, Zhang YR, Liu ZL. Effects of estrogen on the proliferation and differentiation of human embryo mandibular condylar chondrocytes[J] West China J Stomatol. 2013;31(6):628–632. [PubMed] [Google Scholar]
- 9.饶 跃, 罗 颂椒, 肖 邦良. 大鼠下颌髁突生长发育的组织学和组织化学研究[J] 华西口腔医学杂志. 1990;8(1):30–33. [Google Scholar]; Rao Y, Luo SJ, Xiao BL. Histological and histochemical studies on the growth and development of mandibular condyle in rats[J] West China J Stomatol. 1990;8(1):30–33. [Google Scholar]
- 10.Neufeld TP. Autophagy and cell growth—the yin and yang of nutrient responses[J] J Cell Sci. 2012;125(10):2359–2368. doi: 10.1242/jcs.103333. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Tao Y, Sun H, Sun H, et al. 17beta-estradiol activates mTOR in chondrocytes by AKT-dependent and AKT-independent signaling pathways[J] Int J Clin Exp Pathol. 2015;8(12):15911–15918. [PMC free article] [PubMed] [Google Scholar]
- 12.何 磊, 胡 惠军, 潘 勇权, et al. 雌激素通过GPR30-AMPK-mTOR通路诱导Ishikawa细胞自噬增强细胞活力[J] 中国生物化学与分子生物学报. 2017;33(4):353–361. [Google Scholar]; He L, Hu HJ, Pan YQ, et al. Estrogen enhances ishikawa cell viability by inducing autophagy via the GPR30-AMPK-mTOR pathway[J] Chin J Biochem Mol Biol. 2017;33(4):353–361. [Google Scholar]
- 13.Blagosklonny MV. Rapamycin, proliferation and geroconversion to senescence[J] Cell Cycle. 2018;17(24):2655–2665. doi: 10.1080/15384101.2018.1554781. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Toy W, Weir H, Razavi P, et al. Activating ESR1 mutations differentially affect the efficacy of ER antagonists[J] Cancer Discov. 2017;7(3):277–287. doi: 10.1158/2159-8290.CD-15-1523. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Xiang J, Liu X, Ren J, et al. How does estrogen work on autophagy[J] Autophagy. 2019;15(2):197–211. doi: 10.1080/15548627.2018.1520549. [DOI] [PMC free article] [PubMed] [Google Scholar]