Abstract
目的
探讨长链非编码RNA(lncRNA)HCG22在口腔鳞状细胞癌(OSCC)中的表达及作用机制。
方法
检测OSCC组织和对应癌旁组织、OSCC细胞和正常口腔角质细胞HOK中HCG22的水平;转染过表达载体质粒上调SCC-25和HSC-3细胞中HCG22的表达,采用甲基噻唑基四唑(MTT)法、流式细胞仪、Transwell小室检测细胞的增殖、凋亡,迁移和侵袭能力变化,Western blotting检测细胞上皮间质转化相关蛋白的表达;荧光定量聚合酶链反应(RT-qPCR)检测细胞中微小RNA-650(miR-650)表达水平;双荧光素酶报告基因实验检测HCG22和miR-650靶向关系。
结果
与癌旁组织比较,OSCC组织中HCG22表达明显降低(P<0.05),且HCG22低表达患者预后生存期显著低于高表达组(P<0.05);与HOK细胞比较,SCC-25、HN13、HSC-3和CAL-27细胞中HCG22表达明显下调(P<0.05);上调HCG22表达可抑制SCC-25和HSC-3细胞增殖、迁移、侵袭,诱导细胞凋亡,上调上皮间质转化蛋白上皮细胞钙黏蛋白(E-cadherin)和下调N-钙黏着蛋白(N-cadherin)、波形蛋白(Vimentin)蛋白表达(P<0.05)。miR-650模拟物可使转染HCG22野生型质粒细胞的荧光素酶活性降低(P<0.05),且上调HCG22表达后SCC-25和HSC-3细胞中miR-650表达下降(P<0.05)。
结论
HCG22在OSCC中低表达,上调其表达可抑制OSCC细胞的增殖、迁移、侵袭和上皮间质转化,其作用机制可能与对miR-650的靶向调控有关。
Keywords: 口腔鳞状细胞癌, 长链非编码RNA HCG22, 细胞迁移, 细胞侵袭, 微小RNA-650
Abstract
Objective
To investigate the expression and mechanism of the long non-coding RNA (lncRNA) HCG22 in oral squamous cell carcinoma (OSCC).
Methods
HCG22 levels were detected in the OSCC and adjacent tissues, OSCC cells, and normal oral keratinocytes. HCG22 expression in SCC-25 and HSC-3 cells was upregulated by transfection of the overexpressing plasmi dvector. Methyl thiazolyl tetrazolium (MTT) assay, flow cytometry, and Transwell assay were employed to detect changes in cell proliferation, apoptosis, migration, and invasion ability, while Western blotting was used to detect the expression of epithelial-mesenchymal transformation-related proteins. The expression level of miR-650 in the cells was detected by real-time quantitative polymerase chain reaction (RT-qPCR), and dual-luciferase reporter gene assay was applied to assess the targeting relationship between HCG22 and miR-650.
Results
Compared with that in adjacent tissues, the expression of HCG22 significantly decreased in OSCC tissues (P<0.05). Moreover, the prognostic survival of patients in the low-HCG22 expression group was significantly lower than that in the high-expression group (P<0.05). Compared with that in HOK cells, the expression of HCG22 was significantly lower in SCC-25, HN13, HSC-3, and CAL-27 cells (P<0.05). Upregulation of HCG22 expression could inhibit the proliferation, migration, invasion, and apoptosis of SCC-25 and HSC-3 cells, upregulatethe expression of E-cadherin, and downregulate the expression of N-cadherin and vimentin (P<0.05). miR-650 mimics could reduce the luciferase activity of HCG22 wild-type plasmid cells (P<0.05), and the expression of miR-650 in SCC-25 and HSC-3 cells decreased after upregulation of HCG22 expression (P<0.05).
Conclusion
HCG22 is expressed at low levels in OSCC. Upregulation of the expression of this lncRNA can inhibit the proliferation, migration, invasion, and epithelial-mesenchymal transition of OSCC cells. The mechanism of action of HCG22 may be related to its targeted regulation of miR-650.
Keywords: oral squamous cell carcinoma, long non-coding RNA HCG22, cell migration, cell invasion, microRNA-650
口腔癌是全球常见的恶性肿瘤之一,口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是其常见的病理类型,约占所有口腔癌的90%[1]。全世界每年新发超过30万的OSCC患者,且OSCC整体5年死亡率达到48%[2]。目前,手术、化疗和放疗是OSCC重要的治疗手段,但患者在5年内的生存率仍不理想。研究显示,长链非编码RNA(long non-coding RNA,lncRNA)的异常表达与OSCC发生发展和预后不良有关[3]–[5]。lncRNA HCG22(HLA complex group 22)是常见lncRNAs的一种,已被报道在食管鳞癌和膀胱癌等组织中特异性表达下调且发挥一定抑癌作用,被认为是潜在的治疗新靶点[6]–[7]。近年来,有学者[8]利用基因表达综合数据库(Gene Expression Omnibus,GEO)和肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)分析发现HCG22在口腔癌的诊断和预后方面显示出优越的潜力,但HCG22在OSCC中的表达和作用机制并不完全清楚。本研究通过检测OSCC组织和细胞中HCG22的表达情况,分析HCG22表达与OSCC患者预后的关系,并探讨HCG22表达对OSCC细胞系增殖、迁移、侵袭和上皮间质转化的作用及可能机制,以期为OSCC诊疗提供新线索。
1. 材料和方法
1.1. 实验材料
1.1.1. 组织标本的获取
收集2017年9月—2018年9月于郑州大学第一附属医院行手术切除的68例OSCC患者的癌组织样本及相应的癌旁组织(距离肿瘤2~3 cm)标本。纳入标准:1)病理诊断为OSCC;2)接受手术且术前未接受任何治疗;3)有完整的临床病理资料;4)无感染性疾病及其他系统肿瘤等。其中,男性36例,女性32例,年龄27~80岁,中位年龄58岁;获取的新鲜组织标本立即放入液氮中保存。对所有参与者术后进行随访,随访截止时间为2020年9月。本研究的开展经患者或家属知情同意,并已获得郑州大学第一附属医院伦理委员会的批准。
1.1.2. 其他实验材料
人OSCC细胞株SCC-25、HN13、HSC-3(上海素尔生物科技有限公司)和CAL-27(湖南丰晖生物科技有限公司),人正常口腔角质永生化细胞株HOK、pcDNA3.1-HCG22过表达载体质粒和pcDNA3.1空载体质粒(上海雅吉生物科技有限公司),RPMI1640培养基、DMEM培养基、胎牛血清、脂质体3000、甲基噻唑基四唑(methyl thiazolyl tetrazolium,MTT)试剂盒、逆转录试剂盒和Transwell小室(北京索莱宝生物科技有限公司),AnnexinV-APC/7-AAD细胞凋亡检测试剂盒(上海钰博生物科技有限公司),微小RNA-650(microRNA-650,miR-650)模拟物(mimics)及其阴性对照mimics-NC(广州锐博生物科技有限公司),上皮细胞钙黏蛋白(E-cadherin)、N-钙黏着蛋白(N-cadherin)、波形蛋白(Vimentin)和磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)抗体(Abcam公司,英国),37XC型倒置显微镜(上海光学仪器厂),iMark型酶标仪和CFX96型实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)仪(Bio-Rad公司,美国)。
1.2. 方法
1.2.1. 细胞培养、转染和分组处理
HSC-3和CAL-27细胞采用含10%胎牛血清的DMEM培养基培养,而HOK、SCC-25和HN-13细胞采用含10%胎牛血清的RPMI1640培养基培养,均置于温度为37 °C、5%CO2和湿度饱和的培养箱内贴壁培养。将对数期SCC-25和HSC-3细胞种植到6孔板上,培养至70%融合度时,按照脂质体3000使用说明进行瞬时转染;其中,将转染pcDNA3.1-HCG22过表达载体质粒的SCC-25和HSC-3细胞作为HCG22组,转染pcDNA3.1空载体质粒的SCC-25和HSC-3细胞作为空载体组,并以正常培养不做转染的细胞作为对照组,每组均设3个重复。
1.2.2. RT-qPCR检测OSCC组织和细胞中HCG22及miR-650表达
按照Trizol试剂使用说明提取待测组织样品或细胞的总RNA,测定RNA纯度与浓度后,使用逆转录试剂盒将RNA合成单链cDNA。取2 µL cDNA作为模板,加入10 µL SYBR Green Mix、0.5 µL上游引物、0.5 µL下游引物和7 µL ddH2O制备20 µL荧光定量体系;将其上样至RT-qPCR仪上后,在设定的程序(95 °C 3 min;95 °C 20 s、60 °C 30 s、72 °C 30 s,循环40次)下进行PCR扩增。以GAPDH或U6为内参照,2−ΔΔCt法计算组织样品或细胞中HCG22及miR-650表达水平。其中,聚合酶链反应(polymerase chain reaction,PCR)引物序列(上海生工生物工程股份有限公司)如下。HCG22上游引物序列:5′-ACAGCAGTGAAACCCACCA-3′,下游引物序列:5′-GAAGCCCAATCCAACAAAGAGC-3′;miR-650上游引物序列:5′-AGGAGGCAGCGCTCTC-3′,下游引物序列:5′-GAACATGTCTGCGTATCTC-3′;GAPDH上游引物序列:5′-GTCTCCTCTGACTTCAACAGCG-3′,下游引物序列:5′-ACCACCCTGTTGCTGTAGCCAA-3′;U6上游引物序列:5′-CTCGCTTCGGCAGCACAT-3′,下游引物序列:5′-TTTGCGTGTCATCCTTGCG-3′。
1.2.3. MTT法检测SCC-25和HSC-3细胞增殖活力
将对数期的SCC-25和HSC-3细胞种植到96孔板上后,培养箱内常规培养至65%~75%融合度时按照1.2.1中的方法进行转染;在转染0、24、48、72和96 h时,按照MTT试剂盒说明书以酶标仪于450 nm处检测SCC-25和HSC-3细胞的光密度(optical density,OD)值。
1.2.4. 流式细胞仪检测SCC-25和HSC-3细胞凋亡率
以预冷的磷酸缓冲液重悬收集到的SCC-25和HSC-3细胞后,1000 r·min−1离心5 min;以结合缓冲液调整细胞后,取100 µL细胞液(含105个细胞)于流式管中,分别加入AnnexinV-APC 5 µL和7-AAD 10 µL,室温避光孵育5 min后,上流式细胞仪检测SCC-25和HSC-3细胞凋亡率。
1.2.5. Transwell小室实验检测SCC-25和HSC-3细胞迁移和侵袭能力
收集对数期的HCG22组、空载体组SCC-25和HSC-3细胞,加入无血清培养基制成浓度为每毫升105个单细胞悬液;取100 µL细胞液至未处理(观察迁移)或经Matrigel胶包被(观察侵袭)的Transwell小室上室中,于24孔板中加入含血清的培养基600 µL,放入培养箱内常规培养;24 h后以棉签拭去小室上室内残留的细胞后,先以甲醇固定细胞25 min,再以0.5%结晶紫染色10 min。洗涤干燥后,采用倒置显微镜观察拍照并统计穿膜细胞数。
1.2.6. Western blotting检测SCC-25和HSC-3细胞上皮间质转化相关蛋白的表达
按照总蛋白提取试剂盒使用说明提取SCC-25和HSC-3细胞的总蛋白后,采用二喹啉甲酸法检测蛋白的浓度。将变性后的蛋白样品行电泳分离后,半干法转膜。脱脂奶粉封膜2 h后,加入GAPDH(1∶2 000)、E-cadherin(1∶1 000)、N-cadherin(1∶1 000)和Vimentin(1∶800)抗体;4 °C下孵育过夜后,再加入辣根过氧化酶标记的二抗(1∶5 000);室温孵育2 h后,化学发光剂显影;采用凝聚成像分析系统分析SCC-25和HSC-3细胞中E-cadherin、N-cadherin和Vimentin蛋白的表达水平,以GAPDH为内参照进行校正。
1.2.7. 双荧光素酶报告基因实验检测HCG22和miR-650靶向关系
将野生的HCG22及定点突变后的HCG22序列片段克隆重组至pGL3-Basic-Vector载体质粒上,构建野生型pGL3-HCG22(HCG22-WT)和突变型pGL3-HCG22(HCG22-MUT)质粒。将HCG22-WT、HCG22-MUT分别与miR-650 mimics及mimics-NC共转染293T细胞,转染48 h后按照双荧光素酶报告基因实验检测试剂盒使用说明检测荧光素酶活性。
1.3. 统计学分析
采用SPSS 19.0软件进行统计学分析,以x±s表示计量资料,其中,独立样本t检验分析两组间差异,单因素方差分析多组间差异,SNK-q检验对组间进一步两两比较进行分析;计数资料采用χ2检验分析,并采用Kaplan-Meier法分析随访3年患者的生存情况;以P<0.05表示差异有统计学意义。
2. 结果
2.1. HCG22在OSCC组织中的表达及与临床病理特征的关系
RT-qPCR检测结果显示:OSCC组织中HCG22表达水平(0.89±0.21)较癌旁组织(2.12±0.22)明显降低(P<0.05)。以HCG22表达水平中位值为界,将68例OSCC组织样本分为低表达组和高表达组,观察分析HCG22表达水平与OSCC患者临床病理特征的关系。结果显示:HCG22表达水平可能与患者肿瘤大小、TNM分期、分化程度和淋巴结转移等密切相关(P<0.05)(表1)。生存曲线分析结果显示:截止随访,HCG22低表达组、高表达组患者的总生存率分别为23.25%和45.27%;与HCG22高表达组比较,HCG22低表达组患者总生存率明显降低(P<0.05)(图1)。
表 1. HCG22表达与OSCC患者临床病理特征的关系.
Tab 1 The relationship between HCG22 expression and clinicopathological features of OSCC patients
| 资料 | n | HCG22[n(%)] |
χ2值 | P值 | ||
| 低表达组 | 高表达组 | |||||
| 性别 | 男 | 36 | 20(55.56) | 16(44.44) | 0.846 | 0.358 |
| 女 | 32 | 20(62.50) | 12(37.50) | |||
| 年龄/岁 | >60 | 39 | 22(56.41) | 17(43.59) | 0.744 | 0.388 |
| ≤60 | 29 | 18(62.07) | 11(37.93) | |||
| 肿瘤大小/cm | ≥3 | 41 | 21(51.22) | 20(48.78) | 7.553 | 0.006 |
| <3 | 27 | 19(70.37) | 8(29.63) | |||
| 肿瘤部位 | 舌部 | 38 | 22(57.89) | 16(42.11) | 0.111 | 0.946 |
| 颊部 | 20 | 12(60.00) | 8(40.00) | |||
| 其他 | 10 | 6(60.00) | 4(40.00) | |||
| TNM 分期 | Ⅰ~Ⅱ期 | 40 | 26(65.00) | 14(35.00) | 4.604 | 0.032 |
| Ⅲ~Ⅳ期 | 28 | 14(50.00) | 14(50.00) | |||
| 分化程度 | 低分化 | 42 | 27(64.29) | 15(35.71) | 3.998 | 0.046 |
| 中、高分化 | 26 | 13(50.00) | 13(50.00) | |||
| 淋巴结转移 | 无 | 47 | 30(63.83) | 17(36.17) | 5.195 | 0.023 |
| 有 | 21 | 10(47.62) | 11(52.38) | |||
图 1. HCG22表达与OSCC患者预后的关系.

Fig 1 The relationship between HCG22 expression and prognosis of OSCC patients
2.2. HCG22在OSCC中的表达及转染效果
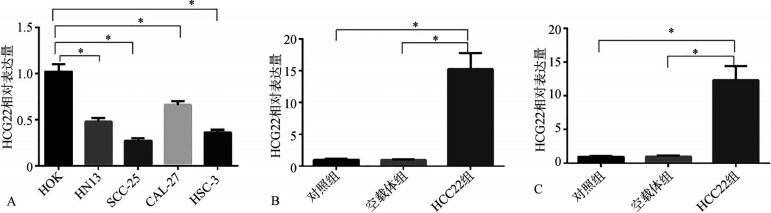
与人正常口腔角质HOK细胞比较,OSCC细胞株HN13、SCC-25、CAL-27和HSC-3中HCG22表达水平明显降低(P<0.05),且SCC-25和HSC-3细胞相对较低。故选择SCC-25和HSC-3细胞上调HCG22的表达进行后续实验。将pcDNA3.1-HCG-22过表达载体转染至SCC-25和HSC-3细胞中,RT-qPCR检测结果显示:与对照组比较,转染pcDNA3.1空载体后HCG22表达水平差异无统计学意义(P>0.05),转染pcDNA3.1-HCG22过表达载体组HCG22水平明显升高(P<0.05)(图2)。
图 2. OSCC细胞中HCG22表达水平检测.
Fig 2 Detection of HCG22 expression level in OSCC cells
A:HCG22在OSCC中的表达,与HOK细胞比较,*P<0.05;B、C:分别为转染后SCC-25细胞和HSC-3细胞中HCG22的表达水平;与对照组和空载体组比较,*P<0.05。
2.3. 上调HCG22表达对OSCC细胞增殖的影响
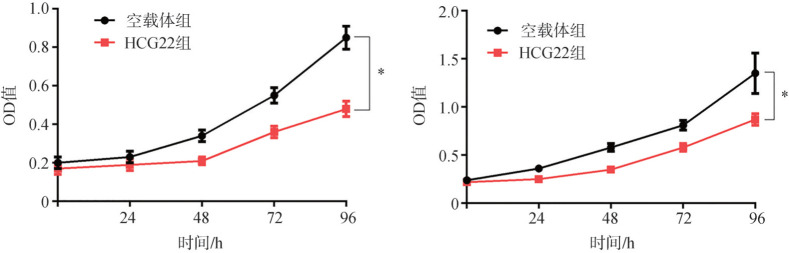
CCK-8法检测结果显示:与空载体组比较,HCG22组SCC-25细胞和HSC-3细胞增殖活力均明显降低(P<0.05)(图3)。
图 3. 上调HCG22表达对OSCC细胞增殖的影响.
Fig 3 Effect of up-regulating HCG22 on the proliferation of OSCC cells
左:SCC-25细胞增殖活力比较;右:HSC-3细胞增殖活力比较。与空载体组比较,*P<0.05。
2.4. 上调HCG22表达对OSCC细胞凋亡的影响
流式细胞仪检测结果显示,与空载体组比较,HCG22组SCC-25细胞和HSC-3细胞的凋亡率均明显升高(P<0.05)(图4)。
图 4. 上调HCG22表达对OSCC细胞凋亡的影响.
Fig 4 Effect of up-regulating HCG22 on the apoptosis of OSCC cells
上:流式细胞仪检测SCC-25细胞凋亡率;下:流式细胞仪检测HSC-3细胞凋亡率。与空载体组比较,*P<0.05。
2.5. 上调HCG22表达对OSCC细胞迁移和侵袭影响
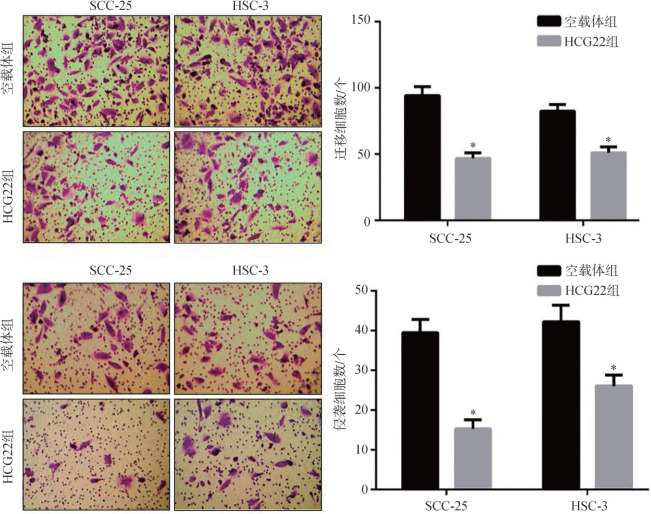
Transwell小室检测结果显示:与空载体组比较,HCG22组SCC-25细胞和HSC-3细胞迁移和侵袭能力明显减弱(P<0.05)(图5)。
图 5. 上调HCG22表达对OSCC细胞迁移和侵袭影响.
Fig 5 Effects of up-regulating HCG22 on the migration and invasion of OSCC cells
上:Transwell小室迁移实验;下:Transwell小室侵袭实验;左:Transwell小室结晶紫染色 × 200;右:与空载体组比较,*P<0.05。
2.6. 上调HCG22表达对OSCC细胞上皮间质转化相关蛋白的影响
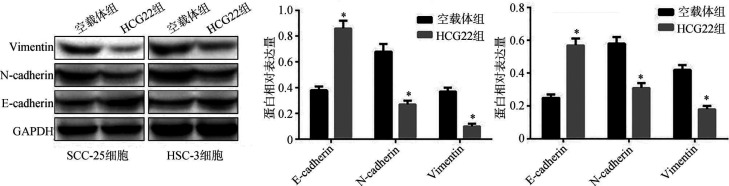
Western blotting检测结果显示:与空载体组比较,HCG22组SCC-25细胞和HSC-3细胞中上皮间质转化相关蛋白E-cadherin表达水平明显升高,而N-cadherin和Vimentin蛋白表达水平明显降低(P<0.05)(图6)。
图 6. 上调HCG22表达对OSCC细胞上皮间质转化相关蛋白的影响.
Fig 6 Effects of up-regulating HCG22 on epithelial mesenchymal transformation related proteins in OSCC cells
左:Western blotting检测上皮间质转化相关蛋白结果;中:SCC-25细胞中各蛋白的相对表达量;右:HSC-3细胞中各蛋白的相对表达量。与空载体组比较,*P<0.05。
2.7. HCG22靶基因预测及其验证
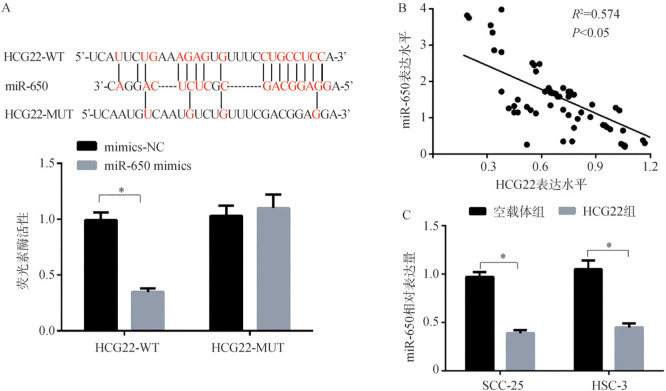
生物学软件LncBase Predicted v.2预测结果显示:HCG22和miR-650之间存在互补的结合位点;双荧光素酶报告基因实验检测结果显示,转染miR-650 mimics可使HCG22-WT载体的荧光素酶活性明显降低(P<0.05)(图7A);RT-qPCR检测结果显示,OSCC组织中HCG22和miR-650表达水平呈负相关性,上调HCG22表达可引起SCC-25和HSC-3细胞中miR-650表达水平降低(P<0.05)(图7C)。
图 7. HCG22和miR-650靶向关系的验证.
Fig 7 Verification of the targeting relationship between HCG22 and miR-650
A:荧光素酶报告基因实验验证HCG22和miR-650靶向关系活性;B:OSCC组织中HCG22和miR-650表达的相关性;C:上调HCG22表达后OSCC细胞中miR-650表达水平,与空载体组比较,*P<0.05。
3. 讨论
OSCC是一种好发于舌、颊和牙龈等部位的恶性肿瘤,有着较高的发病率和死亡率[9]。目前,手术切除是OSCC治疗的主要手段,但部分患者术后易出现复发和转移,导致预后不良[10],其根本原因在于OSCC恶性发生发展的机制不够明确。在人类基因组中,有98%的RNA为非编码RNA,而lncRNAs在非编码RNA中占80~90%;lncRNAs是一类长度超过200个碱基的非编码RNA,在基因的表观遗传、基因翻译、基因转录及转录后调控等过程中发挥着重要作用,广泛参与了机体的各组生理和病理过程[11]。随着对OSCC发生发展分子机制研究的深入,越来越多的证据表明OSCC中异常表达的lncRNAs不仅与患者临床病理特征关系密切,还可通过调控miRNA或者信号通路等多种机制影响肿瘤细胞的生物学行为,发挥促进或抑制癌症进展的作用[12]–[14];lncRNAs不仅可作为肿瘤诊断和预后因子,还可作为肿瘤标志物和肿瘤治疗的靶点。因此,研究差异性表达的lncRNAs对OSCC早期诊断和治疗具有重要意义。
HCG22是一种研究相对较少的lncRNA,与人体多种疾病的发生密切相关。如Yatagai等[15]研究发现,日本人群迟发性哮喘易感性的增加与HCG22的变异有关。Jeong等[16]报道指出,HCG22是一种黏蛋白基因,在类固醇诱导的高眼压发生过程中发挥着重要作用。除了与哮喘和高眼压发生有关外,HCG22表达异常也被证实与肿瘤的发生密切相关。Li等[6]报道指出,HCG22在食管鳞癌组织中表达下调,且其表达与分化程度及临床TNM分期显著相关;另外,生物功能实验证实HCG22可以通过靶向调控ADAMTS12的表达抑制肿瘤细胞迁移和侵袭。Jiang等[7]研究指出,HCG-22在膀胱癌中呈弱表达,且HCG22低表达与患者低生存率密切相关;细胞水平上也证实HCG22可通过调控HuR/PTBP1轴发挥抑制癌细胞增殖、迁移和上皮-间充质转化的作用。尽管,有学者[17]采用GEO数据库及检测20例OSCC组织发现HCG22表达下调,但其在OSCC中的表达及作用机制并不完全清楚。本研究通过检测OSCC组织和细胞中HCG22的表达情况,结果发现HCG22在OSCC中呈低表达状态;进一步分析发现,HCG22低表达与OSCC患者肿瘤大小、TNM分期、分化程度和淋巴结转移等密切相关。结果提示,HCG22可能在OSCC的恶性进展过程中扮演着重要角色。在具有代表性的SCC-25和HSC-3细胞株中进行功能实验发现,上调HCG22表达可抑制SCC-25和HSC-3细胞增殖、迁移、侵袭,诱导细胞凋亡,并可通过上调上皮间质转化上皮标志物E-cadherin和下调间质标志物N-cadherin、Vimentin蛋白的表达。因此可见,HCG22在OSCC发生和发展过程中扮演着抑癌因子的角色,可能是OSCC诊疗的潜在靶点。
miRNAs是一种不同于lncRNAs的且研究相对较多的短链非编码RNA,其异常表达与包括肿瘤在内的多种疾病的发生发展有着密切联系[18]。研究[19]–[21]显示,lncRNAs和miRNA之间存在着相互作用,lncRNAs可作为“分子海绵”靶向调控miRNA的表达来发挥生物学作用。miR-650是一种与结肠癌、肝癌和非小细胞肺癌等肿瘤发生发展密切相关的致癌基因,在肿瘤细胞增殖、凋亡、迁移、侵袭和上皮间质转化等过程中发挥着重要的调控作用[22]–[24]。有研究[25]指出,miR-650在OSCC中表达上调,且可通过上调Gfi1的表达促进肿瘤细胞的增殖、迁移和侵袭。本研究采用生物学软件对HCG22潜在靶基因进行预测发现:HCG22与miR-650之间存在互补的结合位点,结合上述相关资料最终将miR-650作为HCG22的靶向研究对象。检测结构显示,miR-650在OSCC组织中的表达与HCG22呈负相关,同时,miR-650 mimics可使转染HCG22-WT质粒细胞的荧光素酶活性降低,而上调HCG22表达可降低SCC-25和HSC-3细胞中miR-650表达。因此推测,在OSCC中HCG22可直接靶向作用于miR-650,而HCG22在OSCC中发挥抑癌作用的分子机制也可能与对miR-650的调控有关。
综上所述,本研究认为HCG22在OSCC组织和细胞中低表达,上调其表达可抑制OSCC细胞的增殖、迁移、侵袭和上皮间质转化,其作用机制可能与靶向调控miR-650表达有关。该结果的发现为进一步探讨HCG22在OSCC抑癌机制中的作用奠定基础,也为OSCC有效诊疗方案开辟了新的前景。
Funding Statement
[基金项目] 2020年度河南省高等学校重点科研项目(20B320019)
Supported by: Institution of Higher Education Key Scientific Research Project of Henan Province in 2020 (20B320019).
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.耿 玉东, 王 树斌, 卢 泰青, et al. 长链非编码RNA肌动蛋白纤维相关蛋白1-反义RNA1在口腔鳞状细胞癌中的表达及其相关功能[J] 华西口腔医学杂志. 2019;37(6):594–601. doi: 10.7518/hxkq.2019.06.005. [DOI] [PMC free article] [PubMed] [Google Scholar]; Geng YD, Wang SB, Lu TQ, et al. Expression and functions of long non-coding RNA actin filament-associated protein1-antisense RNA1 in oral squamous cell carcinoma[J] West China J Stomatol. 2019;37(6):594–601. doi: 10.7518/hxkq.2019.06.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Vucicevic Boras V, Fucic A, Virag M, et al. Significance of stroma in biology of oral squamous cell carcinoma[J] Tumori. 2018;104(1):9–14. doi: 10.5301/tj.5000673. [DOI] [PubMed] [Google Scholar]
- 3.Qu XH, Shi YL, Ma Y, et al. LncRNA DANCR regulates the growth and metastasis of oral squamous cell carcinoma cells via altering miR-216a-5p expression[J] Hum Cell. 2020;33(4):1281–1293. doi: 10.1007/s13577-020-00411-0. [DOI] [PubMed] [Google Scholar]
- 4.Chen ZF, Wang Y, Sun LL, et al. LncRNA SNHG20 enhances the progression of oral squamous cell carcinoma by regulating the miR-29a/DIXDC1/Wnt regulatory axis[J] Eur Rev Med Pharmacol Sci. 2020;24(10):5436–5445. doi: 10.26355/eurrev_202005_21328. [DOI] [PubMed] [Google Scholar]
- 5.Liu L, Zhan Y, Huang Y, et al. LncRNA FGD5-AS1 can be predicted as therapeutic target in oral cancer[J] J Oral Pathol Med. 2020;49(9):243–252. doi: 10.1111/jop.12989. [DOI] [PubMed] [Google Scholar]
- 6.Li X, Xiao X, Chang R, et al. Comprehensive bioinformatics analysis identifies lncRNA HCG22 as a migration inhibitor in esophageal squamous cell carcinoma[J] J Cell Biochem. 2020;121(1):468–481. doi: 10.1002/jcb.29218. [DOI] [PubMed] [Google Scholar]
- 7.Jiang D, Zhang Y, Yang L, et al. Long noncoding RNA HCG22 suppresses proliferation and metastasis of bladder cancer cells by regulation of PTBP1[J] J Cell Physiol. 2020;235(2):1711–1722. doi: 10.1002/jcp.29090. [DOI] [PubMed] [Google Scholar]
- 8.Yin J, Zeng X, Ai Z, et al. Construction and analysis of a lncRNA-miRNA-mRNA network based on competitive endogenous RNA reveal functional lncRNAs in oral cancer[J] BMC Med Genomics. 2020;13(1):84–97. doi: 10.1186/s12920-020-00741-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.程 兰欣, 朱 卓立. 具核梭杆菌与口腔鳞状细胞癌关系的研究进展[J] 重庆医学. 2020;49(16):2767–2770, 2774. [Google Scholar]; Cheng LX, Zhu ZL. Advances in the relationship between Fusobacterium nucleatum and oral squamous cell carcinoma[J] Chongqing Med. 2020;49(16):2767–2770, 2774. [Google Scholar]
- 10.王 倩, 侯 大为. 口腔鳞状细胞癌发病及转移机制研究进展[J] 口腔医学研究. 2018;34(11):1164–1167. [Google Scholar]; Wang Q, Hou DW. Research progress in pathogenesis of oral squamous cell carcinoma[J] J Oral Sci Res. 2018;34(11):1164–1167. [Google Scholar]
- 11.王 婷梅, 曲 丽娜, 李 莹辉. LncRNA的结构、功能及其与疾病的关系[J] 中国生物化学与分子生物学报. 2015;31(7):659–666. [Google Scholar]; Wang TM, Qu LN, Li YH. Structures and functions of long non-coding RNAs and its roles in diseases[J] Chin J Biochem Mol Biol. 2015;31(7):659–666. [Google Scholar]
- 12.Gao P, Fan R, Ge T. SNHG20 serves as a predictor for prognosis and promotes cell growth in oral squamous cell carcinoma[J] Oncol Lett. 2019;17(1):951–957. doi: 10.3892/ol.2018.9709. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Zhang L, Meng X, Zhu XW, et al. Long non-coding RNAs in oral squamous cell carcinoma: biologic function, mechanisms and clinical implications[J] Mol Cancer. 2019;18(1):102. doi: 10.1186/s12943-019-1021-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.黄 佳欣, 邵 婷如, 陈 跃川, et al. 长链非编码RNA在口腔鳞状细胞癌中的研究进展[J] 分子诊断与治疗杂志. 2018;10(2):120–124. [Google Scholar]; Huang JX, Shao TR, Chen YC, et al. The progress of lncRNAs in oral squamous cell carcinoma [J] J Mol Diagn Ther. 2018;10(2):120–124. [Google Scholar]
- 15.Yatagai Y, Hirota T, Sakamoto T, et al. Variants near the HLA complex group 22 gene (HCG22) confer increased susceptibility to late-onset asthma in Japanese populations[J] J Allergy Clin Immunol. 2016;138(1):281–283. doi: 10.1016/j.jaci.2015.11.023. [DOI] [PubMed] [Google Scholar]
- 16.Jeong S, Patel N, Edlund CK, et al. Identification of a novel mucin gene HCG22 associated with steroid-induced ocular hypertension[J] Invest Ophthalmol Vis. 2015;56(4):2737–2748. doi: 10.1167/iovs.14-14803. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Feng L, Houck JR, Lohavanichbutr P, et al. Transcriptome analysis reveals differentially expressed lncRNAs between oral squamous cell carcinoma and healthy oral mucosa[J] Oncotarget. 2017;8(19):31521–31531. doi: 10.18632/oncotarget.16358. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Zhong X, Coukos G, Zhang L. miRNAs in human cancer[J] Methods Mol Biol. 2012;822:295–306. doi: 10.1007/978-1-61779-427-8_21. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.武 丹, 曾 林祥. 长链非编码RNA的微RNA海绵作用与呼吸系统疾病[J] 中国生物化学与分子生物学报. 2019;35(5):499–503. [Google Scholar]; Wu D, Zeng LX. The roles of long non-coding RNAs functioning as MicroRNA sponge in respiratory diseases[J] Chin J Biochem Mol Biol. 2019;35(5):499–503. [Google Scholar]
- 20.Shen Y, Xu J, Pan X, et al. LncRNA KCNQ1OT1 sponges miR-34c-5p to promote osteosarcoma growth via ALDOA enhanced aerobic glycolysis[J] Cell Death Dis. 2020;11(4):278. doi: 10.1038/s41419-020-2485-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Zhang J, Wang L, Jiang J, et al. The lncRNA SNHG15/miR-18a-5p axis promotes cell proliferation in ovarian cancer through activating Akt/mTOR signaling pathway[J] J Cell Biochem. 2020;121(12):4699–4710. doi: 10.1002/jcb.29474. [DOI] [PubMed] [Google Scholar]
- 22.王 琴, 何 峰, 刘 强, et al. TNF-α通过调控miR-650/LATS1表达对结肠癌细胞增殖和凋亡的影响及其机制研究[J] 中国免疫学杂志. 2020;36(6):699–706. [Google Scholar]; Wang Q, He F, Liu Q, et al. Effects of TNF-α on proliferation and apoptosis of colon cancer cells by regulating expression of miR-650/LATS1 and its mechanism[J] Chin J Immun. 2020;36(6):699–706. [Google Scholar]
- 23.Han LL, Yin XR, Zhang SQ, et al. miR-650 promotes the metastasis and epithelial-mesenchymal transition of hepatocellular carcinoma by directly inhibiting LATS2 expression[J] Cell Physiol Biochem. 2018;51(3):1179–1192. doi: 10.1159/000495495. [DOI] [PubMed] [Google Scholar]
- 24.Tang XQ, Ding YJ, Wang XQ, et al. miR-650 promotes non-small cell lung cancer cell proliferation and invasion by targeting ING4 through Wnt-1/β-catenin pathway[J] Oncol Lett. 2019;18(5):4621–4628. doi: 10.3892/ol.2019.10805. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Ningning S, Libo S, Chuanbin W, et al. MiR-650 regulates the proliferation, migration and invasion of human oral cancer by targeting growth factor independent 1 (Gfi1)[J] Biochimie. 2019;156:69–78. doi: 10.1016/j.biochi.2018.10.001. [DOI] [PubMed] [Google Scholar]