Abstract
目的:
探究盐诱导激酶2(SIK2)对脑缺血再灌注大鼠能量代谢相关物质表达的影响。
方法:
选用成年SD雄性大鼠(240~260 g),参照改良Zea-Longa线栓法建立大鼠短暂性中动脉栓塞模型(MCAO),在构建MCAO模型前8 d予以右侧脑室注射7 μL腺病毒使大鼠脑组织SIK2过表达,随后建立缺血2 h再灌注24 h模型。实验分为手术对照组、缺血对照组、缺血再灌注组、腺病毒空载组及SIK2过表达组。苏木精-伊红(HE)染色观察大鼠神经细胞损伤的病理学改变;氯化三苯基四氮唑(TTC)染色观察大鼠脑组织梗死情况;酶联免疫吸附试验(ELISA)检测各组大鼠脑组织中腺苷三磷酸(ATP)、腺苷二磷酸(ADP)的含量;荧光定量聚合酶链反应和蛋白质印迹法检测各组大鼠脑组织中SIK2及缺氧诱导因子1α(HIF-1α)的表达量。
结果:
与手术对照组比较,缺血对照组及缺血再灌注组SIK2表达减少,且缺血再灌注组较缺血对照组减少更明显( P<0.05);与手术对照组和缺血对照组比较,缺血再灌注组病理损伤较重,梗死体积较大;与缺血再灌注组和腺病毒空载组比较,SIK2过表达组病理损伤较轻,梗死体积减少。与手术对照组比较,缺血对照组和缺血再灌注组HIF-1α表达均增加,其中缺血对照组增加更明显(均 P<0.05);SIK2过表达组HIF-1α表达比缺血再灌注组和腺病毒空载组均增多(均 P<0.05)。与手术对照组比较,缺血对照组和缺血再灌注组ATP含量均减少,且缺血再灌注组较缺血对照组减少更为显著( P<0.05);ADP含量在缺血对照组和缺血再灌注组均增多,且缺血再灌注组较缺血对照组明显增多( P<0.05);与缺血再灌注组和腺病毒空载组比较,SIK2过表达组ATP含量增加(均 P<0.05),ADP含量减少(均 P<0.05)。
结论:
SIK2可通过上调HIF-1α的表达,增加大鼠脑组织中ATP的含量,减少ADP含量,减轻大鼠脑缺血再灌注损伤。
Abstract
Objective:
To investigate the effects of salt-inducible kinase 2 (SIK2) on energy metabolism in rats with cerebral ischemia-reperfusion.
Methods:
Adult SD male rats (240-260 g) were divided into 5 groups: sham group, ischemia group, reperfusion group, adenovirus no-load group, and SIK2 overexpression group with 5 animals in each group. The middle cerebral artery occlusion (MCAO) was induced with the modified Zea-Longa line thrombus method to establish the cerebral ischemia reperfusion model. Eight days before the MCAO, SIK2 overexpression was induced by injecting 7 μL adenovirus in the right ventricle, then MCAO was performed for 2 h, followed by reperfusion 24 h. HE staining was used to observe the pathological changes of cerebral tissue in rats; TTC staining was used to observe the volume of cerebral infarct. The levels of adenosine triphosphate (ATP) and adenosine diphosphate (ADP) in rat brain tissue were detected by ELISA; the levels of SIK2 and hypoxia-inducible factor 1α (HIF-1α) in the rat brain tissues were detected by RT-qPCR and Western blotting.
Results:
Compared with the sham group, SIK2 level was decreased in the ischemia group, and it was further declined in the reperfusion group ( P<0.05). Compared with the sham group and ischemic group, the pathological injury in reperfusion group were more severe, and the infarct size was larger; compared with the reperfusion group and adenovirus no-load group, the pathological injury of the SIK2 overexpression group was milder, and the infarct size is less. Compared with the sharn group, HIF-1α was increased in both ischemia group and reperfusion group, especially in ischemia group (all P<0.05); HIF-1α level in the SIK2 overexpression group was higher than that in the reperfusion group and adenovirus no-load group (all P<0.05). ATP level in ischemia group and reperfusion group was lower than that in the sham group, and the reperfusion group decreased more significantly than the ischemia group ( P<0.05); ADP content was increased in the ischemia and reperfusion group, and the ADP content in reperfusion group was significantly higher than that in the ischemia group ( P<0.05). ATP level in the SIK2 overexpression group was higher than that in the reperfusion group and adenovirus no-load group (all P<0.05), and ADP was decreased in the SIK2 overexpression group (all P<0.05).
Conclusion:
SIK2 can up-regulate the ATP level and down-regulate the ADP level in rat brain tissue and alleviate cerebral ischemia-reperfusion injury by increase the level of HIF-1α.
Keywords: Ischemia reperfusion, Energy metabolism, Salt-inducible kinase 2, Hypoxia-inducible factor-1α, Adenosine triphosphate, Adenosine diphosphate, SD rat
腺苷三磷酸(adenosine triphosphate,ATP);腺苷二磷酸(adenosine diphosphate,ADP);盐诱导激酶(salt-inducible kinase,SIK);AMP活化的蛋白激酶(AMP-activated protein kinase,AMPK);缺氧诱导因子(hypoxia-inducible factor,HIF);血管内皮生长因子(vascular endothelial growth factor,VEGF);聚合酶链反应(polymerase chain reaction,PCR);大脑中动脉栓塞(middle cerebral artery occlusion,MCAO);苏木精-伊红(hematoxylin and eosin,HE);氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC);放射免疫沉淀法(radioimmunoprecipitation assay,RIPA);苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF);信使RNA(messenger RNA,mRNA);酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA);
溶栓或介入治疗是脑梗死或心肌梗死唯一有效的方法 [1] 。但随着被阻断血管的血流恢复,部分患者的病情不仅没有减轻反而加重。针对这一情况,研究者提出了缺血再灌注损伤的概念,即在组织、器官缺血的基础上恢复血流后损伤反而加重,甚至发生不可逆性损伤的现象 [2] 。目前研究证实这种损伤的发生涉及能量代谢障碍、氧化应激、钙离子等多种机制 [3] 。但无论是何种机制相互作用发生的级联反应,最终都会影响到线粒体的结构和功能。而线粒体是机体的“能量工厂”,是细胞产生ATP的唯一场所。ATP是生物体内最直接的能量来源,可水解生成ADP,同时释放能量。
SIK是一种AMPK家族的丝氨酸/苏氨酸蛋白激酶 [4] 。AMPK是细胞能量变化的保守传感器,可调节线粒体氧化能力、底物利用,影响葡萄糖及脂肪酸的转运等多种途径,通过减少ATP消耗过程来维持能量平衡,是细胞分解代谢中的重要物质 [ 5- 6] 。SIK2和AMPK不仅具有共同的下游靶点,还可被相同的上游激酶肝激酶B1激活,提示SIK2可能具有与AMPK类似的功能 [ 7- 8] 。目前研究发现,SIK在能量代谢、细胞代谢及肿瘤等方面有重要作用。SIK2通过调节蛋白质翻译后乙酰化和磷酸化水平,在细胞自噬体成熟和自噬过程中发挥重要作用,为SIK2对细胞营养和能量代谢的调节作用提供了新的证据 [9] 。HIF-1α可调控肿瘤细胞的代谢以及血管生成,并可以有效调控VEGF的表达,减轻大鼠脑缺血再灌注损伤 [ 10- 11] 。HIF-1α还可激活缺氧介导反应,调节糖酵解,下调有氧磷酸化,并转录活化细胞代谢相关的基因 [12] ,在肿瘤细胞的能量代谢中意义重大。本研究探索了SIK2在大鼠脑缺血再灌注前后对能量代谢相关物质及HIF-1α表达的影响,分析了SIK2表达与能量代谢变化之间的联系,为临床脑梗死患者的治疗提供参考。
1材料与方法
1.1实验动物及分组
4~6周龄的SD雄性大鼠由长沙市天勤生物技术有限公司提供[SCXK(湘)2019-0014]。所有大鼠自然光照饲养1周,正常饮食,保持体重在240~260 g,维持室温25 ℃,湿度60%~70%。本实验在皖南医学院动物保护与伦理委员会的监督下进行。
大鼠随机分为5组,每组5只:①手术对照组:只分离血管不插栓;②缺血对照组:缺血2 h不再灌注;③缺血再灌注组:缺血2 h后再灌注24 h;④腺病毒空载组:腺病毒空载注入大鼠右脑室8 d后缺血2 h再灌注24 h;⑤SIK2过表达组:SIK2过表达腺病毒载体注入大鼠右脑室8 d后缺血2 h再灌注24 h。实验中脑缺血2 h后行为学评分低于2分或高于3分或再灌注后瘫痪、昏迷甚至死亡的大鼠予以排除。
1.2主要材料
A5级栓线为北京西浓科技有限公司产品。苏木素染色液及伊红染色液为北京索莱宝科技有限公司产品;小鼠多克隆抗体抗SIK2(PA1-41208)为美国ThermoFisher Scientific公司产品;兔单克隆抗体抗HIF-1α(bs-20399R)为北京博奥森生物技术有限公司产品;兔多克隆抗体抗β-actin(BL005B)为合肥白鲨生物科技有限公司产品;大鼠ATP ELISA试剂盒(m1460314)为上海酶联生物科技有限公司产品;大鼠ADP ELISA试剂盒(N06210)为上海纪宁实业有限公司产品。引物设计由生工生物工程(上海)股份有限公司完成;腺病毒过表达载体由汉恒生物科技(上海)有限公司合成。RNA扩增仪、荧光定量PCR仪CFX96Touch、蛋白电泳仪MF-10、化学发光凝胶成像系统均为美国BIO-RAD公司产品;多功能酶标仪为美谷分子仪器(上海)有限公司产品。
1.3建立MCAO大鼠模型
大鼠禁食8~10 h后,腹腔注射10%水合氯醛(0.3~0.5 mL/100 g)麻醉,然后仰卧位固定于恒温鼠板上。参照改良Zea-Longa线栓法 [ 13- 15] 建模,分离、暴露右侧颈总、颈外及颈内动脉;颈外动脉做一切口,线栓由此插入颈总动脉;游离颈外动脉,将线栓插入颈内动脉颅内段至线栓标记处,固定线栓,缝合皮肤。2 h后对大鼠进行行为学评分:大鼠行走正常,无神经功能缺损症状为0分;提尾时缺血侧对侧前肢不能完全伸直为1分;行走时向缺血侧对侧转弯为2分;行走时向缺血侧对侧跌倒呈跛行为3分;不能主动行走或有意识丧失为4分 [16] 。分值2~3分为建模成功。拔出线栓,开始灌注。24 h后取脑,–80 ℃冻存或4%多聚甲醛浸泡。
1.4构建腺病毒过表达载体
MCAO模型制备前8 d,选取245~255 g大鼠,经腹腔麻醉后俯卧位于恒温鼠板上。消毒备皮后剪开头皮及黏膜层,暴露颅骨。利用脑立体定位仪做大鼠右脑侧脑室定位,以前囟为原点,向后1 mm,右侧旁开2 mm,垂直向下4.5 mm,钻孔后利用微量注射器缓慢注射腺病毒7 μL(10~15 min),留针5 min后退针、计时。缝合头皮,伤口定时清理消毒,第8天时开始建立MCAO模型。
1.5HE染色观察大鼠脑组织病理学改变
将大鼠脑组织在4%多聚甲醛中浸泡24 h后进行脱水、包埋、切片和染色。脱水:取完整脑组织从视神经交叉处切开,再将前部分脑组织切为二等分,后部分脑组织切为三等分,保证每片脑组织的厚度为2~3 mm(均为矢状面),放入全自动脱水机;包埋:利用包埋机将脱水后的组织做成蜡块备用;切片:10 μm厚度粗切,待切到组织后,调至5 μm厚度精切;染色:利用梯度乙醇和HE染液分别将神经细胞的细胞质和细胞核染成红色和蓝色,中性树胶封片后,光学显微镜下观察细胞结构及形态的改变。
1.6TTC染色观察大鼠脑组织梗死体积
取新鲜脑组织,用等渗氯化钠溶液冲洗干净后放入–20 ℃冰箱中30 min,配制0.5%~2% TTC染色液(现配)装入棕色瓶,注意避光,然后将脑组织沿冠状面切成2~3 mm厚度的薄片5片,避光置于TTC溶液,37 ℃隔水式电热恒温水箱加热15 min,注意保证组织朝下的面统一为靠近延髓方向的那一面或统一为其反面。染色结束后取出脑组织置于4%甲醛溶液中固定,第2天拍照摄片。利用ImageJ 软件测量各个层面的梗死体积,计算脑梗死体积,即脑梗死体积=2×(对侧脑组织体积–缺血侧未梗死体积)。进一步计算梗死体积百分比,即梗死体积百分比=脑梗死体积/对侧脑组织体积×100%。
1.7定量PCR检测SIK2及HIF-1α mRNA表达量
提取右脑皮质梗死中心区脑组织总核糖核酸,加入适量TRIzol(1 mL/50~100 mg脑组织),研磨后离心取上清液,加入适量氯仿(200 μL/1 mL TRIzol),振荡混匀静置15 min后离心取上清液,加入适量异丙醇(0.5 mL/1 mL TRIzol),振荡混匀静置10 min后离心弃上清液,加入适量75%乙醇(1 mL/1 mL TRIzol),振荡悬浮沉淀,离心弃上清液,加入50 μL无RNA酶水振荡混匀,上机检测RNA浓度。加入逆转录试剂盒试剂,利用扩增仪将RNA逆转录成互补DNA,加入引物及SYBR,利用荧光定量PCR仪检测SIK2和HIF-1α的Ct值,结果以2 –ΔΔCt表示。引物序列如下。SIK2 正向:5′-TCCTGCTTCCTGTCACTAT-3′,反向:5′-TCCACGGCTTCTACCATT-3′;HIF-1α 正向:5′-GGAAATGCTGGCTCCCATT-3′,反向:5′-CTGTAACTGGGTCTGCTGGA-3′;β-actin 正向:5′-GCGCAAGTACTCTGTGTGGA-3′,反向:5′-AGGGTGTAAAACGCAGCTCAG-3′。
1.8蛋白质印迹法检测SIK2及HIF-1α蛋白表达量
提取右脑皮质梗死中心区脑组织总蛋白,每100 mg总蛋白加入800 μL裂解液(体积比RIPA裂解液∶PMSF=99∶1),研磨后静置30 min,离心后取上清液即为总蛋白含量。分装后加入5×蛋白上样缓冲液,100 ℃水浴煮10 min后–20 ℃短期储存备用;按照十二烷基硫酸钠–聚丙烯酰胺凝胶电泳试剂盒配制凝胶,经上样、电泳、转膜后,先后加入一抗(1∶1000)和二抗(1∶10 000)孵育,次日即可利用凝胶成像仪器曝光出条带,采用Image Lab软件分析条带灰度值。
1.9ELISA法检测脑组织ATP及ADP含量
按照ELISA试剂盒说明书步骤提取脑组织匀浆,取右脑皮质梗死中心区脑组织,加入一定量事先预冷的磷酸盐缓冲液或等渗氯化钠溶液(每克脑组织加入9 mL磷酸盐缓冲液或等渗氯化钠溶液),研磨后离心取上清液备用;按说明依次加入标准品、样品、酶试剂,温育后洗涤,再依次加入显色液及终止液,5 min内利用多功能酶标仪在450 nm波长处测定每个孔的吸光度,用标准品的浓度和吸光度值计算出标准曲线的回归方程,再计算样品浓度。
1.10统计学方法
采用SPSS 13.0软件进行数据分析。正态分布的计量数据以均数±标准差( )表示,组间比较采用单因素方差分析, P<0.05为差异有统计学意义。
2结果
2.1脑缺血和再灌注大鼠脑组织中SIK2表达变化
与手术对照组比较,缺血对照组及缺血再灌注组SIK2 mRNA和蛋白表达减少,且缺血再灌注组较缺血对照组减少更明显,差异有统计学意义(均 P<0.05),见 图1和 表1。结果提示,脑组织缺血再灌注后SIK2表达减少。
图 1 .
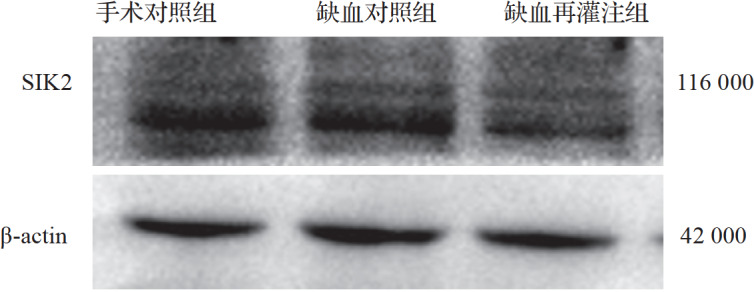
手术对照组、缺血对照组和缺血再灌注组脑组织中盐诱导激酶(SIK)2蛋白表达电泳图
表 1 手术对照组、缺血对照组和缺血再灌注组脑组织盐诱导激酶2表达量比较
Table 1 Comparison of SIK2 levels among brain tissues of sham group, ischemia group and ischemia-reperfusion group
( )
|
组 别 |
n |
mRNA |
蛋白 |
|
手术对照组 |
4 |
0.73±0.09 |
0.98±0.05 |
|
缺血对照组 |
4 |
0.58±0.05 |
0.96±0.04 |
|
缺血再灌注组 |
4 |
0.46±0.10 * |
0.85±0.02 *# |
与手术对照组比较, * P<0.05;与缺血对照组比较, # P<0.05.
2.2各组大鼠皮质区脑组织病理学改变
手术对照组神经细胞形态规则,细胞质丰富,细胞核呈圆形清晰可见,未见空泡状结构及淡染区;缺血对照组缺血中心区淡染,可见少部分神经细胞液化性坏死,出现空泡样结构并呈筛网状;缺血再灌注组出现大面积神经细胞液化性坏死,高倍镜下整个视野布满空泡样结构;腺病毒空载组亦出现大面积神经细胞液化性坏死,高倍镜下整个视野布满空泡样结构;SIK2过表达组部分皮质区淡染,细胞核增多,高倍镜下可见空泡样结构( 图2)。手术对照组每视野(258.0±11.9)个细胞,缺血对照组每视野(239.6±30.2)个细胞,缺血再灌注组每视野(145.2±14.3)个细胞,腺病毒空载组每视野(137.8±19.2)个细胞,SIK2过表达组每视野(181.8±14.5)个细胞。其中,缺血再灌注组细胞计数少于手术对照组和缺血对照组(均 P<0.05),SIK2过表达组细胞计数多于缺血再灌注组和腺病毒空载组(均 P<0.05),而手术对照组与缺血对照组,缺血再灌注组与腺病毒空载组之间细胞计数差异均无统计学意义(均 P>0.05)。结果表明,大鼠脑组织缺血再灌注后神经细胞出现损伤,且再灌注后损伤范围变大,而SIK2过表达可减轻神经细胞的损伤。
图 2 .
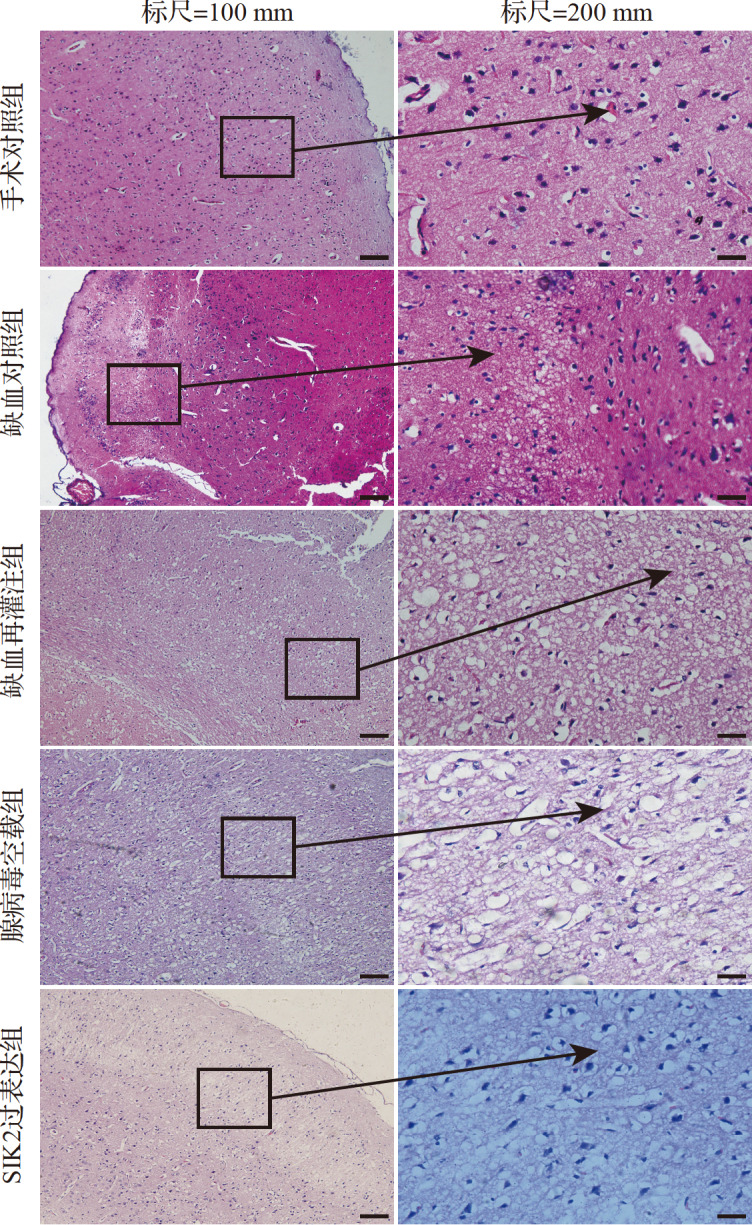
各组脑组织病理学表现(HE染色)手术对照组神经细胞形态规则,细胞质丰富,细胞核呈圆形清晰可见,未见空泡状结构及淡染区;缺血对照组缺血中心区淡染,可见少部分神经细胞液化性坏死,出现空泡样结构呈筛网状;缺血再灌注组出现大面积神经细胞液化性坏死,高倍镜下整个视野布满空泡样结构;腺病毒空载组亦出现大面积神经细胞液化性坏死,高倍镜下整个视野布满空泡样结构;SIK2过表达组部分皮质区淡染,细胞核增多,高倍镜下可见空泡样结构.红色区域为细胞质,蓝色为细胞核.
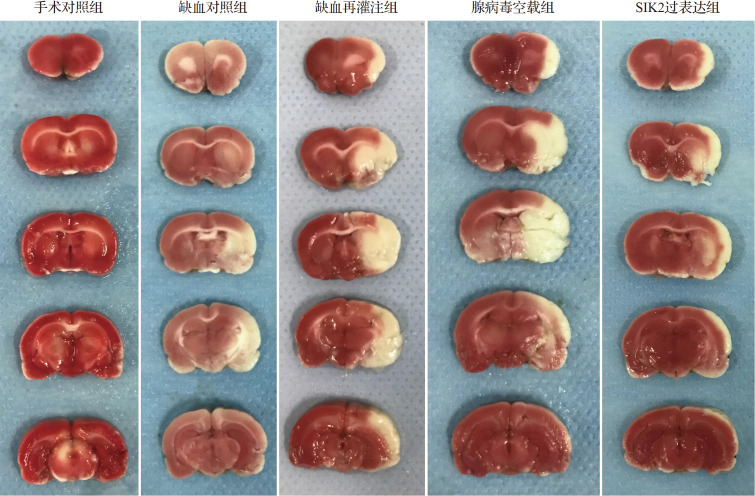
2.3各组大鼠脑组织梗死情况
手术对照组脑组织染色呈正常的红色,无梗死灶;缺血对照组脑组织存在白色梗死灶,面积较小;缺血再灌注组脑组织有明显的白色梗死灶且面积较大;腺病毒过表达组脑组织有明显的白色梗死灶且面积较大;SIK2过表达组出现白色梗死灶,面积较小( 图3)。缺血对照组梗死体积占总体积比为0.07±0.03,缺血再灌注组为0.23±0.01,腺病毒空载组为0.19±0.04,SIK2过表达组为0.10±0.00。其中,缺血对照组较手术对照组梗死体积虽有所增加,但差异无统计学意义( P>0.05);缺血再灌注组较缺血对照组和手术对照组梗死体积均增大(均 P<0.05);SIK2过表达组较缺血再灌注组和腺病毒空载组梗死体积均减小(均 P< 0.05)。结果表明,大鼠脑缺血再灌注后脑组织梗死加重,而SIK2过表达大鼠脑组织缺血再灌注后损伤减轻。
图 3 .
各组脑组织梗死情况比较手术对照组脑组织染色呈正常的红色,无梗死灶;缺血对照组脑组织存在白色梗死灶,面积较小;缺血再灌注组脑组织有明显的白色梗死灶且面积较大;腺病毒空载组脑组织有明显的白色梗死灶且面积较大;SIK2过表达组出现白色梗死灶,面积较小. 红色为正常脑组织,白色为组织梗死区域.
2.4各组大鼠脑组织中HIF-1α表达变化
与手术对照组比较,缺血对照组及缺血再灌注组HIF-1α表达均增加,其中缺血对照组HIF-1α表达增加更为明显(均 P<0.05),而缺血再灌注组与手术对照组差异无统计学意义(均 P>0.05)。与缺血再灌注组比较,SIK2过表达组HIF-1α表达增加( P<0.05),而腺病毒空载组与缺血再灌注组差异无统计学意义( P>0.05),见 图4和 表 2、 3 。结果提示,脑组织缺血再灌注后HIF-1α对脑血管的正调控作用减弱,脑组织损伤加重,而SIK2过表达可促进HIF-1α对脑组织血管侧支循环的影响,减轻缺血再灌注后的脑损伤。
图 4 .
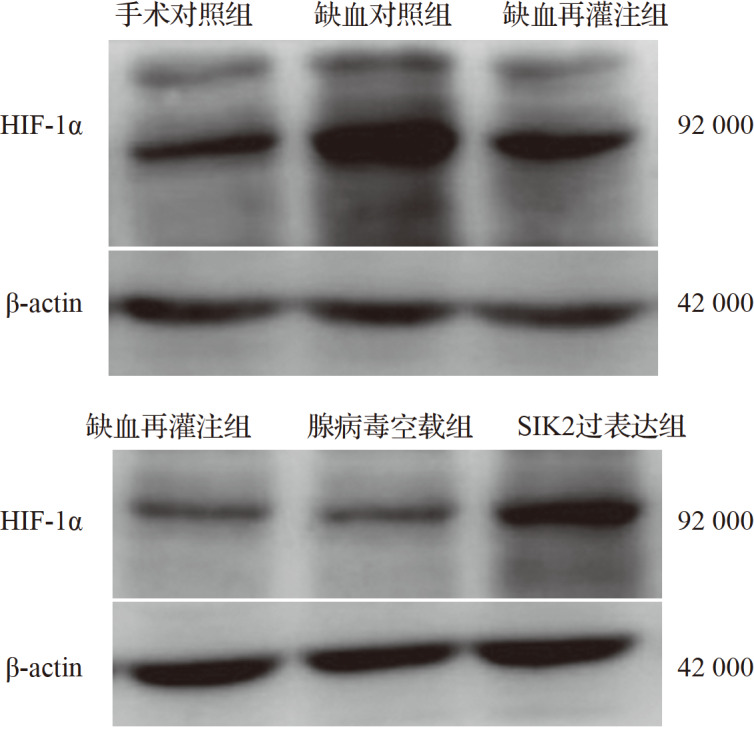
各组脑组织中缺氧诱导因子1α蛋白表达电泳图
|
组 别 |
n |
mRNA |
蛋 白 |
|
手术对照组 |
5 |
0.92±0.11 |
0.77±0.10 |
|
缺血对照组 |
5 |
1.29±0.62 * |
1.00±0.00 * |
|
缺血再灌注组 |
5 |
1.03±0.10 # |
0.86±0.08 # |
与手术对照组比较, * P<0.05;与缺血对照组比较, # P<0.05.
表 3 盐诱导激酶2过表达对缺血再灌注大鼠脑组织中缺氧诱导因子1α表达量的影响
Table 3 The level of HIF-1α in ischemic-reperfusion rat brain tissue with SIK2 overexpression
( )
|
组 别 |
n |
mRNA |
蛋白 |
|
缺血再灌注组 |
5 |
0.92±0.14 |
0.73±0.09 |
|
腺病毒空载组 |
5 |
1.00±0.07 |
0.75±0.08 |
|
SIK2过表达组 |
5 |
1.27±0.07 *# |
1.00±0.09 *# |
与缺血再灌注组比较, * P<0.05;与腺病毒空载组比较, # P<0.05.
2.5各组大鼠脑组织ATP、ADP含量变化
与手术对照组比较,缺血对照组及缺血再灌注组ATP含量均减少(均 P<0.05),而ADP在缺血对照组和缺血再灌注组增多( P<0.05)。与缺血再灌注组和腺病毒空载组比较,SIK2过表达组ATP含量增加,ADP含量减少(均 P<0.05),而腺病毒空载组与缺血再灌注组差异无统计学意义(均 P>0.05),见 表4。结果提示,大鼠脑缺血再灌注后脑细胞供能减少,组织损伤加重,而SIK2过表达大鼠脑缺血再灌注后脑细胞供能增加,损伤减轻。
表 4 各组脑组织中腺苷三磷酸和腺苷二磷酸含量比较
Table 4 The content of ATP and ADP in brain tissues of each group
( ,nmol/L)
|
组 别 |
n |
腺苷三磷酸 |
腺苷二磷酸 |
|
手术对照组 |
5 |
6187±306 |
0.98±0.14 |
|
缺血对照组 |
5 |
5877±244 |
2.08±1.18 |
|
缺血再灌注组 |
5 |
5122±233 *# |
7.38±3.25 *# |
|
腺病毒空载组 |
5 |
5491±295 |
7.08±2.45 |
|
SIK2过表达组 |
5 |
7296±214 △▲ |
0.58±0.28 △▲ |
与手术对照组比较, * P<0.05;与缺血对照组比较, # P<0.05;与缺血再灌注组比较, △ P<0.05;与腺病毒空载组比较, ▲ P<0.05.
3讨论
目前,脑缺血再灌注损伤与脑能量代谢的关联研究已较为深入。AMPK作为细胞内的能量感受器,活化后可抑制消耗ATP的合成代谢过程,启动生成ATP的分解代谢过程,使机体能量代谢保持平衡 [ 17- 18] 。SIK2作为AMPK家族成员,其对能量代谢的影响在脂肪细胞代谢、细胞自噬等方面研究较多 [ 19- 20] ,而其在脑能量代谢中的研究较为少见。本研究初步证明了大鼠脑缺血再灌注过程中SIK2可影响脑组织HIF-1α的表达及ATP、ADP的含量,但SIK2究竟如何调控HIF-1α的表达,以及通过怎样的途径影响ATP的生成,还需要进一步探讨。
本研究通过注射腺病毒SIK2过表达载体,利用脑立体定位体使大鼠局部脑组织中SIK2过表达,在此基础上构建大鼠大脑中动脉缺血再灌注模型,继而检测大鼠脑能量代谢相关蛋白HIF-1α的表达情况及脑组织中ATP、ADP的含量变化。实验结果表明,大鼠脑缺血再灌注后SIK2表达水平下降,神经细胞损伤较缺血时加重,脑组织中HIF-1α表达较缺血时减少,ATP含量减少,ADP含量增加;而在SIK2过表达大鼠脑缺血再灌注后神经细胞损伤减轻,HIF-1α表达上升,脑组织ATP含量增加,ADP含量减少。由此推测,SIK2可能通过调节脑组织ATP的产生,促进脑能量代谢,进而减轻脑缺血再灌注损伤。
HIF-1α作为一种转录调节因子,可与细胞核内DNA上的低氧反应原件结合,调控其下游靶基因VEGF等的转录 [21] 。大量研究表明,HIF-1α在脑缺血性损伤中发挥了神经保护和修复作用。实验证明,在大鼠MCAO模型建立2 h后,经颈外动脉外源性注射HIF-1α质粒,再灌注72 h后脑组织TTC染色脑组织与对照组出现明显差异,而VEGF的表达在再灌注6 h后逐渐上升,24 h时达到高峰;结果证明HIF-1α可在大鼠脑缺血再灌注损伤中促进VEGF的表达,增加侧支循环血管再生,进而起到保护神经元的作用 [10] 。另外,张爱民等 [22] 对缺血再灌注损伤大鼠进行高压氧预处理,并检测了HIF-1/VEGF通路相关蛋白及凋亡相关蛋白的水平。结果证实,大鼠经高压氧预处理后神经功能评分增加,脑梗死面积减小,且HIF-1α、VEGF和抑凋亡蛋白B淋巴细胞瘤2表达上调,说明高压氧预处理减轻大鼠大脑缺氧再灌注损伤的机制与HIF-1α/VEGF通路相关。三白脂素-8作为HIF-1α的特异性抑制剂可有效降低肾癌细胞的ATP、丙酮酸含量及琥珀酸脱氢酶的活性 [23] ,说明HIF-1α在肿瘤细胞中的能量代谢调节作用。本实验结果与上述研究基本保持一致,脑组织缺血再灌注后HIF-1α对脑血管的正调控作用减弱,脑组织损伤加重,而SIK2过表达可促进HIF-1α对脑组织血管侧支循环的影响,减轻缺血再灌注后的脑损伤。
综上所述,本文资料提示SIK2可通过对大鼠脑组织中HIF-1α表达的调控,影响脑组织中能量代谢相关物质的生成,进而减轻脑缺血再灌注后的组织损伤。
COMPETING INTERESTS
所有作者均声明不存在利益冲突
Funding Statement
安徽高校自然科学研究重大项目(KJ2020ZD55);安徽省高校优秀青年人才支持计划(gxyq2018044);皖南医学院校级中青年基金(WK201914)
References
- 1.盛桂芝, 王 波. 超早期溶栓治疗脑梗塞的疗效及影响因素探析[J]. 系统医学, 2019, 4(3): 62-64 ; SHENG Guizhi, WANG Bo. Analysis of the efficacy and influencing factors of ultra-early thrombolytic therapy for cerebral infarction[J]. Systems Medicine, 2019, 4(3): 62-64. (in Chinese)
- 2.刘 磊, 刘丽华, 马玉奎. 脑缺血再灌注损伤机制研究进展[J]. 药学研究, 2016, 35(9): 542-544 ; LIU Lei, LIU Lihua, MA Yukui. Research progress on mechanisms of cerebral ischemia-reperfusion injury[J]. Journal of Pharmaceutical Research, 2016, 35(9): 542-544. (in Chinese)
- 3.郭敏敏, 蔡 乐, 王 勇. 脑缺血再灌注损伤发病机制的研究进展[J]. 世界最新医学信息文摘, 2019, 19(30): 80-81 ; GUO Minmin, CAI Le, WANG Yong. Research progress on pathogenesis of cerebral ischemia-reperfusion injury[J]. World Latest Medicine Information, 2019, 19(30): 80-81. (in Chinese)
- 4.UEBI T, ITOH Y, HATANO O, et al. Involvement of SIK3 in glucose and lipid homeostasis in mice[J/OL] PLoS ONE. . 2012;7(5):e37803. doi: 10.1371/journal.pone.0037803. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.KE R, XU Q, LI C, et al. Mechanisms of AMPK in the maintenance of ATP balance during energy metabolism[J] Cell Biol Int. . 2018;42(4):384–392. doi: 10.1002/cbin.10915. [DOI] [PubMed] [Google Scholar]
- 6.O’NEILL H M, MAARBJERG S J, CRANE J D, et al. AMP-activated protein kinase (AMPK) beta1beta2 muscle null mice reveal an essential role for AMPK in maintaining mitochondrial content and glucose uptake during exercise[J] Proc Natl Acad Sci U S A. . 2011;108(38):16092–16097. doi: 10.1073/pnas.1105062108. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.LIZCANO J M, GÖRANSSON O, TOTH R, et al. LKB1 is a master kinase that activates 13 kinases of the AMPK subfamily, including MARK/PAR-1[J] EMBO J. . 2004;23(4):833–843. doi: 10.1038/sj.emboj.7600110. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.JALEEL M, MCBRIDE A, LIZCANO J M, et al. Identification of the sucrose non-fermenting related kinase SNRK, as a novel LKB1 substrate[J] FEBS Lett. . 2005;579(6):1417–1423. doi: 10.1016/j.febslet.2005.01.042. [DOI] [PubMed] [Google Scholar]
- 9.YANG F C, TAN B C M, CHEN W H, et al. Reversible acetylation regulates salt-inducible kinase (SIK2) and its function in autophagy[J] J Biol Chem. . 2013;288(9):6227–6237. doi: 10.1074/jbc.M112.431239. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.赵 雷. 缺氧诱导因子-1α对脑缺血缺氧性损伤治疗作用的研究[D]. 石家庄: 河北医科大学, 2013 ; ZHAO Lei. Study on the therapeutic effect of hypoxia-inducible factor-1α on cerebral ischemia and hypoxic injury[D]. Shijiazhuang: Hebei Medical University, 2013. (in Chinese)
- 11.宋慧琨. 缺氧诱导因子-1α在脑缺血中的作用及其机制研究[D]. 唐山: 华北理工大学, 2015 ; SONG Huikun. The role and mechanism of hypoxia-inducible factor-1α in cerebral ischemia[D]. Tangshan: North China University of Science and Technology, 2015. (in Chinese)
- 12.SHI H, CHANG Y. Regulations and posttranslational modifications of hypoxia inducible factor-1[J] Acta Biophysica Sinca. . 2012;28(5):373–382. doi: 10.3724/SP.J.1260.2012.20032. [DOI] [Google Scholar]
- 13.张文芳, 王 东, 崔景晶. 最佳线栓头端直径建立对小鼠脑缺血再灌注模型成功率的影响[J]. 中国康复医学杂志, 2019, 34(4): 386-391 ; ZHANG Wenfang, WANG Dong, Cui Jingjing. The best tip diameter of the suture established the middle cerebral artery occlusion mouse model[J]. Chinese Journal of Rehabilitation Medicine, 2019, 34(4): 386-391. (in Chinese)
- 14.李振宗, 赵育梅, 袁 辉. 大鼠线栓法局灶性脑缺血模型的改良[J]. 中国微侵袭神经外科杂志, 2018, 23(9): 419-422 ; LI Zhenzhong, ZHAO Yumei, YUAN Hui. Improvement of the cerebral ischemia model by intraluminal filament in rats[J]. Chinese Journal of Minimally Invasive Neurosurgery, 2018, 23(9): 419-422. (in Chinese)
- 15.LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J] Stroke. . 1989;20(1):84–91. doi: 10.1161/01.STR.20.1.84. [DOI] [PubMed] [Google Scholar]
- 16.郑建峰. 缺血性脑卒中相关大脑中动脉梗阻模型制备的研究[D]. 福州: 福建医科大学, 2016 ; ZHEN Jianfeng. Study on the preparation of a model of middle cerebral artery obstruction associated with ischemic stroke[D]. Fuzhou: Fujian Medical University, 2016. (in Chinese)
- 17.方永奇, 莫镇涛. 脑能量代谢调节机制研究新进展[J]. 广州中医药大学学报, 2011, 28(3): 328-331 ; FANG Yongqi, MO Zhentao. Research progress on the regulation mechanism of brain energy metabolism[J]. Journal of Guangzhou University of Traditional Chinese Medicine, 2011, 28(3): 328-331. (in Chinese)
- 18.HARDIE D G, ROSS F A, HAWLEY S A. AMPK: a nutrient and energy sensor that maintains energy homeostasis[J] Nat Rev Mol Cell Biol. . 2012;13(4):251–262. doi: 10.1038/nrm3311. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.杜 静, 杨 超, 晏耀明, 等. SIK2抑制3T3-L1脂肪细胞脂肪合成的效应及机制[J]. 中国实验诊断学, 2012, 16(8): 1354-1357 ; DU Jing, YANG Chao, YAN Yaoming, et al. The inhibition effect and mechanism of SIK2 on lipogenesis in 3T3-L1 adipocyte[J]. Chinese Journal of Laboratory Diagnosis, 2012, 16(8): 1354-1357. (in Chinese)
- 20.王建校, 李珊珊, 赵珊珊, 等. 盐诱导激酶2的研究进展[J]. 生物物理学报, 2014, 30(2): 93-100 ; WANG Jianxiao, LI Shanshan, ZHAO Shanshan, et al. Research progress of salt-induced kinase 2[J]. Acta Biophysica Sinica, 2014, 30(2): 93-100. (in Chinese)
- 21.ZHANG Z, YAO L, YANG J, et al. PI3K/Akt and HIF‑1 signaling pathway in hypoxia‑ischemia (Review)[J] Mol Med Rep. . 2018;18(4):3547–3554. doi: 10.3892/mmr.2018.9375. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.张爱民, 蒋宗滨. 高压氧预处理通过HIF-1α/VEGF通路减轻大脑缺血再灌注损伤[J]. 中国病理生理杂志, 2018, 34(11): 2048-2053 ; ZHANG Aiming, JIANG Zongbing. Role of HIF-1α/VEGF pathway in treatment of cerebral ischemia-reper fusion injury by hyperbaric oxygen pretreatment[J]. Chinese Journal of Pathophysiology, 2018, 34(11): 2048-2053. (in Chinese)
- 23.张永春, 谷 江, 董安涛, 等. 三白脂素-8抑制缺氧诱导因子-1α对肾癌细胞能量代谢的影响[J]. 贵州医药, 2018, 42(8): 926-929 ; ZHANG Yongchun, GU Jiang, DONG Antao, et al. Effect of Man A on energy metabolism of renal carcinoma cells when HIF-1α inhibited[J]. Guizhou Medical Journal, 2018, 42(8): 926-929. (in Chinese)