Abstract
目的:
探讨高纤复合膳食纤维对妊娠糖尿病(GDM)患者血糖控制及妊娠结局的影响。
方法:
选取 112 例浙江大学医学院附属妇产科医院收治的孕中期 GDM 患者为研究对象,随机分为膳食纤维组( n=56)和对照组( n=56),两组患者均接受基础营养治疗方案,膳食纤维组在此基础上添加膳食纤维方案(9.5 g膳食纤维/d,餐前服用),共干预 8 周。每周检测空腹血糖、餐后2 h末梢血糖(2 h BG),产后42 d进行口服葡萄糖耐量试验(OGTT),并记录围产结局。
结果:
干预 8 周内膳食纤维组患者 2 h BG 低于对照组( P<0.05);第 3~8 周血糖控制合格率高于对照组( P<0.05或 P<0.01);产后 OGTT 服糖后2 h血糖值及糖耐量减低率低于对照组,且 OGTT 合格率高于对照组(均 P<0.01);胎膜早破、新生儿高胆红素血症发生率低于对照组( P<0.05或 P<0.01)。
结论:
高纤复合膳食纤维干预可有效控制 GDM 患者孕期血糖水平,改善围产期不良妊娠结局,减少产后糖耐量减低发生率。
Abstract
Objective:
To investigate the effect of dietary fiber on blood glucose and pregnancy outcomes in patients with gestational diabetes mellitus (GDM).
Methods:
One hundred and twelve patients with GDM in the second trimester of pregnancy were recruited from Women’s Hospital, Zhejiang University School of Medicine. Patients were randomized into two groups with 56 in each group: the control group received basic nutrition support; while the dietary fiber group were given additional dietary fiber (9.5 g total dietary fiber per day) before meals in addition to basic nutrition support. Intervention for all cases lasted for 8 weeks. Fasting blood glucose and 2 h postprandial blood glucose (2 h BG) were measured every week, and oral glucose tolerance test (OGTT) was performed at 42 d postpartum to evaluate the glycemic outcomes. Perinatal outcomes were recorded.
Results:
The dietary fiber intervention markedly improved 2 h BG in patients with GDM and significantly elevated the glucose compliance rate from the 3rd to 8th week compared to the control group ( P<0.05 or P<0.01). OGTT 2 h glucose and the incidence of impaired glucose tolerance in the dietary fiber group were significantly lower than those in the control group, while the glucose compliance rate was significantly higher than that in the control group (all P<0.01). Moreover, the rates of adverse perinatal outcomes, such as premature rupture of membranes and neonatal hyperbilirubinemia were declined in the dietary fiber group ( P<0.05 or P<0.01).
Conclusion:
Dietary fiber intervention can ameliorate hyperglycemia in GDM patients, improve perinatal outcomes and reduce the incidence of postpartum impaired glucose tolerance.
Keywords: Dietary fiber, Gestational diabetes mellitus, Clinical nutrition, Impaired glucose tolerance, Pregnancy outcome, Randomized controlled trial
妊娠糖尿病(gestational diabetes mellitus,GDM);医学营养治疗(medical nutrition therapy,MNT);口服葡萄糖耐量试验(oral glucose tolerance test,OGTT);空腹血浆血糖(fasting plasma glucose,FPG);空腹末梢血糖(fasting blood glucose,FBG);餐后 2 h 末梢血糖(2 h postprandial blood glucose,2 h BG);身体质量指数(body mass index,BMI);成纤维细胞生长因子(fibroblast growth factor,FGF);
GDM 是妊娠期最常见的并发症之一。不合理的饮食模式、久坐不动的生活方式以及高龄孕产妇的不断增加使全世界 GDM 的发生率不断攀升 [ 1- 2] 。目前,我国 GDM的 发生率已高达 17.5%~18.9% [ 3- 4] 。长期高糖妊娠状态易引起早产、剖宫产、死产、胎儿畸形、巨大儿等诸多不良母婴结局,且孕妇产后发生 2 型糖尿病的风险增加 7 倍 [5] 。鉴于 GDM 的危害,美国糖尿病协会在 20 世纪 90 年代中期就提出了个体化的糖尿病 MNT 方案。通过合理的饮食摄入方案,尤其是高膳食纤维/低游离糖的膳食模式,能够提高孕妇对自身糖脂代谢的调节能力,降低 GDM 患者妊娠期间胰岛素使用率,减少 GDM 相关不良妊娠结局的发生 [6] 。然而在临床实践中,传统的 MNT 方案会受到多种因素的影响,GDM 患者依从性差,导致效果不佳。为探索临床干预 GDM 新思路、弥补传统 MNT 方案的不足,本研究采用开放性随机对照临床试验观察高纤复合膳食纤维在 MNT 中的作用,研究膳食纤维干预对 GDM 患者血糖管理及母婴妊娠结局的影响。
1对象与方法
1.1对象
选取 2018 年 5 月 1 日—11 月 30 日在浙江大学医学院附属妇产科医院定期产检的 GDM 患者为研究对象,共 112 例。患者年龄为 22~43 岁,平均(33.6±4.3)岁;平均孕周为(26.3±1.9)周;初产妇 53 例,占 47.3%,经产妇 59 例,占 52.7%。GDM 诊断标准:75 g OGTT 结果 FPG 值至少5.1 mmol/L,OGTT 1 h 血糖值至少10.0 mmol/L,OGTT 2 h 血糖值至少8.5 mmol/L,满足上述任一标准即可诊断为 GDM [7] 。排除标准:①多胎妊娠者;②孕前即患有糖尿病者;③合并高血压以及其他内外科疾病者;④使用降糖药物或胰岛素控制血糖者;⑤因药物滥用或精神因素导致观察不能依从者;⑥正在服用膳食纤维营养补充剂、保健品者。
因本研究中 GDM 患者的年龄跨度较大,为保证均衡,首先将研究对象按照年龄排序,然后采用随机数字表法分成膳食纤维组( n=56)和对照组( n=56)。两组均接受基础营养治疗方案,膳食纤维组在营养治疗方案的基础上添加膳食纤维方案。干预前两组患者年龄、入组孕周、孕前 BMI、产次等差异均无统计学意义(均 P>0.05),孕期增重差异无统计学意义( P>0.05),提示两组基线资料均衡可比,孕期营养摄入与运动情况尚可匹配( 表 1)。
表 1 膳食纤维组与对照组基线资料比较
Table 1 Baseline information of the dietary fiber group and the control group
[ 或 n(%)]
|
组别 |
n |
年龄(岁) |
入组孕周(周) |
孕前 BMI(kg/m 2) |
产次 |
孕期增重(kg) |
|
|
初产妇 |
经产妇 |
||||||
|
膳食纤维组 |
56 |
33.4±4.4 |
26.6±2.0 |
22.8±3.1 |
27(48.2) |
29(51.8) |
11.46±4.92 |
|
对照组 |
56 |
33.9±4.1 |
26.0±1.8 |
21.9±3.1 |
26(51.8) |
30(53.6) |
10.94±3.17 |
|
t/ χ 2 值 |
— |
–0.577 |
1.751 |
1.540 |
0.036 |
0.660 |
|
|
P值 |
— |
>0.05 |
>0.05 |
>0.05 |
>0.05 |
>0.05 |
“—”:无相关数据.BMI:身体质量指数.
本研究通过浙江大学医学院附属妇产科医院伦理委员会审批(20171032),所有患者均签署知情同意书。
1.2基础营养治疗方案
患者入组后至少参加一次 GDM 一日门诊学习和实践,接受营养医师关于 GDM 的营养宣教及运动指导。营养医师根据患者身高、孕前 BMI、孕期增重、膳食营养摄入情况以及体力活动水平评估患者所需能量,制定营养食谱。能量计算公式如下:妊娠中期能量=(身高–105)kg×能量系数(25~30 kcal/kg)+300 kcal (1 kcal =4.186 KJ);妊娠晚期能量=(身高–105)kg×能量系数(25~30 kcal/kg)+450 kcal [8] 。一日食谱中蛋白质供能 15%~20%,脂肪供能 25%~35%,碳水化合物供能 45%~60%。为了加深患者对营养食谱的理解,营养厨师会在营养师的监督下完成指定能量营养餐的制作,让患者通过亲自品尝的方式对各类食物的摄入量有直观的认识。营养师要教会患者使用食物交换份法在家中烹制满足营养需求的各类膳食;教会患者正确记录饮食日记、运动日记和血糖记录。患者定期与营养师沟通交流,营养师对于不合要求的膳食及时调整、指导,同时督促患者每日运动打卡,确保两组患者膳食结构、关键营养素摄入和日运动量相近。
1.3膳食纤维方案
《中国糖尿病医学营养治疗指南(2013)》推荐糖尿病患者膳食纤维摄入量为 25 ~30 g/d [9] 。膳食纤维组在对照组的基础上每日增加高纤复合膳食纤维粉(瑞康能,珠海市爱迈德生物生物科技有限公司)一包,中餐前冲服,共干预 8 周。该膳食纤维粉由燕麦纤维、小麦纤维、大豆纤维、玉米纤维四种膳食纤维复合组成,每包含膳食纤维 9.5 g,具体营养成分见 表 2。
|
营养素 |
含量(每 18 g 纤维粉) |
营养素参考值(%) * |
|
能量 |
46.5 kcal |
2.0 |
|
蛋白质 |
1.7 g |
3.0 |
|
脂肪 |
0.3 g |
1.0 |
|
碳水化合物 |
3.7 g |
1.0 |
|
膳食纤维 |
9.5 g |
38.0 |
|
钠 |
8.6 mg |
0.0 |
* 该营养素占每日推荐量的百分比.
1.4随防及监测指标
两组患者均于干预前统一在营养门诊检测早餐前 FBG 及早餐后 2 h BG。开始干预后每周复诊一次,门诊检测早餐前 FBG 及早餐后 2 h BG。患者产后 42 d 复查 OGTT,检测 FPG 和 OGTT 2 h 血糖值。通过电子病历系统收集并记录患者的妊娠结局。末梢血糖控制合格标准 [10] :FBG至少5.3 mmol/L且 2 h BG 至少 6.7 mmol/L。产后 42 d OGTT合格标准为FPG小于6.1 mmol/L且 OGTT 2 h血糖值小于 7.8 mmol/L;FPG至少 6.1 mmol/L但小于 7.0 mmol/L且 OGTT 2 h 血糖值小于7.8 mmol/L为 FPG 受损;FPG 小于 7.0 mmol/L且 OGTT 2 h 血糖值至少 7.8 mmol/L但不小于11.1 mmol/L 为糖耐量减低 [11] 。
1.5统计学方法
采用 Excel 软件进行数据整理,SPSS 23.0 软件进行统计分析。计量资料经正态性检验后以均数±标准差( )描述,两组间比较采用独立样本 t检验;计数资料以例数和百分率[ n(%)]描述,两组间比较采用 χ 2检验或 Fisher 确切概率法。 P<0.05 表示差异有统计学意义。
2结果
2.1膳食纤维组与对照组末梢血糖水平比较
膳食纤维干预前,两组 FBG 及 2 h BG 差异均无统计学意义(均 P>0.05);干预8周内,两组FBG差异均无统计学意义(均 P>0.05),但膳食纤维组 2 h BG 均低于对照组(均 P<0.05),见 图 1。结果提示,膳食纤维干预能降低 GDM 患者 2 h BG 水平。
图 1 .
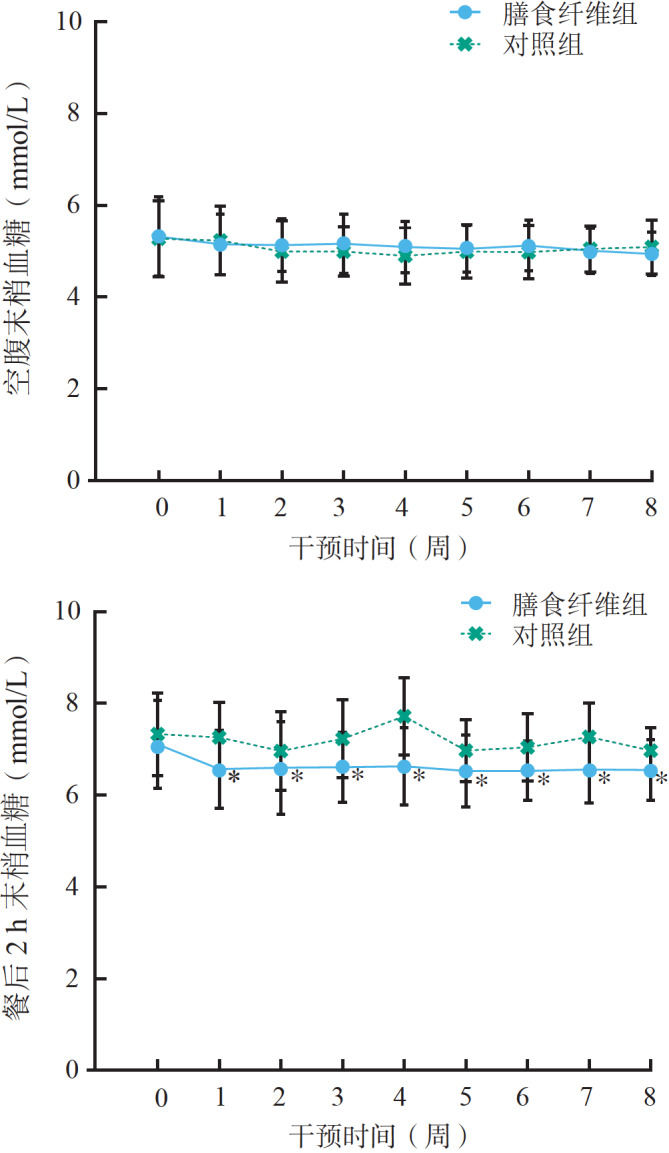
膳食纤维组和对照组患者干预 8 周血糖水平变化趋势与对照组比较,<0.05
两组血糖控制合格率见 表 3。膳食纤维干预前及干预后两周内两组血糖控制合格率差异无统计学意义(均 P>0.05)。干预第 3 ~第 8 周,膳食纤维组血糖控制合格率高于对照组,差异均有统计学意义( P<0.05 或 P<0.01)。结果提示,膳食纤维干预能提高 GDM 患者血糖控制合格率。
表 3 膳食纤维组与对照组干预 8 周血糖控制合格率比较
Table 3 Comparison of the glucose compliance rate during 8 weeks between the dietary fiber group and the control group
[ n(%)]
|
组别 |
n |
第 0 周 |
第 1 周 |
第 2 周 |
第 3 周 |
第 4 周 |
第 5 周 |
第 6 周 |
第 7 周 |
第 8 周 |
|
膳食纤维组 |
56 |
9(16.1) |
24(42.9) |
26(46.4) |
29(51.8) |
30(53.6) |
38(67.9) |
37(66.1) |
37(66.1) |
40(71.4) |
|
对照组 |
56 |
8(14.3) |
15(26.8) |
19(33.9) |
13(23.2) |
17(30.4) |
25(44.6) |
23(41.1) |
18(32.1) |
18(32.1) |
|
χ 2 值 |
— |
0.069 |
3.187 |
1.820 |
9.752 |
6.196 |
6.132 |
7.036 |
12.897 |
17.308 |
|
P值 |
— |
>0.05 |
>0.05 |
>0.05 |
<0.01 |
<0.05 |
<0.05 |
<0.01 |
<0.01 |
<0.01 |
“—”:无相关数据.
2.2膳食纤维组与对照组产后 42 d OGTT 结果比较
两组产后 42 d OGTT 检测结果、血糖控制合格率、FPG 受损率以及糖耐量减低率见 表 4。两组 FPG 水平、FPG 合格率和 FPG 受损率差异均无统计学意义(均 P>0.05);膳食纤维组 OGTT 2 h 血糖值和糖耐量减低率均低于对照组(均 P<0.01),而 OGTT 2 h 血糖合格率及 OGTT 合格率均高于对照组(均 P<0.01)。结果提示,膳食纤维干预可降低 GDM 患者产后 42 d OGTT 2 h 血糖水平,改善GDM 患者产后糖耐量异常发生率,提高 OGTT 2 h血糖合格率及 OGTT 合格率。
表 4 膳食纤维组与对照组产后 42 d OGTT 血糖控制率比较
Table 4 Comparison of the compliance rates for OGTT after postpartum between the dietary fiber group and the control group
[( )或%]
|
组别 |
n |
FPG(mmol/L) |
OGTT 2 h 血糖(mmol/L) |
FPG€合格率 |
OGTT 2 h 血糖合格率 |
OGTT€合格率 |
FPG€受损率 |
糖耐量减低率 |
|
膳食纤维组 |
56 |
5.18±0.56 |
7.30±1.30 |
96.4 |
78.6 |
76.8 |
3.6 |
17.9 |
|
对照组 |
56 |
5.00±0.48 |
8.07±1.60 |
98.2 |
39.3 |
39.3 |
1.8 |
55.4 |
|
t/ χ 2 值 |
— |
1.761 |
–2.784 |
0.000 |
17.855 |
16.168 |
0.000 |
16.967 |
|
P值 |
— |
>0.05 |
<0.01 |
>0.05 |
<0.01 |
<0.01 |
>0.05 |
<0.01 |
“—”:无相关数据.OGTT:口服葡萄糖耐量试验;FPG:空腹血浆血糖.
2.3膳食纤维组与对照组妊娠结局比较
两组早产、剖宫产、产道裂伤、胎儿窘迫、巨大儿、低出生体重儿发生率差异均无统计学意义(均 P>0.05);膳食纤维组未发生新生儿窒息,且胎膜早破、新生儿高胆红素血症发生率低于对照组( P<0.05 或 P<0.01)。见表5。结果提示,膳食纤维干预可降低GDM患者胎膜早破、新生儿高胆红素血症及窒息发生率,改善围产期不良妊娠结局。
表 5 膳食纤维组与对照组妊娠结局比较
Table 5 Comparison of the pregnancy outcomes between the dietary fiber group and the control group
[ n(%)]
|
组 别 |
n |
产 妇 |
新生儿 |
||||||||
|
早 产 |
剖宫产 |
产道裂伤 |
胎儿窘迫 |
胎膜早破 |
巨大儿 |
低出生体重儿 |
高胆红素血症 |
新生儿窒息 |
|||
|
膳食纤维组 |
56 |
6(10.7) |
31(55.4) |
13(23.2) |
7(12.5) |
7(12.5) |
5(8.9) |
6(10.7) |
5(8.9) |
0(0.0) |
|
|
对照组 |
56 |
9(16.1) |
24(42.9) |
15(26.8) |
10(17.9) |
16(28.6) |
8(14.3) |
4(7.1) |
21(37.5) |
6(10.7) |
|
|
χ 2 值 |
— |
0.693 |
1.751 |
0.190 |
0.624 |
4.432 |
0.783 |
0.439 |
12.823 |
— |
|
|
P值 |
— |
>0.05 |
>0.05 |
>0.05 |
>0.05 |
<0.05 |
>0.05 |
>0.05 |
<0.01 |
<0.05 * |
“—”:无相关数据. *Fisher 确切概率法.
3讨论
为了供给胎儿生长所需的营养物质,母体激素水平会出现复杂变化,妊娠中晚期会出现进行性胰岛素抵抗和糖耐量下降。这种可代偿的胰岛素抵抗可能会发展成为病理性的胰岛素抵抗,即 GDM。目前,GDM 较为公认的发病原因是患者出现胰岛素分泌不足和胰岛素抵抗,但其具体发病机制尚不明确。连续测量中晚期 GDM 患者胰岛素敏感性后发现,胰岛素促进葡萄糖利用、抑制葡萄糖和脂肪酸生成的能力进行性减弱,且与健康孕妇相比,胰岛β细胞补偿胰岛素抵抗的能力损失近 67% [12] 。在一项产后胰岛素敏感性研究中,GDM 患者相较于健康孕妇也表现出更高的胰岛素抵抗 [13] ,为产后 2 型糖尿病的发生埋下了隐患。不仅如此,宫内高血糖暴露与子代成年后超重及代谢综合征有关 [ 14- 15] 。研究表明,GDM 后代患 2 型糖尿病的基因易感性增加,胰岛素分泌功能受损 [ 16- 17] 。
膳食纤维对于血糖稳态正向调节作用。膳食纤维广泛存在于全谷物如小麦、玉米、燕麦、大豆等和各类蔬菜水果中,以可溶和不可溶的形式在体内起到增加胃内容物容积、延缓胃排空速率及增强饱腹感的作用,进而减少小肠对糖的吸收、减缓餐后血糖上升速度、降低血浆胰岛素水平、增强胰岛素敏感性 [ 18- 20] 。美国“护士健康研究”队列跟踪 8 年发现,总膳食纤维摄入量与 GDM 风险密切相关,总膳食纤维每增加10 g/d,GDM 发病风险降低 26% [21] 。此外,GDM 患者体内脂联素水平低于健康孕妇,而高膳食纤维饮食可上调血清脂联素水平 [ 22- 23] ;动物干预实验表明,可溶性膳食纤维可增加糖尿病模型鼠肠道丁酸含量,并通过调节组蛋白去乙酰化酶活性、活化线粒体功能及提高能量代谢的方式促进胰岛素敏感性 [24] 。以上结果提示膳食纤维增强胰岛素敏感性、改善糖耐量的潜在机制。本文资料中,GDM 患者每日补充高纤复合膳食纤维粉9.5 g能有效控制 2 h BG 水平,并从干预第一周开始高纤复合膳食纤维就表现出一定的降血糖作用;膳食纤维组血糖控制合格率从第三周开始即高于对照组,提示高纤复合膳食纤维粉具有显著的血糖控制效果。
超过 10%的 GDM 患者在生育后会发生糖耐量减低的症状,其余 GDM 患者 20%~60% 在产后 5~10 年罹患 2 型糖尿病 [25] 。FGF21 在 GDM 患者体内呈高表达状态,而 FGF21 升高可增加糖脂代谢紊乱的发生风险 [ 26- 27] 。研究显示,膳食纤维干预可下调模型鼠肝脏 FGF21 水平,激活胰岛素信号通路,降低胰岛素抵抗指数,改善小鼠代谢紊乱状态 [28] 。此外,GDM 患者产后糖耐量减低与胰岛β细胞功能失调密切相关 [29] 。膳食纤维干预可升高 GDM 患者 处置指数,而处置 指数升高提示胰岛功能良好,可见膳食纤维可通过改善胰岛β细胞功能提高 GDM 患者产后糖耐量水平 [30] 。本研究追踪患者产后 OGTT 血糖水平变化,发现膳食纤维组OGTT 2 h血糖低于对照组。进一步比较后发现,膳食纤维组 OGTT 2 h血糖及 OGTT 合格率均大于对照组,而糖耐量减低率小于对照组。该结果提示,孕期膳食纤维干预对产后 OGTT 结果有正向调节作用,可有效改善 GDM 患者产后糖耐量减低症状。本文资料中,GDM 患者 FBG 及产后 OGTT结果FPG 超标者所占比例不高,空腹末梢血糖控制情况、产后 OGTT结果FPG 合格率及 FPG 受损率的差异无统计学意义。
高血糖与妊娠不良结局研究发现,孕期血糖值增高与早产、肩难产、产伤、先兆子痫及新生儿高胆红素血症发生成正相关 [31] 。早在 20 世纪50 年代,Pedersen 教授 [32] 就提出了母体高血糖状态引起胎儿血糖上升进而引发胎体高胰岛素血症的观点。胰岛素水平升高使胎儿宫内代谢合成加快,巨大儿风险增加 [33] ;同时,胎体耗氧相对增加,易引起宫内窘迫及新生儿窒息 [34] ;慢性胎儿低氧血症还将诱发胎儿促红细胞生成素增多,引起红细胞增多症,出生后有核红细胞破坏引起高胆红素血症 [ 35- 36] 。此外,胎儿高血糖状态会引起渗透性利尿,羊水容积增加,从而导致宫腔压力增高,出现胎膜早破 [33] 。本文资料中,膳食纤维组胎膜早破和新生儿高胆红素血症发生率均低于对照组,且未发生新生儿窒息病例,提示膳食纤维干预对改善 GDM 患者母婴结局有积极意义。其他结局指标差异无统计学意义,可能与本次研究样本量有限、 GDM 患者的综合诊疗管理及个体差异有关。
综上,高纤复合膳食纤维干预可有效控制GDM 患者孕期血糖水平,改善围产期不良妊娠结局,减少产后糖耐量减低。临床实践中,对于GDM 患者的综合管理往往会出现临床医嘱严格执行、营养医嘱却难以长期遵从的问题。本研究通过额外补充膳食纤维方案,配合 MNT 在 GDM 患者孕期血糖管理中发挥积极作用,操作方便、效果明显,弥补了患者执行力不强、依从性不高的缺陷。本研究不足之处主要是未对两组患者膳食摄入的主要营养素及运动情况进行量化比较,也未对胰岛素、稳态模型评估胰岛素抵抗指数等客观反映胰岛素抵抗的指标分析比较。此外,高纤复合膳食纤维干预对孕期血糖代谢调节以及改善母婴结局影响的分子机制有待进一步研究。
COMPETING INTERESTS
所有作者均声明不存在利益冲突
Funding Statement
浙江省重点研发计划(2018C03010)
References
- 1.FERRARA A. Increasing prevalence of gestational diabetes mellitus: a public health perspective[J] Diabetes Care. . 2007;30(Supplement 2):S141–S146. doi: 10.2337/dc07-s206. [DOI] [PubMed] [Google Scholar]
- 2.GUARIGUATA L, LINNENKAMP U, BEAGLEY J, et al. Global estimates of the prevalence of hyperglycaemia in pregnancy[J] Diabetes Res Clin Pract. . 2014;103(2):176–185. doi: 10.1016/j.diabres.2013.11.003. [DOI] [PubMed] [Google Scholar]
- 3.WEI Y, YANG H, ZHU W, et al. International association of diabetes and pregnancy study group criteria is suitable for gestational diabetes mellitus diagnosis: further evidence from China[J]. Chin Med J (Engl), 2014, 127(20): 3553-3556 . [PubMed]
- 4.ZHU W W, FAN L, YANG H X, et al. Fasting plasma glucose at 24–28 weeks to screen for gestational diabetes mellitus[J]. Diabetes Care, 2013, 36(7): 2038-2040 . [DOI] [PMC free article] [PubMed]
- 5.JIWANI A, MARSEILLE E, LOHSE N, et al. Gestational diabetes mellitus: results from a survey of country prevalence and practices[J] J Maternal-Fetal Neonatal Med. . 2012;25(6):600–610. doi: 10.3109/14767058.2011.587921. [DOI] [PubMed] [Google Scholar]
- 6.MORENO-CASTILLA C, MAURICIO D, HERNANDEZ M. Role of medical nutrition therapy in the management of gestational diabetes mellitus[J] Curr Diab Rep. . 2016;16(4):22. doi: 10.1007/s11892-016-0717-7. [DOI] [PubMed] [Google Scholar]
- 7.METZGER B E, GABBE S G, PERSSON B, et al. International association of diabetes and pregnancy study groups recommendations on the diagnosis and classification of hyperglycemia in pregnancy[J] Diabetes Care. . 2010;33(3):676–682. doi: 10.2337/dc09-1848. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.中华人民共和国国家卫生健康委员会. WS/T 601—2018 妊娠期糖尿病患者膳食指导[S]. 北京: 中华人民共和国卫生行业标准, 2018: 2-3 ; National Health Commission of the People’s Republic of China. WS/T 601—2018 Dietary guide for patients with gestational diabetes mellitus (GDM)[S]. Beijing: Sanitation Standards of the People’s Republic of China, 2018: 2-3. (in Chinese)
- 9.中华医学会糖尿病学分会,中国医师协会营养医师专业委员会. 中国糖尿病医学营养治疗指南(2013)[J]. 中华糖尿病杂志, 2015, 7(2): 73-88 ; Chinese Diabetes Society, Nutritionist Committee, Chinese Medical Doctor Association. Chinese guideline for the medical nutrition therapy of type 2 diabetes mellitus (2013)[J]. Chinese Journal of Diabetes Mellitus, 2015,7(2): 73-88. (in Chinese)
- 10.中华医学会妇产科学分会产科学组, 中华医学会围产医学分会妊娠合并糖尿病协作组. 妊娠合并糖尿病诊治指南(2014)[J]. 中华围产医学杂志, 2014, 17(8): 537-545 ; Obstetrics group, Chinese Society of Obstetrics and Gynecology, Chinese Medical Association, Group of Pregnancy with Diabetes Mellitus, Chinese Society of Perinatal Medicine, Chinese Medical Association. Diagnosis and therapy guideline of pregnancy with diabetes mellitus (2014)[J]. Chinese Journal of Perinatal Medicine, 2014,17(8): 537-545. (in Chinese)
- 11.中华医学会糖尿病学分会. 中国 2 型糖尿病防治指南(2017 年版)[J]. 中华糖尿病杂志, 2018, 10 (1): 4-67 ; Chinese Diabetes Society. Chinese guideline for the prevention and treatment of type 2 diabetes mellitus(2017 edition)[J]. Chinese Journal of Diabetes Mellitus, 2018, 10(1): 4-67. (in Chinese)
- 12.XIANG A H, PETERS R K, TRIGO E, et al. Multiple metabolic defects during late pregnancy in women at high risk for type 2 diabetes[J] Diabetes. . 1999;48(4):848–854. doi: 10.2337/diabetes.48.4.848. [DOI] [PubMed] [Google Scholar]
- 13.HOMKO C, SIVAN E, CHEN X, et al. Insulin secretion during and after pregnancy in patients with gestational diabetes mellitus[J] J Clin Endocrinol Metab. . 2001;86(2):568–573. doi: 10.1210/jcem.86.2.7137. [DOI] [PubMed] [Google Scholar]
- 14.CLAUSEN T D, MATHIESEN E R, HANSEN T, et al. High prevalence of type 2 diabetes and pre-diabetes in adult offspring of women with gestational diabetes mellitus or type 1 diabetes: the role of intrauterine hyperglycemia[J] Diabetes Care. . 2008;31(2):340–346. doi: 10.2337/dc07-1596. [DOI] [PubMed] [Google Scholar]
- 15.CLAUSEN T D, MATHIESEN E R, HANSEN T, et al. Overweight and the metabolic syndrome in adult offspring of women with diet-treated gestational diabetes mellitus or type 1 diabetes[J] J Clin Endocrinol Metab. . 2009;94(7):2464–2470. doi: 10.1210/jc.2009-0305. [DOI] [PubMed] [Google Scholar]
- 16.KELSTRUP L, DAMM P, MATHIESEN E R, et al. Insulin resistance and impaired pancreatic beta-cell function in adult offspring of women with diabetes in pregnancy[J] J Clin Endocrinol Metab. . 2013;98(9):3793–3801. doi: 10.1210/jc.2013-1536. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.LAUENBORG J, GRARUP N, DAMM P, et al. Common type 2 diabetes risk gene variants associate with gestational diabetes[J] J Clin Endocrinol Metab. . 2009;94(1):145–150. doi: 10.1210/jc.2008-1336. [DOI] [PubMed] [Google Scholar]
- 18.ISMAIEL M, YANG H, MIN C. Dietary fiber role in type 2 diabetes prevention[J] British Food J. . 2016;118(4):961–975. doi: 10.1108/BFJ-08-2015-0297. [DOI] [Google Scholar]
- 19.QI X, AL‐GHAZZEWI F H, TESTER R F. Dietary Fiber, gastric emptying, and carbohydrate digestion: a mini-review[J] Starch ‐ Stärke. . 2018;70(9-10):1700346. doi: 10.1002/star.201700346. [DOI] [Google Scholar]
- 20.GOUSETI O, LOVEGROVE A, KOSIK O, et al. Exploring the role of cereal eietary fiber in digestion[J] J Agric Food Chem. . 2019;67(30):8419–8424. doi: 10.1021/acs.jafc.9b01847. [DOI] [PubMed] [Google Scholar]
- 21.ZHANG C, LIU S, SOLOMON C G, et al. Dietary fiber intake, dietary glycemic load, and the risk for gestational diabetes mellitus[J] Diabetes Care. . 2006;29(10):2223–2230. doi: 10.2337/dc06-0266. [DOI] [PubMed] [Google Scholar]
- 22.ESPOSITO K, NAPPO F, GIUGLIANO F, et al. Meal modulation of circulating interleukin 18 and adiponectin concentrations in healthy subjects and in patients with type 2 diabetes mellitus[J] Am J Clin Nutrition. . 2003;78(6):1135–1140. doi: 10.1093/ajcn/78.6.1135. [DOI] [PubMed] [Google Scholar]
- 23.NOURELDEEN A F H, QUSTI S Y, AL-SEENI M N, et al. Maternal leptin, adiponectin, resistin, visfatin and tumor necrosis factor-alpha in normal and gestational diabetes[J] Indian J Clin Biochem. . 2014;29(4):462–470. doi: 10.1007/s12291-013-0394-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.LI L, PAN M, PAN S, et al. Effects of insoluble and soluble fibers isolated from barley on blood glucose, serum lipids, liver function and caecal short-chain fatty acids in type 2 diabetic and normal rats[J] Food Chem Toxicol. . 2020;135:110937. doi: 10.1016/j.fct.2019.110937. [DOI] [PubMed] [Google Scholar]
- 25.BUCHANAN T A, XIANG A H, PAGE K A. Gestational diabetes mellitus: risks and management during and after pregnancy[J] Nat Rev Endocrinol. . 2012;8(11):639–649. doi: 10.1038/nrendo.2012.96. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.WANG D, ZHU W, LI J, et al. Serum concentrations of fibroblast growth factors 19 and 21 in women with gestational diabetes mellitus: association with insulin resistance, adiponectin, and polycystic ovary syndrome history[J/OL] PLoS ONE. . 2013;8(11):e81190. doi: 10.1371/journal.pone.0081190. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.FISHER F M, CHUI P C, ANTONELLIS P J, et al. Obesity is a fibroblast growth factor 21 (FGF21)-resistant state[J] Diabetes. . 2010;59(11):2781–2789. doi: 10.2337/db10-0193. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.WANG Z Q, YU Y, ZHANG X H, et al. Comparing the effects of nano-sized sugarcane fiber with cellulose and psyllium on hepatic cellular signaling in mice[J] Int J Nanomedicine. . 2012;7:2999. doi: 10.2147/ijn.S30887. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.CAO X p, XIAO H p, CHEN S j, et al. Beta-cell dysfunction is the primary contributor to the early postpartum diabetes among Chinese women with history of gestational diabetes mellitus[J] Chin Med J (Engl) . 2008;121(8):696–700. doi: 10.1097/00029330-200804020-00007. [DOI] [PubMed] [Google Scholar]
- 30.LIESE A D, SCHULZ M, FANG F, et al. Dietary glycemic index and glycemic load, carbohydrate and fiber intake, and measures of insulin sensitivity, secretion, and adiposity in the Insulin Resistance Atherosclerosis Study[J] Diabetes Care. . 2005;28(12):2832–2838. doi: 10.2337/diacare.28.12.2832. [DOI] [PubMed] [Google Scholar]
- 31.HAPO Study Cooperatine Research Group. METZGER B E, LOWE L P, et al. Hyperglycemia and adverse pregnancy outcomes[J] N Engl J Med. . 2008;358(19):1991–2002. doi: 10.1056/NEJMoa0707943. [DOI] [PubMed] [Google Scholar]
- 32.PEDERSEN J. Diabetes and pregnancy; blood sugar of newborn infants during fasting and glucose administration[J]. Ugeskr Laeger, 1952, 114(21): 685 . [PubMed]
- 33.徐泽湄, 吴连方. 妊娠期糖尿病患者羊水葡萄糖水平与羊水量及新生儿出生体重的关系[J]. 中华妇产科杂志, 2006, 41(11): 724-728 . [PubMed]; XU Zemei, WU Lianfang. Correlation between amniotic fluid glucose concentration and amniotic fluid volume and neonatal birth weight in pregnancy complicated by gestational diabetes mellitus[J]. Chinese Journal of Obstetrics Gynecology, 2006, 41(11): 724-728. (in Chinese) . [PubMed]
- 34.陈月梅, 雪丽霜, 葛圆, 等. 妊娠期糖尿病与母婴结局的回顾性对照研究[J]. 中国妇幼保健, 2011, 26(35): 5489-5491 ; CHEN Yuemei, XUE Lishuang, GE Yuan, et al. A retrospective comparative study of gestational diabetes mellitus and maternal and infantile outcomes[J]. Maternal and Child Health Care of China, 2011, 26(35): 5489-5491. (in Chinese)
- 35.HANION-LUNDBERG K M, KIRBY R S, GANDHI S, et al. Nucleated red blood cells in cord blood of singleton term neonates[J]. Am J Obstet Gynecol, 1997, 176(6): 1149-1156 . [DOI] [PubMed]
- 36.LUENGMETTAKUL J, SUNSANEEVITHAYAKUL P, TALUNGCHIT P. Pregnancy outcome in women with gestational diabetes mellitus according to the Carpenter-Coustan criteria in Thailand[J] J Obstet Gynaecol Res. . 2015;41(9):1345–1351. doi: 10.1111/jog.12727. [DOI] [PubMed] [Google Scholar]


