Abstract
目的:
探讨白介素-17(IL-17)诱导的自噬及其相关蛋白在促进牙槽骨破坏过程中的具体机制。
方法:
对照组以含30 ng/mL巨噬细胞集落刺激因子、50 ng/mL核因子κB 受体活化因子配体(RANKL)的培养基诱导小鼠骨髓来源巨噬细胞(BMM),IL-17组分别以 0.01、0.1、1.0、10 ng/mL IL-17 处理,采用抗酒石酸酸性磷酸酶(TRAP)染色观察 TRAP 阳性多核破骨细胞;鬼笔环肽荧光染色检测肌动蛋白环周长;甲苯胺蓝染色分析骨吸收陷窝形成情况。另设对照组使用含50 ng/mL RANKL 的培养基诱导 RAW264.7 细胞,IL-17组分别以 0.01、0.1、1.0、10 ng/mL的 IL-17 处理,采用蛋白质印迹法检测不同浓度 IL-17 处理后自噬相关蛋白 Beclin-1、微管相关蛋白 1 轻链3(LC3)及破骨细胞相关蛋白 c-fos、活化 T 细胞核因子 1(NFATc1)的表达;检测1.0 ng/mL IL-17 处理及加入自噬抑制剂 3-MA 后 RAW264.7 细胞 LC3、NFATc1、TRAF6/ERK/p38 信号通路相关蛋白的表达。
结果:
0.01、0.1、1.0 ng/mL IL-17 处理 BMM 后,TRAP 阳性多核破骨细胞数量、肌动蛋白环周长以及骨吸收陷窝面积较对照组均增加,且1.0 ng/mL IL-17 处理 RAW264.7 细胞后,c-fos、NFATc1、Beclin-1、LC3、TRAF6、磷酸化 ERK、磷酸化 p38 蛋白表达均上调(均 P<0.05);而采用自噬抑制剂 3-MA 处理后,LC3、NFATc1、TRAF6、磷酸化 ERK、磷酸化 p38 的表达水平均下降(均 P<0.05)。
结论:
IL-17 可促进 Beclin-1、LC3 等自噬关键蛋白表达,增强破骨前体细胞的分化能力,TRAF6/ERK/p38 信号通路参与该过程。
Abstract
Objective:
To investigate the effects of interleukin (IL)-17-mediated autophagy on the TNF receptor associated factor (TRAF6)/extracellular signal-regulated kinase (ERK)/p38 pathway and osteoclast differentiation.
Methods:
Mouse bone marrow-derived macrophages (BMM) were cultured with a medium containing 30 ng/mL macrophage colony stimulating factor and 50 ng/mL receptor activator of nuclear factor-kappa B ligard (RANKL), and IL-17 (0.01, 0.1, 1.0, 10 ng/mL) was added for intervention (IL-17 group). Tartrate-resistant acid phosphatase (TRAP) staining was used to observe TRAP positive multinucleated cells; phalloidin fluorescent staining was used to detect actin ring circumference; toluidine blue staining was used to analyze bone resorption lacuna formation. To further examine the mechanism of the effect of IL-17-mediated autophagy on the differentiation of osteoclasts, the control group used 50 ng/mL RANKL medium to culture mouse macrophage RAW264.7 cells, while the IL-17 group was treated with IL-17 (0.01, 0.1, 1.0, 10 ng/mL). Western blot was used to detect the expression of autophagy-related proteins Beclin-1, microtubule-associated protein 1 light chain 3 (LC3) and osteoclast-related proteins c-fos and nuclear factor of activated T cell 1 (NFATc1) after treatment with different concentrations of IL-17. The expression of LC3, NFATc1, TRAF6/ERK/p38 signaling pathway related proteins were detected in 1.0 ng/mL IL-17 and autophagy inhibitor 3-MA group.
Results:
The number of TRAP positive multinucleated cells, the circumference of the actin ring and the area of bone resorption lacuna in IL-17 group treated with IL-17 (0.01, 0.1, 1.0 ng/mL) were significantly higher than those in the control group. In IL-17 treated RAW264.7 cells, the expression of c-fos, NFATc1, Beclin-1, LC3, TRAF6, p-ERK, and p-p38 was all significantly up-regulated (all P <0.05). After treatment with the autophagy inhibitor 3-MA, the expression levels of LC3, NFATc1, TRAF6, p-ERK, and p-p38 all decreased significantly (all P <0.05).
Conclusion:
IL-17 can promote the expression of autophagy proteins and enhance the differentiation ability of osteoclast precursor cells, and the TRAF6/ERK/p38 signaling pathway may be involved in this process.
Keywords: Osteoclast, Cell differentiation, Interleukin-17, Autophagy, TRAF6/ERK/p38 pathway
白介素(interleukin,IL);辅助性 T 细胞(helper T cell,Th);抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP);肿瘤坏死因子受体相关因子(TNF receptor associated factor,TRAF);核因子κB 受体活化因子配体(receptor activator of nuclear factor-kappa B ligand,RANKL);胞外信号调节激酶(extracellular signal-regulated kinase,ERK)巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF);微管相关蛋白 1 轻链3(microtubule-associated protein 1 light chain 3,LC3);活化 T 细胞核因子(nuclear factor of activated T cell,NFATc);细胞计数试剂盒(cell counting kit,CCK);聚偏二氟乙烯(polyvinylidenefluoride,PVDF);骨髓来源巨噬细胞(bone marrow-derived macrophages,BMM);磷酸盐缓冲液(phosphate buffered saline,PBS);甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH);
牙周炎是以菌斑微生物及其产物为始动因子,以牙周组织炎性浸润为特征的慢性感染性疾病,可导致牙槽骨进行性破坏,继而引发牙齿脱落 [1] 。IL-17 是主要由 Th17 产生的促炎细胞因子,近年来因其在牙周炎牙槽骨吸收过程中起到重要作用而受到广泛关注 [2] 。已有研究表明, IL-17 可通过诱导自噬促进破骨细胞的分化,加重实验性牙周炎小鼠模型的牙槽骨吸收 [3] ,但自噬参与这一过程的具体机制尚未明确。
破骨细胞是人体内唯一的骨吸收细胞,其极化后的封闭区可在骨表面形成密闭的骨吸收微环境,并通过褶皱缘胞膜分泌氢离子及胶原分解酶至微环境中溶解矿物质、降解有机骨基质 [ 4- 6] 。TRAP 阳性多核细胞是破骨前体细胞分化的标志,具有 3 个或 3 个以上细胞核的 TRAP 阳性细胞被称为成熟破骨细胞 [ 7- 8] ;而肌动蛋白环是破骨前体细胞终末分化的特征,也是破骨细胞发挥骨吸收功能的必要条件;骨吸收陷窝的形成则表明破骨细胞已分化成熟并具有骨吸收活性 [7] 。
TRAF6 是 IL-17 受体信号转导以及 Th17 分化的重要调控因子,同时也是 RANKL 在破骨细胞分化和骨吸收过程中发挥作用的关键下游介质 [9] 。有学者指出,在 IL-17 诱导的类风湿关节炎中,TRAF6 下游相关通路蛋白 ERK、p38 均被激活,提示 TRAF6/ERK/p38 信号通路参与 IL-17 诱导的炎症反应 [10] 。Beclin-1 是介导自噬体膜延伸的关键启动子 [11] ,其与三型磷脂酰肌醇3激酶的相互作用在自噬体的形成与成熟过程中不可或缺 [12] 。有研究显示,Beclin-1 上存在两个可能与 TRAF6 结合的位点,且 TRAF6 介导的 Beclin-1 泛素化能够促进单核巨噬细胞白血病细胞RAW264.7自噬,提示 TRAF6与自噬诱导之间存在密切联系,但TRAF6及其相关通路在IL-17诱导自噬促进破骨细胞分化过程中的作用机制尚未明确 [13] 。本文旨在研究IL-17促进破骨细胞分化过程中的自噬活动与 TRAF6/ERK/p38 信号通路之间的关系,探讨牙周炎症性牙槽骨吸收的致病机制,为牙周炎的治疗提供新的靶点。
1材料与方法
1.1试剂和仪器
可溶性重组小鼠 IL-17 为美国 PeproTech 公司产品;M-CSF和RANKL为美国 R&D Systems 公司产品。所有细胞培养基及耗材均为美国 Gibco和 Thermo Fisher Scientific 公司产品。LC3、Beclin-1、c-fos、NFATc1、TRAF6 和 GAPDH 抗体为美国Proteintech 公司产品;磷酸化 ERK 及磷酸化 p38 抗体为美国 Cell Signaling Technology 公司产品;山羊抗兔免疫球蛋白 G 二抗为博士德生物工程有限公司产品;二辛可宁酸试剂盒、增强化学发光检测试剂及鬼笔环肽为美国 Thermo Fisher Scientific 公司产品;自噬抑制剂 3-MA 为上海翊圣生物科技有限公司产品;TRAP 试剂盒及 CCK-8 为德国 Sigma-Aldrich 公司产品;PVDF 膜、分光光度计为美国Bio-Rad Laboratories公司产品。CKX53倒置显微镜为日本 Olympus 公司产品; 荧光显微镜为德国 Leica 公司产品。
1.2实验动物
本研究经浙江大学医学院附属第二医院动物伦理委员会审批(批准文号为 2017–052),所有动物实验均根据美国国立卫生研究院的实验动物护理和使用原则及程序进行。所有手术均在戊巴比妥钠麻醉下进行。10只7周龄的C57BL/6 雌性小鼠购自浙江大学实验动物中心,体重为(23.4±1.7)g,饲养于浙江大学医学院附属第二医院动物中心,喂食清洁饲料和纯净水,每日按时更换垫料,环境温度25 ℃,日光照时间12 h。
1.3细胞来源及培养
1.3.1小鼠 BMM 细胞培养及制备破骨细胞
BMM 获取方法同文献 [14],即小鼠用戊巴比妥钠(150 mg/kg,腹膜内注射)麻醉后,通过颈椎脱位法实施安乐死。解剖分离小鼠股骨和胫骨,切开末端,用含有30 ng/mL M-CSF 的对照培养基(含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的DMEM培养基)冲洗骨髓腔。将混合物均质化后置于培养皿中,于含 5%二氧化碳的37 ℃恒温培养箱中孵育3 d,收集贴壁细胞,即BMM。BMM以5×10 4个/孔接种至48孔板,使用含M-CSF(30 ng/mL)、RANKL(50 ng/mL)及不同浓度 IL-17(0、0.01、0.1、1.0、10 ng/mL)的对照培养基培 养 [ 3, 15] 。每隔1 d更换培养基,直到倒置显微镜下出现多核细胞。制备的细胞用于TRAP染色、鬼笔环肽染色及甲苯胺蓝染色实验。
1.3.2小鼠 RAW264.7 细胞培养及制备破骨细胞
实验所用 RAW264.7细胞 来自上海酶研生物科技有限公司。用 DMEM 培养基以 2×10 4个/cm 2的浓度培养细胞,培养基中含有 10%胎牛血清、 50 ng/mL RANKL、100 U/mL青霉素和100 U/mL链霉素,在含 5%二氧化碳的25 ℃恒温培养箱中孵育。RAW264.7 细胞以 10×10 4个/孔的密度接种到六孔板中,使用含 50 ng/mL RANKL及不同浓度 IL-17(0、0.01、0.1、1.0、10 ng/mL)的对照培养基培养;每隔1 d更换培养基,直至倒置显微镜下出现多核细胞。制备的细胞用于检测相关蛋白表达水平。
1.4细胞增殖实验测定细胞活力
将 RAW264.7 细胞在 96 孔板(3×10 3个/孔)中孵育24 h,用不同浓度的 IL-17(0、0.01、0.1、1.0 和10 ng/mL)或 3-MA(1 mmol/L)处理后继续培养72 h。每孔在相同的时间点下加入10 μL CCK-8 溶液,在含 5%二氧化碳的37 ℃恒温培养箱中孵育1.5 h后,采用分光光度计在450 nm下测量吸光度值。
1.5TRAP 染色鉴定成熟破骨细胞
对照组以含30 ng/mL M-CSF、50 ng/mL RANKL 的培养基培养 BMM,IL-17组分别以 0.01、0.1、1.0、10 ng/mL IL-17 作为干预,BMM 形成多核细胞后,吸出培养基,用 PBS 洗涤,在室温下用 4%多聚甲醛固定20 min,使用 TRAP 染液在37 ℃恒温孵箱中避光孵育1 h,PBS 洗净染液后光学显微镜下观察细胞并计数。体积大、细胞质呈紫红色,且具有 3 个或 3 个以上细胞核的 TRAP 阳性细胞称为成熟破骨细胞 [8] 。
1.6荧光显微镜观察破骨细胞分化情况
肌动蛋白环的形成是终末分化破骨细胞的特征 [7] 。对照组培养基含30 ng/mL M-CSF、50 ng/mL RANKL,IL-17组分别添加 0.01、0.1、1.0、10 ng/mL的 IL-17 作为干预,成熟破骨细胞形成后,在室温下将细胞用 4%多聚甲醛固定30 min,PBS 洗涤后用鬼笔环肽孵育2 h,再次用 PBS 洗涤后使用荧光显微镜观察肌动蛋白环的形成。
1.7甲苯胺蓝染色测定体外骨吸收陷窝
将 BMM 以 5×10 4个/孔的密度接种在放置牛骨片的 48 孔板上,24 h后将对照组细胞用30 ng/mL M-CSF、50 ng/mL RANKL 处理,IL-17组细胞在对照组基础上加入不同浓度的 IL-17(0.01、0.1、1.0 和10 ng/mL)。每隔1 d更换一次培养基,观察到成熟的破骨细胞后继续培养3 d。培养结束后牛骨片用 PBS 洗涤并干燥,使用甲苯胺蓝染色,观察骨吸收陷窝。
1.8蛋白质印迹法检测破骨细胞分化、自噬和TRAF6/ERK/p38 通路相关蛋白的表达
采用蛋白质印迹法检测破骨细胞分化早期关键转录因子 c-fos、NFATc1 [7] ,介导自噬体形成的关键启动子 Beclin-1,自噬小体膜延伸的关键标志物 LC3 蛋白 [ 11, 16] ,以及 TRAF6/ERK/p38 通路相关蛋白的表达。使用细胞裂解液提取细胞的总蛋白后,采用二辛可宁酸试剂盒进行蛋白浓度定量。随后使用十二烷基硫酸钠–聚丙烯酰胺凝胶电泳分离15 μg的总蛋白,并转移至0.2 μm孔径的 PVDF 膜上,在室温下用 5%脱脂奶粉封闭1 h,并在相应的一抗中4 ℃孵育过夜。第二天使用 1×TBST 洗涤 PVDF 膜后将其与二抗在室温下共同孵育1 h,化学发光检测试剂检测相应蛋白条带。
1.9统计学方法
每组实验均重复 3 次,所有定量数据以均值±标准差( ) 表示。使用 GraphPad Prism 8.0 软件用单向方差分析法进行统计学分析,两样本均数间差异采用 t检验。 P<0.05 为差异具有统计学意义。
2结果
2.1IL-17 对细胞增殖活性的影响
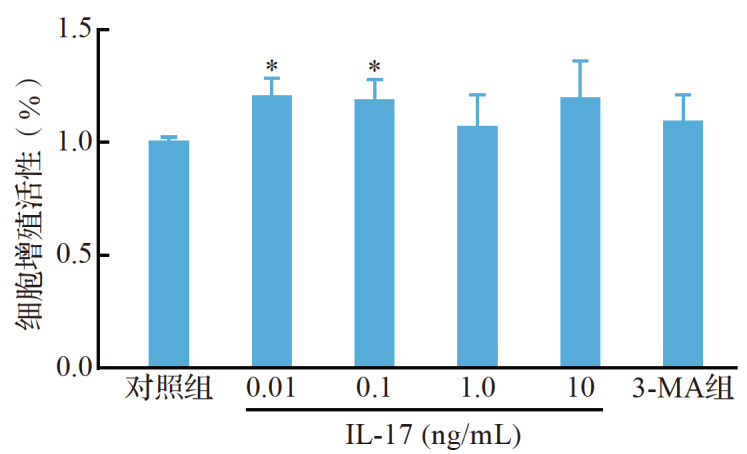
0.01、0.1 ng/mL IL-17 处理后细胞增殖活性较对照组增强(均 P <0.05);1.0、10 ng/mL IL-17 及1 mmol/L 3-MA 处理后细胞增殖活性与对照组差异无统计学意义(均 P>0.05),见 图 1。结果提示,0.01、0.1、1.0、10 ng/mL IL-17 及1 mmol/L 3-MA 对破骨前体细胞均无毒性。
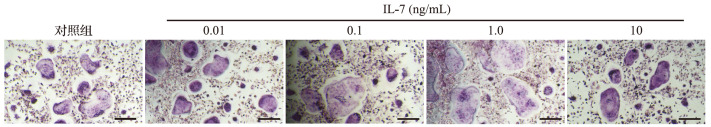
2.2IL-17 对 TRAP 阳性多核破骨细胞数量的影响
0.01、0.1、1.0 ng/mL IL-17 处理后,TRAP 阳性多核破骨细胞的数量较对照组增加;但10 ng/mL IL-17 处理后 TRAP 阳性多核破骨细胞的数量较对照组减少,见 图 2。结果提示,0.01、0.1、1.0 ng/mL IL-17 可促进破骨细胞成熟,而10 ng/mL IL-17 则会抑制破骨细胞成熟。
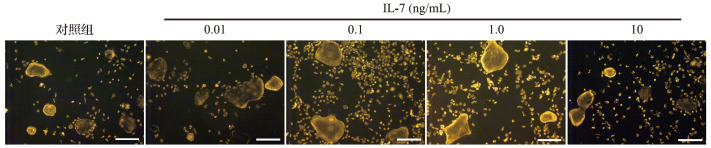
2.3IL-17 对破骨细胞分化的影响
0.01、0.1、1.0 ng/mL IL-17处理后,破骨细胞肌动蛋白环的周长较对照组增加;而10 ng/mL IL-17 处理后破骨细胞肌动蛋白环的周长较对照组减小,见 图3。结果提示,0.01、0.1、1.0 ng/mL IL-17可促进破骨细胞的分化,而10 ng/mL IL-17则会抑制破骨细胞分化。
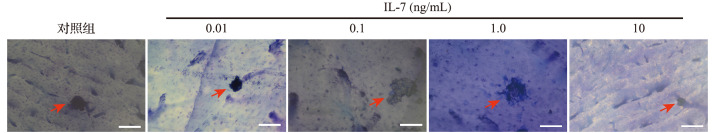
2.4IL-17对体外培养破骨细胞骨吸收活性的影响
0.01、0.1、1.0 ng/mL IL-17 处理后,骨吸收陷窝面积较对照组增大;而10 ng/mL IL-17 处理后骨吸收陷窝面积较对照组减小,见 图 4。结果提示,0.01、0.1、1.0 ng/mL IL-17 可以促进破骨细胞骨吸收活性,而10 ng/mL IL-17 则会抑制破骨细胞骨吸收活性。
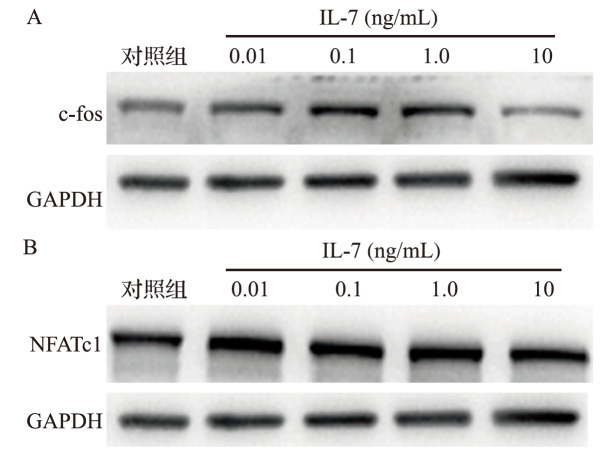
2.5IL-17 对破骨细胞分化相关蛋白表达的影响
0.01、0.1、1.0 ng/mL IL-17 处理后细胞中c-fos 和 NFATc1 表达较对照组增加(均 P<0.05);而10 ng/mL IL-17处理后细胞中c-fos和NFATc1 的表达减少(均 P<0.05),见 图5和 表1。结果提示,0.01、0.1、1.0 ng/mL IL-17可上调破骨细胞分化相关转录因子表达并促进破骨细胞分化,而10 ng/mL IL-17 处理后这一过程被抑制。
图 5 .
不同浓度 IL-17 处理破骨细胞相关蛋白表达变化A:c-fos 蛋白表达电泳图;B:NFATc1 蛋白表达电泳图.IL:白介素;NFATc:活化 T 细胞核因子;GAPDH: 甘油醛-3-磷酸脱氢酶.
表 1 不同浓度 IL-17 处理后破骨细胞分化和自噬相关蛋白表达量比较
Table 1 Expression of osteoclast and autophagy-related proteins after treatment with different concentrations of IL-17
( )
|
组 别 |
n |
c-fos |
NFATc1 |
Beclin-1 |
LC3 |
|
对照组 |
3 |
1.000±0.026 |
1.000±0.028 |
1.000±0.012 |
1.000±0.020 |
|
IL-7 0.01 ng/mL |
3 |
1.068±0.100 * |
1.142±0.039 ** |
1.070±0.059 * |
1.053±0.043 * |
|
0.1 ng/mL |
3 |
1.127±0.136 * |
1.121±0.085 * |
1.050±0.031 * |
1.053±0.051 * |
|
1.0 ng/mL |
3 |
1.162±0.101 * |
1.146±0.034 ** |
1.046±0.032 * |
1.168±0.089 * |
|
10 ng/mL |
3 |
0.800±0.116 * |
0.900±0.048 * |
0.789±0.153 * |
0.827±0.095 * |
与对照组比较, * P<0.05, ** P<0.01. IL:白介素;NFATc:活化T细胞核因子;LC3:微管相关蛋白 1 轻链 3.
2.6IL-17 在破骨细胞分化过程中对自噬相关蛋白表达的影响
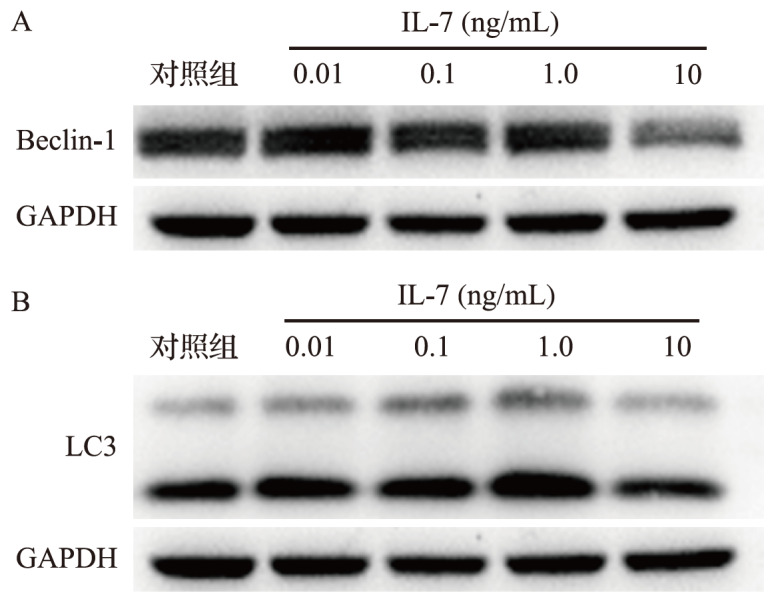
0.01、0.1、1.0 ng/mL IL-17 处理后细胞中 Beclin-1和LC3 蛋白表达水平较对照组上调(均 P<0.05),而10 ng/mL IL-17 处理后自噬相关蛋白 Beclin-1和LC3表达较对照组下调(均 P<0.05),见 图 6和 表 1。结果提示,自噬参与 IL-17 诱导的破骨细胞分化过程。
2.7自噬抑制剂对 IL-17 诱导的破骨细胞分化过程中 TRAF6/ERK/p38 通路的影响
选择对破骨细胞分化及自噬相关蛋白表达促进作用较为明显的1.0 ng/mL IL-17处理组检测 TRAF6/ERK/p38 通路相关蛋白 TRAF6、磷酸化 ERK、磷酸化 p38 的表达。结果显示,破骨细胞经1.0 ng/mL IL-17处理后,TRAF6、磷酸化 ERK、磷酸化 p38 蛋白表达较对照组上调(均 P<0.05);而自噬抑制剂 3-MA(1 mmol/L)可使破骨细胞分化相关蛋白、自噬相关蛋白 TRAF6、磷酸化 ERK、磷酸化 p38 表达下调(均 P<0.05),见 图 7、 表 2。结果提示,TRAF6/ERK/p38 信号通路参与IL-17 诱导的自噬促进破骨细胞分化过程。
图 7 .
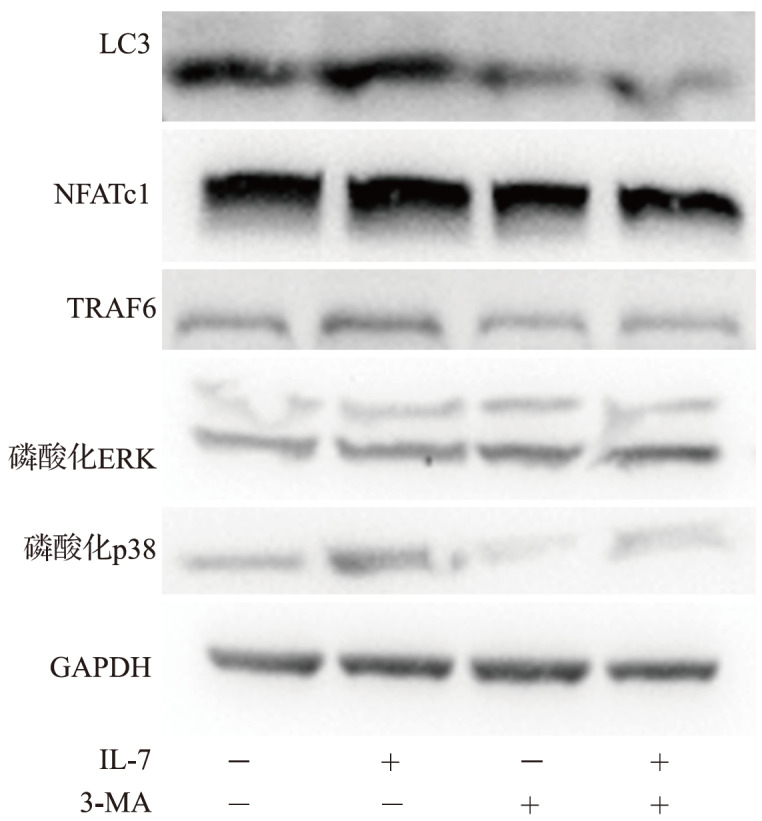
自噬抑制剂对破骨细胞 LC3、NFATc1 及 TRAF6/ERK/p38 通路相关蛋白表达的影响“-”:无;“+”:有.LC3:微管相关蛋白 1 轻链 3;NFATc:活化 T 细胞核因子;TRAF:肿瘤坏死因子受体相关因子;ERK:胞外信号调节激酶;GAPDH: 甘油醛-3-磷酸脱氢酶; IL:白介素.
表 2 自噬抑制剂处理后破骨细胞 LC3、NFATc1、TRAF6、磷酸化 ERK 及磷酸化 p38 蛋白表达量比较
Table 2 Comparison of LC3,NFATc1,TRAF6,p-ERK and p-p38 protein expression after autophagy inhibitor treatment
( )
|
组 别 |
n |
LC3 |
NFATc1 |
TRAF6 |
磷酸化 ERK |
磷酸化 p38 |
|
对照组 |
3 |
1.000±0.027 |
1.000±0.038 |
1.000±0.017 |
1.000±0.025 |
1.000±0.023 |
|
IL-17 组 |
3 |
1.337±0.099 ** |
1.106±0.061 * |
1.397±0.084 ** |
1.090±0.042 * |
1.211±0.115 * |
|
3-MA 组 |
3 |
0.600±0.051 ** |
0.673±0.021 ** |
0.705±0.016 ** |
0.800±0.023 ** |
0.536±0.090 ** |
|
IL-17+3-MA 组 |
3 |
0.612±0.089 ** |
0.757±0.038 ** |
0.754±0.039 ** |
0.873±0.037 ** |
0.719±0.041 ** |
与对照组比较, * P<0.05, ** P<0.01.IL:白介素;LC3:微管相关蛋白 1 轻链3;NFATc:活化 T 细胞核因子;TRAF:肿瘤坏死因子受体相关因子;ERK:胞外信号调节激酶.
3讨 论
牙周炎是以牙菌斑为始动因子、受多种因素(遗传、环境、宿主因素等)影响的慢性感染性疾病 [ 1, 17] 。牙菌斑中的微生物及其有毒产物可在牙周组织中引起局部炎症反应,产生的炎症因子可增加破骨细胞活性并促进牙槽骨吸收 [18] 。研究表明,BMM 经 M-CSF 与 RANKL 刺激可分化为成熟的破骨细胞,而 RAW264.7细胞同时表达M-CSF及其受体 c-fms,因此只需 RANKL 刺激即可分化为破骨细胞,两者均为体外破骨细胞的主要来源 [ 19- 20] 。BMM 作为原代细胞取自新鲜组织,其生物学特性尚未发生较明显的变化,所得数据更具有说服力,但 BMM 获取难度大且无法增殖,无法满足蛋白提取实验所需,且研究证实RAW264.7细胞与BMM细胞向破骨细胞分化的特性无明显差异 [21] ,因此本研究在 TRAP 染色、鬼笔环肽染色及骨吸收实验中使用 BMM 细胞,而在蛋白免疫印迹分析实验中使用 RAW264.7 细胞。
IL-17 是炎症因子中极具潜力的骨生理稳定调节介质之一 [22] 。本文资料显示,0.01、0.1、1.0 ng/mL IL-17 处理能够促进破骨细胞相关蛋白 c-fos、NFATc1 表达,TRAP 阳性多核破骨细胞、肌动蛋白环形成,且以1.0 ng/mL IL-17 的促进作用较为显著,但当 IL-17 浓度达到10 ng/mL时,c-fos、NFATc1 蛋白表达以及 TRAP 阳性多核破骨细胞、肌动蛋白环形成均减少,提示 0.01、0.1、1.0 ng/mL IL-17 可以促进破骨细胞的分化与成熟,但10 ng/mL IL-17 可抑制这一过程。Kitami 等 [15] 和 Wijekoon 等 [23] 的研究也得到了相似的结果:1.0 ng/mL IL-17 刺激人 RAW264.7 细胞或犬 BMM 后 TRAP 阳性多核破骨细胞数量及骨吸收陷窝面积均增大,10 ng/mL IL-17则可降低TRAP阳性多核破骨细胞生成及骨吸收陷窝面积。然而,Sprangers 等 [24] 观察到10 ng/mL IL-17对人源性 BMM 的破骨细胞分化仍具有积极作用;Yago等 [25] 研究发现,1.0、10、30 ng/mL IL-17 均可促进人外周血单核细胞破骨分化,而当 IL-17 浓度达到100 ng/mL时破骨细胞分化活性出现下降。上述结果提示,IL-17 对破骨细胞分化的作用差异可能与细胞的种属以及不同实验条件下多种复杂的信号通路调节相关,其机制仍需进一步探索。但不同研究均显示1 ng/mL IL-17 对破骨细胞分化具有促进作用,本研究结果与其一致。
自噬是维持细胞内环境稳态的一种机体自我保护机制,近年来因其在免疫防御和炎症调控方面的作用而备受关注 [26] 。本文资料显示,0.01、0.1、1.0 ng/mL IL-17能够促进自噬相关蛋白 LC3、Becliln-1 表达,而当 IL-17 浓度达到10 ng/mL时,LC3、Becliln-1蛋白表达减少。自噬抑制剂3-MA 也可通过抑制破骨细胞的自噬活动下调 LC3、 Becliln-1。Ke 等 [27] 研究也揭示 IL-17 可上调破骨前体细胞中自噬相关蛋白 LC3、Becliln-1 的表达,并进一步促进破骨细胞分化。Lin 等 [28] 进一步使用小分子干扰 RNA 敲除小鼠自噬相关基因 Atg7,结果显示 Atg7敲除小鼠糖皮质激素和卵巢切除术诱导的全身骨丢失显著减轻,且药物抑制自噬同样会降低破骨细胞活性并减少破骨细胞中NFATc1、TRAP和组织蛋白酶 K 的表达 [29] 。本文资料中 3-MA 组破骨细胞 NFATc1 蛋白表达下调与上述研究结果一致。这些研究结果均提示,IL-17 通过激活自噬促进破骨细胞分化,但其具体机制仍须进一步明确。
IL-17 可上调人类破骨前体细胞中 RANK 的表达,促进 RANKL 与 RANK 的结合,激活核因子κB 通路,从而介导破骨前体细胞分化 [30] 。而该过程中 TRAF6/ERK/p38 作为 RANKL-RANK 的下 游通路蛋白对破骨细胞分化起关键作用 [ 31- 34] 。Qian 等 [35] 采用去卵巢小鼠模型模拟绝经后骨质疏松症,发现半胱氨酸可通过抑制 ERK 及 p38 通路下调破骨细胞分化能力,减少去卵巢小鼠模型的全身骨丢失。本文资料显示,1 ng/mL IL-17 能促进通路相关蛋白 TRAF6、磷酸化 ERK、磷酸化 p38 的表达,提示 TRAF6/ERK/p38 信号通路参与 IL-17 促进破骨前体细胞分化的过程。随后用自噬抑制剂 3-MA 刺激1 ng/mL IL-17 组,结果显示自噬相关蛋白 LC3、TRAF6 相关通路蛋白TRAF6、磷酸化ERK、磷酸化p38及破骨相关蛋白NFATc1的表达均下调,表明抑制自噬可使TRAF6/ERK/p38 通路激活受限,导致IL-17介导的破骨细胞分化能力减弱。由此推测IL-17可通过促进LC3等自噬关键蛋白的表达,增强破骨前体细胞的分化能力,这一过程中 TRAF6/ERK/p38 信号通路被激活。Arai等 [36] 进一步探索自噬与破骨细胞分化之间机制,证明TRAF6介导的 Beclin-1 泛素化对于 RANKL 刺激的破骨细胞分化是不可或缺的。也有学者检测到Beclin-1 上存在两个可能与 TRAF6 结合的位点 [13] 。因此,推测单纯3-MA组破骨细胞中TRAF6、磷酸化ERK、磷酸化p38表达下调缘于Beclin-1与TRAF6的结合对TRAF6/ERK/p38通路激活至关重要,而自噬抑制剂可降低破骨细胞中 Beclin-1 水平从而下调 TRAF6/ERK/p38 通路蛋白表达,但其中的分子生物学机制仍需进一步探索。
综上,TRAF6/ERK/p38 信号通路参与了IL-17介导自噬促进破骨前体细胞分化这一过程。本研究进一步阐明了 IL-17 促进破骨细胞分化的具体分子机制,为宿主免疫反应介导牙槽骨破坏提供了新的理论解释,但自噬与 TRAF6/ERK/p38 通路间相互作用的关键靶点有待进一步探索,以期为牙周病治疗提供新的可能干预措施。
COMPETING INTERESTS
所有作者均声明不存在利益冲突
Funding Statement
国家自然科学基金(81771072,81800972)
References
- 1.BUNTE K, BEIKLER T. Th17 cells and the IL-23/IL-17 axis in the pathogenesis of periodontitis and immune-mediated inflammatory diseases[J] Int J Mol Sci. . 2019;20(14):3394. doi: 10.3390/ijms20143394. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.REYNOLDS J M, ANGKASEKWINAI P, DONG C. IL-17 family member cytokines: regulation and function in innate immunity[J] Cytokine Growth Factor Rev. . 2010;21(6):413–423. doi: 10.1016/j.cytogfr.2010.10.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.SONG L, TAN J, WANG Z, et al. Interleukin‑17A facilitates osteoclast differentiation and bone resorption via activation of autophagy in mouse bone marrow macrophages[J] Mol Med Report. . 2019;19(6):4743–4752. doi: 10.3892/mmr.2019.10155. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.SOYSA N S, ALLES N. Osteoclast function and bone-resorbing activity: an overview[J] Biochem BioPhys Res Commun. . 2016;476(3):115–120. doi: 10.1016/j.bbrc.2016.05.019. [DOI] [PubMed] [Google Scholar]
- 5.INDO Y, TAKESHITA S, ISHII K A, et al. Metabolic regulation of osteoclast differentiation and function[J] J Bone Miner Res. . 2013;28(11):2392–2399. doi: 10.1002/jbmr.1976. [DOI] [PubMed] [Google Scholar]
- 6.BAR-SHAVIT Z. The osteoclast: a multinucleated, hematopoietic-origin, bone-resorbing osteoimmune cell[J] J Cell Biochem. . 2007;102(5):1130–1139. doi: 10.1002/jcb.21553. [DOI] [PubMed] [Google Scholar]
- 7.ONO T, NAKASHIMA T. Recent advances in osteoclast biology[J] Histochem Cell Biol. . 2018;149(4):325–341. doi: 10.1007/s00418-018-1636-2. [DOI] [PubMed] [Google Scholar]
- 8.TEVLIN R, MCARDLE A, CHAN C K F, et al. Osteoclast derivation from mouse bone marrow[J] J Vis Exp. . 2014;6(93):52–56. doi: 10.3791/52056. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.WALSH M C, LEE J E, CHOI Y. Tumor necrosis factor receptor-associated factor 6 (TRAF6) regulation of development, function, and homeostasis of the immune system[J] Immunol Rev. . 2015;266(1):72–92. doi: 10.1111/imr.12302. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.HOT A, ZRIOUAL S, TOH M L, et al. IL-17A- versus IL-17F-induced intracellular signal transduction pathways and modulation by IL-17RA and IL-17RC RNA interference in rheumatoid synoviocytes[J] Ann Rheum Dis. . 2011;70(2):341–348. doi: 10.1136/ard.2010.132233. [DOI] [PubMed] [Google Scholar]
- 11.XU H D, QIN Z H. Beclin 1, Bcl-2 and autophagy[J]. Adv Exp Med Biol, 2019, 1206: 109-126 . [DOI] [PubMed]
- 12.MAEJIMA Y, ISOBE M, SADOSHIMA J. Regulation of autophagy by Beclin 1 in the heart[J] J Mol Cell Cardiol. . 2016;95:19–25. doi: 10.1016/j.yjmcc.2015.10.032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.SHI C S, KEHRL J H. TRAF6 and A20 regulate lysine 63-linked ubiquitination of Beclin-1 to control TLR4-induced autophagy[J] Sci Signal. . 2010;3(123):ra42. doi: 10.1126/scisignal.2000751. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.XING L, BOYCE B F. RANKL-based osteoclastogenic assays from murine bone marrow cells[J]. Methods Mol Biol, 2014, 1130: 307-313 . [DOI] [PubMed]
- 15.KITAMI S, TANAKA H, KAWATO T, et al. IL-17A suppresses the expression of bone resorption-related proteinases and osteoclast differentiation via IL-17RA or IL-17RC receptors in RAW264.7 cells[J] Biochimie. . 2010;92(4):398–404. doi: 10.1016/j.biochi.2009.12.011. [DOI] [PubMed] [Google Scholar]
- 16.HALE A N, LEDBETTER D J, GAWRILUK T R, et al. Autophagy: regulation and role in development[J] Autophagy. . 2013;9(7):951–972. doi: 10.4161/auto.24273. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.KINANE D F, STATHOPOULOU P G, PAPAPANOU P N. Periodontal diseases[J] Nat Rev Dis Primers. . 2017;3(1):17038. doi: 10.1038/nrdp.2017.38. [DOI] [PubMed] [Google Scholar]
- 18.CEKICI A, KANTARCI A, HASTURK H, et al. Inflammatory and immune pathways in the pathogenesis of periodontal disease[J] Periodontol 2000. . 2014;64(1):57–80. doi: 10.1111/prd.12002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.BOYLE W J, SIMONET W S, LACEY D L. Osteoclast differentiation and activation[J] Nature. . 2003;423(6937):337–342. doi: 10.1038/nature01658. [DOI] [PubMed] [Google Scholar]
- 20.YANG J, BI X, LI M. Osteoclast differentiation assay[J]. Methods Mol Biol, 2019, 1882: 143-148 . [DOI] [PubMed]
- 21.曾 立, 耿 欢, 邢更彦. RAW264.7 细胞与骨髓源巨噬细胞向破骨细胞分化特性的比较[J]. 中华灾害救援医学, 2018, 6(1): 30-34 ; ZENG Li, GENG Huan, XING Gengyan. Comparison between bone marrow-derived macrophages and RAW 264.7 cells in inducing osteoclast differentiation[J]. Chinese Journal of Disaster Medicine, 2018, 6(1): 30-34. (in Chinese)
- 22.CHENG W C, HUGHES F J, TAAMS L S. The presence, function and regulation of IL-17 and Th17 cells in periodontitis[J] J Clin Periodontol. . 2014;41(6):541–549. doi: 10.1111/jcpe.12238. [DOI] [PubMed] [Google Scholar]
- 23.WIJEKOON S, BWALYA E C, FANG J, et al. Chronological differential effects of pro-inflammatory cytokines on RANKL-induced osteoclast differentiation of canine bone marrow-derived macrophages[J] J Vet Med Sci. . 2017;79(12):2030–2035. doi: 10.1292/jvms.17-0393. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.SPRANGERS S, SCHOENMAKER T, CAO Y, et al. Different blood-borne human osteoclast precursors respond in distinct ways to IL-17A[J] J Cell Physiol. . 2016;231(6):1249–1260. doi: 10.1002/jcp.25220. [DOI] [PubMed] [Google Scholar]
- 25.YAGO T, NANKE Y, ICHIKAWA N, et al. IL-17 induces osteoclastogenesis from human monocytes alone in the absence of osteoblasts, which is potently inhibited by anti-TNF-α antibody: a novel mechanism of osteoclastogenesis by IL-17[J] J Cell Biochem. . 2009;108(4):947–955. doi: 10.1002/jcb.22326. [DOI] [PubMed] [Google Scholar]
- 26.YANG M, LI C, YANG S, et al. Mitochondria-associated ER membranes-the origin site of autophagy[J] Front Cell Dev Biol. . 2020,;8: 595 doi: 10.3389/fcell.2020.00595. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.KE D, FU X, XUE Y, et al. IL-17A regulates the autophagic activity of osteoclast precursors through RANKL-JNK1 signaling during osteoclastogenesis in vitro[J] . Biochem BioPhys Res Commun. . 2018;497(3):890–896. doi: 10.1016/j.bbrc.2018.02.164. [DOI] [PubMed] [Google Scholar]
- 28.LIN N Y, CHEN C W, KAGWIRIA R, et al. Inactivation of autophagy ameliorates glucocorticoid-induced and ovariectomy-induced bone loss[J] Ann Rheum Dis. . 2016;75(6):1203–1210. doi: 10.1136/annrheumdis-2015-207240. [DOI] [PubMed] [Google Scholar]
- 29.JI L, GAO J, KONG R, et al. Autophagy exerts pivotal roles in regulatory effects of 1α, 25-(OH) 2D 3 on the osteoclastogenesis[J] . Biochem BioPhys Res Commun. . 2019;511(4):869–874. doi: 10.1016/j.bbrc.2019.02.114. [DOI] [PubMed] [Google Scholar]
- 30.ADAMOPOULOS I E, CHAO C C, GEISSLER R, et al. Interleukin-17A upregulates receptor activator of NF-κB on osteoclast precursors[J] Arthritis Res Ther. . 2010;12(1):R29. doi: 10.1186/ar2936. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.OKAMOTO K, NAKASHIMA T, SHINOHARA M, et al. Osteoimmunology: the conceptual framework unifying the immune and skeletal systems[J] Physiol Rev. . 2017;97(4):1295–1349. doi: 10.1152/physrev.00036.2016. [DOI] [PubMed] [Google Scholar]
- 32.HUANG Z, PEI X, GRAVES D T. The interrelationship between diabetes, IL-17 and bone loss[J] Curr Osteoporos Rep. . 2020;18(1):23–31. doi: 10.1007/s11914-020-00559-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.ASAGIRI M, TAKAYANAGI H. The molecular understanding of osteoclast differentiation[J] Bone. . 2007;40(2):251–264. doi: 10.1016/j.bone.2006.09.023. [DOI] [PubMed] [Google Scholar]
- 34.BOYCE B F. Advances in the regulation of osteoclasts and osteoclast functions[J] J Dent Res. . 2013;92(10):860–867. doi: 10.1177/0022034513500306. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.QIAN Z, ZHONG Z, NI S, et al. Cytisine attenuates bone loss of ovariectomy mouse by preventing RANKL‐induced osteoclastogenesis[J] J Cell Mol Med. . 2020;24(17):10112–10127. doi: 10.1111/jcmm.15622. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.ARAI A, KIM S, GOLDSHTEYN V, et al. Beclin1 modulates bone Homeostasis by regulating osteoclast and chondrocyte dsifferentiation[J] J Bone Miner Res. . 2019;34(9):1753–1766. doi: 10.1002/jbmr.3756. [DOI] [PMC free article] [PubMed] [Google Scholar]