Resumen
Introducción
La recaída del SNC en pacientes con LDCBG en un evento de mal pronóstico. La incidencia de recaída es variable según la bibliografía. Los datos en América Latina son escasos.
Metodología
Para establecer la incidencia de recaída en SNC, el tiempo a la recaída en SNC y el impacto de los factores de riesgo de recaída del SNC, se realizó un estudio de cohorte retrospectiva, de enero del 2012 a junio del 2017.
Resultados
Se analizaron 147 pacientes. La mediana de edad fue de 66 años (IIC 56-76); 76 pacientes (51,70%) fueron hombres. El IPI fue bajo o intermedio/bajo en 115 (78,2%) casos. El CNS IPI fue intermedio en 77 (52,4%) y alto en 14 (9,5%) casos. Treinta y cinco (23,81%) pacientes recibieron profilaxis intratecal del SNC, ninguno profilaxis sistémica. Durante el seguimiento, 8 (4,59%) pacientes tuvieron recaída del SNC. La mediana de tiempo a la recaída fue de 6,5 meses (IIC 5,5 - 10). Siete (87,5%) pacientes recayeron dentro del año. No encontramos factores de riesgo para el compromiso del SNC en el análisis bivariado. La incidencia de recaída fue del 2,7% (IC 0,2%-4,6%), 4,8% (IC 1,8%-8,9%) y 5,4% (IC 4,5-8,9%) a los 6, 12 y 24 meses, respectivamente.
Discusión
La incidencia de recaída del SNC fue similar a la descrita en las series internacionales. Nuestro estudio confirma que la mayoría de los pacientes que recaen, lo hacen dentro del primer año del diagnóstico. Debemos realizar trabajos colaborativos más amplios para establecer mejor los factores de riesgo asociados.
Palabras clave: linfoma no hodgkin, linfoma de células b grandes difuso, recurrencia local de neoplasia, sistema nervioso central
Abstract
Introduction
CNS relapse in patients with LDCGB is a poor prognosis event. The incidence of relapse is variable according to the literature. Data in Latin America is lacking.
Methods
In order to establish the incidence of CNS relapse in our cohort, time to CNS relapse and the impact of CNS relapse risk factors, a retrospective cohort study was performed, from January 2012 to June 2017.
Results
One hundred and forty seven patients were analyzed. The median age was 66 years (ICR 56-76); 76 patients (51.70%) were men. The IPI was low or intermediate/low in 115 (78.2%) cases. The CNS IPI was intermediate in 77 (52.4%) and high in 14 (9.5%) of cases. Thirty-five (23.81%) patients received intrathecal prophylaxis. No patient received systemic prophylaxis. During the follow-up, 8 (4.59%) patients had CNS relapse, none of them with high IPI. The median time to relapse was 6.5 months (ICR 5.5-10). Seven (87.5%) patients relapsed within the year of diagnosis. We found no risk factors for CNS involvement in the bivariate analysis. The incidence of relapse was 2.7% (CI 0.2% -4.6%), 4.8% (CI 1.8% -8.9%) and 5.4% (CI 4.5- 8.9%) at 6, 12 and 24 months, respectively.
Discussion
The incidence of CNS relapse was similar to that described in the international series. Our study confirms that the majority of patients relapse during the first year of follow up. We must carry out broader collaborative work to better establish the risk factor for CNS relapse.
Keywords: lymphoma non-hodgkin, lymphoma large b-cell diffuse, neoplasm recurrence local, central nervous system
Resumo
Introdução
recidiva do SNC em pacientes com LDGCB em um evento de mau prognóstico. A incidência de recidiva é variável de acordo com a literatura. Os dados na América Latina são escassos.
Métodos
Para estabelecer a incidência de recidiva do SNC em nossa coorte, o tempo até a recidiva no SNC e o impacto dos fatores de risco de recaída no SNC, foi realizado um estudo de coorte retrospectivo, de janeiro de 2012 a junho de 2017.
Resultados
Cento e quarenta e sete pacientes foram analisados. A idade média foi de 66 anos (IIQ 56-76); 76 pacientes (51,70%) eram homens. O IPI foi baixo ou intermediário / baixo em 115 (78,2%) casos. O IPI do CNS foi intermediário em 77 (52,4%) e alto em 14 (9,5%) casos. Trinta e cinco (23,81%) pacientes receberam profilaxia intratecal no SNC, nenhuma profilaxia sistêmica. Durante o seguimento, 8 (4,59%) pacientes tiveram recidiva no SNC. O tempo médio para recidiva foi de 6,5 meses (IIQ 5.5-10). Sete (87,5%) pacientes recidivaram em um ano. Não encontramos fatores de risco para o envolvimento do SNC na análise bivariada. A incidência de recidiva foi de 2,7% (IC 0,2% -4,6%), 4,8% (IC 1,8% -8,9%) e 5,4% (IC 4,5- 8,9%) aos 6, 12 e 24 meses, respectivamente.
Discussão
A incidência de recidiva no SNC foi semelhante à descrita na série internacional. Nosso estudo confirma que a maioria dos pacientes com recidiva o faz no primeiro ano de diagnóstico. Devemos realizar um trabalho colaborativo mais amplo para melhor estabelecer os fatores de risco associados.
Palavras chave: linfoma não-hodgkin, linfoma difuso de grandes células b, recidiva local de neoplasia, sistema nervoso central
El compromiso del sistema nervioso central en pacientes con linfoma difuso de células B grandes es una complicación grave pero infrecuente. A lo largo de los últimos 15 años se han desarrollado estrategias para disminuir los pacientes que mueren con este tipo de recaídas. Lamentablemente, al ser un evento infrecuente, es difícil calcular su frecuencia, al punto que no hay estudios en nuestro país que hayan podido describir este evento. Creemos que nuestro estudio aporta datos no publicados previamente de la experiencia de un hospital de alta complejidad de Buenos Aires.
Conceptos claves
El LDCBG es el linfoma más frecuente de todos los linfomas no Hodgkin, con una prevalencia entre el 35% y el 40%.
La incidencia de recaída del SNC varía de 1% a 35% según los diferentes factores de riesgo informados en diferentes cohortes.
Este tipo de recaídas son poco frecuentes, pero de alta mortalidad, siendo la sobrevida de estos pacientes de entre 2 y 5 meses
Los datos en América Latina son escasos, no hay estudios en Argentina que hayan descripto la incidencia de recaída en SNC.
Nuestro estudio busca calcular la incidencia de recaída en SNC en un centro de alta complejidad de Buenos Aires, así como el tiempo a la recaída del SNC y los factores de riesgo asociados.
Introducción
El linfoma difuso de células B grandes (LDCBG) es el linfoma más frecuente de todos los linfomas no Hodgkin, con una prevalencia entre el 35% y el 40%, siendo esta una patología agresiva con alta morbimortalidad y una alta demanda del sistema de salud para el tratamiento de la patología de base y sus complicaciones 1,2. La recaída en el SNC en pacientes que han recibido tratamiento de primera línea para el LDCGB es un evento poco frecuente pero de alta mortalidad, siendo la sobrevida de estos pacientes de entre 2 y 5 meses 3-5 . El mayor desafío es tratar de identificar pacientes de alto riesgo para establecer medidas profilácticas adecuadas. El score central nervous system international prognostic index (CNS IPI) es hasta el momento la forma más sólida de establecer pacientes de alto riesgo. Este score publicado por Schmitz N. contempla la evaluación de 6 variables: compromiso renal o suprarrenal, edad mayor a 60 años, LDH aumentada, PS por ECOG mayor a 1, estadio III/IV y más de 1 órgano extranodal afectado, categoriza a los pacientes en riesgo bajo, intermedio o alto de compromiso del SNC. Sin embargo, la cohorte de pacientes que validó el score excluyó a pacientes con VIH y pacientes con compromiso de la médula espinal. Por otro lado, los pacientes de alto riesgo en este estudio recibieron CHOEP o MegaCHOEP como tratamiento, estándar no utilizado en nuestro centro 6 .
La medida que ha modificado en mayor medida la incidencia de recaída en SNC fue la adición de Rituximab a los regímenes similares a CHOP. Dicha intervención bajó en un 1% la incidencia de recaída a expensas de una franca disminución de la recaída leptomeníngea, siendo la recaída parenquimatosa la predominante en la era post Rituximab 7 , 8 . Otras estrategias como la profilaxis con terapia intratecal e infusión de Metotrexate, aún hoy son motivo de controversia 8-11 . La profilaxis sistémica con Metotrexate es hoy en día la profilaxis más comúnmente usada y ha sido avalada por estudios retrospectivos multicéntricos, mientras que la terapia intratecal no ha demostrado beneficios en la era post Rituximab 12 .
La incidencia de recaída del SNC varía de 1% a 35% según los diferentes factores de riesgo informados en diferentes cohortes 8-13 . Dado que carecemos de datos locales, nos propusimos estudiar nuestra cohorte de pacientes diagnosticados con LDCGB tratados con inmunoquimioterapia, estableciendo la tasa de recaída en el SNC, la utilidad de los diferentes factores de riesgo y las estrategias de profilaxis utilizadas.
Métodos
Estudio de cohorte retrospectivo, entre enero de 2012 y junio de 2017. El estudio se realizó en el Hospital Italiano de Buenos Aires, un hospital universitario de alta complejidad, con 600 camas y 30000 egresos por año, por la sección de Hematología.
Se incluyeron todos los pacientes mayores de 18 años con diagnóstico nuevo de LDCGB evaluados con criterios de la OMS 2016 14 . Se excluyeron los pacientes no tratados en nuestro hospital, los pacientes sin datos en la historia clínica electrónica (HCE) y los pacientes con diagnóstico de HIV. Además excluimos los pacientes con compromiso primario del SNC por resonancia magnética nuclear o estudio del líquido cefalorraquídeo. En nuestro hospital evaluamos el compromiso del SNC al diagnóstico en pacientes con síntomas neurológicos o riesgo de compromiso de duramadre por contigüidad, no así en pacientes asintomáticos 15, 16 . Además, realizamos profilaxis del SNC en pacientes con CNS IPI alto, compromiso en 2 o más sitios extranodales, compromiso testicular, renal suprarrenal, de mama o epidural y en pacientes con rearreglos del MYC + BCL2/BCL6 17 .
El hospital cuenta con un repositorio único de información de cada paciente a través de una HCE. La HCE está orientada a problemas, con un servidor de terminología con tesauro local que asigna vocabulario controlado a los problemas asignados a cada paciente. Los datos demográficos, las características clínicas y los datos de anatomía patológica de los participantes se obtuvieron de la HCE. Datos demográficos recopilados: edad, sexo; características clínicas: estado funcional, fecha de diagnóstico, subtipo de linfoma (linfoma testicular primario, linfoma de células B primario de mediastino, linfoma folicular transformado), estadio, afectación extranodal, enfermedad voluminosa, IPI, CNS IPI, LDH, B2 microglobulina, albúmina; tratamientos: primera línea, número de ciclos, radioterapia, trasplante; anatomía patológica: c Myc, BCL 2 por inmunohistoquímica y FISH, BCL 6 y FISH, Ki 67, célula de origen por algoritmo Hans, compromiso de SNC: diagnóstico de compromiso, clínica, tratamiento, respuesta al tratamiento.
El objetivo principal fue estimar la incidencia acumulada de recaída / progresión del SNC en la población global. Los objetivos secundarios fueron evaluar el tiempo hasta la recaída global y evaluar el impacto de los diferentes factores de riesgo de recaída en el SNC. Se consideró recaída en SNC a los pacientes que tuvieran evidencia de enfermedad por resonancia magnética, líquido cefalorraquídeo o ambos.
Nuestro estudio fue aprobado por el comité de ética de protocolos de investigación del Hospital italiano, llevado a cabo de acuerdo con la Declaración de Helsinki e informado de acuerdo con las directrices STROBE.
Análisis estadístico
Utilizamos estadística descriptiva para las características clínicas y anatomopatológicas. Las variables cuantitativas se expresaron como mediana e intervalo intercuartil (IIC), mientras que las variables cualitativas se expresaron como número total y porcentaje. A cada paciente se le realizó un seguimiento retrospectivo desde la fecha de diagnóstico hasta la muerte, la pérdida de seguimiento o la fecha de finalización administrativa (6/1/2017). Se calculó la incidencia acumulada de recaída en SNC a 6, 12 y 24 meses con un intervalo de confianza del 95%. Para estimar el tiempo a la recaída en SNC, se realizó un análisis de tiempo al evento considerando riesgos competitivos utilizando el modelo de regresión de Fine y Grey. Se tomó al evento muerte sin recaída en SNC como evento competitivo. Se realizaron análisis bivariados para analizar los siguientes factores de riesgo: sexo, performance status, estadio, LDH, tratamiento inicial, ki67%, compromiso extranodal, compromiso ginecológico, retroperitoneal, testicular u óseo. El análisis estadístico se realizó con el Software Stata 14.
Resultados
Se analizaron 234 pacientes de los cuales 87 no cumplían criterios de inclusión o tenían criterios de exclusión. Finalmente, se incluyeron 147 pacientes (Figura 1). La mediana de edad fue de 66 años (IIC 56-76); 76 pacientes (51,7%) fueron hombres; 92 (63,9%) presentaron compromiso extranodal; 66 (44,9%) fueron estadio IV. El IPI fue bajo o intermedio/bajo en 83 (56,4%) casos. El CNS IPI fue intermedio en 62 (42,2%) y alto en alto en 31 (23,1%) de los casos (Tabla 1). Todos los pacientes recibieron tratamiento, 145 (98,6%) con quimioterapia: R CHOP en 117 (81,8%), R Da EPOCH en 6 (4,2%) pacientes. Treinta y cinco (23,8%) pacientes recibieron profilaxis intratecal del SNC de los cuales 26 (74,2%) no tenían una indicación clara ya que eran pacientes con CNS IPI bajo o intermedio sin otros factores de riesgo de recaída en SNC. De los pacientes con CNS IPI alto solo 9/34 (36%) recibió profilaxis. Ningún paciente recibió profilaxis sistémica con Metotrexate.
Figura 1. Diagrama de flujo.
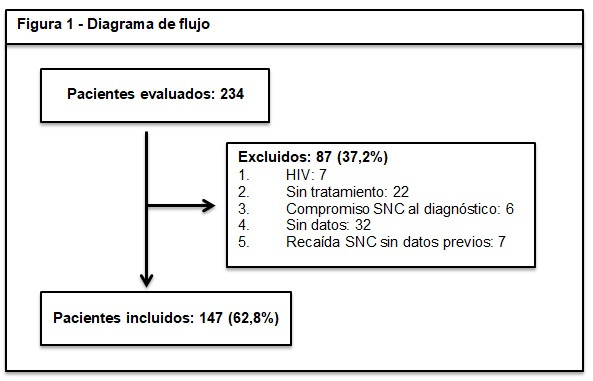
Tabla 1. Características basales (N 1 =147) .
|
Demográficas % N 2 |
|
|
Edad, mediana (IIC 3 ) |
66 (56-76) |
|
Hombres |
51,7% (76) |
|
Clínicas % N |
|
|
Performance estatus, mediana (IIC) |
1 (0-1) |
|
Estadio, mediana (IIC) |
3 (2-4) |
|
Enfermedad extranodal |
63,9% (92) |
|
Síntomas B |
34% (50) |
|
Masa voluminosa |
34,9% (59) |
|
Bajo grado transformado |
13,8% (24) |
|
IPI 4 % N |
|
|
Bajo |
34% (50) |
|
Intermedio/Bajo |
22,4% (33) |
|
Intermedio/Alto |
21,8% (32) |
|
Alto |
15,6% (23) |
|
Sin datos |
6,12% (9) |
|
CNS IPI 5 % N |
|
|
Bajo |
25,2% (37) |
|
Intermedio |
42,2% (62) |
|
Alto |
23,1% (34) |
|
Sin datos |
9,5% (14) |
Número
Porcentaje y número
Intervalo intercuartil
International prognostic index
Central nervous system international prognostic index
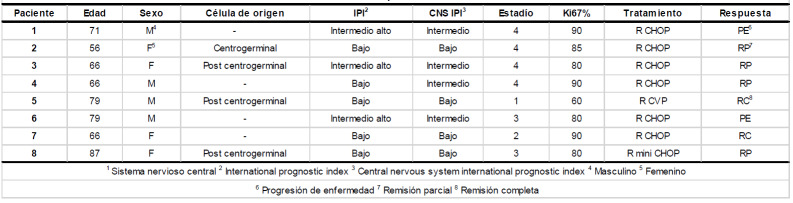
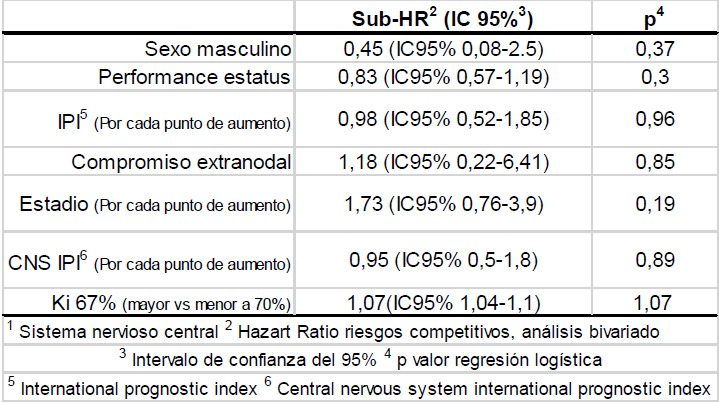
La mediana de seguimiento fue de 23 meses (IIC 9-56). Durante el seguimiento, 8 (5,4%) pacientes tuvieron recaída del SNC, ninguno de ellos con IPI alto. Sólo 2 (25%) de los pacientes alcanzaron remisión completa previo a la recaída, el resto tuvieron respuesta parcial en 4 (50%) y progresión de enfermedad en los restantes 2 (25%) pacientes. Cuatro (50%) pacientes tuvieron recaída solo parenquimatosa, 3 (37,5%) pacientes tuvieron recaída meníngea y parenquimatosa y solo 1 (12,5%) paciente tuvo recaída meníngea (Tabla 2). La mediana de tiempo a la recaída fue de 6,5 meses (IIC 5,5-10) mientras que la sobrevida global en días fue de 39,5 (IIC 31-81). Siete (87,5%) pacientes recayeron dentro del año. No encontramos factores de riesgo para el compromiso del SNC en el análisis bivariado, ni siquiera el CNS IPI fue estadísticamente significativo (Tabla 3). La incidencia de recaída fue del 2,7% (IC 0,2%-4,6%), 4,8% (IC 1,8%-8,9%) y 5,4% (IC 4,5-8,9%) a los 6, 12 y 24 meses, respectivamente.
Tabla 2. Características pacientes con recaída SNC1.
Tabla 3. Factores asociados a recaída del SNC1.
Discusión
Nuestro estudio buscó describir la incidencia de recaída en SNC en pacientes con LDCBG. La incidencia en nuestra cohorte fue cercana al 5% similar a la descrita en las series internacionales 3-5 . Boheme y col. describieron en una cohorte de pacientes mayores de 60 años una incidencia acumulada del 4,1 (IC 2,3-5,9), mientras que Ghose A. y col. tuvieron un resultado similar de 5,5% +/-2,2%, ambos estudios en pacientes tratados con inmunoquimioterapia 4, 5 .
El estudio confirma que la mayoría de los pacientes que recaen lo hacen dentro del primer año del diagnóstico. Datos similares fueron publicados por Boheme y col. que mostraron una mediana de 6,5 meses +/- 0,5. Donde hubo una diferencia llamativa, fue en la sobrevida posterior a la recaída de nuestra cohorte de 39,5 días en comparación a la cohorte de Schmitz N. y col. de 210 días y de Boheme y col. de 365 días. Esta diferencia podría estar en parte explicada por el promedio de edad de la población añosa de nuestro hospital (mediana de 66 años vs50,5 en la cohorte de Schmitz N, aunque similar a la mediana 68 años de Boheme y col.). Esta mala evolución a corto plazo realza las dificultades que representan este subgrupo de pacientes para su tratamiento 3-13 .
Con respecto a los factores de riesgo para recaída del SNC, solo el ki67 con un porcentaje de corte del 70% fue estadísticamente significativo (p=0,00). El grupo alemán de Schmitz N. y col. son quienes mejor han objetivado estos factores de riesgo, además del conocido score CNS IPI, describieron los estadios III, IV y el aumento de la LDH como factores que triplican el riesgo de recaída en SNC 6-13 . La reciente revisión de la British Society confirma al CNS IPI de alto riesgo, el compromiso de 3 o más sitios extranodales, el compromiso testicular, renal suprarrenal, intravascular, y probablemente el compromiso uterino y de mama 16 . Lamentablemente, se necesita mayor número de pacientes para hacer una evaluación más exhaustiva de estos factores en nuestra cohorte.
En cuanto a los hallazgos, llama la atención el bajo porcentaje de profilaxis en paciente con alto riesgo de recaída. Estos hallazgos también fueron descritos en la revisión sistemática de Eyre y col. donde los autores publicaron un 57% de compliance 7, 8 . Por otro lado en nuestro estudio no hubo pacientes con profilaxis sistémica con Metotrexate, conducta que se generalizó en nuestro servicio luego de terminado el presente estudio.
Nuestra cohorte cuenta con problemas inherentes al diseño, ya que al tratarse de una cohorte retrospectiva, la recopilación de datos de algunas variables clínicas podría no ser precisa. Pese a esto la aproximación retrospectiva es la única posibilidad para una patología de tan baja frecuencia y el sistema integrado de la HCE permite obtener información administrativa de alta calidad. Por otro lado las variables relacionadas a nuestros objetivos primarios y secundarios al ser outcomes duros, parecieran ser confiables.
Como fortaleza contamos con pocas cohortes de pacientes en América Latina y no encontramos datos en nuestro país que describan las características y midan la incidencia de recaída en SNC 15 , 18 . Consideramos estos datos de vital importancia para evaluar la evolución de nuestros pacientes, a fin de poder mejorar los tratamientos y las profilaxis de esta patología.
Como consideración final nuestro estudio muestra una incidencia de recaída en SNC y sobrevida similares a las publicadas en otras series. El análisis de la bibliografía actual deja bastante claro que aún quedan dudas con respecto a la mejor profilaxis. Los estudios de tipo retrospectivo no permiten evaluar de forma contundente la superioridad de una estrategia sobre la otra 8-13, 19 . Si bien en la actualidad la tendencia es a realizar profilaxis sistémica con Metotrexate, este tratamiento tiene una alta toxicidad y podría ser una opción con costo beneficio no adecuada en población añosa como la de nuestro hospital 19 . Nuestro equipo está trabajando en nuevos proyectos para evaluar este tipo de profilaxis sistémica, así como en estudios colaborativos más amplios para mejorar el análisis de subgrupos y de factores de riesgo, limitados por el bajo número de pacientes.
Footnotes
Limitaciones de responsabilidad: La responsabilidad del trabajo es solo de los autores.
Fuentes de apoyo: Todos los gastos fueron cubiertos por la Sección de Hematología y el Servicio de Clínica Médica del Hospital Italiano de Buenos Aires.
Originalidad: Este artículo es original y no ha sido enviado para su publicación a otro medio de difusión científica en forma completa ni parcialmente.
Cesión de derechos: Los participantes de este trabajo ceden el derecho de autor a la Universidad Nacional de Córdoba para publicar en la Revista de la Facultad de Ciencias Médicas y realizar las traducciones necesarias al idioma inglés.
Conflicto de interés: No se reporta conflicto de intereses.
Participación de los autores: Todos los autores han participado en la idea y redacción del proyecto, procesamiento de la información y elaboración del manuscrito, haciéndose públicamente responsables de su contenido y aprobando su versión final
Contributor Information
Fernando Warley, Email: fernando.warley@hospitalitaliano.org.ar.
Nancy Cristaldo, Email: nancy.cristaldo@hospitalitaliano.org.ar.
Giuliana Colucci, Email: giuliana.colucci@hospitalitaliano.org.ar..
Victoria Otero, Email: victoria.otero@hospitalitlaiano.org.ar.
Bibliografía
- 1.Chiu BC-H, Hou N. Epidemiology and Etiology of Non-Hodgkin Lymphoma. Non-Hodgkin Lymphoma. 2015. pp. 1–25. [DOI] [PubMed] [Google Scholar]
- 2.Shankland KR, Armitage JO, Hancock BW. Non-Hodgkin lymphoma. The Lancet. 2012:848–857. doi: 10.1016/s0140-6736(12)60605-9. [DOI] [PubMed] [Google Scholar]
- 3.Bernstein SH, Unger JM, LeBlanc M, Friedberg J, Miller TP, Fisher RI. Natural History of CNS Relapse in Patients With Aggressive Non-Hodgkin's Lymphoma: A 20-Year Follow-Up Analysis of SWOG 8516-The Southwest Oncology Group. Journal of Clinical Oncology. 2009:114–119. doi: 10.1200/jco.2008.16.8021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Boehme V, Schmitz N, Zeynalova S, Loeffler M, Pfreundschuh M. CNS events in elderly patients with aggressive lymphoma treated with modern chemotherapy (CHOP-14) with or without rituximab: an analysis of patients treated in the RICOVER-60 trial of the German High-Grade Non-Hodgkin Lymphoma Study Group (DSHNHL) Blood. 2009;113:3896–3902. doi: 10.1182/blood-2008-10-182253. [DOI] [PubMed] [Google Scholar]
- 5.Ghose A, Elias HK, Guha G, Yellu M, Kundu R, Latif T. Influence of Rituximab on Central Nervous System Relapse in Diffuse Large B-Cell Lymphoma and Role of Prophylaxis-A Systematic Review of Prospective Studies. Clinical Lymphoma Myeloma and Leukemia. 2015:451–457. doi: 10.1016/j.clml.2015.02.026. [DOI] [PubMed] [Google Scholar]
- 6.Schmitz N, Zeynalova S, Nickelsen M, Kansara R, Villa D, Sehn LH, et al. CNS International Prognostic Index: A Risk Model for CNS Relapse in Patients With Diffuse Large B-Cell Lymphoma Treated With R-CHOP. J Clin Oncol. 2016;34:3150–3156. doi: 10.1200/JCO.2015.65.6520. [DOI] [PubMed] [Google Scholar]
- 7.Zhang J, Chen B, Xu X. Impact of rituximab on incidence of and risk factors for central nervous system relapse in patients with diffuse large B-cell lymphoma: a systematic review and meta-analysis. Leukemia & Lymphoma. 2014:509–514. doi: 10.3109/10428194.2013.811239. [DOI] [PubMed] [Google Scholar]
- 8.Eyre TA, Djebbari F, Kirkwood AA, Collins GP. A systematic review of the efficacy of CNS prophylaxis with stand-alone intrathecal chemotherapy in diffuse large B cell lymphoma patients treated with anthracycline-based chemotherapy in the rituximab era. Haematologica. 2019 doi: 10.3324/haematol.2019.229948. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Feugier P, Virion JM, Tilly H, Haioun C, Marit G, Macro M, et al. Incidence and risk factors for central nervous system occurrencein elderly patients with diffuse large-B-cell lymphoma: influenceof rituximab. Annals of Oncology. 2004:129–133. doi: 10.1093/annonc/mdh013. [DOI] [PubMed] [Google Scholar]
- 10.Villa D, Connors JM, Shenkier TN, Gascoyne RD, Sehn LH, Savage KJ. Incidence and risk factors for central nervous system relapse in patients with diffuse large B-cell lymphoma: the impact of the addition of rituximab to CHOP chemotherapy. Ann Oncol. 2010;21:1046–1052. doi: 10.1093/annonc/mdp432. [DOI] [PubMed] [Google Scholar]
- 11.McMillan A, Ardeshna KM, Cwynarski K, Lyttelton M, McKay P, Montoto S, et al. Guideline on the prevention of secondary central nervous system lymphoma: British Committee for Standards in Haematology. Br J Haematol. 2013;163:168–181. doi: 10.1111/bjh.12509. [DOI] [PubMed] [Google Scholar]
- 12.Cheah CY, Herbert KE, O'Rourke K, Kennedy GA, George A, Fedele PL, et al. A multicentre retrospective comparison of central nervous system prophylaxis strategies among patients with high-risk diffuse large B-cell lymphoma. Br J Cancer. 2014;111:1072–1079. doi: 10.1038/bjc.2014.405. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Schmitz N, Zeynalova S, Glass B, Kaiser U, Cavallin-Stahl E, Wolf M, et al. CNS disease in younger patients with aggressive B-cell lymphoma: an analysis of patients treated on the Mabthera International Trial and trials of the German High-Grade Non-Hodgkin Lymphoma Study Group. Annals of Oncology. 2012:1267–1273. doi: 10.1093/annonc/mdr440. [DOI] [PubMed] [Google Scholar]
- 14.Swerdlow SH, Campo E, Pileri SA, Harris NL, Stein H, Siebert R, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood. 2016;127:2375–2390. doi: 10.1182/blood-2016-01-643569. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Oliver AC, Irigoin V, Sgarbi N, Peixoto A, Turcatti P, Diaz L, et al. Resonancia magnética como screening inicial de diagnóstico de compromiso secundario del sistema nervioso central en LNH difuso de grandes Células B. Revista de la Facultad de Ciencias Médicas. 2018:67. doi: 10.31053/1853.0605.v75.n2.17517. [DOI] [PubMed] [Google Scholar]
- 16.McKay P, Wilson MR, Chaganti S, Smith J, Fox CP, Cwynarski K, et al. The prevention of central nervous system relapse in diffuse large B-cell lymphoma: a British Society for Haematology Good Practice Paper. Br J Haematol. 2020 doi: 10.1111/bjh.16866. [DOI] [PubMed] [Google Scholar]
- 17.Zelenetz AD, Gordon LI, Abramson JS, Advani RH, Bartlett NL, Caimi PF, et al. NCCN Guidelines Insights: B-Cell Lymphomas, Version 3.2019. J Natl Compr Canc Netw. 2019;17:650–661. doi: 10.6004/jnccn.2019.0029. [DOI] [PubMed] [Google Scholar]
- 18.Rocha TMB da S da, da Rocha TMB da S, Fortier SC, Pinto MSG, da Silva IC, Paes RP, et al. Secondary infiltration of the central nervous system in patients with diffuse large B-cell lymphoma. Revista Brasileira de Hematologia e Hemoterapia. 2013 doi: 10.5581/1516-8484.20130094. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Abramson JS, Hellmann M, Barnes JA, Hammerman P, Toomey C, Takvorian T, et al. Intravenous methotrexate as central nervous system (CNS) prophylaxis is associated with a low risk of CNS recurrence in high-risk patients with diffuse large B-cell lymphoma. Cancer. 2010;116:4283–4290. doi: 10.1002/cncr.25278. [DOI] [PubMed] [Google Scholar]