Abstract
Hintergrund
Seit Beginn der SARS-CoV-2-Pandemie häufen sich Fälle des Hyperinflammationssyndroms „pediatric inflammatory multisystem syndrome“ (PIMS). Die Klinik ist variabel und tritt 2 bis 6 Wochen nach einer Infektion mit SARS-CoV‑2 auf. Aktuell kommen Immunglobuline und/oder Steroide sowie ASS zum Einsatz.
Methode
Im Vivantes Klinikum Neukölln präsentierten sich zwischen Juni 2020 und Juni 2021 11 Patient*innen mit PIMS, deren Daten retrospektiv erhoben und ausgewertet wurden.
Ergebnis
Von den 11 Patient*innen waren 6 männlich, die Altersverteilung reichte von 4 bis 18 Jahren. Sieben Patient*innen waren übergewichtig oder adipös. Fast alle Patient*innen zeigten eine gastrointestinale und kardiovaskuläre Beteiligung, 4 hatten respiratorische Symptome, 6 Zeichen einer Nephritis. Alle zeigten Blutbildveränderungen mit Anämie oder Leukozytose und eine Koagulopathie. CRP, Ferritin und der lösliche IL-2-Rezeptor waren bei allen Patient*innen stark erhöht. Nur 2 Patient*innen hatten weder eine Troponin-T- noch NT-proBNP-Erhöhung. Sieben Patient*innen hatten eine eingeschränkte linksventrikuläre Funktion. Bei 10 fand sich eine positive SARS-CoV-2-Serologie, bei 2 eine positive SARS-CoV-2-PCR im Nasen-Rachen-Abstrich.
Alle wurden zunächst antibiotisch behandelt. 3 Patient*innen benötigten eine O2-Supplementation, 6 mussten intensivmedizinisch behandelt werden, bei 5 bestand Katecholaminbedarf. Bis auf eine Patientin erhielten alle Immunglobuline und ASS, 5 erhielten Prednisolon. Die Liegedauer lag zwischen 4 und 51 Tagen.
Schlussfolgerung
PIMS ist eine schwere akute hyperinflammatorische Erkrankung, die in unserer Klinik bei 11 Patient*innen gesichert wurde. Teilweise bestand intensivmedizinischer Handlungsbedarf. Unter antiinflammatorischer Therapie zeigte sich ausnahmslos ein gutes Ansprechen.
Schlüsselwörter: PIMS, SARS-CoV‑2, „Kawasaki-like“, Multiorganbeteiligung, Immunglobuline
Abstract
Background
Since the beginning of the SARS-CoV‑2 pandemic, cases of the hyperinflammatory syndrome pediatric inflammatory multisystem syndrome (PIMS) have been accumulating. The clinical presentation is variable and it occurs 2–6 weeks after infection with SARS-CoV‑2. As of today, immunoglobulins and/or steroids as well as ASS are used for medication.
Method
In our clinic 11 patients presented with PIMS between 06/2020 and 06/2021, whose data were retrospectively collected and analyzed.
Results
Of the 11 patients 6 were male, the age distribution ranged from 4–18 years and 7 were overweight or obese. Almost all patients showed gastrointestinal and cardiovascular involvement, 4 had respiratory symptoms, 6 showed signs of nephritis. All showed blood count changes with anemia or leukocytosis and coagulopathy. CRP, ferritin, and soluble IL2 receptor were highly elevated in all patients. Only 2 patients had neither troponin‑T nor NT-pro-BNP elevation and 7 patients had impaired left ventricular function. Positive SARS-CoV‑2 serology was found in 10, and positive SARS-CoV‑2 PCR via nasopharyngeal swabs in 2.
All were initially treated with antibiotics, 3 patients required O2 supplementation, 6 required intensive care and 5 required vasoactive agents. All but one patient received immunoglobulins and ASS, 5 received prednisolone. Length of stay ranged from 4–51 days.
Conclusion
PIMS is a severe acute hyperinflammatory disease, which was secured in 11 patients in our clinic. In some cases, there was a need for intensive care. Under anti-inflammatory therapy there was a good response without exception.
Keywords: PIMS, SARS-CoV‑2, Kawasaki-like, Multiorgan involvement, Immunoglobulins
Einleitung
Seit Beginn der Coronapandemie stellen sich zunehmend Kinder und Jugendliche aufgrund eines „pediatric inflammatory multisystem syndrome“ (PIMS) in den Praxen und Kinderkliniken vor. Die Diagnosestellung ist bei variabler Klinik oft erschwert. In folgender Arbeit wird auf das Krankheitsbild eingegangen, die Daten der in unserer Klinik stationären Kinder mit PIMS werden vorgestellt und diese in die aktuelle Literatur eingeordnet.
Hintergrund
Seitdem der National Health Service (NHS) des Vereinigten Königreichs am 25.04.2020 erstmalig von einem neuartigen schweren multisystemischen Inflammationssyndrom in einem zeitlichen Zusammenhang mit einer SARS-CoV-2-Infektion bei Kindern berichtete [1], häufen sich weltweit Veröffentlichungen zu Kindern und Jugendlichen mit einer multisystemischen Hyperinflammation [2–7].
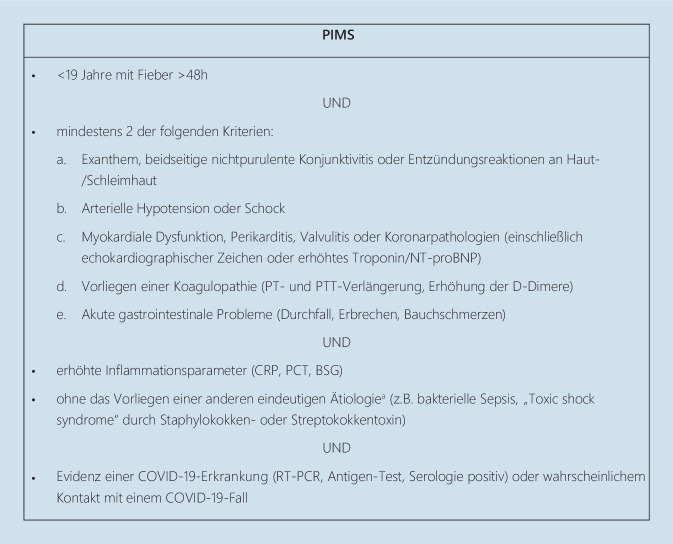
Das „Royal College of Paediatrics and Child Health“ (RCPCH) bezeichnet das Syndrom als „paediatric inflammatory multisystem syndrome temporally associated with COVID-19 (PIMS-TS)“ [8], die US Centers for Disease Control and Prevention (CDC) [9] und die World Health Organisation (WHO) [10] sprechen von „multisystem inflammatory syndrome in children“ (MIS-C) (Abb. 1).
Nach nachgewiesener SARS-CoV-2-Infektion sind das Risiko bei Kindern, ein PIMS zu entwickeln, mit 0,14 % [12] und die Mortalität mit 1,7–2,2 % beschrieben [3, 13].
Der Altersgipfel liegt bei 7 bis 10 Jahren, [14, 15] es können jedoch auch Säuglinge [16, 17] und Erwachsene betroffen sein [18]. Die meisten Patient*innen mit PIMS sind vorher gesund, männliche Kinder und Jugendliche scheinen etwas häufiger betroffen zu sein, und Übergewicht ist als Risikofaktor beschrieben [14, 17–19].
Differenzialdiagnosen sind das Kawasaki-Syndrom, schwere Infektionen, ein „toxic shock syndrome“, eine Appendizitis, eine Myokarditis, ein Makrophagenaktivierungssyndrom sowie ein M. Still. Im Vergleich zum Kawasaki-Syndrom sind PIMS-Patient*innen meist älter, zeigen höhere Inflammationsparameter, häufiger eine Anämie und Thrombozytopenie, häufiger gastrointestinale Symptome und häufigere und schwerwiegendere myokardiale Dysfunktionen [6], auch zeigt die Therapie mit Immunglobulinen beim PIMS im Vergleich zum Kawasaki-Syndrom ein geringeres Ansprechen [11, 18].
Pathophysiologie
Das PIMS tritt ca. 2 bis 6 Wochen nach einer häufig auch asymptomatischen SARS-CoV-2-Infektion auf. Es wird vermutet, dass eine überschießende Immunreaktion ein Schlüsselfaktor sein könnte, die sich jedoch von der Pathophysiologie von COVID-19 und des Kawasaki-Syndroms unterscheidet [20]. Ein Erklärungsansatz ist die „Antibody-dependent-enhancement“-Hypothese. Hier binden infektionsverstärkende Antikörper an das Spike-Protein des SARS-CoV‑2 und führen zu einer verbesserten Aufnahme des Antikörper-Antigen-Komplexes in die Zielzelle und damit zu einer erhöhten Virusreplikation [21, 22]. Eine zweite Hypothese ist ein Zytokinsturm durch eine verzögerte Interferonantwort. Coronaviren sind in der Lage, Autoantikörper zu induzieren, die eine Blockade der Interferon-I- und Interferon-III-Typen bewirken, wodurch es zu einer verspäteten Interferonantwort und damit zu einer verzögerten Virusbekämpfung und folgender überschießender Inflammation mit Zytokinsturm kommt [23, 24]. Eine mögliche Erklärung, warum Adipositas ein Risikofaktor sein könnte, ist die vermehrte Anzahl von SARS-CoV-2-bindenden Rezeptoren in den Fettgewebszellen und die dadurch vermehrte Akkumulation der Entzündungszellen im Fettgewebe [13]. Ein anderer Erklärungsmechanismus ist die mögliche Rolle von Autoantikörpern. Es wurde bei Patienten*innen mit PIMS eine erhöhte Konzentration von Autoantikörpern gefunden, welche einen Einfluss auf die Lymphozytenaktivierung sowie auf den intrazellulären Signalweg hatte [25]. Das Vorkommen von möglichen Zielstrukturen der Autoantikörper in verschiedenen Gewebetypen könnte die multisystemische Auswirkung von PIMS erklären [20].
Klinik
Die Klinik des PIMS ist je nach betroffenen Organsystemen variabel. In Tab. 1 sind mögliche Symptome nach Organsystem sowie die in der Literatur beschriebene Häufigkeit aufgezählt.
|
Allgemein |
Fieber |
|
Gastrointestinal |
Bauchschmerzen, Erbrechen, nichtblutiger Durchfall, Aszites |
|
Kardiovaskulär 31–100 % |
Arterielle Hypotension, linksventrikuläre Dysfunktion, Perikarderguss, Valvulitis, Klappeninsuffizienz, Koronaraneurysmen, Herzrhythmusstörungen, Tachykardie, Schock |
|
Respiratorisch |
Husten, Halsschmerzen, Luftnot, O2-Bedarf, Pneumonie, Pleuraerguss |
|
Mukokutan |
Konjunktivitis (nicht purulent, nicht exsudativ), makulopapulöses Exanthem, Cheilitis |
|
Neurologisch |
Kopfschmerzen, Nackenschmerzen oder -steife, Irritabilität, Enzephalopathie, Sehstörungen |
|
Nephrologisch |
Transientes akutes Nierenversagen |
| Muskuloskeletal | Myalgien |
Therapie
Im deutschsprachigen Raum gibt es einen Expertenkonsens, herausgegeben durch verschiedene pädiatrische Arbeitsgemeinschaften zur Therapie des PIMS. Aktuell kommen intravenöse Immunglobuline (IVIG) und/oder Steroide, ASS und ggf. Biologika zum Einsatz (Tab. 2 und 3).
| Kawasaki-Phänotyp (4 von 5 Hauptkriterien oder mindestens 2 Hauptkriterien + Nebenkriterien für Kawasaki) |
Nicht-Kawasaki-Phänotyp |
|---|---|
|
IVIG (intravenöse Immunglobuline) 2 g/kgKG (max. 80 g) in 1 ED über 12 h + Acetylsalicylsäure (ASS): 30–50 mg/kgKG in 4 ED, nach 48–72 h Fieberfreiheit auf 3–5 mg/kgKG und Tag reduzieren (ggf. in Kombinationstherapie mit Heparinisierung bei Neugeborenen, Jugendlichen, Patient*innen mit eingeschränkter Herzfunktion oder Kontraindikationen für ASS) + Je nach Risiko-Scores (Risikofaktoren, s. Kawasaki-Leitlinie [29]): Prednisolon 2 mg/kgKG (bei schwerer Erkrankung i.v. Prednisolon-Puls) |
IVIG 2 g/kgKG (max. 80 g) in 1 ED über 12 h + Bei schwerem Verlauf: Methylprednisolon 20–30 mg/kgKG (max. 1 g) i.v. in 1 ED für 3 Tage, danach p.o. und Reduktion je nach Inflammationszustand Bei mittelschwerem Verlauf: Prednisolon 2 mg/kgKG (max. 80 mg) täglich in 2 ED, danach langsame Reduktion + ASS 3–5 mg/kgKG, maximal 100 mg bei Thrombozytenzahl >450.000/µl Ggf. Heparinisierung (s. linke Spalte) |
|
Bei unzureichendem Ansprechen Ggf. 2. Gabe IVIG, Fortsetzung Steroide plus Anakinra (IL-1-Rezeptor-Antagonist) oder Tocilizumab (monoklonaler Antikörper gegen IL-6-Rezeptor) (Bei Kindern < 2 Jahren und V. a. bakterielle Superinfektion IL‑1 bevorzugen aufgrund Zulassung und historischer klinischer Erfahrung) Ggf. auch TNF-Inhibition (Infliximab) |
Bei unzureichendem Ansprechen bzw. Nichtansprechen Fortsetzung Steroide plus Anti-IL-1- oder Anti-IL-6-Therapie (s. linke Spalte) |
| Adjuvante Therapie |
|---|
| Antibiotische Therapie initial bis zum Ausschluss einer bakteriellen Genese |
| Prophylaktische i.v.-Heparinisierung oder niedermolekulares Heparin (insbesondere bei den Patienten mit Kawasaki-like-PIMS, Patienten mit linksventrikulärer Dysfunktion und bei größeren Kindern). Je nach Alter, Schweregrad und Risikofaktoren kann auf eine therapeutische Dosis eskaliert werden |
Studiendesign und Untersuchungsmethoden
Die Daten der in unserer Klinik betreuten Kinder mit PIMS wurden retrospektiv ausgewertet und in den Kontext der aktuellen Literatur über PIMS gestellt.
Ergebnisse
In unserer Klinik präsentierten sich zwischen Juni 2020 und Juni 2021 elf Patient*innen mit PIMS, davon wurde ein junger Erwachsener in der Klinik für Pneumologie und Infektiologie betreut. Die Altersverteilung reichte von 4 bis 18 Jahren (Median = 11); sechs waren männlich.
Der 18-Jährige hatte eine Adipositas II° (BMI 37,2 kg/m2), 3 Patient*innen hatten eine Adipositas (BMI > 97. P.), 2 ein Übergewicht (BMI > 90. P.) und 3 lagen mit dem BMI über der 75. P. Nur ein Patient hatte mit einem BMI von 13,1 kg/m2 (2. P.) ein niedriges Gewicht.
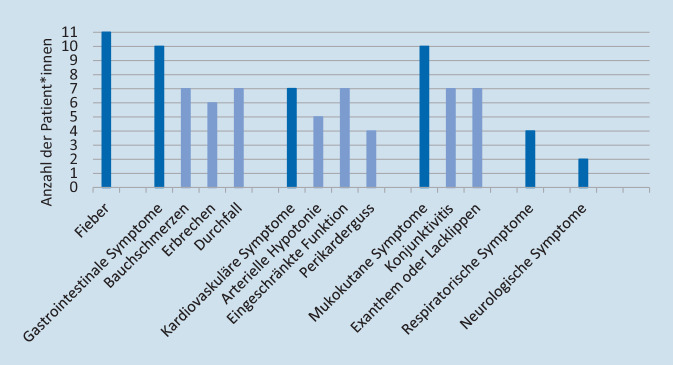
Die Häufigkeiten klinischer Zeichen sind in Abb. 2 vermerkt.
Fieber trat bei allen auf. Gastrointestinale Symptome waren mit Bauchschmerzen und/oder Diarrhö und/oder Erbrechen ebenfalls bei fast allen vertreten. 4 Patient*innen wurden mit der Verdachtsdiagnose Appendizitis aufgenommen; bei einem Patienten fanden sich bildmorphologisch eine ausgeprägte terminale Ileitis und ileozäkale Lymphadenopathie, sodass zunächst die Verdachtsdiagnose eines M. Crohn gestellt wurde.
Kardiovaskuläre Symptome waren eine arterielle Hypotonie und eine eingeschränkte linksventrikuläre Funktion. Bei 2 Patient*innen fielen supraventrikuläre Extrasystolen auf, bei einem der beiden zudem eine beinahe täglich auftretende selbstlimitierende supraventrikuläre Tachykardie bis zu einer Herzfrequenz von 200/min. Echokardiographisch fanden sich eine eingeschränkte linksventrikuläre Funktion und Perikardergüsse; Koronaraneurysmen traten nicht auf.
Mukokutane Symptome mit Exanthem oder Konjunktivitis zeigten sich bei allen pädiatrischen Patient*innen, nicht aber bei dem 18-Jährigen.
Respiratorisch zeigte sich eine Partialinsuffizienz. Keines der Kinder zeigte klinische oder radiologische Zeichen einer Pneumonie. Der 18-Jährige präsentierte sich initial mit einer prolongierten ambulant erworbenen Pneumonie und parapneumonischem Erguss nach COVID‑19-Pneumonie.
Es wurden bei 3 Patient*innen Liquoruntersuchungen durchgeführt, bei 2 zeigte sich der Befund unauffällig, bei einem Patienten mit einer Pleozytose von 31 Zellen im Liquor lieferte ein nachfolgend durchgeführtes cMRT einen unauffälligen Befund.
Die Nierenbeteiligung mit Proteinurie normalisierte sich im Verlauf. Sonographisch fand sich bei einem Patienten ein geschwollenes Nierenparenchym, das im Verlauf komplett regredient war.
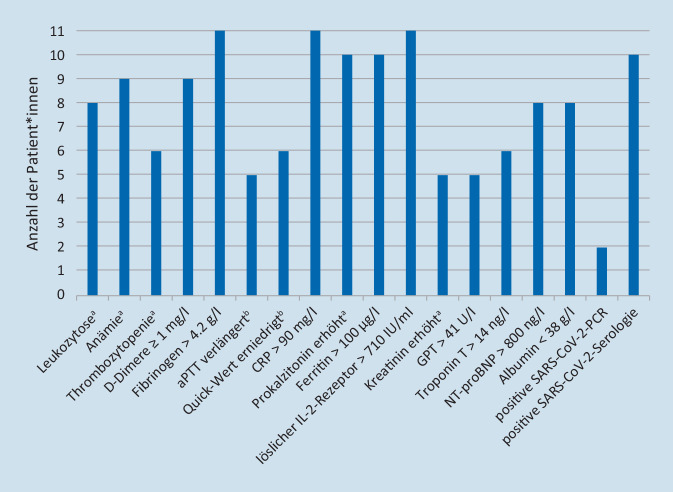
Die laborchemischen Veränderungen sind in Abb. 3 aufgeschlüsselt.
Im Differenzialblutbild fielen bei 9 Patient*innen eine Neutrophilie und eine Lymphopenie auf. 9 Patient*innen hatten entweder eine Troponin-T- oder eine NT-proBNP-Erhöhung, bei 5 waren beide Herzenzyme erhöht. Obwohl bei einer 10-jährigen Patientin mit einem Troponin T von 244 ng/l und einem NT-proBNP von 51.841 ng/l enorm hohe Werte nachweisbar waren, zeigten sich EKG und Echokardiographie wiederholt unauffällig. Der Inflammationsparameter CRP war z. T. stark erhöht (95,20–409,8 mg/l). Zudem zeigten alle eine Koagulopathie mit einer Erhöhung der D‑Dimere (1–12,27 mg/l) und Fibrinogenerhöhung (4,6–8,4 g/l) sowie 5 Patient*innen eine zusätzliche aPTT-Verlängerung. Ebenso zeigte sich stets eine Hyperinflammation mit deutlichen Erhöhungen von Ferritin (243–7198 µg/l) und löslichem IL-2-Rezeptor (760–18.840 IU/ml). Zwei Patient*innen hatten deutlich erhöhte Nierenretentionswerte (Kreatinin max. 2,05/2,35 mg/dl), die wir im Rahmen einer Hypovolämie als akutes prärenales Nierenversagen interpretierten.
Nur ein Patient hatte sowohl eine negative SARS-CoV-2-PCR als auch -Serologie.
Alle Patient*innen wurden zunächst antibiotisch behandelt; Blutkulturen waren bei allen negativ.
6 Patient*innen wurden zwischenzeitlich für 2 bis 8 Tage auf die Kinderintensivstation verlegt. 5 Patient*innen benötigten aufgrund einer arteriellen Hypotonie trotz Volumengaben über max. 4 Tage eine i.v.-Katecholamintherapie, 3 Patient*innen eine High-flow-Atemunterstützung.
Die einmalige IVIG-Gabe war bei 8 Patient*innen effektiv, zwei benötigten 2 Gaben IVIG. Bei einer 11-jährigen Patientin besserte sich der klinische Zustand noch vor der Diagnosestellung deutlich, sodass sie keine Immunglobuline erhielt. Die weitere Therapie ist in Tab. 4 dargestellt.
| Immunglobuline (IVIG) | ASS (30–50 mg/kgKG) bis 48–72 h nach Fieberfreiheit, dann 3–5 mg/kgKG | ASS 3–5 mg/kgKG | Thromboseprophylaxe mit niedermolekularem Heparin s.c. | Prednisolon p.o. |
|---|---|---|---|---|
| 10 | 9a | 1 | 7 | 5 |
aBei 2 Patient*innen musste bei Thrombozytopenie die ASS-Gabe im Verlauf bis zur Normalisierung der Thrombozytenzahl ausgesetzt werden
Alle waren bei Entlassung nach einer Liegedauer von 4 bis 12 Tagen bei den pädiatrischen Patient*innen und 51 Tagen bei dem 18-Jährigen symptomfrei. Bei 7 bestanden noch erhöhte Inflammationsparameter, bei dem 18-Jährigen zeigte sich zudem noch eine leicht eingeschränkte linksventrikuläre Funktion.
Diskussion
Seit Juni 2020 wurden in unserer Klinik 11 Patient*innen mit PIMS diagnostiziert.
Der leichte Trend zur Jungenwendigkeit sowie die Altersverteilung zwischen 4 und 18 Jahren lassen sich auch in der Literatur so wiederfinden [15, 17–19], ebenso wie das bei uns bei 7/11 vorliegende Übergewicht. Dies untermauert die Vermutung, dass Übergewicht ein Risikofaktor für die Manifestation eines PIMS darstellt [13, 16, 17].
Klinisch zeigten unsere Patient*innen sehr variable Symptome; die Diagnosestellung erfolgte bei den pädiatrischen Patient*innen zwischen dem 1. und 3., bei dem 18-Jährigen nach 13 Tagen.
Bis auf eine Patientin zeigten übereinstimmend mit der aktuellen Literatur alle eine gastrointestinale Beteiligung sowie z. T. sonographische Auffälligkeiten im Sinne einer Inflammation [15, 17–19, 26]. Im PIMS-Survey (Stand 18.07.2021) wurde zu 24 % eine Gastroenteritis und zu 11 % eine Appendizitis als Verdachtsdiagnose bei Aufnahme angegeben [15], was sich mit unseren Beobachtungen deckt. In einer Studie von Miller et al. zeigte sich, dass sich 29,5 % der im Verlauf stationär mit PIMS aufgenommenen Patient*innen innerhalb einer Woche vor Aufnahme mit gastrointestinalen Symptomen in einer Rettungsstelle oder einem akutmedizinischen Zentrum vorgestellt hatten [30].
Übereinstimmend mit unseren Beobachtungen zeigen sich auch in den bisher publizierten Studien eine häufige kardiovaskuläre Beteiligung und echokardiographische Auffälligkeiten wie Perikardergüsse oder Myokarditis [18, 19, 26]. Koronararterienaneurysmata waren im Vergleich zur publizierten Literatur bei uns nicht zu finden [13, 17, 19, 26, 28]. In einem systematischen Review von Ahmed et al. zeigten sich bei einer Mehrzahl der Patient*innen bei initial unauffälliger Echokardiographie erst im Verlauf der Erkrankung echokardiographisch eine Funktionsstörung sowie teilweise Koronaraneurysmata [13], sodass repetitive Echokardiographien notwendig sind.
Die Beobachtung, dass respiratorische Symptome, wie sie bei SARS-CoV‑2 vorkommen, meist nicht schwerwiegend sind, Husten, Hypoxie und Dyspnoe aber auftreten können [17], ließ sich auch in unserem Kollektiv wiederfinden.
Zwei unserer Patient*innen zeigten neurologische Symptome, die den Verdacht auf eine Meningitis bzw. Enzephalitis begründeten. Im DGPI-Survey war die Meningitis zu 6 % (Stand 18.07.2021) die Verdachtsdiagnose bei der stationären Aufnahme [15]. Esposito und Principi berichten in ihrer Übersichtsarbeit sogar bei 22–55 % der Patient*innen von neurologischen Symptomen wie Kopfschmerzen, Dysarthrie und Dysphagie, Meningismus, Ataxie, Muskelschwäche und abgeschwächten Reflexen [18].
Die in unserem Patient*innenkollektiv gezeigte Affektion der Niere findet sich auch in der Literatur wieder, hier ist ein Nierenversagen mit bis zu 38 % beschrieben, eine Nierenersatztherapie war jedoch fast nie notwendig [7, 13, 18].
Nur 2 Patient*innen hatten unauffällige Herzenzyme, bei den anderen waren diese Werte z. T. drastisch erhöht. Übereinstimmend sind die kardialen Marker praktisch ausnahmslos als stark erhöht beschrieben [13, 14, 16], z. T. wurde bei 33–68 % von einer Troponin-T- und bei 44–73 % von einer NT-proBNP-Erhöhung berichtet [13, 14, 16, 19, 26, 28]. Ausgehend von der Annahme, dass ACE-2-Rezeptoren eine elementare Rolle beim Eintritt von SARS-CoV‑2 in die Zelle spielen [31] und der Menge der ACE-2-Rezeptoren im Myokardgewebe, erscheint dies nicht überraschend.
Die bei unseren Patient*innen beobachteten Blutbildveränderungen mit Leukozytose, Neutrophilie, Lymphopenie, Thrombopenie und Anämie sind auch in der Literatur zu finden [13, 19]. Womöglich spiegelt das Ausmaß der Separation der Neutrophilen und Lymphozyten das Ausmaß der Inflammation wider [13].
Die laborchemischen Entzündungsparameter, insbesondere CRP, Prokalzitonin sowie Ferritin, sind in der Literatur stets als stark erhöht beschrieben [14, 17–19].
Nur bei einem Patienten waren die SARS-CoV-2-PCR sowie die Antikörperdiagnostik nicht wegweisend. Hier erfolgte die Diagnosestellung durch das Zusammenspiel von Klinik, passender Laborchemie und auffälliger Echokardiographie. Auch in der Literatur sind der positive Nachweis einer SARS-CoV-2-PCR nur bei 14–45 % der PIMS-Patient*innen und der Antikörpernachweis mit 75–87 % beschrieben [7, 15, 21].
6 unserer Patient*innen wurden zwischenzeitlich auf der Kinderintensivstation betreut, 5 benötigten eine Katecholamintherapie. Dies stimmt ebenfalls mit den publizierten Daten überein, wo die Notwendigkeit der Intensivbetreuung bei 44 bis > 90 % der Fälle lag [13, 14, 17–19] und 42–80 % der Patient*innen vasoaktive Medikamente benötigten [13, 16, 19].
Es liegt eine deutschsprachige Therapieempfehlung zur Behandlung des PIMS aus dem November 2020 vor [11]. Wir behandelten 9 der Patient*innen hochdosiert mit ASS. Die Entscheidung zur Gabe von Steroiden war jeweils eine Einzelfallentscheidung, u. a. dadurch erklärbar, dass zu dem Zeitpunkt der jeweiligen Gabe die Therapieempfehlungen teilweise noch nicht vorlagen. Eine Kombinationstherapie aus Immunglobulinen und Methylprednisolon/Prednisolon scheint aktuell bessere Ergebnisse zu zeigen [12, 32]; weitere Studien sind jedoch noch notwendig.
Die Limitationen folgender Arbeit ergeben sich aus dem retrospektiven und beschreibenden Charakter sowie der kleinen Fallzahl.
Fazit für die Praxis
PIMS ist eine schwere akute hyperinflammatorische Erkrankung im Zusammenhang mit einer SARS-CoV-2-Infektion.
Die Klinik ist variabel, und PIMS muss insbesondere bei Fieber unklarer Genese in Betracht gezogen werden.
Zur Diagnostik gehören neben der Suche nach teils flüchtigen klinischen Zeichen eine detaillierte Labor- und sonographische Diagnostik.
Für die Therapie muss zwischen Nicht-Kawasaki-Phänotyp und Kawasaki-Phänotyp unterschieden werden.
Es kommen intravenöse Immunglobuline und/oder Steroide, ASS und ggf. Biologika zum Einsatz.
Zum weiteren Erkenntnisgewinn sollten eigene Beobachtungen und Erfahrungen gerne an das DGPI-PIMS-Register gemeldet werden.
Einhaltung ethischer Richtlinien
Interessenkonflikt
N. Glaser, M. Boeckelmann, F. Dejas, I. Östreicher, J. Grüner, A. Höche, S. Akanbi, D. Thiemig und R. Rossi geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien. Diese retrospektive Studie erfolgte nach Konsultation der zuständigen Ethikkommission und im Einklang mit nationalem Recht.
Footnotes
M. Boeckelmann und N. Glaser trugen in gleicher Weise zu dieser Arbeit bei und sind daher beide als Erstautor*innen zu nennen

QR-Code scannen & Beitrag online lesen
Contributor Information
Moritz Boeckelmann, Email: moritz.boeckelmann@vivantes.de.
Nicola Glaser, Email: nicola.glaser@vivantes.de.
Literatur
- 1.Jones VG, Mills M, Suarez D, Hogan CA, Yeh D, Segal JB, Nguyen EL, Barsh GR, Maskatia S, Mathew R. COVID-19 and Kawasaki disease: novel virus and novel case. Hosp Pediatr. 2020;10(6):537–540. doi: 10.1542/hpeds.2020-0123. [DOI] [PubMed] [Google Scholar]
- 2.Riphagen S, Gomez X, Gonzalez-Martinez C, Wilkinson N, Theocharis P. Hyperinflammatory shock in children during COVID-19 pandemic. Lancet. 2020;395(10237):1607–1608. doi: 10.1016/S0140-6736(20)31094-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Sood M, Sharma S, Sood I, Sharma K, Kaushik A. Emerging evidence on multisystem inflammatory syndrome in children associated with SARS-CoV-2 infection: a systematic review with meta-analysis. SN Compr Clin Med. 2021 doi: 10.1007/s42399-020-00690-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Feldstein LR, Tenforde MW, Friedman KG, et al. Characteristics and outcomes of US children and adolescents with multisystem inflammatory syndrome in children (MIS-C) compared with severe acute COVID-19. JAMA. 2021;325(11):1074. doi: 10.1001/jama.2021.2091. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Belay ED, Abrams J, Oster ME, Giovanni J, Pierce T, Meng L, Prezzato E, Balachandran N, Openshaw JJ, Rosen HE, Kim M, Richardson G, Hand J, Tobin-D’Angelo M, Wilson S, Hartley A, Jones C, Kolsin J, Mohamed H, Colles Z, Hammett T, Patel P, Stierman B, Campbell AP, Godfred-Cato S. Trends in geographic and temporal distribution of US children with multisystem inflammatory syndrome during the COVID-19 pandemic. JAMA Pediatr. 2021 doi: 10.1001/jamapediatrics.2021.0630. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Cattalini M, Paolera DS, Zunica F, Bracaglia C, Giangreco M, Verdoni L, Meini A, Sottile R, Caorsi R, Zuccotti G, Fabi M, Montin D, Meneghel A, Consolaro A, Dellepiane RM, Maggio MC, La Torre F, Marchesi A, Simonini G, Villani A, Cimaz R, Ravelli A, Taddio A. Defining Kawasaki disease and pediatric inflammatory multisystem syndrome-temporally associated to SARS-CoV-2 infection during SARS-CoV-2 epidemic in Italy: results from a national, multicenter survey. Pediatr Rheumatol Online J. 2021;19(1):29. doi: 10.1186/s12969-021-00511-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Whittaker E, Bamford A, Kenny J, Kaforou M, Jones CE, Shah P, Ramnarayan P, Fraisse A, Miller O, Davies P, Kucera F, Brierley J, McDougall M, Carter M, Tremoulet A, Shimizu C, Herberg J, Burns JC, Lyall H, Levin M. Clinical characteristics of 58 children with a pediatric inflammatory multisystem syndrome temporally associated with SARS-CoV-2. JAMA. 2020 doi: 10.1001/jama.2020.10369. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Royal College of Paediatrics and Child Health . Guidance: Paediatric multisystem inflammatory syndrome temporally associated with COVID-19. 2020. [Google Scholar]
- 9.CDC (2020) Multisystem inflammatory syndrome in children (MIS-C) associated with coronavirus disease 2019 (COVID-19). https://emergency.cdc.gov/han/2020/han00432.asp. Zugegriffen: 8. Apr. 2021
- 10.World Health Organization . Multisystem inflammatory syndrome in children and adolescents with COVID-19: scientific brief, 15 May 2020. Technical documents. 2020. [Google Scholar]
- 11.Deutsche Gesellschaft für Pädiatrische Infektiologie (2020) Stellungnahme der DGPI, GPP, API, GKJR, DGPK und STAKOB zur klinischen Präsentation und zur medikamentösen Behandlung von Kindern mit COVID-19. https://dgpi.de/stellungnahme-medikamentoesen-behandlung-kindern-covid-19/. Zugegriffen: 8. Apr. 2021
- 12.Ouldali N, Toubiana J, Antona D, et al. Association of intravenous immunoglobulins plus methylprednisolone vs immunoglobulins alone with course of fever in multisystem inflammatory syndrome in children. JAMA. 2021;325(9):855–864. doi: 10.1001/jama.2021.0694. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Ahmed M, Advani S, Moreira A, Zoretic S, Martinez J, Chorath K, Acosta S, Naqvi R, Burmeister-Morton F, Burmeister F, Tarriela A, Petershack M, Evans M, Hoang A, Rajasekaran K, Ahuja S, Moreira A. Multisystem inflammatory syndrome in children: a systematic review. EClinicalMedicine. 2020;26:100527. doi: 10.1016/j.eclinm.2020.100527. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Abrams JY, Oster ME, Godfred-Cato SE, Bryant B, Datta SD, Campbell AP, Leung JW, Tsang CA, Pierce TJ, Kennedy JL, Hammett TA, Belay ED. Factors linked to severe outcomes in multisystem inflammatory syndrome in children (MIS-C) in the USA: a retrospective surveillance study. Lancet Child Adolesc Health. 2021 doi: 10.1016/S2352-4642(21)00050-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Deutsche Gesellschaft für Pädiatrische Infektiologie (2021) PIMS Survey Update: 2021, Kalenderwoche 28. https://dgpi.de/pims-survey-update/. Zugegriffen: 21. Juli 2021
- 16.Godfred-Cato S, Bryant B, Leung J, Oster ME, Conklin L, Abrams J, Roguski K, Wallace B, Prezzato E, Koumans EH, Lee EH, Geevarughese A, Lash MK, Reilly KH, Pulver WP, Thomas D, Feder KA, Hsu KK, Plipat N, Richardson G, Reid H, Lim S, Schmitz A, Pierce T, Hrapcak S, Datta D, Morris SB, Clarke K, Belay E. COVID-19-associated multisystem inflammatory syndrome in children—United States, March-July 2020. MMWR Morb Mortal Wkly Rep. 2020;69(32):1074–1080. doi: 10.15585/mmwr.mm6932e2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Rafferty MS, Burrows H, Joseph JP, Leveille J, Nihtianova S, Amirian ES. Multisystem inflammatory syndrome in children (MIS-C) and the coronavirus pandemic: current knowledge and implications for public health. J Infect Public Health. 2021;14(4):484–494. doi: 10.1016/j.jiph.2021.01.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Esposito S, Principi N. Multisystem inflammatory syndrome in children related to SARS-CoV-2. Paediatr Drugs. 2021 doi: 10.1007/s40272-020-00435-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Feldstein LR, Rose EB, Horwitz SM, et al. Multisystem inflammatory syndrome in U.S. children and adolescents. N Engl J Med. 2020;383(4):334–346. doi: 10.1056/NEJMoa2021680. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Consiglio CR, Cotugno N, Sardh F, Pou C, Amodio D, Rodriguez L, Tan Z, Zicari S, Ruggiero A, Pascucci GR, Santilli V, Campbell T, Bryceson Y, Eriksson D, Wang J, Marchesi A, Lakshmikanth T, Campana A, Villani A, Rossi P, Landegren N, Palma P, Brodin P. The immunology of multisystem inflammatory syndrome in children with COVID-19. Cell. 2020;183(4):968–981.e7. doi: 10.1016/j.cell.2020.09.016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Carter MJ, Shankar-Hari M, Tibby SM. Paediatric inflammatory multisystem syndrome temporally-associated with SARS-CoV-2 infection: an overview. Intensive Care Med. 2021;47(1):90–93. doi: 10.1007/s00134-020-06273-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Dolhnikoff M, Ferreira Ferranti J, de Almeida Monteiro RA, Duarte-Neto AN, Soares Gomes-Gouvêa M, Viu Degaspare N, Figueiredo Delgado A, Montanari Fiorita C, Nunes Leal G, Rodrigues RM, Taverna Chaim K, Rebello Pinho JR, Carneiro-Sampaio M, Mauad T, Ferraz da Silva LF, Brunow de Carvalho W, Saldiva PHN, Garcia Caldini E. SARS-CoV-2 in cardiac tissue of a child with COVID-19-related multisystem inflammatory syndrome. Lancet Child Adolesc Health. 2020;4(10):790–794. doi: 10.1016/S2352-4642(20)30257-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Park A, Iwasaki A. Type I and type III interferons—induction, signaling, evasion, and application to combat COVID-19. Cell Host Microbe. 2020;27(6):870–878. doi: 10.1016/j.chom.2020.05.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Rowley AH. Understanding SARS-CoV-2-related multisystem inflammatory syndrome in children. Nat Rev Immunol. 2020;20(8):453–454. doi: 10.1038/s41577-020-0367-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Evans C, Davies P. SARS-CoV-2 paediatric inflammatory syndrome. Paediatr Child Health. 2021;31(3):110–115. doi: 10.1016/j.paed.2020.12.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Radia T, Williams N, Agrawal P, Harman K, Weale J, Cook J, Gupta A. Multi-system inflammatory syndrome in children & adolescents (MIS-C): a systematic review of clinical features and presentation. Paediatr Respir Rev. 2020 doi: 10.1016/j.prrv.2020.08.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Abrams JY, Godfred-Cato SE, Oster ME, Chow EJ, Koumans EH, Bryant B, Leung JW, Belay ED. Multisystem inflammatory syndrome in children associated with severe acute respiratory syndrome coronavirus 2: a systematic review. J Pediatr. 2020 doi: 10.1016/j.jpeds.2020.08.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Haghighi Aski B, Manafi Anari A, Abolhasan Choobdar F, Zareh Mahmoudabadi R, Sakhaie M. Cardiac abnormalities due to multisystem inflammatory syndrome temporally associated with Covid-19 among children: a systematic review and meta-analysis. Int J Cardiol Heart Vasc. 2021 doi: 10.1016/j.ijcha.2021.100764. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Leitlinie Kawasaki Syndrom. S2k Leitlinie. https://www.awmf.org/uploads/tx_szleitlinien/185-003l_S2k_Kawasaki-Syndrom_2021-01.pdf. Zugegriffen: 14. Jan. 2022
- 30.Miller J, Cantor A, Zachariah P, Ahn D, Martinez M, Margolis KG. Gastrointestinal symptoms as a major presentation component of a novel multisystem inflammatory syndrome in children that is related to coronavirus disease 2019: a single center experience of 44 cases. Gastroenterology. 2020;159(4):1571–1574.e2. doi: 10.1053/j.gastro.2020.05.079. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Xu H, Zhong L, Deng J, Peng J, Dan H, Zeng X, Li T, Chen Q. High expression of ACE2 receptor of 2019-nCoV on the epithelial cells of oral mucosa. Int J Oral Sci. 2020;12(1):8. doi: 10.1038/s41368-020-0074-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Son MBF, Murray N, Friedman K, et al. Multisystem inflammatory syndrome in children—initial therapy and outcomes. N Engl J Med. 2021 doi: 10.1056/NEJMoa2102605. [DOI] [PMC free article] [PubMed] [Google Scholar]