Abstract
目的
探究人源骨骼肌电压门控钠通道hNav1.4 I1363T突变体导致患者出现先天性副肌强直症状的机制。
方法
利用氨基酸序列比对,检测hNav1.4 I1363位点的保守性;将hNav1.4蛋白的羧基端融合荧光蛋白mCherry,利用共聚焦显微镜观察hNav1.4野生型与I1363T突变体蛋白的表达量与分布情况;通过全细胞电生理技术记录野生型与I1363T突变体的稳态激活及快失活参数,并进一步分析野生型与I1363T突变体的窗电流。
结果
hNav1.4 I1363位点在各类钠通道中高度保守。野生型与I1363T突变体均能正常上膜,且表达量无明显差异。野生型与I1363T突变体的50%激活电压 V 0.5 分别为(-29.08±0.24)mV和(-28.79±0.21)mV,斜率因子 k分别为5.06±0.21和4.73±0.18(均 P>0.05);野生型与I1363T突变体的50%失活电压 V 0.5 分别为(-68.03±0.34)mV和(-59.01±0.26)mV,斜率因子 k分别为4.55±0.21和5.24±0.23(均 P<0.05),I1363T突变体的失活电压向去极化方向移动,且更为平缓。I1363T突变体形成的窗电流大于野生型的窗电流。
结论
I1363T突变会导致hNav1.4慢失活受损,增加肌肉细胞兴奋性,导致肌强直的发生;而增大的窗电流使得钠离子在细胞内缓慢聚集,最终导致细胞兴奋性下降,引发肌无力。
Abstract
Objective
To investigate the mechanism of congenital paramyotonia caused by human skeletal muscle voltage-gated sodium channel hNav1.4 mutant I1363T.
Methods
The conservation of the mutant site were detecled by using amino acid sequence alignment; the C-terminal mCherry fusion hNav1.4 was constructed, and the expression and distribution of wild type and hNav1.4 mutant I1363T were determined by confocal microscopy; the steady-state activation, fast inactivation and window current of wild type and hNav1.4 mutant I1363T were examined by whole-cell patch clamp.
Results
Alignment of the amino acid sequences revealed that Ile1363 is highly conserved in human sodium channels. There was no significant difference in expression level and distribution between wild type and I1363T. Although no significant differences were observed between I1363T mutant and wild type in the activation upon channel gating, the V 0.5 of voltage-dependence of fast inactivation of I1363T mutant [(-59.01±0.26) mV] shifted 9 mV towards depolarization as compared with wild type [(-68.03±0.34) mV], and the slope factor of voltage-dependence curve increased to (5.24±0.23) mV, compared with (4.55±0.21) mV of the wild type. Moreover, I1363T showed the larger window current than that of the wild type.
Conclusions
I1363T causes the defect in fast inactivation of hNav1.4, which may increase the excitability of muscle cells and be responsible for myotonia. The increased window current of I1363T may result in an increase of inward Na + current, could subsequently inactivate the channels and lead to loss of excitability and paralysis.
Keywords: Muscle, skeletal/physiopathology; Myotonia congenita/genetics; Gene expression; Voltage-gated sodium channels/genetics; Mutation; Transfection
先天性副肌强直是一类与电压门控离子通道相关的家族遗传疾病,其主要特点是幼年发病,且寒冷或运动等易引发患者肌强直或肌无力症状 [ 1, 2] 。先天性副肌强直最常见的病因是编码人骨骼肌电压门控钠通道4型α亚基(hNav1.4)的 SCN4A基因发生突变,使得通道功能变化,最终导致肌肉细胞功能异常 [ 3, 4, 5] 。
电压门控钠通道是一类主要存在于神经和肌肉细胞上的膜蛋白,发挥起始与传递动作电位的作用 [ 6] 。当细胞膜电位达阈电位时,电压门控钠通道从静息变为开放状态,导致细胞膜电位去极化,在持续去极化过程中,通道又从开放转变为关闭的失活状态。电压门控钠通道功能的变化可能影响细胞动作电位的产生与传递,继而影响细胞的兴奋性 [ 7, 8, 9] 。
已有报道表明,当hNav1.4的1363位异亮氨酸突变成苏氨酸后(I1363T),患者会产生副肌强直症状 [ 10] 。本研究利用细胞培养体外表达hNav1.4通道蛋白,结合全细胞电生理技术,从蛋白质水平检测I1363T突变对hNav1.4激活、失活等功能的影响,并进一步探究该突变的致病机制。
1 材料与方法
1.1 试剂与仪器
无缝克隆试剂盒、点突变试剂盒为南京诺唯赞生物科技有限公司产品;pIRES2-EGFP载体、N1-mCherry载体为美国Clontech公司产品;人源 SCN4A和 SCN1B基因为美国Vigene公司产品;DMEM培养液、FBS、青霉素和链霉素混合液(P/S)、胰蛋白酶为美国Gibco公司产品;多聚赖氨酸为美国Sigma-Aldrich公司产品;生物安全柜为海尔公司产品;二氧化碳培养箱为美国Thermo Fisher Scientific公司产品;FV1000激光共聚焦显微镜为日本Olympus公司产品;玻璃微电极、P97 电极拉制仪、微操仪为美国Sutter公司产品;MultiClamp 700B 放大器、DigiData 1440 数模转换器、pClamp 10.2数据采集分析软件为荷兰Axon公司产品。
1.2 载体构建与定点突变
利用无缝克隆试剂盒将人源 SCN4A的野生型cDNA克隆到N1-mCherry载体上,mCherry的DNA序列位于 SCN4A cDNA序列的3′之后,且两段序列之间无终止密码子,使得该载体能够表达hNav1.4的羧基端融合mCherry蛋白。将人源 SCN1B基因克隆到pIRES2-EGFP载体上。利用点突变试剂盒,将 SCN4A的4087至4089位碱基突变为ACG,使表达的hNav1.4第1363位的异亮氨酸突变成苏氨酸(I1363T)。对野生型质粒与I1363T突变体质粒进行全长测序,确保没有额外的突变位点。
1.3 细胞培养与转染
HEK293细胞种植于60 mm的培养皿中,并置于37 ℃ 5% 二氧化碳培养箱中培养,使用含10% FBS和1% P/S的DMEM培养基。当细胞生长至铺满培养皿底部时进行传代处理。取出培养皿,弃上清液,并用PBS缓冲液清洗残余培养液。取已预热的0.25%胰蛋白酶1 mL消化细胞1~2 min后,加入2 mL培养液中和胰蛋白酶的消化作用,用移液器轻柔吹打底层细胞使其悬浮,并转移至离心管中,200 × g离心5 min。离心完成后弃上清液,用培养液重悬浮细胞。取适当密度的细胞种植于多聚赖氨酸包被过的8 mm × 8 mm方玻片上,37 ℃、5% 二氧化碳恒温培养箱中培养。培养24 h后,用脂质体转染法分别将野生型质粒和I1363T突变体质粒与pIRES2-SCN1B-EGFP共转染HEK293细胞。转染24 h后用于电生理记录实验。
1.4 激光共聚焦显微镜成像检测I1363T突变体的蛋白表达量与分布情况
野生型质粒和I1363T突变体质粒分别转染HEK293细胞24 h后,通过激光共聚焦显微镜检测红色荧光蛋白的分布。取出种植于方玻片表面的细胞,用细胞外液清洗2次后浸泡于盛有细胞外液的35 mm小平皿中,镜下观察。
1.5 全细胞电生理技术检测I1363T突变体的稳态激活及快失活参数
质粒转染细胞18~24 h后,在荧光显微镜下选取有表达红色荧光蛋白(mCherry)与绿色荧光蛋白(EGFP)的细胞,即共表达了hNav1.4和SCN1B两种蛋白的细胞来进行电生理实验。全细胞记录在室温(25 ℃)条件下进行。利用电极拉制仪将玻璃微电极拉制成电阻1~1.5 Ω开口大小。细胞放置于细胞外液中(含145 mmol/L氯化钠、4 mmol/L 氯化钾、1.8 mmol/L氯化钙、1 mmol/L氯化镁、10 mmol/L葡萄糖、10 mmol/L HEPES),用氢氧化钠调节酸碱度至7.35,用蔗糖将渗透浓度调至 310 mmol/L;玻璃微电极灌注电极内液(含10 mmol/L氟化钠、 110 mmol/L氟化铯、20 mmol/L 氯化铯、2 mmol/L EGTA、10 mmol/L HEPES),用氢氧化铯调节酸碱度至7.35,用蔗糖将渗透浓度调至310 mmol/L。数据的采样量为20 kHz,过滤值为5 kHz。串联电阻补偿为80%~90%,以减少电压差。使用pClamp 10.2软件进行电流曲线分析。
记录通道激活特征的具体步骤为:将细胞钳制在-120 mV电压下,然后给予100 ms从-80 mV至+90 mV、步阶5 mV的去极化刺激来诱发通道开放。不同电压下的电流值需除以该次记录中的最大电流值来进行标化处理。以标化过后的数据作图,可得到电流-电压曲线,通过该曲线中的数值,带入方程 G= I/( V- V rev),获得不同电压下的电导值,进一步获得电导-电压曲线。将电导-电压曲线进行标准玻尔兹曼(Boltzmann)分布拟合 G( V)/ G max =1/{1+ exp[-( V- V 0.5)/ k]},可得50%开放电压( V 0.5值)及斜率因子( k值)。
记录通道快失活特征的具体步骤为:将细胞钳制在-120 mV电压下,给予500 ms从-150 mV至-10 mV、步阶为10 mV的预刺激,再给予40 ms、 -10 mV的测试电压,记录不同预刺激情况下仍未失活的通道电流,将数据经玻尔兹曼方程 I/ I max = 1/{1+ exp[( V- V 0.5)/ k]}拟合后,可得50%失活电压 V 0.5值及斜率因子 k值。
1.6 统计学方法
使用Prism 6.0软件进行统计学分析。计量资料用均数±标准差( )表示,组间比较采用 t检验, P<0.05为差异有统计学意义。
2 结果
2.1 hNav1.4的I1363位点具有高度保守性
如图 1A所示,hNav1.4蛋白是由一条肽链上4个同源结构域组成的通道蛋白,每个结构域包含6个跨膜区,而I1363T突变发生在第四结构域的第一跨膜区。与其他高等生物(如猕猴、大鼠、小鼠、犬类、鸡)的Nav1.4通道序列比对结果显示,I1363位点高度保守(图 1B);与人源Nav家族其他通道(hNav1.1~1.9)进行序列比对,I1363位点也十分保守(图 1C)。
图1 .
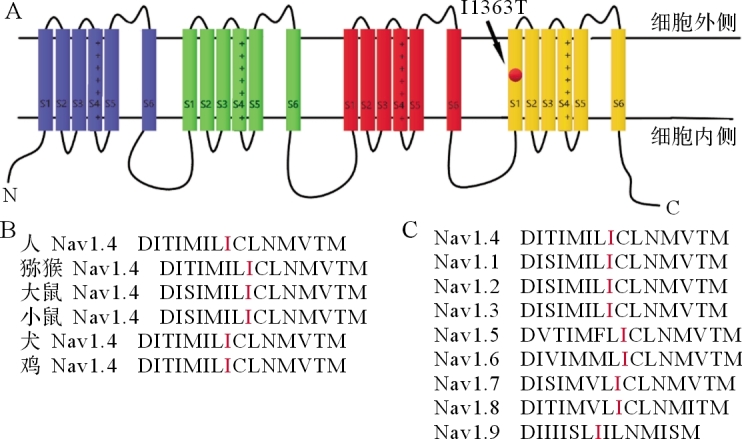
I1363T突变体序列分析A:hNav1.4拓扑学结构图,I1363T突变位于第四结构域第一跨膜区;B:高等动物中Nav1.4的I1363位点序列比对;C:人源各钠通道的I1363位点序列比对.
2.2 I1363T突变体在HEK293细胞上的表达及定位与野生型相似
野生型与突变体hNav1.4蛋白(红色荧光)在HEK293上表达类似,且能够在膜上定位(图 2),提示I1363T突变并未对蛋白的定位产生影响。
图2 .
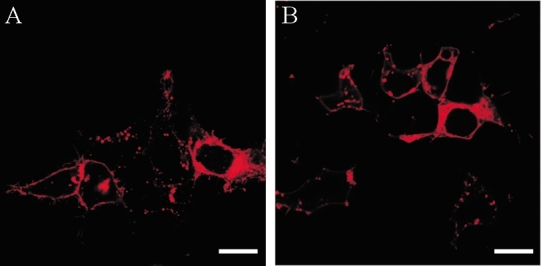
共聚焦显微镜下观察野生型和I1363T突变体在HEK293细胞中的表达及定位A:hNav1.4拓扑学结构图,I1363T突变位于第四结构域第一跨膜区;B:高等动物中Nav1.4的I1363位点序列比对;C:人源各钠通道的I1363位点序列比对.
2.3 I1363T突变体的稳态激活和快失活
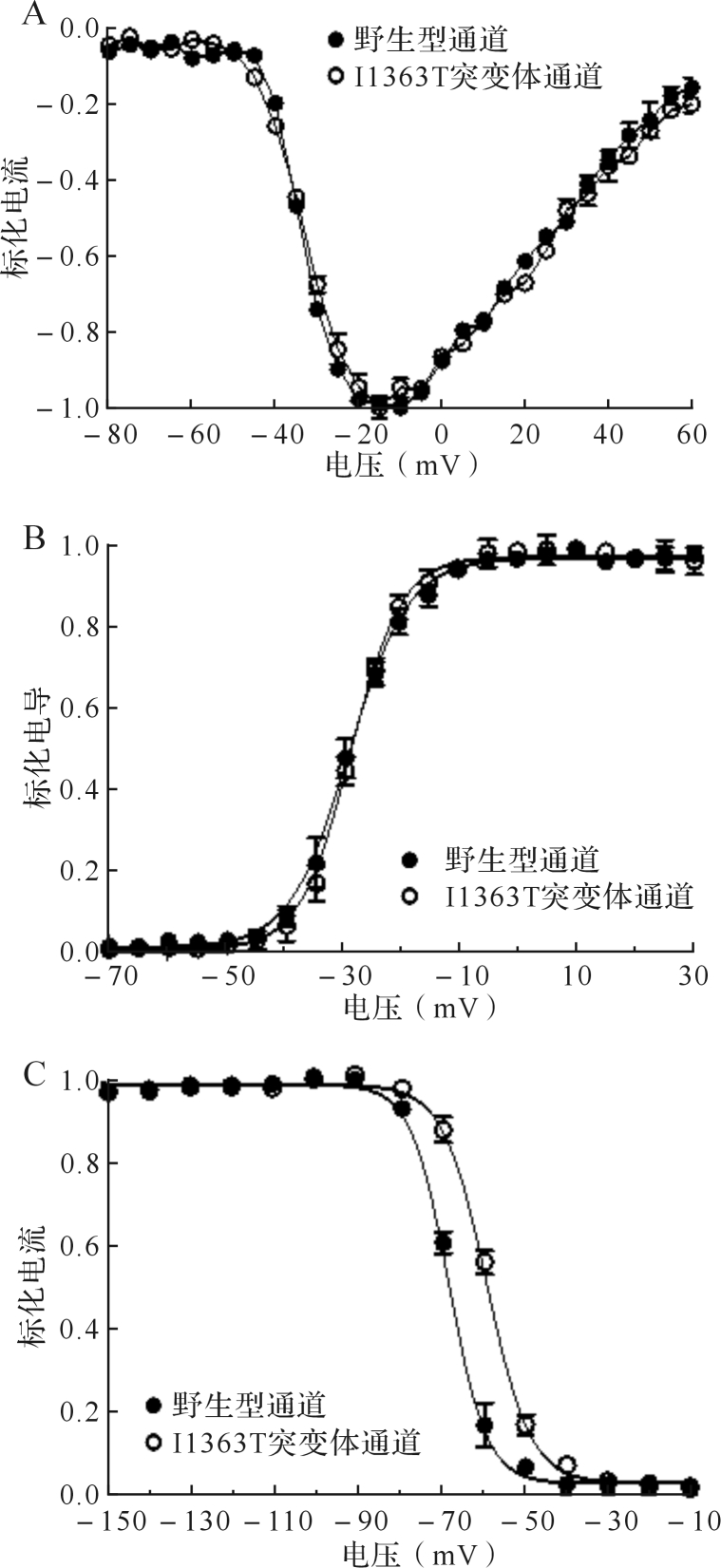
2.3.1 I1363T突变体的稳态激活特征无明显改变 野生型和I1363T突变体通道开放的电流-电压曲线如图 3A所示,将该曲线带入方程 G= I/( V- V rev ),可获得电导-电压曲线(图 3B)。将电导-电压曲线进行标准玻尔兹曼分布拟合,所得野生型通道和I1363T突变体通道的 V 0.5 值分别为(-29.08±0.24)mV和(-28.79±0.21)mV, k值分别为5.06±0.21和4.73±0.18,差异无统计学意义(均 P>0.05)。结果提示,I1363T突变并未明显改变通道的稳态激活参数。
图3 .
I1363T突变体的电压依赖性A:hNav1.4拓扑学结构图,I1363T突变位于第四结构域第一跨膜区;B:高等动物中Nav1.4的I1363位点序列比对;C:人源各钠通道的I1363位点序列比对.
2.3.2 I1363T突变体的稳态快失活受损 如图 3所示,I1363T的快失活曲线较野生型通道偏向去极化方向,野生型通道的 V 0.5 值为(-68.03±0.34)mV,I1363T突变体通道为(-59.01±0.26)mV( P<0.05);野生型通道的快失活曲线比I1363T突变体通道更陡,野生型通道的 k值为4.55±0.21,I1363T突变体通道为5.24±0.23( P<0.05)。
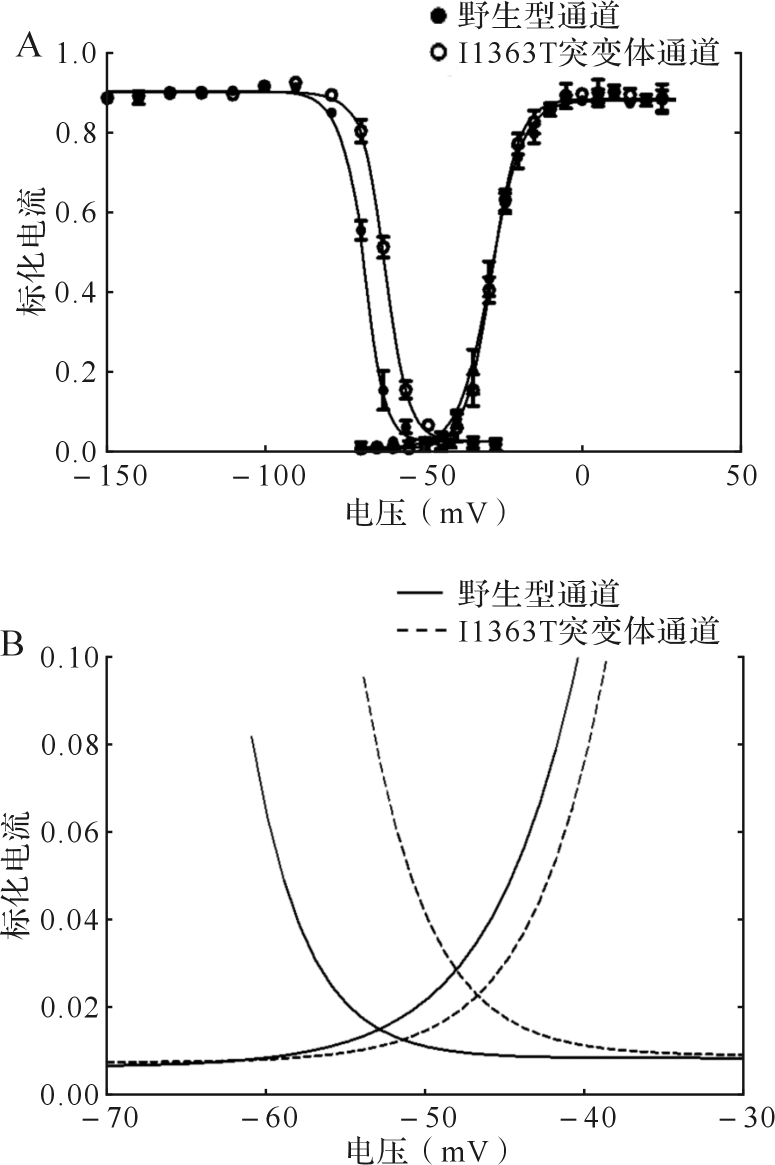
2.3.3 I1363T突变体的窗电流增加 当膜电位处于钠通道尚未完全失活且能够激活通道开放时,产生的电流就是窗电流。窗电流的大小意味细胞钠电流的流入情况,可以通过激活曲线和失活曲线直观描述。如图 4所示,野生型通道与I1363T突变体通道各自的激活曲线与失活曲线重叠的部分,即各自的窗电流。由于I1363T突变体的快失活曲线向去极化方向偏移,其产生的窗电流大于野生型hNav1.4。
图4 .
I1363T突变体的窗电流A:hNav1.4拓扑学结构图,I1363T突变位于第四结构域第一跨膜区;B:高等动物中Nav1.4的I1363位点序列比对;C:人源各钠通道的I1363位点序列比对.
3 讨论
肌肉电压门控钠通道hNav1.4的许多突变体都会改变通道本身的活性,继而影响肌肉细胞的兴奋性,产生各种肌肉异常的疾病,如肌强直、副肌强直、高血钾周期性麻痹、低血钾周期性麻痹及肌无力等 [ 11, 12, 13, 14] 。产生副肌强直的hNav1.4突变体中,大多数为功能获得型突变,或通道的失活受损,或通道的激活增强,或两者皆有之 [ 15, 16, 17] 。本研究检测了hNav1.4突变体I1363T的电生理特性,并与野生型通道的通道特性进行比较。结果发现,I1363T突变后通道的稳态快失活受损,曲线向去极化方向移动。这一现象会导致通道失活延迟或者失活不完全,增加肌纤维细胞的兴奋性,让更多通道处于能够开放的状态,使动作电位的不应期缩短,更易于产生动作电位,最终导致肌肉发生强直 [ 1, 18, 19] 。另一方面,快失活的右移也使得I1363T突变体的窗电流明显增加,从而导致额外的钠离子电流进入肌纤维细胞 [ 20] 。持续电流会使细胞的膜电位趋向于去极化,钠通道逐渐进入缓慢失活状态。当失活的钠通道积累到一定程度后,便难以引发动作电位的产生,使细胞兴奋性下降,产生肌肉麻痹的症状 [ 17, 21] 。
I1363T突变位于hNav1.4通道蛋白第四结构域的第一跨膜区,已有研究表明,M1360V、N1366S、M1370V等处于该区域的突变大多会导致副肌强直症状的产生 [ 13, 22, 23, 24] 。对这些突变的功能分析显示,大多在激活与快失活参数上发生了变化,而慢失活则很少受到影响。已有晶体学数据表明该区域氨基酸与第四跨膜区上电压敏感区的精氨酸通过氢键形成相互作用;而最新的文献报道,氢键的形成与断裂能够在一定程度上改变电压门控钠通道的电压依赖性及离子选择性等特性 [ 25, 26, 27, 28] 。当氢键一端的氨基酸发生改变,如异亮氨酸突变成苏氨酸,则氢键的强弱、角度等都有可能发生变化,继而可能影响通道的激活、失活等,从而使整个通道的功能发生变化 [ 29, 30] 。
在临床上,副肌强直和钾恶化性肌强直患者常服用一种具有局部麻醉功能的Ⅰb类抗心律失常药物美西律来治疗肌强直症状 [ 31] 。已有文献报道,美西律可以有效增强hNav1.4的快失活电压依赖性,使快失活向超极化方向偏移,从而在一定程度上延长骨骼肌细胞的绝对不应期,降低其兴奋性,舒缓肌强直症状 [ 32] 。在I1363T突变中,快失活的电压依赖性呈现去极化方向的偏移。这一结果提示美西律对于因I1363T突变引起的肌强直症状可能有一定的治疗效果。
综上所述,hNav1.4的I1363T突变会导致通道的电压依赖性快失活受损,使快失活向去极化方向偏移,更难以进入慢失活,使细胞过度兴奋,继而引起肌强直症状;窗电流的长时间增加又使细胞膜电位升高,最终导致hNav1.4失活,呈现肌无力症状。
参考文献
- 1.PTACEK L J, GOUW L, KWIECIŃSKI H, et al. Sodium channel mutations in paramyotonia congenita and hyperkalemic periodic paralysis. Ann Neurol. 1993;33(3):300–307. doi: 10.1002/ana.410330312. [DOI] [PubMed] [Google Scholar]
- 2.LEHMANN-HORN F, RÜDEL R, RICKER K. Membrane defects in paramyotonia congenita (Eulenburg) Muscle Nerve. 1987;10(7):633–641. doi: 10.1002/mus.880100709. [DOI] [PubMed] [Google Scholar]
- 3.CHAHINE M, GEORGE A L, ZHOU M, et al. Sodium channel mutations in paramyotonia congenita uncouple inactivation from activation. Neuron. 1994;12(2):281–294. doi: 10.1016/0896-6273(94)90271-2. [DOI] [PubMed] [Google Scholar]
- 4.PTÁCEK L J, GEORGE A L, BARCHI R L, et al. Mutations in an S4 segment of the adult skeletal muscle sodium channel cause paramyotonia congenita. Neuron. 1992;8(5):891–897. doi: 10.1016/0896-6273(92)90203-p. [DOI] [PubMed] [Google Scholar]
- 5.HOFFMAN E P, LEHMANN-HORN F, RÜDEL R. Overexcited or inactive: ion channels in muscle disease. Cell. 1995;80(5):681–686. doi: 10.1016/0092-8674(95)90345-3. [DOI] [PubMed] [Google Scholar]
- 6.WOOD J N, BAKER M. Voltage-gated sodium channels. Curr Opin Pharmacol. 2001;1(1):17–21. doi: 10.1016/s1471-4892(01)00007-8. [DOI] [PubMed] [Google Scholar]
- 7.CATTERALL W A. Cellular and molecular biology of voltage-gated sodium channels. Physiol Rev. 1992;72(4):S15–S48. doi: 10.1152/physrev.1992.72.suppl_4.S15. [DOI] [PubMed] [Google Scholar]
- 8.CATTERALL W A. From ionic currents to molecular mechanisms: the structure and function of voltage-gated sodium channels. Neuron. 2000;26(1):13–25. doi: 10.1016/s0896-6273(00)81133-2. [DOI] [PubMed] [Google Scholar]
- 9.MARBAN E, YAMAGISHI T, TOMASELLI G F. Structure and function of voltage-gated sodium channels. J Physiol. 1998;508(3):647–657. doi: 10.1111/j.1469-7793.1998.647bp.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.MILLER T M, DIAS D S M R, MILLER H A, et al. Correlating phenotype and genotype in the periodic paralyses. Neurology. 2004;63(9):1647–1655. doi: 10.1212/01.wnl.0000143383.91137.00. [DOI] [PubMed] [Google Scholar]
- 11.EGRI C, RUBEN P C. A hot topic: temperature sensitive sodium channelopathies. Channels(Austin) 2012;6(2):75–85. doi: 10.4161/chan.19827. [DOI] [PubMed] [Google Scholar]
- 12.SUGIURA Y, AOKI T, SUGIYAMA Y, et al. Temperature-sensitive sodium channelopathy with heat-induced myotonia and cold-induced paralysis. Neurology. 2000;54(11):2179–2181. doi: 10.1212/wnl.54.11.2179. [DOI] [PubMed] [Google Scholar]
- 13.WAGNER S, LERCHE H, MITROVIC N, et al. A novel sodium channel mutation causing a hyperkalemic paralytic and paramyotonic syndrome with variable clinical expressivity. Neurology. 1997;49(4):1018–1025. doi: 10.1212/wnl.49.4.1018. [DOI] [PubMed] [Google Scholar]
- 14.CUMMINS T R, ZHOU J, SIGWORTH F J, et al. Functional consequences of a Na + channel mutation causing hyperkalemic periodic paralysis . Neuron. 1993;10(4):667–678. doi: 10.1016/0896-6273(93)90168-q. [DOI] [PubMed] [Google Scholar]
- 15.O’LEARY M E, CHEN L Q, KALLEN R G, et al. A molecular link between activation and inactivation of sodium channels. J Gen Physiol. 1995;106(4):641–658. doi: 10.1085/jgp.106.4.641. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.BENDAHHOU S, CUMMINS T R, KULA R W, et al. Impairment of slow inactivation as a common mechanism for periodic paralysis in DIIS4-S5. Neurology. 2002;58(8):1266–1272. doi: 10.1212/wnl.58.8.1266. [DOI] [PubMed] [Google Scholar]
- 17.WEBB J, CANNON S C. Cold-induced defects of sodium channel gating in atypical periodic paralysis plus myotonia. Neurology. 2008;70(10):755–761. doi: 10.1212/01.wnl.0000265397.70057.d8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.BOUHOURS M, STERNBERG D, DAVOINE C S, et al. Functional characterization and cold sensitivity of T1313A, a new mutation of the skeletal muscle sodium channel causing paramyotonia congenita in humans. J Physiol. 2004;554(3):635–647. doi: 10.1113/jphysiol.2003.053082. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.DICE M S, ABBRUZZESE J L, WHEELER J T, et al. Temperature-sensitive defects in paramyotonia congenita mutants R1448C and T1313M. Muscle Nerve. 2004;30(3):277–288. doi: 10.1002/mus.20080. [DOI] [PubMed] [Google Scholar]
- 20.SIMKIN D, BENDAHHOU S. Skeletal muscle na channel disorders. Front Pharmacol. 2011;2:63. doi: 10.3389/fphar.2011.00063. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.MOHAMMADI B, MITROVIC N, LEHMANN-HORN F, et al. Mechanisms of cold sensitivity of paramyotonia congenita mutation R1448H and overlap syndrome mutation M1360V. J Physiol. 2003;547(3):691–698. doi: 10.1113/jphysiol.2002.033928. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.JURKAT-ROTT K, HOLZHERR B, FAULER M, et al. Sodium channelopathies of skeletal muscle result from gain or loss of function. Pflugers Arch. 2010;460(2):239–248. doi: 10.1007/s00424-010-0814-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.KE Q, YE J, TANG S, et al. N1366S mutation of human skeletal muscle sodium channel causes paramyotonia congenita. J Physiol. 2017;595(22):6837–6850. doi: 10.1113/JP274877. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.OKUDA S, KANDA F, NISHIMOTO K, et al. Hyperkalemic periodic paralysis and paramyotonia congenita—a novel sodium channel mutation. J Neurol. 2001;248(11):1003–1004. doi: 10.1007/s004150170059. [DOI] [PubMed] [Google Scholar]
- 25.PAYANDEH J, SCHEUER T, ZHENG N, et al. The crystal structure of a voltage-gated sodium channel. Nature. 2011;475(7356):353–358. doi: 10.1038/nature10238. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.ZHANG X, REN W, DECAEN P, et al. Crystal structure of an orthologue of the NaChBac voltage-gated sodium channel. Nature. 2012;486(7401):130–134. doi: 10.1038/nature11054. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.SHEN H, ZHOU Q, PAN X, et al. Structure of a eukaryotic voltage-gated sodium channel at near-atomic resolution. eaal4326. Science. 2017;355(6328) doi: 10.1126/science.aal4326. [DOI] [PubMed] [Google Scholar]
- 28.SHEN H, LI Z, JIANG Y, et al. Structural basis for the modulation of voltage-gated sodium channels by animal toxins. eaau2596. Science. 2018;362(6412) doi: 10.1126/science.aau2596. [DOI] [PubMed] [Google Scholar]
- 29.MOMANY F A, MCGUIRE R F, BURGESS A W, et al. Energy parameters in polypeptides. Ⅶ. Geometric parameters, partial atomic charges, nonbonded interactions, hydrogen bond interactions, and intrinsic torsional potentials for the naturally occurring amino acids. J Phys Chem. 1975;79(22):2361–2381. [Google Scholar]
- 30.NEMETHY G, POTTLE M S, SCHERAGA H A. Energy parameters in polypeptides. 9. Updating of geometrical parameters, nonbonded interactions, and hydrogen bond interactions for the naturally occurring amino acids. J Phys Chem. 1983;87(11):1883–1887. [Google Scholar]
- 31.LEHMANN-HORN F, ENGEL A G, RICKER K, et al. The periodic paralyses and paramyotonia congenita. Myology. 1994;2:1303–1334. [Google Scholar]
- 32.FLEISCHHAUER R, MITROVIC N, DEYMEER F, et al. Effects of temperature and mexiletine on the F1473S Na + channel mutation causing paramyotonia congenita . Pflugers Arch. 1998;436(5):757–765. doi: 10.1007/s004240050699. [DOI] [PubMed] [Google Scholar]