Abstract
2019冠状病毒病(COVID-19)重型、危重型患者往往合并基础疾病,用药种类复杂,存在潜在的药物相互作用、特殊人群用药等问题。本文依据《新型冠状病毒肺炎诊疗方案(试行第六版)》,基于《2019冠状病毒病(COVID-19)诊疗浙江经验》,总结重型、危重型患者选择抗病毒药物、糖皮质激素、血管活性药物、抗菌药物、微生态制剂、营养支持方案等经验,建议针对药物疗效和疗程评估、药物不良反应防治、潜在药物相互作用识别、基于生物安全防护的个体化用药监测以及特殊人群给药等进行重点用药管理,以期为COVID-19患者临床药物选择和用药管理提供参考。
Abstract
Severe and critically ill patients with coronavirus disease 2019 (COVID-19) were usually with underlying diseases, which led to the problems of complicated drug use, potential drug-drug interactions and medication errors in special patients. Based on Diagnosis and treatment of novel coronavirus pneumonia ( trial version 6), and Management of COVID-19: the Zhejiang experience, we summarized the experience in the use of antiviral drugs, corticosteroids, vascular active drugs, antibacterial, probiotics, nutrition support schemes in severe and critically ill COVID-19 patients. It is also suggested to focus on medication management for evaluation of drug efficacy and duration of treatment, prevention and treatment of adverse drug reactions, identification of potential drug-drug interactions, individualized medication monitoring based on biosafety protection, and medication administration for special patients.
Keywords: Coronavirus disease 2019, Severe acute respiratory syndrome coronavirus 2, Novel coronavirus infection, Critical illness, Safety management, Drug utilization
目前,2019冠状病毒病(coronavirus disease 2019,COVID-19)患者的治疗没有特效药,以对症治疗为主。其中,重型和危重型COVID-19患者的治疗原则是在对症治疗的基础上,积极防治并发症、治疗基础疾病、预防继发感染,及时进行器官功能支持治疗 [ 1] 。浙江大学医学院附属第一医院通过建立完善的多学科协作诊疗机制,在COVID-19重型和危重型患者的救治中获得了良好的效果 [ 2] 。临床药学作为多学科协作诊疗团队的重要组成,是治疗措施的具体体现。针对COVID-19重型、危重型患者用药种类复杂、涉及特殊人群用药等特点,我们根据《新型冠状病毒肺炎诊疗方案(试行第六版)》 [ 1] (以下简称“诊疗方案”)和《2019冠状病毒病(COVID-19)诊疗浙江经验》 [ 2] (以下简称“浙江经验”)等,总结了COVID-19重型、危重型患者主要治疗用药的管理经验,旨在为临床药物选择和用药管理提供参考。
1 COVID-19重型、危重型患者主要药物选择
1.1 抗病毒药物
目前尚无循证医学证据支持现有抗病毒药物对严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)有效,“诊疗方案”提出可试用α干扰素雾化吸入、洛匹那韦/利托那韦、利巴韦林(建议与干扰素或洛匹那韦/利托那韦联合使用)、磷酸氯喹、阿比多尔等。“浙江经验”建议洛匹那韦/利托那韦联合阿比多尔的方案,如果不耐受洛匹那韦/利托那韦,也可通过伦理审查后探索性地使用达芦那韦/考比司他或法匹拉韦。上述药物的作用机制、代谢酶、代谢途径以及给药剂量见 表 1。
表1 2019冠状病毒病潜在抗病毒药物的作用机制、代谢途径及给药方案 [ 1, 2, 11- 14]
Table 1 Mechanism, metabolism and dosage regimens of antiviral agents for COVID-19 [ 1, 2, 11- 14]
|
药物名称 |
可能作用机制 |
代谢途径和代谢酶 |
给药方案 |
|
α干扰素(雾化) |
抑制病毒RNA与蛋白合成,诱导细胞产生抗病毒蛋白 |
肺 |
每次500万U,2次/d,雾化(建议在负压病房进行) |
|
利巴韦林 |
抑制病毒RNA多聚酶和mRNA鸟苷转移酶等 |
肝脏 |
500 mg,2~3次/d,静脉输注,疗程不超过10 d |
|
洛匹那韦/利托那韦 |
抑制病毒3CLpro蛋白酶活性 |
肝脏,CYP3A |
400 mg/100 mg,2次/d,口服,疗程不超过10 d |
|
达芦那韦/考比司他 |
可能与洛匹那韦/利托那韦相同 |
肝脏,CYP3A |
800 mg/150 mg,1次/d,口服,随餐同服 |
|
阿比多尔 |
抑制病毒的脂膜与宿主细胞的融合 |
肝脏,CYP3A4 |
200 mg,3次/d,口服,疗程不超过10 d |
|
法匹拉韦 |
活性代谢产物抑制病毒基因组复制和转录 |
肝脏,前体药物 |
首剂1600 mg,1次/12 h,维持剂量600 mg,1次/12 h,口服 |
|
磷酸氯喹 |
抑制冠状病毒与人体细胞ACE2受体结合及免疫调节等 |
肝脏 |
适用于18~65周岁患者:>50 kg,500 mg,2次/d,口服;≤50 kg,500 mg,口服,第1~2天,2次/d,第3~7天,1次/d,疗程不超过7 d |
ACE2:血管紧张素转换酶2.
1.2 糖皮质激素
目前没有循证医学证据支持应用糖皮质激素可改善COVID-19重型患者的预后,不推荐常规使用糖皮质激素。“诊疗方案”推荐对氧合指标进行性恶化、影像学表现进展迅速、机体炎症反应过度激活状态的患者短期内(3~5 d)酌情使用糖皮质激素,建议剂量不超过甲泼尼龙1~ 2 mg·kg -1·d -1。“浙江经验”推荐重型、危重型患者可早期使用甲泼尼龙,根据炎症损伤程度,给药剂量为0.75~1.5 mg·kg -1·d -1,治疗期间每隔2~3 d评估病情及疗效,逐渐减量,总疗程10~15 d。
甲泼尼龙消除半衰期为1.8~5.2 h,作用持续时间为12~36 h,具有给药方便、作用中效、对下丘脑-垂体-肾上腺轴(HPA)轴功能抑制作用小等特点,同时直接经肝脏CYP3A4酶代谢为无活性的代谢产物,相较于氢化可的松、地塞米松等糖皮质激素,更适合COVID-19患者的治疗。
1.3 血管活性药物
血流动力学不稳定状态出现时,在容量管理上应当保持满足组织灌注的最低血容量,以避免容量过负荷、加重肺损伤。应给予恰当容量复苏,必要时使用常见的血管活性药物如去甲肾上腺素,也可以选择多巴胺、多巴酚丁胺、间羟胺等,还可使用垂体后叶素 [ 3] 。有关血管活性药物的作用机制、作用时间见 表 2,给药剂量根据血压、心律及心率目标调整。
表2 2019冠状病毒病血管活性药物的作用机制、作用时间及给药剂量
Table 2 Mechanism, effect time and dosage regimens of vasoactive agents for COVID-19
|
药物名称 |
受 体 |
心脏兴奋强度 |
作用血管强度 |
作用时间 |
|
|
收 缩 |
舒 张 |
||||
|
去甲肾上腺素 |
α |
一般 |
高 |
— |
1~2 min |
|
肾上腺素 |
α β |
高 |
高 |
中等 |
1~2 h (皮下注射) |
|
异丙肾上腺素 |
β 1 β 2 |
高 |
— |
高 |
不到1 h |
|
多巴胺 |
D α β |
中等 |
一般 |
中等 |
5~10 min |
|
多巴酚丁胺 |
β 1 |
高 |
— |
中等 |
约10 min |
|
间羟胺 |
α |
一般 |
中等 |
— |
20 min |
“—”无相关资料.
1.4 抗菌药物
避免盲目或不恰当地使用抗菌药物,尤其是联合使用广谱抗菌药物。存在基础疾病如结构性肺病,或有证据支持继发细菌感染,重型患者可酌情考虑使用喹诺酮类、第二代或第三代头孢菌素类、β-内酰胺酶抑制剂复方制剂等;危重型患者根据个体高危因素及病原体特征选择抗菌药物,包括碳青霉烯类、β-内酰胺酶抑制剂复方制剂、恶唑烷酮类、糖肽类等。继发真菌感染的患者可给予棘白菌素类、三唑类等治疗 [ 2] 。常用抗菌药物的药动学、药动学/药效学特征及给药方案见 表 3。
表3 2019冠状病毒病重型、危重型患者继发感染常用治疗药物的药学特点及给药方案 [ 15- 18]
Table 3 Pharmaceutical characteristics and dosage regimens of therapeutic drugs for secondary infections in severe and critical ill COVID-19 patients [ 15- 18]
|
分类 |
代表药物 |
药动学 |
PK/PD特性 |
临床PK/PD靶目标 |
给药方案(静脉用药) |
|
喹诺酮类 |
莫西沙星 |
半衰期为12 h,肝肾排泄 |
浓度依赖型 |
AUC 0-24/MIC:125~250 C max/MIC≥8 |
400 mg,1次/d |
|
酶复合制剂 |
哌拉西林/他唑巴坦 |
半衰期为0.7~1.2 h,原形肾脏排泄 |
时间依赖型 |
40%~50% T>MIC |
4.5 g,3~4次/d(根据感染严重程度及药敏结果调整方案) |
|
头孢哌酮/舒巴坦(1:1) |
头孢哌酮半衰期为1.7 h,75%胆道排泄;舒巴坦半衰期为1 h,原形肾脏排泄 |
时间依赖型 |
45%~100% T>MIC |
2 g,3~4次/d(根据感染严重程度及药敏结果调整方案) |
|
|
头孢他啶/阿维巴坦(4:1) |
半衰期为2~3 h,大部分以原形肾脏排泄 |
时间依赖型 |
45%~100% T>MIC |
2.5 g,1次/8 h |
|
|
碳青霉烯类 |
亚胺培南 |
半衰期为1 h,原形肾脏排泄 |
时间依赖型 |
75% T>MIC |
≤4 g/d,2次/d以上,根据感染严重程度及药敏结果调整方案 |
|
美罗培南 |
半衰期为1 h,原形肾脏排泄 |
时间依赖型 |
75% T>MIC |
≤6 g/d,2次/d以上,根据感染严重程度及药敏结果调整方案 |
|
|
糖肽类 |
万古霉素 |
半衰期为4~6 h,原形肾脏排泄 |
时间-浓度依赖型 |
AUC 0-24/MIC≥400 |
1 g,2次/d,根据血药浓度监测调整方案 |
|
恶唑烷酮类 |
利奈唑胺 |
半衰期为5 h,65%非肾脏途径清除,其余原形肾脏排泄 |
时间-浓度依赖型 |
AUC 0-24/MIC≥85 85%T>MIC |
600 mg,2次/d,必要时根据血药浓度监测调整方案 |
|
环脂肽类 |
达托霉素 |
半衰期约为8 h,原形肾脏排泄 |
浓度依赖型 |
C max/MIC:59~94AUC 0-24/MIC:388~537 |
6~10 mg/kg,1次/d |
|
三唑类 |
伏立康唑 |
半衰期约为6 h,肝脏CYP2C19、CYP2C9等代谢 |
时间-浓度依赖型 |
AUC 0-24/MIC≥20 |
负荷剂量:6 mg/kg,1次/12 h(第1天);维持剂量:4 mg/kg,2次/d,根据血药浓度监测调整方案 |
|
棘白菌素类 |
卡泊芬净 |
半衰期为9~11 h,肝脏代谢 |
浓度依赖型 |
C max/MIC>10 |
负荷剂量:70 mg,1次/d(第1天);维持剂量:50 mg,1次/d |
PK/PD:药动学/药效学;AUC:药时曲线下面积;MIC:最低抑菌浓度;C max:峰浓度;T>MIC:药物浓度高于MIC的时间.
1.5 微生态制剂
“诊疗方案”推荐使用微生态调节剂维持患者肠道微生态平衡,预防继发细菌感染。“浙江经验”推荐肠道微生态制剂包括地衣芽孢杆菌活菌、双歧杆菌活菌、双歧杆菌三联活菌、双歧杆菌乳杆菌三联活菌等,常用肠道微生态制剂的用法及用量见 表 4 [ 4] 。注意事项:①微生态制剂为活菌制剂,溶解时水温不宜超过40 ℃(布拉氏酵母菌不宜超过50 ℃);②地衣芽孢杆菌(低于30 ℃)和布拉氏酵母菌可常温储存(低于25 ℃),其他三种肠道微生态调节剂须低温(2~8 ℃)保存,注意避光、密封;③双歧杆菌乳杆菌三联活菌片为真空封装,开袋后应尽快服用;④对于不耐酸的活菌制剂,宜餐后30 min服用,如双歧杆菌活菌;⑤植入中央静脉导管的住院患者、免疫功能抑制患者、严重胃肠道疾病患者或高剂量使用布拉氏酵母菌的患者中可出现罕见真菌感染,其中极少数患者血液培养布拉氏酵母菌阳性,极度虚弱的患者中有报道由布拉氏酵母菌引起败血症的病例。
表4 2019冠状病毒病患者常用肠道微生态制剂用法、用量及注意事项
Table 4 Dosage regimens and notes of intestinal microecological modulators for COVID-19 patients
|
药物名称 |
成 分 |
剂型、规格及用量用法 |
|
地衣芽孢杆菌活菌 |
地衣芽孢杆菌 |
胶囊剂、颗粒剂0.25 g(含2.5亿活菌)成人:每次0.5 g,3次/d,首剂加倍儿童:每次0.25 g,3次/d,首剂加倍吞咽困难者可打开胶囊将药粉倒出加入少量温开水后服用 |
|
双歧杆菌活菌 |
双歧杆菌 |
胶囊剂0.35 g(含0.5亿活菌)成人:每次0.35~0.7 g,2次/d餐后服用 |
|
双歧杆菌乳杆菌三联活菌 |
长型双歧杆菌、保加利亚乳杆菌、嗜热链球菌 |
片剂0.5 g(每片含双歧杆菌活菌数应不低于0.5×10 7CFU,保加利亚乳杆菌和嗜热链球菌应不低于0.5×10 6CFU)成人:每次2 g,2次/d或3次/d餐后服用,温开水或温牛奶冲服 |
|
双歧杆菌三联活菌 |
长型双歧杆菌、嗜酸乳杆菌、粪肠球菌 |
散剂1 g(含活菌数分别应不低于1.0×10 7CFU) 6岁及以上,每次2 g,3次/d 1~5岁,每次1 g,3次/d 0~1岁,每次0.5 g,3次/d温水冲服胶囊剂0.21 g(含活菌数分别应不低于1.0×10 7CFU)成人:每次420~840 mg,2次/d或3次/d儿童用药酌减餐后半小时,婴幼儿服用可剥开胶囊倒出药粉,温开水或温牛奶送服 |
|
布拉氏酵母菌 |
冻干布拉氏酵母菌 |
菌粉0.25 g/袋(每1 g菌粉含活菌数分别应不低于1.3×10 9CFU)成人:每次2袋,2次/d 3岁及以上儿童:每次1袋,2次/d 3岁以下儿童:每次1袋,1次/d可将内容物倒入少量温水中,混合均匀后服下;可在任何时候服用,但最好不在进食时服用 |
|
复方嗜酸乳杆菌 |
中国株嗜酸乳杆菌、日本株嗜酸乳杆菌、粪链球菌、枯草杆菌 |
片剂0.5 g(每克含嗜酸乳杆菌10 7个)口服,成人一次1~2片,3次/d |
CFU:菌落形成单位.
1.6 营养支持方案
COVID-19重型患者根据营养风险筛查(NRS2002)评分进行营养风险筛查 [ 5] 。尽早启动肠内营养,不建议早期单独使用肠外营养或补充性肠外营养联合肠内营养。建议对重型患者留置鼻胃管经胃营养。对不适合经胃营养的患者,采用幽门后喂养途径,如鼻肠管等。对于重型患者,目标喂养量为每天25~30 kcal/kg(1 kcal=4.184 kJ),以低剂量开始喂养。如喂养不耐受,可考虑滋养型喂养(输注速度为10~20 kcal/h或10~30 mL/h)。强化蛋白质供给,目标蛋白需要量为每天1.5~2.0 g/kg。当蛋白量摄入不足时,建议在标准整蛋白制剂基础上额外添加蛋白粉。COVID-19患者可以使用富含Ω-3脂肪酸的肠内营养制剂。肠外营养中可以添加富含二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)成分的脂肪乳,对实施肠内营养的患者采取相应措施,防止发生呕吐、反流。发生喂养相关性腹泻者,建议改变营养液输注方式或配方成分。
1.7 其他治疗药物选择
① 免疫治疗:目前尚无充分循证证据,重型患者依据病情可酌情早期静脉输注免疫球蛋白0.25~0.50 g·kg -1·d -1,疗程3~5 d [ 6] ,或静脉给予血必净100 mL/次,2次/d治疗;对淋巴细胞计数低、免疫功能低下的重型患者,考虑使用胸腺肽α 1 [ 5] ;②镇静、镇痛治疗:危重型机械通气患者需要适当的镇痛镇静治疗,可考虑使用吗啡、芬太尼等镇痛药物,丙泊酚、咪达唑仑、右美托咪定等镇静药物,根据患者病情及治疗措施设定镇痛、镇静目标 [ 5] ;③静脉血栓栓塞症预防:重型、危重型卧床时间长的患者,应进行静脉血栓栓塞症风险评估决定是否进行抗凝治疗,建议首选低分子肝素预防 [ 5] ,3000或4000 IU,1次/d。
2 COVID-19重型、危重型患者的用药管理
2.1 重视治疗药物的疗效和疗程评估
2.1.1 抗病毒药物
按照COVID-19患者的出院标准, 体温正常3 d以上,呼吸道症状明显好转,肺部影像学显示渗出性病变明显改善,连续两次呼吸道标本核酸检测阴性(采样时间至少间隔1 d)视为治疗有效。抗病毒药物使用过程中应注意对患者体温、呼吸道症状、肺部影像学的监护,尤其应注意患者呼吸道核酸检测(部分地区包含粪便检测)的结果。抗病毒药物的疗程原则上不超过10 d(其中磷酸氯喹不超过7 d),但由于抗病毒药物的疗效有待临床资料进一步验证,有关疗程应根据患者的具体情况调整。
2.1.2 糖皮质激素
根据炎症损伤程度,尤其在COVID-19发病早期,可给予甲泼尼龙治疗。治疗期间每天复查血常规、C反应蛋白、细胞因子、血生化(尤其是血糖)等指标,定期复查胸部CT评估病情及疗效。如病情改善,体温正常,糖皮质激素使用时间1周以内,可直接停用,使用时间超过1周须逐渐减量,以免发生撤药综合征。
2.1.3 血管活性药物
根据患者的血压、心率、心律等指标调整剂量,评估疗效。
2.1.4 抗菌药物
在治疗期间须密切监测症状、体征、影像学、血常规、C反应蛋白、降钙素原等指标,出现病情变化须综合判断,在不能排除继发感染时须第一时间留取合格标本进行涂片、培养,作核酸、抗原抗体检测以便尽早明确感染病原体。在有充分的感染依据时,可经验性给予抗菌药物治疗,疗程一般不超过7 d。
2.1.5 微生态制剂
一般患者耐受性良好,应定期根据患者粪便的性状、频次以及广谱抗菌药物用药情况评估微生态制剂的疗效。
2.2 积极甄别药物不良反应,尤其抗病毒药物及糖皮质激素的不良反应
COVID-19重型、危重型患者治疗涉及的主要治疗药物中,因抗病毒药物及糖皮质激素相对不良反应较大,在不良反应监测过程中应重点予以关注,有关抗病毒药物与糖皮质激素的主要不良反应及用药监测见 表 5,同时在监测过程中还应注意下列事项:
表5 2019冠状病毒病患者抗病毒药物及糖皮质激素主要不良反应与用药监护 [ 13, 19- 22]
Table 5 Main adverse reactions and pharmaceutical notes of antiviral drugs and glucocorticoids for COVID-19 patients [ 13, 19- 22]
|
药物 |
主要不良反应 |
监护要点 |
|
α干扰素 |
流感样症状,白细胞和血小板下降等 |
使用干扰素雾化吸入治疗易诱发气溶胶,建议在负压病房进行,不建议普通病房内开展雾化治疗 |
|
利巴韦林 |
骨髓抑制,引起溶血性贫血、白细胞下降等 |
使用前评估血细胞计数等,如引起严重白细胞下降及血色素下降,予停药,同时给予粒细胞集落刺激因子、促红细胞生长素等治疗 |
|
洛匹那韦/利托那韦 |
可引起腹泻、恶心、呕吐,肝酶与黄疸升高、血脂异常,乳酸增高等不良反应,停药后可恢复 |
如腹泻等不能耐受,可选择达芦那韦抗病毒治疗,肝酶及黄疸升高,给予降酶及退黄对症治疗 |
|
达芦那韦/考比司他 |
与洛匹那韦相似,但临床观察胃肠道耐受性高于洛匹那韦 |
使用过程密切监测肝功能,含磺胺成分,磺胺过敏者谨慎使用 |
|
阿比多尔 |
肝酶及黄疸升高,心率下降,与洛匹那韦联用时,发生率更高,停药后一般可恢复 |
使用过程密切监测肝功能,可引起心动过缓等不良反应,存在传导阻滞、心动过缓的患者谨慎使用 |
|
法匹拉韦 |
血尿酸升高、腹泻、中性粒细胞降低、休克、急性重型肝炎、急性肾损伤等; 重型患者可出现黄疸升高,尤见于老年或合并细胞因子风暴的患者 |
使用过程密切监测肝功能,尤其老年及危重型患者,注意监测血尿酸及血常规等指标 |
|
磷酸氯喹 |
可引起头晕、头痛、恶心、呕吐、腹泻、各种皮疹等,心博骤停是最严重不良反应,眼部病变是最主要不良反应 |
适用于18~65岁人群; 用药前行心电图检查,禁忌或相对禁忌用于心律失常(如传导阻滞)、慢性心脏病、视网膜疾病,以及听力减退或听力丧失等患者 |
|
甲泼尼龙 |
可引起内分泌紊乱、血压升高、电解质紊乱、消化道溃疡、感染、肾上腺皮质功能减退等 |
治疗前完善结核感染T细胞斑点试验、乙型肝炎病毒和丙型肝炎病毒标志物等检测,避免在激素治疗过程中发生潜在感染被激活;根据情况应用质子泵抑制剂预防消化道溃疡及出血;监测血糖,一旦出现血糖升高,使用胰岛素皮下注射或强化胰岛素治疗;注意霉菌感染的风险,必要时给予碳酸氢钠含漱液、抗真菌药物等治疗 |
① 评估药物不良反应时,应根据患者的疾病因素综合考虑,比如感染引起的骨髓抑制;
② 抗病毒药物如洛匹那韦、阿比多尔等主要不良反应为肝酶、黄疸升高,血脂异常,一般可逆,发生率较高,须重点监护;
③ 抗病毒药物如洛匹那韦、阿比多尔等主要经过肝脏CYP3A代谢,应注意与他克莫司、伏立康唑等相互作用后不良反应增加的风险;
④ 磷酸氯喹治疗剂量与中毒剂量较为相近,且可发生心脏骤停等致命不良反应,用药过程应重点监护。
2.3 施行生物安全防护下的血药浓度监测,实现个体化给药
对COVID-19患者开展治疗药物监测(therapeutic drug monitoring,TDM)时,由于涉及生物安全问题,在实验环境与个人防护,标本采集、运送、接收,标本检测,废弃物处理与实验室清洁,以及实验室生物安全操作失误或意外的处理等环节,均须按要求进行严格防护 [ 7- 10] ( 图 1)。
图1.
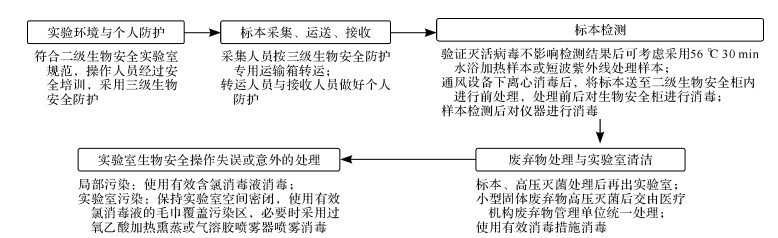
2019冠状病毒病患者治疗药物监测实施过程中的生物安全防护
需开展TDM的药物品种及注意事项:COVID-19患者目前常需进行TDM的抗病毒和抗菌药物有洛匹那韦/利托那韦、β-内酰胺类抗生素、万古霉素、利奈唑胺、伏立康唑等,主要治疗药物TDM浓度与监测注意事项见 表 6,一旦发现血药浓度异常,应结合患者临床症状、合并用药,综合进行给药方案设计,个体化用药。
|
药物名称 |
采血时间点 |
治疗浓度范围 |
样品保藏条件 |
注意事项 |
|
洛匹那韦/利托那韦 |
(峰)给药后30 min内(谷)给药前30 min内 |
洛匹那韦:(谷)>1 μg/mL(峰) < 8.2 μg/mL |
— |
疗效相关的血药浓度监测可只监测洛匹那韦;高浓度的利托那韦与神经和胃肠道不良反应相关 |
|
亚胺培南 |
当日给药前10 min内 |
1~8 μg/mL |
室温半小时,冷藏1 h,冷冻1 h,须立即送检 |
β-内酰胺类抗生素为时间依赖型抗生素,2019冠状病毒病患者继发细菌感染时,须结合病原学检测的最低抑菌浓度值解读血药浓度监测结果,进而调整用药方案 |
|
美罗培南 |
当日给药前10 min内 |
1~16 μg/mL |
室温2 h,冷藏3 d,冷冻10 d |
|
|
哌拉西林/舒巴坦 |
当日给药前10 min内 |
16~64 μg/mL |
— |
— |
|
万古霉素 |
当日给药前30 min内 |
10~20 mg/L(重症MRSA感染时推荐15~20 mg/L) |
室温1 d,冷藏3 d,冷冻14 d |
须常规监测血药浓度,同时密切关注患者的肾功能 |
|
利奈唑胺 |
当日给药前30 min内 |
2~7 μg/mL |
室温1 h,冷藏2 h,冷冻3 d,需立即送检 |
肾功能不全患者和透析患者须加强监测利奈唑胺血药浓度 |
|
伏立康唑 |
当日给药前30 min内 |
1~5.5 μg/mL |
室温14 d,冷藏14 d,冷冻14 d |
须考虑药物相互作用对伏立康唑血药浓度的影响;监测患者肝功能 |
“—”无相关资料;TDM:治疗药物监测;MRSA:耐甲氧西林金黄色葡萄球菌.
2.4 关注抗病毒药物与基础疾病用药潜在的药物相互作用
COVID-19患者可能的药物相互作用:COVID-19重型患者一般较轻型患者合并更多基础疾病,如高血压、慢性阻塞性肺疾病、冠心病、器官移植等,同时可能合并细菌、真菌感染,用药方案复杂。涉及的主要治疗药物中,由于抗病毒药物如洛匹那韦/利托那韦等经肝脏CYP3A酶代谢,须仔细排查可能的药物相互作用,合理选择药物,同时通过TDM等药学手段优化用药,有关抗病毒药物与常见基础疾病用药的相互作用见 表 7。
表7 2019冠状病毒病患者常用抗病毒药物与常见基础疾病用药的相互作用 [ 25- 27]
Table 7 Interactions between antiviral drugs and drugs for common underlying diseases in patients with COVID-19 [ 25- 27]
|
药物名称 |
可能的相互作用 |
联合用药禁忌 |
|
洛匹那韦/利托那韦 |
①与CYP3A代谢的药物(如二氢吡啶、钙通道阻滞剂、HMG-CoA还原酶抑制剂、免疫抑制剂和PDE5抑制剂)联合使用可导致药物的血浆浓度升高,尤其要注意临床症状及治疗药物监测;②导致利伐沙班AUC增加153%,阿托伐他汀AUC增加5.9倍,咪达唑仑AUC增加13倍 |
严禁与胺碘酮(致命性心律失常)、喹硫平(严重昏迷)、辛伐他汀(横纹肌溶解)等联合使用 |
|
达芦那韦/考比司他 |
①与主要经由CYP3A和/或CYP2D6代谢的药物联合用药时可导致此类药物血浆浓度升高;②药物相互作用参考洛匹那韦/利托那韦 |
参考洛匹那韦/利托那韦 |
|
阿比多尔 |
与CYP3A4及UGT1A9底物、抑制剂和诱导剂之间可能存在药物相互作用 |
— |
|
利巴韦林 |
①与齐多夫定联合使用可导致药物毒性增加;②与核苷反转录酶抑制剂联合使用可导致线粒体中毒(乳酸中毒、胰腺炎、肝衰竭)相关不良反应风险增加 |
— |
|
法匹拉韦 |
①茶碱可使法匹拉韦生物利用度上升;②可使乙酰氨基酚生物利用度上升到1.79倍;③与吡嗪酰胺联合使用可使血液中尿酸水平升高;④与瑞格列奈联合使用会导致瑞格列奈血药浓度升高,不良反应发生率增加 |
— |
|
磷酸氯喹 |
— |
严禁与莫西沙星、阿奇霉素、胺碘酮等可能导致Q-T间期延长的药物合用 |
“—”无相关资料;TDM:治疗药物监测;AUC:药时曲线下面积.
药物相互作用临床处理体会:①努力甄别有临床意义的相互作用,对治疗需求进行综合考量后决定是否调整用药方案;②重点关注可引起严重和/或致命不良事件或存在禁忌的相互作用,如洛匹那韦与喹硫平、胺碘酮联合使用;③及时推荐避免药物相互作用的可替代治疗方案,如卡泊芬净替代伏立康唑,避免与抗病毒药物相关的相互作用。
2.5 肝、肾功能不全等特殊人群用药须避免二重用药损伤
COVID-19危重型患者一般收治进入ICU,往往伴有器官功能障碍,如肝肾功能不全,需机械通气、肾脏替代治疗、体外膜氧合器、人工肝血液净化等治疗,器官功能损伤以及特殊治疗手段均可能影响治疗药物药动学,因此针对上述特殊人群用药,须重点监护,及时调整给药方案 [ 11] 。
特殊人群给药方案建议:①甄别特殊人群,关注患者的肝肾功能等指标;②根据 表 8调整常用药物的治疗方案;③原则上肝功能不全患者尽量选择原形经肾脏排泄的药物,肾功能不全患者尽量选择经肝脏代谢或肝肾双通道排泄的药物;④尽量选择在人工肝血液净化治疗后给予药物,以避免治疗过程中药物被清除。
表8 2019冠状病毒病重型、危重型患者特殊人群治疗药物用药建议 [ 11, 28- 31]
Table 8 Drug therapy recommendation in special populations of severe and critical ill COVID-19 patients [ 11, 28- 31]
|
药物名称 |
妊娠妇女 |
机械通气患者 |
肝功能不全患者 |
肾功能不全患者 |
肾脏替代治疗者 |
体外膜氧合器治疗者 |
|
洛匹那韦/利托那韦 |
选择片剂 |
选择口服液 |
重度肝功能不全禁用 |
无须调整 |
无须调整 |
增加剂量 |
|
α干扰素(雾化) |
禁用 |
避免使用超声雾化 |
肝硬化失代偿期禁用 |
无须调整 |
无须调整 |
无须调整 |
|
利巴韦林 |
禁用 |
无须调整 |
慎用 |
CrCL<50 mL/min避免使用 |
血液透析:按1/2原剂量给药连续性肾脏替代治疗:无须调整 |
无须调整 |
|
磷酸氯喹 |
禁用 |
无须调整 |
慎用 |
慎用 |
血液透析部分清除 |
— |
|
阿比多尔 |
— |
无须调整 |
慎用 |
重度肾功能不全慎用 |
— |
— |
|
达芦那韦/考比司他 |
慎用 |
不可碾碎 |
重度肝功能不全禁用 |
无须调整 |
无须调整 |
增加剂量 |
|
法匹拉韦 |
禁用 |
无须调整 |
减少剂量 |
无须调整 |
— |
— |
|
甲泼尼龙 |
慎用 |
无须调整 |
无须调整 |
无须调整 |
血液透析可清除 |
— |
|
微生态制剂 |
避免使用布拉氏酵母菌 |
无须调整 |
无须调整 |
无须调整 |
无须调整 |
无须调整 |
|
莫西沙星 |
禁用 |
无须调整 |
肝功能损伤(Child Pugh C)和转氨酶升高大于5倍正常值上限者禁用 |
无须调整 |
无须调整 |
— |
|
头孢呋辛 |
可用 |
无须调整 |
无须调整 |
CrCL 10~20 mL/min:750 mg,1次/12 h; CrCL < 10 mL/min:750 mg,1次/d |
血液透析后加用750 mg连续性肾脏替代治疗: 1.5 g,1次/12 h |
— |
|
哌拉西林/他唑巴坦 |
慎用 |
无须调整 |
无须调整 |
CrCL 20~40 mL/min:4.5 g,1次/8 h; CrCL < 20 mL/min:4.5 g,1次/12 h |
血液透析:医院获得性肺炎最大剂量2.25 g,1次/8 h,透析后加用0.75 g连续性肾脏替代治疗:2.25~4.5 g,1次/6 h |
无须调整 |
|
头孢哌酮/舒巴坦 |
慎用 |
无须调整 |
重度肝功能不全者头孢哌酮日剂量 < 2 g |
CrCL 15~30 mL/min:舒巴坦最高剂量为0.5 g,1次/12 h; CrCL < 15 mL/min:舒巴坦最高剂量为0.5 g,1次/12 h |
血液透析:血透结束后给药连续性肾脏替代治疗:1g,1次/8 h |
— |
|
头孢他啶/阿维巴坦 |
慎用 |
无须调整 |
无须调整 |
CrCL 31~50 mL/min:1.25 g,1次/8 h; CrCL 16~30 mL/min:0.94 g,1次/12 h; CrCL 6~15 mL/min:0.94 g,1次/d; CrCL≤5 mL/min:0.94 g,1次/48 h |
血液透析:血透结束后适当追加药物剂量连续性肾脏替代治疗:2.5 g,1次/8 h |
— |
|
亚胺培南/西司他丁 |
慎用 |
无须调整 |
无须调整 |
CrCL 41~70 mL/min:原剂量的2/3~3/4 CrCL 21~40 mL/min:原剂量的1/2 CrCL 6~20 mL/min:原剂量的1/4~1/2 |
血液透析:CrCL≤5 mL/min患者进行血液透析时参考CrCL 6~20 mL/min未行血液透析时剂量,血液透析后使用;连续性肾脏替代治疗:0.5~1 g,1次/6 h |
谷浓度个体差异大 |
|
万古霉素 |
慎用 |
无须调整 |
无须调整 |
CrCL 20~50 mL/min:0.5 g,1次/12~24 h; CrCL10~19 mL/min:0.5 g,1次/24~48 h; CrCL < 10 mL/min:0.5g,1次/48~96 h; 根据TDM调整 |
血液透析:500 mg,1次/48~96 h,高通量透析后需补充剂量,根据TDM调整;连续性肾脏替代治疗:初始给予15~20 mg/kg剂量,后续根据TDM调整 |
可能需要增加剂量,建议根据TDM调整 |
|
利奈唑胺 |
慎用 |
无须调整 |
无需调整,建议监测血药浓度 |
无需调整,建议监测血药浓度 |
无需调整,建议监测血药浓度 |
无须调整 |
|
达托霉素 |
可用 |
无须调整 |
无须调整 |
CrCL<30 mL/min:6 mg/kg,1次/48 h |
血透:CrCL<30 mL/min:6 mg/kg,1次/48 h连续性肾脏替代治疗:6~8 mg/kg,1次/d |
无须调整 |
|
伏立康唑 |
避免使用 |
无须调整 |
肝硬化Child Pugh A与B,负荷剂量不变,维持剂量减半,Child Pugh C缺少研究 |
注射剂CrCL<50 mL/ min权衡利弊使用 |
无须调整 |
浓度升高,可能需要减少剂量 |
|
卡泊芬净 |
慎用 |
无须调整 |
Child Pugh评分7~9负荷剂量不变,维持剂量每日35 mg |
无须调整 |
无须调整 |
无须调整 |
“—”无相关资料;TDM:治疗药物监测;CrCL:肌酐清除率.
3 结语
COVID-19作为新发传染病,针对重型、危重型患者的诊治方案在不断探索与完善中,目前尚缺乏具有明确循证证据的抗病毒药物,临床暂且以对症治疗和防治并发症、治疗基础疾病、预防继发感染等为主。临床药学作为COVID-19多学科协作诊治团队的重要组成,在参与用药管理的模式、抗病毒药物的药代学和药动学研究等方面尚待进一步探索与完善。
References
- 1.中华人民共和国国家卫生健康委员会办公厅, 国家中医药管理局办公室.新型冠状病毒感染的肺炎诊疗方案(试行第六版)[A/OL].国卫办医涵[2020] 145号.(2020-02-18)[2020-02-28].. http://www.nhc.gov.cn/yzygj/s7653p/202002/8334a8326dd94d329df351d7da8aefc2.shtml
- 2.徐 凯进, 蔡 洪流, 沈 毅弘, et al. 2019冠状病毒病(COVID-19)诊疗浙江经验. http://www.zjujournals.com/med/CN/10.3785/j.issn.1008-9292.2020.02.02. 浙江大学学报(医学版) 2020;49(2):147–157. doi: 10.3785/j.issn.1008-9292.2020.02.02. [徐凯进, 蔡洪流, 沈毅弘, 等.2019冠状病毒病(COVID-19)诊疗浙江经验[J].浙江大学学报(医学版), 2020, 49(2):147-157. DOI:10.3785/j.issn.1008-9292.2020.02.02.] [DOI] [Google Scholar]
- 3.武汉同济医院新型冠状病毒肺炎救治协作组.重症新型冠状病毒感染肺炎诊疗与管理共识[A/OL].(2020-02-11)[2020-02-25].. http://health.people.com.cn/n1/2020/0211/c14739-31581678.html
- 4.中华预防医学会微生态学分会 中国消化道微生态调节剂临床应用共识(2016版) 中国微生态学杂志. 2016;28(6):621–631. doi: 10.13381/j.cnki.cjm.201606001. [中华预防医学会微生态学分会.中国消化道微生态调节剂临床应用共识(2016版)[J].中国微生态学杂志, 2016, 28(6):621-631. DOI:10.13381/j.cnki.cjm.201606001.] [DOI] [Google Scholar]
- 5.中华人民共和国国家卫生健康委员会办公厅, 国家中医药管理局办公室.新型冠状病毒肺炎重型、危重型病例诊疗方案(试行第二版)[A/OL].国卫办医函[2020] 127号.(2020-02-14)[2020-02-28].. http://www.gov.cn/zhengce/zhengceku/2020-04/01/content_5497892.htm
- 6.李太生, 曹玮, 翁利, 等.北京协和医院关于"新型冠状病毒感染的肺炎"诊疗建议方案(V2.0)[J].协和医学杂志, 2020: 1-5.
- 7.中华人民共和国国家卫生健康委员会办公厅.新型冠状病毒肺炎防控方案(第四版)[A/OL].国卫办疾控函[2020] 109号.(2020-02-06)[2020-02-25].. http://www.gov.cn/zhengce/zhengceku/2020-02/07/content_5475813.htm
- 8.中华人民共和国国家卫生健康委员会办公厅.新型冠状病毒实验室生物安全指南(第二版)[A/OL].国卫办科教函[2020] 70号.(2020-01-23)[2020-02-28].. http://www.nhc.gov.cn/xcs/zhengcwj/202001/0909555408d842a58828611dde2e6a26.shtml
- 9.中华医学会检验医学分会 2019新型冠状病毒肺炎临床实验室生物安全防护专家共识. 中华检验医学杂志. 2020;43(3):203–208. doi: 10.3760/cma.j.issn.1009-8158.2020.0001. [中华医学会检验医学分会.2019新型冠状病毒肺炎临床实验室生物安全防护专家共识[J].中华检验医学杂志, 2020, 43(3):203-208. DOI:10.3760/cma.j.issn.1009-8158.2020.0001.] [DOI] [Google Scholar]
- 10.广东省药学会 新型冠状病毒肺炎患者血药浓度检测技术指引. 今日药学. 2020:1–7. doi: 10.12048/j.issn.1674-229X.2020.01.001. [广东省药学会.新型冠状病毒肺炎患者血药浓度检测技术指引[J].今日药学, 2020:1-7.] [DOI] [Google Scholar]
- 11.李 璐, 陈 娜, 孔 丽敏, et al. 新型冠状病毒感染特殊人群的抗病毒药物治疗方案. 中国现代应用药学. 2020;37(3):257–263. doi: 10.13748/j.cnki.issn1007-7693.2020.03.001. [李璐, 陈娜, 孔丽敏, 等.新型冠状病毒感染特殊人群的抗病毒药物治疗方案[J].中国现代应用药学, 2020, 37(3):257-263. DOI:10.13748/j.cnki.issn1007-7693.2020.03.001.] [DOI] [Google Scholar]
- 12.STOCKMAN L J, BELLAMY R, GARNER P. SARS:systematic review of treatment effects. PLoS Med. 2006;3(9):e343. doi: 10.1371/journal.pmed.0030343. [STOCKMAN L J, BELLAMY R, GARNER P. SARS:systematic review of treatment effects[J/OL]. PLoS Med, 2006, 3(9):e343. DOI:10.1371/journal.pmed.0030343.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.魏 娜, 王 彩霞, 刘 喜宝, et al. 抗病毒新药法匹拉韦研究进展. 医药导报. 2016;35(2):169–171. doi: 10.3870/j.issn.1004-0781.2016.02.016. [魏娜, 王彩霞, 刘喜宝, 等.抗病毒新药法匹拉韦研究进展[J].医药导报, 2016, 35(2):169-171. DOI:10.3870/j.issn.1004-0781.2016.02.016.] [DOI] [Google Scholar]
- 14.WANG M, CAO R, ZHANG L, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro . Cell Res. 2020;30:269–271. doi: 10.1038/s41422-020-0282-0. [WANG M, CAO R, ZHANG L, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro[J]. Cell Res, 2020, 30:269-271. DOI:10.1038/s41422-020-0282-0. ] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.汪复, 张婴元.实用抗感染治疗学[M].2版.北京: 人民卫生出版社, 2012.
- 16.中华医学会呼吸病学分会 中国成人社区获得性肺炎诊断和治疗指南(2016年版) 中华结核和呼吸杂志. 2016;39(4):253–279. doi: 10.3760/cma.j.issn.1001-0939.2016.04.005. [中华医学会呼吸病学分会.中国成人社区获得性肺炎诊断和治疗指南(2016年版)[J].中华结核和呼吸杂志, 2016, 39(4):253-279. DOI:10.3760/cma.j.issn.1001-0939.2016.04.005.] [DOI] [Google Scholar]
- 17.中华医学会呼吸病学分会感染学组 中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版) 中华结核和呼吸杂志. 2018;41(4):255–280. doi: 10.3760/cma.j.issn.1001-0939.2018.04.006. [中华医学会呼吸病学分会感染学组.中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)[J].中华结核和呼吸杂志, 2018, 41(4):255-280. DOI:10.3760/cma.j.issn.1001-0939.2018.04.006.] [DOI] [Google Scholar]
- 18.HONORE P M, JACOBS R, DE WAELE E, et al. Applying pharmacokinetic/pharmacodynamic principles for optimizing antimicrobial therapy during continuous renal replacement therapy. Anaesthesiol Intensive Ther. 2017;49(5):412–418. doi: 10.5603/AIT.a2017.0071. [HONORE P M, JACOBS R, DE WAELE E, et al. Applying pharmacokinetic/pharmacodynamic principles for optimizing antimicrobial therapy during continuous renal replacement therapy[J]. Anaesthesiol Intensive Ther, 2017, 49(5):412-418. DOI:10.5603/AIT.a2017.0071.] [DOI] [PubMed] [Google Scholar]
- 19.KNOWLES S R, PHILLIPS E J, DRESSER L, et al. Common adverse events associated with the use of ribavirin for severe acute respiratory syndrome in Canada. Clin Infect Dis. 2003;37(8):1139–1142. doi: 10.1086/378304. [KNOWLES S R, PHILLIPS E J, DRESSER L, et al. Common adverse events associated with the use of ribavirin for severe acute respiratory syndrome in Canada[J]. Clin Infect Dis, 2003, 37(8):1139-1142. DOI:10.1086/378304.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.中华医学会感染病学分会艾滋病丙型肝炎学组, 中国疾病预防控制中心 中国艾滋病诊疗指南(2018年版) 中华内科杂志. 2018;57(12):867–884. doi: 10.3760/cma.j.issn.0578-1426.2018.12.002. [中华医学会感染病学分会艾滋病丙型肝炎学组, 中国疾病预防控制中心.中国艾滋病诊疗指南(2018年版)[J].中华内科杂志, 2018, 57(12):867-884. DOI:10.3760/cma.j.issn.0578-1426.2018.12.002.] [DOI] [Google Scholar]
- 21.DESCAMPS D, LAMBERT-NICLOT S, MARCELIN A G, et al. Mutations associated with virological response to darunavir/ritonavir in HIV-1-infected protease inhibitor-experienced patients. J Antimicrob Chemother. 2009;63(3):585–592. doi: 10.1093/jac/dkn544. [DESCAMPS D, LAMBERT-NICLOT S, MARCELIN A G, et al. Mutations associated with virological response to darunavir/ritonavir in HIV-1-infected protease inhibitor-experienced patients[J]. J Antimicrob Chemother, 2009, 63(3):585-592. DOI:10.1093/jac/dkn544.] [DOI] [PubMed] [Google Scholar]
- 22.刘 宏博, 曲 文秀, 李 胜岐, et al. 盐酸阿比朵尔片治疗流行性感冒的多中心随机双盲平行对照临床研究. 中国临床药理学杂志. 2006;22(6):403–405. doi: 10.3969/j.issn.1001-6821.2006.06.001. [刘宏博, 曲文秀, 李胜岐, 等.盐酸阿比朵尔片治疗流行性感冒的多中心随机双盲平行对照临床研究[J].中国临床药理学杂志, 2006, 22(6):403-405. DOI:10.3969/j.issn.1001-6821.2006.06.001.] [DOI] [Google Scholar]
- 23.SCHULTHEIß M, KLING S, LENKER U, et al. Lopinavir serum concentrations of critically ill infants:a pharmacokinetic investigation in South Africa. Med Microbiol Immunol. 2018;207(5-6):339–343. doi: 10.1007/s00430-018-0550-5. [SCHULTHEIß M, KLING S, LENKER U, et al. Lopinavir serum concentrations of critically ill infants:a pharmacokinetic investigation in South Africa[J]. Med Microbiol Immunol, 2018, 207(5-6):339-343. DOI:10.1007/s00430-018-0550-5.] [DOI] [PubMed] [Google Scholar]
- 24.JAGER N G, VAN HEST R M, LIPMAN J, et al. Therapeutic drug monitoring of anti-infective agents in critically ill patients. Expert Rev Clin Pharmacol. 2016;9(7):961–979. doi: 10.1586/17512433.2016.1172209. [JAGER N G, VAN HEST R M, LIPMAN J, et al. Therapeutic drug monitoring of anti-infective agents in critically ill patients[J]. Expert Rev Clin Pharmacol, 2016, 9(7):961-979. DOI:10.1586/17512433.2016.1172209.] [DOI] [PubMed] [Google Scholar]
- 25.王 融溶, 徐 强, 李 璐, et al. 新型冠状病毒肺炎合并基础疾病患者抗病毒药物使用的药学监护策略. 中国医院药学杂志. 2020;40:1–9. doi: 10.13286/j.1001-5213.2020.06.01. [王融溶, 徐强, 李璐, 等.新型冠状病毒肺炎合并基础疾病患者抗病毒药物使用的药学监护策略[J].中国医院药学杂志, 2020, 40:1-9. DOI:10.13286/j.1001-5213.2020.06.01.] [DOI] [Google Scholar]
- 26.MATOULKOVÁ P, PÁVEK P, MALÝ J, et al. Cytochrome P450 enzyme regulation by glucocorticoids and consequences in terms of drug interaction. Expert Opin Drug Metab Toxicol. 2014;10(3):425–435. doi: 10.1517/17425255.2014.878703. [MATOULKOVÁ P, PÁVEK P, MALÝ J, et al. Cytochrome P450 enzyme regulation by glucocorticoids and consequences in terms of drug interaction[J]. Expert Opin Drug Metab Toxicol, 2014, 10(3):425-435. DOI:10.1517/17425255.2014.878703.] [DOI] [PubMed] [Google Scholar]
- 27.Drug interactions checker[EB/OL].[2020-02-20]. .
- 28.ABDUL-AZIZ M H, ROBERTS J A. Antibiotic dosing during extracorporeal membrane oxygenation:does the system matter? Curr Opin Anaesthesiol. 2020;33(1):71–82. doi: 10.1097/ACO.0000000000000810. [ABDUL-AZIZ M H, ROBERTS J A. Antibiotic dosing during extracorporeal membrane oxygenation:does the system matter?[J]. Curr Opin Anaesthesiol, 2020, 33(1):71-82. DOI:10.1097/ACO.0000000000000810.] [DOI] [PubMed] [Google Scholar]
- 29.SHAW A R, MUELLER B A. Antibiotic dosing in continuous renal replacement therapy. Adv Chronic Kidney Dis. 2017;24(4):219–227. doi: 10.1053/j.ackd.2017.05.004. [SHAW A R, MUELLER B A. Antibiotic dosing in continuous renal replacement therapy[J]. Adv Chronic Kidney Dis, 2017, 24(4):219-227. DOI:10.1053/j.ackd.2017.05.004.] [DOI] [PubMed] [Google Scholar]
- 30.HAHN J, CHOI J H, CHANG M J. Pharmacokinetic changes of antibiotic, antiviral, antituberculosis and antifungal agents during extracorporeal membrane oxygenation in critically ill adult patients. J Clin Pharm Ther. 2017;42(6):661–671. doi: 10.1111/jcpt.12636. [HAHN J, CHOI J H, CHANG M J. Pharmacokinetic changes of antibiotic, antiviral, antituberculosis and antifungal agents during extracorporeal membrane oxygenation in critically ill adult patients[J]. J Clin Pharm Ther, 2017, 42(6):661-671. DOI:10.1111/jcpt.12636.] [DOI] [PubMed] [Google Scholar]
- 31.CIES J J, MOORE W S 2ND, GILIAM N, et al. Impact of ex-vivo extracorporeal membrane oxygenation circuitry on daptomycin . Perfusion. 2018;33(8):624–629. doi: 10.1177/0267659118781761. [CIES J J, MOORE W S 2ND, GILIAM N, et al. Impact of ex-vivo extracorporeal membrane oxygenation circuitry on daptomycin[J]. Perfusion, 2018, 33(8):624-629. DOI:10.1177/0267659118781761. ] [DOI] [PubMed] [Google Scholar]


