Abstract
目的
建立同时测定杭白芍9种主要成分没食子酸、羟基芍药苷、儿茶素、芍药内酯苷、芍药苷、五没食子酰葡萄糖、苯甲酸、苯甲酰芍药苷和丹皮酚的高效液相色谱法(HPLC),优化杭白芍的提取工艺。
方法
HPLC检测采用0.1%磷酸水溶液-乙腈为流动相线性梯度洗脱,流速为0.8 mL/min,柱温为30℃,检测波长为230 nm。采用超声提取法,甲醇和乙醇为提取溶剂,选用L 9(3 4)表分别设计三因素三水平的正交试验,考察溶剂浓度、液料比和提取时间对杭白芍9种主要成分总含量的影响。
结果
所建立的HPLC法具有较高的专属性、灵敏度和准确性,可用于同时定量分析杭白芍9种主要成分;确定了杭白芍9种主要成分的最佳提取工艺,即采用70%乙醇为提取溶剂,液料比为200 mL/g,超声提取时间为30 min。
结论
建立了同时测定杭白芍9种主要成分的HPLC法及其最佳工艺条件。
Abstract
Objective
To establish the optimum extraction technique and high performance liquid chromatographic (HPLC) method to simultaneously quantify nine compounds of gallic acid, hydroxy-paeoniflorin, catechin, albiflorin, paeoniflorin, pentagalloylglucose, benzoic acid, benzoylpaeoniflorin and paeonol in Paeoniae Radix Alba.
Methods
Linear gradient elution was applied using water containing 0.1%phosphoric acid and acetonitrile as the mobile phase with a flow rate of 0.8 mL/min, column temperature of 30℃ and wavelength of 230 nm. The method of ultrasound extraction was used. Methanol and ethanol were used as extraction solvents, and three factors and three levels of orthogonal experiments was designed using L 9(3 4) table to investigate the effects of solvent concentration, ratio of liquid to material and extraction time on the total content of nine components of Paeoniae Radix Alba.
Results
HPLC method was verified to have high specificity, sensitivity and accuracy through methodological validation, and it could be used for simultaneous quantitative analysis of nine components of Paeoniae Radix Alba. The results showed that the optimum extraction technology of nine components of Paeoniae Radix Alba was using 70%ethanol as extraction solvent, ratio of liquid to material was 200 mL/g and ultrasound extraction time was 30 min.
Conclusion
HPLC method for the simultaneous determination of nine components of Paeoniae Radix Alba is established, and the optimum extraction technology is confirmed.
Keywords: Paeonia; Chromatography, liquid; Technology, pharmaceutical; Orthogonal experiment; Ultrasound extraction
白芍为毛茛科植物芍药的干燥根,始载于《神农本草经》,具有平肝止痛、养血调经等功效。杭白芍主产于浙江磐安,在药用白芍中种植历史最久、品质最佳,是“浙八味”之一,为道地药材 [ 1- 2] 。目前,白芍主要成分的分析及提取工艺等研究已多有报道 [ 3- 16] ,但缺乏定量分析及提取工艺研究。目前,杭白芍生产极度萎缩,种质面临濒危 [ 1] ,因此有必要开展杭白芍的物质基础和提取方法研究,为其质量控制和种质保护提供依据。
建立定性、定量检测方法获得具有多个特征成分分析方法、指纹图谱,使之具有特异性和可控性,是中药质量标准的基础 [ 17] 。本研究建立同时测定杭白芍9种主要成分的高效液相色谱法(high performance liquid chromatography,HPLC), 以9种成分总含量为评价指标,运用正交试验设计考察提取溶剂种类、溶剂浓度、液料比和提取时间对杭白芍主要成分总含量的影响,筛选和优化杭白芍的提取工艺。
1 材料与方法
1.1 试剂和仪器
杭白芍中药饮片为嘉兴东方国药饮片有限公司产品,产地为浙江磐安。对照品没食子酸(批号171106,质量分数>99%)、羟基芍药苷(批号170603,质量分数>98%)、儿茶素(批号171028,质量分数>99%)、芍药内酯苷(批号171226,质量分数>98%)、芍药苷(批号171229,质量分数>98%)、五没食子酰葡萄糖(批号170930,质量分数>98%)、苯甲酸(批号171024,质量分数>99%)、苯甲酰芍药苷(批号170526,质量分数>98%)和丹皮酚(批号170721,质量分数>98%)均为上海融禾医药科技发展有限公司产品;甲醇和乙腈均为色谱纯,为国药集团化学试剂有限公司产品;其余试剂均为分析纯。
Agilent1260型高效液相色谱仪为美国Agilent公司产品;旋转蒸发器RE52-99为上海亚荣生化仪器厂产品;KQ-50E型超声波清洗器为昆山超声仪器有限公司产品;十万分之一电子分析天平(XS105 DualRange)为瑞士Mettler Toledo公司产品;高速离心机CF-10为韩国Daihan公司产品;Cascada LS超纯水仪为美国Pall公司产品;Vortex Genius 3涡旋混合器为德国IKA公司产品;SHB-ⅢA循环水式多用真空泵为郑州长城科工贸有限公司产品。
1.2 HPLC色谱条件
色谱柱选用Agilent XB-C18柱(4.6 mm×250 mm, 5 μm)。流动相A相为0.1%磷酸水溶液(酸碱度为2.7),C相为乙腈。线性梯度洗脱:0~5 min,10%~15%乙腈;5~25 min,15%~22%乙腈;25~45 min,22%~70%乙腈;45~46 min,70%~80%乙腈;46~48 min,80%乙腈。流速为0.8 mL/min,检测波长为230 nm,柱温为30 ℃,进样量为10 μL。
1.3 对照品溶液的制备
分别取对照品没食子酸、羟基芍药苷、儿茶素、芍药内酯苷、芍药苷、五没食子酰葡萄糖、苯甲酸、苯甲酰芍药苷和丹皮酚适量,精密称定,各加入80%甲醇溶液定容至1 mL,得各对照品储备液。分别精密量取各对照品储备液适量混匀,并用80%甲醇溶液定容至1 mL,得混合对照品溶液。
1.4 提取方法的初步筛选
分别精密称取两份杭白芍饮片粉末各0.4 g(过40目筛),置于锥形瓶中,各加入40 mL 50%甲醇溶液作为提取溶剂。其中一份采用100 ℃加热回流提取1.5 h, 另一份在35 ℃下超声(功率为100 kHz)提取30 min,静置至室温。两份均称定并补足质量,0.22 μm微孔滤膜过滤,取续滤液,按1.2中的色谱条件进行HPLC检测。对比两种提取方法所得9种成分的总峰面积,可见超声提取所得各成分的总峰面积大于加热回流提取,因此采用超声提取法开展下一步研究。
1.5 供试品溶液的制备
精密称取杭白芍饮片粉末0.4 g(过40目筛),置于锥形瓶中,加入一定量提取溶剂,称定质量,35 ℃下超声(功率为100 kHz)提取一定时间。静置至室温,称定补足质量,过滤,得滤液。超声提取法所得滤液进一步采用旋转蒸发器进行旋蒸浓缩,得浸膏。采用相应提取溶剂溶解浸膏,混匀,定容至5 mL。取100 μL浸膏溶液,加入500 μL相应提取溶剂稀释,混匀,40 000× g离心5 min,取上清液用0.22 μm微孔滤膜滤过,取续滤液,即得供试品溶液。
1.6 方法学考察
专属性考察:分别进样70%乙醇、70%甲醇、混合对照品溶液和杭白芍供试品溶液,考察HPLC检测方法的专属性。定量下限和线性范围考察:取一定质量浓度的混合对照品溶液用80%甲醇逐级稀释,按信噪比10:1计,确定各待测成分的定量下限,根据供试品中各成分含量,综合考虑各成分的浓度上限,确定各成分的线性范围;配制一系列质量浓度的混合对照品溶液,采用HPLC分析,以各成分质量浓度( X)为横坐标,各成分峰面积( Y)为纵坐标得线性回归方程。仪器精密度考察:吸取一定浓度的混合对照品溶液适量,采用HPLC连续进样6次,计算峰面积的相对标准偏差(RSD)。重复性考察:按供试品溶液制备方法得浸膏溶液后,分别取100 μL浸膏溶液,各加入250、500和750 μL提取溶剂(70%乙醇)稀释浸膏溶液,得质量浓度比为3:2:1的高、中、低三种供试品溶液,每种浓度平行制备三份,采用HPLC测定各成分高、中、低质量浓度,并计算RSD值。加样回收率考察:分别配制高、中、低三种质量浓度的混合对照品溶液,加至已测定各成分含量的供试品溶液中,每种浓度平行制备三份,测定各成分高、中、低质量浓度,计算混合对照品各成分的测定值,根据混合对照品各成分的测定值与理论值的比值计算加样回收率(%)。
1.7 正交试验设计
选用L 9(3 4)表设计正交试验,以甲醇或乙醇为提取溶剂分别考察溶剂浓度、液料比、超声时间三个因素对提取效率的影响,每个因素设置三个水平( 表 1),以各因素、各水平为提取工艺条件分别制备供试品溶液,采用HPLC测定9种成分的质量浓度,并进一步计算杭白芍药材9种成分的总含量,以总含量为指标筛选最优提取工艺条件。
表1 以甲醇或乙醇为提取溶剂的正交试验方案
Table 1 Design of orthogonal experiments using methanol or ethanol as extraction solvent
|
水平 |
溶剂浓度(%) |
液料比(mL/g) |
超声时间(min) |
|
1 |
50 |
50 |
10 |
|
2 |
70 |
100 |
20 |
|
3 |
85 |
200 |
30 |
1.8 统计学方法
方法学考察中精密度采用RSD表示,计量资料用均数±标准差( x ± s)表示, 组间差异比较采用 t检验, P<0.05为差异具有统计学意义。
2 结果
2.1 方法学考察结果
2.1.1 专属性
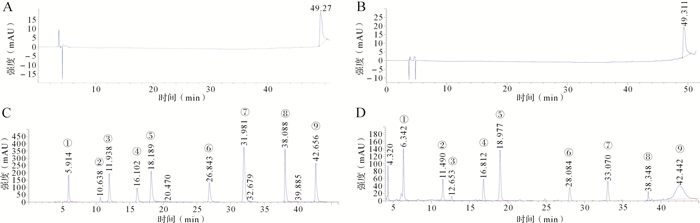
70%乙醇、70%甲醇、混合对照品溶液、杭白芍供试品溶液的HPLC色谱图见 图 1。结果显示,提取溶剂70%乙醇和70%甲醇对杭白芍9种主要成分分析均不存在干扰,可见本研究中HPLC方法专属性良好。
图1.
70%乙醇(A)、70%甲醇(B)、混合对照品溶液(C)和杭白芍供试品溶液(D)的HPLC色谱图
1:没食子酸;2:羟基芍药苷;3:儿茶素;4:芍药内酯苷;5:芍药苷;6:五没食子酰葡萄糖;7:苯甲酸;8:苯甲酰芍药苷;9:丹皮酚.HPLC:高效液相色谱.
2.1.2 定量下限和线性范围
杭白芍9种成分的线性回归方程、相关系数、线性范围和定量下限见 表 2。结果显示,杭白芍9种成分在所考察的浓度范围内线性良好。
表2 杭白芍9种成分的线性范围和定量下限
Table 2 The linear and lower limit of quantification of nine components of Paeoniae Radix Alba
|
成分 |
回归方程 |
相关系数 |
线性范围(μg/mL) |
定量下限(μg/mL) |
|
没食子酸 |
y=19.630 x+105.700 |
0.9977 |
2.172~139.0 |
2.172 |
|
羟基芍药苷 |
y=2.416 x+19.241 |
0.9968 |
1.641~105.0 |
1.641 |
|
儿茶素 |
y=30.524 x+21.984 |
0.9971 |
0.8062~51.60 |
0.8062 |
|
芍药内酯苷 |
y=13.139 x-6.099 |
0.9997 |
3.469~222.0 |
3.469 |
|
芍药苷 |
y=17.135 x-33.984 |
0.9990 |
6.734~431.0 |
6.734 |
|
五没食子酰葡萄糖 |
y=24.812 x-5.225 |
0.9999 |
0.1650~40.00 |
0.1650 |
|
苯甲酸 |
y=66.120 x-49.208 |
0.9999 |
3.422~219.0 |
3.422 |
|
苯甲酰芍药苷 |
y=25.562 x-38.283 |
0.9998 |
4.844~310.0 |
4.844 |
|
丹皮酚 |
y=50.046 x+51.925 |
0.9984 |
0.3981~25.50 |
0.3981 |
2.1.3 精密度
没食子酸、羟基芍药苷、儿茶素、芍药内酯苷、芍药苷、五没食子酰葡萄糖、苯甲酸、苯甲酰芍药苷和丹皮酚的RSD分别为1.61%、1.93%、0.75%、1.41%、1.87%、1.31%、1.00%、0.98%和1.90%,可见仪器进样精密度良好。
2.1.4 重复性
高、中、低三种质量浓度的供试品溶液中,杭白芍9种成分的RSD分别为1.50%~3.51%、2.14%~3.98%、1.91%~4.10%, 可见方法的重复性良好。
2.1.5 加样回收率
高、中、低三种质量浓度混合对照品各成分的加样回收率分别为86.3%~107.2%,88.4%~106.2%、88.6%~110.7%,RSD均未超过4.73%,说明方法的准确度良好。
2.2 正交试验结果
以甲醇或乙醇为提取溶剂,杭白芍超声提取工艺正交试验结果见 表 3。极差分析结果显示,无论是以甲醇还是以乙醇为提取溶剂,溶剂浓度的极差值均最大,说明溶剂浓度对杭白芍9种成分提取总含量的影响最大,其次为液料比和超声时间,见 表 4。各因素水平对杭白芍9种成分提取总含量的影响变化趋势如 图 2所示。
表3 杭白芍超声提取工艺条件三因素三水平正交试验结果
Table 3 The results of orthogonal experiments with three factors and three levels for ultrasound extraction technology of Paeoniae Radix Alba
|
序号 |
溶剂浓度 |
液料比 |
超声时间 |
空白 |
总含量(g/g) |
|
|
甲醇为溶剂 |
乙醇为溶剂 |
|||||
|
1 |
1 |
1 |
1 |
1 |
0.0303 |
0.0338 |
|
2 |
1 |
2 |
3 |
2 |
0.0367 |
0.0408 |
|
3 |
1 |
3 |
2 |
3 |
0.0327 |
0.0403 |
|
4 |
2 |
1 |
3 |
3 |
0.0366 |
0.0368 |
|
5 |
2 |
2 |
2 |
1 |
0.0391 |
0.0377 |
|
6 |
2 |
3 |
1 |
2 |
0.0382 |
0.0390 |
|
7 |
3 |
1 |
2 |
2 |
0.0216 |
0.0172 |
|
8 |
3 |
2 |
1 |
3 |
0.0272 |
0.0152 |
|
9 |
3 |
3 |
3 |
1 |
0.0353 |
0.0220 |
表4 杭白芍超声提取工艺条件正交试验极差分析结果
Table 4 Range analysis of orthogonal experiment for ultrasound extraction technology of Paeoniae Radix Alba
|
极差分析指标 |
甲醇为溶剂 |
乙醇为溶剂 |
|||||||
|
溶剂浓度 |
液料比 |
超声时间 |
误差 |
溶剂浓度 |
液料比 |
超声时间 |
误差 |
||
|
K 1 |
0.0996 |
0.0885 |
0.0957 |
0.1046 |
0.1149 |
0.0878 |
0.0880 |
0.0935 |
|
|
K 2 |
0.1138 |
0.1029 |
0.0934 |
0.0965 |
0.1135 |
0.0937 |
0.0952 |
0.0971 |
|
|
K 3 |
0.0841 |
0.1062 |
0.1085 |
0.0965 |
0.0544 |
0.1013 |
0.0996 |
0.0923 |
|
|
κ 1 |
0.0332 |
0.0295 |
0.0319 |
0.0349 |
0.0383 |
0.0293 |
0.0293 |
0.0312 |
|
|
κ 2 |
0.0379 |
0.0343 |
0.0311 |
0.0322 |
0.0378 |
0.0312 |
0.0317 |
0.0324 |
|
|
κ 3 |
0.0280 |
0.0354 |
0.0362 |
0.0322 |
0.0181 |
0.0338 |
0.0332 |
0.0308 |
|
|
极差 |
0.0099 |
0.0059 |
0.0051 |
0.0027 |
0.0202 |
0.0045 |
0.0039 |
0.0016 |
图2.
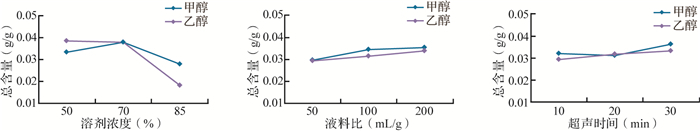
以甲醇或乙醇为溶剂时溶剂浓度、液料比、超声时间对9种成分总含量的影响趋势
正交试验方差分析结果见 表 5。根据《 F分布数值表》 [ 18] ,以甲醇为溶剂的提取工艺中,甲醇浓度在 α=0.1水平上显著,液料比在 α=0.2水平上显著,超声提取时间在 α=0.25水平上显著;以乙醇为溶剂的提取工艺中,乙醇浓度在 α=0.005水平上显著,液料比在 α=0.15水平上显著,超声提取时间在 α=0.2水平上显著。
表5 杭白芍超声提取工艺条件正交试验方差分析结果
Table 5 Variance analysis of orthogonal experiment for ultrasound extraction technology of Paeoniae Radix Alba
|
方差分析指标 |
甲醇为溶剂 |
乙醇为溶剂 |
|||||||
|
溶剂浓度 |
液料比 |
超声时间 |
误差 |
溶剂浓度 |
液料比 |
超声时间 |
误差 |
||
|
偏差平方和 |
1.47×10 -4 |
5.93×10 -5 |
4.46×10 -5 |
1.47×10 -5 |
7.96×10 -4 |
3.06×10 -5 |
2.29×10 -5 |
4.20×10 -6 |
|
|
自由度 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
|
|
方差 |
7.36×10 -5 |
2.97×10 -5 |
2.23×10 -5 |
7.33×10 -6 |
3.98×10 -4 |
1.53×10 -5 |
1.15×10 -5 |
2.10×10 -6 |
|
|
F值 |
10.0405 |
4.0433 |
3.0385 |
— |
189.60 |
7.29 |
5.46 |
— |
“—”:无相关数据.
2.3 最佳提取工艺的确定
以甲醇为溶剂的提取工艺中,甲醇浓度为70%时,提取总含量最大;液料比为100 mL/g和200 mL/g时提取总含量接近;超声时间为30 min时,提取总含量最大。因此,以甲醇为溶剂的最佳提取工艺条件是甲醇浓度70%、液料比100 mL/g或200 mL/g, 超声时间30 min。以乙醇为溶剂的提取工艺中,乙醇浓度为50%或70%时,提取总含量最大;液料比为200 mL/g时提取总含量最大;超声时间为30 min时,提取总含量最大。以乙醇或甲醇为提取溶剂获得的杭白芍9种成分总含量差异无统计学意义( P>0.05)。考虑到乙醇比甲醇经济、环保,因此本研究选择以乙醇作为杭白芍的提取溶剂。
为确定最优提取工艺条件,再次采用乙醇为提取溶剂的两种最佳工艺条件进行杭白芍提取实验并测定9种成分的总含量,每种条件平行制备3份。以70%乙醇为提取溶剂获得杭白芍9种成分平均总含量高于以50%乙醇为提取溶剂获得的平均总含量,见 表 6。与50%乙醇为提取溶剂比较,芍药苷、五没食子酰葡萄糖和苯甲酸在70%乙醇为提取溶剂下可以获得较高的提取含量( P < 0.05)。因此,本研究确定杭白芍9种主要成分的最佳提取工艺条件为采用70%乙醇为提取溶剂,液料比为200 mL/g,超声提取时间为30 min。
表6 以乙醇为提取溶剂的两种方案提取杭白芍9种成分的结果
Table 6 The concentration of nine components extracting from Paeoniae Radix Alba using ethanol as extraction solvent ( x ± s, n=3)
|
成分 |
方案1 |
方案2 |
|||
|
质量浓度(μg/mL) |
含量(g/g) |
质量浓度(μg/mL) |
含量(g/g) |
||
|
没食子酸 |
60.79±2.17 |
0.0045±0.0002 |
65.15±8.52 |
0.0049±0.0006 |
|
|
羟基芍药苷 |
50.51±3.33 |
0.0038±0.0002 |
48.56±6.02 |
0.0036±0.0005 |
|
|
儿茶素 |
3.75±0.48 |
0.0003±0.0000 |
4.81±0.47 |
0.0004±0.0000 |
|
|
芍药内酯苷 |
58.07±3.27 |
0.0043±0.0002 |
65.33±7.77 |
0.0049±0.0006 |
|
|
芍药苷 |
101.60±6.42 |
0.0075±0.0005 |
126.80±9.01 |
0.0095±0.0007 * |
|
|
五没食子酰葡萄糖 |
19.95±2.70 |
0.0015±0.0002 |
50.14±11.14 |
0.0038±0.0008 * |
|
|
苯甲酸 |
10.30±1.69 |
0.0008±0.0001 |
12.62±2.77 |
0.0009±0.0002 * |
|
|
苯甲酰芍药苷 |
7.58±1.35 |
0.0006±0.0001 |
9.31±1.86 |
0.0007±0.0001 |
|
|
丹皮酚 |
8.73±2.53 |
0.0006±0.0002 |
8.71±2.41 |
0.0007±0.0002 |
|
|
总含量(g/g) |
— |
0.0239±0.0018 |
— |
0.0292±0.0044 |
“—”:无相关数据.与方案1比较, * P < 0.05.方案1:乙醇浓度为50%,液料比为200 mL/g, 超声时间为30 min; 方案2:乙醇浓度为70%,液料比为200 mL/g, 超声时间为30 min.
3 讨论
杭白芍在药用白芍中品质最佳,但其质量控制研究还非常欠缺,限制了其种质保护及相关产品开发。杭白芍主要含芍药苷、羟基芍药苷、苯甲酰芍药苷等单萜苷类,没食子酸、儿茶素等鞣质类及苯甲酸等其他成分 [ 19] 。但目前还缺乏杭白芍多种主要成分的定量分析研究。本研究通过HPLC同时测定杭白芍9种主要成分含量,经方法学验证表明所建立的方法具有较高的特异性、灵敏度和准确性,可以用于杭白芍多种成分的定量分析,为杭白芍的质量控制和产品开发提供方法保障。同时,研究结果发现杭白芍中羟基芍药苷的含量相对较高(3.6 mg/g),仅次于芍药苷(9.5 mg/g)、芍药内酯苷(4.9 mg/g)、没食子酸(4.9 mg/g)和五没食子酰葡萄糖(3.8 mg/g)。而以往白芍成分分析相关研究较少考察羟基芍药苷或其测定结果提示含量较低 [ 20] ,可见杭白芍的物质组成与其他种质白芍可能存在差异。羟基芍药苷是否为杭白芍的特征性质量标志物及其生物活性还需进一步研究。
超声提取为白芍的经典提取方法,因其操作简单、提取效率高,同时可避免高温提取可能导致的芍药苷等单萜苷类不稳定 [ 21] 。另外,随着中药分析技术的发展,对中药提取工艺的考察不再是以一两个含量较高的成分为指标优化提取方法,而逐渐倾向于以中药多种成分为综合评价指标,全面、充分考察提取工艺 [ 8, 12, 16, 22- 23] 。本研究以杭白芍9种主要成分总含量为综合评价指标,对杭白芍的提取工艺条件进行优化。基于超声提取法,以甲醇和乙醇为提取溶剂,分别设计了三因素三水平的正交试验,考察了溶剂浓度、液料比和超声时间对杭白芍9种成分总含量的影响。研究结果发现,溶剂浓度对杭白芍主要物质的提取效果影响最大,其次是液料比,超声时间对杭白芍主要物质的提取效果影响较小。最后,根据正交试验结果分析并确定了杭白芍的最佳提取工艺条件,即采用70%乙醇为提取溶剂,液料比200 mL/g,超声提取时间30 min,在该工艺条件下,可保证杭白芍多成分的较全面提取。本研究可为杭白芍的质量控制、种质保护及其相关产品开发提供科学依据。基于本研究结果,后续将进一步开展杭白芍的药理作用及体内药物代谢过程研究。
Funding Statement
浙江省自然科学基金(LY18H280011);国家自然科学基金(81503338);浙江省大学生科技创新活动计划(新苗人才计划)项目(2019R417026)
References
- 1.查 良平, 杨 俊, 彭 华胜, et al. 四大产地白芍的种质调查. 中药材. 2011;34(7):313–317. doi: 10.13863/j.issn1001-4454.2011.07.015. [查良平, 杨俊, 彭华胜, 等.四大产地白芍的种质调查[J].中药材, 2011, 34(7):313-317. DOI:10.13863/j.issn1001-4454.2011.07.015.] [DOI] [Google Scholar]
- 2.朱 如彩, 蔡 萍, 李 雅, et al. 不同产地白芍HPLC指纹图谱及芍药苷和芍药内酯苷含量的比较研究. 湖南中医药大学学报. 2012;32(3):34–37. doi: 10.3969/j.issn.1674-070X.2012.03.010.034.04. [朱如彩, 蔡萍, 李雅, 等.不同产地白芍HPLC指纹图谱及芍药苷和芍药内酯苷含量的比较研究[J].湖南中医药大学学报, 2012, 32(3):34-37. DOI:10.3969/j.issn.1674-070X.2012.03.010.034.04.] [DOI] [Google Scholar]
- 3.林 庆义, 汪 世琼. 白芍超声提取工艺研究. 中药材. 2002;25(10):737–738. doi: 10.13863/j.issn1001-4454.2002.10.022. [林庆义, 汪世琼.白芍超声提取工艺研究[J].中药材, 2002, 25(10):737-738. DOI:10.13863/j.issn1001-4454.2002.10.022.] [DOI] [Google Scholar]
- 4.刘 媛, 周 劲松, 陈 玉俊, et al. 白芍提取工艺的研究. 时珍国医国药. 2006;17(7):1239–1240. doi: 10.3969/j.issn.1008-0805.2006.07.068. [刘媛, 周劲松, 陈玉俊, 等.白芍提取工艺的研究[J].时珍国医国药, 2006, 17(7):1239-1240.] [DOI] [Google Scholar]
- 5.刘 玉红, 陈 燕, 黄 志芳, et al. RP-HPLC测定白芍提取物的总苷含量. 中国中药杂志. 2007;32(11):1114–1115. doi: 10.3321/j.issn:1001-5302.2007.11.036. [刘玉红, 陈燕, 黄志芳, 等.RP-HPLC测定白芍提取物的总苷含量[J].中国中药杂志, 2007, 32(11):1114-1115. DOI:10.3321/j.issn:1001-5302.2007.11.036.] [DOI] [Google Scholar]
- 6.彭 晓霞, 路 莎莎, 张 振巍. 混合均匀设计效应面法优选赤芍中芍药苷的提取工艺. http://www.cnki.com.cn/Article/CJFDTotal-ZGYA201111017.htm. 中国药房. 2011;22(11):994–996. [彭晓霞, 路莎莎, 张振巍.混合均匀设计效应面法优选赤芍中芍药苷的提取工艺[J].中国药房, 2011, 22(11):994-996.] [Google Scholar]
- 7.谢 仲德, 李 文烈, 方 应权, et al. 白芍中芍药苷的闪式提取工艺研究. 中成药. 2013;35(9):2037–2039. doi: 10.3969/j.issn.1001-1528.2013.09.052. [谢仲德, 李文烈, 方应权, 等.白芍中芍药苷的闪式提取工艺研究[J].中成药, 2013, 35(9):2037-2039. DOI:10.3969/j.issn.1001-1528.2013.09.052.] [DOI] [Google Scholar]
- 8.余 捷婧, 吴 金雄, 梁 亚凤, et al. HPLC同时测定赤芍和白芍中没食子酸等6种成分的量. 中草药. 2015;46(11):1673–1677. doi: 10.7501/j.issn.0253-2670.2015.11.021. [余捷婧, 吴金雄, 梁亚凤, 等.HPLC同时测定赤芍和白芍中没食子酸等6种成分的量[J].中草药, 2015, 46(11):1673-1677. DOI:10.7501/j.issn.0253-2670.2015.11.021.] [DOI] [Google Scholar]
- 9.尹 雪, 孙 萍, 温 学森, et al. 混合均匀设计法优化白芍提取工艺. 中国药房. 2016;27(1):89–91. doi: 10.6039/j.issn.1001-0408.2016.01.29. [尹雪, 孙萍, 温学森, 等.混合均匀设计法优化白芍提取工艺[J].中国药房, 2016, 27(1):89-91. DOI:10.6039/j.issn.1001-0408.2016.01.29.] [DOI] [Google Scholar]
- 10.王 巧, 郭 洪祝, 霍 长虹, et al. 白芍化学成分研究. 中草药. 2010;41(8):1245–1248. doi: 10.3321/j.issn:0253-2670.2007.07.003. [王巧, 郭洪祝, 霍长虹, 等.白芍化学成分研究[J].中草药, 2010, 41(8):1245-1248. DOI:10.3321/j.issn:0253-2670.2007.07.003.] [DOI] [Google Scholar]
- 11.金 林, 赵 万顺, 郭 巧生, et al. 白芍UPLC指纹图谱研究. 中草药. 2015;46(23):3564–3569. doi: 10.7501/j.issn.0253-2670.2015.23.020. [金林, 赵万顺, 郭巧生, 等.白芍UPLC指纹图谱研究[J].中草药, 2015, 46(23):3564-3569. DOI:10.7501/j.issn.0253-2670.2015.23.020.] [DOI] [Google Scholar]
- 12.李 伟铭, 赵 月然, 杨 燕云, et al. HPLC波长切换法同时测定白芍饮片中9个成分的含量. 药物分析杂志. 2011;31(12):2208–2212. doi: 10.16155/j.0254-1793.2011.12.010. [李伟铭, 赵月然, 杨燕云, 等.HPLC波长切换法同时测定白芍饮片中9个成分的含量[J].药物分析杂志, 2011, 31(12):2208-2212. DOI:10.16155/j.0254-1793.2011.12.010.] [DOI] [Google Scholar]
- 13.REN M L, ZHANG X, DING R, et al. Two new monoterpene glucosides from Paeonia lactiflora Pall. J Asian Nat Prod Res. 2009;11(7):670–674. doi: 10.1080/10286020902980087. [REN M L, ZHANG X, DING R, et al. Two new monoterpene glucosides from Paeonia lactiflora Pall[J]. J Asian Nat Prod Res, 2009, 11(7):670-674. DOI:10.1080/10286020902980087.] [DOI] [PubMed] [Google Scholar]
- 14.SHU X, DUAN W, LIU F, et al. Preparative separation of polyphenols from the flowers of Paeonia lactiflora Pall. by high-speed counter-current chromatography. J Chromatogr B Analyt Technol Biomed Life Sci. 2014;(947-948):62–67. doi: 10.1016/j.jchromb.2013.12.004. [SHU X, DUAN W, LIU F, et al. Preparative separation of polyphenols from the flowers of Paeonia lactiflora Pall. by high-speed counter-current chromatography[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2014, (947-948):62-67. DOI:10.1016/j.jchromb.2013.12.004.] [DOI] [PubMed] [Google Scholar]
- 15.张 慧, 王 涛, 陈 杰, et al. 白芍多波长叠加指纹图谱研究. 中药材. 2017;40(9):2121–2124. doi: 10.13863/j.issn1001-4454.2017.09.028. [张慧, 王涛, 陈杰, 等.白芍多波长叠加指纹图谱研究[J].中药材, 2017, 40(9):2121-2124. DOI:10.13863/j.issn1001-4454.2017.09.028.] [DOI] [Google Scholar]
- 16.金 林, 赵 万顺, 郭 巧生, et al. 响应面法优化白芍提取工艺的研究. 中国中药杂志. 2015;40(15):2988–2993. doi: 10.4268/cjcmm20151514. [金林, 赵万顺, 郭巧生, 等.响应面法优化白芍提取工艺的研究[J].中国中药杂志, 2015, 40(15):2988-2993. DOI:10.4268/cjcmm20151514.] [DOI] [PubMed] [Google Scholar]
- 17.刘 昌孝, 陈 士林, 肖 小河, et al. 中药质量标志物(Q-Marker):中药产品质量控制的新概念. 中草药. 2016;47(9):1443–1457. doi: 10.7501/j.issn.0253-2670.2016.09.001. [刘昌孝, 陈士林, 肖小河, 等.中药质量标志物(Q-Marker):中药产品质量控制的新概念[J].中草药, 2016, 47(9):1443-1457. DOI:10.7501/j.issn.0253-2670.2016.09.001.] [DOI] [Google Scholar]
- 18.国家标准化管理委员会.BG4086.4-1983统计分布数值表F分布[S].北京: 中国标准出版社, 1984.
- 19.李 彬, 曾 金香, 李 晶, et al. 杭白芍的化学成分. 药学与临床研究. 2009;17(3):204–206. doi: 10.3969/j.issn.1673-7806.2009.03.011. [李彬, 曾金香, 李晶, 等.杭白芍的化学成分[J].药学与临床研究, 2009, 17(3):204-206. DOI:10.3969/j.issn.1673-7806.2009.03.011.] [DOI] [Google Scholar]
- 20.葛 志伟, 贺 庆, 林 云径, et al. RP-HPLC法测定杭白芍及其饮片中芍药内酯苷、芍药苷和苯甲酰芍药苷. 中草药. 2008;39(3):378–380. doi: 10.3321/j.issn:0253-2670.2008.03.018. [葛志伟, 贺庆, 林云径, 等.RP-HPLC法测定杭白芍及其饮片中芍药内酯苷、芍药苷和苯甲酰芍药苷[J].中草药, 2008, 39(3):378-380. DOI:10.3321/j.issn:0253-2670.2008.03.018.] [DOI] [Google Scholar]
- 21.黄 月纯, 魏 刚, 刘 翠玲, et al. 白芍HPLC特征指纹图谱的稳定性考察. http://d.old.wanfangdata.com.cn/Periodical/zyxyylcyl201003022. 中药新药与临床药理. 2010;21(3):280–284. [黄月纯, 魏刚, 刘翠玲, 等.白芍HPLC特征指纹图谱的稳定性考察[J].中药新药与临床药理, 2010, 21(3):280-284.] [Google Scholar]
- 22.李 妍, 杨 燕云, 张 振秋, et al. HPLC法同时测定白芍、甘草药对提取物中9种有效成分. http://d.old.wanfangdata.com.cn/Periodical/zhongcy201301023. 中成药. 2013;35(1):100–104. [李妍, 杨燕云, 张振秋, 等.HPLC法同时测定白芍、甘草药对提取物中9种有效成分[J].中成药, 2013, 35(1):100-104.] [Google Scholar]
- 23.张 雯雯, 徐 志伟, 曹 岗. 多指标正交设计优选白术-白芍药对的提取工艺. 浙江中医药大学学报. 2014;38(5):511–516. doi: 10.16466/j.issn1005-5509.2014.05.026. [张雯雯, 徐志伟, 曹岗.多指标正交设计优选白术-白芍药对的提取工艺[J].浙江中医药大学学报, 2014, 38(5):511-516. DOI:10.16466/j.issn1005-5509.2014.05.026.] [DOI] [Google Scholar]


