Abstract
目的
研究急进高原缺氧环境对大鼠肝脏孕烷X受体(PXR)表达的影响及相关机制。
方法
Wistar雄性大鼠40只,随机分为对照组和急进高原缺氧12、24、36、48 h组,每组8只。待预定缺氧时间完成,采集各组大鼠腹主动脉血,全自动血气分析仪进行血气分析;HE染色观察肝组织病理变化状况;实时定量PCR测定各组大鼠肝组织中PXR mRNA水平;蛋白质印迹法测定各组大鼠肝组织中PXR和蛋白酶SUG1的表达。
结果
与对照组比较,急进高原缺氧12 h后大鼠血液酸碱度值降低;缺氧24 h后动脉血氧饱和度(SaO 2)低于80%,动脉氧分压(PaO 2)低于60 mmHg(1 mmHg=0.133 kPa);缺氧48 h后动脉二氧化碳分压(PaCO 2)增加( P < 0.05)。对照组大鼠肝组织结构完整,急进高原缺氧12、24 h组肝组织中央静脉有明显水肿,缺氧36、48 h组大鼠肝组织见炎性浸润。大鼠肝脏内PXR mRNA表达从急进高原缺氧12 h时即显著下调,缺氧12、24、36、48 h组分别降低了63%、96%、86%、85%(均 P < 0.05);其蛋白表达从缺氧36 h后显著上调,缺氧36、48 h后分别上调93%、99%(均 P < 0.05)。蛋白酶SUG1的表达从缺氧24 h开始降低,缺氧24、36、48 h后分别下降14%、34%、46%(均 P < 0.01)。
结论
急进高原缺氧可对大鼠肝脏中核受体PXR表达产生影响,蛋白酶SUG1可能是影响急进高原缺氧下PXR表达的调控因素。
Abstract
Objective
To investigate the effects of high-altitude hypoxic environment on the expression of pregnane X receptor (PXR) in rat liver and related mechanism.
Methods
Wistar rats were randomly divided into five groups with 8 rats in each group, the rats were exposed to high-plateau hypoxia for 0 (control group), 12, 24, 36 and 48 h, respectively. Abdominal aortic blood samples were collected for blood gas analysis. HE staining was used to observe the pathological changes of liver tissue. The expression levels of PXR mRNA in liver tissues were determined by RT-PCR. Western blot analysis was performed to determine the protein expression of PXR and protease SUG1 in liver tissues of rats.
Results
Compared with the control group, the blood pH of the rats decreased after 12 h of acute hypoxia. After 24 h exposed to hypoxia, SaO 2 was lower than 80%, PaO 2 was lower than 60 mmHg (1 mmHg=0.133 kPa); and PaCO 2 increased after 48 h exposed to hypoxia ( P < 0.05). There was obvious edema in the central vein of the liver tissue at 12 h and 24 h after exposure to hypoxia. The liver tissue of the rats exposed to hypoxia for 36 h and 48 h showed inflammatory infiltration. The expression of PXR mRNA was significantly decreased by 63%, 96%, 86%, and 85%at 12, 24, 36 h, and 48 h after exposure to hypoxia (all P < 0.05), respectively. The protein expression of PXR was significantly up-regulated by 93%and 99%after 36 h and 48 h exposure to hypoxia (all P < 0.05), respectively. The protein expression of proteinase SUG1 decreased by 14%, 34%and 46%after 24, 36 and 48 h after hypoxia (all P < 0.01).
Conclusion
Acute hypoxia at high altitude can affect the expression of nuclear receptor PXR in rat liver, and protease SUG1 may be a regulatory factor for PXR expression in hypoxia.
Keywords: Altitude; Acute disease; Hypoxia/physiopathology; Adaptation, physiological; Receptors, cytoplasmic and nuclear/physiology; Liver; Rats, Wistar
缺氧是高原环境中影响人体的最严重因素 [ 1] 。高原未习服的平原人群急进高原,会出现明显的生理及病理反应,如血气、各项生化指标、血流动力学、体液以及主要脏器功能的改变,严重者可能出现急性高山病、高原肺水肿和脑水肿等急性高原反应 [ 2] 。这些生理性甚至病理性变化会在一定程度上影响药物在体内的吸收、分布、代谢和排泄。前期研究发现,高原缺氧环境下药物代谢酶的活性及表达会产生变化 [ 3] 。孕烷X受体(pregnane X receptor, PXR)是典型的代谢型核受体 [ 4] ,可在肝脏中调控药物代谢酶的转录过程 [ 5] ,进而影响药物代谢过程。有文献报道PXR激动剂能够使细胞色素P450酶的表达上调,从而加快同期服用药物的清除速率,导致疗效降低 [ 6] 。PXR在药物代谢过程的作用不容小觑,而在高原缺氧环境下PXR相关研究鲜有报道。本实验通过急进高原4010 m缺氧,探究不同缺氧时间下大鼠肝组织中核受体PXR的表达,期望为高原缺氧环境下药物代谢的研究提供新的思路,进而指导高原合理用药。
1 材料与方法
1.1 仪器与试剂
全自动样品快速研磨仪(上海净信实业发展公司),SpectraMax i3酶标仪(美国Molecular Devices公司),蛋白质印迹转移电泳仪(美国Bio-Rad公司),NP80超微量紫外分光光度计(德国Implen公司),ABI 9700型PCR仪、ViiA TM 7 Dx实时定量荧光PCR仪(美国Applied Biosystems公司)。RIPA裂解液、蛋白酶抑制剂、BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司),抗PXR抗体、抗β-actin抗体(英国Abcam公司),抗PSMC5抗体(美国Proteintech公司),山羊抗兔IgG-HRP二抗(武汉博士德生物工程有限公司),超敏电化学发光试剂盒(美国Millipore公司),RNAiso Plus、PrimeScript TM RT Master Mix、SYBR Premix Ex Taq TM Ⅱ(宝生物工程有限公司)。由宝生物工程有限公司完成引物合成。
1.2 动物分组及处理
SPF级健康雄性Wistar大鼠40只,体质量为(200±20)g,购自中国人民解放军联勤保障部队第九四○医院动物科[动物合格证书号:SCXK(甘)2013-0002]。研究通过中国人民解放军联勤保障部队第九四○医院动物试验伦理委员会批准。将大鼠随机分为对照组及急进高原缺氧12、24、36、48 h组,每组8只。对照组大鼠按清洁级标准饲养于中国人民解放军联勤保障部队第九四○医院动物实验室。急进高原缺氧组(简称“缺氧组”)用恒温箱式货车从甘肃兰州运输至青海玉树(海拔高度为4010 m),途中给予果冻补水。待预定缺氧时间完成,进行下一步实验。
1.3 全自动血气分析仪测定大鼠血气指标
各组大鼠采用腹腔注射10 %水合氯醛溶液0.8 mL进行麻醉,解剖后使用含少量肝素浸润管壁的一次性1 mL注射器采集腹主动脉血1 mL,立即用全自动血气分析仪进行血气分析,测定指标包括血液酸碱度值、动脉血氧饱和度(SaO 2)、动脉二氧化碳分压(PaCO 2)、动脉氧分压(PaO 2)等。
1.4 HE染色观察大鼠肝组织病理切片
大鼠麻醉解剖取肝组织,用预冷的等渗氯化钠溶液清洗后将部分肝组织置于4 %甲醛溶液中,由武汉谷歌生物科技有限公司制作病理切片,最后在光学显微镜下观察肝组织病理变化。
1.5 实时定量PCR测定大鼠肝组织PXR mRNA
10 %水合氯醛麻醉大鼠后解剖并摘取肝组织,采用RNAiso Plus等试剂提取各组大鼠肝组织中总RNA后,按PrimeScript TM RT Master Mix操作流程将总RNA反转录成cDNA,反应条件为:37 ℃反转录15 min,85 ℃灭活反转录酶15 s,终止反应待样品冷却至4 ℃。根据PXR及内参β-actin的基因全长序列分别设计引物,PXR引物:上游5′-TGGCTATCACTTCAATGTCA-3′,下游5′-CCTGCTGTTCTTCTGTCA-3′,长度299 bp;β-actin引物:上游5′-GGAGATTACTGCCCTGGCTCCTA-3′,下游5′- GACTCATCGTACTCCTGCTTGCTG-3′,长度150 bp。按SYBR Premix Ex Taq TM Ⅱ操作流程,以2 μL cDNA为模板进行PCR扩增,反应条件为:95 ℃预变性30 s;95 ℃反应5 s,60 ℃退火31 s,40个循环。熔解曲线生成的反应程序为:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。最后采用2 -△△Ct法比较各样本PXR mRNA的表达差异。
1.6 蛋白质印迹法测定大鼠肝组织PXR和SUG1蛋白表达
各组大鼠肝脏样品中加入RIPA裂解液(另加蛋白酶抑制剂)后匀浆并提取总蛋白,进一步采用BCA法测定蛋白浓度。通过SDS-PAGE分离蛋白质样品,并在恒定电流300 mA下转移至PVDF膜。5 %脱脂奶粉封闭2 h,分别加入抗PXR抗体(1 :500)、抗PSMC5抗体(1 :500)和抗β-actin抗体(1 :5000),4 ℃过夜孵育一抗。随后用TBST冲洗4次(每次10 min),冲洗完毕后将PVDF膜与合适稀释浓度的二抗在摇床上室温孵育1 h。孵育完成后再用TBST洗涤4次(每次10 min)。洗涤完成后使用超敏电化学发光试剂盒检测,最后暗室曝光。所得胶片扫描成图片后用ImageJ软件测定,以β-actin作为内参,计算各样本PXR蛋白和SUG1蛋白的相对表达量。
1.7 统计学方法
采用SPSS 16.0进行分析。结果用均数±标准差( x ± s)描述。单因素方差分析(One-Way ANOVA)行多组间比较, t检验行两组间比较, P < 0.05为差异具有统计学意义。
2 结果
2.1 急进高原缺氧大鼠肝组织血气指标变化
如 表 1所示, 与对照组比较,急进高原缺氧12 h大鼠血液酸碱度值降低( P < 0.05);在缺氧24 h后SaO 2低于80 %,PaO 2低于60 mmHg;缺氧48 h后PaCO 2增加( P < 0.05)。结果提示,急进高原后大鼠受缺氧影响,血液中可利用氧减少,血液酸碱度发生变化,可能会对肝脏功能产生影响。
表1 各组大鼠血气指标比较
Table 1 Blood gas analysis of hypoxia rats and healthy controls ( x ± s)
|
组别 |
n |
酸碱度值 |
SaO 2(%) |
PaO 2(mmHg) |
PaCO 2(mmHg) |
|
对照组 |
8 |
7.43±0.03 |
91.28±1.67 |
60.29±4.83 |
25.32±3.55 |
|
缺氧12 h组 |
8 |
7.29±0.10 * |
84.70±8.91 * |
61.13±7.95 |
24.17±2.96 |
|
缺氧24 h组 |
8 |
7.41±0.04 |
73.57±8.48 * |
56.60±4.83 |
25.75±1.51 |
|
缺氧36 h组 |
8 |
7.32±0.12 * |
67.45±5.22 * |
55.27±5.48 |
24.28±2.41 |
|
缺氧48 h组 |
8 |
7.37±0.10 |
69.43±13.90 * |
52.43±10.72 * |
28.49±3.84 * |
与对照组比较, * P < 0.05.SaO 2:动脉血氧饱和度;PaO 2:动脉氧分压;PaCO 2:动脉二氧化碳分压.1 mmHg=0.133 kPa.
2.2 急进高原缺氧大鼠肝组织病理变化
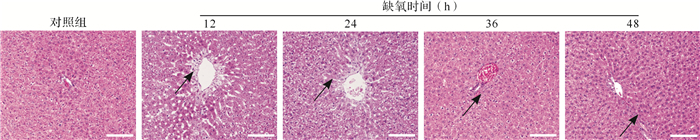
如 图 1所示, 对照组肝组织结构完整,细胞形态正常,无明显病理改变;急进高原缺氧12、24 h组肝组织中央静脉有明显水肿,细胞轻度坏死,发生核固缩;急进高原缺氧36、48 h组肝组织可见炎性浸润。结果提示,急进高原后大鼠肝组织受环境影响,产生水肿、炎性浸润等现象,导致肝组织受损。
图1.
各组大鼠肝组织病理检查结果
对照组肝组织结构完整,细胞形态正常,无明显病理改变;急进高原缺氧12、24 h组肝组织中央静脉有明显水肿,细胞轻度坏死,发生核固缩(箭头所示);急进高原缺氧36、48 h组肝组织可见炎性浸润(箭头所示).标尺=100 μm.
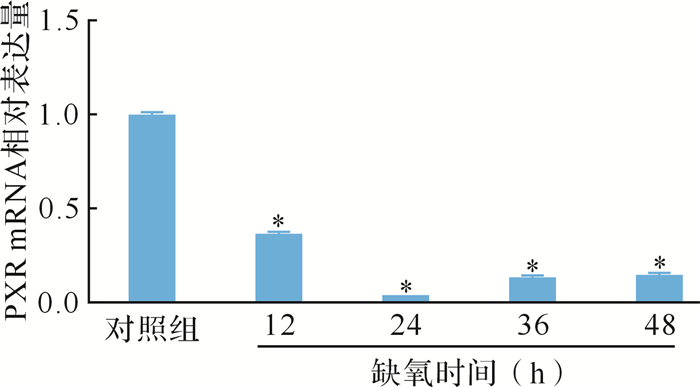
2.3 急进高原缺氧大鼠肝组织PXR mRNA水平变化
与对照组比较,急进高原缺氧大鼠肝脏内PXR的mRNA表达缺氧12 h时即下调,缺氧12、24、36、48 h分别降低了63 %、96 %、86 %、85 % (均 P < 0.05), 见 图 2。结果提示,大鼠肝组织中PXR mRNA水平急进高原缺氧后下降,可能影响相关靶基因的表达。
图2.
各组大鼠肝脏中PXR mRNA表达量比较( n=8)
与对照组比较, * P < 0.05.PXR:孕烷X受体.
2.4 急进高原缺氧大鼠肝组织PXR蛋白表达变化
与对照组比较,大鼠肝脏内PXR蛋白的表达从急进高原缺氧36 h后显著上调,缺氧36、48 h后分别上调93 %、99 % (均 P < 0.05), 见 图 3。结果提示,大鼠肝组织中PXR蛋白水平急进高原缺氧后上调,与其mRNA变化趋势相反,可能是PXR蛋白降解过程受阻,导致其沉积在细胞内,总蛋白含量升高。
图3.
各组大鼠肝脏中PXR和SUG1蛋白表达( n=8)
与对照组比较, * * P < 0.01.PXR:孕烷X受体.
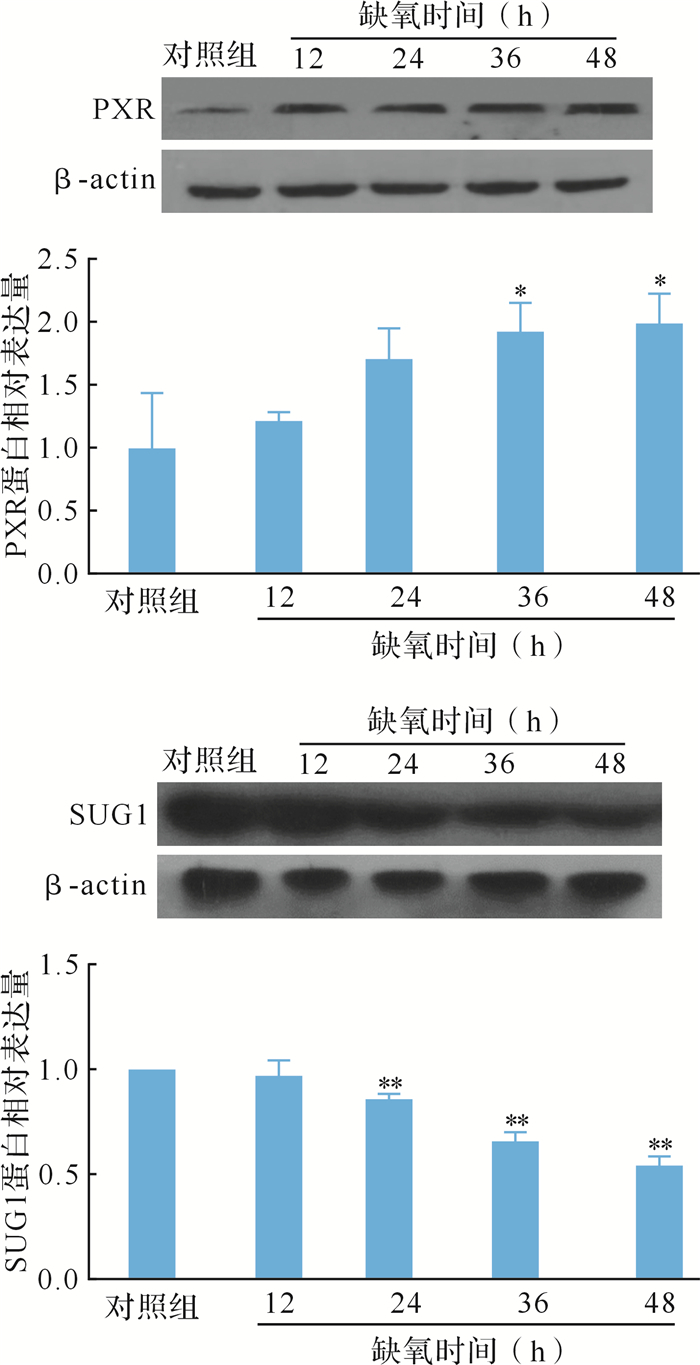
2.5 急进高原缺氧大鼠肝组织中蛋白酶SUG1表达变化
与对照组比较,大鼠肝脏内SUG1蛋白表达从急进高原缺氧24 h后显著下降,缺氧24、36、48 h后分别下降14 %、34 %、46 % (均 P < 0.01),见 图 3。结果提示,急进高原缺氧后大鼠肝脏中SUG1蛋白表达下降可能是导致PXR蛋白降解受阻从而出现蛋白沉积现象的原因。
3 讨论
缺氧作为高原环境下最具特征性的因素之一,可影响人体正常生理活动,产生一系列病理性变化,从而影响药物的体内处置过程。然而临床上高原用药的方式和剂量与平原无异,这将影响高原人群用药的安全性和有效性。药物代谢酶作为药物在体内进行生物转化的重要蛋白,在药物的解毒和转化过程中发挥重要作用。目前关于高原缺氧状态下药物代谢酶的调控机制尚不明确,因此探究相关因素对酶的调控作用非常必要。
肝脏作为人体最大的代谢器官,其完整性及正常功能对药物代谢起到重要作用,故考察肝脏在高原缺氧环境下的完整性显得尤为重要。本研究首先分析了急进高原缺氧不同时间点大鼠体内的血气指标,并且通过病理切片分析肝组织的形态变化,初步评价了高原缺氧环境下肝组织的生理变化。由血气分析结果可知,大鼠急进高原后血液酸碱度值降低,可能是由PaCO 2的升高使二氧化碳溶解在血液中形成的碳酸氢根增加导致。当酸碱度较低时,酸性药物解离变少 [ 7] ,药物以分子形式在血液中存在,药物脂溶性增加更易通过细胞膜进入细胞,使得血药浓度增加。因此,酸性药物在高原使用时血药浓度会高于平原,进一步探究酸碱度值与药物代谢的关系非常必要。SaO 2是血液中被氧结合的氧合血红蛋白(HbO 2)的容量占全部可结合的血红蛋白容量的百分比,即血液中血氧的浓度。它是呼吸循环的重要生理参数,直接影响机体各项功能。大鼠急进高原后体内血氧浓度降低,导致机体各器官可利用氧气变少,影响生理状态。病理结果显示,高原组大鼠肝细胞轻度坏死,周围血管轻微充血,核固缩,中央静脉水肿且伴有炎性浸润,导致肝脏功能可能受损,这与文献报道一致 [ 8] 。肝脏在高原中受到这些不良影响可能会使其代谢功能减缓,影响药物代谢过程中涉及的相关调控因子如核受体等的合成、表达,进而影响药物在体内的生物转化。
核受体是一种配体依赖性转录因子,与药物代谢过程中的基因表达调控密切相关。研究表明,核受体对靶基因的调控是一个先激活后结合的过程,受外界刺激后,核受体的相关配体结合位点激活从而促使核受体与细胞内RXR受体结合后进入核内,进而与靶基因的启动子区域结合调控其转录过程 [ 9] 。PXR作为药物代谢酶的重要上游调控因素之一,探究其表达变化十分有意义。有文献报道,缺氧状态下HepaRG细胞中PXR的mRNA水平存在一定程度下调 [ 10] 。本文资料显示,急进高原缺氧大鼠肝脏中PXR mRNA水平在12 h即显示下调,但其蛋白表达在36 h后明显上升,mRNA水平与蛋白表达趋势相反。有文献报道,PXR可经由蛋白酶体途径被降解,而作为蛋白酶体其中之一的组成部分SUG1与PXR蛋白降解有关 [ 6- 7] ,因此本研究进一步考察了各组大鼠肝组织中SUG1变化。结果显示,SUG1从缺氧24 h后蛋白水平即被下调,推测PXR的mRNA与蛋白水平不一致的原因可能是因为在高原缺氧环境下作为PXR降解因素之一的SUG1下调,使得PXR蛋白降解过程受阻,导致其在细胞内沉积,总蛋白含量升高。而关于PXR mRNA下降的时间点与其蛋白表达上升的时间点不一致,极大可能是因为真核基因表达的转录和翻译发生的时间和位点存在时空间隔 [ 11] 。确切原因仍需进一步实验证明。
综上,本研究考察了在高原缺氧不同时间点下大鼠肝脏PXR表达变化并初步探究了PXR mRNA与蛋白表达水平不一致的原因,为药物代谢酶在高原缺氧下调控机制的研究提供了一定的理论指导和新的思考角度。
Funding Statement
国家科技重大专项(2018ZX09J18109-001);国家自然科学基金(81673508)
References
- 1.BAHRKE M S, SHUKITT-HALE B. Effects of altitude on mood, behaviour and cognitive functioning. A review. Sports Med. 1993;16(2):97–125. doi: 10.2165/00007256-199316020-00003. [BAHRKE M S, SHUKITT-HALE B. Effects of altitude on mood, behaviour and cognitive functioning. A review[J]. Sports Med, 1993, 16(2):97-125.] [DOI] [PubMed] [Google Scholar]
- 2.BASNYAT B, HOFMEYR R, TOLKEN G, et al. Acute high-altitude illness. S Afr Med J. 2017;107(7):556–561. doi: 10.7196/SAMJ.2017.v107i7.12612. [BASNYAT B, HOFMEYR R, TOLKEN G, et al. Acute high-altitude illness[J]. S Afr Med J, 2017, 107(7):556-561.] [DOI] [PubMed] [Google Scholar]
- 3.李 向阳, 刘 永年, 袁 明, et al. 高原低氧对药物代谢酶CYP2C9和2C19活性及蛋白表达的影响. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=yxxb201202008. 药学学报. 2012;47(2):188–193. [李向阳, 刘永年, 袁明, 等.高原低氧对药物代谢酶CYP2C9和2C19活性及蛋白表达的影响[J].药学学报, 2012, 47(2):188-193.] [PubMed] [Google Scholar]
- 4.TIEN E S, NEGISHI M. Nuclear receptors CAR and PXR in the regulation of hepatic metabolism. Xenobiotica. 2006;36(10-11):1152–1163. doi: 10.1080/00498250600861827. [TIEN E S, NEGISHI M. Nuclear receptors CAR and PXR in the regulation of hepatic metabolism[J]. Xenobiotica, 2006, 36(10-11):1152-1163.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.HARMSEN S, MEIJERMAN I, BEIJNEN J H, et al. The role of nuclear receptors in pharmacokinetic drug-drug interactions in oncology. Cancer Treat Rev. 2007;33(4):369–380. doi: 10.1016/j.ctrv.2007.02.003. [HARMSEN S, MEIJERMAN I, BEIJNEN J H, et al. The role of nuclear receptors in pharmacokinetic drug-drug interactions in oncology[J]. Cancer Treat Rev, 2007, 33(4):369-380.] [DOI] [PubMed] [Google Scholar]
- 6.SMUTNY T, MANI S, PAVEK P. Post-translational and post-transcriptional modifications of pregnane X receptor (PXR) in regulation of the cytochrome P450 superfamily. Curr Drug Metab. 2013;14(10):1059–1069. doi: 10.2174/1389200214666131211153307. [SMUTNY T, MANI S, PAVEK P. Post-translational and post-transcriptional modifications of pregnane X receptor (PXR) in regulation of the cytochrome P450 superfamily[J]. Curr Drug Metab, 2013, 14(10):1059-1069.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.MASUYAMA H, INOSHITA H, HIRAMATSU Y, et al. Ligands have various potential effects on the degradation of pregnane X receptor by proteasome. Endocrinology. 2002;143(1):55–61. doi: 10.1210/endo.143.1.8578. [MASUYAMA H, INOSHITA H, HIRAMATSU Y, et al. Ligands have various potential effects on the degradation of pregnane X receptor by proteasome[J]. Endocrinology, 2002, 143(1):55-61.] [DOI] [PubMed] [Google Scholar]
- 8.荣 黎, 曾 维政, 吴 晓玲. 高原缺氧与肝脏损伤. 世界华人消化杂志. 2009;17(21):2171–2178. doi: 10.3969/j.issn.1009-3079.2009.21.010. [荣黎, 曾维政, 吴晓玲.高原缺氧与肝脏损伤[J].世界华人消化杂志, 2009, 17(21):2171-2178.] [DOI] [Google Scholar]
- 9.TOLSON A H, WANG H. Regulation of drug-metabolizing enzymes by xenobiotic receptors:PXR and CAR. Adv Drug Deliv Rev. 2010;62(13):1238–1249. doi: 10.1016/j.addr.2010.08.006. [TOLSON A H, WANG H. Regulation of drug-metabolizing enzymes by xenobiotic receptors:PXR and CAR[J]. Adv Drug Deliv Rev, 2010, 62(13):1238-1249.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.LEGENDRE C, HORI T, LOYER P, et al. Drug-metabolising enzymes are down-regulated by hypoxia in differentiated human hepatoma HepaRG cells:HIF-1alpha involvement in CYP3A4 repression. Eur J Cancer. 2009;45(16):2882–2892. doi: 10.1016/j.ejca.2009.07.010. [LEGENDRE C, HORI T, LOYER P, et al. Drug-metabolising enzymes are down-regulated by hypoxia in differentiated human hepatoma HepaRG cells:HIF-1alpha involvement in CYP3A4 repression[J]. Eur J Cancer, 2009, 45(16):2882-2892.] [DOI] [PubMed] [Google Scholar]
- 11.GRIFFIN T J, GYGI S P, IDEKER T, et al. Complementary profiling of gene expression at the transcriptome and proteome levels in Saccharomyces cerevisiae . Mol Cell Proteomics. 2002;1(4):323–333. doi: 10.1074/mcp.M200001-MCP200. [GRIFFIN T J, GYGI S P, IDEKER T, et al. Complementary profiling of gene expression at the transcriptome and proteome levels in Saccharomyces cerevisiae[J]. Mol Cell Proteomics, 2002, 1(4):323-333. ] [DOI] [PubMed] [Google Scholar]


