Abstract
目的
探讨糖皮质激素治疗对2019冠状病毒病(COVID-19)危重型患者炎症反应和临床预后的影响。
方法
回顾性分析浙江省首例COVID-19危重型患者的流行病学史、诊疗经过和患者预后。患者于入院第2天开始采用甲泼尼龙80 mg治疗,其后适时调整剂量,累计使用13 d。动态监测激素治疗前后患者淋巴细胞亚群(CD4 +T、CD8 +T、NK细胞、B细胞)和淋巴细胞因子(IL-2、IL-4、IL-6、IL-10、TNF-α、γ干扰素)变化情况。
结果
入院第1天,患者外周血CD3 +T、CD4 +T、CD8 +T、NK细胞数较正常值范围明显降低;随着病情改善,CD3 +T、CD8 +T和CD4 +T细胞数量逐渐恢复,呈线性增长趋势(线性拟合方程: Y=18.59 X+109.4, P < 0.05)。入院第2天,患者IL-6、IL-10显著高于正常值,γ干扰素处于正常高值,随后迅速降低;IL-2、IL-4、TNF-α均在正常值范围。入院第6、7天,患者IL-6、IL-10首次降至正常值范围。入院第18天,患者痰液病毒核酸检测首次阴性,粪便病毒核酸检测仍为阳性;入院第20天,患者痰液和粪便病毒核酸检测均为阴性。入院第34天,患者痊愈出院,出院时肌力评分44分,日常生活能力评分90分。
结论
缺少有效抗病毒药物的情况下,COVID-19危重型患者早期使用合适剂量的糖皮质激素能够迅速减轻炎症反应程度、改善临床症状,但这在一定程度上会减少T细胞数量,须及时调整剂量。
Abstract
Objective
To investigate the effect of corticosteroids therapy on the inflammatory response in a critically ill coronavirus disease 2019 (COVID-19) patient.
Methods
A 55-year old female patient with critical ill COVID-19 was admitted in Taizhou Hospital on January 19, 2020. The patient was treated with methylprednisolone 80 mg on the 2nd day after admission. Thereafter, the dose was adjusted in a timely manner and the therapy lasted for 13 days. The peripheral lymphocyte subsets (CD3 +T, CD4 + T, CD8 + T, NK cells, B cells), as well as serum levels of lymphocyte factors (IL-2, IL-4, IL-6, IL-10, TNF-α, IFN-γ) were dynamically monitored.
Results
On D1 of admission, the numbers of peripheral blood CD3 + T, CD4 + T, CD8 + T, and NK cells were significantly lower than the normal range. With the improvement of the disease, the numbers of CD3 + T, CD8 + T and CD4 + T cells gradually recovered and showed a linear growth trend (linear fitting equation: Y=18.59 X+109.4, P < 0.05). On D2 of admission, the patient's IL-6 and IL-10 levels were significantly higher than normal values, IFN-γ was at a normal high value, and then rapidly decreased; IL-2, IL-4, and TNF-α were all in the normal range. On the D6 and D7, the IL-6 and IL-10 decreased to the normal range for the first time. On the D18, the sputum virus nucleic acid test was negative for the first time, and the fecal virus nucleic acid test was still positive; on the D20 the sputum and fecal virus nucleic acid test were both negative. On D34, the patient recovered and was discharged. At the discharge the muscle strength score of the patient was 44 and the daily life ability evaluation was 90.
Conclusion
In the absence of effective antiviral drugs, early use of appropriate doses of corticosteroids in critically ill patient with COVID-19 can quickly alleviate inflammatory response and improve clinical symptoms, however, it may reduce the number of T cells, and to adjust the dose in time is necessary.
Keywords: Coronavirus disease 2019, Severe acute respiratory syndrome coronavirus 2, Novel coronavirus pneumonia, Glucocorticoids, Critical illness, Inflammatory factor
严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)是2019冠状病毒病(coronavirus disease 2019,COVID-19)的致病病毒。截至2020年2月22日,我国COVID-19患者实验室确诊76 392例,死亡2348例,病死率达3.07 %,其中危重型患者的病死率达61.5 % [ 1- 2] 。目前,COVID-19还没有特效的治疗方法,以支持治疗为主,糖皮质激素通过抑制包含单核和巨噬细胞在内的细胞炎性细胞因子的合成和分泌来减轻炎症反应。COVID-19患者肺部病理组织学改变包括肺泡透明膜形成、单核巨噬细胞浸润和肺间质水肿,我国指南推荐糖皮质激素可用于氧合指数进行性恶化、影像学进展迅速、机体炎症反应过度激活等情况,但是临床应用尚有争议 [ 3- 4] 。2020年1月19日,浙江大学台州医院在诊治浙江省首例危重型COVID-19患者中采用了糖皮质激素治疗,患者最终痊愈出院。本文回顾性分析其诊疗经过,重点分析糖皮质激素对患者炎症反应的影响。本研究经浙江省台州医院医学伦理委员会审批通过(K20200111)。
1 患者诊治经过
患者女性,55岁,从事家政行业。身高155 cm,体质量65 kg,既往有2型糖尿病病史。发病前2周内患者本人无湖北旅游史和野生动物接触史,有疑似“感冒”患者接触史;与患者密切接触者中有5人最终确诊为COVID-19。2020年1月9日,患者出现阵发性干咳,伴发热,体温波动在38.0 ℃左右,温州当地诊所诊断为上呼吸道感染,给予“感冒灵”对症治疗。2020年1月16日症状加重,体温39.6 ℃,同时出现痰中带血,伴腹泻,当地卫生院就诊,胸部CT检查提示“两肺感染”,诊断“肺部感染”,给予头孢噻肟抗感染,症状未见明显好转。2020年1月19日以“重症病毒性肺炎”收入台州医院ICU负压病房。入院后测体温36.8 ℃,脉搏95次/min,呼吸20次/min,血压143/94 mmHg(1 mmHg=0.133 kPa),血氧饱和度(SPO 2)93 % (吸氧浓度60 %),意识清,精神软,双肺呼吸音粗,两肺可及广泛湿性啰音。血常规检查:白细胞计数6.9×10 9/L,中性粒细胞百分比92.5 %,淋巴细胞百分比5.4 %,淋巴细胞绝对值0.4×10 9/L。胸部CT检查提示两肺多发磨玻璃样改变,病灶靠近胸膜( 图 1A)。给予高流量氧疗,予奥司他韦胶囊口服,哌拉西林/他唑巴坦抗感染治疗,并送呼吸道样本检测:呼吸道合胞病毒、副流感病毒、腺病毒、H1N1/H3N2、H7N9、肺炎支原体、肺炎衣原体均阴性。1月20日(入院第2天)患者体温38.5 ℃,呼吸急促,38次/min,吸氧浓度上调至90 %,血气分析提示动脉血氧饱和度(SaO 2)94 %,血氧分压(PaO 2)62 mmHg,氧合指数(PaO 2/FiO 2)69 mmHg,立即行气管插管、机械通气,压力控制(PC)模式:PC 20 cmH 2O(1 cmH 2O=0.098 kPa)、呼气末正压(PEEP)14 cmH 2O、吸入氧浓度(FiO 2)90 %。插管后予甲泼尼龙40 mg,1次/12 h静脉滴注,肺保护性通气、去甲肾上腺素维持血压及限制性补液等治疗,并动态监测外周血T细胞亚群、IL-6、IL-10等炎症细胞因子。具体用药见 表 1。1月21日胸片示两肺弥漫性渗出( 图 1B)。1月22日(入院第4天)患者体温降至37 ℃,C反应蛋白由入院时的188.6 ng/mL降至66.3 ng/mL,下呼吸道分泌物SARS-COV-2核酸阳性,诊断为“COVID-19危重型、急性呼吸窘迫综合征、脓毒症休克、2型糖尿病”。实验室检查结果见 表 2。1月24日(入院第6天)早上暂停激素,体温升至38.3 ℃,当天下午临时加用40 mg甲泼尼龙一次。1月25日复查C反应蛋白升高至208 ng/mL,下午临时加用40 mg甲泼尼龙一次。1月25日胸片示渗出减少( 图 1C)。1月26日(入院第8天)重新给予甲泼尼龙40 mg,1次/d,氧合指数逐渐改善,乳酸趋于正常,之后激素用量逐渐减少。2月2日(入院第15天)停用甲泼尼龙,疗程13 d,累计480 mg。2月3日(入院第16天)拔除气管插管,改高流量吸氧。2月5日(入院第18天)患者痰液病毒核酸检测首次阴性,粪便病毒核酸仍检测均阳性;2月7日(入院第20天,病程第29天)患者痰液和粪便病毒核酸均阴性。患者住院期间咽拭子、血液、尿液、球结膜分泌物SARS-CoV-2核酸检测均阴性。2月7日(入院第20天)复查胸部CT提示两肺纤维化病灶,渗出明显减少( 图 1D)。2月21日(入院第34天),患者痊愈出院,出院时肌力评分(medical research council score)44分,日常生活能力评分(barthel index)90分。
图1.
本例2019冠状病毒病危重型患者胸部CT影像学表现动态变化
A:1月19日两肺多发靠近胸膜的磨玻璃样改变;B:1月21日两肺弥漫性渗出;C:1月25日两肺渗出明显减轻;D:2月7日两肺渗出病灶基本消失,可见纤维化病灶.
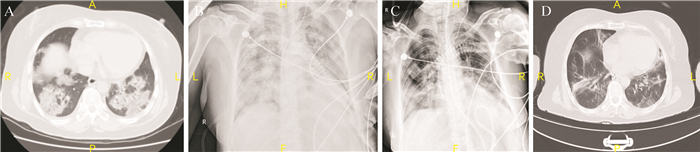
表1 本例2019冠状病毒病危重型患者用药情况(2020年1月19日至2月2日)
Table 1 Clinical drug use of this critical ill COVID-19 patient (January 19 to February 2, 2020)
|
项目 |
1月19日(D1) |
1月20日(D2) |
1月21日(D3) |
1月22日(D4) |
1月23日(D5) |
1月24日(D6) |
1月25日(D7) |
1月26日(D8) |
1月27日(D9) |
1月28日(D10) |
1月29日(D11) |
1月30日(D12) |
1月31日(D13) |
2月1日(D14) |
2月2日(D15) |
|
体温(℃) |
39.6 |
38.5 |
37.5 |
37 |
37.5 |
38.3 |
36.5 |
36.5 |
36.8 |
37.2 |
37.2 |
37.1 |
37.0 |
37.1 |
37.3 |
|
液体平衡(mL/24 h) |
— |
530 |
1370 |
180 |
545 |
-450 |
-565 |
-60 |
-500 |
110 |
70 |
30 |
70 |
10 |
15 |
|
抗菌药物 |
|||||||||||||||
|
抗病毒药物 |
|||||||||||||||
|
免疫调节剂 |
|||||||||||||||
|
血管活性药物 |
D:用药天数.
表2 本例2019冠状病毒病危重型患者实验室检查结果(2020年1月19日至2月2日)
Table 2 Laboratory examination of this critical ill COVID-19 patient (January 19 to February 2, 2020)
|
检测指标 |
正常值范围 |
1月19日(D1) |
1月20日(D2) |
1月22日(D4) |
1月23日(D5) |
1月24日(D6) |
1月25日(D7) |
1月26日(D8) |
1月27日(D9) |
1月29日(D11) |
1月31日(D13) |
2月1日(D14) |
2月2日(D15) |
|
白细胞计数(×10 9/L) |
3.5~9.5 |
6.9 |
8.4 |
7.1 |
9.2 |
5.6 |
2.4 |
5.2 |
6.6 |
14.9 |
16.3 |
17.1 |
17.2 |
|
中性粒细胞比例(%) |
40.0~75.0 |
92.5 |
92.3 |
87.2 |
89.2 |
85.7 |
82.3 |
89.4 |
87.5 |
86.9 |
91.2 |
87.0 |
83.8 |
|
淋巴细胞比例(%) |
20.0~50.0 |
5.4 |
6.3 |
8.5 |
8.0 |
11.0 |
12.6 |
5.7 |
5.0 |
6.0 |
5.0 |
3.6 |
6.2 |
|
淋巴细胞绝对值(×10 9/L) |
1.1~3.2 |
0.4 |
0.5 |
0.6 |
0.7 |
0.6 |
0.3 |
0.3 |
0.3 |
0.9 |
0.8 |
0.6 |
1.1 |
|
血红蛋白(g/L) |
115~156 |
123 |
129 |
111 |
107 |
102 |
99 |
92 |
99 |
102 |
105 |
104 |
110 |
|
血小板计数(×10 9/L) |
125~350 |
125 |
156 |
157 |
177 |
149 |
150 |
189 |
242 |
340 |
363 |
356 |
351 |
|
肌酐(μmol/L) |
45~84 |
58 |
62 |
— |
57 |
63 |
54 |
43 |
47 |
44 |
46 |
50 |
45 |
|
天冬氨酸转氨酶(U/L) |
15~40 |
56 |
64 |
— |
31 |
— |
50 |
31 |
21 |
29 |
37 |
36 |
20 |
|
总胆红素(mmol/L) |
3.4~20.5 |
6.1 |
5.9 |
— |
6.1 |
— |
9.3 |
10.6 |
11.5 |
11.3 |
15.7 |
— |
17.9 |
|
乳酸脱氢酶E(U/L) |
100~198 |
529 |
794 |
— |
653 |
— |
452 |
398 |
320 |
202 |
121 |
— |
— |
|
血糖(mmol/L) |
3.89~5.83 |
10.7 |
7.4 |
8.9 |
12.5 |
10.0 |
13.7 |
12.0 |
11.7 |
10.5 |
9.7 |
9.4 |
8.4 |
|
肌红蛋白(U/L) |
<106 |
29.5 |
— |
— |
138.5 |
— |
123.0 |
125.6 |
102.0 |
76.0 |
— |
— |
— |
|
D-二聚体(mg/L) |
0.00~0.50 |
2.05 |
2.98 |
— |
2.63 |
2.61 |
2.61 |
2.88 |
2.15 |
2.01 |
1.88 |
— |
2.47 |
|
凝血酶原时间(s) |
11.0~14.5 |
13.6 |
13.0 |
— |
13.6 |
14.0 |
12.0 |
13.9 |
12.0 |
13.7 |
13.0 |
13.0 |
13.0 |
|
活化部分凝血活酶时间(s) |
28.0~42.0 |
45.3 |
39.8 |
— |
28.8 |
32.0 |
29.2 |
29.0 |
28.3 |
31.2 |
28.9 |
26.0 |
25.8 |
|
降钙素原(ng/mL) |
<0.05 |
0.39 |
0.39 |
— |
0.19 |
0.33 |
0.23 |
0.11 |
0.07 |
0.06 |
0.09 |
0.05 |
0.06 |
|
C反应蛋白(mg/L) |
<8.0 |
188.6 |
185.0 |
66.3 |
23.7 |
89.2 |
208.0 |
76.8 |
32.8 |
3.4 |
11.3 |
10.9 |
8.2 |
|
酸碱度 |
7.35~7.45 |
7.44 |
7.45 |
7.43 |
7.46 |
7.47 |
7.43 |
7.44 |
7.47 |
7.44 |
7.48 |
7.43 |
7.49 |
|
二氧化碳分压(mmHg) |
35~45 |
33 |
32 |
38 |
43 |
42 |
54 |
47 |
46 |
42 |
42 |
48 |
46 |
|
氧分压(mmHg) |
83~108 |
80 |
62 |
91 |
57 |
82 |
78 |
123 |
81 |
97 |
111 |
114 |
142 |
|
血氧饱和度(%) |
93~98 |
97 |
94 |
98 |
93 |
97 |
97 |
99 |
98 |
98 |
99 |
99 |
99 |
|
碳酸氢根浓度(mmol/L) |
22.0~26.0 |
23.5 |
26.0 |
25.6 |
29.8 |
29.9 |
33.9 |
30.7 |
32.6 |
27.5 |
30.9 |
30.2 |
33.7 |
|
碱剩余(mmol/L) |
-3.0~+3.0 |
-1.6 |
-3.2 |
-3.2 |
6.2 |
6.1 |
10.5 |
7.1 |
8.8 |
3.5 |
7.1 |
6.8 |
10.4 |
|
乳酸(mmol/L) |
0.5~1.6 |
1.0 |
3.2 |
1.8 |
2.9 |
2.5 |
1.6 |
2.1 |
1.8 |
1.2 |
1.3 |
2.2 |
1.3 |
|
吸氧浓度 |
— |
0.60 |
0.90 |
0.55 |
0.60 |
0.55 |
0.55 |
0.60 |
0.45 |
0.40 |
0.40 |
0.40 |
0.40 |
|
氧合指数(mmHg) |
— |
133 |
69 |
165 |
95 |
149 |
142 |
205 |
180 |
243 |
278 |
285 |
355 |
D:用药天数;1 mmHg=0.133 kPa; “—”无数据.
激素使用过程中,患者血糖出现波动,1月20日激素使用前血糖(均值)7.4 mmol/L,1月21日升高至11.8 mmol/L,1月25日最高值达13.7 mmol/L,激素减量后降至8.4 mmol/L。
2 患者炎症指标动态检测及结果
2.1 患者淋巴细胞亚群动态检测及结果
将采集到的外周静脉血(早上10:00,糖皮质激素使用后)用流式细胞仪(BD FACSCanto TM,美国BD公司)按照说明书进行荧光抗体标记检测,采用美国BD MultiTEST IMK试剂盒检测。
1月19日(入院第1天)患者外周血CD3 +T、CD4 +T、CD8 +T细胞数较正常值明显减少;随着病情改善,CD3 +T、CD8 +T和CD4 +T细胞数量逐渐恢复,呈线性增长趋势(线性拟合方程: Y=18.59 X+109.4, P<0.05),趋势曲线波动与激素使用有关( 图 2、 表 3)。
图2.
本例2019冠状病毒病危重型患者外周血CD4 + T细胞数量动态变化
GraphPad Prism8统计软件线性拟合分析, Y=18.59 X+109.4, P<0.05;MP:甲泼尼龙.
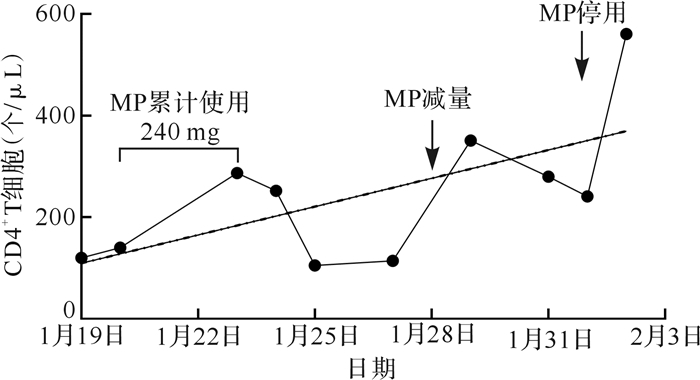
表3 本例2019冠状病毒病危重型患者淋巴细胞亚群和淋巴细胞因子动态检测结果(2020年1月19日至2月2日)
Table 3 Dynamic changes of lymphocyte subsets and lymphokines of this critical ill COVID-19 patient (January 19 to February 2, 2020)
|
检测指标 |
正常值范围 |
1月19日(D1) |
1月20日(D2) |
1月23日(D5) |
1月24日(D6) |
1月25日(D7) |
1月27日(D9) |
1月29日(D11) |
1月31日(D13) |
2月1日(D14) |
2月2日(D15) |
|
CD3 +T(个/μL) |
770~2041 |
192 |
230 |
476 |
324 |
192 |
210 |
585 |
512 |
486 |
869 |
|
CD4 +T(个/μL) |
414~1123 |
120 |
140 |
287 |
252 |
105 |
114 |
351 |
280 |
246 |
561 |
|
CD8 +T(个/μL) |
238~874 |
68 |
70 |
210 |
78 |
90 |
96 |
207 |
208 |
234 |
308 |
|
CD4/CD8 |
0.7~2.5 |
1.76 |
2.00 |
1.37 |
3.23 |
1.17 |
1.19 |
1.70 |
1.76 |
1.05 |
1.82 |
|
B细胞(个/μL) |
90~560 |
100 |
— |
81 |
— |
81 |
51 |
180 |
112 |
187 |
165 |
|
NK细胞(个/μL) |
150~1100 |
80 |
— |
18 |
— |
24 |
27 |
126 |
40 |
66 |
44 |
|
IL-2(pg/mL) |
1.1~9.8 |
— |
2.34 |
1.94 |
2.34 |
1.80 |
1.99 |
2.05 |
2.28 |
2.25 |
2.25 |
|
IL-4(pg/mL) |
0.1~3.0 |
— |
2.36 |
2.24 |
2.17 |
1.99 |
2.05 |
1.81 |
2.24 |
2.05 |
2.24 |
|
IL-6(pg/mL) |
1.7~16.6 |
— |
251.80 |
141.26 |
57.06 |
10.20 |
5.15 |
17.58 |
9.04 |
7.49 |
18.00 |
|
IL-10(pg/mL) |
2.6~4.9 |
— |
39.53 |
12.20 |
15.84 |
6.90 |
4.87 |
7.84 |
3.66 |
4.06 |
5.04 |
|
TNF-α(pg/mL) |
0.1~5.2 |
— |
2.27 |
1.34 |
2.54 |
1.98 |
1.69 |
2.12 |
1.69 |
1.98 |
2.02 |
|
γ干扰素(pg/mL) |
1.6~17.3 |
— |
13.55 |
3.77 |
2.61 |
2.38 |
2.66 |
2.66 |
3.43 |
3.77 |
2.66 |
D:用药天数;“—”无数据.
1月19日(入院第1天)患者外周血NK细胞数较正常值减少,随着病情改善NK细胞数量逐渐恢复;外周血B细胞入院第1天正常范围,之后降低,随着病情改善,B细胞数逐渐恢复。
2.2 患者淋巴细胞因子动态检测及结果
将采集到的外周静脉血(早上10 :00,糖皮质激素使用后)分离血浆,采用人Th1/Th2亚群检测试剂盒(杭州塞基生物科技有限公司)进行检测。
1月20日(入院第2天),患者IL-6、IL-10高于正常值,γ干扰素处于正常高值,随后迅速降低;IL-2、IL-4、TNF-α均在正常值范围。1月24、25日(入院第6、7天),患者IL-6、IL-10首次降至正常值范围( 图 3, 表 3)。
图3.
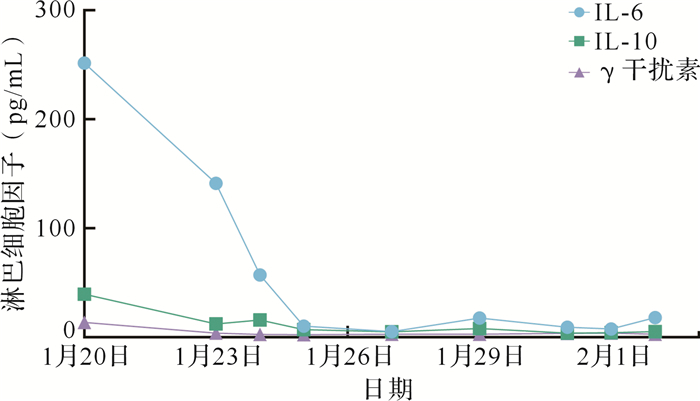
本例2019冠状病毒病危重型患者外周血IL-6、IL-10、γ干扰素水平动态变化
3 讨论
COVID-19患者尸体解剖以及外周血流式细胞检测发现肺部存在弥漫性肺泡损伤,肺组织有透明膜形成以及T细胞过度激活 [ 5] ,IL-6、IL-10等细胞因子升高已经被证实 [ 6] 。因此,SARS-CoV-2的致病机制可能与MERS-CoV和SARS-CoV一样,除了与病毒快速复制有关,还与大量炎性细胞浸润和促炎性细胞因子/趋化因子应答升高引起的细胞因子风暴有关 [ 7- 9] 。有效抗病毒和降低炎症因子风暴带来损害是治疗的目标。尽管洛匹那韦/利托那韦、α干扰素目前被用于COVID-19患者的抗病毒治疗,但是目前没有来自随机对照研究的证据支持其有效性。糖皮质激素可抑制多种免疫细胞,因此能非常有效地控制炎症和自身免疫性疾病的许多急性表现。动物实验发现,糖皮质激素可降低血清及支气管肺泡灌洗液中IL-6、IL-10、TGF-β1水平从而有效减轻SARS-CoV N蛋白所致的肺部炎症反应 [ 10] 。早期使用激素能够减少急性呼吸窘迫综合征患者中性粒细胞、单核细胞,淋巴细胞的肺内迁移从而降低炎症反应 [ 11] 。上述作用主要与糖皮质激素-反应元件有关。本例患者入院时IL-6、IL-10水平超过正常上限数倍,γ干扰素虽然在正常范围但有所升高,其后随着病情改善,胸片渗出减少,C反应蛋白、IL-6、IL-10水平快速下降。除与氧疗、保护性肺通气治疗有关外,很可能与糖皮质激素有关。首先,我们观察到糖皮质激素使用后体温、C反应蛋白、IL-6、IL-10水平快速降低;1月24日暂停使用糖皮质激素后C反应蛋白由23.7 mg/L重新升高至208 mg/L,重新使用糖皮质激素后又降低。其次,患者外周血CD4 +T细胞数和白细胞数在治疗过程中的波动也提示与糖皮质激素相关。此外,在洛匹那韦/利托那韦和α干扰素等抗病毒药物使用前,患者CD4 +T细胞数已经开始升高且炎症指标已经下降,可能与糖皮质激素的使用有关。
尽管如此,糖皮质激素仍是把双刃剑。Russell等 [ 12] 认为,糖皮质激素虽然可以抑制肺部炎症,但也会抑制免疫反应和免疫系统对于病毒的清除作用。本例患者入院时淋巴细胞绝对值和CD4 +T、CD8 +T细胞数量降低可能与SARS-CoV-2感染有关。随着病情好转,患者外周血CD4 +和CD8 +T细胞数都有所升高,糖皮质激素在减轻炎症的同时,随后几日一定程度上减少CD4 +T细胞数量,随着剂量的调整CD4 +T数量随之波动。CD8 +T细胞有类似的表现。糖皮质激素可能是通过促使T淋巴细胞迁移出循环系统、抑制淋巴组织释放T细胞的能力、诱导细胞凋亡等减少CD4 +、CD8 +T细胞数量。我们也观察到停用激素后,CD4 +T数量快速增加,而且激素的使用也没有抑制CD4 +T数量增加的趋势。IL-6、IL-10并没有出现与CD4 +T、CD8 +T类似的波动可能由于IL-6、IL-10并非单纯由T细胞分泌缘故。过早停用糖皮质激素可能引起C反应蛋白等炎症指标升高,也有研究表明过早停用糖皮质激素与不良的临床预后相关 [ 13] 。本例患者使用甲泼尼龙80 mg/d,2 d,然后逐级降至40、20、10 mg能够快速控制炎症,但是存在T淋巴细胞数量降低导致感染的风险,及时停用激素有助于T淋巴细胞数量恢复。本研究通过监测患者治疗过程中血糖的变化发现,激素减量后血糖似乎更加平稳。出院时肌力评分44分,日常生活能力评分90分,表明患者日常生活能够基本自理。本例患者经过18 d下呼吸道SARS-CoV-2 RNA清除,经过20 d粪便SARS-CoV-2 RNA清除,因为缺少对照数据,激素的使用是否延长患者SARS-CoV-2 RNA排出时间不能确定。
本文一例患者治疗经验提示,在缺少有效抗病毒药物的情况下,COVID-19危重型患者早期使用合适剂量的糖皮质激素能够迅速降低炎症反应程度、改善临床症状,疗程中须警惕糖皮质激素导致的T细胞数量减少,一旦发现及时减量或停用激素。
Funding Statement
浙江省医药卫生科技计划(2017KY163)
References
- 1.World Health Organization. Coronavirus disease (COVID-2019) situation reports[EB/OL].[2020-02-22]. .
- 2.YANG X, YU Y, XU J, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med. 2020 doi: 10.1016/S2213-2600(20)30079-5. [YANG X, YU Y, XU J, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study[J]. Lancet Respir Med, 2020. DOI:10.1016/S2213-2600(20)30079-5.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.中华人民共和国国家卫生健康委员会办公厅, 国家中医药管理局办公室.新型冠状病毒感染的肺炎诊疗方案(试行第六版)[A/OL].国卫办医函〔2020〕145号.(2020-02-18)[2020-02-28]..http://www.nhc.gov.cn/yzygj/s7653p/202002/8334a8326dd94d329df351d7da8aefc2.shtml
- 4.RUSSELL C D, MILLAR J E, BAILLIE J K. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury. Lancet. 2020;395(10223):473–475. doi: 10.1016/S0140-6736(20)30317-2. [RUSSELL C D, MILLAR J E, BAILLIE J K. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury[J]. Lancet, 2020, 395(10223):473-475. DOI:10.1016/S0140-6736(20)30317-2.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.XU Z, SHI L, WANG Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med. 2020 doi: 10.1016/S2213-2600(20)30076-X. [XU Z, SHI L, WANG Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome[J]. Lancet Respir Med, 2020. DOI:10.1016/S2213-2600(20)30076-X.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.HUANG C, WANG Y, LI X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497–506. doi: 10.1016/S0140-6736(20)30183-5. [HUANG C, WANG Y, LI X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395(10223):497-506. DOI:10.1016/S0140-6736(20)30183-5.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.CHANNAPPANAVAR R, PERLMAN S. Pathogenic human coronavirus infections: causes and consequences of cytokine storm and immunopathology. Semin Immunopathol. 2017;39(5):529–539. doi: 10.1007/s00281-017-0629-x. [CHANNAPPANAVAR R, PERLMAN S. Pathogenic human coronavirus infections: causes and consequences of cytokine storm and immunopathology[J]. Semin Immunopathol, 2017, 39(5):529-539. DOI:10.1007/s00281-017-0629-x.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.WONG C K, LAM C W, WU A K, et al. Plasma inflammatory cytokines and chemokines in severe acute respiratory syndrome. Clin Exp Immunol. 2004;136(1):95–103. doi: 10.1111/j.1365-2249.2004.02415.x. [WONG C K, LAM C W, WU A K, et al. Plasma inflammatory cytokines and chemokines in severe acute respiratory syndrome[J]. Clin Exp Immunol, 2004, 136(1):95-103. DOI:10.1111/j.1365-2249.2004.02415.x.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.MAHALLAWI W H, KHABOUR O F, ZHANG Q, et al. MERS-CoV infection in humans is associated with a pro-inflammatory Th1 and Th17 cytokine profile. Cytokine. 2018;104:8–13. doi: 10.1016/j.cyto.2018.01.025. [MAHALLAWI W H, KHABOUR O F, ZHANG Q, et al. MERS-CoV infection in humans is associated with a pro-inflammatory Th1 and Th17 cytokine profile[J]. Cytokine, 2018, 104:8-13. DOI:10.1016/j.cyto.2018.01.025.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.郝 东, 何 礼贤, 瞿 介明, et al. SARS冠状病毒N蛋白致大鼠肺部炎症及糖皮质激素对其的作用. 中华内科杂志. 2005;44(12):890–893. doi: 10.3760/j.issn:0578-1426.2005.12.004. [郝东, 何礼贤, 瞿介明, 等.SARS冠状病毒N蛋白致大鼠肺部炎症及糖皮质激素对其的作用[J].中华内科杂志, 2005, 44(12):890-893.] [DOI] [PubMed] [Google Scholar]
- 11.BURNHAM E L, JANSSEN W J, RICHES D W, et al. The fibroproliferative response in acute respiratory distress syndrome: mechanisms and clinical significance. Eur Respir J. 2014;43(1):276–285. doi: 10.1183/09031936.00196412. [BURNHAM E L, JANSSEN W J, RICHES D W, et al. The fibroproliferative response in acute respiratory distress syndrome: mechanisms and clinical significance[J]. Eur Respir J, 2014, 43(1):276-285. DOI:10.1183/09031936.00196412.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.RUSSELL C D, MILLAR J E, BAILLIE J K. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury. Lancet. 2020;395(10223):473–475. doi: 10.1016/S0140-6736(20)30317-2. [RUSSELL C D, MILLAR J E, BAILLIE J K. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury[J]. Lancet, 2020, 395(10223):473-475. DOI:10.1016/S0140-6736(20)30317-2.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.MEDURI G U, BRIDGES L, SHIH M C, et al. Prolonged glucocorticoid treatment is associated with improved ARDS outcomes: analysis of individual patients' data from four randomized trials and trial-level meta-analysis of the updated literature. Intensive Care Med. 2016;42(5):829–840. doi: 10.1007/s00134-015-4095-4. [MEDURI G U, BRIDGES L, SHIH M C, et al. Prolonged glucocorticoid treatment is associated with improved ARDS outcomes: analysis of individual patients' data from four randomized trials and trial-level meta-analysis of the updated literature[J]. Intensive Care Med, 2016, 42(5):829-840. DOI:10.1007/s00134-015-4095-4.] [DOI] [PubMed] [Google Scholar]


