Abstract
目的
观察大剂量维生素C对乳腺癌细胞增殖及荷瘤小鼠肿瘤生长的影响,并探索其中的机制。
方法
以乳腺癌细胞Bcap37和MDA-MB-453为体外研究对象,分别给予小(0.01 mmol/L)、中(0.10 mmol/L)、大(2.00 mmol/L)剂量的维生素C。采用CCK-8试剂盒检测细胞增殖;蛋白质印迹法检测葡萄糖转运蛋白1(Glut1)和哺乳动物雷帕霉素靶蛋白(mTOR)信号通路相关蛋白表达;乳酸脱氢酶比色法测定乳酸含量。同时,取10只6周龄雌性BALB/c裸鼠,采用皮下接种乳腺癌Bcap37细胞建立荷瘤小鼠移植瘤模型,取5只小鼠腹腔注射维生素C(4 g/kg),观察肿瘤重量和小鼠体质量的变化。
结果
体外细胞学实验结果显示,与空白对照组比较,大剂量维生素C作用下Bcap37和MDA-MB-453细胞增殖受到抑制(均 P < 0.01),Glut1转运蛋白表达减少(均 P < 0.05),乳酸分泌量减少(均 P < 0.01),mTOR信号通路相关蛋白表达水平下调(均 P < 0.05)。体内实验结果显示,与对照组比较,大剂量维生素C组肿瘤重量明显减小( P < 0.05),但体质量增长无明显变化。
结论
大剂量维生素C可抑制乳腺癌细胞增殖,这一效果可能与大剂量维生素C抑制乳腺癌细胞能量摄取和下调mTOR信号通路有关。
Abstract
Objective
To investigate the effects of high dose vitamin C (VC) on proliferation of breast cancer cells and to explore its mechanisms.
Methods
Human breast cancer cells Bcap37 and MDA-MB-453 were treated with VC at low dose (0.01 mmol/L), medium dose (0.10 mmol/L) and high dose (2.00 mmol/L). Cell proliferation was determined with CCK-8 assay, protein expression was evaluated by Western blot, and the secretion of lactic acid in tumor cells was detected by colorimetric method. Bcap37 cells were inoculated in nude mice, and tumor baring nude mice were intraperitoneally injected with high VC(4 g/kg, VC group, n=5)or normal saline (control group, n=5) for 24 d. Tumor weight and body weight were calculated.
Results
In vitro experiments demonstrated that high dose VC significantly inhibited cell proliferation in Bcap37 and MDA-MB-453 cells (all P < 0.01); the expressions of Glut1 and mTOR signaling pathway-related proteins were decreased (all P < 0.05); and the secretion of lactic acid was also markedly reduced (all P < 0.05). In vivo experiment showed that the tumor weight was decreased in mice treated with high-dose VC as compared with control group ( P < 0.05), but no difference in body weights between two groups was observed.
Conclusion
High dose VC may inhibit proliferation of breast cancer cells both in vitro and in vivo through reducing glycolysis and protein synthesis.
Keywords: Breast neoplasms/physiopathology, Ascorbic acid/administration & dosage, Glucose transporter type 1/metabolism, Protein-serine-threonine kinases/biosynthesis, Signal transduction, Lactic acid/metabolism, Cell proliferation
近年来我国肿瘤的发生率和病死率呈上升趋势,2015年我国新增肿瘤患者400多万例,因肿瘤死亡患者近300万例。在我国,乳腺癌的发病占所有恶性肿瘤的26.86%,位居女性恶性肿瘤的首位 [ 1- 2] 。目前,随着社会、经济、自然环境等诸多因素的变化,乳腺癌的发病率在全球范围内迅速增加,仅10年时间总发病率提高了近10倍 [ 3] 。
维生素C是一种水溶性维生素,人类自身不能合成,需要通过水果和蔬菜等食物补充。早在十六世纪,人类就有通过补充维生素C预防坏血病的经验 [ 4] 。近年研究表明,维生素C在治疗乳腺癌、前列腺癌、皮肤癌等多种肿瘤上具有很大的潜力,患者静脉注射维生素C 7.5~50.0 g,前列腺特异性抗原、癌胚抗原等肿瘤标志物和炎症因子表达水平下降 [ 5] 。但是,目前关于维生素C对肿瘤的治疗作用,特别是大剂量维生素C治疗肿瘤的具体给药剂量及改善患者症状的机制尚未明确。
细胞代谢发生改变是肿瘤细胞在肿瘤发生过程中的特征之一 [ 6] 。肿瘤细胞糖酵解活动增强 [ 7] , 葡萄糖消耗增加、糖酵解活性增加及乳酸的积累构成了肿瘤细胞的基本特征 [ 8] 。葡萄糖转运蛋白1(glucose transporter 1,Glut1)是负责转运氧化型维生素C和葡萄糖的重要转运蛋白,在乳腺癌、肝癌、非小细胞肺癌等多种肿瘤组织中均观察到Glut1表达水平增加,其表达量也成为肿瘤的重要预后指标 [ 9] 。另外,肿瘤的发生和发展过程中常常伴随哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路激活 [ 10] 。mTOR作为一种丝氨酸/苏氨酸激酶,具有调控蛋白质合成的作用, 并参与多种生理过程(如细胞生长、增殖和修复等) [ 11- 13] 。
本研究通过检测相关蛋白质表达量和乳酸含量, 从糖酵解和mTOR信号通路两个方面探讨不同剂量维生素C对乳腺癌细胞Bcap37和MDA-MB-453的影响。
1 材料与方法
1.1 细胞、动物与试剂
人乳腺癌细胞Bcap37和MDA-MB-453来自浙江大学医学院肿瘤研究所。6周龄雌性BALB/c裸鼠购自上海斯莱克实验动物有限公司,动物许可证号为SCXK(沪)2012-0002。按照浙江大学医学院动物实验室管理规范进行实验。动物的饲养条件为温度25 ℃,湿度50%~60%,昼、夜各12 h,自由进食和饮水。
维生素C为美国Sigma公司产品,使用前用RPMI 1640培养基(美国Hyclone公司)溶解并使用10 mol/L氢氧化钠溶液调节酸碱度至7。Glut1兔单克隆抗体、血小板型磷酸果糖激酶(phosphofructokinase-platelet,PFKP)兔单克隆抗体、mTOR抗体、p70 S6激酶(S6K)抗体、S6核糖体蛋白兔单克隆抗体、磷酸化mTOR抗体、磷酸化p70 S6K抗体、磷酸化S6核糖体蛋白抗体和内参抗体GAPDH为美国Cell Signaling Technology公司产品;乳酸试剂盒为南京建成生物工程研究所有限公司产品。
1.2 细胞培养
Bcap37和MDA-MB-453细胞用含10%FBS、1%青/链霉素的RPMI 1640培养基培养。将细胞置于37 ℃、含5%二氧化碳的恒温孵箱中,待细胞融合至80%~90%时使用胰蛋白酶消化传代。
1.3 CCK8试剂盒检测细胞增殖
取生长状态良好的Bcap37和MDA-MB-453细胞,收集细胞悬液,调整至1×10 4个/mL,接种于96孔板中,每孔100 μL,加入小(0.01 mmol/L)、中(0.10 mmol/L)、大(2.00 mmol/L)剂量的维生素C,隔天换液,连续给药6 d,未经维生素C处理的细胞作为空白对照。检测肿瘤细胞培养液在第0、2、4、6天时的吸光度值。具体操作:去原培养基,每孔加入100 μL新鲜培养基,并加入CCK8溶液(10 μL/孔),放置孵箱中继续培养1 h,然后在450 nm处读取吸光度值,并绘制生长曲线。
1.4 蛋白质印迹法检测Glut1和mTOR信号通路相关蛋白表达
将生长状态良好的Bcap37细胞和MDA-MB-453细胞接种到6孔板中,贴壁后给予小(0.01 mmol/L)、中(0.10 mmol/L)、大(2.00 mmol/L)剂量的维生素C作用24 h,未经维生素C处理的细胞作为空白对照。使用蛋白裂解液收集总蛋白,BCA蛋白浓度检测试剂盒测定其蛋白浓度,调整总蛋白上样量为50 μg,经10%SDS-PAGE后将蛋白转移至硝酸纤维素膜。将膜用5%脱脂牛奶封闭1 h后加入Glut1、PFKP、磷酸化mTOR、磷酸化S6K、磷酸化S6、mTOR、S6K、S6或GAPDH一抗(1:1000稀释),置于摇床上4 ℃孵育过夜。洗膜后加入相应的二抗(1:10 000稀释),室温孵育1 h,Odyssey红外激光双色图像分析系统扫描得蛋白表达量,并用ImageJ软件对蛋白条带进行灰度分析。
1.5 乳酸脱氢酶比色法测定糖酵解产物乳酸
将生长状态良好的Bcap37细胞和MDA-MB-453细胞接种到24孔板中,给予小(0.01 mmol/L)、中(0.10 mmol/L)、大(2.00 mmol/L)剂量的维生素C作用48 h,未经维生素C处理的细胞作为空白对照。取培养基上清液,按照乳酸检查试剂盒说明书的步骤测定乳酸含量。
1.6 称量荷瘤裸鼠体质量及肿瘤质量
裸鼠移植瘤模型的建立:收集生长状态良好的Bcap37细胞,按照1×10 6个/只的密度皮下接种到裸鼠(共10只)腋下,一周后肿瘤生长至肉眼可见。实验动物随机分为对照组和观察组,每组5只,观察组给予大剂量(4 g/kg)维生素C腹腔注射,对照组给予等渗氯化钠溶液。每天给药1次,连续给药24 d,记录小鼠体质量。给药结束后处死裸鼠,剥离肿瘤并称重。
1.7 统计学方法
采用SPSS 15.0软件进行统计学分析。计量数据用均数±标准差( x ± s)表示,多组间比较采用单因素方差分析,组间两两比较采用Dunnett- t检验, P < 0.05为差异有统计学意义。
2 结果
2.1 大剂量维生素C抑制乳腺癌细胞增殖
乳腺癌细胞Bcap37和MDA-MB-453经维生素C作用0、2、4、6 d后,与空白对照组比较,小剂量维生素C可以增强Bcap37和MDA-MB-453细胞的增殖能力,其中对Bcap37细胞增殖能力的影响更为显著( P < 0.01);中剂量维生素C对两种乳腺癌细胞增殖均有促进作用( P < 0.01或 P < 0.05);而大剂量维生素C对两种乳腺癌细胞增殖均有抑制作用(均 P < 0.01),如 图 1所示。结果提示,不同剂量维生素C对乳腺癌细胞增殖的影响不同,大剂量维生素C可抑制乳腺癌细胞增殖。
图1.
不同剂量维生素C作用2、4、6 d乳腺癌细胞增殖情况
A:Bcap37细胞的吸光度随时间变化的曲线;B:MDA-MB-453细胞的吸光度随时间变化的曲线.吸光度值反应细胞数量,吸光度值越大表明细胞数量越多.与空白对照组比较, * P < 0.05, ** P < 0.01.

2.2 大剂量维生素C抑制乳腺癌细胞糖酵解
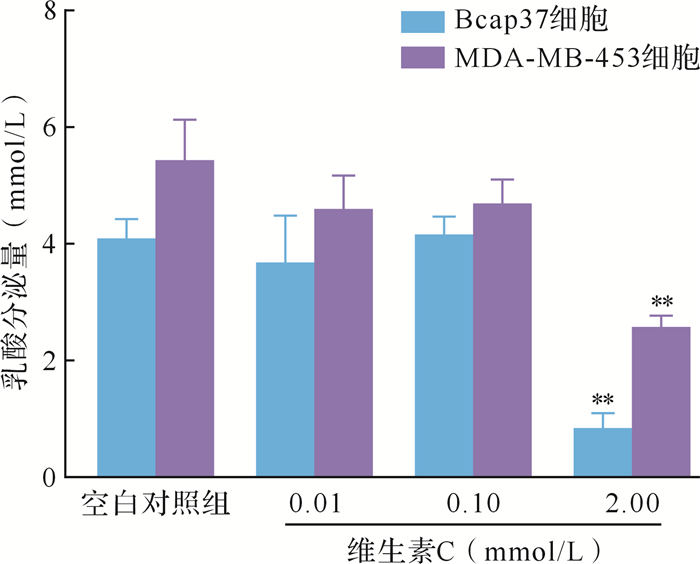
维生素C在培养基中的半衰期约1.5 h,肿瘤细胞利用维生素C的方式主要是通过Glut1转运氧化型维生素C进入细胞 [ 14] 。如 图 2所示,在乳腺癌细胞Bcap37和MDA-MB-453中,小剂量维生素C对两种细胞系Glut1的表达无显著影响;中剂量维生素C对Bcap37细胞Glut1的表达有上调作用;而大剂量维生素C对两种细胞系Glut1的表达均有抑制作用(均 P < 0.05)。PFKP的表达量检测结果显示,不同剂量的维生素C对PFKP的表达并未产生明显影响。乳酸检测结果显示,在乳腺癌细胞Bcap37和MDA-MB-453中,小剂量和中剂量维生素C对乳酸分泌未见明显影响;但在大剂量维生素C作用下,乳酸分泌量减少( P < 0.01),见 图 3。以上结果提示,大剂量维生素C通过抑制Glut1表达,减少细胞摄入氧化型维生素C,使糖酵解过程中的底物含量降低,从而抑制乳腺癌细胞糖酵解。在这个过程中,糖酵解关键酶的活性未改变。
图2.
不同剂量维生素C作用后乳腺癌细胞Glut1和PFKP蛋白表达变化
A、B:Bcap37细胞Glut1和PFKP蛋白电泳代表性条带和统计分析;C、D:MDA-MB-453细胞Glut1和PFKP蛋白电泳代表性条带和统计分析.与空白对照组比较, * P < 0.05.Glut1:葡萄糖转运蛋白1;GAPDH:甘油醛-3-磷酸脱氢酶;PFKP:血小板型磷酸果糖激酶.

图3.
不同剂量维生素C作用48 h乳腺癌细胞乳酸分泌量变化
与空白对照组比较, ** P < 0.01.
2.3 大剂量维生素C通过下调mTOR信号通路抑制乳腺癌细胞增殖
与空白对照组比较,乳腺癌细胞Bcap37和MDA-MB-453在小剂量和中剂量维生素C作用下,mTOR、S6K和S6蛋白磷酸化水平未见明显变化;但在大剂量维生素C作用下,S6K和S6蛋白磷酸化水平下调(均 P < 0.01),尤其在Bcap37细胞中更为明显,见 图 4。结果提示,大剂量维生素C可以通过下调mTOR信号通路抑制蛋白质合成,从而抑制乳腺癌细胞增殖。
图4.
不同剂量维生素C对乳腺癌细胞中mTOR信号通路的影响
A、B:Bcap37细胞中mTOR信号通路相关蛋白电泳代表性条带和统计分析;C、D:MDA-MB-453细胞中mTOR信号通路相关蛋白电泳代表性条带和统计分析.与空白对照组比较, * P < 0.05, ** P < 0.01.mTOR:哺乳动物雷帕霉素靶蛋白;S6K:S6激酶.

2.4 大剂量维生素C抑制荷瘤裸鼠肿瘤组织生长
荷瘤动物模型在经过连续24 d的维生素C治疗后,与对照组[(3.99±0.34)g]比较,大剂量维生素C可以抑制肿瘤生长[(2.70±0.22)g, P < 0.05, 图 5],但两组荷瘤裸鼠体质量增长差异无统计学意义( 图 6)。结果提示,大剂量维生素C可以抑制荷瘤小鼠肿瘤组织生长,且未见明显不良反应。
图5.

大剂量维生素C作用后肿瘤大体观
图6.

大剂量维生素C作用后裸鼠体质量变化
3 讨论
维生素C作为人体必需的营养物质,大量临床研究显示其在治疗肿瘤方面有效且不良反应较小 [ 15- 17] 。Cameron等 [ 18] 最早将维生素C用于肿瘤治疗,给予患者每日静脉输注10 g维生素C,连续10 d,随后每日口服8~10 g维生素C,接受治疗的50例患者中48%的患者出现症状缓解。随后,Cameron等 [ 19] 又进行了一项对100例晚期肿瘤患者使用静脉注射大剂量维生素C(10 g/d)治疗肿瘤的试验,发现与未接受维生素C治疗的患者比较,接受大剂量维生素C治疗的患者平均寿命延长了约300 d。但是,Moertel等 [ 20] 和Creagan等 [ 21] 分别设计双盲试验,给予患者每日口服10 g维生素C,并未发现上述治疗效果。因此,维生素C在肿瘤治疗中的作用仍存在争议, 需要更多的实验来证实。
在肿瘤生长过程中,肿瘤细胞快速分裂、增殖,常常造成肿瘤组织内部呈缺氧状态,肿瘤细胞因此关闭了线粒体的有氧氧化,能量由葡萄糖的无氧酵解提供,葡萄糖代谢为丙酮酸后不再通过线粒体的三羧酸循环进行有氧氧化,而通过乳酸脱氢酶转变为乳酸排出细胞 [ 7] 。本研究中,大剂量维生素C作用于乳腺癌细胞后,转运葡萄糖的Glut1转运蛋白表达减少,且无氧酵解终产物乳酸含量明显下降,表明大剂量维生素C具有抑制无氧酵解的作用。本研究并未发现大剂量维生素C明显改变糖酵解关键酶PFKP的表达量,因此维生素C可能主要通过下调Glut1转运体,减少糖酵解所需反应底物葡萄糖,导致肿瘤细胞能量利用降低。
肿瘤细胞的快速增殖需要大量蛋白质合成,mTOR信号通路是细胞增殖分化以及蛋白质合成的重要信号通路 [ 22- 24] ,与细胞的增殖密切相关。本文资料显示,大剂量维生素C下调了mTOR信号通路中多种磷酸化蛋白的表达,包括mTOR、S6K和S6的蛋白表达,提示维生素C对肿瘤细胞增殖的抑制作用与抑制mTOR信号通路相关。mTOR信号通路是复杂的信号系统,受到多种正反馈和负反馈调控。本研究中并未对mTOR信号通路的其他靶点如PI3K-AKT、Gsk3和PDK等进行检测,将在今后的研究中进一步深入探讨。
综上所述,大剂量维生素C通过抑制糖酵解和蛋白质合成的方式抑制了乳腺癌细胞的增殖,从能量和蛋白质合成角度解释了大剂量维生素C作用下细胞增殖受到抑制的部分机制,同时为抗肿瘤药物的靶点研究和精准调控提供了思路。虽然本研究中产生肿瘤抑制作用的维生素C剂量在体外研究中高达2 mmol/L,与此相对应的体内剂量为4 g/kg,但并未对模型动物的体质量产生明显影响,提示维生素C不同于其他肿瘤化疗药物,大剂量下并未发现明显不良反应。但是,维生素C对肿瘤的选择性杀死作用依然存在许多未解之谜,找到维生素C发挥抗肿瘤的关键环节将有利于设计治疗肿瘤的靶向药物,也是未来研究维生素C治疗肿瘤的核心。
Funding Statement
杭州市重大科技创新项目(20152013A02)
References
- 1.CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66(2):115–132. doi: 10.3322/caac.21338. [CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2):115-132.] [DOI] [PubMed] [Google Scholar]
- 2.BRAY F, JEMAL A, GREY N, et al. Global cancer transitions according to the Human Development Index(2008-2030):a population-based study. Lancet Oncol. 2012;13(8):790–801. doi: 10.1016/S1470-2045(12)70211-5. [BRAY F, JEMAL A, GREY N, et al. Global cancer transitions according to the Human Development Index(2008-2030):a population-based study[J]. Lancet Oncol, 2012, 13(8):790-801.] [DOI] [PubMed] [Google Scholar]
- 3.HAO C, WANG Z, GU Y, et al. Prognostic value of osteopontin splice variant-c expression in breast cancers:a meta-analysis. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4947640/ Biomed Res Int. 2016;2016:7310694. doi: 10.1155/2016/7310694. [HAO C, WANG Z, GU Y, et al. Prognostic value of osteopontin splice variant-c expression in breast cancers:a meta-analysis[J]. Biomed Res Int, 2016, 2016:7310694.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.MARTINI E. Jacques Cartier witnesses a treatment for scurvy. https://www.ncbi.nlm.nih.gov/pubmed/12422875. Vesalius. 2002;8(1):2–6. [MARTINI E. Jacques Cartier witnesses a treatment for scurvy[J]. Vesalius, 2002, 8(1):2-6.] [PubMed] [Google Scholar]
- 5.MIKIROVA N, CASCIARI J, ROGERS A, et al. Effect of high-dose intravenous vitamin C on inflammation in cancer patients. J Transl Med. 2012;10:189. doi: 10.1186/1479-5876-10-189. [MIKIROVA N, CASCIARI J, ROGERS A, et al. Effect of high-dose intravenous vitamin C on inflammation in cancer patients[J]. J Transl Med, 2012, 10:189.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.HANAHAN D, WEINBERG R A. Hallmarks of cancer:the next generation. Cell. 2011;144(5):646–674. doi: 10.1016/j.cell.2011.02.013. [HANAHAN D, WEINBERG R A. Hallmarks of cancer:the next generation[J]. Cell, 2011, 144(5):646-674.] [DOI] [PubMed] [Google Scholar]
- 7.WARBURG O. On the origin of cancer cells. Science. 1956;123(3191):309–314. doi: 10.1126/science.123.3191.309. [WARBURG O. On the origin of cancer cells[J]. Science, 1956, 123(3191):309-314.] [DOI] [PubMed] [Google Scholar]
- 8.NGO D C, VERVERIS K, TORTORELLA S M, et al. Introduction to the molecular basis of cancer metabolism and the Warburg effect. Mol Biol Rep. 2015;42(4):819–823. doi: 10.1007/s11033-015-3857-y. [NGO D C, VERVERIS K, TORTORELLA S M, et al. Introduction to the molecular basis of cancer metabolism and the Warburg effect[J]. Mol Biol Rep, 2015, 42(4):819-823.] [DOI] [PubMed] [Google Scholar]
- 9.VOLLBRACHT C, SCHNEIDER B, LEENDERT V, et al. Intravenous vitamin C administration improves quality of life in breast cancer patients during chemo-/radiotherapy and aftercare:results of a retrospective, multicentre, epidemiological cohort study in Germany. https://www.researchgate.net/publication/51737042_Intravenous_Vitamin_C_Administration_Improves_Quality_of_Life_in_Breast_Cancer_Patients_during_Chemo-Radiotherapy_and_Aftercare_Results_of_a_Retrospective_Multicentre_Epidemiological_Cohort_Study_in_G. In Vivo. 2011;25(6):983–990. [VOLLBRACHT C, SCHNEIDER B, LEENDERT V, et al. Intravenous vitamin C administration improves quality of life in breast cancer patients during chemo-/radiotherapy and aftercare:results of a retrospective, multicentre, epidemiological cohort study in Germany[J]. In Vivo, 2011, 25(6):983-990.] [PubMed] [Google Scholar]
- 10.CONCIATORI F, CIUFFREDA L, BAZZICHETTO C, et al. mTOR cross-talk in cancer and potential for combination therapy[J/OL]. Cancers(Basel), 2018, 10(1). pii: E23. https://www.researchgate.net/publication/322625361_mTOR_Cross-Talk_in_Cancer_and_Potential_for_Combination_Therapy. . [DOI] [PMC free article] [PubMed]
- 11.WULLSCHLEGER S, LOEWITH R, HALL M N. TOR signaling in growth and metabolism. Cell. 2006;124(3):471–484. doi: 10.1016/j.cell.2006.01.016. [WULLSCHLEGER S, LOEWITH R, HALL M N. TOR signaling in growth and metabolism[J]. Cell, 2006, 124(3):471-484.] [DOI] [PubMed] [Google Scholar]
- 12.DAZERT E, HALL M N. mTOR signaling in disease. Curr Opin Cell Biol. 2011;23(6):744–755. doi: 10.1016/j.ceb.2011.09.003. [DAZERT E, HALL M N. mTOR signaling in disease[J]. Curr Opin Cell Biol, 2011, 23(6):744-755.] [DOI] [PubMed] [Google Scholar]
- 13.HAY N, SONENBERG N. Upstream and downstream of mTOR. Genes Dev. 2004;18(16):1926–1945. doi: 10.1101/gad.1212704. [HAY N, SONENBERG N. Upstream and downstream of mTOR[J]. Genes Dev, 2004, 18(16):1926-1945.] [DOI] [PubMed] [Google Scholar]
- 14.YUN J, MULLARKY E, LU C, et al. Vitamin C selectively kills KRAS and BRAF mutant colorectal cancer cells by targeting GAPDH. Science. 2015;350(6266):1391–1396. doi: 10.1126/science.aaa5004. [YUN J, MULLARKY E, LU C, et al. Vitamin C selectively kills KRAS and BRAF mutant colorectal cancer cells by targeting GAPDH[J]. Science, 2015, 350(6266):1391-1396.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.MA Y, CHAPMAN J, LEVINE M, et al. High-dose parenteral ascorbate enhanced chemosensitivity of ovarian cancer and reduced toxicity of chemotherapy. Sci Transl Med. 2014;6(222):222ra18. doi: 10.1126/scitranslmed.3007154. [MA Y, CHAPMAN J, LEVINE M, et al. High-dose parenteral ascorbate enhanced chemosensitivity of ovarian cancer and reduced toxicity of chemotherapy[J]. Sci Transl Med, 2014, 6(222):222ra18.] [DOI] [PubMed] [Google Scholar]
- 16.MONTI D A, MITCHELL E, BAZZAN A J, et al. Phase I evaluation of intravenous ascorbic acid in combination with gemcitabine and erlotinib in patients with metastatic pancreatic cancer[J/OL]. PLoS One, 2012, 7(1): e29794. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0029794. . [DOI] [PMC free article] [PubMed]
- 17.YEOM C H, JUNG G C, SONG K J. Changes of terminal cancer patients' health-related quality of life after high dose vitamin C administration. J Korean Med Sci. 2007;22(1):7–11. doi: 10.3346/jkms.2007.22.1.7. [YEOM C H, JUNG G C, SONG K J. Changes of terminal cancer patients' health-related quality of life after high dose vitamin C administration[J]. J Korean Med Sci, 2007, 22(1):7-11.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.CAMERON E, CAMPBELL A, JACK T. The orthomolecular treatment of cancer. Ⅲ. Reticulum cell sarcoma:double complete regression induced by high-dose ascorbic acid therapy. Chem Biol Interact. 1975;11(5):387–393. doi: 10.1016/0009-2797(75)90007-1. [CAMERON E, CAMPBELL A, JACK T. The orthomolecular treatment of cancer. Ⅲ. Reticulum cell sarcoma:double complete regression induced by high-dose ascorbic acid therapy[J]. Chem Biol Interact, 1975, 11(5):387-393.] [DOI] [PubMed] [Google Scholar]
- 19.CAMERON E, PAULING L. Supplemental ascorbate in the supportive treatment of cancer:reevaluation of prolongation of survival times in terminal human cancer. Proc Natl Acad Sci U S A. 1978;75(9):4538–4542. doi: 10.1073/pnas.75.9.4538. [CAMERON E, PAULING L. Supplemental ascorbate in the supportive treatment of cancer:reevaluation of prolongation of survival times in terminal human cancer[J]. Proc Natl Acad Sci U S A, 1978, 75(9):4538-4542.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.MOERTEL C G, FLEMING T R, CREAGAN E T, et al. High-dose vitamin C versus placebo in the treatment of patients with advanced cancer who have had no prior chemotherapy. A randomized double-blind comparison. https://www.ncbi.nlm.nih.gov/pubmed/3880867. N Engl J Med. 1985;321(3):137–141. doi: 10.1056/NEJM198501173120301. [MOERTEL C G, FLEMING T R, CREAGAN E T, et al. High-dose vitamin C versus placebo in the treatment of patients with advanced cancer who have had no prior chemotherapy. A randomized double-blind comparison[J]. N Engl J Med, 1985, 312(3):137-141.] [DOI] [PubMed] [Google Scholar]
- 21.CREAGAN E T, MOERTEL C G, O'FALLON J R, et al. Failure of high-dose vitamin C (ascorbic acid) therapy to benefit patients with advanced cancer. A controlled trial. N Engl J Med. 1979;301(13):687–690. doi: 10.1056/NEJM197909273011303. [CREAGAN E T, MOERTEL C G, O'FALLON J R, et al. Failure of high-dose vitamin C (ascorbic acid) therapy to benefit patients with advanced cancer. A controlled trial[J]. N Engl J Med, 1979, 301(13):687-690.] [DOI] [PubMed] [Google Scholar]
- 22.SAXTON R A, SABATINI D M. mTOR signaling in growth, metabolism, and disease. http://d.old.wanfangdata.com.cn/OAPaper/oai_pubmedcentral.nih.gov_3414727. Cell. 2017;169(2):361–371. doi: 10.1016/j.cell.2017.03.035. [SAXTON R A, SABATINI D M. mTOR signaling in growth, metabolism, and disease[J]. Cell, 2017, 169(2):361-371.] [DOI] [PubMed] [Google Scholar]
- 23.LI H, LIU X, WANG Z, et al. MEN1/Menin regulates milk protein synthesis through mTOR signaling in mammary epithelial cells. Sci Rep. 2017;7(1):5479. doi: 10.1038/s41598-017-06054-w. [LI H, LIU X, WANG Z, et al. MEN1/Menin regulates milk protein synthesis through mTOR signaling in mammary epithelial cells[J]. Sci Rep, 2017, 7(1):5479.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.KIM J, GUAN K L. mTOR as a central hub of nutrient signalling and cell growth. Nat Cell Biol. 2019;21(1):63–71. doi: 10.1038/s41556-018-0205-1. [KIM J, GUAN K L. mTOR as a central hub of nutrient signalling and cell growth[J]. Nat Cell Biol, 2019, 21(1):63-71.] [DOI] [PubMed] [Google Scholar]


