Le SARS-CoV2 modifie les propriétés mécaniques de la cellule, menant à la signalisation en changeant l’ordre des phospholipides de la bicouche membranaire amphiphile de la cellule hôte, ce qui initie la fusion des membranes [1], [2], [3].
Le virus réorganise la diffusion moléculaire membranaire, paramètre déterminant de la signalisation, en parasitant également le cytosquelette dont le rôle est crucial. Celui-ci module les nanodomaines menbranaires contenant par exemple le récepteur ACE2. Son réseau de transmission ramifié connecte l’ensemble du milieu intra cellulaire et permet l’échange avec l’environnement extracellulaire.
La pénétration du virus dans la cellule peut être analysée comme un changement topologique. Que signifie cette terminologie : deux objets, des surfaces dans le cas présent, ont la même topologie s’ils peuvent être transformés sans déchirure, par exemple la surface d’un ballon de football transformée en ballon de rugby). Dans le cas de la fusion impliquant le virus et donc conduisant au mélange des milieux intracellulaires de la cellule hôte et du virus, il y a transformation topologique des membranes nécessitant donc de respecter des lois contraignantes mathématiquement définies. Ainsi il est montré que ces domaines en phase ordonnée (souvent nommés « raft » ou liquide ordonné), sont utilisés par le SARS-CoV2 et de nombreux autres virus enveloppés pour s’ancrer sur la membrane cible.
La transformation topologique est alors associée à des fluctuations locales de composition des membranes. Le virus, en exploitant le couplage mécanique entre le cytosquelette et la membrane plasmique [4], [5], dès le stade de la fusion membranaire, modifie les mécanismes physico-chimiques de la mécanotransduction, ce qui perturbe l’information transitant entre la matrice extracellulaire et le noyau intracytoplasmique.
Ce couplage membrane-cytosquelette est également retrouvé dans la zone de contact entre le réticulum endoplasmique et les mitochondries appelée MAM, engagée dans la réponse immunitaire innée. Citons également la défaillance mécanique membranaire initiée par le virus au sein de la barrière endothélio-alvéolo-pulmonaire, qui implique l’état mésogène du surfactant pulmonaire.
Les propriétés des phospholipides membranaires engagées dans ces différents processus ont été bien étudiées par les physiciens depuis plusieurs décennies, et caractérisées comme des structures présentant une organisation ordonnée à l’échelle de quelques nanomètres tout en gardant des propriétés de fluidité similaire à celles d’un liquide visqueux : des mésophases de cristaux liquides.
L’ordre de type mésophase des membranes est crucial pour le mécanisme de l’infection virale.
L’analyse des cristaux liquides organisant les molécules amphiphiles comparable à celle des membranes biologiques est donc un guide nécessaire à la compréhension des différentes étapes de l’infection virale. Des concepts utilisés en physique fournissent des principes et des outils propices à l’exploration de solutions thérapeutiques fondées sur des bases universelles, et susceptibles de contourner la variabilité du virus. Ces concepts traitent par exemple les contraintes topologiques et géométriques dont la courbure et l’énergie des interactions impliquées dans la fusion membranaire.
L’infection virale, lors de la fusion des membranes, modifie les auto-associations moléculaires [6] et mène à des structures présentant un ordre topologique, comme un film phospholipidique séparant deux labyrinthes imbriqués de nature aqueuse : toutes ces organisations s’établissant à l’échelle de quelques dizaines de nanomètres. Ceci rappelle, dans un contexte différent, et surtout sans ordre à grande distance, l’exemple des phases cubiques dites bi-continues, constituées de deux labyrinthes imbriqués et séparés par une surface périodique. L’ordre local observé dans ces structures résulte d’interactions, dont la portée correspond à des distances entre des dizaines et quelques centaines de molécules les constituants.
Nous avons montré, il y a quelques mois [7], [8], dans le domaine de la neurologie, l’oncologie, la virologie, la physiologie de l’audition, que l’approche multidisciplinaire révélait des unifications sous-jacentes à la complexité biologique.
Nous proposons l’expression « vecteur d’information commun » pour exprimer l’idée d’une interaction indissociable entre les, propriétés mécaniques, électrochimiques et géniques de la cellule. Ces interactions sont observées par exemple lors de la mécanotransduction et plus généralement dans l’auto-organisation hors d’équilibre de la matière consommant l’ATP de ses constituants. Ce qui permet notamment l’expression de phénomènes collectifs à longue distance au-delà des covalences intramoléculaires. Ce vecteur apparaît comme un principe générique du vivant. En sortant de notre domaine d’exploration, nous suggérons une cible thérapeutique potentielle constituée par les propriétés mécaniques du domaine transmembranaire TMD de la protéine de fusion Spike comme la flexibilité et la viscoélasticité. Ces propriétés conduisent aux changements topologiques menant à la fusion des membranes. Le domaine de fusion fait partie des zones les plus conservées de la protéine Spike, ce qui est favorable pour constituer une cible thérapeutique face aux multiples variants du SARS-CoV2 et à de nombreux autres virus.
Pour clore cet éditorial, et les ouvertures fournies par la physique fondamentale, citons le VIH-1. Ce virus enveloppé initie des nanodomaines membranaires pour entrer dans la cellule cible et également tout au long de son cycle intracellulaire.
Les connaissances et les techniques de nos amis les physiciens sont indispensables à l’émergence de thérapeutiques compatibles avec les mésophases membranaires et leur modulation mécanique par l’actomyosine dont la contractilité est susceptible de générer les propriétés fractales du cytosquelette (Figure 1, Figure 2, Figure 3 ).
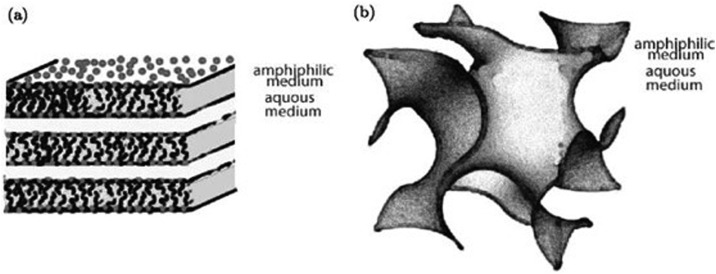
Figure 1.
(a) Représentation schématique de la phase lamellaire d’un cristal liquide lyotrope, les couches planes amphiphiles sont séparées par des couches d’eau ; (b) représentation schématique d’une phase cubique (surface gyroïde), deux labyrinthes de canaux d’eau entrelacés mais non connectés sont séparés par un film unique de molécules amphiphiles avec une topologie complexe.
Dans la phase lamellaire, les couches ont une courbure nulle mais la surface gyroïde a une courbure gaussienne négative avec une topologie très complexe.
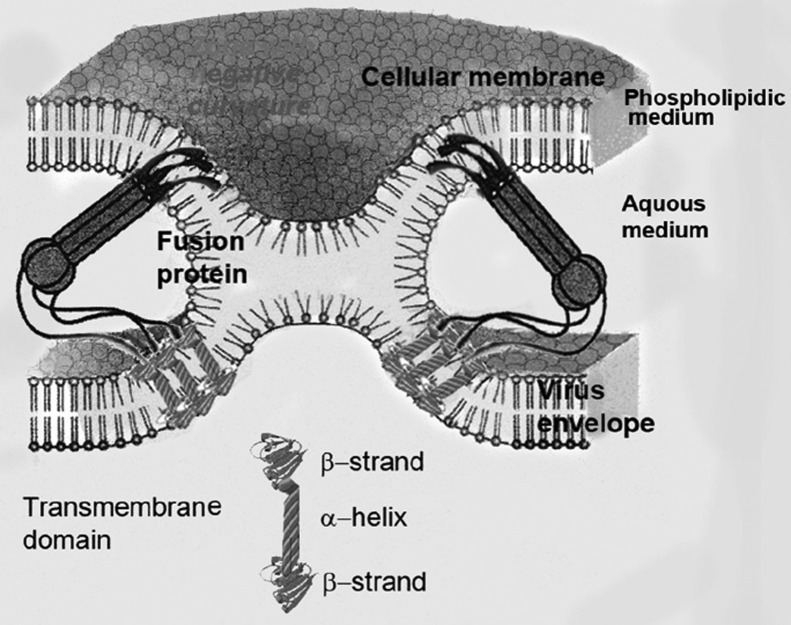
Figure 2.
Fusion des membranes des cellules virales et hôtes. La protéine Spike est le moteur de la fusion des membranes. Elle présente une conformation transmembranaire brin-hélice-brin générant différentes courbures des membranes. Ceci est associé à une hétérogénéité dans la composition des phospholipides impliquant des domaines riches en PE.
Ensuite, une transformation topologique associée à une courbure membranaire négative apparaît sous la forme d’un tube en forme d’hyperboloïde qui relie les deux membranes. La diffusion des molécules impliquée dans cette transformation, conduisant donc à l’hétérogénéité est créée par la modification du repliement des protéines qui fournissent l’énergie nécessaire.
Figure 3.
(a) Deux bicouches de membranes amphiphiles. (b) Un changement local des propriétés des molécules de phospholipides crée deux bosses sur les couches. (c) Fusion des deux couches conduisant à une structure bi-continue.
En (a) on peut considérer qu’il y a trois milieux : deux membranes phospholipidiques et une partie eau en sandwichs : c’est une structuration topologique. En (b), la déformation locale maintient cette topologie inchangée. Mais en (c) la fusion des deux membranes change la topologie : il n’y a toujours qu’un seul milieu phospholipidique. En haut se trouve un schéma très simplifié de la transformation.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Références
- 1.Deng Y., Angelova A. Coronavirus-Induced Host Cubic Membranes and Lipid-Related Antiviral Therapies: A Focus on Bioactive Plasmalogens. Hal Open Science. 2021 doi: 10.3389/fcell.2021630242. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Yao H., Lee M.W., Waring A.J., Wong G.C.L., Hong M. Viral fusion protein transmembrane domain adopts β-strand structure to facilitate membrane topological changes for virus–cell fusion. Proc. Natl. Acad. Sci. USA PNAS. 2015;112:10926–10931. doi: 10.1073/pnas.1501430112. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Tenchov B.G., MacDonald R.C., Lentz B.R. Fusion peptides promote formation of bilayer cubic phases in lipid dispersions. An X-Ray diffraction study. Biophys J. 2013;104(5):1029–1037. doi: 10.1016/j.bpj.2012.12.034. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Sadegh S., Higgins J., Mannion P.C., Tamkun M.M., Krapf D. Plasma membrane is compartmentalized by a self-similar cortical actin meshwork. Phys Rev. 2017;7(1) doi: 10.1103/PhysRevX.7.011031. 011031-011041. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Koster D.V., Husain K., Iljazi E., Bhat A., Bieling P., Mullins R.D., et al. Actomyosin dynamics drive local membrane component organization in an in vitro active composite layer. Natl Acad Sci USA. 2016;113(12):E1645–E1654. doi: 10.1073/pnas.1514030113. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Charvolin J., Sadoc J.F. Ordered bicontinuous films of amphiphiles and biological membranes. Philos Trans R Soc Lond. 1996;A354:2173–2192. [Google Scholar]
- 7.Binot C., Sadoc J.F., Chouard C.H. Cell Mechanics and Signalization: SARS-CoV-2 Hijacks. Membrane Liquid Crystals and Cytoskeletal Fractal Topology. Biophysical Reviews and Letters. 2021;16(3):55–75. doi: 10.1142/S1793048021300024. [DOI] [Google Scholar]
- 8.Binot C., Chouard C., Sadoc J.F. Oncogenesis, lipids rafts and liquid crystals: a nanoscopic supplementary field for applied researches and a new hope of advances in cancer. Heliyon. 2018;4(7):E00687. doi: 10.1016/j.heliyon.2018.e00687. [DOI] [PMC free article] [PubMed] [Google Scholar]