Résumé
Le développement de nouveaux vaccins était traditionnellement un travail de longue haleine, même si l’expérience récente de l’émergence de la Covid-19 a fait exploser les délais de développement et de production. Il n’en reste pas moins que le développement des vaccins dans les phases précliniques et les phases 1 et 2 de développement clinique est basé sur l’étude de la réponse immunitaire spécifique du système immunitaire adaptatif.
Mots clés: anticorps, cellule présentatrice d’antigènes, Elisa, lymphocyte B, lymphocyte T, vaccin
Abstract
The development of new vaccines has traditionally been a long-term job, although recent experience with the emergence of Covid-19 has caused development and production delays to skyrocket. The fact remains that the development of vaccines in the preclinical phases and in phases 1 and 2 of clinical development is based on the study of the specific immune response of the adaptive immune system.
Keywords: antibody, antigen presenting cell, B lymphocyte, Elisa, T lymphocyte, vaccine
© Design Cells / stock.adobe.com
Introduction
L’obtention d’une réponse immunitaire vaccinale protectrice est un défi complexe, car la plupart des vaccins actuellement sur le marché ont été majoritairement développés de manière empirique, avec très peu si ce n’est aucun élément rationnel de compréhension de la manière dont ils activent le système immunitaire. Même les vaccins les plus récents, basés sur les ARN messagers (ARNm) mis sur le marché fin 2020 et courant 2021 contre l’infection par le virus Sars-CoV-2 ont été développés essentiellement sur des bases empiriques. Les vaccins agissent en mimant les phases précoces d’une infection, principalement en exposant au système immunitaire des composants du pathogène (associés ou non à des adjuvants) qui sont dans un premier temps reconnus par le système immunitaire inné (non spécifique). L’activation de l’immunité innée immédiate et locale active ensuite les mécanismes de l’immunité adaptative (spécifique) dont les principaux effecteurs sont, pour la composante humorale les anticorps secrétés par les lymphocytes B (pour bone marrow car ils se développent dans la moelle osseuse), et pour la composante cellulaire les lymphocytes T (pour thymus car ils se développent en partie dans cet organe). Les lymphocytes T ont deux grands phénotypes différenciés par des marqueurs de surface dénommés CD pour « Cluster of differentiation » :
-
◗
les lymphocytes T de type CD8+ qui exercent une activité cytotoxique permettant l’élimination des cellules infectées ;
-
◗
les lymphocytes de type CD4+ qui exercent une activité de type helper par la sécrétion de molécules modulatrices baptisées cytokines. Ces lymphocytes T CD4+ aident le développement des lymphocytes B et T CD8+. Initialement deux grands types de lymphocytes T CD4+ ont été décrits, les lymphocytes Th1 produisant de l’Interféron (IFN)-γ stimulant principalement l’immunité cellulaire et les lymphocytes Th2 produisant de l’interleukine (IL)-4 stimulant la production d’anticorps et donc l’immunité humorale.
À ces deux populations se sont rajoutés les lymphocytes Th17 produisant de l’IL-17 stimulant la protection contre les pathogènes extracellulaires, les lymphocytes régulateur (Treg) produisant de l’IL-10 et permettant le contrôle de l’expansion de la réponse immunitaire. Enfin, les lymphocytes T helper folliculaires (Tfh) particulièrement importants par leur fonction effectrice dans les ganglions lymphatiques au niveau des centres germinatifs pour permettre le développement des lymphocytes B et la maturation et la production des anticorps sécrétés. Ces lymphocytes Tfh sont particulièrement surveillés dans le domaine de la vaccinologie du fait de leur fonction critique.
Seront présentés ici, dans une première partie, un rappel sur les mécanismes de mise place de la réponse immunitaire naturelle et vaccinale, puis, dans une deuxième partie, les différentes méthodes d’étude de la réponse immunitaire post-vaccinale.
L’activation de l’immunité innée immédiate et locale active ensuite les mécanismes de l’immunité adaptative
La mise en place de la réponse immunitaire spécifique
De l’activation de l’immunité innée à l’immunité adaptative : les premières étapes après immunisation
L’ensemble des cellules humaines sont capables de reconnaître des motifs moléculaires conservés associés à des pathogènes (lipopolysaccharides des bactéries à Gram négatives, acides lipotéchoïques, peptidoglycanes de bactéries, ADN double brin et simple brin des virus et bactéries, ARN simple brin des virus) dénommés pathogen-associated molecular patterns (Pamp) par l’intermédiaire de récepteurs dénommés pattern recognition receptors (PRR). L’importance de ce système de récepteurs de l’immunité innée, prédite par le célèbre immunologiste Charles Janeway en 1989, n’a été découverte que tardivement à la fin des années 1990 par le prix Nobel de médecine Jules Hoffman chez la drosophile [[1], [2]]. Ces mécanismes sont cruciaux pour la défense contre l’ensemble des pathogènes et sont assez conservés dans l’évolution soulignant l’importance des contraintes et de la pression évolutive sur ce système. Ce système est aussi celui qui initie la réponse de l’immunité adaptative, et de manière corollaire qui est mis en jeu dans la réponse vaccinale. Les adjuvants qui sont associés aux vaccins inactivés et sous-unitaires ont pour unique fonction l’activation non-spécifique de ce système.
L’activation d’une réponse antigène-spécifique des lymphocytes B et T nécessite leur activation dans les ganglions drainants par des cellules présentatrices d’antigènes (CPA), essentiellement des cellules dendritiques (DC) qui sont recrutées (figure 1) . À l’état immature, les DC patrouillent l’ensemble des organes du corps [3]. Quand les DC reconnaissent des agents pathogènes qu’elles discriminent à partir de la batterie de PRR qu’elles expriment à leur surface ou dans leur cytosol, elles activent un programme rapide de maturation incluant :
-
◗
une capacité à phagocyter et détruire les pathogènes ;
-
◗
une capacité à présenter les fragments de celui-ci associés aux molécules du complexe majeur d’histo-compatibilité (CMH) de classe I et II associées à des molécules de co-stimulation ;
-
◗
une capacité à exprimer un programme de récepteurs de chimiokine qui leur permettent de migrer jusqu’au ganglion lymphatique.
Figure 1.
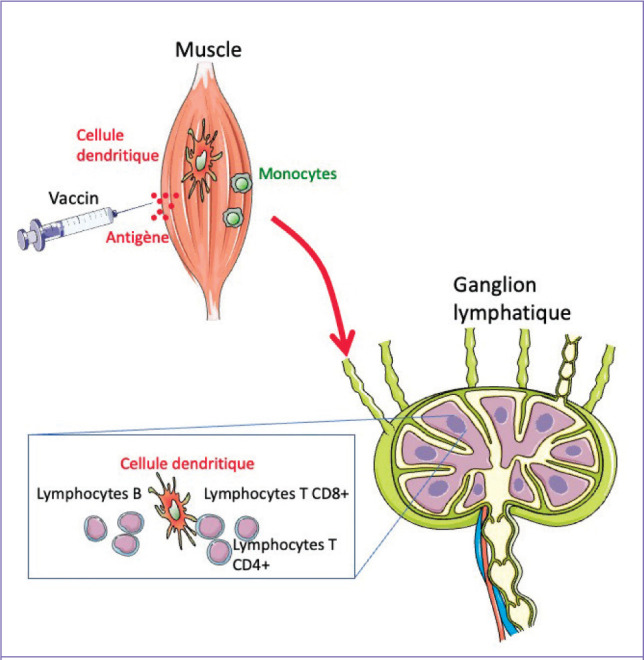
Principes généraux de la réponse immunitaire : application au vaccin.
Le vaccin injecté par voie intramusculaire contient des antigènes qui sont captés par les cellules dendritiques circulantes et résidentes des muscles. La présence de motifs moléculaires signant la présence de pathogène activent les récepteurs de l’immunité innée de la cellule dendritique qui migre jusqu’au ganglion lymphatique drainant. Les cellules dendritiques présentent les antigènes aux lymphocytes T CD4+ et CD8+, alors que les cellules dendritiques folliculaires présentent les antigènes aux lymphocytes B.
© J.-N. Tournier.– Servier médical art
Dans les ganglions lymphatiques les antigènes sont présentés par les DC matures aux lymphocytes T. En présence de molécules de co-stimulation, les lymphocytes T naïfs se différencient en lymphocytes Th. En l’absence de molécules de co-stimulation, les lymphocytes T naïfs sont induits sur la voie des Treg qui maintiennent la tolérance.
La réponse immunitaire vaccinale
La réponse immunitaire vaccinale peut être assez différente de celle induite naturellement, par exemple certaines bactéries produisant des toxines comme Clostridium tetani, Corynebacterium diphteriae induisent des phénomènes pathogéniques uniquement liés à la présence de toxines et l’induction d’anticorps anti-toxines permet d’induire une protection complète contre la maladie. Par ailleurs, les vaccins sont injectés majoritairement par voie intra-musculaire, alors que les pathogènes entrent majoritairement au niveau des muqueuses [4]. Les modes d’activation sont donc très différents en termes d’effecteurs et de programme cellulaire de migration.
Les vaccins viraux vivants atténués induisent une réponse immunitaire de meilleure qualité, liés à la production de molécules fortement activatrices de l’immunité innée comme les ARN viraux grâce à leur reconnaissance par les PRR. Après leur injection, ces particules virales peuvent se répliquer et se disséminer à la manière dont elles le font lors de l’infection naturelle.
Les vaccins non vivants incluant des microorganismes inactivés, des protéines, des polysaccharides, des glyco-conjugués et désormais des ARNm codant des protéines virales, peuvent contenir des Pamp. S’ils en contiennent peu, ce sont les adjuvants auxquels ils sont associés qui vont apporter les Pamp nécessaires à l’induction d’une réponse immunitaire de qualité. Mais en général, celle-ci est de moins forte amplitude dans le temps et l’espace, ce qui explique la nécessité de rappels réguliers dans le temps avec ces vaccins.
La voie d’administration des vaccins joue un rôle aussi important. Le derme est un tissu très riche en DC alors que les tissus graisseux sont assez pauvres en DC, aussi les injections intra-dermiques sont réputées plus efficaces qu’en sous-cutané. Par contre, les muscles sont relativement riches en DC qui patrouillent les organes vascularisés, d’où l’utilisation majeure de la voie intra-musculaire. Enfin, la voie d’administration muqueuse intra-nasale, bien que très peu utilisée, s’avèrerait très intéressante pour induire une bonne réponse locale (réponses muqueuses et génération de lymphocytes T mémoires tissulaires). Cependant, des effets secondaires à type de paralysie faciale ont été observés lors de l’utilisation d’adjuvants muqueux.
Maturation de la réponse adaptative et induction de la mémoire
La maturation de la réponse dans les ganglions lymphatiques
Les lymphocytes B produits dans la moelle osseuse sont activés dans les ganglions lymphatiques drainants. Les antigènes vaccinaux rejoignent la région des sinus sous-capsulaires, par diffusion dans les espaces lymphatiques et par transport par les DC. Les macrophages spécialisés des sinus sous-capsulaires transportent les antigènes vers les zones B des ganglions. Les lymphocytes B équipés d’un récepteur de surface reconnaissant les antigènes vaccinaux sont activés dans les centres germinatifs et migrent à l’interface entre les zones B et les zones T. Les lymphocytes B entament alors leur prolifération. Les antigènes protéiques sont présentés par les CPA et activent les lymphocytes Tfh. Ces lymphocytes induisent une différentiation très importante des lymphocytes B dans les centres germinatifs. Les centres germinatifs sont organisés par des cellules spécialisées, les cellules dendritiques folliculaires (FDC) d’origine mésenchymateuse, dont le rôle est de capturer l’antigène et de le présenter aux lymphocytes B et Tfh pendant de longues périodes de temps.
Les antigènes polysaccharidiques qui ne peuvent pas activer les lymphocytes Tfh, ne stimulent pas les centres germinatifs et induisent une réponse plus faible et moins durable.
Au niveau des centres germinatifs, deux phénomènes vont se produire, une expansion clonale et une maturation d’affinité des récepteurs des plasmablastes dont seuls les plus affins survivent. Cette maturation se fait par l’intermédiaire de recombinaisons géniques et par mutation somatique au niveau des gènes codant les immunoglobulines. Le switch entre les classes d’immunoglobulines vers les IgG, IgA et IgE se fait en fonction de l’environnement cellulaire en lymphocyte Th1, Th2 et de la production de cytokines. Les lymphocytes Th1 produisant de l’IFN-γ induisent une production d’IgG2a, alors que les lymphocytes Th2 induisent la production d’IgG1, IgE et IgG3.
L’induction de la mémoire immunitaire
Les lymphocytes B mémoires sont générés pendant la réponse primaire T-dépendante [5]. Ils persistent avec une longue durée de vie mais ne produisent pas d’anticorps (ils ne participent pas directement à la protection), à moins d’être réexposés à l’antigène qui induit leur différenciation en plasmablaste. Cette réactivation est rapide de telle manière qu’elle induit une réponse avec des titres en anticorps très hauts et une plus haute affinité que celle des anticorps produits pendant la réponse primaire. Les lymphocytes B mémoires possèdent des capacités à migrer dans les zones extra-folliculaires des ganglions et de la rate.
Il existe aussi des lymphocytes T mémoires à longue durée de vie. Deux types principaux de lymphocytes T mémoires ont été décrits :
-
◗
les lymphocytes T mémoires centraux (Tcm) qui circulent dans les ganglions lymphatiques et la moelle osseuse, n’ont pas de grand potentiel cytotoxique mais un grand potentiel prolifératif ;
-
◗
les lymphocytes T mémoires effecteurs (Tem) qui ont un potentiel cytotoxique important et ressemblent plus à des cellules activées.
Les méthodes d’étude de la réponse vaccinale
L’immunogénicité post-vaccinale est complexe et fait intervenir de nombreux acteurs cellulaires et humoraux. Pour la grande majorité des vaccins, la protection vaccinale (contre la maladie ou contre l’infection) corrèle avec les titres d’anticorps. Ces corrélats de protection peuvent être mécanistiques, c’est-à-dire qu’ils sont responsables de la protection, ou non mécanistiques, c’est-à-dire qu’ils ne sont que le reflet d’une réponse immunitaire plus complexe mais plus difficile à mesurer [6]. À titre d’exemple, la protection contre la rougeole est associée à un titre d’anticorps supérieur à 120 mU/mL. Or, ce titre ne représente pas la quantité d’anticorps neutralisants, ni les capacités de réponse cellulaire qui sont à elles seules responsables de la protection chez des enfants agammaglobulinémiques. Le titre d’anticorps est cependant un marqueur efficace de mesure de la protection à l’échelle individuelle et collective. Il s’agit d’un corrélat de protection non mécanistique.
Les méthodes d’étude de l’immunité humorale
Les anticorps sont ainsi les effecteurs majoritairement associés à la protection vaccinale, bien que pour certains vaccins (BCG, zona) le corrélat de protection soit cellulaire. Les anticorps sont des molécules duales leur permettant d’un côté de neutraliser spécifiquement les pathogènes, et de l’autre d’activer des médiateurs cellulaires par la reconnaissance de leur fragment constant (Fc). La neutralisation du pathogène permet d’éviter sa dissémination. La reconnaissance du Fc active différents mécanismes cellulaires :
-
◗
la cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC, antibody-dependent cellular cytotoxicity),
-
◗
la cytotoxicité dépendante du complément (CDC, complement-dependent cytotoxicity)
-
◗
la phagocytose cellulaire dépendante des anticorps (ADCP, antibody-dependent cellular phagocytosis).
Dans le processus d’ADCC et du CDC, les anticorps fixés sur les antigènes du pathogène à la surface des cellules infectées sont reconnus par des cellules cytotoxiques, principalement des lymphocytes NK dans le cas de l’ADCC, ou par le complément dans le cas du CDC. Ces deux mécanismes aboutissent à la lyse de la cellule infectée grâce à la formation d’un pore dans sa membrane soit par le relargage des perforines et du granzyme par les lymphocytes NK, soit par la polymérisation de la protéine C9 du complément. Enfin, dans l’ADCP, les anticorps fixés sur les antigènes du pathogène à la surface des cellules infectées sont reconnus par les macrophages induisant la phagocytose de la cellule. À l’inverse, des anticorps dits « facilitants » ou ADE (antibody-dependent enhancement) peuvent, une fois liés à l’agent pathogène, favoriser son entrée dans les cellules hôtes exprimant des récepteurs reconnaissants le Fc. L’ADE peut également favoriser chez les macrophages un phénotype inflammatoire délétère. Cela a été particulièrement étudié pour les virus ayant une diversité antigénique, dont les quatre sérotypes des virus de la dengue [7]. Cet éventail de mécanismes fait donc des anticorps un effecteur très étudié dans la réponse immunitaire post-vaccinale.
Titrage des anticorps
L’Elisa (Enzyme linked immunosorbent assay) est la technique principale utilisée pour l’étude qualitative ou quantitative de la réponse immunitaire humorale. Il s’agit d’une technique immuno-enzymatique. Il en existe quatre types : l’Elisa direct qui est plus fréquemment utilisé pour la détection des antigènes et les Elisa indirect, sandwich et de compétition. Partant du même principe, des tests plus sensibles basés sur l’électrochemiluminescence ont ensuite été développés. Tout comme l’Elisa, on retrouve quatre types d’Eclia (Electrochemilluminescence immunosorbent assay) pouvant être qualitatifs ou quantitatifs. Ces deux techniques sont basées sur l’interaction des anticorps des fluides biologiques avec leurs antigènes et mesurent l’apparition d’un composé coloré (Elisa) ou luminescent (Eclia). Plus rarement, le signal mesuré peut être fluorescent lors de la technique Elfa (Enzyme linked fluorescent assay). Les Elisa et Eclia de type indirect sont les plus fréquents en sérodiagnostics et sont détaillés dans la figure 2 . Dans ces essais, la protéine cible est adsorbée au fond d’un puits d’une plaque 96 puits en polystyrène pour l’Elisa ou sur une électrode pour l’Eclia. Chaque puits est ensuite incubé avec une solution dite bloquante (non représentée dans la figure) qui permet de combler chaque surface vide et ainsi d’éviter toute réaction aspécifique. Les échantillons de patients et l’anticorps de révélation sont ensuite incubés successivement et des étapes de lavage ont lieu entre chaque étape. Le substrat de révélation est enfin ajouté puis la lecture est réalisée. Dans le cas d’un résultat positif en Elisa, le substrat est oxydé par une peroxydase couplée à l’anticorps de détection, et devient coloré. L’absorbance de ce composé est mesurée par un spectrophotomètre. Dans un Eclia, le couplage de l’anticorps de révélation et le substrat est différent. Ce dernier émet de la lumière par transfert d’électron après stimulation électrique. L’intensité lumineuse est alors mesurée par un tube photomultiplicateur ou une caméra. En routine clinique, il existe des détections automatisées d’anticorps utilisant la technique Eclia. Selon l’anticorps de révélation utilisé, dirigé contre la partie constante des anticorps, il est possible de détecter les anticorps totaux ou une classe d’anticorps en particulier, les IgM, IgA et IgG étant les plus recherchés. Il est possible de les rechercher dans différentes matrices bien que les fluides des muqueuses (lait, sécrétion bronchique, salive…) entraînent un signal aspécifique plus important. Bien qu’il nécessite la mise au point de nombreuses étapes, le développement d’un Elisa « maison » (figure 3) est facilement réalisable en termes de ressources, ce qui en fait un outil de diagnostic très répandu. Comme tout outil de sérodiagnostic, l’Elisa est caractérisé par :
-
◗
sa sensibilité qui représente sa capacité à détecter les patients immunisés ;
-
◗
sa spécificité qui représente sa capacité à ne pas détecter les patients non-immunisés ;
-
◗
sa performance qui est fonction de la sensibilité, la spécificité et la séroprévalence de la population.
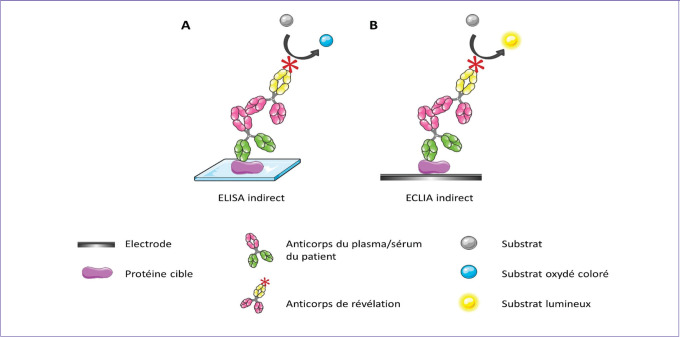
Figure 2.
Différences entre un Elisa indirect et un Eclia indirect.
A. Dans un Elisa, la protéine cible est adsorbée sur une surface en polystyrène. Dans le cas d’un résultat positif le substrat, oxydé par une peroxydase couplée à l’anticorps de détection, devient coloré. L’absorbance de ce composé est mesurée par un spectrophotomètre.
B. Dans un Eclia, les étapes expérimentales sont les mêmes mais la protéine cible est adsorbée sur une électrode. Dans le cas d’un résultat positif le substrat émet de la lumière par transfert d’électron après stimulation électrique. L’intensité lumineuse est mesurée par un tube photomultiplicateur ou une caméra.
© J. Denis – Servier médical art
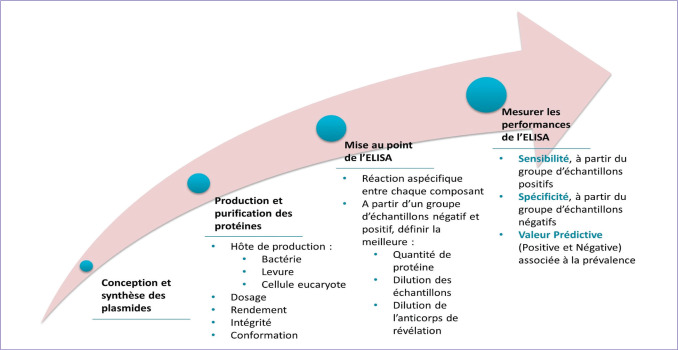
Figure 3.
Étapes majeures de la mise au point d’un Elisa.
La production et la purification des protéines nécessitent des étapes de mise au point non détaillées ici. L’intégrité et la conformation des protéines ainsi que le rendement de production peuvent être améliorés en changeant d’hôte de production (bactérie, levure, cellule eucaryote). Dans l’idéal, la mise au point de l’Elisa nécessite un troisième groupe d’échantillons négatifs pour la cible mais positifs pour une cible du plus proche parent afin de s’affranchir des réactions croisées contre les pathogènes de la même famille. La sensibilité représente la capacité à détecter les personnes immunisées tandis que la spécificité représente la capacité à ne pas détecter les non-immunisés. La Valeur Prédictive Positive (VPP) est la probabilité que le patient soit immunisé si le test est positif tandis que la Valeur Prédictive Négative (VPN) est la probabilité que le patient soit non-immunisé si le test est négatif.
© J. Denis– Servier médical art
Cette performance est représentée par la valeur prédictive positive (VPP) qui est la probabilité que le patient soit immunisé quand le test est positif et la valeur prédictive négative (VPN) qui est la probabilité que le patient soit non-immunisé quand le test est négatif. Pour calculer ces différents indicateurs, il est impératif de disposer d’échantillons de patients positifs, immunisés contre la cible et des échantillons de patients négatifs, non-immunisés contre la cible. Dans l’idéal, la mise au point nécessite l’utilisation d’un troisième groupe d’échantillons de patients négatifs qui sont non-immunisés contre la cible mais immunisés contre la cible du plus proche parent afin de s’affranchir des réactions croisées contre les pathogènes de la même famille. L’accès à ce type d’échantillons est souvent difficile et donc peu réalisable en pratique. En revanche, il peut être intéressant de tester également des échantillons issus de patients non-immunisés mais ayant des pathologies auto-immunes ou hématologiques pouvant entraîner là aussi des réactions croisées. Les résultats de ces tests peuvent être qualitatifs, ce qui est très souvent suffisant pour le sérodiagnostic ou les études épidémiologiques. Mais ils nécessitent d’être quantitatifs pour mesurer un titre si un seuil de protection a été défini comme corrélat de protection. Il faut alors disposer d’un anticorps monoclonal titré ou d’un sérum de référence pour établir une gamme d’étalonnage. Ces tests quantitatifs sont très intéressants pour le suivi dans le temps de la réponse immunitaire.
Bien que ces essais simplex soient très fréquemment utilisés en sérodiagnostic et qu’ils présentent des résultats précis, ils sont très ciblés et n’étudient la réponse immunitaire que contre un seul antigène d’un seul pathogène à la fois. L’arrivée du multiplexage a permis de faire évoluer le sérodiagnostic en étudiant différentes cibles d’un même pathogène ou de plusieurs pathogènes. Ces essais nécessitent un développement plus long et plus complexe mais ils se révèlent très avantageux en termes de coût et de temps pour une exploration clinique complète. L’Eclia a ainsi été adapté en multiplex et des kits commercialisés par Meso Scale Discovery (MSD®) permettent de tester jusqu’à dix cibles différentes par puits. Une autre technologie, basée sur l’utilisation de microbilles et de fluorescence (technologie Luminex®), permet de tester en théorie cent cibles différentes simultanément mais la multiplication des cibles diminue fortement les performances de l’essai dû à la réactivité croisée des différents anticorps.
Dans cette technologie, les cibles liées de façon covalente aux microbilles fluorescentes sont incubées avec les échantillons des patients puis l’anticorps de révélation couplé à un fluorochrome. Des étapes de lavage ont lieu entre chaque étape puis les résultats sont lus avec un fluorimètre en flux. La lecture se fait à deux niveaux :
-
◗
dans un premier temps, la fluorescence de la bille est mesurée pour déterminer quelle cible est étudiée ;
-
◗
dans un second temps, la fluorescence de l’anticorps de révélation est mesurée pour quantifier les anticorps du patient dirigés contre cette cible.
Le tableau 1 compare l’Elisa ou l’Eclia simplex à ces deux technologies de multiplexage (MSD® et Luminex®). Ces outils de diagnostic sont rapides et spécifiques mais ne reflètent pas le caractère fonctionnel de la réponse immunitaire mise en évidence. Seul l’Elisa de compétition peut donner une approximation du caractère neutralisant des anticorps. Ce pouvoir neutralisant est fonction de l’affinité et de l’avidité des anticorps. L’affinité caractérise l’intensité d’interaction entre le paratope et l’épitope d’un couple anticorps/antigène et l’avidité caractérise la force globale d’interaction de plusieurs couples anticorps/antigènes dans un complexe immun. L’avidité prend donc en compte la valence des anticorps et des antigènes, elle pourrait se résumer par la somme de toutes les affinités du complexe immun. De nombreux Elisa de compétition de différentes configurations ont d’ailleurs été développés dans le cadre de la pandémie de Sars-CoV-2 [8]. Dans celui proposé par Byrnes et al., la protéine RBD (receptor binding domain) du Sars-CoV-2 est adsorbée au fond du puits puis l’échantillon du patient et le récepteur ACE-2 (angiotensin I converting enzyme 2) du Sars-CoV-2 sont incubés en même temps sur l’antigène. Après une étape de lavage, l’anticorps de révélation est incubé et permet de détecter les anticorps du patient [9]. Ces anticorps sont dits neutralisants car ils présentent une forte affinité pour l’antigène ne permettant pas au récepteur ACE-2 de prendre sa place en se liant à la cible. Ces Elisa de compétition sont très avantageux pour étudier une pseudo-fonctionnalité des anticorps car ils sont rapides, de faible coût et ne nécessitent pas de laboratoire de sécurité biologique. Cependant ils ne caractérisent la réponse immunitaire que vis-à-vis d’un seul antigène et ne prennent pas en compte l’avidité des anticorps.
Tableau 1.
Comparaison des techniques Elisa simplex, Eclia multiplex et des tests multiplex par fluorescence sur billes.
| Elisa simplex | Eclia multiplex (Technologie MSD®) | Test multiplex par fluorescence sur billes (Technologie Luminex®) | |
|---|---|---|---|
| Nombre de cibles | 1 | Jusqu’à 10 analytes | Jusqu’à 100 analytes (théorie) |
| Support analytique, système de revêtement | Surface 2D en polystyrène, adsorbtion | Surface 2D en électrode de carbone, adsorbtion | Surface 3D en microbilles magnétiques, liaison covalente |
| Système de révélation | Colorimétrie | Luminescence | Fluorescence |
| Équipement de lecture | Spectrophotomètre | Tube photomultiplicateur ou caméra | Fluorimètre en flux |
| Temps d’expérimentation | 5 heures | 5 heures 30 | 4 heures 10 |
| Temps de lecture/plaque 96 puits | 10 secondes | 2 minutes 30 | 1 heure 30 |
| Sensibilité | ++ | +++ | + |
| Coût/analyte | ++ | + | + |
| Automatisable | Oui | Oui | Non |
| Quantifiable | Oui | Oui | Oui |
| Avantages | • Développement «maison» facile • Grande diversité de cibles |
• Limite basse de quantification (ultra sensible) •Utilisation de faible quantité d’échantillon •Évite les problèmes d’extinction, « quenching » •Adaptation des kits « maison » réalisable • Reproductibilité |
• Limite haute de quantification importante •Utilisation de faible quantité d’échantillon •Grande diversité de cibles • Adaptation des kits « maison » réalisable |
| Inconvénients | • Utilisation de quantité importante d’échantillon | • Electrode fragile | • Perte des billes fréquente • Perte de sensibilité avec l’ajout d’analytes |
Les tests fonctionnels
La séroneutralisation
Le test de séroneutralisation mis en place dans les laboratoires de sécurité biologique permet de mesurer ce pouvoir neutralisant tout en prenant en compte l’avidité des anticorps. Le principe est présenté dans la figure 4 . Les cellules sont mises en culture dans des plaques 96 puits jusqu’à l’obtention d’un tapis cellulaire confluant à 80 % afin de réaliser l’expérimentation. Les sérums de patients sont alors dilués en série puis incubés avec les particules virales afin de permettre la formation du complexe immun. Chaque cocktail de dilution est ensuite transféré sur le tapis cellulaire d’un puits, incubé pendant une heure puis remplacé par du milieu de culture frais. Les cellules sont alors incubées pour une durée variant selon le virus étudié. La lecture se fait au microscope et l’apparition des effets cytopathiques (ECP) est recherchée par l’expérimentateur. Le résultat est rendu sous forme de titre de séroneutralisation correspondant à la dilution la plus forte pour laquelle aucun ECP n’a été observé, soit la plus forte dilution à laquelle le sérum neutralise les particules virales. Bien que l’obtention des résultats soit longue, 3-4 jours à 1 semaine, et qu’aucun système de lecture ne soit automatisé, elle est considérée comme le Gold Standard pour l’étude de la neutralisation des anticorps. Ce type de test nécessite des laboratoires de confinement biologique adaptés à l’agent infectieux et n’est donc pas réalisable en laboratoire de biologie médicale de ville.
Figure 4.
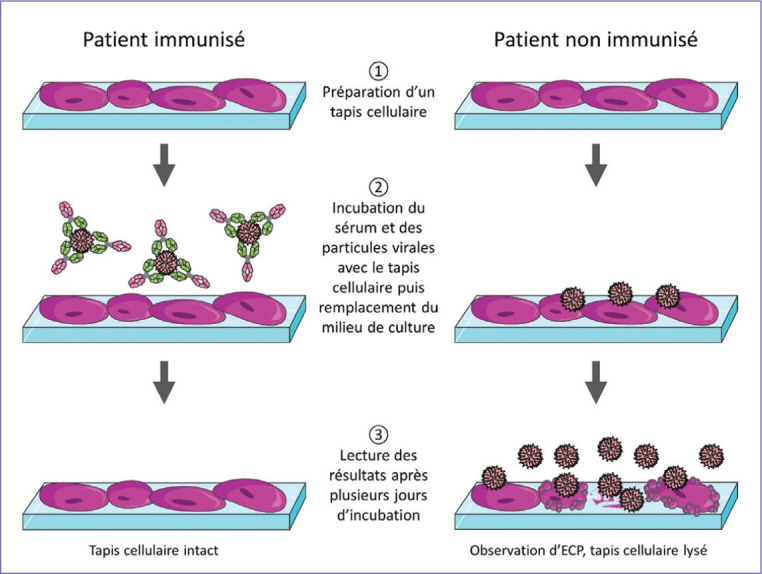
Principe du test de séroneutralisation.
Les cellules sont cultivées en plaques 96 puits jusqu’à l’obtention d’un tapis cellulaire confluent à 80% afin de réaliser l’expérimentation. Les sérums de patients sont alors dilués en série puis incubés avec les particules virales afin de permettre la formation du complexe immun. Chaque cocktail de dilution est ensuite transféré sur le tapis cellulaire d’un puits, incubé pendant une heure puis remplacé par du milieu de culture frais. Les cellules sont alors incubées pour une durée variable selon le virus étudié. La lecture se fait au microscope et l’apparition des effets cytopathiques (ECP) est recherchée par l’expérimentateur. Le résultat est rendu sous forme de titre de séroneutralisation correspondant à la dilution la plus forte pour laquelle aucun ECP n’a été observé, soit la plus forte dilution à laquelle le sérum neutralise les particules virales.
© J. Denis– Servier médical art
Cytotoxicité et phagocytose induite par les anticorps
Les tests fonctionnels permettant de rechercher l’induction de cytotoxicité cellulaire dépendante des anticorps (ADCC), de cytotoxicité dépendante du complément (CDC) ou de phagocytose dépendante des anticorps (ADCP) sont utilisés chez l’homme en recherche au cours des essais cliniques vaccinaux mais ne sont pas validés pour le diagnostic de routine en laboratoire. Ils nécessitent d’être réalisés dans des laboratoires de niveau de sécurité biologique adaptés à l’agent infectieux étudié. Les cellules infectées par l’agent pathogène d’intérêt sont incubées avec les sérums de patients, puis l’ajout de cellules mononuclées issues du sang périphérique (PBMC) comprenant des lymphocytes NK permet de rechercher la présence d’ADCC. L’ajout du complément permet d’étudier l’induction de CDC. Suite à ces incubations, un marqueur de viabilité cellulaire fluorescent est ajouté puis les cellules sont analysées au cytomètre en flux. Le pourcentage de mortalité des cellules infectées en présence ou en l’absence du sérum de personnes immunisées permet d’attester de l’induction d’une lyse cellulaire par le mécanisme étudié. L’ADCP peut être évaluée en mesurant l’incorporation de fluorescence par les macrophages grâce à l’association de l’antigène cible à des billes fluorescentes. Enfin, l’ADE peut être explorée en mesurant l’incorporation d’un pathogène fluorescent sur une lignée cellulaire exprimant le FcgRII [10]. Tous ces tests fonctionnels, dont la mise en œuvre est plus complexe, souffrent souvent d’un manque de reproductibilité dûs en partie à la variabilité biologique interindividuelle. Afin d’améliorer la reproductibilité et la réalisation de ces tests fonctionnels, des cellules rapportrices ont été développées pour étudier l’ADCC (médiée par le CD16A) et l’ADCP (médiée par le CD32A). C’est le cas de lymphocytes T modifiés exprimant les récepteurs au fragment constant des anticorps (CD16 ou CD32) et un rapporteur : la luciférase. Les cellules infectées incubées avec les sérums de personnes immunisées sont mises en contact avec les lymphocytes T modifiés. La fixation du Fc des anticorps sur les récepteurs CD16 et/ou CD32 va déclencher une production de luciférase dans la cellule rapportrice. Cette luciférase pourra, après ajout d’un substrat, produire de la luminescence qui sera mesurée par un tube photomultiplicateur.
Enfin, il faut garder à l’esprit que les résultats de ces tests fonctionnels in vitro ne reflètent pas toujours la réalité observée in vivo et doivent donc être interprétés avec prudence. Ils ne sont pas utilisés en routine.
Les méthodes d’étude de l’immunité cellulaire
Les méthodes d’étude de l’immunité cellulaire sont rarement disponibles en laboratoire de biologie médicale. Le premier agent infectieux bénéficiant de tests commerciaux utilisés en routine est la tuberculose, avec deux tests fonctionnels détectant la synthèse de l’IFNγ par les lymphocytes T spécifiques de Mycobacterium tuberculosis (QuantiFERON® et T.Spot-TB®). Cependant, les indications de ces tests sont plus à visées épidémiologique et diagnostique qu’une évaluation de la qualité de la réponse vaccinale. Pourtant, cette évaluation peut s’avérer cruciale pour certains agents infectieux car la réponse humorale n’est qu’une partie de la réponse immunitaire à l’infection ou la vaccination, et ne corrèle pas systématiquement avec la protection. Ces tests sont aujourd’hui disponibles également pour le Sars-CoV-2 (QuantiFERON® Sars-CoV-2 et T.Spot-Covid®). Nous allons décrire les méthodes d’étude de l’immunité cellulaire permettant de mesurer la qualité, la quantité et la fonctionnalité des lymphocytes T. Bien que manquant de standardisation, les méthodes utilisées de façon courante sont :
-
◗
le phénotypage et la caractérisation des sous-populations lymphocytaires d’intérêt ;
-
◗
des tests fonctionnels évaluant la réponse cytokinique, la prolifération lymphocytaire T ou encore la cytotoxicité antigène-dépendante.
-
◗
Enfin, nous décrirons succinctement l’approche actuelle de biologie systémique intégrative (immunoprofilage) dont les analyses bioinformatiques par des méthodes de machine learning permettent d’identifier de façon plus précise des corrélats de protection.
Phénotypage lymphocytaire
La numération formule sanguine ne donne qu’un aperçu de la quantité de cellules immunitaires présentes dans le sang, sans pouvoir dissocier les sous-types cellulaires d’intérêt caractérisés par l’expression de marqueurs de surface membranaire. Un immunophénotypage plus poussé est indispensable pour évaluer la quantité et la qualité de la réponse. La cytométrie en flux est la méthode de référence pour l’immunophénotypage car c’est une méthode à haut débit qui permet d’étudier de façon simultanée plusieurs marqueurs de surface grâce à l’immunofluorescence. Les anticorps dirigés contre les antigènes de surfaces cellulaires sont couplés à des fluorochromes. Lors du passage de la cellule dans le système fluidique du cytomètre, les fluorochromes sont excités par différents lasers et une onde d’émission spécifique est enregistrée en présence du fluorochrome d’intérêt à la surface de la cellule. La cytométrie en flux permet d’évaluer en routine de 8 à 18 marqueurs de façon simultanée. Les progrès technologiques permettent aujourd’hui de monter ce multiparamétrage à près de 50 marqueurs. Cependant, les limites d’analyses liées au chevauchement des spectres de fluorescence nécessitent d’interpréter les résultats avec prudence dès lors qu’on multiplie les cibles.
La réponse humorale n'est qu'une partie de la réponse immunitaire à l'infection ou à la vaccination
La cytométrie de masse et la cytométrie spectrale sont des techniques plus récentes mais moins accessibles en routine. La cytométrie de masse utilise la spectrométrie de masse pour identifier les métaux lourds utilisés pour le marquage (plus de 50 marquages simultanés), ce qui évite les problématiques de chevauchement de spectre de fluorescence de la cytométrie conventionnelle. Son débit est par contre beaucoup plus lent et cette technique n’ouvre pas d’opportunité de tri cellulaire. La cytométrie spectrale permet de limiter l’impact de l’autofluorescence en recueillant l’ensemble du spectre émis par un fluorochrome. Peu d’appareils sont déployés au sein des instituts de recherche à ce jour. Les marquages peuvent être faits sur toute préparation cellulaire en suspension. Dans le cadre de la réponse à la vaccination, on privilégiera le sang total ou les PBMCs. Les marquages de surfaces permettent à la fois de différencier les lignages cellulaires, les états d’activation cellulaire, et le potentiel de migration tissulaire (dits marqueurs de « homing »). Les marqueurs de lignages cellulaires et de mémoire permettent de différencier les lymphocytes T CD4+ (CD3+CD4+) et CD8+ (CD3+CD8+) et leurs sous-populations mémoires et effectrices à l’aide, par exemple, des marqueurs CD197 (ou CD27) et CD45RA (ou CD45RO) : cellules T effectrices mémoires Tem (CD197-CD45RA-), cellules T mémoires centrales Tcm (CD197+CD45RA-), cellules T mémoires effectrices de différentiation terminale Temra (CD197-CD45RA+) et cellules T naïves (CD197+CD45RA+). L’expression du marqueur CXCR5 de homing ganglionnaire par des lymphocytes T CD4+ est caractéristique des cellules Tfh nécessaires à la maturation des lymphocytes B dans les centres germinatifs des ganglions lymphatiques [11]. Enfin, les lymphocytes Treg expriment les marqueurs de surface CD3, CD4 et CD25 mais n’expriment pas CD127 [12]. Cependant le marqueur CD25 est surexprimé après activation cellulaire et l’identification certaine des Treg repose alors sur le marquage intranucléaire du facteur de transcription FoxP3.
Pour isoler les lymphocytes T spécifiques d’un antigène, il faut auparavant stimuler les cellules ex vivo par cet antigène. La stimulation peut se faire par l’agent infectieux (inactivé le plus souvent), une protéine issue de l’agent infectieux ou des peptides correspondant à des épitopes T spécifiques (CD8 ou CD4). Les cellules spécifiques de l’antigène peuvent ensuite être isolées selon deux méthodes :
-
◗
la technique de marquage des tétramères ;
-
◗
l’association de marqueurs d’activation cellulaire (méthode AIM pour « Activation-induced markers assay »).
Les tétramères comportent quatre complexes associant un peptide synthétique spécifique d’un antigène et un marqueur d’histocompatibilité, couplés à un fluorochrome. Il existe aujourd’hui des pentamères et dextramères qui multimérisent ces complexes pour plus d’efficacité de reconnaissance. Ces complexes lient un récepteur T spécifique de l’épitope antigénique. L’avantage de cette méthode est qu’elle est très spécifique et reproductible. L’inconvénient majeur est qu’elle est restreinte à un épitope donné et donc dépendante du statut HLA de l’individu. Pour mesurer une réponse spécifique d’un antigène sur plusieurs individus, la méthode AIM est plus adaptée [13]. La présence de deux marqueurs d’activation spécifiques d’un type cellulaire après stimulation ex vivo (par exemple CD154 et CD69 pour les lymphocytes T CD4+, ou CD137 et CD69 pour les lymphocytes T CD8+) permet d’isoler les cellules spécifiques de cet antigène. Il est par contre impératif de prendre en compte le potentiel bruit de fond représenté par les cellules activées d’un individu au moment du prélèvement sanguin. Ce bruit de fond sera facilement identifié par un puits contrôle non stimulé. La figure 5 représente un exemple de stratégie d’immunophénotypage post-vaccinale au cours d’un essai clinique de phase I par cytométrie en flux [14].
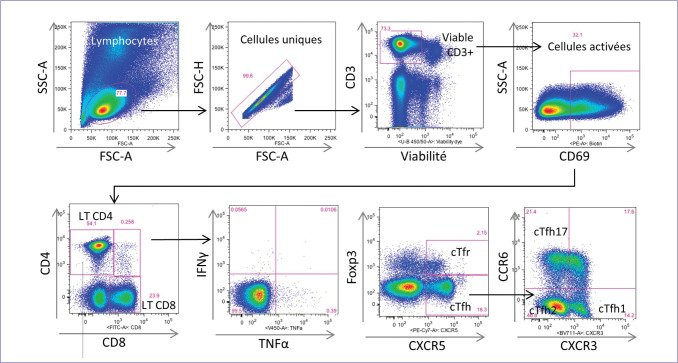
Figure 5.
Exemple de stratégie de phénotypage des lymphocytes T associée à un marquage intracytoplasmique des cytokines.
La stratégie décrite permet d’isoler les populations de lymphocytes T CD4 (LT CD4) et CD8 (LT CD8) activés sécrétant de l’IFNγ et/ou du TNFα ainsi que les lymphocytes T folliculaires helper (cTfh) et régulateurs (cTfr) et leurs sous-types fonctionnels (cTfh1, cTfh2, cTfh17). Le facteur de transcription Foxp3 est exprimé par les lymphocytes T régulateurs et le marqueur CXCR5 permet d’isoler les populations folliculaires.
© M. Mura.– Servier médical art
Tests fonctionnels
Les tests fonctionnels sont essentiels pour évaluer la qualité et le sous-type de réponse lymphocytaire (Th1, Th2, Th17 et T régulatrice) engendrée par la stimulation antigénique. Les méthodes les plus courantes sont basées sur l’analyse de la réponse cytokinique.
ELISpot (enzyme-linked immunosorbent spot)
L’ELISpot est une technique de quantification des lymphocytes spécifiques d’un antigène par mesure de la capacité de sécrétion d’un analyte spécifique de la réponse immunitaire. C’est une méthode adaptable à différents types cellulaires (lymphocytes B et T), différents analytes de l’immunité (cytokines, chémokines, anticorps), différents systèmes de détection (fluorescence, immunoenzyme) et différents modes d’analyse (détection simple ou multiple). Il est facile à standardiser et peu cher. La lecture des spots peut se faire à l’œil nu ou à l’aide d’un lecteur automatisé pour améliorer la reproductibilité des résultats.
Le test ELISpot classique mesure la quantité de lymphocytes T sécrétant de l’IFN-γ après stimulation antigénique (figure 6) . Pour cela, les lymphocytes extraits du sang total sont stimulés par l’antigène d’intérêt (agent infectieux inactivé, protéine, peptide spécifique ou pool de peptides) et déposés dans des puits recouverts d’anticorps de capture de l’IFN-γ pour une durée de 18 à 36 heures selon les protocoles. Après incubation, les cellules sont lavées et l’analyte est révélé par un anticorps secondaire couplé à un système de détection, habituellement par biotinylation révélé par réaction enzymatique. Chaque lymphocyte sécrétant de l’IFN-γ engendrera un spot de marquage. La quantification du nombre de spots permet de définir le nombre de lymphocytes T spécifiques de l’antigène sécrétant de l’IFN-γ.
Figure 1.
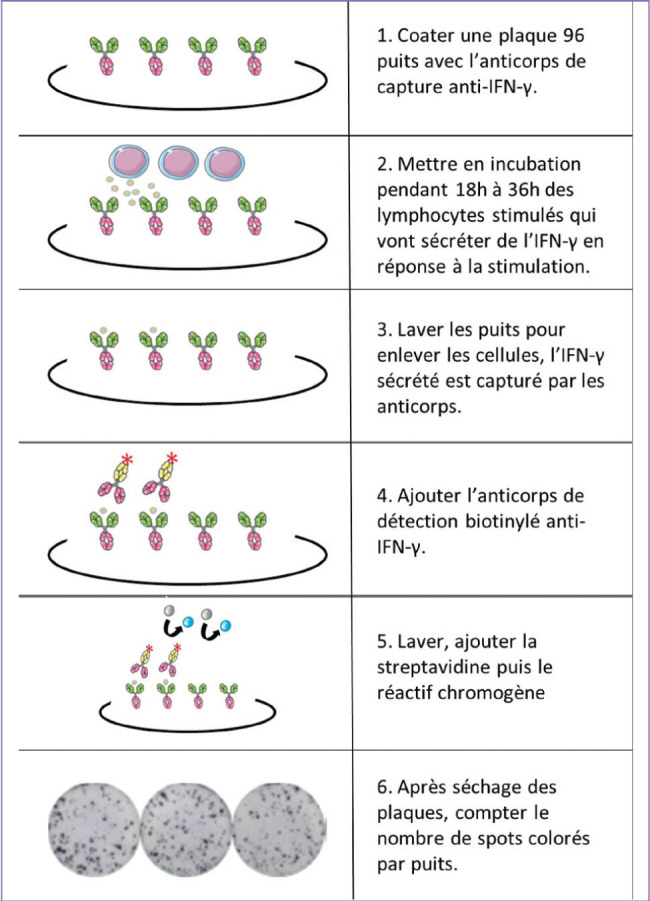
Principe du test ELISpot.
La technique ELISpot à IFNγ permet d’identifier par des spots colorés la présence de lymphocytes T spécifiques de l’antigène, sécrétant de l’IFNγ en réponse à la stimulation cellulaire. La technique est quantitative, chaque spot coloré correspondant à un lymphocyte activé. Les résultats s’expriment habituellement en nombre de spots par million de cellules. Il existe également des ELISpot pour lymphocytes B permettant de quantifier le nombre de plasmocytes sécrétant des immunoglobulines contre une cible déterminée.
© M. Mura.– Servier médical art
C’est une méthode robuste et reproductible mais qui ne donne pas d’information sur le phénotype des cellules spécifiques de l’antigène. Elle reste réductrice dans son information par la mesure d’un seul analyte (ou jusqu’à trois avec un système de détection basé sur la fluorescence ou FluoroSpot).
Marquage intracytoplasmique des cytokines (ICS)
La cytométrie en flux permet de mesurer la présence de cytokines dans le cytoplasme cellulaire après stimulation puis blocage de la migration des vésicules depuis le Golgi pour empêcher la sécrétion des cytokines. Après une première étape de marquage de surface, la cellule est fixée puis imperméabilisée pour le marquage de cytokines intracellulaires. L’avantage de cette méthode est de disposer à la fois du phénotype cellulaire et de la fonctionnalité des cellules spécifiques de l’antigène. Classiquement, le marquage de l’IFN-γ et du TNF-a permet de mettre en évidence une réponse Th1. Le marquage de l’IL-4, de l’IL-5 et/ou de l’IL-13 révèle un profil de réponse Th2. L’IL-17, IL-21 et IL-22 sont associées au profil de réponse Th17, et l’IL-10 à une réponse de type régulatrice. La quantité de cellules spécifiques de l’antigène sécrétant des cytokines après vaccination est habituellement faible. Le recours à un enrichissement cellulaire préalable basé sur un marqueur d’activation cellulaire (par exemple CD154, CD137 ou CD69) améliore la sensibilité du test [15]. Bien qu’apportant des réponses plus complètes qu’un ELISpot, cette méthode est moins standardisée et moins reproductible d’un laboratoire à un autre, avec un coût supplémentaire en termes d’équipement et de formation.
Dosage des cytokines circulantes
Les cytokines sécrétées en réponse à une stimulation antigénique peuvent être dosées par des méthodes immunoenzymatiques classiques, principalement l’Elisa (qui peut être un Elisa direct, indirect, sandwich ou compétitif). Par exemple, le test QuantiFERON® permet de doser par Elisa l’IFN-γ sécrété par les lymphocytes T en réponse à des protéines mycobactériennes. Ce test a progressivement remplacé l’intradermoréaction à la tuberculine.
Plusieurs plateformes technologiques permettent de multiplexer le dosage des cytokines dans le plasma ou dans le surnageant de PBMCs stimulés ex vivo. La plateforme technologique Luminex® associe le principe d’un Elisa combiné à la cytométrie en flux pour multiplexer le dosage d’analytes. Cette technologie est très flexible grâce à ses microbilles fluorescentes et permet de doser jusqu’à 500 analytes simultanément. La plateforme Meso Scale Discovery® utilise le principe d’un Eclia multiplexé grâce à 10 micropuits. Cette séparation physique du multiplexage est un avantage certain en termes de reproductibilité et de sensibilité du test, mais limite les capacités d’analyse simultanée au dosage de 10 analytes. D’autres techniques ultra-sensibles (fg/mL) comme la technique Simoa (Single molecule array) basée sur une technologie d’Elisa digitale sont aujourd’hui disponibles mais avec pour l’instant un coût élevé et peu d’analytes disponibles par rapport aux autres technologies. Les multiplexages ont l’avantage majeur d’utiliser une quantité minime d’échantillon biologique (plasma ou sérum).
Tests de prolifération lymphocytaire T
La mesure de la prolifération lymphocytaire en réponse à une stimulation antigénique est une méthode traditionnelle peu utilisée aujourd’hui pour l’étude de la réponse post-vaccinale. Le gold-standard a été pendant de longues années la mesure de l’incorporation de nucléosides radioactifs (thymidine tritiée). Les alternatives reposent sur le marquage en cytométrie en flux de Ki-67, un antigène nucléaire présent dans les cellules en division, ou plus fréquemment par des analyses de prolifération par dilution de colorant utilisant le CFSE (Carboxyfluorescéine succinimidyl ester). La capacité de CFSE à marquer les cellules avec une haute intensité de fluorescence et une très faible toxicité cellulaire permet de visualiser jusqu’à 8 divisions cellulaires. L’intensité du signal fluorescent est divisée par deux à chaque division cellulaire. Cette approche a l’avantage de pouvoir être combinée au phénotypage lymphocytaire. Les inconvénients des tests de prolifération lymphocytaire sont leur durée (5 à 7 jours de culture) et leur grande variabilité inter-expérimentale.
Test de cytotoxicité cellulaire
La cytotoxicité médiée par les lymphocytes T CD8 cytotoxiques est un élément essentiel de la réponse vaccinale pour détruire les cellules infectées. Plusieurs approches ont été développées mais le consensus se porte à ce jour sur le marquage par cytométrie en flux de CD107a (marqueur de dégranulation) à la surface cellulaire et du granzyme B et/ou de la perforine en intracellulaire pour démontrer de façon indirecte les fonctions cytotoxiques des lymphocytes T CD8+.
La biologie des systèmes
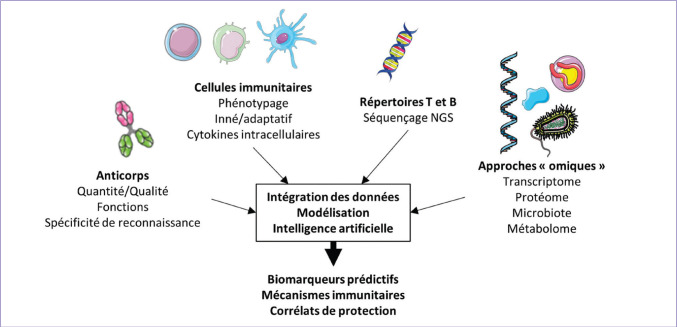
Jusqu’à très récemment, les réponses immunitaires post-vaccinales étaient étudiées de façon fragmentaire, en ciblant a priori les composants majeurs de la réponse adaptative. Or les avancées technologiques liées aux approches « omiques » et une compréhension plus profonde des mécanismes immunitaires de la réponse anti-infectieuse ouvrent des perspectives d’analyses des réponses immunitaires sans a priori (figure 7) . Cette approche en biologie de systèmes permet d’explorer plus en profondeur le système immunitaire en incluant la quantité, la qualité, la fonctionnalité et la spécificité de reconnaissance des anticorps :
-
◗
un large phénotypage des cellules immunitaires innées et adaptatives ;
-
◗
l’analyse du répertoire des récepteurs T et des immunoglobulines par séquençage de dernière génération ;
-
◗
les niveaux d’expression des gènes des cellules immunitaires (RNAseq ou puces à ARN, avec des approches en single cell) ;
-
◗
le statut métabolique des cellules immunitaires (métabolomique).
Figure 7.
Exploration de la réponse immunitaire par une approche en biologie de systèmes.
Exploration de la réponse immunitaire par une approche en biologie de systèmes pour étudier sans a priori les mécanismes immunitaires mis en oeuvre par la vaccination et identifier des biomarqueurs prédictifs de la protection vaccinale.
© M. Mura.– Servier médical art
Les outils bioinformatiques d’intégration des données utilisant des techniques d’intelligence artificielle pour modéliser la réponse vaccinale ouvrent les perspectives d’identification de corrélats de protection malgré la variabilité de la réponse interindividuelle [[14], [16], [17], [18]].
Conclusion
La compréhension de la réponse immunitaire à une vaccination fait l’objet de travaux qui partent de l’exploration très fondamentale de la réponse immunitaire, aux études de cohortes sur de nombreux patients. L’essentiel des mécanismes d’action des vaccins nous reste empirique et mal connu. Il est désormais clair qu’avec la biologie de systèmes le décryptage de la réponse immunitaire va s’améliorer dans le futur. L’émergence du Sars-CoV-2 et son contrôle par une approche de vaccination de masse nous rappelle combien les besoins de connaissance dans ces domaines sont importants.
Déclaration de liens d’intérêts : les auteurs déclarent ne pas avoir de liens d'intérêts.
Points à retenir
-
◗
Les vaccins miment les phases précoces d’une infection en exposant des antigènes activant l’immunité innée puis les mécanismes de l’immunité adaptative dont les principaux effecteurs sont, pour la compo-sante humorale, les anticorps sécrétés par les lymphocytes B et, pour la composante cellulaire, les lymphocytes T CD4 et CD8.
-
◗
Les corrélats de protection peuvent être mécanistiques, c’est-à-dire responsables de la protection, ou non mécanistiques, c’est-à-dire qu’ils ne sont que le reflet d’une réponse immunitaire plus complexe mais plus difficile à mesurer.
-
◗
L’étude de la réponse humorale se fait à travers de tests standardisés d’étude de l’interaction des anticorps des fluides biologiques avec leurs antigènes et mesurant l’apparition d’un composé coloré (Elisa) ou luminescent (Eclia), ou par des tests fonctionnels comme la séroneutralisation ou l’étude de la cytotoxicité et de la phagocytose induite par les anticorps.
-
◗
L’étude de la réponse cellulaire ne se fait pas en pratique de biologie courante mais des techniques existent basées sur le phénotypage et la caractérisation des sous-populations lymphocytaires d’intérêt en cytométrie de flux, ou bien des tests fonctionnels évaluant la réponse cytokinique, la prolifération lymphocytaire T ou encore la cytotoxicité antigène-dépendante, ou encore l’approche de biologie systémique intégrative (immunoprofilage) avec des analyses bioinformatiques par des méthodes de machine learning.
Références
- 1.Janeway C.A. Approaching the asymptote? Evolution and revolution in immunology. Cold Spring Harb Symp Quant Biol. 1989;54(1):1–13. doi: 10.1101/sqb.1989.054.01.003. [DOI] [PubMed] [Google Scholar]
- 2.Lemaitre B., Nicolas E., Michaut L., et al. The Dorsoventral Regulatory Gene Cassette spätzle/Toll/cactus Controls the Potent Antifungal Response in Drosophila Adults. Cell. 1996;86(6):973–983. doi: 10.1016/s0092-8674(00)80172-5. [DOI] [PubMed] [Google Scholar]
- 3.Worbs T., Hammerschmidt S.I., Förster R. Dendritic cell migration in health and disease. Nat Rev Immunol. 2017;17(1):30–48. doi: 10.1038/nri.2016.116. [DOI] [PubMed] [Google Scholar]
- 4.Alu A., Chen L., Lei H., et al. Intranasal COVID-19 vaccines: From bench to bed. EBioMedicine. 2022;76:103841. doi: 10.1016/j.ebiom.2022.103841. doi: 10.1016/j.ebiom.2022.103841. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Sette A., Crotty S. Adaptive immunity to SARS-CoV-2 and COVID-19. Cell. 2021;184(4):861–880. doi: 10.1016/j.cell.2021.01.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Plotkin S.A. Updates on immunologic correlates of vaccine-induced protection. Vaccine. 2020;38(9):2250–2257. doi: 10.1016/j.vaccine.2019.10.046. [DOI] [PubMed] [Google Scholar]
- 7.Narayan R., Tripathi S. Intrinsic ADE: The Dark Side of Antibody Dependent Enhancement During Dengue Infection. Front Cell Infect Microbiol. 2020;10:580096. doi: 10.3389/fcimb.2020.580096. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Shalash A.O., Azuar A., Madge H.YR., et al. Detection and Quantification of SARS-CoV-2 Receptor Binding Domain Neutralization by a Sensitive Competitive ELISA Assay. Vaccines. 2021;9(12):1493. doi: 10.3390/vaccines9121493. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Byrnes J.R., Zhou X.X., Lui I., et al. Competitive SARS-CoV-2 Serology Reveals Most Antibodies Targeting the Spike Receptor-Binding Domain Compete for ACE2 Binding. mSphere. 2020;5(5):e00802–e00820. doi: 10.1128/mSphere.00802-20. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Zhou Y., Liu Z., Li S., Xu W., et al. Enhancement versus neutralization by SARS-CoV-2 antibodies from a convalescent donor associates with distinct epitopes on the RBD. Cell Rep. 2021;34(5):108699. doi: 10.1016/j.celrep.2021.108699. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Breitfeld D., Ohl L., Kremmer E., et al. Follicular B Helper T Cells Express Cxc Chemokine Receptor 5, Localize to B Cell Follicles, and Support Immunoglobulin Production. J Exp Med. 2000;192(11):1545–1552. doi: 10.1084/jem.192.11.1545. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Yu N., Li X., Song W., et al. CD4+CD25+CD127low/− T Cells: A More Specific Treg Population in Human Peripheral Blood. Inflammation. 2012;35(6):1773–1780. doi: 10.1007/s10753-012-9496-8. [DOI] [PubMed] [Google Scholar]
- 13.Bowyer G., Rampling T., Powlson J., et al. Activation-induced Markers Detect Vaccine-Specific CD4+ T Cell Responses Not Measured by Assays Conventionally Used in Clinical Trials. Vaccines. 2018;6(3):50. doi: 10.3390/vaccines6030050. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Mura M., Lu P., Atre T., et al. Immunoprofiling Identifies Functional B and T Cell Subsets Induced by an Attenuated Whole Parasite Malaria Vaccine as Correlates of Sterile Immunity. Vaccines. 2022;10(1):124. doi: 10.3390/vaccines10010124. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Mura M., Chaudhury S., Farooq F., et al. Optimized flow cytometric protocol for the detection of functional subsets of low frequency antigen-specific CD4+ and CD8+ T cells. MethodsX. 2020;7:101005. doi: 10.1016/j.mex.2020.101005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Kazmin D., Nakaya H.I., Lee E.K., et al. Systems analysis of protective immune responses to RTS,S malaria vaccination in humans. Proc Natl Acad Sci USA. 2017;114(9):2425–2430. doi: 10.1073/pnas.1621489114. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Petitdemange C., Kasturi S.P., Kozlowski P.A., et al. Vaccine induction of antibodies and tissue-resident CD8+ T cells enhances protection against mucosal SHIV-infection in young macaques. JCI Insight. 2019;4(4):e126047. doi: 10.1172/jci.insight.126047. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Querec T.D., Akondy R.S., Lee E.K., et al. Systems biology approach predicts immunogenicity of the yellow fever vaccine in humans. Nat Immunol. 2009;10(1):116–125. doi: 10.1038/ni.1688. [DOI] [PMC free article] [PubMed] [Google Scholar]