Abstract
目的
探讨大叶冬青叶中三萜类活性成分27-P-香豆酰基-乌索酸(27-P-CAUA)对乳腺癌细胞增殖抑制的作用机制。
方法
27-P-CAUA处理HCC-1806细胞24、48、72 h后,CCK-8法检测HCC-1806细胞存活率;集落克隆法检测27-P-CAUA对细胞的增殖抑制作用;JC-1检测线粒体膜电位改变;流式细胞术检测细胞凋亡情况;细胞免疫荧光观察C-Caspase-3、P62表达;氯喹预处理后,Western blot观察27-P-CAUA对LC3I/II、P62以及HER2信号通路蛋白的影响。
结果
CCK-8和集落克隆结果显示,随着药物浓度增加和时间延长,27-P-CAUA对HCC-1806乳腺癌细胞的抑制作用逐渐增强(P < 0.01),24、48、72 h的IC50值分别为83.671、49.479、19.578 μmol/L;JC-1检测结果显示,线粒体膜电位改变明显(P < 0.01);流式细胞术结果显示,27-P-CAUA可诱导细胞发生凋亡,细胞早期调亡比率增加3.34%;免疫荧光结果显示,C-Caspase-3表达增强,促进细胞凋亡,40 μmol /L 27-PCAUA能显著诱导细胞凋亡(P < 0.01)。Western blot和细胞免疫荧光结果显示,27-P-CAUA降低LC3II表达,导致P62降解,诱导自噬发生。经氯喹预处理后,27-P-CAUA诱导自噬可被逆转。此外,27-P-CAUA可抑制细胞内Her2及AKT蛋白的磷酸化,细胞内的Her2以及磷酸化AKT蛋白表达逐渐减少(P < 0.01)。
结论
27-P-CAUA可通过抑制HER2/PI3K/AKT信号通路,抑制HCC-1806细胞增殖,诱导细胞发生线粒体自噬和凋亡。
Keywords: HCC-1806细胞, 27-P-CAUA, HER2, 细胞凋亡, 线粒体自噬
Abstract
Objective
To investigate the inhibitory effect of 27-P-coumayl-ursolic acid (27-P-CAUA), the active ingredient in triterpenoids from the leaves of Ilex latifolia Thunb, against breast cancer cells and explore the underlying mechanism.
Methods
CCK-8 assay was used to assess the changes in viability of breast cancer HCC-1806 cells after 27-P-CAUA treatment for 24, 48, or 72 h. The inhibitory effect of 27-P-CAUA on proliferation of the cells was determined by clonogenic assay. JC-1 was used to detect the changes in mitochondrial membrane potential and flow cytometry was performed for analyzing cell apoptosis following 27-P-CAUA treatment. Immunofluorescence assay was used to observe the expression of cl-caspase-3 and P62 in the treated cells. Western blotting was performed to observe the effect of 27-P-CAUA and chloroquine pretreatment on the expressions of LC3I/II, P62 and HER2 signaling pathway proteins in the cells.
Results
The results of CCK-8 and clonogenic assays showed that 27-P-CAUA treatment significantly inhibited the proliferation of HCC-1806 cells (P < 0.01) with IC50 values of 81.473, 48.392 and 18.467 μmol/L at 24, 48, and 72 h, respectively. 27-P-CAUA treatment also caused obvious changes in mitochondrial membrane potential (P < 0.01) and induced cell apoptosis in HCC-1806 cells with a 3.34% increase of the early apoptosis rate. Immunofluorescence assay revealed a significant increase of cl-caspase3 expression in 27-P-CAUA-treated HCC-1806 cells, and treatment with 40 μmol/L 27-P-CAUA resulted in significant cell apoptosis (P < 0.01). 27-P-CAUA obviously reduced the expression of LC3II, caused P62 degradation and induced autophagy in HCC-1806 cells. Chloroquine pretreatment obviously blocked the autophagy-inducing effect of 27-P-CAUA. 27-P-CAUA treatment also inhibited the phosphorylation of HER2 and AKT proteins and progressively lowered the expressions of HER2 and phosphorylated AKT protein in HCC-1806 cells (P < 0.01).
Conclusion
27-P-CAUA can inhibit the proliferation and induce mitochondrial autophagy and apoptosis of HCC-1806 cells by inhibiting the HER2/PI3K/AKT signaling pathway.
Keywords: HCC-1806 cells, 27-P-coumayl-ursolic acid, HER2, mitochondrial autophagy, apoptosis
目前乳腺癌主要治疗方式为手术、放化疗、分子靶向治疗等,但其复发率高,不良反应多,严重影响患者的生活质量[1]。从天然药物中筛选和开发具有抗乳腺癌活性的分子靶向药物潜力巨大,寻找高效低毒的抗乳腺癌化合物是近年来抗乳腺癌药物的研究热点[2-4]。有研究发现天然产物中三萜类化合物具有良好的抗肿瘤活性,其能够诱导肿瘤细胞凋亡、抑制肿瘤细胞增殖[5]。本课题组前期从大叶冬青叶中分离得到一系列三萜类化合物[6-7],并且进行了抗乳腺癌活性研究,发现27-P-香豆酰基-乌索酸(27-P-CAUA)对人乳腺癌MDA-MB-231细胞有良好的抑制作用[8]。目前国内外对该化合物药理方面的研究相对较少。本课题组前期研究发现27-PCAUA对两类独特表型人乳腺癌细胞MDA-MB- 468(EGFR+HER2+)和HCC-1806(EGFR-HER2+)有良好的的抑制作用,并观察到27-P-CAUA是一种分子结构特殊的EGFR酪氨酸激酶抑制剂[9]。HER2属于表皮生长因子家族成员,其表面不能与配体结合,常常与其他家族成员形成二聚体,激活PI3K/AKT信号通路,PI3K/AKT信号通路的异常激活会引起多种下游信号分子活化,调控肿瘤细胞增殖、凋亡、自噬等多种生物学过程[10]。针对乳腺癌分子分型中的HER2阳性患者,临床上主要采用曲妥珠单抗进行治疗。目前尚无天然药物来源的小分子抑制剂在HER2阳性乳腺癌患者的临床研究报道,故本实验以27-P-CAUA为研究对象,观察其在特殊表型EGFR-/HER2+人乳腺癌HCC-1806细胞中的增殖抑制作用,以及通过靶向HER2/PI3K/AKT信号通路调控人乳腺癌HCC-1806细胞凋亡和促进线粒体自噬,为治疗HER2阳性乳腺癌患者临床药物的开发提供新的科学依据。
1. 材料和方法
1.1. 细胞系与试剂
HCC-1806细胞株,MDA-MB-468细胞株(中国科学院上海生命科学研究所细胞库)。27-PCoumaroyloxyursolic acid(上海古朵生物科技有限公司);L-15培养基和RPMI 1640培养基(生工生化工程上海股份有限公司);胰酶细胞消化液(碧云天生物技术研究所);胎牛血清(Thermo Fisher);PVDF膜(Immobilon);BCA蛋白定量试剂盒(碧云天生物技术研究所);EGF Receptor(D38B1)XP Rabbit mAb抗体(CST);预染蛋白Ladder(Thermo Fisher);Cleaved Caspase-3(5A1E)Rabbit mAb(CST);LC3A/B(D3U4C)XP Rabbit mAb抗体(CST);HER2/ErbB2(D8F12)XP Rabbit mAb抗体(CST);SQSTM1/P62 Rabbit mAb(Abclonal);CCK-8试剂盒(Biomiky);JC-1检测试剂盒(碧云天生物技术研究所);Pan-AKT Rabbit mAb(Abclonal);Phos-pho-Akt(Ser473)(D9E)XP Rabbit mAb(CST);CoraLite®488-Conjugated Beta Tubulin Monoclonal Antibody(Proteintech);CoraLite594-conjugated Goat Anti-Mouse IgG(Proteintech);山羊抗兔igG(Biomiky);GAPDH(14C10)Rabbit mAb(CST);Anti-rabbit igG,HRPlinked Antibody(CST)。
1.2. 实验仪器
CO2培养箱(JC-CHP-160Q);蛋白垂直电泳装置(Bio-Rad);酶标仪(Thermo);流式细胞仪(FACSVerse);混旋仪(Mixer-OM 1);激光共聚焦显微镜(TCS SP8);曝光机(GE,Amersham lmager600)。
1.3. 实验方法
1.3.1. HCC-1806细胞培养
取HCC-1806人乳腺癌细胞加入含10% 胎牛血清的RPMI 1640培养基,置37 ℃,5% CO2培养箱中培养,每2 d更换1次培养基,连续培养待细胞80% 融合后,胰酶消化传代培养。
1.3.2. CCK-8细胞存活率检测
将HCC-1806细胞接种于96孔板中,7×103/孔,置于恒温37 ℃培养箱中培养,待细胞贴壁后,弃掉原孔中培养液,更换为单用27-P-CAUA(10、20、40、60、80 µmol/L)、单用氯喹(40 µmol/L)以及27-P-CAUA(40 µmol/L)与氯喹联合的RPIM 1640培养液,每组5个复孔,并设置空白对照组,在培养箱中继续培养24、48、72 h后,每孔加入CCK-8溶液10 μL,放置于培养箱中孵育2 h,酶标仪设置450 nm,检测此波长下各个孔的吸光度值A450 nm,重复实验3次。计算公式:细胞存活率(%)=(A实验组/A对照组)×100%。
1.3.3. 集落克隆法细胞增殖检测
将HCC-1806细胞接种于6孔板中,5×103/孔,细胞贴壁后,弃掉原培养液,将细胞培养液更换为含有27-P-CAUA(20、40、60 µmol/L)的新鲜培养液,对照组更换为同体积的不含有27-PCAUA的新鲜培养液,再将细胞置于37 ℃培养箱继续培养。2 d后移除培养液并使用预冷PBS清洗2次,然后加入多聚甲醛,放置在-20 ℃冰箱中,10 min后加入结晶紫,室温放置10 min,然后使用双蒸水清洗,室温放置干燥后拍照。实验重复3次。
1.3.4. 细胞形态学观察
将HCC-1806细胞接种于6孔板中,2×105/孔,待细胞于培养箱中贴壁良好,弃去孔中培养液,将细胞培养液更换为含有27-P-CAUA(20、40、60 µmol/L)的新鲜培养液,对照组更换为同体积的不含有27-P-CAUA的新鲜培养液,,再将细胞置于37 ℃培养箱继续培养,24 h后使用倒置显微镜拍照。
1.3.5. JC-1线粒体膜电位检测
将HCC-1806细胞接种于6孔板中,2×105/孔,待细胞贴壁后,弃掉原培养液,将细胞培养液更换为含有27-P-CAUA(20、40、60 µmol/L)的新鲜培养液,对照组更换为同体积的不含有27-PCAUA的新鲜培养液,再将细胞置于37 ℃培养箱继续培养24 h,弃去孔中培养液并使用预冷PBS洗涤两次,加入1 mL JC-1染色工作液,充分混匀。细胞培养箱中37 ℃孵育20 min。在孵育期间,按照每1 mL JC-1染色缓冲液(5×)加入4 mL蒸馏水的比例,配制10 mL适量的JC-1染色缓冲液(1×),并放置于冰浴。37 ℃孵育结束后,吸除上清液,用JC-1染色缓冲液(1×)洗涤2次。加入2 mL细胞培养液,使用激光共聚焦显微镜观察线粒体膜电位变化,实验重复3次。线粒体膜电位的降低可由红光向绿光的转变。
1.3.6. 流式细胞术细胞凋亡检测
将HCC-1806细胞接种于6孔板中,2×105/孔,置于37 ℃培养箱中,细胞贴壁后,弃掉原培养液,将细胞培养液更换为含有27-PCAUA(20,40,60 µmol/L)的新鲜培养液,对照组更换为同体积的不含有27-P-CAUA的新鲜培养液,再将细胞置于37 ℃培养箱继续培养24 h后,用0.25% 的胰蛋白酶(不含EDTA)消化得细胞悬液,再用PBS离心洗涤3次,除去血清;用500 μL的Binding Buffer重悬细胞,加入5 μLAnnexin V-FITC混匀后,加入5 μL Propidium Iodide,混匀,室温、避光反应10 min;在1 h内,进行流式细胞仪的观察和检测,实验重复3次。
1.3.7. 免疫荧光法检测C-Caspase-3、P62蛋白
将HCC-1806细胞接种于24孔板中,1×104/孔,置于37 ℃培养箱中,待细胞贴壁后,弃掉原培养液,将细胞培养液更换为含有27-P-CAUA(20,40 µmol/L)的新鲜培养液,对照组更换为同体积的不含有27-P-CAUA的新鲜培养液,再将细胞置于37 ℃培养箱继续培养24 h后,弃去孔中培养液并使用PBS洗涤3次,5 min/次,加入4% 甲醛室温摇床15 min,再用PBS洗涤3次,5 min/次,用山羊血清室温摇床封闭1 h,1∶400稀释C-Caspase-3,1∶100稀释P62,每孔加入100 µL一抗4 ℃孵育过夜,回收C-Caspase-3和P62抗体,用PBS洗涤3次,5 min/次,再加入C-Caspase-3的孔里加入488,1∶200稀释,再加入P62的孔里加入594,1∶200稀释,加入100 µL/孔二抗,室温避光摇床2 h,继续用PBS洗涤3次,5 min/次,加入DAPI染液10 min,用PBS-T洗涤3次,5 min/次后装片,激光共聚焦拍照,实验重复2次。
1.3.8. Western blot
HCC-1806细胞种于6孔板中,分组情况:Con-trol组、27-P-CAUA(40 µmol/L)、氯喹(40 µmol/L)及27-P-CAUA(40 µmol/L)和氯喹联合。待细胞贴壁后,弃掉原培养液,将细胞培养液更换为含有27-P-CAUA(40 µmol/L)的新鲜培养液、含有氯喹(40 µmol/L)的新鲜培养液以及含有27-P-CAUA(40 µmol/L)和氯喹(40 µmol/L)的新鲜培养液,对照组更换为同体积的不含有27-P-CAUA和氯喹的新鲜培养液,再将细胞置于37 ℃培养箱继续培养。药物作用24 h,收集细胞并加入RIPA裂解液,冰上裂解20 min,4 ℃低温离心机13 000 r/mim离心15 min,提取蛋白上清,使用BCA法进行蛋白定量,使各组蛋白至等浓度。各组取30 µg蛋白,SDS-PAGE电泳,然后转膜至PVDF膜,使用5%脱脂牛奶封闭3 h;TBST洗膜3次,5 min/次;4 ℃一抗孵育过夜,一抗稀释比例均按照1∶1000,TBST洗膜3次;室温二抗孵育2 h,二抗稀释比例1∶2000,TBST洗膜3次;ECL试剂盒发光显影,使用凝胶成像系统获取图像。Image J测定各显色条带的灰度值,以目的条带与GAPDH灰度值的比值作为目的蛋白的相对表达量。
1.4. 统计分析方法
采用GraphPad prism8.0软件对实验结果进行分析,数据以均数±标准差表示,采用单因素方差分析检验组间差异,P < 0.05为差异具有统计学意义。
2. 结果
2.1. 27-P-CAUA抑制HCC-1806细胞增殖
CCK-8结果显示,随着药物浓度增加和时间延长,27-P-CAUA对HCC-1806细胞的抑制作用逐渐增强(图 1A),24、48、72 h的IC50值分别为83.671、49.479、19.578 µmol/L。集落克隆实验结果显示,27-P-CAUA呈剂量依赖性的抑制集落的形成(图 1B)。通过倒置显微镜观察到给予27-P-CAUA药物组细胞的形态和密度与对照组相比均出现不同程度的变化,27-P-CAUA可促使细胞萎缩加剧,折光增强,悬浮细胞明显增加(图 1C)。
1.
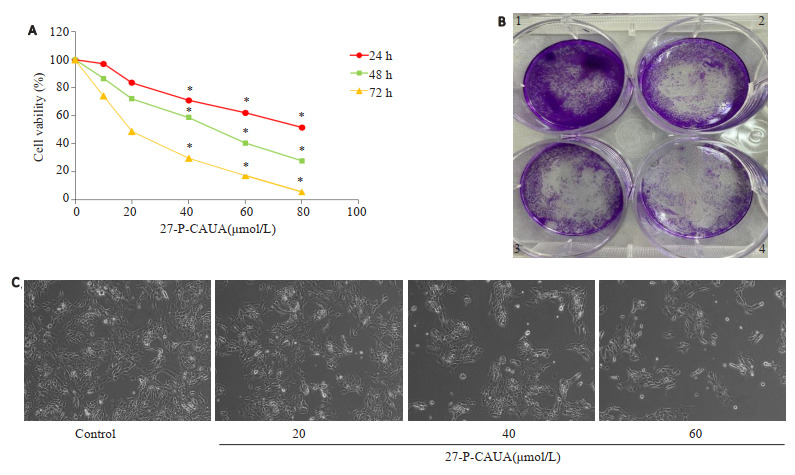
27-P-CAUA对HCC-1806细胞的增殖抑制作用
Inhibitory effects of 27-P-CAUA on HCC-1806 cells. A: CCK-8 assay; B: Clonogenic assay; 1: Control; 2: 27-P-CAUA (20 µmol/L); 3: 27-P-CAUA (40 µmol/L); 4: 27-P-CAUA (60 µmol/L); C: Morphological changes of HCC1806 cells. *P < 0.01 vs control.
2.2. 27-P-CAUA诱导HCC-1806细胞凋亡
JC-1结果显示,给予40、60 µmol/L 27-P-CAUA处理细胞,与对照组相比,细胞内红色荧光比例减少,绿色荧光比例增加(图 2A)。流式细胞术检测细胞早期调亡比率增加3.34%,免疫荧光法检测结果显示,40 µmol /L 27-P-CAUA能显著诱导细胞凋亡(P < 0.01,图 2C、D)。
2.
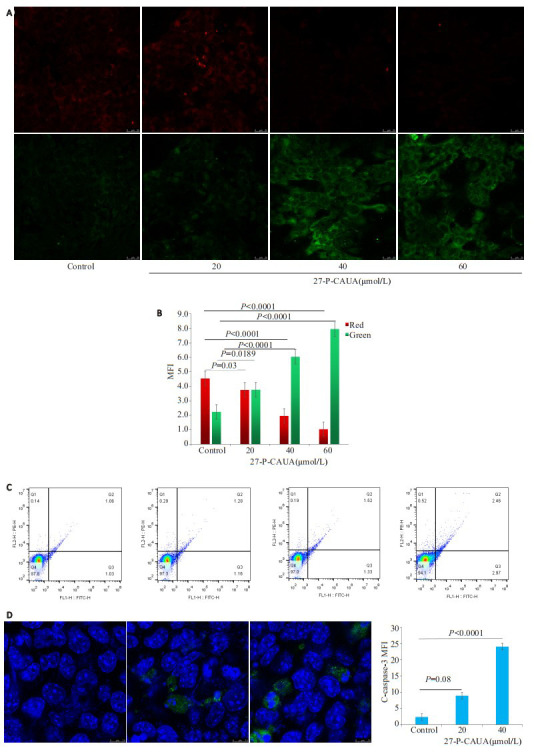
27-P-CAUA诱导HCC-1806细胞发生凋亡
27-P-CAUA induces apoptosis in HCC1806 cells. A: Effect of 27-P-CAUA on mitochondrial membrane potential of the cells. B: Bar graph of changes in mitochondrial membrane potential. C: Flow cytometry of the cells with different treatments. D: C-caspase-3 immunofluorescence graph and bar graph.
2.3. 27-P-CAUA促进HCC-1806细胞线粒体自噬
氯喹预处理细胞4 h后,CCK-8检测结果显示,与对照组和单用27-P-CAUA(40、60 µmol/L)相比,27-PCAUA联合氯喹组细胞存活率降低(P < 0.01,图 3A)。27-P-CAUA促进LC3I/II的累积,LC3I与LC3II表达上调。单用氯喹组观察发现,氯喹可阻断LC3I向LC3II的转化,显示氯喹具有抑制细胞自噬进程作用。
3.
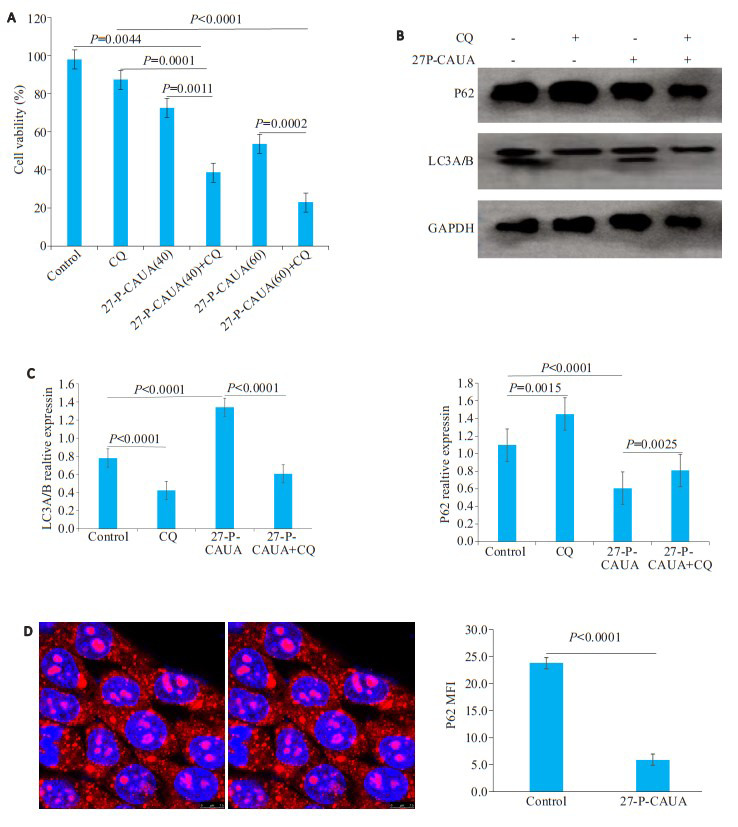
抑制自噬增强HCC-1806细胞对27-P-CAUA的敏感性
Inhibition of autophagy enhances the sensitivity of HCC-1806 cells to 27-P-CAUA. A: CCK-8 assay of the cells incubated with 27-P-CAUA (40 and 60 µmol/L) for 24 h with or without pretreatment with CQ for 4 h. B: Western blot analysis. C: LC3A/B and P62 protein expression bar graph. D: P62 protein immunofluorescence graph and bar graph.
P-CAUA联合氯喹组中LC3II缺失,显示27-PCAUA诱导的线粒体自噬可被自噬抑制剂氯喹逆转(图 3B)。细胞免疫荧光结果显示,27-P-CAUA(40 µmol/L)组P62蛋白水平明显降低(图 3D),细胞自噬进展中P62出现降解。
2.4. 27-P-CAUA抑制HER2/PI3K/AKT信号通路作用
Western blot结果显示,HCC-1806(EGFR-Her2+)随着27- P-CAUA浓度的增加,细胞内的HER2以及磷酸化AKT蛋白表达逐渐减少,与对照组差异具有统计学意义(P < 0.05,图 4)。结果显示,27-P-CAUA可以通过抑制HER2/PI3K/AKT信号通路,抑制HCC-1806细胞的增殖,诱导细胞发生线粒体自噬和凋亡,其信号通路如图 5。
4.
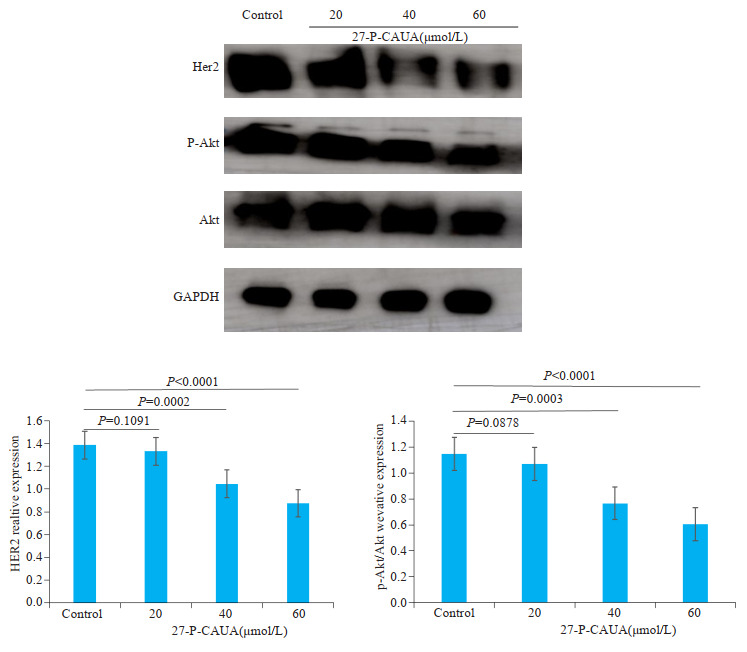
27-P-CAUA降低HCC-1806细胞内Her2和AKT蛋白的磷酸化水平
27-P-CAUA reduces phosphorylation of Her2 and AKT proteins in HCC-1806 cells.
5.
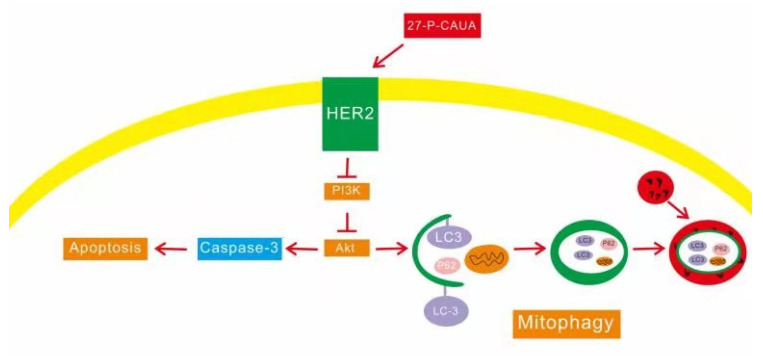
27-P-CAUA诱导HCC-1806发生凋亡和线粒体自噬信号通路图
Signaling pathway of 27-P-CAUA-induced apoptosis and mitophagy in HCC-1806 cells.
3. 讨论
HER2属于ErbB受体家族的一种,该家族包括EGFR(ErbB1),Her2(ErbB2),Her3(ErbB3)和Her4(ErbB4)[11-12]。本课题组前期研究发现27-P-CAUA对两类独特表型的人乳腺癌细胞MDA-MB-468(EGFR+HER2+)和HCC-1806(EGFR-HER2+)有良好的的抑制作用,且观察到27-P-CAUA是一种分子结构特殊的EGFR酪氨酸激酶抑制剂[9]。本研究通过CCK-8和集落克隆法检测27-PCAUA对HCC-1806(EGFR-HER2+)细胞增殖抑制的影响,CCK-8实验结果表明27-P- CAUA可呈时间和剂量依赖性的抑制HCC-1806细胞的增殖,集落克隆法实验结果表明27-P-CAUA药物组细胞的形态和密度出现明显的细胞萎缩,折光增加,悬浮细胞明显增多的现象,说明27-P-CAUA诱导HCC-1806(EGFR-HER2+)细胞死亡。
细胞程序性死亡主要包括细胞凋亡、细胞自噬等,自噬是细胞维持自身稳定性的生理过程[13-14],线粒体自噬属于自噬的特殊类型[15]。适度的线粒体自噬可以维持神经元内稳态,但当线粒体自噬过度激活时,会导致神经元线粒体功能进行性的损害,最终诱导神经元死亡[16-17]。线粒体自噬过程受多种分子调控,损伤的线粒体sequestosome1(SQSTM1/p62)和微管相关蛋白轻链3II(LC3II)形成自噬小体,由自噬小体呈送至溶酶体,进而通过自噬—溶酶体降解途径完成线粒体的降解和再利用[18]。LC3II常被作为自噬形成的标志物,在调节肿瘤的起始和生长过程中起着重要作用[19]。本研究发现与氯喹组相比,27-P-CAUA组可上调细胞内自噬标记蛋白LC3II的表达,降解P62蛋白,表明27-P-CAUA可诱导细胞线粒体自噬发生。而应用自噬抑制剂氯喹预处理细胞4 h后,联用组发现氯喹可逆转27-P-CAUA导致的线粒体自噬行为发生,进一步说明27-P-CAUA通过诱导HCC-1806细胞发生线粒体自噬导致细胞死亡。细胞凋亡是细胞受多种因素调控的程序化死亡过程,是机体维持正常功能的必需手段[20]。Caspases酶家族在细胞凋亡过程中起介导和执行的作用,Caspase-3是Caspases家族的下游蛋白,是细胞凋亡真正的实施者[21]。Annex-inV-PI双染经流式细胞仪检测发现27-PCAUA促进HCC-1806细胞凋亡且呈剂量依赖性。线粒体膜电位检测发现线粒体膜电位明显改变。细胞免疫荧光分析发现27-P-CAUA导致HCC-1806细胞剪切的Caspase-3表达增加,提示27-P-CAUA通过诱导HCC-1806细胞凋亡而导致细胞死亡。
PI3K/AKT通路影响着蛋白质合成、代谢、细胞周期和增殖等多种生理活动,在调节自噬和凋亡中起重要作用[22-23],HER2/PI3K/AKT信号通路激活可以抑制细胞自噬、抗细胞凋亡[24]。为进一步了解27-P-CAUA诱导HCC-1806细胞发生线粒体自噬和凋亡的分子机制,我们研究了不同浓度27-P-CAUA对Her2、AKT、pAKT的表达影响,结果发现27-P-CAUA导致细胞内Her2和p-AKT蛋白水平降低,推测27-P-CAUA可能通过抑制HER2/PI3K/AKT信号通路发挥作用。
27-P-CAUA为天然药物中分离得到的活性成分,具有高效低毒等特点,目前国内外对该化合物药理方面的研究鲜有报道,而且极少报道对特殊表型人鳞状乳腺癌HCC-1806细胞方面的研究[25-26]。本实验以27-PCAUA为研究对象,通过其对特殊表型人鳞状乳腺癌HCC-1806细胞凋亡和线粒体自噬的研究,结果表明27-P-CAUA可以通过抑制HER2/PI3K/AKT信号通路,抑制HCC-1806细胞的增殖,诱导细胞发生线粒体自噬和凋亡。然而,27-P-CAUA诱导的HCC-1806细胞发生线粒体自噬与凋亡之间的确切关系仍需进一步研究。本课题组希望通过研究27-P-CAUA抗乳腺癌的作用机制,为抗乳腺癌新药的研发提供实验依据,为特殊表型的乳腺癌患者治疗提供新的方法策略。
Biography
黄超,在读硕士研究生,E-mail:1142487820@qq.com
Funding Statement
国家自然科学基金(81402818);安徽省重点研究与开发计划项目(202004a07020042);安徽省中医药管理局项目(2020zcyb10);安徽省教育厅高校自然科学重点研究项目(KJ2020A0621);皖南医学院校级重点科研项目(WK2019Z03)
Supported by National Natural Science Foundation of China(81402818)
Contributor Information
黄 超 (Chao HUANG), Email: 1142487820@qq.com.
王 宏婷 (Hongting WANG), Email: leonasuper@126.com.
王 存琴 (Cunqin WANG), Email: wcq5188b@163.com.
References
- 1.Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2021. CA Cancer J Clin. 2021;71(1):7–33. doi: 10.3322/caac.21654. [Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33.] [DOI] [PubMed] [Google Scholar]
- 2.郭 怡, 姜 成燕, 焦 瑞华, et al. Antimycin类天然产物抗三阴性乳腺癌细胞MDA-MB-231作用机制初步研究. https://www.cnki.com.cn/Article/CJFDTOTAL-NJDZ202102019.htm. 南京大学学报: 自然科学. 2021;57(2):334–43. [郭怡, 姜成燕, 焦瑞华, 等. Antimycin类天然产物抗三阴性乳腺癌细胞MDA-MB-231作用机制初步研究[J]. 南京大学学报: 自然科学, 2021, 57(2): 334-43.] [Google Scholar]
- 3.袁 永贵, 张 夏炎, 朱 晓俊, et al. 白花丹素对乳腺癌细胞凋亡和自噬的影响. 中国中医药信息杂志. 2022;29(1):90–5. [袁永贵, 张夏炎, 朱晓俊, 等. 白花丹素对乳腺癌细胞凋亡和自噬的影响[J]. 中国中医药信息杂志, 2022, 29(1): 90-5.] [Google Scholar]
- 4.李 佳鑫, 石 金凤, 吴 亿晗, et al. 雷公藤甲素抗乳腺癌的机制及应用进展. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGZY202113009.htm. 中国中药杂志. 2021;46(13):3249–56. doi: 10.19540/j.cnki.cjcmm.20210225.601. [李佳鑫, 石金凤, 吴亿晗, 等. 雷公藤甲素抗乳腺癌的机制及应用进展[J]. 中国中药杂志, 2021, 46(13): 3249-56.] [DOI] [PubMed] [Google Scholar]
- 5.林 艳, 闫 庆梓, 李 亚梅, et al. 夏枯草抗乳腺癌最佳组分筛选及其作用机制研究. 中草药. 2019;50(21):5298–306. doi: 10.7501/j.issn.0253-2670.2019.21.024. [林艳, 闫庆梓, 李亚梅, 等. 夏枯草抗乳腺癌最佳组分筛选及其作用机制研究[J]. 中草药, 2019, 50(21): 5298-306.] [DOI] [Google Scholar]
- 6.汪 雷, 陈 颖, 王 存琴, et al. HPLC法测定不同产地大叶冬青叶中4种三萜类成分的含量. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYXY202001016.htm. 中药新药与临床药理. 2020;31(1):96–101. [汪雷, 陈颖, 王存琴, 等. HPLC法测定不同产地大叶冬青叶中4种三萜类成分的含量[J]. 中药新药与临床药理, 2020, 31(1): 96-101.] [Google Scholar]
- 7.王 存琴, 陈 颖, 汪 雷, et al. HPLC法同时测定大叶冬青叶中6种有效成分的含量. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYXY201904013.htm. 中药新药与临床药理. 2019;30(4):466–71. [王存琴, 陈颖, 汪雷, 等. HPLC法同时测定大叶冬青叶中6种有效成分的含量[J]. 中药新药与临床药理, 2019, 30(4): 466-71.] [Google Scholar]
- 8.王 宏婷, 王 存琴. 27-O-(E)-香豆酰基-乌索酸通过调控JNK/SAPK通路诱导人乳腺癌细胞MDA-MB-231细胞凋亡. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGZY201504027.htm. 中国中药杂志. 2015;40(4):722–6. [王宏婷, 王存琴. 27-O-(E)-香豆酰基-乌索酸通过调控JNK/SAPK通路诱导人乳腺癌细胞MDA-MB-231细胞凋亡[J]. 中国中药杂志, 2015, 40(4): 722-6.] [PubMed] [Google Scholar]
- 9.Wang CQ, Wang RB, Chen Y, et al. Discovery of an EGFR tyrosine kinase inhibitor from Ilex latifolia in breast cancer therapy. Bioorg Med Chem Lett. 2019;29(11):1282–90. doi: 10.1016/j.bmcl.2019.04.009. [Wang CQ, Wang RB, Chen Y, et al. Discovery of an EGFR tyrosine kinase inhibitor from Ilex latifolia in breast cancer therapy[J]. Bioorg Med Chem Lett, 2019, 29(11): 1282-90.] [DOI] [PubMed] [Google Scholar]
- 10.刘 欢, 梁 丽英, 刘 显, et al. 白花丹醌对人结肠腺癌Caco-2细胞凋亡、自噬及PI3K/Akt/mTOR信号通路的影响. https://www.cnki.com.cn/Article/CJFDTOTAL-ZBLS202102009.htm. 中国病理生理杂志. 2021;37(2):255–62. [刘欢, 梁丽英, 刘显, 等. 白花丹醌对人结肠腺癌Caco-2细胞凋亡、自噬及PI3K/Akt/mTOR信号通路的影响[J]. 中国病理生理杂志, 2021, 37(2): 255-62.] [Google Scholar]
- 11.Robichaux JP, Elamin YY, Vijayan RSK, et al. Pan-cancer landscape and analysis of ERBB2 mutations identifies poziotinib as a clinically active inhibitor and enhancer of T-DM1 activity. Cancer Cell. 2019;36(4):444–57. doi: 10.1016/j.ccell.2019.09.001. [Robichaux JP, Elamin YY, Vijayan RSK, et al. Pan-cancer landscape and analysis of ERBB2 mutations identifies poziotinib as a clinically active inhibitor and enhancer of T-DM1 activity[J]. Cancer Cell, 2019, 36(4): 444-57.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Kwon Y, Kim M, Jung HS, et al. Targeting autophagy for overcoming resistance to anti-EGFR treatments. Cancers. 2019;11(9):1374. doi: 10.3390/cancers11091374. [Kwon Y, Kim M, Jung HS, et al. Targeting autophagy for overcoming resistance to anti-EGFR treatments[J]. Cancers, 2019, 11(9): 1374.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.陈 海, 王 建. PI3K/AKT信号通路在缺血性脑卒中后细胞程序性死亡中的研究进展. 中药药理与临床. 2021;8(2):1–16. [陈海, 王建. PI3K/AKT信号通路在缺血性脑卒中后细胞程序性死亡中的研究进展[J]. 中药药理与临床, 2021, 8(2): 1-16.] [Google Scholar]
- 14.郝 艳梅, 殷 红梅, 朱 超莽, et al. 苦参碱通过抑制PI3K/AKT/mTOR通路促进非小细胞肺癌A549细胞的自噬和凋亡. https://www.j-smu.com/CN/10.12122/j.issn.1673-4254.2019.07.02. 南方医科大学学报. 2019;39(7):760–5. doi: 10.12122/j.issn.1673-4254.2019.07.02. [郝艳梅, 殷红梅, 朱超莽, 等. 苦参碱通过抑制PI3K/AKT/mTOR通路促进非小细胞肺癌A549细胞的自噬和凋亡[J]. 南方医科大学学报, 2019, 39(7): 760-5.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.曾 炼, 刘 晨光, 孙 晓东, et al. 罗哌卡因通过抑制STAT3的磷酸化诱导PC12细胞线粒体自噬. 中国病理生理杂志. 2021;37(7):1187–94. doi: 10.3969/j.issn.1000-4718.2021.07.005. [曾炼, 刘晨光, 孙晓东, 等. 罗哌卡因通过抑制STAT3的磷酸化诱导PC12细胞线粒体自噬[J]. 中国病理生理杂志, 2021, 37(7): 1187-94.] [DOI] [Google Scholar]
- 16.Doxaki C, Palikaras K. Neuronal mitophagy: friend or foe? Front Cell Dev Biol. 2021;8:611938. doi: 10.3389/fcell.2020.611938. [Doxaki C, Palikaras K. Neuronal mitophagy: friend or foe?[J]. Front Cell Dev Biol, 2021, 8: 611938.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Mani S, Swargiary G, Chadha R. Mitophagy impairment in neurodegenerative diseases: Pathogenesis and therapeutic interventions. Mitochondrion. 2021;57:270–93. doi: 10.1016/j.mito.2021.01.001. [Mani S, Swargiary G, Chadha R. Mitophagy impairment in neurodegenerative diseases: Pathogenesis and therapeutic interventions [J]. Mitochondrion, 2021, 57: 270-93.] [DOI] [PubMed] [Google Scholar]
- 18.Hara H, Kuwano K, Araya J. Mitochondrial quality control in COPD and IPF. Cells. 2018;7(8):86. doi: 10.3390/cells7080086. [Hara H, Kuwano K, Araya J. Mitochondrial quality control in COPD and IPF[J]. Cells, 2018, 7(8): 86.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Weckman A, Rotondo F, di Ieva A, et al. Autophagy in endocrine tumors. Endocr Relat Cancer. 2015;22(4):R205–18. doi: 10.1530/ERC-15-0042. [Weckman A, Rotondo F, di Ieva A, et al. Autophagy in endocrine tumors[J]. Endocr Relat Cancer, 2015, 22(4): R205-18.] [DOI] [PubMed] [Google Scholar]
- 20.张 特, 张 亮, 陆 俊霏, et al. 重楼皂苷I靶向EGFR影响人乳腺癌细胞增殖及凋亡的作用机制. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGZY202203019.htm. 中国中药杂志. 2021;11(6):1–10. [张特, 张亮, 陆俊霏, 等. 重楼皂苷I靶向EGFR影响人乳腺癌细胞增殖及凋亡的作用机制[J]. 中国中药杂志, 2021, 11(6) : 1-10.] [Google Scholar]
- 21.熊 见, 魏 宇燕, 李 亮, et al. Bcl-2、Caspase-3、Apo2.7在胃癌变过程中的表达及与细胞凋亡的相关性研究. 检验医学与临床. 2021;18(15):2155–8. doi: 10.3969/j.issn.1672-9455.2021.15.004. [熊见, 魏宇燕, 李亮, 等. Bcl-2、Caspase-3、Apo2.7在胃癌变过程中的表达及与细胞凋亡的相关性研究[J]. 检验医学与临床, 2021, 18(15): 2155-8.] [DOI] [Google Scholar]
- 22.Heras-Sandoval D, Pérez-Rojas JM, Hernández-Damián J, et al. The role of PI3K/AKT/mTOR pathway in the modulation of autophagy and the clearance of protein aggregates in neurodegeneration. Cell Signal. 2014;26(12):2694–701. doi: 10.1016/j.cellsig.2014.08.019. [Heras-Sandoval D, Pérez-Rojas JM, Hernández-Damián J, et al. The role of PI3K/AKT/mTOR pathway in the modulation of autophagy and the clearance of protein aggregates in neurodegeneration[J]. Cell Signal, 2014, 26(12): 2694-701.] [DOI] [PubMed] [Google Scholar]
- 23.Kumar D, Shankar S, Srivastava RK. Rottlerin induces autophagy and apoptosis in prostate cancer stem cells via PI3K/Akt/mTOR signaling pathway. Cancer Lett. 2014;343(2):179–89. doi: 10.1016/j.canlet.2013.10.003. [Kumar D, Shankar S, Srivastava RK. Rottlerin induces autophagy and apoptosis in prostate cancer stem cells via PI3K/Akt/mTOR signaling pathway[J]. Cancer Lett, 2014, 343(2): 179-89.] [DOI] [PubMed] [Google Scholar]
- 24.葛 贤明, 周 巧, 张 语涵, et al. EGFR酪氨酸激酶抑制剂HS-10296诱导三阴乳腺癌MDA-MB-231细胞发生自噬和凋亡. https://www.j-smu.com/CN/10.12122/j.issn.1673-4254.2020.07.10. 南方医科大学学报. 2020;40(7):981–7. doi: 10.12122/j.issn.1673-4254.2020.07.10. [葛贤明, 周巧, 张语涵, 等. EGFR酪氨酸激酶抑制剂HS-10296诱导三阴乳腺癌MDA-MB-231细胞发生自噬和凋亡[J]. 南方医科大学学报, 2020, 40(7): 981-7.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.史 莹, 王 丹, 姜 朋丽, et al. 葫芦素B对三阴乳腺癌HCC1806细胞增殖凋亡及Wnt信号通路的影响. 中国实验诊断学. 2020;24(11):1833–5. doi: 10.3969/j.issn.1007-4287.2020.11.021. [史莹, 王丹, 姜朋丽, 等. 葫芦素B对三阴乳腺癌HCC1806细胞增殖凋亡及Wnt信号通路的影响[J]. 中国实验诊断学, 2020, 24(11): 1833-5.] [DOI] [Google Scholar]
- 26.韩 亮, 孟 艳艳, 张 丽荣, et al. 转录因子特异性蛋白1对三阴乳腺癌HCC1806细胞增殖凋亡的影响及其机制. 中华实验外科杂志. 2020;37(7):1201–4. doi: 10.3760/cma.j.cn421213-20200108-01016. [韩亮, 孟艳艳, 张丽荣, 等. 转录因子特异性蛋白1对三阴乳腺癌HCC1806细胞增殖凋亡的影响及其机制[J]. 中华实验外科杂志, 2020, 37(7): 1201-4.] [DOI] [Google Scholar]


