Abstract
目的
探究棕榈酸(PA)对心肌细胞自噬功能的影响及潜在机制。
方法
提取大鼠乳鼠心肌细胞(NRCMs)并体外培养24 h,分别加入10%BSA以及不同浓度的PA(0、0.1、0.3、0.5、0.7 mmol/L)共培养24 h。Western blotting检测NRCMs中自噬指标(PINK1、Parkin、p62、LC3Ⅱ/LC3Ⅰ)以及cGAS、STING、p-IRF3/IRF3的蛋白表达水平。CCK8法检测细胞活性,筛选0.7 mmol/L PA用于后续实验。进一步将cGAS siRNA转染入NRCMs中以敲降cGAS的表达,将NRCMs细胞分为:空白对照组(Control组,无特殊处理)、阴性对照组(NC组,转染NC序列)、cGAS siRNA组(转染cGAS-siRNA敲降cGAS)、PA组(0.7 mmol/L PA处理24 h)、cGAS siRNA+PA组(转染cGAS-siRNA后予以0.7 mmol/L PA处理24 h)。Western blot检测NRCMs自噬相关蛋白指标表达变化,CCK8法检测细胞活性,免疫荧光检测p62和LC3阳性着色情况。
结果
经不同浓度PA作用24 h后,NRCMs中PINK1、Parkin,LC3Ⅱ/LC3Ⅰ和LC3Ⅱ/LC3Ⅰ+Ⅱ蛋白表达量明显降低(P < 0.05),p62蛋白表达量明显增高(P < 0.05),且心肌细胞活性明显下降(P < 0.05)。将cGAS敲降后,可明显逆转PA诱导的NRCMs自噬功能降低,并改善心肌细胞活性(P < 0.05)。
结论
PA通过介导cGAS-STING-IRF3通路激活,抑制心肌细胞的自噬功能,导致细胞活性降低。
Keywords: 棕榈酸, cGAS-STING-IRF3, 心肌细胞, 自噬
Abstract
Objective
To investigate the effect of palmitic acid (PA) on autophagy in neonatal rat cardiomyocytes (NRCMs) and explore the underlying mechanism.
Methods
NRCMs were isolated and cultured for 24 h before exposure to 10% BSA and 0.1, 0.3, 0.5, or 0.7 mmol/L PA for 24 h. After the treatments, the expressions of Parkin, PINK1, p62, LC3Ⅱ/ LC3Ⅰ, cGAS, STING and p-IRF3/IRF3 were detected using Western blotting and the cell viability was assessed with CCK8 assay, based on which 0.7 mmol/L was selected as the optimal concentration in subsequent experiments. The effects of cGAS knockdown mediated by cGAS siRNA in the presence of PA on autophagy-related proteins in the NRCMs were determined using Western blotting, and the expressions of P62 and LC3 in the treated cells were examined using immunofluorescence assay.
Results
PA at different concentrations significantly lowered the expressions of Parkin, PINK1, LC3 Ⅱ/LC3 Ⅰ and LC3 Ⅱ/LC3 Ⅰ+Ⅱ (P < 0.05), increased the expression of p62 (P < 0.05), and inhibited the viability of NRCMs (P < 0.05). Knockdown of cGAS obviously blocked the autophagy-suppressing effect of PA and improved the viability of NRCMs (P < 0.05).
Conclusion
PA inhibits autophagy by activating the cGAS-STING-IRF3 pathway to reduce the viability of NRCMs.
Keywords: palmitic acid, cGAS-STING-IRF3, cardiomyocytes, autophagy
棕榈酸(PA)是食物中含量最多的游离脂肪酸,也是脂毒性损伤的主要诱发者[1-2]。随着人类的饮食结构向高脂饮食转变,与脂毒性相关的心脏疾病引起人们的注意,并严重威胁着患者的生命健康[3]。这种被称为脂毒性心肌病的疾病,是因游离脂肪酸的摄入和利用的失调,引起心肌脂质大量积聚所致,以心肌功能障碍为主要表现[4-5]。探究脂质通过何种机制导致心肌功能的改变,以及如何干预脂毒性心肌病已然成为当今慢病防治领域的热点及难点。
自噬是一种能量分解代谢过程,目的是清除不必要的或受损的细胞器,维持细胞内的稳态[6]。过高或过低的自噬均会促进细胞死亡,而适度的自噬对于维持蛋白稳定是必不可少的[7]。在脂毒性心肌病中,常发生自噬功能改变,进而损伤心脏功能[2, 8]。因此,探明其中相关机制具有重要意义。
cGAS-STING-IRF3通路是新发现的固有免疫系统组成通路[9]。cGAS可感知损伤的DNA,进一步募集锚定于内质网上的STING蛋白,触发转录因子IRF3的磷酸化激活,从而引起下游相关反应发生[10]。近期,一项针对海葵线虫的研究表明,参与细胞的自噬活动是cGAS的主要功能之一[11],提示自噬与cGAS-STINGIRF3通路可能有着密切的关系,但在心肌细胞中未见文献报道。此外,PA可通过AMPK-mTORC、PERKATF4-CHOP、TLR4-JNK-MAPK信号通路诱导心肌细胞脂毒性已在多个研究中得到证实[12-13]。但PA是否可以影响cGAS-STING-IRF3通路,也并未见任何报道。因此,本实验旨在探究PA对cGAS-STING-IRF3通路的影响作用,以及该通路在PA诱导的心肌细胞自噬功能改变中的作用,为了解心脏脂毒性损伤的发病机制提供新的视角。
1. 材料和方法
1.1. 实验动物和材料
出生3 d以内的SD乳鼠购自重庆医科大学实验动物中心;DMEM高糖培养基(Gibico);0.25%胰蛋白酶(Servicebio);胶原酶Ⅱ(BIOFROXX);棕榈酸、BSA、BrdU、LipofectamineTM 3000(Invitrogen);胎牛血清(PAN);cGAS抗体(Abcam);STING、IRF3、p-IRF3、LC3Ⅰ/Ⅱ、P62抗体(CST);PINK1抗体(Affinity);Parkin、GAPDH、Cardiac Troponin Ⅰ(cTnⅠ)抗体(Proteintech);RIPA裂解液、磷酸酶抑制剂(MCE);BCA蛋白浓度测定试剂盒(Beyotime);羊抗兔Ⅱ抗、羊抗鼠Ⅱ抗(Thermo);Cell Counting Kit-8(Bimake)。
1.2. 方法
1.2.1. 大鼠乳鼠心肌细胞的分离和培养
本实验由重庆医科大学动物伦理委员会批准通过,方法参考先前的研究[14-15]。取1~3 d龄SD乳鼠,75%酒精消毒皮肤,剪开胸廓取出心脏,将心尖部分剪为碎块,加入0.08%胰蛋白酶溶液消化10 min,自然沉淀弃去上清;向剩余组织块中加入1∶1混合的0.08%胰蛋白酶和0.04%胶原酶,置于37 ℃水浴锅中消化10 min,静止并吸取上清,将其加入含15%胎牛血清的培养基中以终止消化,以1000 r/min离心10 min,弃去上清,加入培养基充分吹打混匀。剩余沉淀组织采用同样的条件方法反复消化,直至所有组织消化殆尽。将各次收集的细胞悬液接种于100 mL培养瓶。分离纯化细胞采用差速贴壁法和化学方法[16]。在细胞培养箱(37 ℃、饱和湿度、5% CO2)孵育1.5~2 h,分离纯化心肌细胞。非心肌细胞贴壁快,当其贴附瓶底时,心肌细胞仍处于悬浮状态。吸取细胞悬液离心,向沉淀中加入培养基混匀并接种于6孔板,或经细胞计数,将细胞以1×104/孔的密度接种于96孔板,每2~3 d换1次液。通过对心肌肌钙蛋白(I cTnI)这一特异表达于心肌并参与调控横纹肌收缩的结构蛋白进行免疫荧光染色来鉴定心肌细胞[17]。
1.2.2. PA配置
称取0.02794 g PA粉末加入含10 mL PBS的离心管中,置于95 ℃恒温水浴锅中加热,直至PA完全溶解。再另取一个离心管并称取2 g BSA,加入10 mL PBS并充分混匀。分次将两管液体完全融合,充分震荡后得到50 mmol/L的PA母液,之后于超净工作台中过滤此母液,封口后于4 ℃冰箱保存。
1.2.3. Western blot检测蛋白表达量
先于4 ℃冰箱中预冷PBS,之后将PBS加入六孔板,轻轻晃动,然后抽干PBS,如此重复清洗3次。向每个六孔板孔中加入100 μL RIPA和1 μL PMSF,于冰上静置约15 min后用细胞刮片轻刮培养皿,之后将液体转移至1.5 mL EP管中静置10 min使细胞充分裂解。之后于4 ℃离心机中12 000 r/min离心20 min,转移上清液至另一个1.5 mL离心管中,即为蛋白原液。BCA法测定蛋白浓度。每孔蛋白上样量为20 μg,选用12% 分离胶进行电泳,然后进行湿法电转至PVDF膜。室温下用5%脱脂奶粉溶液封闭1 h,分别加入相应Ⅰ抗(抗体稀释比例均为1∶1000)。4 ℃冰箱孵育过夜。Ⅱ抗(稀释比例1∶10000)孵育1 h后,TBST洗3次,10 min/次。ECL化学发光显色,条带用Image Lab 6. 0进行灰度值分析。
1.2.4. CCK8检测细胞活性
根据CCK8说明书测定细胞活性。将细胞以1×104/孔的密度接种于96孔板,培养24 h。然后,按上述方法处理细胞。处理结束后,每孔加入100 μL的无血清的DMEM高糖培养基和10 μL的CCK8溶液。37 ℃孵育1~4 h后,用酶标仪分光光度计检测A450。
1.2.5. cGAS siRNA转染
NRCMs贴壁24 h后,显微镜下观察细胞状态,并进行cGAS siRNA转染。两部分实验分成5组:空白对照组(Control组):不做任何干预操作;阴性对照组(NC组):使用NC序列进行转染;cGAS siRNA组:将cGAS siRNA转染入细胞;PA处理组:使用0.7 mmol/L PA处理24 h,无转染操作;cGAS siRNA+ PA处理组:先转染cGAS siRNA后予以0.7 mmol/L PA处理24 h。转染时用终浓度为100 nmol/L的cGAS siRNA+250 μL Opti-MEM+5 μL LipofectamineTM 3000混匀,阴性对照组加入等量的Opti-MEM+NC+Lipo fectamineTM 3000混悬液。空白对照组加入等量OPTIMDMEM培养液。室温放置20 min。更换培养液,将转染复合物加到培养皿中,轻柔摇匀。转染6 h后换新鲜的含10% FBS的DMEM(高糖)培养基继续培养24 h,再进行后续实验。cGAS siRNA序列如下所示:cGASrattus Mb21d1干扰序列:
正义链:5'CGGCAGCUAUUAUGAACAUtt3';反义链:5'AUGUUCAUAAUAGCUGCCGtt3';
1.2.6. 细胞免疫荧光实验
细胞爬片置于24孔培养板,将细胞以1×105/mL种板并按1.2.5所述方法处理细胞,待处理培养结束,4% 甲醛固定(30 min),PBS清洗(3次×3 min),用PBS配制的0.5% Triton X-100于室温通透30 min,重复PBS清洗(3次×3 min),用PBS配制的10%山羊血清封闭液于室温封闭1 h,然后用山羊血清稀释的肌钙蛋白、LC3、p62一抗封闭液(1∶100)于4 ℃孵育过夜,次日弃去一抗封闭液,PBS清洗(3次×3 min)后加入FITC标记山羊抗兔IgG(H+L)二抗(稀释比1∶500)于室温避光孵育1 h,再次PBS清洗(3次× 3 min),滴加DAPI染液避光染色5 min,PBS清洗(5次× 3 min),滴加抗荧光猝灭剂封片固定,荧光显微镜观察荧光图片。
1.3. 统计学处理
所有的实验数据来源于至少3次独立实验结果,所得数据用均数±标准差表示。采用GraphPad Prism 8.0软件统计并作图。比较各组间(对照组vs BSA处理组;PA处理组vs BSA对照组;NC处理组vs cGAS siRNA处理组;0.7 mmol/L PA处理组vs 0.7mmol/L PA+cGAS siRNA处理组)的统计学差异采用单因素方差分析后进行Turkey检验;以P < 0.05为差异有统计学意义。
2. 结果
2.1. NRCMs的免疫荧光鉴定
cTnI组所示,绿色荧光代表心肌标志性蛋白cTnI,被用于标记NRCMs。DAPI组中蓝色荧光为同一视野中核染色,表明该处有细胞,但与细胞类别无关。Merge组中将cTnI染色与核染色合并,绿蓝荧光重合即表明该处细胞为NRCMs。结果显示原代培养的NRCMs纯度较高(图 1)。
1.
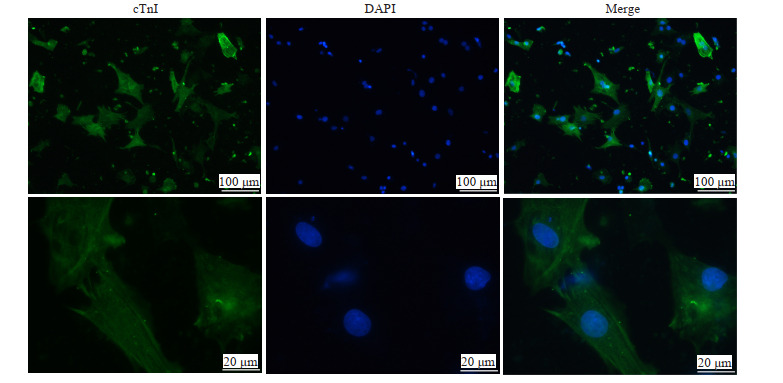
NRCMs的免疫荧光鉴定
NRCMs identified by immunofluorescence assay.
2.2. PA处理NRCMs 24 h后,自噬和细胞生存率呈浓度依赖性降低
与Control组相比,BSA组各项自噬指标和细胞活性未见明显变化,差异不具有统计学意义(P>0.05),用以排除PA溶液中的BSA对结果产生干扰。与BSA组相比,PA以浓度依赖的方式引起PINK1(图 2B)、LC3Ⅱ/ LC3Ⅰ(图 2E)、LC3Ⅱ/LC3Ⅰ+Ⅱ(图 2F)的表达下调和p62(图 2D)表达上调,其中0.1 mmol/L PA组与BSA组之间差异不具有统计学意义(P>0.05),但0.3、0.5、0.7 mmol/L PA与BSA组的差异存在统计学意义(P < 0.05),其中0.7 mmol/L PA处理组与BSA组差异最大,分别为PINK1(0.39±0.02 vs 1.03±0.07)、LC3Ⅱ/LC3Ⅰ(0.29±0.03 vs 0.98±0.04)、LC3Ⅱ/LC3Ⅰ+Ⅱ(0.45±0.04 vs 0.99±0.02)、p62(5.69±0.31 vs 1.01±0.03)。与BSA组相比,各浓度PA以浓度依赖的方式引起Parkin表达下调且差异具有统计学意义(P < 0.05),0.7 mmol/L PA处理组与BSA组差异最大(0.16±0.02 vs 1.00±0.02,图 2C)。与BSA组相比,0.1、0.3 mmol/L PA处理组细胞活性未见统计学意义(P>0.05),0.5、0.7 mmol/L PA可使细胞活性降低(P < 0.05),以0.7 mmol/L处理组效果最为显著(0.54±0.05 vs 1.02±0.09,图 2G)。
2.
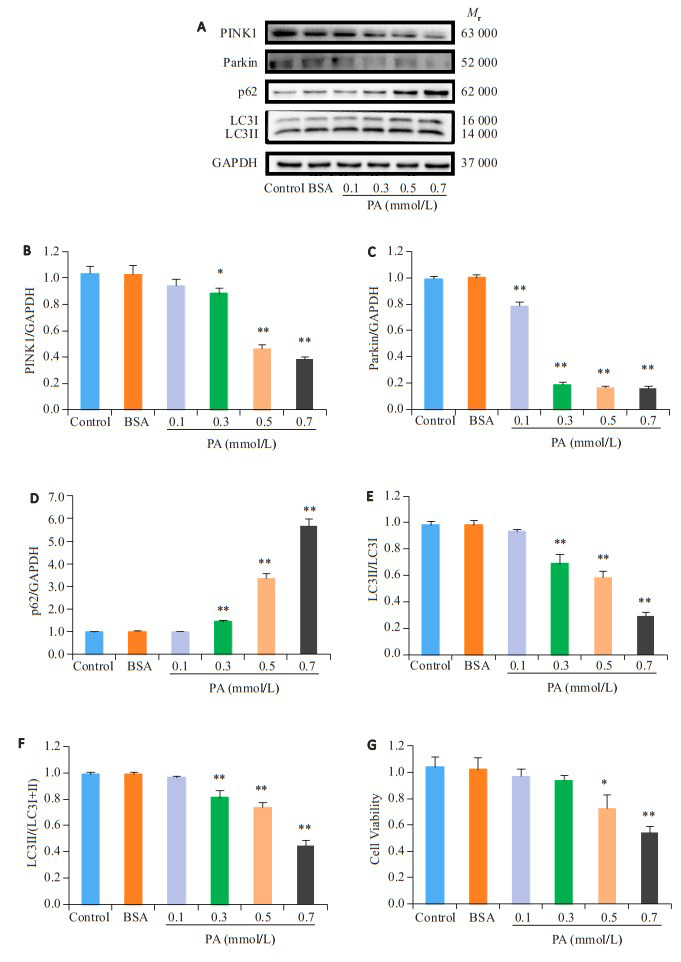
棕榈酸处理NRCMs 24 h后, 自噬和细胞生存率呈浓度依赖性降低
Palmitic acid (PA) treatment for 24 h dose-dependently suppresses autophagy and reduces survival rate of NRCMs. A: Western blots of PINK1, Parkin, P62, LC3 Ⅰ andLC3 Ⅱ in NRCMs after treatment with BSA or PA (0, 0.1, 0.3, 0.5, and 0.7 mmol/L). B-F: Quantitative analysis of the protein expressions (n=4). *P < 0.05, **P < 0.01 vs BSA group. G: Cell viability of the cells with different treatments (n=4). *P < 0.05, **P < 0.01 vs BSA group.
2.3. PA处理NRCMs24h后cGAS-STING-IRF3通路激活,且成浓度依赖性
与Control组相比,BSA组cGAS-STING-IRF3通路表达未见明显变化,差异不具有统计学意义(P> 0.05),PA溶液中的BSA对细胞未产生干扰。与BSA组相比,各浓度PA明显诱导了cGAS(图 3B)和STING(图 3C)的表达呈浓度依赖性增加(P < 0.05),其中0.7 mmol/L效果最为显著,分别为cGAS(2.48± 0.13 vs 0.99±0.08)、STING(2.03±0.04 vs 1.01±0.04)。与BSA组相比,0.1 mmol/L PA未对p-IRF3/IRF3产生明显影响(P>0.05),但0.3、0.5、0.7 mmol/L PA可使pIRF3/IRF3呈浓度依赖性上升(P < 0.05),以0.7 mmol/L PA效果最为显著(1.41±0.03 vs 0.98±0.02,图 3D)。鉴于图 2~3中展示的各个实验中0.7 mmol/L PA处理可取得最显著的效果,故该浓度被应用于后续实验中。
3.
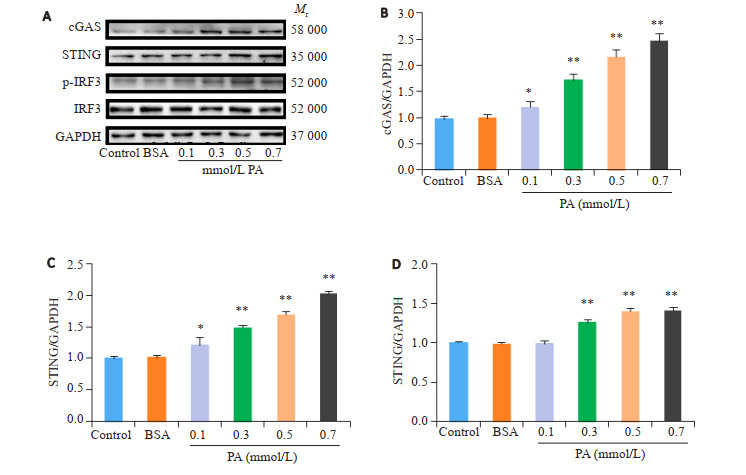
棕榈酸处理NRCMs24 h后cGAS-STING-IRF3通路激活, 且成浓度依赖性
Palmitic acid (PA) treatment for 24 h dose-dependent activates cGAS-STING-IRF3 pathway in NRCMs. A: Western blots of cGAS, STING and p-IRF3/IRF3 in NRCMs treated with BSA or PA (0, 0.1, 0.3, 0.5, and 0.7 mmol/L). B-D: Quantitative analysis of the protein expressions (n=4). *P < 0.05, **P < 0.01 vs BSA group.
2.4. cGAS siRNA转染NRCMs效率与cGAS敲降效果
用25、50、100 nmol/L cGAS siRNA处理NRCMs 24 h后于荧光显微镜下观察,发现绿色荧光随cGAS siRNA浓度增高逐渐增强,表明转染效率随浓度依次上升(图 4A)。因100 nmol/L转染效率最高,故选择用作后续实验。Western blot结果显示,NC组cGAS与Control组相比无统计学差异(0.96±0.06 vs 1.01±0.08,P>0.05),但cGAS siRNA组cGAS较NC组明显降低(0.47±0.08 vs 0.96±0.06,P < 0.05,图 4B、C)。
4.
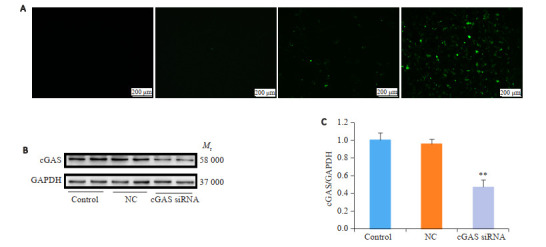
cGAS siRNA转染NRCMs效率与cGAS敲降效果
Efficiency of cGAS siRNA transfection and cGAS knockdown. A: Fluorescence microscopy of NRCMs e treated with Fam-cGAS-siRNA (25, 50, and 100 nmol/L) for 24 h. B: Western blots of cGAS in NRCMs transfected with NC-siRNA (100 nmol/L) and cGAS siRNA (100 nmol/L) for 24 h (n=4). **P < 0.01 vs NC group.
2.5. cGAS siRNA转染入NRCMs中敲降cGAS表达可逆转PA所致自噬和细胞活性下降
与Control组相比,PA明显诱导了cGAS(2.31± 0.15 vs 1.00±0.02,P < 0.05,图 5B)、STING(1.71±0.05 vs 1.00±0.02,P < 0.05,图 5C)、p-IRF3/IRF3(2.19±0.03 vs 1.03±0.04,P < 0.05,图 5D)和p62(5.55±0.49 vs 0.99± 0.02,P < 0.05,图 5G)的表达增加,并使PINK(0.36±0.03 vs 1.02±0.05,P < 0.05,图 5E)、Parkin(0.37±0.03 vs 1.02± 0.06,P < 0.05,图 5F)、LC3Ⅱ/LC3Ⅰ(0.54±0.05 vs 1.07± 0.07,P < 0.05,图 5H)和LC3 Ⅱ/LC3 Ⅰ + Ⅱ(0.70±0.04 vs 1.03±0.03,P < 0.05,图 5I)的表达和细胞活性(0.50±0.09 vs 1.00±0.08,P < 0.05,图 5J)下降。与PA组相比,PA+ sicGAS组cGAS(1.37±0.07 vs 2.31±0.15,P < 0.05)、STING(1.20±0.04 vs 1.71±0.05,P < 0.05)、p-IRF3/IRF3(1.39±0.12 vs 2.19±0.03,P < 0.05)和p62(3.01±0.34 vs 5.55±0.49,P < 0.05)的表达下降,而PINK(0.56±0.03 vs 0.36±0.03,P < 0.05)、Parkin(0.51±0.04 vs 0.37±0.03,P < 0.05)、LC3Ⅱ/LC3Ⅰ(0.94±0.04 vs 0.54±0.05,P < 0.05)和LC3Ⅱ/LC3Ⅰ+Ⅱ(0.97±0.02 vs 0.70±0.04,P < 0.05)的表达和细胞活性(0.77±0.07 vs 0.50±0.09,P < 0.05)上升。
5.
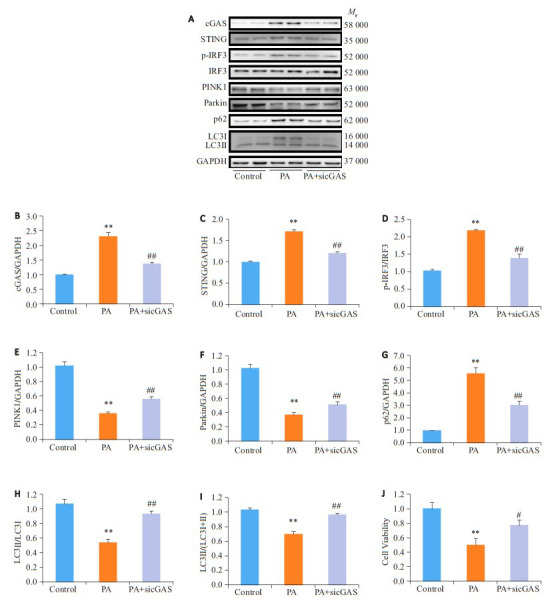
cGAS siRNA转染入NRCMs中敲降cGAS表达可逆转PA所致自噬和细胞活性下降
cGAS knockdown blocks palmitic acid (PA)-induced suppression of autophagy and cell viability reduction in NRCMs. A: Western blots of cGAS, STING, p-IRF3/IRF3, LC3 Ⅱ/LC3 Ⅰ, p62, Parkin and PINK1 in NRCMs transfected with cGAS siRNA before treatment with PA(0.7 mmol/L)for 24 h. B-I: Quantitative analysis of the protein expressions(n=4). **P < 0.01 vs control group; ##P < 0.01 vs PA group. J: Cell viability detected by CCK8 assay(n=4). **P < 0.01 vs control group; #P < 0.05 vs PA group.
2.6. 敲降cGAS表达可逆转PA所致NRCMs的LC3蛋白阳性着色降低和p62阳性着色增高
绿色荧光为LC3(左侧)和p62(右侧)蛋白染色,DAPI组为蓝色荧光表示的对应相同视野下的细胞核染色,Merge组二者合并图片(图 6)。与Control组相比,PA组中表示LC3的绿色荧光减弱,表示p62的绿色荧光增强。与PA处理组相比,PA+sicGAS组中表示LC3的绿色荧光增强,表示p62的绿色荧光减弱。
6.
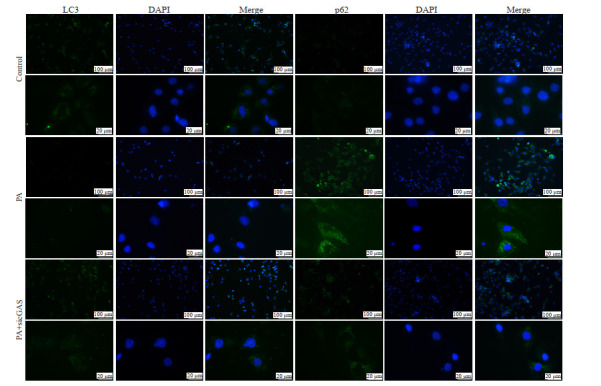
敲降cGAS表达可逆转棕榈酸所致NRCMs的LC3蛋白阳性着色降低和p62阳性着色增高
cGAS knockdown blocks palmitic acid (PA)-induced decrease of LC3 protein and increase of p62 protein expression in NRCMs.
3. 讨论
本实验探究了脂毒性心肌损伤的相关机制原理,通过使用PA处理NRCMs探究其自噬功能和细胞活性的改变,创新性的提出了cGAS-STING-IRF3通路在其中具有重要作用。最后我们通过敲降cGAS的表达抑制cGAS-STING-IRF3通路的激活,证明了其在PA引起的心肌细胞自噬功能下降中具有重要调节作用。
自噬是真核生物通过溶酶体或胞液进行饥饿状态下的营养动员,从而清除受损蛋白质的一种高度保守的胞内降解途径[18-19]。我们发现经过PA处理后,NRCMs中LC3Ⅱ与LC3Ⅰ的比值以及与总LC3的比值下降。LC3是自噬体膜形成的标记蛋白,通过调控自噬体的形成参与细胞自噬[20]。当自噬发生时,LC3Ⅰ蛋白首先合成,之后与磷脂酰乙醇胺结合,形成LC3Ⅱ蛋白,诱导自噬小体的形成[21]。比值下降意味着LC3Ⅱ的生成受抑制,自噬功能减退。此外,我们的结果表明NRCMs中p62表达随PA浓度增大而增大。p62蛋白是细胞自噬的降解底物,其通过结合泛素化蛋白,与LC3结合形成复合物,转入自噬溶酶体中被降解[22-23]。因此,当p62表达增加,表明其未被自噬活动所降解,即自噬功能受抑制。所以,LC3和p62的结果均表明了在PA抑制了NRCMs生理状况下的自噬功能。生理性自噬对心血管具有保护作用[24]。但当自噬过低时,部分未及时清除的细胞内错误折叠的蛋白不仅导致细胞内剧烈的内质网应激反应,还能够加剧炎症反应,使细胞生存率降低[25]。这一点从我们的CCK8实验中也得到了印证。
线粒体自噬是保持线粒体数量和质量平衡的一种重要调控机制,主要负责回收并降解衰老或受损的线粒体,以维持线粒体稳态和细胞生存[26-27]。在我们的实验中,使用PA刺激NRCMs后,PINK1和Parkin的表达明显下调。PINK1/Parkin途径是最受关注并广泛存在于哺乳动物体内的线粒体自噬调节途径[28]。这表明PA除引起总自噬下降外,还可导致线粒体自噬功能障碍。这会导致受损的线粒体无法及时被清除而累积增多,并使大量促炎因子产生而引起炎症反应,最终引起细胞生存率降低[29]。因而线粒体自噬功能下降也与我们CCK8实验中得到的细胞生存率下降是一致的。
已有研究表明cGAS-STING-IRF3通路对自噬功能具有调节作用[30]。为此我们检测了PA诱导下NRCMs中cGAS、STING、p-IRF3/IRF3的表达变化情况。结果提示PA可以可激活NRCMs中cGAS-STING-IRF3通路。于是我们提出一个假设:cGAS-STING-IRF3通路参与调节PA引起的NRCMs自噬功能障碍和细胞活力下降。为验证这一假设,我们进一步通过cGAS siRNA敲降NRCMs中cGAS表达。实验结果表明,当cGASSTING-IRF3通路激活受阻时,PA对心肌细胞总自噬和线粒体自噬功能抑制作用可被明显逆转,最终表现为细胞生存率的提高。最后,我们通过免疫荧光染色来观察PA和cGAS siRNA对NRCMs中LC3和p62蛋白的阳性着色的影响,结果表明PA引起的NRCMs自噬功能降低可以被cGAS敲降所逆转。
我们的实验探究了心脏脂毒性损伤的一种可能的方式及潜在的机制。长期高脂饮食引起的肥胖已对人类健康造成严重威胁[31]。血液中游离脂肪酸的增加导致各个脏器中脂肪蓄积,在心脏中表现为心脏重塑,最终引起失代偿性心肌肥厚和收缩功能障碍而导致心功能衰竭[32]。我们的成果为治疗脂毒相关的心脏病提供了一种可能。不过本实验也存在局限性,探讨仅存在于细胞层面。通过高脂喂养小鼠引起心脏功能的变化,以及cGAS-STING-IRF3在其中的作用是我们后续实验计划。
总之,本实验发现PA通过激活cGAS-STINGIRF3通路能抑制NRCMs的自噬,使细胞生存能力降低。而通过cGAS敲降处理后,可逆转PA对心肌细胞自噬和细胞活性的抑制,保护了心肌细胞。
Biography
余蕙麟,在读硕士研究生,E-mail:446826414@qq.com
Funding Statement
国家自然科学基金(82070238)
Supported by National Natural Science Foundation of China(82070238)
Contributor Information
余 蕙麟 (Huilin YU), Email: 446826414@qq.com.
罗 素新 (Suxin LUO), Email: Luosuxin0204@163.com.
References
- 1.仲 美楠, 李 玉子. 棕榈酸在心血管疾病中的研究进展. 吉林医学. 2018;39(5):963–6. doi: 10.3969/j.issn.1004-0412.2018.05.078. [仲美楠, 李玉子. 棕榈酸在心血管疾病中的研究进展[J]. 吉林医学, 2018, 39(5): 963-6.] [DOI] [Google Scholar]
- 2.尧 青, 赵 辛元, 李 丹, et al. 西格列汀通过调控自噬和凋亡减轻棕榈酸诱导的心肌细胞损伤. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGYZ202123007.htm. 中国医院药学杂志. 2021;41(23):2423–7. [尧青, 赵辛元, 李丹, 等. 西格列汀通过调控自噬和凋亡减轻棕榈酸诱导的心肌细胞损伤[J]. 中国医院药学杂志, 2021, 41(23): 2423-7.] [Google Scholar]
- 3.Nguyen HC, Qadura M, Singh KK. Role of the fatty acid binding proteins in cardiovascular diseases: a systematic review. J Clin Med. 2020;9(11):3390. doi: 10.3390/jcm9113390. [Nguyen HC, Qadura M, Singh KK. Role of the fatty acid binding proteins in cardiovascular diseases: a systematic review[J]. J Clin Med, 2020, 9(11): 3390.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Wen DT, Zheng L, Li JX, et al. Endurance exercise resistance to lipotoxic cardiomyopathy is associated with cardiac NAD+/dSIR2/ PGC-1α pathway activation in old Drosophila. Biol Open. 2019;8(10):bio044719. doi: 10.1242/bio.044719. [Wen DT, Zheng L, Li JX, et al. Endurance exercise resistance to lipotoxic cardiomyopathy is associated with cardiac NAD+/dSIR2/ PGC-1α pathway activation in old Drosophila[J]. Biol Open, 2019, 8(10): bio044719.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Nakamura M, Liu T, Husain S, et al. Glycogen synthase kinase-3α promotes fatty acid uptake and lipotoxic cardiomyopathy. Cell Metab. 2019;29(5):1119–34. doi: 10.1016/j.cmet.2019.01.005. [Nakamura M, Liu T, Husain S, et al. Glycogen synthase kinase-3α promotes fatty acid uptake and lipotoxic cardiomyopathy[J]. Cell Metab, 2019, 29(5): 1119-34. e12.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Hong SW, Lee JM, Kim MJ, et al. Clusterin protects lipotoxicityinduced apoptosis via upregulation of autophagy in insulinsecreting cells. Endocrinol Metab (Seoul) 2020;35(4):943–53. doi: 10.3803/EnM.2020.768. [Hong SW, Lee JM, Kim MJ, et al. Clusterin protects lipotoxicityinduced apoptosis via upregulation of autophagy in insulinsecreting cells[J]. Endocrinol Metab (Seoul), 2020, 35(4): 943-53.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Zhang YM, Whaley-Connell AT, Sowers JR, et al. Autophagy as an emerging target in cardiorenal metabolic disease: from pathophysiology to management. Pharmacol Ther. 2018;191:1–22. doi: 10.1016/j.pharmthera.2018.06.004. [Zhang YM, Whaley-Connell AT, Sowers JR, et al. Autophagy as an emerging target in cardiorenal metabolic disease: from pathophysiology to management[J]. Pharmacol Ther, 2018, 191: 1-22.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Yao Q, Ke ZQ, Guo S, et al. Curcumin protects against diabetic cardiomyopathy by promoting autophagy and alleviating apoptosis. J Mol Cell Cardiol. 2018;124:26–34. doi: 10.1016/j.yjmcc.2018.10.004. [Yao Q, Ke ZQ, Guo S, et al. Curcumin protects against diabetic cardiomyopathy by promoting autophagy and alleviating apoptosis [J]. J Mol Cell Cardiol, 2018, 124: 26-34.] [DOI] [PubMed] [Google Scholar]
- 9.Zhang XW, Bai XC, Chen ZJ. Structures and mechanisms in the cGAS-STING innate immunity pathway. Immunity. 2020;53(1):43–53. doi: 10.1016/j.immuni.2020.05.013. [Zhang XW, Bai XC, Chen ZJ. Structures and mechanisms in the cGAS-STING innate immunity pathway[J]. Immunity, 2020, 53 (1): 43-53.] [DOI] [PubMed] [Google Scholar]
- 10.Xu QQ, Xiong HL, Zhu WX, et al. Small molecule inhibition of cyclic GMP-AMP synthase ameliorates Sepsis-induced cardiac dysfunction in mice. Life Sci. 2020;260:118315. doi: 10.1016/j.lfs.2020.118315. [Xu QQ, Xiong HL, Zhu WX, et al. Small molecule inhibition of cyclic GMP-AMP synthase ameliorates Sepsis-induced cardiac dysfunction in mice[J]. Life Sci, 2020, 260: 118315.] [DOI] [PubMed] [Google Scholar]
- 11.Gui X, Yang H, Li T, et al. Autophagy induction via STING trafficking is a primordial function of the cGAS pathway. Nature. 2019;567(7747):262–6. doi: 10.1038/s41586-019-1006-9. [Gui X, Yang H, Li T, et al. Autophagy induction via STING trafficking is a primordial function of the cGAS pathway[J]. Nature, 2019, 567(7747): 262-6.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Xie M, Morales CR, Lavandero S, et al. Tuning flux: autophagy as a target of heart disease therapy. Curr Opin Cardiol. 2011;26(3):216–22. doi: 10.1097/HCO.0b013e328345980a. [Xie M, Morales CR, Lavandero S, et al. Tuning flux: autophagy as a target of heart disease therapy[J]. Curr Opin Cardiol, 2011, 26 (3): 216-22.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.刘 涛, 李 晶, 鲍 翠玉. 基于PERK/ATF4/CHOP通路探讨普伐他汀对棕榈酸诱导心肌细胞损伤的影响. 中国药理学通报. 2021;37(8):1183–4. doi: 10.3969/j.issn.1001-1978.2021.08.026. [刘涛, 李晶, 鲍翠玉. 基于PERK/ATF4/CHOP通路探讨普伐他汀对棕榈酸诱导心肌细胞损伤的影响[J]. 中国药理学通报, 2021, 37(8): 1183-4.] [DOI] [Google Scholar]
- 14.Guo YZ, You YH, Lv DY, et al. Inducible nitric oxide synthase contributes to insulin resistance and cardiac dysfunction after burn injury in mice. Life Sci. 2019;239:116912. doi: 10.1016/j.lfs.2019.116912. [Guo YZ, You YH, Lv DY, et al. Inducible nitric oxide synthase contributes to insulin resistance and cardiac dysfunction after burn injury in mice[J]. Life Sci, 2019, 239: 116912.] [DOI] [PubMed] [Google Scholar]
- 15.郭 永正, 许 晴琴, 赵 美娜, et al. 心房钠尿肽通过上调OPA1表达抑制心衰小鼠心肌线粒体分裂并改善心脏功能. https://www.cnki.com.cn/Article/CJFDTOTAL-SWCX201811008.htm. 现代生物医学进展. 2018;18(11):2032–7. [郭永正, 许晴琴, 赵美娜, 等. 心房钠尿肽通过上调OPA1表达抑制心衰小鼠心肌线粒体分裂并改善心脏功能[J]. 现代生物医学进展, 2018, 18(11): 2032-7.] [Google Scholar]
- 16.Koitabashi N, Danner T, Zaiman AL, et al. Pivotal role of cardiomyocyte TGF-β signaling in the murine pathological response to sustained pressure overload. J Clin Invest. 2011;121(6):2301–12. doi: 10.1172/JCI44824. [Koitabashi N, Danner T, Zaiman AL, et al. Pivotal role of cardiomyocyte TGF-β signaling in the murine pathological response to sustained pressure overload[J]. J Clin Invest, 2011, 121(6): 2301-12.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Song Y, Zhang C, Zhang JX, et al. Localized injection of miRNA- 21-enriched extracellular vesicles effectively restores cardiac function after myocardial infarction. Theranostics. 2019;9(8):2346–60. doi: 10.7150/thno.29945. [Song Y, Zhang C, Zhang JX, et al. Localized injection of miRNA- 21-enriched extracellular vesicles effectively restores cardiac function after myocardial infarction[J]. Theranostics, 2019, 9(8): 2346-60.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.蒋 琦炜, 张 德宇, 石 烟祝, et al. 细胞自噬与肿瘤发生发展. https://www.cnki.com.cn/Article/CJFDTOTAL-JSYX202103016.htm. 军事医学. 2021;45(3):234–41. [蒋琦炜, 张德宇, 石烟祝, 等. 细胞自噬与肿瘤发生发展[J]. 军事医学, 2021, 45(3): 234-41.] [Google Scholar]
- 19.Xue XL, Li F, Cai M, et al. Interactions between endoplasmic Reticulum stress and autophagy: implications for apoptosis and neuroplasticity-related proteins in palmitic acid-treated prefrontal cells. Neural Plast. 2021;2021:8851327. doi: 10.1155/2021/8851327. [Xue XL, Li F, Cai M, et al. Interactions between endoplasmic Reticulum stress and autophagy: implications for apoptosis and neuroplasticity-related proteins in palmitic acid-treated prefrontal cells[J]. Neural Plast, 2021, 2021: 8851327.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.崔 晓丽, 魏 振, 沈 辉, et al. 雷帕霉素通过激活LC3介导的细胞自噬改善ApoE4/5×FAD小鼠的认知功能. 中国病理生理杂志. 2021;37(8):1400–8. doi: 10.3969/j.issn.1000-4718.2021.08.008. [崔晓丽, 魏振, 沈辉, 等. 雷帕霉素通过激活LC3介导的细胞自噬改善ApoE4/5×FAD小鼠的认知功能[J]. 中国病理生理杂志, 2021, 37(8): 1400-8.] [DOI] [Google Scholar]
- 21.Okubo S, Ohta T, Shoyama Y, et al. Steroidal saponins isolated from the rhizome of Dioscorea tokoro inhibit cell growth and autophagy in hepatocellular carcinoma cells. Life (Basel) 2021;11(8):749. doi: 10.3390/life11080749. [Okubo S, Ohta T, Shoyama Y, et al. Steroidal saponins isolated from the rhizome of Dioscorea tokoro inhibit cell growth and autophagy in hepatocellular carcinoma cells[J]. Life (Basel), 2021, 11(8): 749.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.石 宗华, 王 新军, 张 兰玉, et al. 红景天苷对脑出血后自噬蛋白Beclin-1、LC3-Ⅱ、p62的作用研究. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYHS202012016.htm. 中华中医药学刊. 2020;38(12):61–4, 282. [石宗华, 王新军, 张兰玉, 等. 红景天苷对脑出血后自噬蛋白Beclin-1、LC3-Ⅱ、p62的作用研究[J]. 中华中医药学刊, 2020, 38(12): 61-4, 282.] [Google Scholar]
- 23.胡 小丹, 朱 鸿秋, 朱 影, et al. 桂枝茯苓丸对PCOS模型小鼠卵巢颗粒细胞自噬的影响. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSFX202115001.htm. 中国实验方剂学杂志. 2021;27(15):1–7. [胡小丹, 朱鸿秋, 朱影, 等. 桂枝茯苓丸对PCOS模型小鼠卵巢颗粒细胞自噬的影响[J]. 中国实验方剂学杂志, 2021, 27(15): 1-7.] [Google Scholar]
- 24.Wu SY, Chang GL, Gao L, et al. Trimetazidine protects against myocardial ischemia/reperfusion injury by inhibiting excessive autophagy. J Mol Med (Berl) 2018;96(8):791–806. doi: 10.1007/s00109-018-1664-3. [Wu SY, Chang GL, Gao L, et al. Trimetazidine protects against myocardial ischemia/reperfusion injury by inhibiting excessive autophagy[J]. J Mol Med (Berl), 2018, 96(8): 791-806.] [DOI] [PubMed] [Google Scholar]
- 25.杜 军辉, 李 蓉, 马 楼艳, et al. 自噬与炎症的关系及其在眼科疾病中的相关研究进展. 临床眼科杂志. 2017;25(1):91–4. doi: 10.3969/j.issn.1006-8422.2017.01.029. [杜军辉, 李蓉, 马楼艳, 等. 自噬与炎症的关系及其在眼科疾病中的相关研究进展[J]. 临床眼科杂志, 2017, 25(1): 91-4.] [DOI] [Google Scholar]
- 26.Chu JYK, Ou JHJ. Autophagy in HCV replication and protein trafficking. Int J Mol Sci. 2021;22(3):1089. doi: 10.3390/ijms22031089. [Chu JYK, Ou JHJ. Autophagy in HCV replication and protein trafficking[J]. Int J Mol Sci, 2021, 22(3): 1089.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.闫 明静, 沈 涛. 线粒体功能障碍与血管内皮损伤的研究进展. 中国动脉硬化杂志. 2021;29(10):829–37. doi: 10.3969/j.issn.1007-3949.2021.10.002. [闫明静, 沈涛. 线粒体功能障碍与血管内皮损伤的研究进展[J]. 中国动脉硬化杂志, 2021, 29(10): 829-37.] [DOI] [Google Scholar]
- 28.陈 亚华, 陈 慧. Pink1/Parkin介导的线粒体自噬在心肌缺血再灌注损伤中的作用研究进展. 医学综述. 2021;27(10):1897–902. doi: 10.3969/j.issn.1006-2084.2021.10.005. [陈亚华, 陈慧. Pink1/Parkin介导的线粒体自噬在心肌缺血再灌注损伤中的作用研究进展[J]. 医学综述, 2021, 27(10): 1897-902.] [DOI] [Google Scholar]
- 29.Bi W, Jia JL, Pang R, et al. Thyroid hormone postconditioning protects hearts from ischemia/reperfusion through reinforcing mitophagy. Biomed Pharmacother. 2019;118:109220. doi: 10.1016/j.biopha.2019.109220. [Bi W, Jia JL, Pang R, et al. Thyroid hormone postconditioning protects hearts from ischemia/reperfusion through reinforcing mitophagy[J]. Biomed Pharmacother, 2019, 118: 109220.] [DOI] [PubMed] [Google Scholar]
- 30.Yuan LS, Mao Y, Luo W, et al. Palmitic acid dysregulates the Hippo-YAP pathway and inhibits angiogenesis by inducing mitochondrial damage and activating the cytosolic DNA sensor cGAS-STING-IRF3 signaling mechanism. J Biol Chem. 2017;292(36):15002–15. doi: 10.1074/jbc.M117.804005. [Yuan LS, Mao Y, Luo W, et al. Palmitic acid dysregulates the Hippo-YAP pathway and inhibits angiogenesis by inducing mitochondrial damage and activating the cytosolic DNA sensor cGAS-STING-IRF3 signaling mechanism[J]. J Biol Chem, 2017, 292(36): 15002-15.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.杨 姝瑞, 周 钰点, 王 雅媛, et al. 从食欲调控论针刺干预肥胖的机制. 华中科技大学学报: 医学版. 2021;50(4):544–7. doi: 10.3870/j.issn.1672-0741.2021.04.024. [杨姝瑞, 周钰点, 王雅媛, 等. 从食欲调控论针刺干预肥胖的机制[J]. 华中科技大学学报: 医学版, 2021, 50(4): 544-7.] [DOI] [Google Scholar]
- 32.Zhao L, Fu K, Li XX, et al. Aldehyde dehydrogenase 2 protects cardiomyocytes against lipotoxicity via the AKT/glycogen synthase kinase 3 beta pathways. Biochem Biophys Res Commun. 2020;525(2):360–5. doi: 10.1016/j.bbrc.2020.02.096. [Zhao L, Fu K, Li XX, et al. Aldehyde dehydrogenase 2 protects cardiomyocytes against lipotoxicity via the AKT/glycogen synthase kinase 3 beta pathways[J]. Biochem Biophys Res Commun, 2020, 525(2): 360-5.] [DOI] [PubMed] [Google Scholar]


