Abstract
目的
观察生长分化因子11(GDF11)对小鼠颞下颌关节(TMJ)骨关节炎(OA)髁突软骨细胞脂肪化的影响。
方法
对雌性6周龄C57小鼠施加单侧前牙反 (UAC)刺激并局部注射GDF11。取TMJ髁突软骨进行番红O染色;GDF11、脂联素(Adiponectin)免疫组织化学染色;实时定量聚合酶链式反应(real-time PCR)检测GDF11、Adiponectin、Ⅱ型胶原(Col-Ⅱ)、Aggrecan、Ⅰ型胶原(Col-Ⅰ)、脂肪酸结合蛋4(FABP4)、脂滴包被蛋白1(Perilipin 1)的mRNA含量。
(UAC)刺激并局部注射GDF11。取TMJ髁突软骨进行番红O染色;GDF11、脂联素(Adiponectin)免疫组织化学染色;实时定量聚合酶链式反应(real-time PCR)检测GDF11、Adiponectin、Ⅱ型胶原(Col-Ⅱ)、Aggrecan、Ⅰ型胶原(Col-Ⅰ)、脂肪酸结合蛋4(FABP4)、脂滴包被蛋白1(Perilipin 1)的mRNA含量。
结果
UAC实验组髁突软骨显著变薄、番红O阳性面积显著减少;Col-Ⅱ和Aggrecan的mRNA表达量显著降低;Adiponectin阳性细胞率显著增加;Col-Ⅰ、Adiponectin、FABP4、Perilipin 1的mRNA表达量显著上升。GDF11注射后髁突软骨显著增厚、番红O阳性面积显著增加;Col-Ⅱ和Aggrecan的mRNA表达量显著升高;Adiponectin阳性细胞率显著减少;Col-Ⅰ、Adiponectin、FABP4、Perilipin 1的mRNA表达量显著降低。
结论
UAC刺激诱导的髁突退变软骨中GDF11表达降低并存在软骨细胞脂肪化,补充外源性GDF11可有效抑制软骨细胞脂肪化。
Keywords: 颞下颌关节, 骨关节炎, 生长分化因子11, 软骨细胞, 脂肪化
Abstract
Objective
To observe the effect of growth differentiation factor 11 (GDF11) on the steatosis of condylar chondrocytes in temporomandibular joint (TMJ) osteoarthritic mice.
Methods
Six-week-old female C57 mice were stimulated with unilateral anterior crossbite (UAC) and locally injected with GDF11. TMJ sections were stained with safranin O, and GDF11 and Adiponectin in the TMJ cartilage were detected by immunohistochemical staining. GDF11, Adiponectin, type II collagen (Col-II), Aggrecan, type I collagen (Col-I), fatty acid-binding protein 4 (FABP4), and Perilipin 1 mRNA were detected by real-time polymerase chain reaction (real-time PCR).
Results
The thickness and safranin O-positive area of TMJ cartilage in the UAC groups, as well as the mRNA expression of Col-II and aggrecan, significantly decreased. The ratio of Adiponectin-positive cells significantly increased. The mRNA expression levels of Col-I, Adiponectin, FABP4, and Perilipin 1 significantly increased. The TMJ cartilage of the GDF11 injection groups significantly thickened, and the safranin O-positive area significantly increased. The mRNA expression of Col-II and Aggrecan significantly increased. The ratio of Adiponectin-positive cells significantly decreased. The mRNA expression levels of Col-I, Adiponectin, FABP4, and Perilipin 1 significantly decreased.
Conclusion
Extensive steatosis of chondrocytes and decreased expression of GDF11 in the degenerated cartilage of TMJ osteoarthritis are induced by UAC stimulation. Supplementation of exogenous GDF11 can effectively inhibit the steatosis of chondrocytes.
Keywords: temporomandibular joint, osteoarthritis, growth differentiation factor 11, chondrocytes, steatosis
颞下颌关节(temporomandibular joint,TMJ)骨关节炎(osteoarthritis,OA)是颞下颌关节紊乱病(temporomandibular disorder,TMD)的重症表现,14.56%的TMD患者具有TMJ OA的影像学征象[1]。TMJ髁突软骨退变是TMJ OA的主要病理改变,髁突软骨细胞作为TMJ髁突软骨中唯一的细胞类型,在软骨退变过程中发挥了决定性作用,但其具体机制仍有待进一步明确。近年来有研究[2]表明脂质代谢异常参与膝关节OA的病变发展,膝关节OA软骨细胞内可出现明显的脂肪化改变,但TMJ OA软骨细胞是否也有类似改变目前尚无报道。
生长分化因子11(growth differentiation factor 11,GDF11)又名骨形态发生蛋白11(bone morphogenetic protein 11,BMP11),属于转化生长因子β(transforming growth factor β,TGF-β)超家族,参与了骨骼的发育和牙本质形成[3]–[4]。近年来有研究发现GDF11可抑制骨髓间充质干细胞向脂肪细胞的分化[5]–[6],也能够减轻低单核细胞及肝细胞的脂质沉积[7]–[8]。但目前TMJ OA退变软骨中GDF11的表达是否存在变化仍然缺少研究。
本研究通过对小鼠施加单侧前牙反 (unilateral anterior crossbite,UAC)诱导TMJ OA[9],明确TMJ髁突退变软骨中细胞脂肪化和GDF11表达的联系。同时对TMJ OA小鼠进行关节腔周围的GDF11注射,探索GDF11对抑制TMJ OA进程中软骨细胞脂肪化和软骨退变的作用。
(unilateral anterior crossbite,UAC)诱导TMJ OA[9],明确TMJ髁突退变软骨中细胞脂肪化和GDF11表达的联系。同时对TMJ OA小鼠进行关节腔周围的GDF11注射,探索GDF11对抑制TMJ OA进程中软骨细胞脂肪化和软骨退变的作用。
1. 材料和方法
本研究通过第四军医大学口腔医院伦理委员会审查(2017伦审字007号)。
1.1. 试剂
GDF11抗体(ab124721)、Adiponectin抗体(ab181281)(Abcam公司,英国);山羊抗兔二抗试剂盒(SP-9001)、复合消化液、抗原修复液(北京中杉金桥生物技术有限公司);引物设计及合成由日本Takara公司完成;Trizol溶液(15596026,Thermo Fisher公司,美国);RNA反转试剂盒PrimeScript RT Master Mix(RR036A)、实时定量聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)试剂盒SYBR Premix Ex TaqTM II(RR820A)(Takara公司,日本); DAB显色试剂盒(CW0125)(泰州康维世纪公司)。
1.2. 动物模型建立及分组处理
6周龄雌性C57小鼠(150只)由第四军医大学动物中心提供,随机分为10组,分别为3周对照组、3周UAC实验组、7周对照组、7周UAC实验组、11周对照组、11周UAC实验组、7周UAC+PBS注射组、7周UAC+GDF11注射组、11周UAC+PBS注射组、11周UAC+GDF11注射组,每组实验动物数量15只。1%戊巴比妥麻醉小鼠后,在左侧上、下颌切牙粘接不良修复体。不良修复体利用15号注射针头制作,上颌不良修复体长度1.5 mm,下颌不良修复体导板长度1.5 mm,套筒管长度2.5 mm,导板与套筒管长轴成45°。隔湿后使用聚羧酸锌水门汀粘接不良修复体,整个过程在5 min内完成。整个实验期间保证不良修复体无脱落。对照组小鼠实施同样操作过程,但是不粘接不良修复体。
7周、11周UAC+PBS注射组/UAC+GDF11注射组小鼠于UAC造模后第二天开始行相关药物局部注射,1%戊巴比妥麻醉后沿颧弓后部向后上方进针,抵及骨面后将药物注入,注射量为20 µL,隔天注射。
所有小鼠在同样条件下饲养。在各个实验时间点处死相应小鼠后,各组左侧15个髁突软骨随机分为3份,每份5个髁突软骨;右侧10个髁突随机分为2份,每份5个髁突软骨,这5份髁突软骨用于RNA的提取和后续实验。右侧剩余的5个髁突软骨用于组织染色。
1.3. 总RNA提取、反转和real-time PCR
髁突软骨液氮冷冻5 min后充分砸碎,收集组织粉末后Trizol法提取总RNA。PrimeScript RT Master Mix试剂盒反转RNA,SYBR Premix Ex TaqTM Ⅱ试剂盒进行real-time PCR反应。Ⅱ型胶原(type Ⅱ collagen,Col-Ⅱ)、聚蛋白多糖(Aggrecan)、Ⅰ型胶原(type Ⅰ collagen,Col-Ⅰ)、脂联素(Adiponectin)、脂肪酸结合蛋4(fatty acid-binding protein 4,FABP4)、脂滴包被蛋白1(Perilipin 1)、内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH),引物信息见表1。
表 1. 引物序列.
Tab 1 Sequences of primers
| 分子 | 引物序列 |
| GDF11 | F:CTGCGCCTAGAGAGCATCAAG |
| R:TCTCGGTGGTAGCGTGGTA | |
| Adiponectin | F:CCCCGGAACCCCTGGCAGGAAAG |
| R:GGGTCTCCAGCCCCACACTGAACG | |
| Col-Ⅱ | F:CATCCAGGGCTCCAATGATGTA |
| R:ATGTCCATGGGTGCGATGTC | |
| Aggrecan | F:TTCCACCAGTGCGATGCAG |
| R:TGGTGTCCCGGATTCCGTA | |
| Col-Ⅰ | F:GCGAGTGCTGTGCTTTCT |
| R:AGCAAAGTTTCCTCCAAGG | |
| FABP4 | F:CGCAGACGACAGGAAGGTGA |
| R:TCCACCACCAGCTTGTCACC | |
| Perilipin 1 | F:TTACAGCCCTGCCCAACCCGAGAG |
| R:TGCCCAGGTCACTGCGGAGATGG | |
| GAPDH | F:TGTGTCCGTCGTGGATCTGA |
| R:TTGCTGTTGAAGTCGCAGGAG |
1.4. 组织块处理及染色
分离的TMJ关节组织浸泡于4%多聚甲醛固定液中,固定24 h后10%乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)溶液(pH=7.4)脱钙4周,梯度乙醇脱水后石蜡包埋切片。石蜡切片常规脱蜡至水,参照免疫组化试剂盒说明书中描述的SABC法进行GDF11和Adiponectin免疫组化染色。番红O染色时,切片新鲜二甲苯脱蜡,梯度乙醇至水;1%固绿溶液染色2 min,1%醋酸乙醇轻微洗涤10 s;1%番红O溶液染色5 min,95%乙醇轻微洗涤10~20 s;风干后新鲜二甲苯5 min透明,中性树胶封片。
1.5. 统计学处理
采用SPSS 17.0软件对研究结果进行统计分析。所有数据采用平均值±标准差方式表示,同一时间点的两组数据比较采用独立样本t检验,P<0.05为具有统计学意义。
2. 结果
2.1. 构建UAC致小鼠TMJ OA模型
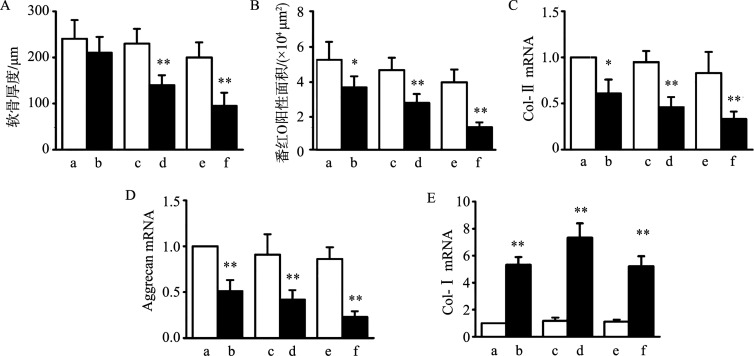
对6周龄小鼠施加UAC刺激后,TMJ髁突软骨呈现典型的OA样改变(图1)。与同期正常对照组相比,UAC实验组小鼠TMJ髁突软骨厚度在7周及11周后显著降低(7周:t=3.767,P=0.002 2;11周:t=4.604,P=0.000 2)(图1和图2A)。番红O染色显示UAC实验组小鼠TMJ髁突软骨基质成分大量丢失,番红O阳性面积在3、7及11周后显著减少(3周:t=2.942,P=0.018 6;7周:t=5.295,P<0.000 1;11周:t=7.06,P<0.000 1)(图1和图2B)。软骨基质标志分子Col-Ⅱ(3周:t=3.081,P=0.013 1;7周:t=3.852,P=0.001 7;11周:t=3.467,P=0.004 8)(图2C)和Aggrecan(3周:t=3.621,P=0.003 2;7周:t=3.258,P=0.008 3;11周:t=3.983,P=0.001 2)(图2D)的mRNA含量在UAC实验组小鼠TMJ髁突软骨中显著降低,而Col-Ⅰ的mRNA含量则显著升高(3周:t=13.42,P<0.000 1;7周:t=11.13,P<0.000 1;11周:t=10.12,P<0.000 1)(图2E)。
图 1. 正常小鼠和TMJ OA小鼠髁突软骨番红O染色结果 番红O染色 × 200.
Fig 1 Safranin O staining of TMJ condylar cartilage in normal and TMJ OA mice safranin O staining × 200
图 2. 正常小鼠和TMJ OA小鼠髁突软骨退变情况对比.
Fig 2 Comparison of TMJ condylar cartilage in normal and TMJ OA mice
A:软骨厚度;B:番红O阳性面积;C:Col-Ⅱ mRNA表达量;D:Aggrecan mRNA表达量;E:Col-Ⅰ表达量。a:3周对照组;b:3周UAC实验组;c:7周对照组;d:7周UAC实验组;e:11周对照组;f:11周UAC实验组。与同期对照组相比,*P<0.05,**P<0.01。
2.2. 正常对照组和UAC实验组小鼠髁突软骨中的脂肪化情况
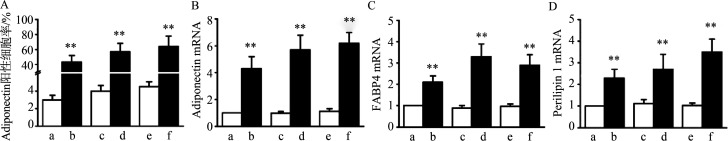
在正常对照组小鼠TMJ髁突软骨中,Adiponectin阳性细胞数量极少,而在3周UAC实验组TMJ髁突软骨中,浅层和中层出现大量Adiponectin阳性软骨细胞(t=7.886,P<0.000 1);在7周和11周时,UAC实验组TMJ髁突软骨中Adiponectin阳性软骨细胞继续增加,且在全层软骨广泛分布(7周:t=10.92,P<0.000 1;11周:t=12.64,P<0.000 1)(图3和图4A)。同时,Adiponectin(3周:t=7.025,P<0.000 1;7周:t=3.952,P=0.001 3;11周:t=4.83,P=0.000 1)(图4B)及另外两种脂肪化标志分子FABP4(3周:t=6.243,P<0.000 1;7周:t=13.42,P<0.000 1;11周:t=9.625,P<0.000 1)(图4C)、Perilipin 1(3周:t=5.243,P<0.000 1;7周:t=6.772,P<0.000 1;11周:t=11.14,P<0.000 1)(图4D)的mRNA含量在3、7及11周的UAC实验组TMJ髁突软骨中均显著增加。
图 3. 正常小鼠和TMJ OA小鼠髁突软骨Adiponectin免疫组织化学染色结果 免疫组织化学染色 × 200.
Fig 3 Adiponectin immunohistochemical staining of TMJ condylar cartilage in normal and TMJ OA mice immunohistochemical staining × 200
图 4. 正常小鼠和TMJ OA小鼠髁突软骨内脂肪化情况对比.
Fig 4 Comparison of steatosis in TMJ condylar cartilage between normal and TMJ OA mice
A:Adiponectin阳性细胞率;B:Adiponectin mRNA表达量;C:FABP4 mRNA表达量;D:Perilipin 1 mRNA表达量。a:3周对照组;b:3周UAC实验组;c:7周对照组;d:7周UAC实验组;e:11周对照组;f:11周UAC实验组。与同期对照组相比,**P<0.01。
2.3. 正常对照组和UAC实验组小鼠髁突软骨中GDF11的表达情况
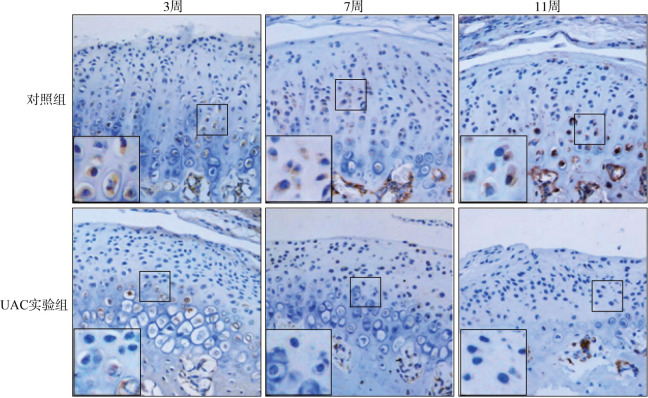
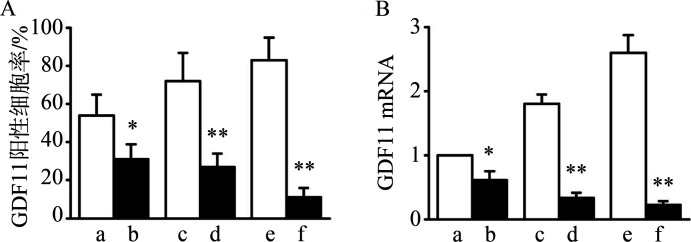
在正常对照组小鼠TMJ髁突软骨中,GDF11阳性软骨细胞在全层软骨广泛分布,而在UAC实验组TMJ髁突软骨中,GDF11阳性细胞显著减少,且仅存在于软骨深层(3周:t=2.815,P=0.025 4;7周:t=6.815,P<0.000 1;11周:t=10.67,P<0.000 1)(图5和图6A)。同时,GDF11的mRNA含量在3、7及11周的UAC实验组TMJ髁突软骨中均显著降低(3周:t=2.869,P=0.022 3;7周:t=10.04,P<0.000 1;11周:t=17.57,P<0.000 1)(图6B)。
图 5. 正常小鼠和TMJ OA小鼠髁突软骨GDF11免疫组织化学染色结果 免疫组织化学染色 × 200.
Fig 5 GDF11 immunohistochemical staining of TMJ condylar cartilage in normal and TMJ OA mice immunohistochemical staining × 200
图 6. 正常小鼠和TMJ OA小鼠髁突软骨内GDF11的表达对比.
Fig 6 Comparison of GDF11 expression in TMJ condylar cartilage between normal and TMJ OA mice
A:GDF11阳性细胞率;B:GDF11 mRNA表达量。a:3周对照组;b:3周UAC实验组;c:7周对照组;d:7周UAC实验组;e:11周对照组;f:11周UAC实验组。与同期对照组相比,*P<0.05;**P<0.01。
2.4. GDF11局部注射对TMJ OA髁突软骨的影响
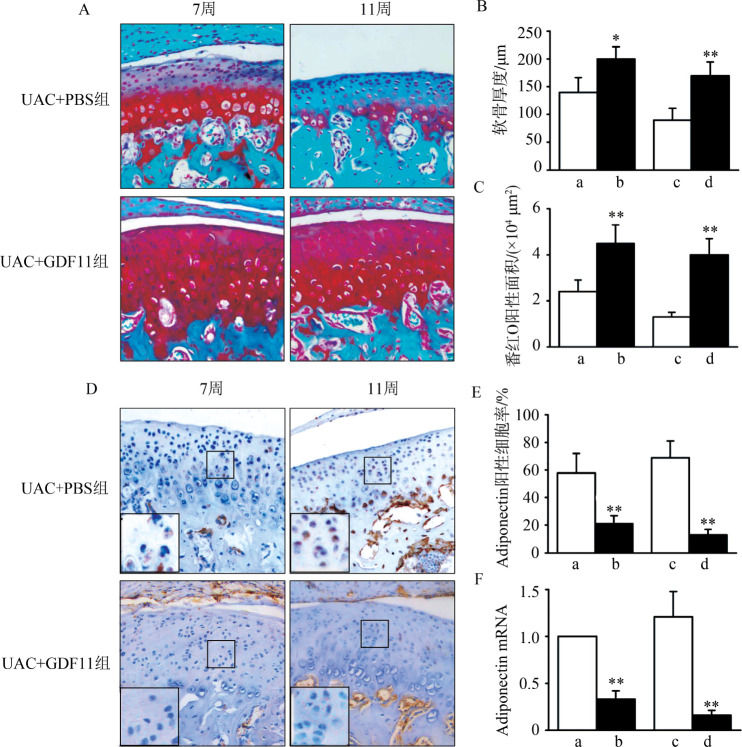
对UAC实验组小鼠在TMJ周围局部分别注射GDF11和PBS。与PBS注射组相比,在GDF11持续注射7周和11周后,TMJ髁突软骨厚度(7周:t=3.136,P=0.010 4;11周:t=5.645,P<0.000 1)(图7A、B)和番红O阳性面积(7周:t=4.772,P=0.000 2;11周:t=4.989,P=0.000 1)(图7A、C)均显著增加;软骨基质标志分子Col-Ⅱ(7周:t=5.029,P=0.000 1;11周:t=4.67,P=0.000 3)(图8A)和Aggrecan(7周:t=5.276,P<0.000 1;11周:t=7.738,P<0.000 1)(图8B)的mRNA含量在GDF11注射组小鼠髁突软骨中显著增加,而Col-Ⅰ的mRNA含量则显著减少(7周:t=17.44,P<0.000 1;11周:t=14.39,P<0.000 1)(图8C)。与PBS注射组相比,在GDF11持续注射7周和11周后,TMJ髁突软骨中Adiponectin阳性细胞数量显著降低(7周:t=5.864,P<0.000 1;11周:t=8.487,P<0.000 1)(图7D、E);同时Adiponectin(7周:t=4.973,P=0.000 1;11周:t=8.033,P<0.000 1)(图7F)、FABP4(7周:t=4.549,P=0.000 4;11周:t=5.003,P=0.000 1)(图8D)及Perilipin 1(7周:t=3.807,P=0.002 2;11周:t=6.662,P<0.000 1)(图8E)的mRNA含量也显著降低。
图 7. PBS注射和GDF11注射小鼠髁突软骨退变、脂肪化情况对比.
Fig 7 Comparison of degeneration and steatosis in TMJ condylar cartilage between mice with PBS or GDF11 injection
A:髁突软骨 番红O染色 × 200;B:软骨厚度;C:番红O阳性面积;D:髁突软骨Adiponectin 免疫组织化学染色 × 200;E:Adiponectin阳性细胞率;F:Adiponectin mRNA表达量。a:7周UAC+PBS注射组;b:7周UAC+GDF11注射组;c:11周UAC+PBS注射组;d:11周UAC+GDF11注射组。与同期对照组相比,*P<0.05;**P<0.01。
图 8. PBS注射和GDF11注射小鼠髁突软骨退变、脂肪化相关分子表达对比.
Fig 8 Comparison of molecular expression related to degeneration and steatosis in TMJ condylar cartilage between mice with PBS or GDF11 injection
A:Col-Ⅱ mRNA表达量;B:Aggrecan mRNA表达量;C:Col-Ⅰ表达量;D:FABP4 mRNA表达量;E:Perilipin 1 mRNA表达量。a:7周UAC+PBS注射组;b:7周UAC+GDF11注射组;c:11周UAC+PBS注射组;d:11周UAC+GDF11注射组。与同期对照组相比,**P<0.01。
3. 讨论
TMJ OA是TMD的重症表现,主要病理改变为TMJ髁突软骨的退变,但是目前TMJ OA的致病因素尚未完全明确。在临床最常见的膝关节和髋关节OA发病过程中,异常生物力刺激起到了关键性的作用[10]。对于TMJ而言,在行使咀嚼功能时将承受生物力的刺激,而异常咬合将可能导致TMJ承受的生物力环境发生改变,进而诱发TMD甚至TMJ OA[11]。在本研究中通过构建UAC改变小鼠的TMJ生物力学环境,成功在TMJ诱导出OA样的软骨退变,进一步证实了咬合异常因素在TMD和TMJ OA发病中的关键作用。
OA的主要病理改变是软骨组织的退变,而软骨细胞作为软骨组织中唯一的细胞类型,在维持软骨稳态方面发挥了核心作用,软骨细胞功能活动的异常将不可避免地影响整个软骨的健康。近年来研究发现软骨细胞脂质代谢与OA发病有重要关联[12],脂质代谢异常将导致软骨细胞内出现脂肪堆积等脂肪化表现,脂肪化程度则和OA严重程度呈现正相关关系[13]–[14]。在本研究中正常对照组小鼠TMJ髁突软骨内基本没有细胞脂肪化的表现,而TMJ OA小鼠髁突软骨内Adiponectin、FABP4、Perilipin 1等脂肪化标志分子的表达显著升高,提示在TMJ OA的髁突软骨中也存在软骨细胞脂肪化的表现。而且在3周时Adiponectin阳性细胞主要分布于TMJ髁突软骨的浅层和中层,在7周和11周时在软骨全层广泛表达,这一结果提示浅层和中层的TMJ髁突软骨细胞更容易在异常生物力刺激下发生脂质代谢的异常,出现软骨细胞的脂肪化。
GDF11已被证实可以抑制骨髓间充质干细胞向脂肪细胞分化[5]–[6],还可以抑制单核细胞[7]、肝细胞[8]内的脂质沉积,因此具有明确的抗脂肪化作用。本研究发现在正常对照组小鼠TMJ髁突软骨中,GDF11在软骨全层广泛高表达,而在TMJ OA软骨中GDF11表达显著降低,且3周时主要在浅层和中层降低,7周和11周时全层降低。结合3周时软骨细胞脂肪化主要出现在髁突软骨的浅层和中层,7周和11周时出现在软骨全层的现象,提示GDF11的减少可能是TMJ OA中软骨细胞脂肪化的重要原因。为进一步明确GDF11的抗脂肪化作用,本研究对TMJ OA小鼠进行外源性GDF11的局部注射,注射组小鼠的TMJ软骨厚度和基质含量均有显著提升,且明显抑制了软骨细胞脂肪化,提示GDF11有望作为新型治疗药物用于OA的治疗,在抑制软骨细胞脂肪化进而延缓软骨退变方面发挥积极作用。与本研究结果相似,有文献[13]指出对老年小鼠给予GDF11后可以显著减轻膝关节软骨的增龄性退变,同样提示GDF11对于关节软骨的积极保护作用。
综上所述,异常咬合可以诱导TMJ髁突软骨出现OA病变,在TMJ OA髁突退变软骨中存在广泛的软骨细胞脂肪化,补充外源性GDF11可以有效地抑制软骨细胞脂肪化进而缓解髁突软骨退变程度。GDF11有望成为新的OA治疗药物,但目前GDF11抑制软骨细胞脂肪化的具体机制仍然不明,需要后期进一步的研究和探索。
Funding Statement
[基金项目] 国家自然科学基金(81700995);大学生创新创业训练项目(202110459049)
Supported by: The National Natural Science Foundation of China (81700995); Innovation and Entrepreneurship Training Program for College Students (202110459049).
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.张 婧. 实验性咬合紊乱致大鼠TMJ髁突骨关节炎样变及Cx43半通道在关节软骨退变中的作用[D] 西安: 第四军医大学; 2013. [Google Scholar]; Zhang J. The study of OA-like alterations and Cx43 hemichannels function in cartilage degradation of rat TMJ induced by experimentally created disordered occlusion[D] Xi'an: The Fourth Military Medical University; 2013. [Google Scholar]
- 2.Liang B, Mamidi MK, Samsa WE, et al. Targeted and sustained Sox9 expression in mouse hypertrophic chondrocytes causes severe and spontaneous osteoarthritis by perturbing cartilage homeostasis[J] Am J Transl Res. 2020;12(3):1056–1069. [PMC free article] [PubMed] [Google Scholar]
- 3.Egerman MA, Glass DJ. The role of GDF11 in aging and skeletal muscle, cardiac and bone homeostasis[J] Crit Rev Biochem Mol Biol. 2019;54(2):174–183. doi: 10.1080/10409238.2019.1610722. [DOI] [PubMed] [Google Scholar]
- 4.Qi X, Xiao Q, Sheng R, et al. Endogenous GDF11 regulates odontogenic differentiation of dental pulp stem cells[J] J Cell Mol Med. 2020;24(19):11457–11464. doi: 10.1111/jcmm.15754. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Li SN, Wu JF. TGF-β/SMAD signaling regulation of mesenchymal stem cells in adipocyte commitment[J] Stem Cell Res Ther. 2020;11(1):41. doi: 10.1186/s13287-020-1552-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Luo H, Guo Y, Liu Y, et al. Growth differentiation factor 11 inhibits adipogenic differentiation by activating TGF-beta/Smad signalling pathway[J] Cell Prolif. 2019;52(4):e12631. doi: 10.1111/cpr.12631. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.王 贺林. GDF11抑制oxLDL引起的巨噬细胞系RAW-264.7细胞泡沫化进程及其机制研究[D] 西安: 第四军医大学; 2016. [Google Scholar]; Wang HL. The study of effect of GDF11 on foam cell formation and related molecules mechanism[D] Xi'an: The Fourth Military Medical University; 2016. [Google Scholar]
- 8.Lu B, Zhong J, Pan J, et al. Gdf11 gene transfer prevents high fat diet-induced obesity and improves metabolic homeostasis in obese and STZ-induced diabetic mice[J] J Transl Med. 2019;17(1):422. doi: 10.1186/s12967-019-02166-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Zhang M, Yang H, Wan X, et al. Prevention of injury-induced osteoarthritis in rodent temporomandibular joint by targeting chondrocyte CaSR[J] J Bone Miner Res. 2019;34(4):726–738. doi: 10.1002/jbmr.3643. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Barnett R. Osteoarthritis[J] Lancet. 2018;391(10134):1985. doi: 10.1016/S0140-6736(18)31064-X. [DOI] [PubMed] [Google Scholar]
- 11.Liu Q, Yang H, Zhang M, et al. Initiation and progression of dental-stimulated temporomandibular joints osteoarthritis[J] Osteoarthritis Cartilage. 2021;29(5):633–642. doi: 10.1016/j.joca.2020.12.016. [DOI] [PubMed] [Google Scholar]
- 12.Zheng L, Zhang Z, Sheng P, et al. The role of metabolism in chondrocyte dysfunction and the progression of osteoarthritis[J] Ageing Res Rev. 2021;66:101249. doi: 10.1016/j.arr.2020.101249. [DOI] [PubMed] [Google Scholar]
- 13.Lippiello L, Walsh T, Fienhold M. The association of lipid abnormalities with tissue pathology in human osteoarthritic articular cartilage[J] Metabolism. 1991;40(6):571–576. doi: 10.1016/0026-0495(91)90046-y. [DOI] [PubMed] [Google Scholar]
- 14.Gao YH, Zhao CW, Liu B, et al. An update on the association between metabolic syndrome and osteoarthritis and on the potential role of leptin in osteoarthritis[J] Cytokine. 2020;129:155043. doi: 10.1016/j.cyto.2020.155043. [DOI] [PubMed] [Google Scholar]