Points clés
L’hyperkaliémie chronique est prévalente chez les patients atteints d’insuffisance rénale chronique, d’insuffisance cardiaque ou d’autres maladies traitées au moyen d’inhibiteurs du système rénine–angiotensine–aldostérone (SRAA) et elle a été associée à de graves complications, y compris la mort.
On peut atténuer le risque d’hyperkaliémie chronique en réduisant l’apport alimentaire en potassium, en ajustant soigneusement la dose des médicaments qui induisent l’hyperkaliémie, en utilisant des diurétiques qui favorisent l’excrétion rénale du potassium et en utilisant des chélateurs du potassium.
Selon les données probantes qui s’accumulent, les conséquences négatives d’une réduction ou de l’arrêt des inhibiteurs du SRAA surclassent les inconvénients potentiels de l’hyperkaliémie, et les lignes directrices recommandent de maintenir l’inhibiteur du SRAA à une dose optimale tout en traitant l’hyperkaliémie par d’autres modalités.
Il faut approfondir la recherche sur la prévention et le traitement de l’hyperkaliémie chez les patients atteints d’insuffisance rénale chronique ou d’insuffisance cardiaque.
L’hyperkaliémie, définie comme un taux de potassium sérique égal ou supérieur à 5,0 mmol/L, peut entraîner de graves perturbations électrophysiologiques, y compris des arythmies cardiaques, et accroître la morbidité et le risque de décès1. On l’observe fréquemment chez des patients atteints de maladies qui nuisent à l’élimination du potassium par les reins, comme l’insuffisance rénale chronique (IRC), l’insuffisance cardiaque, une hypertension rebelle, le diabète ou une combinaison de ces pathologies1,2. Ces patients prennent généralement des inhibiteurs du système rénine–angiotensine–aldostérone (SRAA) pour réduire les risques d’aggravation de l’IRC et de complications cardiovasculaires3. Il arrive toutefois que ces médicaments déclenchent ou exacerbent l’hyperkaliémie4–7. Certaines lignes directrices recommandent désormais l’instauration de ces médicaments et l’augmentation de la posologie jusqu’à la dose maximale approuvée et tolérée par les patients afin d’optimiser l’issue clinique8,9. Il est donc crucial de dépister et de traiter rapidement l’hyperkaliémie chez les patients à qui l’on prescrit ces agents. Nous discutons ici de stratégies pour atténuer le risque d’hyperkaliémie chronique et optimiser les soins aux patients traités pour IRC, insuffisance cardiaque ou d’autres maladies connexes; ces stratégies s’inspirent des résultats de recherches originales, de revues de la littérature et de lignes directrices de pratique clinique (encadré 1).
Encadré 1:
Données utilisées pour la présente revue
Nous avons procédé à une interrogation ciblée du réseau MEDLINE pour recenser les articles sur des recherches originales et les revues de synthèse sur l’hyperkaliémie publiés jusqu’en février 2021. Les termes médicaux de langue anglaise qui ont servi à l’interrogation étaient « hyperkalemia », « chronic kidney disease », « heart failure » et « management ». Nous avons également passé en revue les lignes directrices actuellement en vigueur en Europe, aux États-Unis et au Canada pour la prise en charge de l’hyperkaliémie.
Qui est exposé à un risque d’hyperkaliémie?
Les maladies qui empêchent les reins d’excréter normalement le potassium contribuent à l’hyperkaliémie parce que l’homéostasie du potassium est pour une bonne part assurée par l’excrétion rénale. Une étude de cohorte menée dans la population a permis de constater que 28 % des patients atteints d’IRC et 39 % des patients atteints d’insuffisance cardiaque avaient présenté au moins 1 épisode d’hyperkaliémie10. Par ailleurs, la prévalence et le risque de récurrence de l’hyperkaliémie augmentent à mesure que le fardeau des comorbidités s’alourdit2,11.
Parmi les autres importants facteurs de risque, mentionnons l’âge avancé et l’utilisation de médicaments connus pour faire augmenter les taux de potassium sérique4. Parmi les médicaments qui entraînent une hyperkaliémie, les plus importants sur le plan clinique sont les inhibiteurs du SRAA, qui incluent les inhibiteurs de l’enzyme de conversion de l’angiotensine, les antagonistes des récepteurs de l’angiotensine et les antagonistes des récepteurs des minéralocorticoïdes4–6. Malgré l’hétérogénéité des études, une revue systématique/méta-analyse de 20 études a montré que l’hyperkaliémie est près de 2 fois plus fréquente (risque relatif [RR] 1,89, intervalle de confiance [IC] à 95 % 1,56–2,30) chez les patients qui prennent des médicaments qui agissent sur le SRAA5. De plus, des données tirées d’essais cliniques ont fait état d’une augmentation de l’incidence de l’hyperkaliémie chez les patients atteints d’IRC ou d’insuffisance cardiaque traités par inhibiteurs du SRAA12.
Un premier épisode d’hyperkaliémie expose les patients à un risque de récidive. Une analyse des registres de population a révélé qu’un second épisode d’hyperkaliémie était documenté dans les 6 mois suivant la survenue d’un premier épisode chez 40 % des insuffisants rénaux chroniques, 49 % des insuffisants cardiaques et 37 % des patients sous inhibiteurs du SRAA10. Les prédicteurs d’une récurrence incluaient un premier épisode d’hyperkaliémie modéré à grave (potassium ≥ 5,6 mmol/L), un débit de filtration glomérulaire estimé (DFGe) bas, le diabète et la prise de spironolactone10.
Quelles sont les conséquences de l’hyperkaliémie?
Il a été clairement établi que l’hyperkaliémie grave est associée à un risque accru de décès, mais même de légères augmentations du potassium, souvent jugées non urgentes, peuvent néanmoins avoir une importance clinique. On note une relation en « u » entre les taux de potassium sérique et le risque de mortalité, le risque le plus faible de mortalité de toutes causes s’observant chez les patients dont le taux de potassium se situe entre 4,0 et moins de 5,0 mmol/L11. Une étude de cohorte rétrospective menée au Manitoba a révélé que, comparativement aux patients dont les taux de potassium étaient normaux, ceux qui présentaient une hyperkaliémie (potassium ≥ 5,0 mmol/L) étaient exposés à un risque plus grand de mortalité de toutes causes (rapport des risques instantanés [RRI] 1,15, IC à 95 % 1,13–1,18), d’événements cardiovasculaires (RRI 1,20, IC à 95 % 1,14–1,26) et de mortalité à 30 jours (rapport des cotes [RC] 1,29, IC à 95 % 1,24–1,34)13.
Au Canada, le recours aux services d’urgence est élevé chez les patients atteints d’IRC. Des études d’observation ont montré une association entre l’hyperkaliémie et une augmentation des hospitalisations (RC 1,71, IC à 95 % 1,68–1,74) et des admissions dans les unités de soins intensifs (RC 3,48, IC à 95 % 3,34–3,62), et ont révélé que l’hyperkaliémie représente 48 % des cas de prise en charge par les soins ambulatoires chez les patients dialysés13,14. On ne se surprendra donc pas que l’hyperkaliémie soit associée à des coûts substantiels dus à des hospitalisations fréquentes en raison d’épisodes récurrents13,15.
Les médecins répondent souvent à un épisode d’hyperkaliémie en réduisant ou en suspendant le traitement par inhibiteur du SRAA chez un patient14,16,17. Mais l’administration de doses sous-maximales d’inhibiteurs du SRAA chez les patients atteints d’IRC ou d’insuffisance cardiaque est associée à une augmentation des consultations externes et des coûts globaux en soins de santé, en plus d’aggraver les paramètres cardiorénaux16,18. Cela rappelle la difficulté de trouver le juste équilibre entre les bienfaits cardiorénaux du traitement par inhibiteurs du SRAA et les risques d’hyperkaliémie chronique chez les patients les plus susceptibles de bénéficier de ces médicaments.
À quelle fréquence les médecins devraient-ils vérifier les taux de potassium chez leurs patients?
Les patients exposés à un risque d’hyperkaliémie chronique peuvent être asymptomatiques; des contrôles fréquents en faciliteront le dépistage19. Toutefois, plusieurs facteurs influencent le risque d’hyperkaliémie, et les médecins doivent en tenir compte lorsqu’ils établissent la fréquence des contrôles, particulièrement après l’instauration d’un traitement par inhibiteur du SRAA (encadré 2). De plus, le seuil d’hyperkaliémie à partir duquel le traitement s’impose n’a pas été uniformément standardisé. Les seuils proposés par les lignes directrices actuelles se fondent sur les moyennes enregistrées chez des patients pour un système de laboratoires donné et sur la relation en « u » entre les taux de potassium sérique et le risque de décès11.
Encadré 2:
Fréquence suggérée de vérification des taux de potassium8,19,20
Patients chez qui l’on envisage un traitement par inhibiteurs de l’enzyme de conversion de l’angiotensine ou antagonistes des récepteurs de l’angiotensine
Lors de l’instauration du traitement
1 à 2 semaines après l’instauration du traitement
1 à 4 semaines après la dernière augmentation de la dose
À intervalles réguliers par la suite, selon le risque auquel chaque patient est exposé
Patients chez qui l’on envisage un traitement par antagonistes des récepteurs des minéralocortico ï des
1 et 2 semaines après l’instauration du traitement ou l’augmentation de la dose
8 et 12 semaines après l’instauration du traitement ou l’augmentation de la dose
6, 9 et 12 mois après l’instauration du traitement ou l’augmentation de la dose
À intervalles réguliers par la suite, selon le risque auquel chaque patient est exposé
Une augmentation rapide du potassium est plus susceptible d’entraîner des arythmies cardiaques qu’une augmentation graduelle; à la découverte d’une nouvelle hyperkaliémie, il est donc important de tenir compte de la rapidité avec laquelle elle s’est installée21.
L’hyperkaliémie est rare chez les personnes dont le DFG demeure normal et, en général, elle est alors associée à une pseudohyperkaliémie caractérisée par une hémolyse in vitro, qui donne des taux de potassium élevés. Il faut effectuer des contrôles pour écarter le diagnostic de pseudohyperkaliémie, à moins que les avantages d’une telle vérification ne soient surclassés par le danger potentiel associé à un traitement retardé19.
Les connaissances transmises au patient, le soutien infirmier, le suivi (en personne ou par téléphone), l’autosurveillance ou les tests au point de service peuvent faciliter les contrôles réguliers et assurer une prise en charge rapide et efficace20.
Comment gérer le risque d’hyperkaliémie
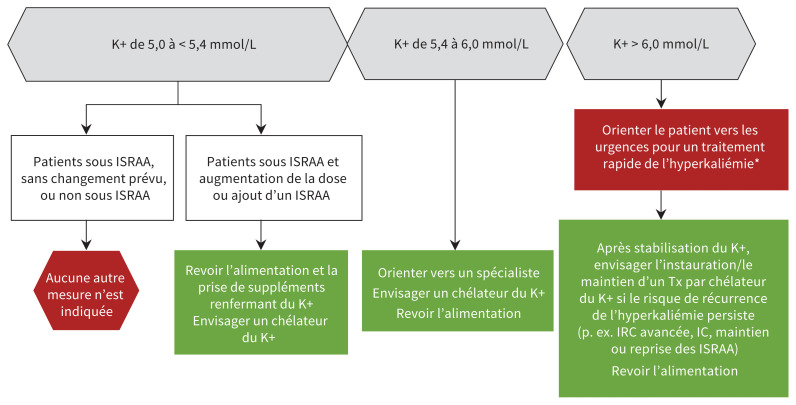
La figure 1 décrit une approche pour la prise en charge de l’hyperkaliémie qui peut être appliquée en consultation externe, lorsque les ressources le permettent. À part le traitement de l’hyperkaliémie aux urgences, les experts suggèrent des approches préventives, par exemple encourager les patients à adopter une alimentation faible en potassium et à cesser la prise de tout supplément en renfermant. Parmi les autres approches, mentionnons traiter l’hypertension associée à une insuffisance cardiaque au moyen de diurétiques de l’anse ou de diurétiques thiazidiques, établir soigneusement la dose d’inhibiteurs du SRAA et de tout autre médicament susceptible de faire augmenter les taux de potassium afin d’équilibrer leurs avantages et risques potentiels, corriger l’acidose concomitante et utiliser des chélateurs du potassium19.
Figure 1:
Stratégies pour réduire le risque d’hyperkaliémie et optimiser les soins. Selon le cas, les médecins devraient corriger l’acidose métabolique au moyen de bicarbonate de sodium oral (si non contre-indiqué), favoriser l’élimination du potassium à l’aide de diurétiques chez les patients en surcharge volémique (si non contre-indiqués) et envisager l’utilisation de chélateurs du potassium (si disponibles). *Même s’il est possible de traiter en consultation externe certains patients qui ont des taux de potassium légèrement supérieurs à 6,0 mmol/L, étant donné la disponibilité variable des ressources pour traiter et réévaluer rapidement les taux de potassium, on recommande leur prise en charge aux urgences. Les détails concernant cette prise en charge excèdent le cadre de la présente revue. Remarque : IC = insuffisance cardiaque; IRC = insuffisance rénale chronique; ISRAA = inhibiteur du système rénine–angiotensine–aldostérone; K+ = potassium; Tx = traitement.
Réduction du potassium alimentaire
Même si les lignes directrices recommandent aux patients exposés à un risque d’hyperkaliémie, particulièrement ceux qui présentent une IRC avancée, de réduire leur apport alimentaire en potassium, peu d’essais ont mesuré l’impact de telles restrictions alimentaires sur les patients atteints d’IRC9,19,22. Néanmoins, étant donné le risque accru d’hyperkaliémie chronique chez les patients atteints d’IRC et d’insuffisance cardiaque, les médecins devraient orienter ces patients vers un nutritionniste, qui pourra les conseiller. L’avantage potentiel d’une alimentation à faible teneur en potassium, surtout végétarienne, est un important domaine de recherche à explorer.
Utilisation judicieuse des diurétiques
Les diurétiques, et plus particulièrement les diurétiques de l’anse, sont souvent utilisés pour maîtriser la surcharge volémique et prévenir les hausses de potassium sérique. L’efficacité des diurétiques à réduire le potassium sérique dépend de la fonction rénale du patient; les lignes directrices les recommandent si la diurèse ou l’ajout d’un antihypertenseur sont souhaités19. L’utilisation des diurétiques peut entraîner une insuffisance rénale aiguë et des anomalies électrolytiques; toutefois, l’effet hypokaliémiant des diurétiques est diminué en présence d’un DFGe faible3,8. Les diurétiques ne seraient peut-être pas idéaux pour une prise en charge à long terme des taux de potassium sérique, surtout pour les patients chez qui il n’y a pas d’autres indications absolues (c.-à-d. surcharge volémique extracellulaire).
Utilisation du bicarbonate de sodium
Le bicarbonate de sodium oral favorise l’élimination du potassium grâce à une excrétion potassique urinaire accrue. On peut l’utiliser pour réduire efficacement le risque d’hyperkaliémie chez les patients atteints d’IRC et d’acidose métabolique. Toutefois, chez les patients qui ont une surcharge volémique, il se peut que l’on doive en cesser l’administration8,19.
Ajustement minutieux des inhibiteurs du SRAA
Réduire ou cesser les médicaments qui induisent l’hyperkaliémie, comme les inhibiteurs du SRAA, sont des stratégies couramment utilisées pour prévenir les épisodes récurrents d’hyperkaliémie3,19,22. Toutefois, compte tenu des données selon lesquelles les avantages des inhibiteurs du SRAA surclassent leurs inconvénients potentiels, y compris l’hyperkaliémie, les lignes directrices récentes recommandent désormais aux médecins de maintenir une dose d’inhibiteurs du SRAA fondée sur des données probantes. C’est en dernier ressort qu’on devrait en réduire la dose dans le but d’éviter une récurrence de l’hyperkaliémie; il faut d’abord appliquer d’autres mesures pour maintenir la dose d’inhibiteurs du SRAA soutenue par les données probantes, ce qui inclut la prise de chélateurs du potassium.
Utilisation des chélateurs du potassium
Le sulfonate de polystyrène sodique, le cyclosilicate de zirconium sodique et le patiromère sont des chélateurs du potassium approuvés au Canada8,9,23–25. Pendant de nombreuses années, le sulfonate de polystyrène sodique a été le seul médicament indiqué spécifiquement pour le traitement de l’hyperkaliémie, mais il a été approuvé avant l’avènement des réglementations modernes, et les données tirées d’essais randomisés pour appuyer son utilisation sont peu nombreuses3. Une étude monocentrique de faible envergure menée auprès de 33 patients atteints d’IRC et d’hyperkaliémie légère (5,0–5,9 mmol/L) suivis en consultation externe a révélé que le sulfonate de polystyrène sodique réduisait les taux de potassium sérique plus efficacement que le placebo après 1 semaine (différence moyenne entre les groupes −1,04 mmol/L, IC à 95 % −1,37 à −0,71 mmol/L)26. Toutefois, les effets du médicament sont imprévisibles, et celui-ci a été associé à un risque de nécrose intestinale aiguë, d’hypernatrémie, de diarrhée et de toxicité gastro-intestinale, particulièrement avec les formules anciennes renfermant du sorbitol27. Une étude de cohorte appariée rétrospective a révélé que, sur une période de 30 jours, l’utilisation du sulfonate de polystyrène sodique était associée à une incidence près de 2 fois plus élevée d’effets indésirables gastro-intestinaux comparativement à sa nonutilisation (37 événements [0,2 %] c. 18 événements [0,1 %]; RRI 1,94, IC à 95 % 1,10–3,41)28. De plus, une alcalose systémique a été signalée après l’administration du sulfonate de polystyrène sodique en association avec des antiacides donneurs de cations non absorbables et des laxatifs comme l’hydroxyde de magnésium et le carbonate d’aluminium; les laxatifs qui renferment du magnésium sont à proscrire avec le sulfonate de polystyrène sodique23. Les médecins doivent donc être au courant du risque d’effets indésirables graves lorsqu’ils soignent l’hyperkaliémie avec du sulfonate de polystyrène sodique. Il faut leur privilégier les chélateurs de potassium plus récents, s’ils sont disponibles.
Le cyclosilicate de zirconium et le patiromère sont des chélateurs de potassium plus récents qui sont en général plus sécuritaires, plus prévisibles et mieux tolérés par les patients (tableau 1). Le cyclosilicate de zirconium sodique est un échangeur de cations insoluble inorganique administré par voie orale qui capte de manière sélective les ions potassium en échange d’ions hydrogène et sodium dans le tractus digestif, ce qui accroît l’excrétion fécale du potassium et réduit le potassium sérique. Son efficacité et son innocuité ont été démontrées lors d’essais cliniques de phases 2 et 3 chez des patients dialysés et non dialysés. Les effets indésirables signalés sont en général de légers à modérés et traitables; ils ne nécessitent pas d’interruption de traitement. L’œdème a été mentionné, probablement dû au fait que le médicament renferme du sodium; il faut donc surveiller la surcharge liquidienne chez les patients qui prennent du cyclosilicate de zirconium sodique30–36. Lors d’essais cliniques, 4,1 % des patients traités au moyen de ce médicament ont aussi présenté de l’hypokaliémie à des valeurs potassiques sériques inférieures à 3,5 mmol/L, qui ont pu être corrigées avec un ajustement de la dose ou l’arrêt du médicament25.
Tableau 1:
Aperçu des chélateurs du potassium
| Caractéristiques | Sulfonate de polystyrène sodique23 | Cyclosilicate de zirconium sodique25 | Patiromère24,29 |
|---|---|---|---|
| Mécanisme | Résine échangeuse de cations non absorbée | Échangeur de cations inorganique à structure cristalline qui capte le K+ | Polymère échangeur de cations non absorbé qui se lie au K+ |
| Siège de l’action | Côlon | Tractus digestif entier | Côlon |
| Ion échangé contre le potassium | Sodium | Sodium | Calcium |
| Début d’action | Quelques heures à quelques jours | 1 heure | 4 à 7 heures |
| Facilitation du Tx par inhibiteurs du SRAA | Ni inscrit dans la monographie ni démontré | Non inscrit dans la monographie Environ 70 % des patients des études de phases 2 et 3 recevaient des inhibiteurs du SRAA au départ | Inscrit dans la monographie 99,4 % des patients des études de phases 2 et 3 recevaient des inhibiteurs du SRAA au départ |
| Événements indésirables | Sténose GI, ischémie intestinale, colite ischémique, hémorragie rectale, nécrose GI, perforation intestinale parfois fatale, hypomagnésémie, hypokaliémie, hypocalcémie | Effets GI de légers à modérés, œdème, hypokaliémie (0 %–11 %, effet dépendant de la dose) | Effets GI de légers à modérés, hypomagnésémie, hypokaliémie (3 %–5,6 %) |
| Dose recommandée | Orale : 15 g, 1–4 fois par jour Rectale : 30–50 g, 1–2 fois par jour | 10 g, 3 fois par jour pendant ≤ 48 heures, puis 5 à 10 g 1 fois par jour ≤ 10 g 1 fois par jour en Tx d’entretien | 8,4 g 1 fois par jour La dose peut être augmentée à intervalles ≥ 1 semaine, par paliers de 8,4 g jusqu’à concurrence de 25,2 g 1 fois par jour |
| Prix quotidien et remboursement par les régimes d’assurance | Générique | 12,50 $ (5 g), 25 $ (10 g); recommandation négative de l’ACMTS* | 13 $ (fixe); recommandation positive de l’ACMTS* |
Remarque : ACMTS = Agence canadienne des médicaments et des technologies de la santé; GI = gastro-intestinal; K+ = potassium; SRAA = système rénine–angiotensine–aldostérone; Tx = traitement.
L’ACMTS est une agence gouvernementale chargée de l’évaluation des données probantes relatives à l’action clinique et au rapport coût:efficacité des médicaments; elle formule des recommandations sur leur remboursement. Une recommandation positive signifie que l’ACMTS est favorable au remboursement. Une recommandation négative signifie que le remboursement n’est pas préconisé. Ces recommandations sont non contraignantes.
La surcharge volémique n’a pas été signalée comme effet indésirable lors des essais sur le patiromère. Ce médicament renferme du calcium comme ion d’échange gastro-intestinal et agit dans le côlon, ce qui signifie que son début d’action est relativement lent. L’utilité du patiromère pour le traitement de l’hyperkaliémie a été démontrée dans des essais de phase 2 et 3 menés auprès de patients hyperkaliémiques, dont des patients atteints d’IRC et d’insuffisance cardiaque traités par inhibiteurs du SRAA. Aucun effet indésirable grave n’a été associé au patiromère; des effets non graves ont toutefois été observés, notamment : constipation, diarrhée, nausées ou vomissements, malaise abdominal, flatulences et déséquilibres électrolytiques (p. ex. hypokaliémie et hypomagnésémie)37–40.
Un corpus croissant de connaissances appuie l’utilisation des chélateurs de potassium plus récents pour faciliter le maintien et l’optimisation des inhibiteurs du SRAA chez les patients hypertendus, insuffisants cardiaques et insuffisants rénaux chroniques35,37,38,40. Dans un essai de phase 2 à double insu avec témoins sous placebo regroupant des patients atteints d’insuffisance cardiaque (PEARL-HF), l’incidence d’hyperkaliémie s’est révélée significativement plus faible chez les patients assignés aléatoirement au patiromère que chez les patients sous placebo (7,3 % c. 24,5 %), ce qui a permis une plus grande utilisation de la spironolactone 50 mg/j (91 % c. 74 %)37. De même, lors de l’essai AMBER mené auprès de patients atteints d’hypertension rebelle et d’IRC, un plus grand nombre de patients du groupe sous traitement actif ont pu continuer de prendre la spironolactone avec une incidence moindre d’hyperkaliémie comparativement au groupe sous placebo40. Même si aucune étude n’a été spécifiquement conçue pour préciser dans quelle mesure le cyclosilicate de zirconium sodique facilite le traitement par inhibiteurs du SRAA, la plupart des patients hyperkaliémiques inscrits à l’étude ZS-005 ont obtenu une normalisation de leurs taux de potassium sans modification substantielle de leur schéma d’inhibiteurs du SRAA35.
Des enjeux liés au coût et au remboursement des chélateurs de potassium plus récents par les régimes d’assurance médicaments pourraient limiter l’adoption de ces agents. Même si ces derniers sont remboursés par certains régimes d’assurance privés et que l’Agence canadienne des médicaments et des technologies de la santé a recommandé le remboursement du patiromère par les régimes d’assurance publics, son coût est d’environ 3500 $ à 7000 $ par patient annuellement, selon la dose29. D’autres négociations tarifaires seraient en cours par l’entremise de l’Alliance pancanadienne pharmaceutique. On enjoint aux fabricants et aux régimes d’assurance médicaments de trouver un prix qui permette l’accès à ces médicaments pour tous les patients qui pourraient en avoir besoin.
Conclusion
L’hyperkaliémie peut avoir de graves conséquences cliniques, cardiovasculaires notamment, et peut même causer la mort11. Elle est associée au traitement par inhibiteurs du SRAA, particulièrement chez les patients qui présentent des comorbidités telles que l’IRC et l’insuffisance cardiaque1. Réduire la dose d’inhibiteurs du SRAA peut abaisser les taux de potassium, mais nuire au traitement optimal de la maladie16,18. Même si des questions demeurent quant à leur capacité d’améliorer les résultats chez les patients, les nouveaux chélateurs du potassium pourraient atténuer le risque d’hyperkaliémie récurrente en abaissant les taux de potassium sérique rapidement et durablement, tout en permettant une optimisation des soins chez les patients afin qu’ils reçoivent les doses d’inhibiteurs du SRAA recommandées par les lignes directrices (encadré 3).
Encadré 3:
Questions sans réponses
Quels sont les seuils de l’hyperkaliémie légère, modérée et grave et à partir de quel seuil devrait-on instaurer un traitement pour l’hyperkaliémie chronique?
Quelles devraient être la méthode standard et la fréquence de vérification des taux de potassium et quel intervalle de référence doit-on utiliser?
Un régime alimentaire à faible teneur en potassium est-il efficace pour les patients atteints d’insuffisance rénale chronique ou d’insuffisance cardiaque et qui sont exposés à un risque d’hyperkaliémie?
Les nouveaux chélateurs du potassium permettent-ils de maintenir un traitement optimal par inhibiteurs du système rénine–angiotensine–aldostérone (SRAA) afin d’en améliorer les résultats?
Remerciements
Les auteurs remercient Maryssa Canuel, PhD, MBA, de liV Medical Education Agency pour le soutien éditorial.
Footnotes
Voir la version anglaise de l’article ici : www.cmaj.ca/lookup/doi/10.1503/cmaj.210831
Intérêts concurrents: Jordan Weinstein déclare avoir travaillé en tant que consultant et expert auprès d’AstraZeneca, Bayer, BI/ Lilly, Alexion, Merck, Amgen, Janssen, Otsuka et CPD Network. Louis-Philippe Girard déclare avoir travaillé en tant que consultant et expert auprès d’Otsuka et AstraZeneca. Robert McKelvie déclare avoir travaillé en tant que consultant et expert auprès d’Otsuka, AstraZeneca, Bayer, Merck et Novartis. Karthik Tennankore déclare avoir travaillé en tant que consultant et expert auprès d’Otsuka, Janssen, AstraZeneca, Baxter et Bayer. Le cyclosilicate de zirconium sodique est utilisé avec l’autorisation d’AstraZeneca Canada. Le patiromère est importé et distribué par Otsuka Canada. Aucun autre intérêt concurrent n’a été déclaré.
Cet article a été révisé par des pairs.
Collaborateurs: Tous les auteurs ont contribué à la conception du travail, ont rédigé le manuscrit et en ont révisé de façon critique le contenu intellectuel important; ils ont donné leur approbation finale pour la version destinée à être publiée et assument l’entière responsabilité de tous les aspects du travail.
Financement: Cette revue de la littérature a été rendue possible grâce à une subvention à la formation versée sans restriction par Otsuka Canada.
Références
- 1.Jain N, Kotla S, Little BB, et al. Predictors of hyperkalemia and death in patients with cardiac and renal disease. Am J Cardiol 2012;109:1510–3. [DOI] [PubMed] [Google Scholar]
- 2.Kovesdy CP. Management of hyperkalaemia in chronic kidney disease. Nat Rev Nephrol 2014;10:653–62. [DOI] [PubMed] [Google Scholar]
- 3.Dunn JD, Benton WW, Orozco-Torrentera E, et al. The burden of hyperkalemia in patients with cardiovascular and renal disease. Am J Manag Care 2015;21 (Suppl 15):s307–15. [PubMed] [Google Scholar]
- 4.Desai AS, Swedberg K, McMurray JJV, et al. Incidence and predictors of hyperkalemia in patients with heart failure: an analysis of the CHARM Program. J Am Coll Cardiol 2007;50:1959–66. [DOI] [PubMed] [Google Scholar]
- 5.Albasri A, Hattle M, Koshiaris C, et al. Association between antihypertensive treatment and adverse events: systematic review and meta-analysis. BMJ 2021;372:n189. doi: 10.1136/bmj.n189. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.McMurray JJV, Packer M, Desai AS, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014;371:993–1004. [DOI] [PubMed] [Google Scholar]
- 7.Bakris GL, Agarwal R, Anker SD, et al. Effect of finerenone on chronic kidney disease outcomes in type 2 diabetes. N Engl J Med 2020;383:2219–29. [DOI] [PubMed] [Google Scholar]
- 8.Kidney Disease: Improving Global Outcomes (KDIGO) Diabetes Work Group. KDIGO 2020 clinical practice guideline for diabetes management in chronic kidney disease. Kidney Int 2020;98(4S):S1–115. [DOI] [PubMed] [Google Scholar]
- 9.Kidney Disease: Improving Global Outcomes (KDIGO) Blood Pressure Work Group. KDIGO 2021 clinical practice guideline for the management of blood pressure in chronic kidney disease. Accessible ici : https://kdigo.org/guidelines/blood-pressure-in-ckd/ (consulté le 25 fév. 2021).
- 10.Adelborg K, Nicolaisen SK, Hasvold P, et al. Predictors for repeated hyperkalemia and potassium trajectories in high-risk patients — a population-based cohort study. PLoS One 2019;14:e0218739. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Collins AJ, Pitt B, Reaven N, et al. Association of serum potassium with all-cause mortality in patients with and without heart failure, chronic kidney disease, and/or diabetes. Am J Nephrol 2017;46:213–21. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Juurlink DN, Mamdani MM, Lee DS, et al. Rates of hyperkalemia after publication of the Randomized Aldactone Evaluation Study. N Engl J Med 2004;351:543–51. [DOI] [PubMed] [Google Scholar]
- 13.Hougen I, Leon SJ, Whitlock R, et al. Hyperkalemia and its association with mortality, cardiovascular events, hospitalizations, and intensive care unit admissions in a population-based retrospective cohort. Kidney Int Rep 2021;6:1309–16. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Ronksley PE, Tonelli M, Manns BJ, et al. Emergency department use among patients with CKD: a population-based analysis. Clin J Am Soc Nephrol 2017;12:304–14. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Kanda E, Kashihara N, Kohsaka S, et al. Clinical and economic burden of hyperkalemia: a nationwide hospital-based cohort study in Japan. Kidney Med 2020;2:742–752.e1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Epstein M, Reaven NL, Funk SE, et al. Evaluation of the treatment gap between clinical guidelines and the utilization of renin-angiotensin-aldosterone system inhibitors. Am J Manag Care 2015;21(Suppl 11):S212–20. [PubMed] [Google Scholar]
- 17.Hundemer GL, Talarico R, Tangri N, et al. Ambulatory treatments for RAAS inhibitor-related hyperkalemia and the 1-year risk of recurrence. Clin J Am Soc Nephrol 2021;16:365–73. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Polson M, Lord TC, Kangethe A, et al. Clinical and economic impact of hyperkalemia in patients with chronic kidney disease and heart failure. J Manag Care Spec Pharm 2017. Apr;23(4-a Suppl):S2–9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Clase CM, Carrero J-J, Ellison DH, et al. Potassium homeostasis and management of dyskalemia in kidney diseases: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies conference. Kidney Int 2020;97:42–61. [DOI] [PubMed] [Google Scholar]
- 20.Ferreira JP, Butler J, Rossignol P, et al. Abnormalities of potassium in heart failure: JACC State-of-the-Art Review. J Am Coll Cardiol 2020;75:2836–50. [DOI] [PubMed] [Google Scholar]
- 21.Conway R, Creagh D, Byrne DG, et al. Serum potassium levels as an outcome determinant in acute medical admissions. Clin Med (Lond) 2015;15:239–43. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Howlett JG, Chan M, Ezekowitz JA, et al. The Canadian Cardiovascular Society heart failure companion: bridging guidelines to your practice. Can J Cardiol 2016;32:296–310. [DOI] [PubMed] [Google Scholar]
- 23.KAYEXALATE [product monograph]. Laval (QC): sanofi-aventis Canada; 2018. Accessible ici : https://pdf.hres.ca/dpd_pm/00047478.PDF (consulté le 21 mars 2021). [Google Scholar]
- 24.VELTASSA [product monograph]. Saint-Laurent (QC): Vifor Fresenius Medical Care Renal Pharma; 2019. Accessible ici : https://pdf.hres.ca/dpd_pm/00053458.PDF (consulté le 4 mars 2021). [Google Scholar]
- 25.LOKELMA [product monograph]. Mississauga (ON): AstraZeneca Canada; 2020. Accessible ici : https://pdf.hres.ca/dpd_pm/00057706.PDF (consulté le 4 mars 2021). [Google Scholar]
- 26.Lepage L, Dufour A-C, Doiron J, et al. Randomized clinical trial of sodium polystyrene sulfonate for the treatment of mild hyperkalemia in CKD. Clin J Am Soc Nephrol 2015;10:2136–42. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Pitt B, Bakris GL. New potassium binders for the treatment of hyperkalemia. Hypertension 2015;66:731–8. [DOI] [PubMed] [Google Scholar]
- 28.Noel JA, Bota SE, Petrcich W, et al. Risk of hospitalization for serious adverse gastrointestinal events associated with sodium polystyrene sulfonate use in patients of advanced age. JAMA Intern Med 2019;179:1025–33. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Canadian Agency for Drugs and Technologies in Health. CADTH reimbursement recommendation patiromer (Veltassa). Can J Health Technol 2021;1:1–10. [Google Scholar]
- 30.Stavros F, Yang A, Leon A, et al. Characterization of structure and function of ZS-9, a K+ selective ion trap. PLoS One 2014;9:e114686. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Kosiborod M, Rasmussen HS, Lavin P, et al. Effect of sodium zirconium cyclosilicate on potassium lowering for 28 days among outpatients with hyperkalemia: the HARMONIZE randomized clinical trial. JAMA 2014;312:2223–33. [DOI] [PubMed] [Google Scholar]
- 32.Ash SR, Singh B, Lavin PT, et al. A phase 2 study on the treatment of hyperkalemia in patients with chronic kidney disease suggests that the selective potassium trap, ZS-9, is safe and efficient. Kidney Int 2015;88:404–11. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Anker SD, Kosiborod M, Zannad F, et al. Maintenance of serum potassium with sodium zirconium cyclosilicate (ZS-9) in heart failure patients: results from a phase 3 randomized, double-blind, placebo-controlled trial. Eur J Heart Fail 2015;17:1050–6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Packham DK, Rasmussen HS, Lavin PT, et al. Sodium zirconium cyclosilicate in hyperkalemia. N Engl J Med 2015;372:222–31. [DOI] [PubMed] [Google Scholar]
- 35.Spinowitz BS, Fishbane S, Pergola PE, et al. Sodium zirconium cyclosilicate among individuals with hyperkalemia: a 12-month phase 3 study. Clin J Am Soc Nephrol 2019;14:798–809. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Fishbane S, Ford M, Fukagawa M, et al. A phase 3b, randomized, double-blind, placebo-controlled study of sodium zirconium cyclosilicate for reducing the incidence of predialysis hyperkalemia. J Am Soc Nephrol 2019;30:1723–33. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Pitt B, Anker SD, Bushinsky DA, et al. Evaluation of the efficacy and safety of RLY5016, a polymeric potassium binder, in a double-blind, placebo-controlled study in patients with chronic heart failure (the PEARL-HF) trial. Eur Heart J 2011;32:820–8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Weir MR, Bakris GL, Bushinsky DA, et al. Patiromer in patients with kidney disease and hyperkalemia receiving RAAS inhibitors. N Engl J Med 2015;372:211–21. [DOI] [PubMed] [Google Scholar]
- 39.Bakris GL, Pitt B, Weir MR, et al. Effect of patiromer on serum potassium level in patients with hyperkalemia and diabetic kidney disease: the AMETHYST-DN randomized clinical trial [published erratum in JAMA 2015;(314):731. doi: 10.1001/jama.2015.9237] JAMA 2015;314:151–61. [DOI] [PubMed] [Google Scholar]
- 40.Agarwal R, Rossignol P, Romero A, et al. Patiromer versus placebo to enable spironolactone use in patients with resistant hypertension and chronic kidney disease (AMBER): a phase 2, randomised, double-blind, placebo-controlled trial. Lancet 2019;394:1540–50. [DOI] [PubMed] [Google Scholar]