Abstract
Hintergrund
Die akute disseminierte Enzephalomyelitis (ADEM) gehört zu den seltenen demyelinisierenden Erkrankungen, die meistens bei Kindern auftreten. ADEM gehört laut Leitlinien zu den Myelin-Oligodendrozyten-Glykoprotein(MOG)-assoziierten Krankheiten und manifestiert sich in der Regel nach febrilen Infektionen (auch nach SARS-CoV-2) oder, deutlich seltener, nach Impfungen.
Fragestellung
Inzidenz, Verlauf und klinische sowie radiologische Diagnostik sowie Entwicklung und Therapieoptionen von ADEM.
Material und Methode
Analyse und Auswertung der Literatur über ADEM sowie Analyse der bemerkenswerten Fälle und Leitlinien.
Ergebnisse
Zu den ersten Anzeichen von ADEM gehören Fieber, Nausea bis zum Erbrechen sowie Kopfschmerzen und Meningismus sowie per definitionem eine Enzephalopathie, die am Anfang wenig ausgeprägt sein kann und sich meistens als Schläfrigkeit und Verwirrung manifestiert. Die radiologische Diagnose wird in der Magnetresonanztomographie (MRT) gestellt. Hier sind asymmetrisch verteilte, unscharf abgrenzbare, tumorsimulierende Läsionen supra- und infratentoriell abgrenzbar. In der akuten Phase nehmen die Läsionen meistens ringförmig Kontrastmittel auf und zeigen eine Diffusionsrestriktion. Spinaler Befall der grauen Substanz mit dem typischen H‑Muster mit Myelitis transversa ist nicht selten. Die ADEM hat meistens einen monophasischen Verlauf, wobei eine rekurrierende Form („relapsing ADEM“) in 1–20 % der Fälle zu erwarten ist. Bei der Behandlung kommen Steroide und in schweren Fällen Immunsuppressiva zum Einsatz.
Schlussfolgerung
ADEM ist eine meist monophasische Erkrankung, deren Symptome nach einigen Wochen/Monaten abklingen sollten. Es ist wichtig, sie von anderen demyelinisierenden Krankheiten wie der multiplen Sklerose zu unterscheiden, um die nötige Therapie nicht zu verzögern.
Schlüsselwörter: Myelitis transvers, Magnetresonanztomographie, Tumorsimulierende Läsionen, Tumefaktive Läsionen, Differenzialdiagnose
Abstract
Background
Acute disseminated encephalomyelitis (ADEM) is a rare demyelinating disease that occurs predominantly in children. According to the guidelines, ADEM belongs to the myelin oligodendrocyte glycoprotein (MOG)-associated diseases and usually manifests after febrile infections (also after SARS-CoV-2) or postvaccinally.
Objectives
Incidence, course and clinical, and as well, as radiological features and new developments and treatment of ADEM.
Methods
Analysis and review of the literature on ADEM and of notable cases and guidelines.
Results
The first signs of ADEM include fever, nausea and vomiting, headache and meningism as well as, by definition, encephalopathy, which usually manifests as drowsiness and confusion. The radiological diagnosis is made by magnetic resonance imaging (MRI). Here, the asymmetrically distributed, diffuse and tumefactive lesions can be located supra- and infratentorially. In the acute phase, the lesions usually show contrast enhancement and restricted diffusion. Spinal involvement of the gray matter with the typical H‑pattern with myelitis transversa is not uncommon. ADEM has mostly a monophasic course, with a recurrent form (“relapsing ADEM”) in 1–20% of cases. For treatment, steroids and in severe cases immunosuppressive drugs are used.
Conclusions
ADEM is generally a monophasic disease whose symptoms usually last for a few weeks or months. It is crucial to differentiate ADEM from other demyelinating diseases, like for example multiple sclerosis, in order not to delay the proper treatment.
Keywords: Myelitis transversa, Magnetic resonance imaging, Tumor-simulating lesions, Tumefactive lesions, Differential diagnosis
Die akute disseminierte Enzephalomyelitis (ADEM), auch bekannt als postinfektiöse Enzephalomyelitis, ist eine demyelinisierende Erkrankung des Zentralnervensystems, die sich typischerweise als monophasische Erkrankung mit multifokalen neurologischen Symptomen und Enzephalopathie präsentiert [13]. ADEM wurde in der medizinischen Literatur bereits vor 200 Jahren als eine seltene Komplikation von Masern, Windpocken und anderen infektiösen Krankheiten des Kindesalters beschrieben. Erst seit 15 Jahren gibt es jedoch Kriterien, die die Diagnose dieser Erkrankung sicherstellen, und genaue diagnostische Tests für Myelin-Oligodendrozyten-Glykoprotein(MOG)-Autoantikörper sind erst in den letzten 3–5 Jahren klinisch verfügbar geworden [16]. Laut den neuesten Leitlinien zur multiplen Sklerose (MS) der deutschen Gesellschaft für Neurologie aus dem Jahr 2021 [20] gehört ADEM zu den MOG-Immunglobulin(Ig)-assoziierten Erkrankungen, muss jedoch von anderen zentralen entzündlichen demyelinisierenden Erkrankungen des Kindesalters unterschieden werden, einschließlich MS und anderen erworbenen entzündlichen demyelinisierenden Syndromen wie Optikusneuritis (ON), transversale Myelitis (TM) und Neuromyelitis-optica-Spektrum-Erkrankungen (NMOD).
Pathogenese
Die Pathogenese beim ADEM konnte bis heute nicht vollständig geklärt werden. Es wird vermutet, dass sie zu den Autoimmunerkrankungen gehört und bei genetisch anfälligen Menschen durch Umweltfaktoren ausgelöst wird. Der vorgeschlagene Mechanismus impliziert, dass Autoantigene des Myelins, wie das basische Myelinprotein (MBP), das Proteolipid-Protein (PLP) und das MOG sich mit auslösenden Pathogenen (z. B. nach einer viralen Infektion) die Antigendeterminanten teilen [23] und dass durch diese molekulare Nachahmung eine Autoimmunität ausgelöst wird. In den letzten Jahren wurde in der medizinischen Literatur viel Aufmerksamkeit der Rolle des MOG Proteins gewidmet, das überwiegend bei Krankheiten mit Beteiligung des Sehnervs und des Rückenmarks von Bedeutung ist. Obwohl MOG mit 0,05 % des Gesamtanteils aller Myelinproteine eine untergeordnete Komponente der Myelinscheiden ist, ist dieses Protein spezifisch für ADEM und wird ausschließlich von Oligodendrozyten im ZNS produziert.
Epidemiologie
ADEM ist eine seltene Krankheit; die geschätzte jährliche Inzidenz beträgt 0,2–0,5 pro 100.000 Kinder [11]. Das durchschnittliche Erkrankungsalter bei Kindern liegt zwischen 3 und 7 Jahren [3, 6], die Krankheit kann jedoch in jeder Altersgruppe auftreten. Es gibt keine spezifische ethnische Verteilung [6]. Mehrere Studien weisen auf eine leichte männliche Dominanz hin [6].
Ursachen
In den meisten Fällen tritt ADEM nach einer febrilen Infektion der oberen Atemwege auf, und tatsächlich wird bei ca. 75 % der Patienten ein vorangegangener Infekt mit Fieber festgestellt [17]. Obwohl in der Literatur einige Fälle von ADEM nach Impfungen beschrieben wurden, konnte keine eindeutige Kausalität zwischen den beiden nachgewiesen werden, insbesondere bei Kindern [6]. Wenn man die Häufigkeit von Infektionen und Impfungen bei kleinen Kindern betrachtet, wobei bis zu 8 Infektionen der oberen Atemwege jährlich als normal gelten, ist es schwierig, den Zusammenhang zwischen einer Impfung und ADEM eindeutig zu beweisen [18]. Es gibt einige Berichte von fokalen neurologischen Komplikationen nach einer Impfung, die insbesondere eine unilaterale Optikusneuritis, gefolgt oder unabhängig von ADEM beschreiben [15]. Spontane Restitutio ad integrum oder Besserung nach Steroidtherapie wurden berichtet, es wurde jedoch auch ein dauerhafter Sehverlust gemeldet [13]. Berichte über ADEM nach Transplantation solider Organe sind selten und beinhalten Fälle, bei denen das Epstein-Barr-Virus (EBV) als Erreger identifiziert wurde [15]. Es ist jedoch unklar, warum die Inzidenz von ADEM bei transplantierten Patienten höher ist als in der normalen Population [21].
ADEM und SARS-CoV-2
ADEM bei einem Kind nach einer SARS-CoV-2-Infektion wurde bereits 2004 in der Literatur beschrieben [27]. Es wurde gezeigt, dass das humane Coronavirus im Liquor des ADEM-kranken Kindes nachweisbar war. In Mausmodellen wurde bereits früher gezeigt, dass das Coronavirus eine chronisch demyelinisierende Erkrankung verursacht, die einer MS sehr ähnelt [26]. Seit Beginn der COVID-19-Pandemie wurden bereits mehrere Berichte über neurologische Symptome bei einer SARS-CoV-2-Infektion publiziert [25]. Es wurde von Patienten sowohl mit ADEM als auch mit einer akuten hämorrhagischen Leukoenzephalitis (AHL) berichtet, einer akuten Variante von ADEM. Das mittlere Intervall zwischen dem Auftreten der SARS-CoV-2-Infektion und ADEM-Symptomen betrug ca. 3 Wochen. Die am häufigsten berichteten klinischen Symptome waren eine akute Meningoenzephalitis einschließlich Enzephalopathie sowie Kopfschmerzen, epileptische Anfälle, Fieber und Ataxie. Bei der Analyse des Liquors cerebrospinalis wurde zwar Pleozytose festgestellt, jedoch kaum RNA des SARS-CoV-2-Virus gefunden [25]. In der Magnetresonanztomographie (MRT) hatte die Mehrheit der Patienten ADEM-typische Läsionen im subkortikalen Marklager wie auch im Hirnstamm, und fast 90 % der Läsionen zeigten ein Kontrastmittel(KM)-Enhancement [25]. Spinale Bildgebung wurde leider nur bei wenigen Patienten durchgeführt; hierzu gibt es aktuell keine Daten.
Diagnostik
Die Diagnose basiert auf klinischen und radiologischen Merkmalen. Die Rolle der Gehirnbiopsie ist sehr limitiert und nur für Fälle reserviert, in denen eine Unsicherheit in der radiologischen Bildgebung besteht, z. B. bei großen tumorsimulierenden Läsionen mit untypischem KM-Enhancement.
Klinische Merkmale
Neurologische Symptome (Tab. 1) bei ADEM treten bei Kindern in der Regel 4 bis 13 Tage, bei Erwachsenen durchschnittlich 26 Tage nach einer Infektion auf [7, 9, 22]. Die prodromalen Symptome dauern in der Regel 3 bis 4 Tage bis zum Beginn der neurologischen Symptomatik. Der Krankenhausaufenthalt kann von einigen Tagen bis mehreren Monaten dauern und beträgt im Durchschnitt zwischen 13 und 27 Tage [14]. Laut der sich aktuell in Überarbeitung befindlichen Leitlinien der pädiatrischen MS sollen bei Verdacht auf ADEM die MOG-Antikörper bestimmt werden [19]. Kinder mit positiven MOG-Antikörpern haben eine höhere Prädisposition für transversale Myelitis [2], jedoch eine günstigere allgemeine Prognose im Vergleich zu Kindern mit spinalem Befall ohne MOG-Antikörper. Anhaltende MOG-IG1-Positivität nach Erholung von ADEM ist nützlich als serologischer Marker zur Vorhersage eines Rezidivs der Erkrankung, was als eine „relapsing ADEM“ oder auch als MDEM bezeichnet wird, wobei das M für multiphasisch steht. Die MDEM entwickelt sich in 1 % bis max. 20 % der Patienten [12]. Das gilt sowohl für pädiatrische als auch erwachsene Patienten [12]. MOG-Antikörper sind selten bei Patienten mit der pädiatrischen Variante der MS [4]. Laut internationalen ADEM-Kriterien aus dem Jahr 2013 [10] müssen alle Kinder mit Verdacht auf ADEM im Laufe der Erkrankung einige Komponenten der Enzephalopathie zeigen, um die Diagnose sicherzustellen. Alle oben beschriebenen Symptome zählen zu der klassischen Variante von ADEM, die am häufigsten beobachtet wird und meistens monophasisch verläuft. Zu den weiteren, deutlich selteneren Varianten von ADEM zählen die akute hämorrhagische Leukoenzephalitis (AHL), akute hämorrhagische Leukoenzephalomyelitis, akute hämorrhagische Leukoenzephalopathie und nekrotisierende Enzephalomyelitis von Weston Hurst [13, 28]. Es handelt sich hier um hämorrhagische Komponenten in der MRT-Bildgebung, die mit einer fulminanten klinischen Symptomatik und hoher Mortalität einhergehen. Bei Erwachsenen wurde zusätzlich über eine klinische oder subklinische elektrodiagnostische Beteiligung des peripheren Nervensystems berichtet [13].
| Symptom | Häufigkeit (%) |
|---|---|
| Enzephalopathie | 100 (per definitionem) |
| Fieber | 12–68 |
| Kopfschmerzen | 6–64 |
| Zerebelläre Ataxie | 36–47 |
| Hirnnervendefizite | 18–39 |
| Pyramidenzeichen | 18–60 |
| Sprachprobleme | 7–44 |
| Neuritis des N. opticus | 1–15 |
| Hemihyphästesie | 0–9 |
Radiologische Diagnose
Methode der Wahl in der Bildgebung bei ADEM ist die MRT. Eine Computertomographie (CT) ist in den ersten Stadien entweder unauffällig oder unspezifisch. Die MRT-Untersuchung sollte mit 1,5 T oder, wenn verfügbar, am besten mit 3 T durchgeführt werden. Die empfohlene Schichtdicke beträgt 3 mm für die 2‑D-Sequenzen. Das MRT-Protokoll ähnelt dem der MS (Tab. 2; [8]). Bei Verdacht auf Optikusneuritis sollen zusätzliche fettgesättigte axiale und koronare T2-gewichtete Sequenzen sowie T1 vor und nach Kontrastmittelgabe durchgeführt werden.
| Kraniale Bildgebung | Spinale Bildgebung |
|---|---|
| 3‑D-FLAIR | T2-TSE sagittal |
| T2-TSE axial und sagittal | T2-STIR sagittal |
| 3‑D-T1 nativ (MPRAGE) ohne und mit KM | T1-TSE sagittal nach KM |
| DWI mit ADC Map axial | T1TSE axial nach KM der befallenen Regionen |
DWI diffusionsgewichtete Bildgebung, FLAIR Fluid-attenuated Inversion Recovery, KM Kontrastmittel, TSE Turbo-Spin-Echo, STIR Short-Tau Inversion Recovery
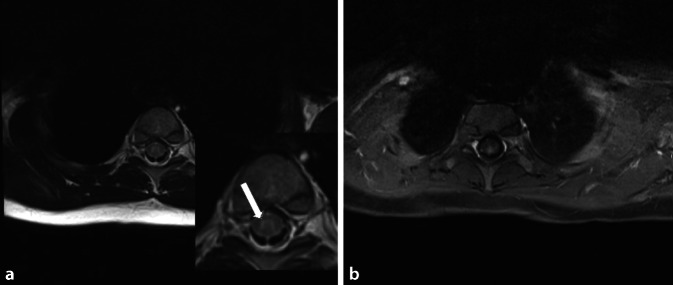
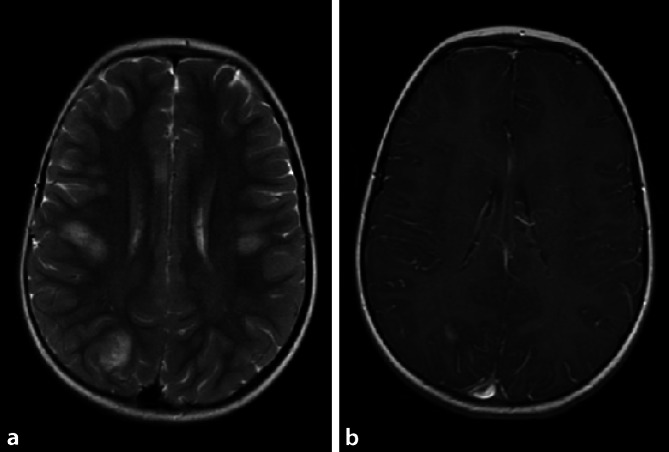
Das MRT-Bild variiert von kleinen punktförmigen Läsionen bis hin zu tumefaktiven Arealen, die einen geringen Masseneffekt haben können. Die Läsionen sind überwiegend in der supra- oder infratentoriellen weißen Substanz verteilt, manchmal begleitet von Läsionen in der grauen Substanz. Im Gegensatz zur MS ist die Beteiligung des Balkens ungewöhnlich [1]. Eine Beteiligung der grauen Substanz, des Hirnstamms oder der Basalganglien ist selten, spricht jedoch, wenn sichtbar, für ADEM und nicht für MS. Die Demyelinisierungsherde zeigen sich zum Kortex hyperintens in der T2-Wichtung, sind >2 cm groß, diffus verteilt und unscharf begrenzt. In der akuten Phase der Erkrankung zeigen sie eine meistens ringförmige KM-Affinität und Diffusionsstörung ([1]; Abb. 1). Kleine Läsionen oder solche, die gut abgrenzbar sind, können bei Beteiligung nur einer Region auf eine MOG-Antikörper-negative Erkrankung hinweisen [1]. Eine Beteiligung des Rückenmarks ist häufig durch eine longitudinal ausgedehnte transversale Myelitis (LETM) gekennzeichnet, deren konfluierende Läsion sich über drei oder mehr Rückenmarksegmente erstreckt (Abb. 2 und 3). LETM ist zwar ein Merkmal verschiedener Untergruppen von MOG-assoziierten Erkrankungen wie NMOD, kann aber auch isoliert auftreten [2]. Sie betrifft hauptsächlich zervikale und thorakale Segmente, seltener lumbale. Bevorzugt ist hier das graue Substanz des Rückenmarks betroffen (Abb. 2 und 3), was einem H‑Muster in der axialen Ebene entspricht. Kurze transversale Myelitis tritt häufiger bei Erwachsenen mit ADEM auf [1, 2].
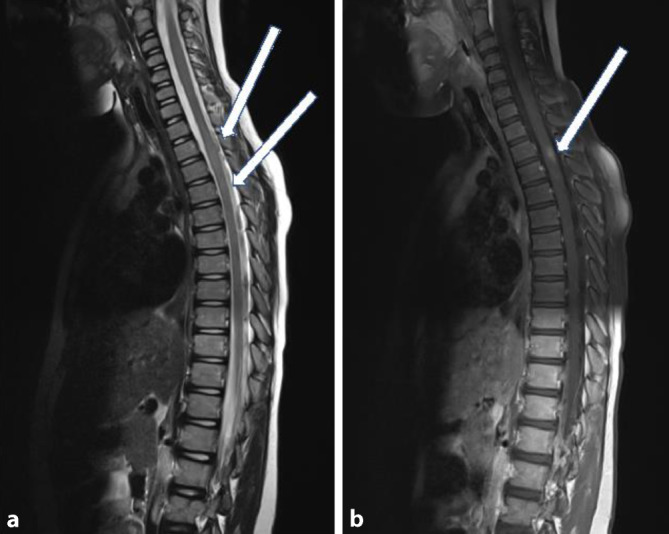
Je nach klinischem Verlauf wird eine Follow-up-Untersuchung 3 bis 6 Monate nach dem Baseline-Scan empfohlen. Wenn jüngere Kinder bei längeren MRT-Protokollen sediert werden müssen, kann eine Reduktion der Sequenzen auf axiale FLAIR-Sequenzen erwogen werden [8].
Differenzialdiagnose
Die erste Differenzialdiagnose bei ADEM ist die MS. Diese beiden Erkrankungen haben anfangs einen sehr ähnlichen Verlauf, daher ist die Differenzierung schwierig. Hier können die Callen-MS-ADEM-Kriterien hilfreich sein [5]. Sie umfassen nur 3 Kriterien (Fehlen eines diffusen bilateralen Läsionsmusters; „black holes“, chronische Destruktion der weißen Hirnsubstanz; Vorhandensein von 2 periventrikulären Läsionen), wobei mindestens zwei davon für die MS-Diagnose erfüllt sein müssen. Weitere Differenzialdiagnosen sind in Tab. 3 zusammengestellt.
| Erkrankung | Magnetresonanztomographie/klinische Merkmale |
|---|---|
| Multiple Sklerose | T2-hyperdense Läsionen im subkortikalen Marklager, symmetrische Verteilung, weiße Substanz, Balkenbefall, eher ältere Patienten, pädiatrische MS 3–5 % vor dem 17. Lebensjahr, Callen-Kriterien ([5], s. Text) |
| MS Marburg-Variante | Tumefaktive Läsionen, Masseneffekt, inkomplettes ringförmiges KM-Enhancement-Muster, fulminante Form der MS, eher junge Patienten |
| MS, konzentrische Sklerose Baló | Irreguläre, konzentrische, schießscheibenartige Demyelinisierungsherde mit ringförmiger KM-Affinität |
| MS, Morbus Schilder | >2 cm große, T2-hyperintese Demyelinisierungsregionen, häufig im Centrum semiovale, meistens supratentoriell |
| Susac-Syndrom (retinokochleozerebelläre Vaskulopathie) | „Snowball“-Läsionen, Balkeninvolvierung, KM-Affinität leptomeningeal, überwiegend junge Frauen, charakteristische klinische Symptomatik mit Hörverlust, Visuseinschränkung und Enzephalopathie |
| „Acute necrotizing encephalitis of childhood“ (ANEC) | Bilateraler Befall der Thalami, Putamen, Tegmentum mesencephali und intrakranielle Hämorrhagien |
| Chronic lymphocytic inflammation with pontine perivascular enhancement responsive to steroids (CLIPPERS) | Multiple, T2-hyperintense Läsionen im Pons und Pedunculi cerebellares sowie auch im Kleinhirn mit KM-Affinität, wenig Parenchymödem und wenig raumfordernd |
KM Kontrastmittel, MS multiple Sklerose
Behandlung und Prognose
Weil die Mehrheit der Fälle monophasisch verläuft, ist hier eine akute Therapie mit hohen Dosen von Steroiden angesagt. Neue Erkenntnisse weisen darauf hin, dass MOG-positive Patienten, insbesondere solche mit „relapsing ADEM“, von einer Immunsuppression profitieren [16]. Die Prognose bei Patienten mit monophasischer Form der Erkrankung ist gut, nach einigen Wochen/Monaten wird eine volle Genesung erwartet. Bei einigen Patienten wurde jedoch eine Persistenz der MRT-Läsionen berichtet, und die neuesten Studien zeigen bei einem Viertel der Patienten eine erniedrigte Lebensqualität, wobei die Aufmerksamkeit der Patienten am meisten beeinträchtigt war [24].
Fazit für die Praxis
Die akute disseminierte Enzephalomyelitis (ADEM) ist eine seltene Erkrankung, die überwiegend Kinder (4 bis 7 Jahre) betrifft, jedoch auch bei Erwachsenen auftreten kann.
Zwischen 50 und 75 % der Fälle treten nach einer vorausgegangenen Infektion (auch nach SARS-CoV-2) auf, maximal 5 % nach einer Impfung.
Bei Verdacht auf ADEM sollten die Myelin-Oligodendrozyten-Glykoprotein(MOG)-Antikörper bestimmt werden.
Es gibt unterschiedliche Formen von ADEM, die Mehrheit der Patienten präsentiert jedoch eine klassische Variante.
Die MRT-Läsionen sind obligat bei der Diagnosestellung und umfassen mehrere unscharf begrenzte T2-hyperintense, asymmetrische, supra- und/oder infratentoriell lokalisierte und meistens ringförmig kontrastmittelaffine Läsionen, die sich im Laufe der Erkrankung in der in den meisten Fälle zurückbilden.
Eine Follow-up-MRT sollte nach 3 bis 6 Monaten erwogen werden.
Einhaltung ethischer Richtlinien
Interessenkonflikt
M. Wolska-Krawczyk gibt an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Baumann M, Bartels F, Finke C, Adamsbaum C, Hacohen Y, Rostásy K. E.U. paediatric MOG consortium consensus: part 2—neuroimaging features of paediatric myelin oligodendrocyte glycoprotein antibody-associated disorders. Eur J Paediatr Neurol. 2020;29:14–21. doi: 10.1016/j.ejpn.2020.10.002. [DOI] [PubMed] [Google Scholar]
- 2.Baumann M, Sahin K, Lechner C, Hennes EM, Schanda K, Mader S, Karenfort M, Selch C, Häusler M, Eisenkölbl A, Salandin M, Gruber-Sedlmayr U, Blaschek A, Kraus V, Leiz S, Finsterwalder J, Gotwald T, Kuchukhidze G, Berger T, Reindl M, Rostásy K. Clinical and neuroradiological differences of paediatric acute disseminating encephalomyelitis with and without antibodies to the myelin oligodendrocyte glycoprotein. J Neurol Neurosurg Psychiatry. 2015;86:265–272. doi: 10.1136/jnnp-2014-308346. [DOI] [PubMed] [Google Scholar]
- 3.Bhatt P, Bray L, Raju S, Dapaah-Siakwan F, Patel A, Chaudhari R, Donda K, Bhatt NS, Dave M, Linga VG, Lekshminarayanan A, Patel SV, Billimoria ZC, Zuckerman S, Yagnik P, Singh D. Temporal trends of pediatric hospitalizations with acute disseminated encephalomyelitis in the United States: an analysis from 2006 to 2014 using national inpatient sample. J Pediatr. 2019;206:26–32. doi: 10.1016/j.jpeds.2018.10.044. [DOI] [PubMed] [Google Scholar]
- 4.Bruijstens AL, Lechner C, Flet-Berliac L, Deiva K, Neuteboom RF, Hemingway C, Wassmer E, Baumann M, Bartels F, Finke C, Adamsbaum C, Hacohen Y, Rostasy K. E.U. paediatric MOG consortium consensus: part 1—classification of clinical phenotypes of paediatric myelin oligodendrocyte glycoprotein antibody-associated disorders. Eur J Paediatr Neurol. 2020;29:2–13. doi: 10.1016/j.ejpn.2020.10.006. [DOI] [PubMed] [Google Scholar]
- 5.Callen DJ, Shroff MM, Branson HM, Li DK, Lotze T, Stephens D, Banwell BL. Role of MRI in the differentiation of ADEM from MS in children. Neurology. 2009;17:968–973. doi: 10.1212/01.wnl.0000338630.20412.45. [DOI] [PubMed] [Google Scholar]
- 6.Cole J, Evans E, Mwangi M, Mar S. Acute disseminated encephalomyelitis in children: an updated review based on current diagnostic criteria. Pediatr Neurol. 2019;100:26–34. doi: 10.1016/j.pediatrneurol.2019.06.017. [DOI] [PubMed] [Google Scholar]
- 7.Dale RC, de Sousa C, Chong WK, Cox TC, Harding B, Neville BG. Acute disseminated encephalomyelitis, multiphasic disseminated encephalomyelitis and multiple sclerosis in children. Brain. 2000;12:2407–2422. doi: 10.1093/brain/123.12.2407. [DOI] [PubMed] [Google Scholar]
- 8.Filippi M, Rocca MA, Ciccarelli O, De Stefano N, Evangelou N, Kappos L, Rovira A, Sastre-Garriga J, Tintorè M, Frederiksen JL, Gasperini C, Palace J, Reich DS, Banwell B, Montalban X, Barkhof F, MAGNIMS Study Group MRI criteria for the diagnosis of multiple sclerosis: MAGNIMS consensus guidelines. Lancet Neurol. 2016;15:292–303. doi: 10.1016/S1474-4422(15)00393-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Hynson JL, Kornberg AJ, Coleman LT, Shield L, Harvey AS, Kean MJ. Clinical and neuroradiologic features of acute disseminated encephalomyelitis in children. Neurology. 2001;22:1308–1312. doi: 10.1212/WNL.56.10.1308. [DOI] [PubMed] [Google Scholar]
- 10.Krupp LB, Tardieu M, Amato MP, Banwell B, Chitnis T, Dale RC, Ghezzi A, Hintzen R, Kornberg A, Pohl D, Rostasy K, Tenembaum S, Wassmer E. International pediatric multiple sclerosis study group. International pediatric multiple sclerosis study group criteria for pediatric multiple sclerosis and immune-mediated central nervous system demyelinating disorders: revisions to the 2007 definitions. Mult Scler. 2013;19:1261–1267. doi: 10.1177/1352458513484547. [DOI] [PubMed] [Google Scholar]
- 11.Leake JA, Albani S, Kao AS, Senac MO, Billman GF, Nespeca MP, Paulino AD, Quintela ER, Sawyer MH, Bradley JS. Acute disseminated encephalomyelitis in childhood: epidemiologic, clinical and laboratory features. Pediatr Infect Dis J. 2004;23(8):756–764. doi: 10.1097/01.inf.0000133048.75452.dd. [DOI] [PubMed] [Google Scholar]
- 12.López-Chiriboga AS, Majed M, Fryer J, Dubey D, McKeon A, Flanagan EP, Jitprapaikulsan J, Kothapalli N, Tillema JM, Chen J, Weinshenker B, Wingerchuk D, Sagen J, Gadoth A, Lennon VA, Keegan BM, Lucchinetti C, Pittock SJ. Association of MOG-IgG serostatus with relapse after acute disseminated encephalomyelitis and proposed diagnostic criteria for MOG-IgG-associated disorders. JAMA Neurol. 2018;75:1355–1363. doi: 10.1001/jamaneurol.2018.1814. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Lotze ET, Chadwick DJ. Acute disseminated encephalomyelitis (ADEM) in children: pathogenesis, clinical features, and diagnosis. 2020. [Google Scholar]
- 14.Marchioni E, Ravaglia S, Montomoli C, Tavazzi E, Minoli L, Baldanti F, Furione M, Alfonsi E, Bergamaschi R, Romani A, Piccolo L, Zardini E, Bastianello S, Pichiecchio A, Ferrante P, Delbue S, Franciotta D, Bono G, Ceroni M. Postinfectious neurologic syndromes: a prospective cohort study. Neurology. 2013;5:882–889. doi: 10.1212/WNL.0b013e3182840b95. [DOI] [PubMed] [Google Scholar]
- 15.Nakayama T, Onoda K. Vaccine adverse events reported in post-marketing study of the Kitasato Institute from 1994 to 2004. Vaccine. 2007;25:570–576. doi: 10.1016/j.vaccine.2006.05.130. [DOI] [PubMed] [Google Scholar]
- 16.Otallah S. Acute disseminated encephalomyelitis in children and adults: a focused review emphasizing new developments. Mult Scler. 2021;27(8):1153–1160. doi: 10.1177/1352458520929627. [DOI] [PubMed] [Google Scholar]
- 17.Pavone P, Pettoello-Mantovano M, Le Pira A, Giardino I, Pulvirenti A, Giugno R, Parano E, Polizzi A, Distefano A, Ferro A, Pavone L, Ruggieri M. Acute disseminated encephalomyelitis: a long-term prospective study and meta-analysis. Neuropediatrics. 2010;41(6):246–255. doi: 10.1055/s-0031-1271656. [DOI] [PubMed] [Google Scholar]
- 18.Pohl D, Alper G, Van Haren K, Kornberg AJ, Lucchinetti CF, Tenembaum S, Belman AL. Acute disseminated encephalomyelitis: updates on an inflammatory CNS syndrome. Neurology. 2016;30:S38–45. doi: 10.1212/WNL.0000000000002825. [DOI] [PubMed] [Google Scholar]
- 19.Deutsche Gesellschaft für Neuropädiatrie . S1 Pädiatrische Multiple Sklerose. 2022. [Google Scholar]
- 20.Deutsche Gesselschaft der Neurologie . S2k Neue Leitlinie für Diagnostik und Therapie der Multiplen Sklerose. 2021. [Google Scholar]
- 21.Sell E, Minassian BA. Demystifying vaccination-associated encephalopathy. Lancet Neurol. 2006;5:465–466. doi: 10.1016/S1474-4422(06)70452-5. [DOI] [PubMed] [Google Scholar]
- 22.de Seze J, Debouverie M, Zephir H, Lebrun C, Blanc F, Bourg V, Wiertlewski S, Pittion S, Laplaud D, Le Page E, Deschamps R, Cabre P, Pelletier J, Malikova I, Clavelou P, Jaillon V, Defer G, Labauge P, Gout O, Boulay C, Edan G, Vermersch P. Acute fulminant demyelinating disease: a descriptive study of 60 patients. Arch Neurol. 2007;64:1426–1432. doi: 10.1001/archneur.64.10.1426. [DOI] [PubMed] [Google Scholar]
- 23.Stonehouse M, Gupte G, Wassmer E, Whitehouse WP. Acute disseminated encephalomyelitis: recognition in the hands of general paediatricians. Arch Dis Child. 2003;88(2):122–124. doi: 10.1136/adc.88.2.122. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Suppiej A, Cainelli E, Casara G, Cappellari A, Nosadini M, Sartori S. Long-term neurocognitive outcome and quality of life in pediatric acute disseminated encephalomyelitis. Pediatr Neurol. 2014;4:363–367. doi: 10.1016/j.pediatrneurol.2013.12.006. [DOI] [PubMed] [Google Scholar]
- 25.Wang Y, Wang Y, Huo L, Li Q, Chen J, Wang H. SARS-CoV-2-associated acute disseminated encephalomyelitis: a systematic review of the literature. J Neurol. 2021;8:1–22. doi: 10.1007/s00415-021-10771-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Wege H, Schluesener H, Meyermann R, Barac-Latas V, Suchanek G, Lassmann H. Coronavirus infection and demyelination. Development of inflammatory lesions in Lewis rats. Adv Exp Med Biol. 1998;440:437–444. doi: 10.1007/978-1-4615-5331-1_55. [DOI] [PubMed] [Google Scholar]
- 27.Yeh EA, Collins A, Cohen ME, Duffner PK, Faden H. Detection of coronavirus in the central nervous system of a child with acute disseminated encephalomyelitis. Pediatrics. 2004;113(1):e73–6. doi: 10.1542/peds.113.1.e73. [DOI] [PubMed] [Google Scholar]
- 28.Yildiz Ö, Pul R, Raab P, Hartmann C, Skripuletz T, Stangel M. Acute hemorrhagic leukoencephalitis (Weston-Hurst syndrome) in a patient with relapse-remitting multiple sclerosis. J Neuroinflammation. 2015;17:175. doi: 10.1186/s12974-015-0398-1. [DOI] [PMC free article] [PubMed] [Google Scholar]