Abstract
目的
研究局灶性癫痫患儿与健康儿童肠道菌群是否不同,以及癫痫患儿治疗前后肠道菌群的变化。
方法
招募未经治疗的初诊局灶性癫痫患儿10例为病例组,且均用单药奥卡西平治疗。收集患儿临床资料,以及治疗前和治疗3个月后的粪便标本;另招募相同年龄段的健康儿童14例为对照组。提取粪便标本中细菌总DNA,进行16S rDNA测序,并行生物信息学分析。
结果
病例组经奥卡西平治疗3个月后癫痫发作频率减少>50%。门水平方面,治疗前组放线菌门丰度高于治疗后组和对照组(P<0.05);属水平方面,治疗前组埃希菌/志贺菌属、链球菌属、柯林斯菌属和巨单胞菌属丰度高于对照组(P<0.05),经治疗后其丰度降低(P<0.05)。
结论
与健康儿童相比,局灶性癫痫患儿的肠道菌群存在显著差异;奥卡西平可以显著改善癫痫症状,重塑癫痫患儿的肠道菌群。
Keywords: 癫痫, 肠道菌群, 局灶性发作, 儿童
Abstract
Objective
To study the difference in intestinal flora between children with focal epilepsy and healthy children and the change in intestinal flora after treatment in children with epilepsy.
Methods
A total of 10 children with newly diagnosed focal epilepsy were recruited as the case group and were all treated with oxcarbazepine alone. Their clinical data were recorded. Fecal specimens before treatment and after 3 months of treatment were collected. Fourteen aged-matched healthy children were recruited as the control group. Total bacterial DNA was extracted from the fecal specimens for 16S rDNA sequencing and bioinformatics analysis.
Results
After 3 months of carbamazepine treatment, the seizure frequency was reduced by >50% in the case group. At the phylum level, the abundance of Actinobacteria in the case group before treatment was significantly higher than that in the control group (P<0.05), and it was reduced after treatment (P<0.05). At the genus level, the abundances of Escherichia/Shigella, Streptococcus, Collinsella, and Megamonas in the case group before treatment were significantly higher than those in the control group (P<0.05), and the abundances of these bacteria decreased significantly after treatment (P<0.05).
Conclusions
There is a significant difference in intestinal flora between children with focal epilepsy and healthy children. Oxcarbazepine can significantly improve the symptoms and intestinal flora in children with epilepsy.
Keywords: Epilepsy, Intestinal flora, Focal seizure, Child
癫痫是神经系统的常见疾病,据统计,全球有7 000多万癫痫患者,发病率约为50/10万人每年[1],局灶性发作已成为儿童癫痫最常见的癫痫发作类型[2],主要治疗方式是口服抗癫痫药物,且以奥卡西平治疗居多。研究表明抗癫痫药物治疗儿童局灶性癫痫效果显著[3],但局灶性发作不仅可继发其他严重的发作类型,如局灶继发双侧强直-阵挛发作,而且仍有一部分患儿对抗癫痫药物耐药,发展为难治性癫痫,反复癫痫发作可导致认知缺陷,如记忆和学习障碍、永久性脑功能障碍及病死率增加等[4],严重影响患儿的健康成长。近年来,研究发现肠道菌群可能通过脑-肠轴与大脑产生双向联系,包括迷走神经、下丘脑-垂体-肾上腺轴、免疫系统、神经递质及炎症因子等途径,参与癫痫的发生发展[5]。因此本研究采用病例对照研究方法了解局灶性癫痫患儿与健康儿童肠道菌群的差异,以及了解癫痫患儿治疗前后肠道菌群的变化,症状改善与肠道菌群的关系,希望为癫痫的发病机制及更好的替代治疗提供新的方向。
1. 资料与方法
1.1. 研究对象
选择2020年4~10月在湖南省儿童医院神经内科就诊的初诊局灶性癫痫患儿,筛选符合纳入标准的且以奥卡西平单药治疗的患儿为病例组,收集治疗前和治疗3个月后的粪便标本。病例组纳入标准:(1)符合2017年国际抗癫痫联盟的癫痫诊断标准[6]。(2)脑电图和临床表现支持癫痫局灶性发作。(3)头颅MRI未见明显异常。(4)入组年龄>2岁,性别不限,于我院神经内科首次确诊。(5)治疗前3个月内癫痫发作频率≥2次。(6)监护人知情同意。排除标准:(1)严重营养不良或过剩;(2)收集粪便标本2周前有呕吐、腹泻、腹痛、便血等消化系统疾病病史;(3)收集粪便标本2周前有使用抗生素及益生菌史;(4)合并孤独症谱系障碍疾病、代谢性脑病等癫痫以外的神经或精神疾病;(5)血氨基酸/尿有机酸代谢异常;(6)近2个月饮食习惯有明显变化。治疗3个月后排除标准:(1)治疗期间未规律服用抗癫痫药物;(2)治疗期间有加用或替换其他抗癫痫药物;(3)治疗期间饮食习惯有明显改变;(4)治疗期间有居住地迁移史;(5)收集粪便标本2周前有呕吐、腹泻、腹痛、便血等消化系统疾病病史;(6)收集粪便标本2周前有使用抗生素及益生菌史。
另招募相同地区相同年龄段的健康儿童为对照组。纳入标准:(1)入组年龄>2岁,性别不限;(2)在我院儿童保健科体格检查合格;(3)监护人知情同意。排除标准:(1)营养不良或过剩;(2)收集粪便标本2周前有呕吐、腹泻、腹痛、便血等消化系统疾病病史;(3)收集粪便标本2周前有使用抗生素及益生菌史;(4)既往有癫痫、孤独症谱系障碍疾病、代谢性脑病等神经或精神疾病;(5)近2个月饮食习惯有明显变化。
本研究已通过我院伦理委员会审查(HCHLL-2020-53)。
1.2. 粪便标本收集
使用常规粪便采集器收集患儿治疗前的粪便标本,取粪便中段标本,每份标本重量应大于5 g,并于采集后半小时内保存于-80℃冰箱。患儿治疗3个月后的粪便使用上海天昊生物科技有限公司提供的粪便采集套装采集(此采集管收集的标本,在常温下2周内不会改变粪便菌群),将粪便采集套装及说明书邮寄给患儿家属,由家属采集大于5 g的粪便中段标本,保存于粪便采集管的保存液中。对照组的粪便标本收集同治疗后组。收到标本后同样保存于-80℃冰箱,之后再通过干冰运送到高通量测序服务公司。
1.3. 16S rDNA测序
(1)提取粪便标本中细菌总DNA;(2)基因组DNA质量检测;(3)在扩增引物下,对合格标本的检测区域V4~V5区进行高保真聚合酶链式反应扩增;(4)通过高保真聚合酶链式反应对各样本添加特异性标签序列;(5)对已添加标签的样本文库进行定量和混合;(6)通过Agilent 2100 Bioanalyzer对文库进行质量检测,再Illumina上机测序,后续对测序数据进行生物信息学分析。
1.4. 生物信息学分析
计算菌群多样性的指数:Shannon指数和Simpson指数是常用的反映α-多样性指数。Shannon指数数值越大,说明群落多样性越高;Simpson指数数值越小,说明群落多样性越高。
Metastats分析:通过对组间样本进行比较,在各分类水平上找出2组中差异有统计学意义的物种,以P<0.05作为差异有统计学意义筛选阈值。
1.5. 临床疗效评判
记录患儿癫痫发作频率、发作形式、持续时间等情况。根据患儿治疗前3个月和治疗后3个月之间癫痫发作频率减少百分率进行疗效判断,其评定标准为:(1)完全控制:无癫痫发作;(2)有效:癫痫发作频率减少≥50%;(3)无效:癫痫发作频率减少<50%或加重。总有效率=完全控制率+有效率[7]。
1.6. 统计学分析
采用SPSS 25.0软件进行数据处理。正态分布计量资料用均数±标准差( )描述,组间比较采用两样本t检验;非正态分布计量资料用中位数(四分位数间距)[M(P 25,P 75)]描述,两组间比较采用Wilcoxon秩和检验或Wilcoxon符号秩检验;计数资料用例数和百分率(%)描述,组间比较采用 检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2. 结果
2.1. 研究对象的基本资料
本研究最初纳入17例局灶性癫痫患儿,经治疗3个月后随访发现治疗无效1例,6例因拒接随访电话或拒绝收集随访标本剔除,由于治疗无效病例太少,不能单独进行数据分析,故不纳入研究。最终本研究共纳入10例治疗有效(7例完全控制,3例癫痫发作频率较前减少≥50%)的局灶性癫痫患儿为病例组,14例健康儿童纳入对照组,2组儿童年龄、性别、体重指数差异无统计学意义(P>0.05),见表1。
表1.
病例组和对照组一般资料比较
| 组别 | 例数 | 年龄[M(P 25, P 75), 岁] | 性别 [例(%)] | 体重指数[M(P 25, P 75), kg/ ] | |
|---|---|---|---|---|---|
| 男 | 女 | ||||
| 对照组 | 14 | 5(4, 8) | 8(57) | 6(43) | 15.2(14.6, 15.6) |
| 病例组 | 10 | 6(5, 9) | 5(50) | 5(50) | 14.4(13.6, 15.9) |
| Z值 | -1.906 | - | -0.586 | ||
| P值 | 0.057 | 1.000 | 0.558 | ||
2.2. 多样性指数分析
治疗前组和治疗后组Shannon指数较对照组均升高(P<0.05),治疗前组Simpson指数较对照组减少(P<0.05)。治疗前组和治疗后组Shannon指数、Simpson指数差异无统计学意义(P>0.05)。见表2。
表2.
治疗前组、治疗后组和对照组多样性指数比较
| 组别 | 例数 | Shannon指数 | Simpson指数 |
|---|---|---|---|
| 对照组 | 14 | 3.047(2.836, 3.491) | 0.094(0.070, 0.144) |
| 治疗前组 | 10 | 3.807(3.643, 4.286) | 0.053(0.026, 0.063) |
| 治疗后组 | 10 | 3.577(3.304, 3.904) | 0.063(0.049, 0.101) |
| P 1值 | 0.001 | 0.001 | |
| P 2值 | 0.165 | 0.190 | |
| P 3值 | 0.019 | 0.122 |
注: P 1代表治疗前组vs对照组;P 2代表治疗前组vs治疗后组;P 3代表治疗后组vs对照组。
[M(P 25,P 75)]
2.3. Metastats分析:从门水平分析肠道菌群组成
门水平方面,治疗前组、治疗后组和对照组肠道菌群结构主要由拟杆菌门、厚壁菌门组成,见图1。从各组菌群丰度值可看出,选取的菌群要求至少有1组菌群丰度>1%,治疗前组放线菌门丰度高于对照组和治疗后组(P<0.05),治疗后组与对照组间拟杆菌门、厚壁菌门、变形菌门、放线菌门丰度差异无统计学意义(P>0.05),见表3。
图1. 3组各样本在门水平上的菌群组成柱状图 D代表治疗前组,S代表治疗后组,J代表对照组。.
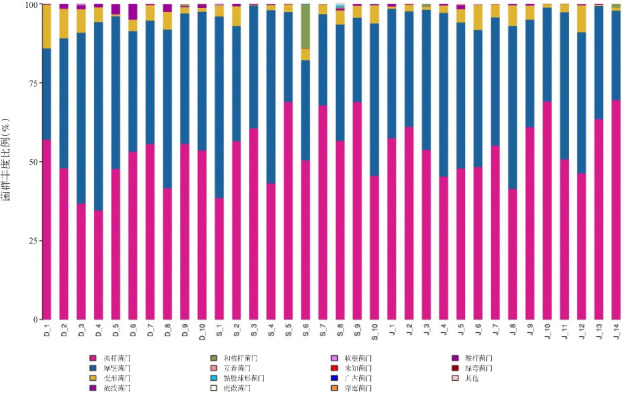
表3.
3组门水平上的肠道菌群差异 ( )
| 菌门 | 对照组 | 治疗前组 | 治疗后组 | P 1值 | P 2值 | P 3值 |
|---|---|---|---|---|---|---|
| 拟杆菌门 | 0.550±0.024 | 0.484±0.026 | 0.557±0.035 | 0.072 | 0.099 | 0.873 |
| 厚壁菌门 | 0.411±0.020 | 0.445±0.028 | 0.389±0.035 | 0.335 | 0.215 | 0.586 |
| 变形菌门 | 0.033±0.007 | 0.053±0.013 | 0.035±0.006 | 0.220 | 0.199 | 0.897 |
| 放线菌门 | 0.003±0.001 | 0.016±0.005 | 0.003±0.001 | 0.005 | 0.003 | 0.940 |
注: P 1代表治疗前组vs对照组;P 2代表治疗前组vs治疗后组;P 3代表治疗后组vs对照组。
2.4. Metastats分析:从属水平分析肠道菌群组成
从属水平上分析治疗前组、治疗后组和对照组之间的肠道差异菌群,见图2和表4,选取的菌群要求至少有1组菌群丰度>1%,结果显示治疗前组肠道菌群差异最大,治疗前组埃希菌/志贺菌属、链球菌属、Romboutsia属、柯林斯菌属和巨单胞菌属的丰度均高于对照组和治疗后组(P<0.05)。而对照组和治疗后组间肠道菌群差异小,对照组副拟杆菌属、颤杆菌克属和巨单胞菌属丰度高于治疗后组(P<0.05),治疗后组的Anaerostipes属丰度高于对照组(P<0.05)。
图2. 从属水平上分析的肠道菌群柱状图 D代表治疗前组,S代表治疗后组,J代表对照组。.
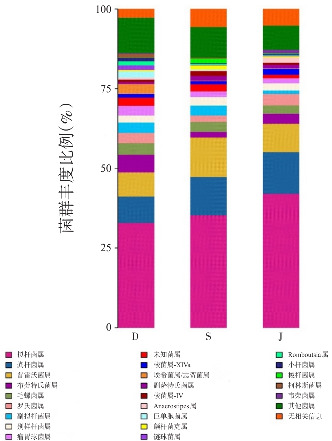
表4.
3组在属水平上的肠道菌群丰度差异 ( )
| 菌属 | 对照组 | 治疗前组 | 治疗后组 | P 1值 | P 2值 | P 3值 |
|---|---|---|---|---|---|---|
| 拟杆菌属 | 0.421±0.047 | 0.329±0.050 | 0.353±0.070 | 0.197 | 0.762 | 0.451 |
| 粪杆菌属 | 0.131±0.013 | 0.083±0.011 | 0.121±0.015 | 0.007 | 0.059 | 0.585 |
| 普雷沃菌属 | 0.088±0.049 | 0.076±0.038 | 0.124±0.056 | 0.886 | 0.482 | 0.626 |
| 布劳特氏菌属 | 0.032±0.005 | 0.055±0.012 | 0.017±0.005 | 0.065 | 0.005 | 0.060 |
| 罗氏菌属 | 0.036±0.011 | 0.032±0.008 | 0.020±0.005 | 0.761 | 0.228 | 0.190 |
| 副拟杆菌属 | 0.011±0.005 | 0.032±0.007 | 0.031±0.004 | 0.025 | 0.858 | 0.012 |
| 别样杆菌属 | 0.022±0.010 | 0.022±0.006 | 0.027±0.008 | 0.990 | 0.627 | 0.681 |
| 瘤胃球菌属 | 0.016±0.005 | 0.030±0.009 | 0.017±0.004 | 0.197 | 0.213 | 0.837 |
| 埃希菌/志贺菌属 | 0.002±0.001 | 0.031±0.012 | 0.001±0.001 | 0.002 | 0.002 | 0.891 |
| 颤杆菌克属 | 0.004±0.002 | 0.004±0.001 | 0.013±0.002 | 0.770 | 0.015 | 0.011 |
| 链球菌属 | 0.002±0.001 | 0.015±0.004 | 0.002±0.001 | 0.001 | 0.001 | 0.842 |
| Romboutsia属 | 0.002±0.001 | 0.013±0.006 | 0.002±0.001 | 0.023 | 0.034 | 0.815 |
| 柯林斯菌属 | 0.001±0.001 | 0.012±0.004 | 0.002±0.001 | 0.003 | 0.005 | 0.177 |
| 巨单胞菌属 | 0.000±0.000 | 0.019±0.007 | 0.003±0.001 | 0.003 | 0.028 | 0.008 |
| Anaerostipes属 | 0.017±0.005 | 0.007±0.002 | 0.003±0.000 | 0.086 | 0.009 | 0.001 |
注: P 1代表治疗前组vs对照组;P 2代表治疗前组vs治疗后组;P 3代表治疗后组vs对照组。
3. 讨论
本研究经多样性指数分析发现治疗前组α-多样性显著高于对照组,而治疗后组的多样性较治疗前组有下降趋势,表明局灶性癫痫患儿在经治疗有效后肠道菌群多样性下降。Peng等[8]研究也发现耐药性癫痫组菌群多样性显著高于药物敏感性癫痫组和健康对照组,同时后者两组间多样性接近,本研究与该结果[8]基本一致。另有研究也证明了癫痫治疗前后肠道菌群多样性存在变化,Zhang等[9]通过生酮饮食治疗20例难治性癫痫患儿,6个月后患儿的肠道菌群多样性降低,且观察到有10例患儿癫痫发作得到有效控制。这说明肠道菌群多样性增加可能在癫痫中起到有害作用。另一方面,也有研究认为肠道菌群多样性增高可能对神经发育不利,Carlson等[10]研究发现,肠道菌群多样性与认知水平有关,α-多样性越高认知表现越差。因此,降低局灶性癫痫患儿中的肠道菌群α-多样性可能有利于减少癫痫发作频率,本研究治疗后组菌群多样性较治疗前组下降,但差异无统计学意义,可能是癫痫治疗时间短,从而菌群改变少有关。
本研究发现治疗前组放线菌门、埃希菌/志贺菌属、链球菌属、柯林斯菌属和巨单胞菌属丰度显著高于对照组,且经治疗后其丰度显著降低。放线菌门包括红蝽菌目、红蝽菌科和柯林斯菌属,文献报道[11]大部分红蝽菌纲属于厌氧菌,在人体肠道内有致病性,而柯林斯菌属是其优势菌群。柯林斯菌属能诱导白细胞介素(interleukin,IL)-17细胞因子的表达[12],辅助性T细胞17主要产生IL-17A、IL-17F和IL-22,而癫痫发作间期IL-17A水平与癫痫发作频率和严重程度呈正相关[13]。埃希菌/志贺菌属被报道其丰度与IL-1β、CXCL2和NLRP3炎性小体的水平呈正相关[14],其中NLRP3炎性小体能促进炎性细胞因子IL-1β和IL-18的成熟和分泌[15-16],IL-1β也能增加神经元兴奋性,参与癫痫发作[17-19]。链球菌是一种常见的病原菌,其生长的增加会提高IL-6和肿瘤坏死因子α的水平[20]。肿瘤坏死因子α被报道能促进Ca2+大量内流,导致神经兴奋性增强[21]。此外,IL-6也可能与癫痫发作有关[22]。因此,柯林斯菌属、埃希菌/志贺菌属、链球菌属在局灶性癫痫患儿中可能通过神经炎症参与癫痫发生。
本研究发现,治疗后组和对照组粪杆菌属和普雷沃菌属丰度显著高于治疗前组,对照组粪杆菌属丰度显著高于治疗前组。普雷沃菌属、粪杆菌属能产生短链脂肪酸(short-chain fatty acids,SCFAs)[23-24]。SCFAs是调节小胶质细胞成熟、形态和功能的关键分子,小胶质细胞作为神经组织内重要的免疫细胞,是中枢神经系统稳态的参与者,在应激或病理状态下,小胶质细胞被活化,从而分泌大量炎症因子,如IL-1、IL-8、肿瘤坏死因子α等,引起神经元免疫性损伤,参与癫痫的发生机制[25-29]。另有研究表明[30]在大鼠近端结肠腔内注射生理浓度的SCFAs,可刺激肠嗜铬细胞释放5-羟色胺(5-hydroxytryptamine,5-HT),5-HT作为一种神经递质,存在不同的受体类型,其中5-HT 7型受体激活后,可抑制癫痫发作[31]。所以拟杆菌属、普雷沃菌属可能通过SCFAs调控免疫炎症和神经递质水平,在局灶性癫痫中起到保护作用。
局灶性癫痫患儿与健康儿童的肠道菌群存在显著差异,患儿经奥卡西平抗癫痫治疗后临床症状改善,肠道菌群也发生改变。奥卡西平抗癫痫的机制可能是通过阻断电压依赖性钠通道降低神经细胞膜兴奋性和突触兴奋传递能力,抑制神经元反复放电来实现的,但其作用于肠道菌群的机制尚不清楚,笔者认为,奥卡西平可能通过脑-肠轴的双向联系来调节肠道菌群。
肠道菌群与癫痫的紧密联系,使得粪便微生物群移植(fecal microbiota transplantation,FMT)可能作为治疗癫痫的新方法,曾有1例伴有17年癫痫发作病史的克罗恩病患者,癫痫发作频率约120次/年,经过FMT治疗后,该患者在无抗癫痫药物治疗下近20个月无癫痫发作[32]。此外,Vendrik等[33]认为FMT对于治疗孤独症谱系障碍、多发性硬化、帕金森病及癫痫等神经系统疾病十分有前景。然而,目前可用的临床证据很少,需要大型前瞻性双盲随机对照试验来进一步证明FMT在癫痫治疗中的作用。
基金资助
社会发展领域重点研发项目(2017SK2154)。
利益冲突声明
所有作者声明不存在利益冲突关系。
参 考 文 献
- 1. Thijs RD, Surges R, O'Brien TJ, et al. Epilepsy in adults[J]. Lancet, 2019, 393(10172): 689-701. DOI: 10.1016/S0140-6736(18)32596-0. [DOI] [PubMed] [Google Scholar]
- 2. 姜永生, 宋婷婷, 张小鸽, 等. 345例儿童癫痫和癫痫综合征发作类型临床分析[J]. 临床儿科杂志, 2019, 37(11): 812-815. DOI: 10.3969/j.issn.1000-3606.2019.11.004. [DOI] [Google Scholar]
- 3. 钟羽, 陈斌, 刘世凯. 儿童癫痫局灶性发作采用奥卡西平与丙戊酸钠治疗临床疗效及其安全性比较[J]. 中外医疗, 2018, 37(5): 136-137, 143. DOI: 10.16662/j.cnki.1674-0742.2018.05.136. [DOI] [Google Scholar]
- 4. Dahlin M, Prast-Nielsen S. The gut microbiome and epilepsy[J]. EBioMedicine, 2019, 44: 741-746. DOI: 10.1016/j.ebiom.2019.05.024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. De Caro C, Iannone LF, Citraro R, et al. Can we 'seize' the gut microbiota to treat epilepsy?[J]. Neurosci Biobehav Rev, 2019, 107: 750-764. DOI: 10.1016/j.neubiorev.2019.10.002. [DOI] [PubMed] [Google Scholar]
- 6. 丛璐璐, 赵宗茂. 2017年国际抗癫痫联盟癫痫发作和癫痫新分类的简要解读[J]. 河北医科大学学报, 2018, 39(9): 993-995, 1001. DOI: 10.3969/j.issn.1007-3205.2018.09.001. [DOI] [Google Scholar]
- 7. Chen XQ, Zhang WN, Yang ZX, et al. Efficacy of levetiracetam in electrical status epilepticus during sleep of children: a multicenter experience[J]. Pediatr Neurol, 2014, 50(3): 243-249. DOI: 10.1016/j.pediatrneurol.2013.10.015. [DOI] [PubMed] [Google Scholar]
- 8. Peng AJ, Qiu XM, Lai WL, et al. Altered composition of the gut microbiome in patients with drug-resistant epilepsy[J]. Epilepsy Res, 2018, 147: 102-107. DOI: 10.1016/j.eplepsyres.2018.09.013. [DOI] [PubMed] [Google Scholar]
- 9. Zhang YJ, Zhou SZ, Zhou YF, et al. Altered gut microbiome composition in children with refractory epilepsy after ketogenic diet[J]. Epilepsy Res, 2018, 145: 163-168. DOI: 10.1016/j.eplepsyres.2018.06.015. [DOI] [PubMed] [Google Scholar]
- 10. Carlson AL, Xia K, Azcarate-Peril MA, et al. Infant gut microbiome associated with cognitive development[J]. Biol Psychiatry, 2017, 83(2): 148-159. DOI: 10.1016/j.biopsych.2017.06.021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Huang NN, Hua DY, Zhan GF, et al. Role of Actinobacteria and Coriobacteriia in the antidepressant effects of ketamine in an inflammation model of depression[J]. Pharmacol Biochem Behav, 2019, 176: 93-100. DOI: 10.1016/j.pbb.2018.12.001. [DOI] [PubMed] [Google Scholar]
- 12. Chen J, Wright K, Davis JM, et al. An expansion of rare lineage intestinal microbes characterizes rheumatoid arthritis[J]. Genome Med, 2016, 8(1): 43. DOI: 10.1186/s13073-016-0299-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Mao LY, Ding J, Peng WF, et al. Interictal interleukin-17A levels are elevated and correlate with seizure severity of epilepsy patients[J]. Epilepsia, 2013, 54(9): e142-e145. DOI: 10.1111/epi.12337. [DOI] [PubMed] [Google Scholar]
- 14. Cattaneo A, Cattane N, Galluzzi S, et al. Association of brain amyloidosis with pro-inflammatory gut bacterial taxa and peripheral inflammation markers in cognitively impaired elderly[J]. Neurobiol Aging, 2017, 49: 60-68. DOI: 10.1016/j.neurobiolaging.2016.08.019. [DOI] [PubMed] [Google Scholar]
- 15. Lu A, Wu H. Structural mechanisms of inflammasome assembly[J]. FEBS J, 2015, 282(3): 435-444. DOI: 10.1111/febs.13133. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Voet S, Srinivasan S, Lamkanfi M, et al. Inflammasomes in neuroinflammatory and neurodegenerative diseases[J]. EMBO Mol Med, 2019, 11(6): e10248. DOI: 10.15252/emmm.201810248. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. Alyu F, Dikmen M. Inflammatory aspects of epileptogenesis: contribution of molecular inflammatory mechanisms[J]. Acta Neuropsychiatr, 2017, 29(1): 1-16. DOI: 10.1017/neu.2016.47. [DOI] [PubMed] [Google Scholar]
- 18. Balosso S, Maroso M, Sanchez-Alavez M, et al. A novel non-transcriptional pathway mediates the proconvulsive effects of interleukin-1beta[J]. Brain, 2008, 131(Pt 12): 3256-3265. DOI: 10.1093/brain/awn271. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. 贾天明, 李月琴, 张晓莉, 等. 核苷酸结合寡聚化结构域样受体蛋白3炎性小体在癫痫大鼠模型中的表达及褪黑素对其的影响[J]. 中华实用儿科临床杂志, 2018, 33(12): 913-917. DOI: 10.3760/cma.j.issn.2095-428X.2018.12.009. [DOI] [Google Scholar]
- 20. Jiang WW, Wu N, Wang XM, et al. Dysbiosis gut microbiota associated with inflammation and impaired mucosal immune function in intestine of humans with non-alcoholic fatty liver disease[J]. Sci Rep, 2015, 5: 8096. DOI: 10.1038/srep08096. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Galic MA, Riazi K, Pittman QJ. Cytokines and brain excitability[J]. Front Neuroendocrinol, 2012, 33(1): 116-125. DOI: 10.1016/j.yfrne.2011.12.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22. Rana A, Musto AE. The role of inflammation in the development of epilepsy[J]. Neuroinflammation, 2018, 15(1): 144. DOI: 10.1186/s12974-018-1192-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23. 谭惠子. 健康人群肠道中低丰度拟杆菌的筛选及生理作用研究[D]. 无锡: 江南大学, 2019. [Google Scholar]
- 24. Joseph J, Depp C, Shih PAB, et al. Modified Mediterranean diet for enrichment of short chain fatty acids: potential adjunctive therapeutic to target immune and metabolic dysfunction in schizophrenia?[J]. Front Neurosci, 2017, 11: 155. DOI: 10.3389/fnins.2017.00155. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25. Erny D, Hrabě de Angelis AL, Jaitin D, et al. Host microbiota constantly control maturation and function of microglia in the CNS[J]. Nat Neurosci, 2015, 18(7): 965-977. DOI: 10.1038/nn.4030. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. Nayak D, Roth TL, McGavern DB. Microglia development and function[J]. Annu Rev Immunol, 2014, 32: 367-402. DOI: 10.1146/annurev-immunol-032713-120240. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27. Eyo UB, Murugan M, Wu LJ. Microglia-neuron communication in epilepsy[J]. Glia, 2017, 65(1): 5-18. DOI: 10.1002/glia.23006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28. Hiragi T, Ikegaya Y, Koyama R. Microglia after seizures and in epilepsy[J]. Cells, 2018, 7(4): 26. DOI: 10.3390/cells7040026. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29. 傅希玥, 陆地, 边立功, 等. 小胶质细胞的激活与癫痫的关系[J]. 昆明医科大学学报, 2017, 38(2): 127-130. DOI: 10.3969/j.issn.1003-4706.2017.02.029. [DOI] [Google Scholar]
- 30. Fukumoto S, Tatewaki M, Yamada T, et al. Short-chain fatty acids stimulate colonic transit via intraluminal 5-HT release in rats[J]. Am J Physiol Regul Integr Comp Physiol, 2003, 284(5): R1269-R1276. DOI: 10.1152/ajpregu.00442.2002. [DOI] [PubMed] [Google Scholar]
- 31. Pericić D, Svob Strac D. The role of 5-HT7 receptors in the control of seizures[J]. Brain Res, 2007, 1141: 48-55. DOI: 10.1016/j.brainres.2007.01.019. [DOI] [PubMed] [Google Scholar]
- 32. He Z, Cui BT, Zhang T, et al. Fecal microbiota transplantation cured epilepsy in a case with Crohn's disease: the first report[J]. World J Gastroenterol, 2017, 23(19): 3565-3568. DOI: 10.3748/wjg.v23.i19.3565. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33. Vendrik KEW, Ooijevaar RE, de Jong PRC, et al. Fecal microbiota transplantation in neurological disorders[J]. Front Cell Infect Microbiol, 2020, 10: 98. DOI: 10.3389/fcimb.2020.00098. [DOI] [PMC free article] [PubMed] [Google Scholar]


