Abstract
目的
探讨ANA-12靶向阻断脑源性神经营养因子(BDNF)/原肌球蛋白受体激酶B(TrkB)信号对炎症痛的抑制作用及机制。
方法
将42只大鼠随机分为7组(6只/组):BDNF处理下的对照组、ANA-12处理组、BDNF处理组以及BDNF和ANA-12联合处理组(BDNF+ANA-12);炎症痛模型下的对照组、CFA处理组以及CFA和ANA-12联合处理组(CFA+ANA-12)。给药完毕后,对各组大鼠进行痛觉行为学检测,记录ANA-12处理对BDNF-急性痛和CFA-慢性炎症痛大鼠痛觉行为的影响;采用免疫印迹法检测各组大鼠脊髓组织TrkB信号、小胶质细胞标记蛋白Iba1和促炎细胞因子TNF-α以及炎症因子IL-1β、Caspase-1、NLRP3的表达水平。
结果
与对照组相比,BDNF增加自发缩足次数(P < 0.05);与BDNF组相比,ANA-12降低自发缩足次数(P < 0.05)。与对照组相比,CFA增加同侧机械刺激敏感性(P < 0.05);与CFA组相比,ANA-12增加同侧缩足阈值(P < 0.05)。与对照组相比,BDNF和CFA增加磷酸化TrkB(Y705)水平(P < 0.05);与BDNF或CFA组相比,ANA-12降低TrkB(Y705)磷酸化水平(P < 0.05)。与对照组相比,BDNF和CFA上调Iba1、TNF-α以及炎症因子表达(P < 0.05);与BDNF或CFA组相比,ANA-12降低Iba1、TNF-α以及炎症因子表达水平(P < 0.05)。
结论
ANA-12靶向阻断BDNF/TrkB信号可降低脊髓炎症并缓解急性痛和慢性痛。
Keywords: 病理性疼痛, 脑源性神经营养因子, 原肌球蛋白受体激酶B, 小胶质细胞, TNF-α
Abstract
Objective
To investigate the inhibitory effect of ANA-12 that blocks brain-derived neurotrophic factor (BDNF)/ tropomyosin receptor kinase B (TrkB) signaling on inflammatory pain in rats and explore the underlying mechanism.
Methods
Forty-two adult SD rats were randomized into BDNF-induced acute pain group (n=24) and CFA-induced chronic pain group. The former group were randomly divided into 4 subgroups, including a control group, ANA-12 treatment group, BDNF treatment group, and BDNF+ANA-12 treatment group; the latter group were subgrouped into control group, CFA treatment group (CFA) and CFA + ANA-12 treatment group. The effects of ANA-12 treatment on pain behaviors of the rats with BDNF-induced acute pain and CFA-induced chronic inflammatory pain were observed. Western blotting was used to examine TrkB signaling and expressions of microglia marker protein Iba1 and TNF-α in the spinal cord of the rats.
Results
BDNF injection into the subarachnoid space significantly increased the number of spontaneous paw withdrawal of the rats (P < 0.05), which was obviously reduced by ANA-12 treatment (P < 0.05). The rats with intraplantar injection of CFA, showed significantly increased ipsilateral mechanical stimulation sensitivity (P < 0.05), and ANA-12 treatment obviously increased the ipsilateral foot withdrawal threshold (P < 0.05). Treatment with either BDNF or CFA significantly increased the phosphorylation level of TrkB (Y705) in the spinal cord of the rats (P < 0.05), which was significantly lowered by ANA-12 treatment (P < 0.05). Treatment with BDNF and CFA both significantly up-regulated the expressions of Iba1 and TNF-α in the spinal cord (P < 0.05), but ANA-12 significantly reduced their expression levels (P < 0.05).
Conclusion
ANA-12 can reduce spinal cord inflammation and relieve acute and chronic pain in rats by targeted blocking of BDNF/TrkB signaling.
Keywords: pathological pain, brain-derived neurotrophic factor, tropomyosin receptor kinase B, microglia, tumor necrosis factor-α
脑源性神经营养因子(BDNF)通过与其高亲和力受体—原肌球蛋白受体激酶B(TrkB)相互作用行使其生物学功能,包括细胞分化以及神经发生等[1]。在脑中,BDNF具有多种生理功能,包括神经元的存活、新突触的形成、兴奋性和抑制性神经递质的调节以及突触可塑性的维持等[2]。除了上述生理功能之外,BDNF还参与痛觉的调控,BDNF的异常表达与痛觉行为表现相关[3]。BDNF在神经损伤或炎症相关的痛觉传导区域过度表达,即伤害性途径,主要分布区域包括背根神经节、三叉神经节、脊髓背角以及躯体感觉皮层[4-5]。BDNF的过度表达对于神经性疼痛和炎症痛的发展是必需的[6]。BDNF/TrkB信号在脊髓中枢敏化中的作用是痛觉维持的基础[7]。BDNF通过激活TkrB而建立慢性痛觉,鞘内注射TrkB受体阻断剂能够阻抑外源性BDNF引起的异常性疼痛[8]。研究显示,BDNF/TrkB信号的激活参与伤害信号传递的调控[9]。目前发现与BDNF/TrkB信号途径相关的分子途径和调节因子包括PAR2-NF-κB、P2X4R-TLR4 -p38信号以及BDNF转录调节因子CREB等[10]。在阐述痛觉敏感性增加的机制方面,多数研究聚焦于胶质细胞。在多种信号途径中,已明确P2X4R-TLR4-p38信号在特定细胞类型,即小胶质细胞中发挥调节作用;对于星形胶质细胞,主要涉及炎症反应及炎症因子的表达调节[11]。但目前对于小胶质细胞在骨癌痛相关的炎症反应中的作用及机制尚未完全明确。
在脊髓和脑中,各种受体系统的激活以及各种化合物的合成参与痛觉调控。脊髓小胶质细胞不仅参与了损伤引发的神经性疼痛的发生,并且也是维持超敏反应所必需的[12]。BDNF在神经病理性疼痛晚期介导小胶质细胞-神经元相互作用的信号分子。在疼痛晚期,中枢炎症反应明显减弱,小胶质细胞主要依赖营养因子BDNF来延长疼痛超敏反应[13]。目前研究主要通过调控BDNF/TrkB下游信号途径在胶质细胞的作用,抑制胶质细胞激活并减少炎症因子或神经营养因子的分泌,以达到改善动物痛觉行为的目的[6]。
BDNF的异常过度表达与动物的痛觉行为表现密切相关,相关研究表明ANA-12可下调BDNF参与/诱导的神经炎症以及病理性疼痛[14];此外,ANA-12还参与慢性疼痛状态维持的调控[15]。上述研究表明,ANA-12可通过抑制BDNF/TrkB信号参与多种痛觉行为的调控,但目前关于ANA-12在痛觉调控中的内在分子机制尚未明确。因此,为探究ANA-12在急性疼痛及慢性疼痛中的作用,小胶质细胞激活与动物痛觉行为的关系,本研究采用鞘内给药TrkB受体拮抗剂ANA-12靶向阻断BDNF/TrkB信号,进而分析BDNF/TrkB信号活性、小胶质细胞的激活状态以及炎症因子的表达情况,明确BDNF/TrkB信号在病理性疼痛中的作用及机制。
1. 材料和方法
1.1. 实验动物及分组
本实验使用42只雄性Sprague-Dawley(SD)大鼠(湖北省实验动物中心),体质量180~200 g,6~8周龄。大鼠饲养在室温为22±2 ℃的环境中,以12/12 h昼夜节律变换并提供充足的水和食物。将大鼠随机分为两大组,BDNF处理组(4小组,6只/组):包括对照组(control)、ANA-12处理组(ANA-12)、BDNF处理组(BDNF)以及BDNF和ANA-12联合处理组(BDNF+ANA-12);炎症痛模型组(3小组,6只/组):包括对照组(control)、CFA处理组(CFA)以及CFA和ANA-12联合处理组(CFA+ANA-12)。本研究所有动物实验均经湖北科技学院实验动物伦理委员会批准(2020-01-900)。
1.2. 主要试剂
蛋白酶抑制剂、Radio Immunoprecipitation Assay裂解液、SDS-PAGE凝胶快速配制试剂盒、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);BDNF(北京义翘神州科技股份有限公司);ANA-12(Selleck);完全弗氏佐剂(CFA)(Sigma-Aldrich)。本实验所用Ⅰ抗如下:anti-BDNF(A4873)、anti-TrkB(A19832)、phospho-TrkB-Y705(AP0423)、anti-Iba1(A1527)和anti-TNF-α(A0277)(武汉爱博泰克生物科技有限公司)。所用Ⅱ抗为HRP标记山羊抗兔IgG(武汉爱博泰克生物科技有限公司)。
1.3. 模型建立及分组处理
BDNF-急性痛大鼠模型:大鼠随机分为对照组(control)和模型组。首先大鼠背部注射部位进行剃毛和皮肤消毒处理,然后用无菌微量注射器于L5和L6脊椎棘突间隙垂直进针,进入蛛网膜下腔,将注射器缓慢倾斜45°方向。模型组大鼠注入10 ng/10 μL BDNF溶液,对照组大鼠注射相同体积(10 μL)的生理盐水。给药处理如下:模型组大鼠随机分为溶剂对照组(BDNF)和ANA-12给药组(BDNF+ANA-12)。BDNF注入30 min后,溶剂对照组鞘内注射10 μL体积的DMSO+生理盐水(体积比1∶1),ANA-12组注射200 μg/10 μL体积的ANA-12溶液。
CFA-慢性炎症痛大鼠模型:大鼠随机分为对照组(control)和模型组。模型组大鼠采用水合氯醛麻醉,将CFA按1∶1的比例与生理盐水混匀为悬浊液,将该悬浊液皮下注入大鼠左后肢足底,使其局部产生红肿热痛等炎性反应。对照组注射相同剂量的生理盐水。给药处理:模型组大鼠随机分为溶剂对照组(CFA)和ANA-12给药组(CFA+ANA-12)。CFA模型构建7 d后,溶剂对照组鞘内注射10 μL体积DMSO+生理盐水(体积比1∶1),ANA-12组注射200 μg/10 μL体积的ANA-12溶液。
1.4. 大鼠自发性缩足反射次数记录
将大鼠置于30 cm×30 cm×30 cm的透明有机玻璃盒内,实验平台高50 cm。实验过程中保持环境安静。实验开始前,将大鼠放入玻璃盒中适应30 min,观察并记录每5 min内大鼠自发性缩足(或舔爪)反射次数,记录3次,5 min/次。脊髓鞘内注射BDNF后,将大鼠放回盒内适应30 min后,记录每5 min内缩足(或舔爪)次数,记录3次。继续鞘内注射溶剂或ANA-12溶液,放回盒内适应30 min后,记录每5 min内缩足(或舔爪)次数,记录3次。
1.5. 50%缩足阈值(PWT)检测
各组大鼠给药处理后0、2、4和6 h,根据up-down法检测50%PWT。方法如下:将动物放置于行为测试笼内,待大鼠适应30 min后,用Von Frey纤维(0.4~26 g)垂直剌激大鼠左侧后肢足底正中,持续时间≤5 s,出现舔足或者抬足等行为视为阳性反应,反之则为阴性反应。记录6次数据后结束检测。根据公式50%PWT(g)=(10[Xf+Kδ])/10000计算各组大鼠的缩足阈值。(Xf为本次行为学测试中使用的最后一个Von Frey纤维的阶数,K为痛觉阈矫正系数,δ为相邻不同纤维刺激之间的差异[9]。)
1.6. 免疫印迹法检测脊髓组织蛋白质表达
行为学记录结束后,给予过量麻醉剂处死大鼠,分离脊髓组织于预冷的PBS中,取腰段脊髓置于含有蛋白酶抑制剂的RIPA裂解液中在冰上进行组织匀浆。收集组织匀浆液于离心管中,4 ℃条件下12 000 r/min离心15 min后取上清,加入1/3体积的4×上样缓冲液,沸水中加热10 min变性。样品的蛋白质浓度用BCA蛋白分析试剂盒进行检测。SDS-PAGE电泳分离蛋白质样品,将蛋白质电转至PVDF膜上,5%脱脂奶粉室温封闭l h,Ⅰ抗4 ℃孵育过夜。所用Ⅰ抗及比例如下:anti-BDNF(1∶500)、anti-TrkB(1∶500)、phospho-TrkB-Y705(1∶ 500)、anti-Iba1(1∶500)和anti-TNF-α(1∶500)。Ⅰ抗孵育之后,洗膜3次,并用Ⅱ抗室温孵育1 h,然后用LAS500凝胶成像系统扫描观察,ImageJ软件分析条带灰度值。
1.7. 统计学方法
采用SPSS 26.0软件进行统计学分析。行为学数据资料以均数±标准误表示,免疫印迹数据资料以均数±标准差表示。组间比较采用单因素方差分析,P < 0.05为差异具有统计学意义。
2. 结果
2.1. BDNF/TrkB信号活性抑制缓解大鼠BDNF-急性痛
与对照组相比,BDNF处理后缩足次数上升(P < 0.05)。进一步进行鞘内给药ANA-12并记录大鼠自发性缩足(或舔爪)反射次数,结果显示,与BDNF组大鼠相比,ANA-12处理降低大鼠自发缩足次数(P < 0.05)。ANA-12处理对正常大鼠的行为学影响无统计学意义(P > 0.05,图 1)。
图 1.
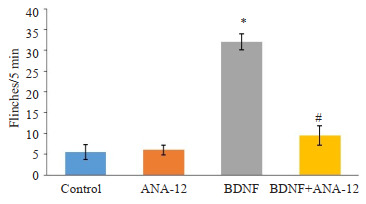
ANA-12有效缓解BDNF诱导的急性痛
ANA-12 effectively relieves BDNF-induced acute pain in rats (Mean ± SE, n=6). *P < 0.05 vs Control group; #P < 0.05 vs BDNF group.
2.2. BDNF/TrkB信号活性抑制缓解大鼠CFA-慢性炎症痛
通过足底注射CFA建立炎症疼痛大鼠模型。注射CFA导致大鼠同侧后爪对机械刺激的敏感性增加,痛觉阈值降低(P < 0.05)。与CFA组比,ANA-12处理2、4、6 h后,大鼠缩足阈值升高(P < 0.05,图 2A)。CFA处理对大鼠对侧后爪的影响无统计学意义,机械痛阈值在ANA-12处理前后的差异也无统计学意义(P > 0.05,图 2B)。
图 2.
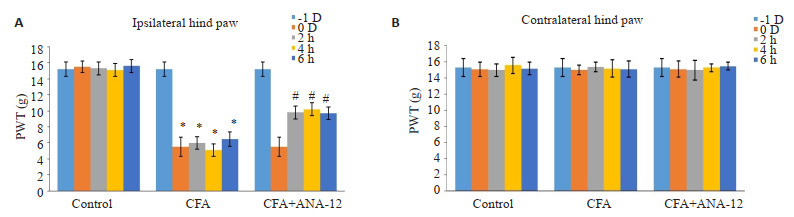
ANA-12降低CFA诱导的炎性痛
ANA-12 reduces CFA-induced inflammatory pain in rats (Mean±SE, n=6). *P < 0.05 vs Control group; #P < 0.05 vs CFA group.
2.3. ANA-12鞘内给药阻断BDNF/TrkB信号
BDNF与TrkB的细胞外结构域结合,诱导受体二聚化,导致细胞内结构域内的酪氨酸(Y705)激酶活性和自磷酸化增加,依次触发下游信号通路的激活。通过检测TrkB在Y705位点的磷酸化水平以表征其活性变化情况。蛋白质免疫印迹结果显示,BDNF和CFA处理均诱导脊髓组织中磷酸化TrkB(Y705)水平增加(P < 0.05);经ANA-12处理后BDNF或CFA组TrkB(Y705)磷酸化水平降低(P < 0.05,图 3)。
图 3.
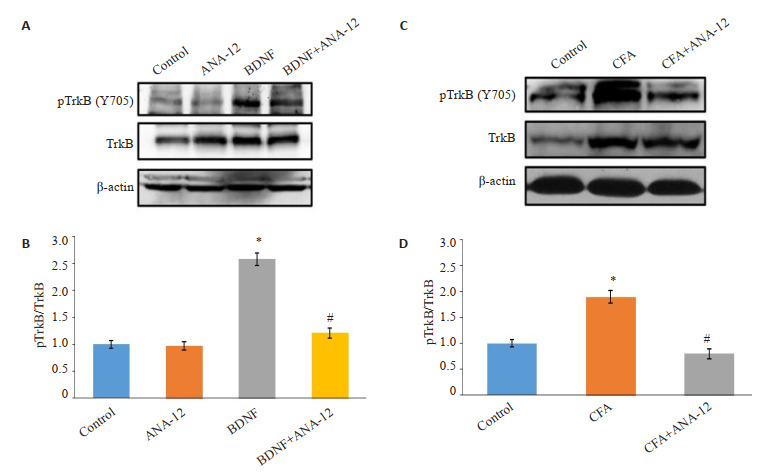
ANA-12处理阻断脊髓组织中BDNF/TrkB信号
ANA-12 treatment blocks BDNF/TrkB signaling in the spinal cord of rats (Mean ± SD, n=3). *P < 0.05 vsControl group; #P < 0.05 vs BDNF or CFA group.
2.4. BDNF/TrkB信号活性抑制减轻脊髓小胶质细胞活化并抑制脊髓炎症
免疫印迹分析显示BDNF和CFA诱导脊髓组织中小胶质细胞的特异性标记物Iba1和促炎细胞因子TNF-α表达上调(P < 0.05,图 4),同时炎症小体NLRP3和caspase-1以及炎症组分IL-1β表达增加(P < 0.05)。ANA-12处理后,Iba1、TNF-α、IL-β、NLRP3和caspase-1表达水平下降(P < 0.05,图 5)。
图 4.
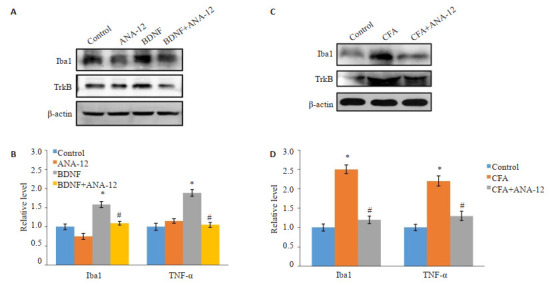
ANA-12处理降低脊髓中小胶质细胞的激活和炎症信号上调
ANA-12 treatment reduces activation of microglia and up-regulation of TNF-α in the spinal cord of rats (Mean±SD, n=3). *P < 0.05 vs Control group; #P < 0.05 vs BDNF or CFA group.
图 5.
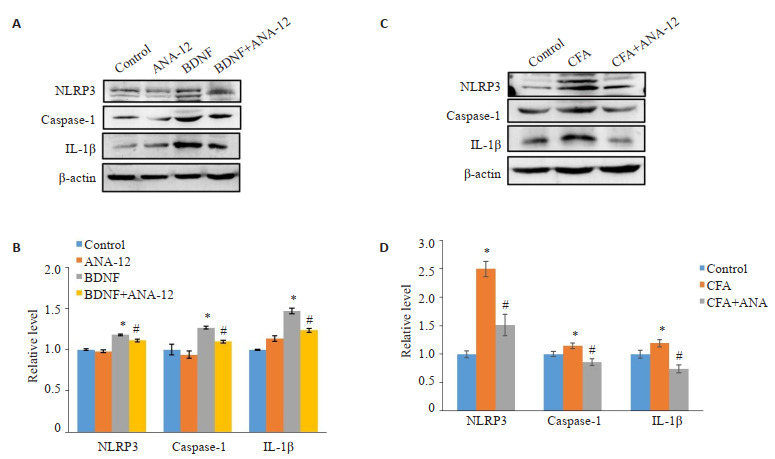
炎症小体组分及炎症因子的表达
ANA-12 lowers BNDF- or CFA- induced up- regulation of inflammatory factors and components of inflammasomes in the spinal cord of the rats (Mean±SD, n=3). *P < 0.05 vs Control group; #P < 0.05 vs BDNF or CFA group.
3. 讨论
疼痛刺激以外周痛觉感受器的激活以及将“痛觉信号”传递到躯体感觉皮层为主要特征“,痛觉信号”传递需要至少3种不同类型的神经元[16]。BDNF是痛觉信息传递中的重要神经调质,BDNF参与了痛觉途径的初始敏化,在损伤的早期阶段的增加可能是适应性;然而,BDNF的持续释放会触发一种“不适应的”和有害的影响,从而维持或导致慢性疼痛[17]。本研究运用BDNF和CFA处理建立动物痛觉模型,从而探究其中BDNF信号在动物痛觉行为调控中的作用及机制。
BDNF在痛觉传导通路中的异常过度表达与动物痛觉行为表现呈正相关性。在外周炎症中,BDNF在DRG神经元水平的增加与脊髓背角释放增加相关,表明BDNF信号在炎症性疼痛中发挥调节作用[18]。本研究中,BDNF鞘内给药处理可显著诱导正常大鼠(即对照组大鼠)痛觉敏感性增加,表现为痛觉过敏。另外,本研究在BDNF和CFA-诱导的痛觉模型中均观察到TrkB信号的表达和活性均上调,而ANA-12处理可下调TrkB受体的表达及活性且降低动物的痛觉敏感性。这表明抑制痛觉传导通路中的BDNF-TrkB信号的活性可改善动物的痛觉行为。
神经胶质细胞,包括小胶质细胞和星形胶质细胞以及它们的相互作用参与神经炎症过程的调控。小胶质细胞被认为是神经炎症反应的主要来源,星形胶质细胞可以被小胶质细胞通过补体级联反应激活并进一步引起神经毒性,因此,星形胶质细胞的激活也被认为是神经炎症的一个重要调控因素[19]。生理状态下小胶质细胞处于静息态,感知和监测周围环境的变化,这使小胶质细胞能够有效地控制微环境,清除积累的代谢产物和恶化的组织成分;外周神经损伤后,脊髓中小胶质细胞活化,大量合成释放诸多疼痛因子(白介素-6、肿瘤坏死因子、γ-干扰素、BDNF等)参与神经病理性疼痛的发生及维持[20-21]。有炎症脊髓水平研究显示,CFA诱导的动物模型中,BDNF和促炎细胞因子TNF-α、IL-1β、IL-6的表达均上调[22]。本研究中,脊髓组织蛋白质水平分析表明BDNF和CFA处理均可激活小胶质细胞,上调NLRP3炎症小体的表达,同时增加炎症因子的表达。结合上述研究提示,不论在正常动物还是炎症痛模型动物中,BDNF的过度表达均参与痛觉的诱导、形成和维持过程。BDNF可通过激活多种信号通路参与小胶质细胞介导的炎症性疼痛反应。BDNF可诱导脊髓小胶质细胞中PI3K和ERK的激活,该效应是神经性疼痛发展的基础[23]。另外,BDNF调节PKCλ和PKMζ的形成以及PKMζ的磷酸化,BDNF/aPKC信号形成了维持集中慢性疼痛状态所需的信号轴[15]。提示本研究中BDNF和CFA诱导的痛觉模型中,小胶质细胞的激活以及炎症因子的表达可能由上述激酶途径介导。BDNF通过与其高亲和力受体TrkB结合介导并激活下游信号通路参与疼痛调节,TrkB抑制剂可显著下调痛觉模型动物的痛觉敏感性并改善痛觉行为[24]。本实验通过对已经存在神经病理性疼痛的大鼠鞘内应用ANA-12,有效的拮抗脊髓背角BDNF/TrkB信号的过度激活,即TrkB活性位点(Y705)磷酸化水平下调,大鼠痛觉过敏症状得到改善,进一步说明,BDNF在疼痛维持过程中起重要作用以及ANA-12的镇痛作用。
综上所述,BDNF/TrkB信号调节脊髓痛觉信息传递,TrkB受体拮抗剂ANA-12下调BDNF/TrkB信号从而抑制脊髓小胶质细胞的激活并下调炎症因子的表达水平,进而缓解动物痛觉,发挥镇痛作用。本研究作用于痛觉信号的源头BDNF/ TrkB,探究小胶质细胞与炎症信号的相关性在痛觉行为学中的调节作用及机制,为相关疾病治疗靶标的选择提供了新的方向,但具体的分子机制还有待深入研究。
Biographies
赵佳佳,在读硕士研究生,E-mail: 1396904895@qq.com
杨荷雨,在读硕士研究生,E-mail: 1510099171@qq.com
Funding Statement
国家自然科学基金(81901149);湖北科技学院校级团队项目(2020TD02);湖北省教育厅项目(Q20192807)
Supported by National Natural Science Foundation of China (81901149)
Contributor Information
赵 佳佳 (Jiajia ZHAO), Email: 1396904895@qq.com.
杨 荷雨 (Heyu YANG), Email: 1510099171@qq.com.
谢 敏 (Min XIE), Email: mmtmrxm@sina.com.
References
- 1.Numakawa T, Odaka H. Brain-derived neurotrophic factor signaling in the pathophysiology of Alzheimer's disease: beneficial effects of flavonoids for neuroprotection. Int J Mol Sci. 2021;22(11):5719–27. doi: 10.3390/ijms22115719. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Lima Giacobbo B, Doorduin J, Klein HC, et al. Brain-derived neurotrophic factor in brain disorders: focus on neuroinflammation. Mol Neurobiol. 2019;56(5):3295–312. doi: 10.1007/s12035-018-1283-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Liu SM. Neurotrophic factors in enteric physiology and pathophysiology. Neurogastroenterol Motil. 2018;30(10):e13446-57. doi: 10.1111/nmo.13446. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Lu B, Nagappan G, Lu Y. BDNF and synaptic plasticity, cognitive function, and dysfunction. Handb Exp Pharmacol. 2014;220:223–50. doi: 10.1007/978-3-642-45106-5_9. [DOI] [PubMed] [Google Scholar]
- 5.Lin YT, Ro LS, Wang HL, et al. Up-regulation of dorsal root Ganglia BDNF and trkB receptor in inflammatory pain: an in vivo and in vitro study. J Neuroinflammation. 2011;8:126–37. doi: 10.1186/1742-2094-8-126. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Coull JAM, Beggs S, Boudreau D, et al. BDNF from microglia causes the shift in neuronal anion gradient underlying neuropathic pain. Nature. 2005;438(7070):1017–21. doi: 10.1038/nature04223. [DOI] [PubMed] [Google Scholar]
- 7.Duan B, Liu DS, Huang Y, et al. PI3-kinase/Akt pathway-regulated membrane insertion of acid-sensing ion channel 1a underlies BDNF-induced pain hypersensitivity. J Neurosci. 2012;32(18):6351–63. doi: 10.1523/JNEUROSCI.4479-11.2012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Yajima Y, Narita M, Usui A, et al. Direct evidence for the involvement of brain-derived neurotrophic factor in the development of a neuropathic pain-like state in mice. J Neurochem. 2005;93(3):584–94. doi: 10.1111/j.1471-4159.2005.03045.x. [DOI] [PubMed] [Google Scholar]
- 9.Maynard KR, Hobbs JW, Phan BN, et al. BDNF-TrkB signaling in oxytocin neurons contributes to maternal behavior. eLife. 2018;7:e33676-82. doi: 10.7554/eLife.33676. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Liang Y, Liu Y, Hou BL, et al. CREB-regulated transcription coactivator 1 enhances CREB-dependent gene expression in spinal cord to maintain the bone cancer pain in mice. Mol Pain. 2016;12:641679–90. doi: 10.1177/1744806916641679. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.黄 河灵, 高 玉元, 聂 坤, et al. 巨噬细胞移动抑制因子介导MPP+/MPTP诱导的小胶质细胞NLRP3炎症小体的激活. 南方医科大学学报. 2021;41(7):972–9. doi: 10.12122/j.issn.1673-4254.2021.07.02. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Colombo E, Farina C. Astrocytes: key regulators of neuroinflammation. Trends Immunol. 2016;37(9):608–20. doi: 10.1016/j.it.2016.06.006. [DOI] [PubMed] [Google Scholar]
- 13.Echeverry S, Shi XQ, Yang M, et al. Spinal microglia are required for long-term maintenance of neuropathic pain. Pain. 2017;158(9):1792–801. doi: 10.1097/j.pain.0000000000000982. [DOI] [PubMed] [Google Scholar]
- 14.Ding HL, Chen JL, Su MZ, et al. BDNF promotes activation of astrocytes and microglia contributing to neuroinflammation and mechanical allodynia in cyclophosphamide-induced cystitis. J Neuroinflammation. 2020;17(1):19. doi: 10.1186/s12974-020-1704-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Tillu DV, Hassler SN, Burgos-Vega CC, et al. Protease-activated receptor 2 activation is sufficient to induce the transition to a chronic pain state. Pain. 2015;156(5):859–67. doi: 10.1097/j.pain.0000000000000125. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Merighi A, Salio C, Ghirri A, et al. BDNF as a pain modulator. Prog Neurobiol. 2008;85(3):297–317. doi: 10.1016/j.pneurobio.2008.04.004. [DOI] [PubMed] [Google Scholar]
- 17.Cappoli N, Tabolacci E, Aceto P, et al. The emerging role of the BDNF-TrkB signaling pathway in the modulation of pain perception. J Neuroimmunol. 2020;349:577406–16. doi: 10.1016/j.jneuroim.2020.577406. [DOI] [PubMed] [Google Scholar]
- 18.Verrills P, Mitchell B, Vivian D, et al. Dorsal root ganglion stimulation is paresthesia-independent: a retrospective study. Neuromodulation. 2019;22(8):937–42. doi: 10.1111/ner.12921. [DOI] [PubMed] [Google Scholar]
- 19.Liu Y, Fu H, Wang T. Neuroinflammation in perioperative neurocognitive disorders: from bench to the bedside. CNS Neurosci Ther. 2022;126:3105–17. doi: 10.1111/cns.13794. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Prinz M, Jung S, Priller J. Microglia biology: one century of evolving concepts. Cell. 2019;179(2):292–311. doi: 10.1016/j.cell.2019.08.053. [DOI] [PubMed] [Google Scholar]
- 21.Xu XR, Fu SX, Shi XM, et al. Microglial BDNF, PI3K, and p-ERK in the spinal cord are suppressed by pulsed radiofrequency on dorsal root ganglion to ease SNI-induced neuropathic pain in rats. Pain Res Manag. 2019;2019:5948686–98. doi: 10.1155/2019/5948686. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Xu F, Yang J, Lu F, et al. Fast green FCF alleviates pain hypersensitivity and down-regulates the levels of spinal P2X4 expression and pro-inflammatory cytokines in a rodent inflammatory pain model. Front Pharmacol. 2018;9:534–40. doi: 10.3389/fphar.2018.00534. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Xu L, He D, Bai Y. Microglia-mediated inflammation and neurodegenerative disease. Mol Neurobiol. 2016;53(10):6709–15. doi: 10.1007/s12035-015-9593-4. [DOI] [PubMed] [Google Scholar]
- 24.Jin W. Regulation of BDNF-TrkB signaling and potential therapeutic strategies for Parkinson's disease. J Clin Med. 2020;9(1):257–65. doi: 10.3390/jcm9010257. [DOI] [PMC free article] [PubMed] [Google Scholar]


