Abstract
目的
探索二氢杨梅素对SKBR3细胞miR-98-5p表达影响及在赫赛汀耐药发生中的机制。
方法
通过TargetScan在线数据库对IGF2和miR-98在乳腺癌中的表达及相互作用进行生信分析。细胞实验培养SKBR3细胞并构建耐曲妥珠单抗的SKBR3-R细胞和裸鼠异种移植瘤模型,免疫印迹法和免疫组化法检测细胞和组织内关键信号蛋白表达及其磷酸化水平。shRNA慢病毒载体构建转染细胞系,RT-qPCR检测细胞内RNA表达水平,MTS法检测细胞增殖,Transwell法检测细胞侵袭。荧光素酶实验验证RNA间的相互作用,免疫共沉淀法分析IGF-1R/HER2异源二聚体含量。
结果
在SKBR3-R细胞中IGF2、p-IGF1R、p-Akt、p-S6K水平高于SKBR3细胞,而PTEN蛋白表达正好相反(P < 0.05);SKBR3-R细胞中IGF1R/HER2异源二聚体含量升高(P < 0.01);转染miR-98-5p的SKBR3-R细胞内IGF2 mRNA表达水平变化无统计学意义(P > 0.05),但IGF2表达水平降低,细胞侵袭能力降低(P < 0.05);经二氢杨梅素饲养后耐药裸鼠肿瘤组织中miR-98-5p表达上调,IGF2表达下降,对赫赛汀敏感性升高(P < 0.05)。
结论
二氢杨梅素通过诱导SKBR3-R细胞内miR-98-5p表达,使其结合IGF2 mRNA降低IGF2水平,进一步抑制IGF-1R/HER2异源二聚体形成,从而逆转细胞对赫赛汀耐药。
Keywords: 二氢杨梅素, miR-98-5p, 异源二聚体, 乳腺癌, 耐药, 赫赛汀
Abstract
Objective
To explore the effect of dihydromyricetin on the expression of miR-98-5p and its mechanism in the development of Herceptin resistance in SKBR3 cells.
Methods
The expression of IGF2 and miR-98-5p and their interaction relationship were analyzed by bioinformatics analysis through TargetScan online databases. SKBR3 cells and drug-resistant SKBR3-R cells were cultured in cell experiments. Xenograft tumor mice were constructed by SKBR3 and SKBR3-R cells. Proteins were detected by western blotting and immunohistochemistry. Transfected cells were constructed by shRNA lentivirus vectors. RT-QPCR was used to detect RNA. Cell proliferation was detected by MTS method. Cell jnvasion was detected by Transwell assay. Luciferase reporting assays were used to verify RNA interactions. IGF-1R/HER2 heterodimer was determined by immunocoprecipitation.
Results
The expression of IGF2, p-IGF1R, p-Akt and p-S6K in SKBR3-R cells were significantly higher than those in SKBR3 cells, while the expression of PTEN protein was lower in SKBR3-R cells (P < 0.05). IGF1R/HER2 heterodimer in SKBR3-R cells was significantly increased (P < 0.01).The expression of IGF2 and invasion ability were significantly reduced while transfected with miR-98-5p in SKBR3-R cells (P < 0.05), but the IGF2 mRNA were no difference in both cells (P > 0.05). The expression of miR-98-5p was up-regulated and IGF2 was decreased in drug-resistant xenograft tumor mice after feeding with dihydromyricetin, and the tumor became more sensitivity to Herceptin (P < 0.05).
Conclusion
Dihydromyricetin could induce the expression of miR-98-5p, which binds to IGF2 mRNA to reduce IGF2 expression, inhibit the IGF-1R/HER2 formation, thereby reversing cell resistance to Herceptin in SKBR3-R cells.
Keywords: dihydromyricetin, miR-98-5p, heterodimer, breast cancer, drug resistance, Herceptin
人表皮生长因子受体2(HER2)阳性乳腺癌约占新发乳腺癌比例的20%~25%,早期研究发现其与预后不良相关[1]。人源化抗HER2单克隆抗体赫赛汀,是一种有效的抗HER2靶向药物,极大地提高了HER2阳性乳腺癌患者的生存率,已被写入诊疗指南[2]。然而,并不是所有HER2阳性乳腺癌患者对赫赛汀的治疗都有良好反应,临床研究发现原发性及获得性赫赛汀耐药占30% ~50%[3],失去有效治疗后的部分患者最终发生肿瘤复发和远处转移,占乳腺癌死亡的90%[4]。因此,赫赛汀耐药成为HER2阳性乳腺癌临床治疗的一个重大障碍。迄今为止,依然缺乏有效预测赫赛汀疗效的生物标志物以及克服耐药的方法。
我们前期研究发现,赫赛汀耐药细胞中胰岛素样表皮生长因子1受体(IGF1-R)下游信号通路IGF1R/AKT异常激活,天然黄酮类化合物二氢杨梅素(DMY)可抑制此通路激活,逆转SKBR3乳腺癌细胞对赫赛汀耐药[5]。胰岛素样生长因子2(IGF2)是IGF1-R的内源性配体,IGF2与IGF-1R特异性结合后,磷酸化特异性胞内信号蛋白—胰岛素受体底物1(IRS1),激活下游的丝裂原激活的蛋白激酶和磷酯酰肌醇3激酶/蛋白激酶B(PI3K/ Akt)信号转导,进而调节细胞的生长增殖及侵袭转移。miR-98-5p是一种小分子非编码MicroRNA,通过生物信息学数据库TargetScan预测其可靶向结合IGF2 mRNA 3'UTR,而目前对于miR-98-5p通过靶向调控IGF2表达影响HER2阳性乳腺癌细胞对赫赛汀的敏感性,尚未见报道。
本研究通过细胞实验验证miR-98-5p/IGF2轴对赫赛汀敏感性的影响,然后建立裸鼠异种移植肿瘤模型,进一步探索二氢杨梅素对miR-98-5p/IGF2调控轴的影响,以及在体内逆转赫赛汀耐药性的可能机制。为临床提高HER2阳性乳腺癌赫赛汀治疗的疗效提供新思路,现报道如下。
1. 材料和方法
1.1. 试剂和细胞
重组人IGF2(R & D Systems,Minneapolis,MN,USA)。Western blot检测中使用的主要抗体:IGF2、IRS1、IGF- 1R、p-IGF-1R(Tyr1131)/IR (Tyr1146)、Akt、p-Akt(Thr308)、p-Akt(Ser473)、S6K、p-S6K(Thr389)、HER2、β-actin(Cell Signaling Technology,Danvers,MA,USA)。实验所用的所有引物均采用Primer3 input设计,南京金斯瑞公司合成。人HER2阳性乳腺癌细胞系SKBR3(ATCC,Manassas,VA),保存在含10%胎牛血清的DMEM培养基中(Invitrogen,Carlsbad,CA,USA)。耐药细胞株的培养和鉴定参见本研究组既往研究文献[5]。
1.2. 异种移植肿瘤模型建立
动物实验获得蚌埠医学院动物保护与使用委员会(IACUC)批准(批准文号:[2020]No.203)。按照IACUC协议遵循标准的动物饲养和实验室指南。小鼠被饲养在单独通风的笼子中,在标准室温(22 ℃)和湿度(55%)下,光照/黑暗周期为12/12。将肿瘤细胞接种于Balb/C裸鼠(购自蚌埠医学院实验动物中心)腋窝皮下,产生异种移植瘤。当肿瘤大小达到100 mm3时,将小鼠随机分为:实验组:二氢杨梅素灌胃(DMY 25 mg·g-1·d)+腹腔注射赫赛汀(100 μg·g-1·w);对照组:腹腔注射赫赛汀(100 μg·g-1·w);空白组:腹腔注射PBS;n=5/组。治疗共6周,每7 d游标卡尺测量一次肿瘤大小,计算肿瘤体积[6]。
1.3. 细胞转染
用含有特异性shRNA的psi-LVRU6GP载体转染细胞(慢病毒转染),并用嘌呤霉素(2 μg/mL)筛选,以建立基因敲除或过表达的转染物。分别使用Lipofectamin 3000(Invitrogen,Carlsbad,CA,USA)转染miRNA模拟物或抑制剂(Ribobio)。
1.4. 免疫印迹
RIPA缓冲液从细胞中提取总蛋白。BCA蛋白测定试剂盒测定蛋白浓度。将等量的蛋白质与5×Lane Marker还原样品缓冲液混合,用SDS聚丙烯酰胺凝胶溶解,然后转移到Immobilon-P转移膜(Millipore,Burlington Mass,USA)上。用5%的脱脂牛奶在Tris缓冲盐水中封闭细胞膜,然后用一抗和二抗孵育。采用增强化学发光Western blot检测试剂盒检测信号。用ImageJ软件(v2.0.0)对信号进行密度分析。
1.5. 总RNA和miRNA的分离和RT-qPCR
RNA分离试剂盒(QIAGEN,Hilden,Germany)按照说明书从细胞中分离出总RNA。RT-qPCR采用CFX96 Real- Time PCR系统(Foster City,California,USA)。采用β-actin作为内参。从培养的细胞中分离出miRNAs,并用miRCURY RNA Isolation Kit(Exiqon, Vedbaek, Denmark)纯化。miRNA序列特异性RT-PCR引物和内源对照RNU6购自GeneCopoeia。通过RNU6归一化计算相对定量表达。
1.6. 细胞增殖及侵袭实验
使用CellTiter 96® AQueous One Solution细胞增殖检测试剂盒(Promega,Madison,WI,USA)进行细胞增殖(MTS)检测。用不同浓度的赫赛汀,以2000/孔(0.20 mL/孔)的浓度将细胞接种到96孔板上。MTS孵育第2天测定细胞活力(0.02 mL/孔)。孵育2 h后,在BioTek Synergy 2系统上记录各孔在490 nm处的吸光度A490 nm,用以代表细胞活力,并计算各时间点的细胞活力。取处于对数生长期细胞,经过消化、离心、PB5S清洗和无血清培养基重悬。取待测细胞悬液加入Transwell小室,1×104/孔,×24孔板,37 ℃、5%CO2培养箱过夜。取出弃去培养液,PBS清洗2遍,4%甲醛固定过夜。0.1%结晶紫染色30 min,棉签轻拭去上层细胞,PBS清洗3遍,显微镜拍照(×100),选取3~5个非重复视野,并进行计数。
1.7. 荧光素酶报告实验
将IGF2 mRNA 3'UTR的基因序列克隆到萤火虫荧光素酶报告基因下游的pMir-Report质粒中。将细胞接种到96孔板上,用pMir-Report荧光素酶载体共转染。转染48 h后,使用BioTek Synergy 2上的双荧光素酶报告基因检测系统(Promega)测定荧光素酶活性。以Renilla荧光素酶活性作为内对照,以Renilla荧光素酶活性归一化后的SD平均值计算萤火虫荧光素酶活性。
1.8. 免疫共沉淀
免疫沉淀在4 ℃下用特异性Ab或IgG进行过夜(阴性对照)。用蛋白g-琼脂糖(Amersham Biosciences)孵育免疫沉淀2 h。反应产物用裂解缓冲液洗涤,免疫复合物用SDS-PAGE进行溶解,进行Western blot检测,采用β-actin作为内参。
1.9. 免疫组化
经福尔马林固定和石蜡包埋后的组织切成4 μm切片。在62 ℃干燥2 h后,在二甲苯中分离脱蜡,依次使用等浓度梯度的乙醇处理。经过抗原修复,然后用3%过氧化氢在甲醇中处理玻片15 min。采用0.01 mol/L环酸钠缓冲液(pH 6.0)微波提取抗原,以达到抑制内源性过氧化物酶活性的目的。在10%山羊血清中预孵育1 h后,将标本与一抗在4 ℃下孵育过夜。根据产品说明书,使用了辣根过氧化物酶检测系统(DAKO,Glostrup,Denmark)。阅片由两位高年资病理科医师独立完成。
1.10. 统计学分析
所有连续数据均符合正态分布,以均数±标准差表示。利用SPSS 19.0和GraphPad Prism 9进行统计分析和绘图,组间比较采用t检验,P < 0.05为差异有统计学意义。Kaplan-Meier plotter生成患者生存曲线(https://kmplot.com/analysis/index.php?p=service&cancer=breast)。
2. 结果
2.1. SKBR3及SKBR3-R细胞中IGF2表达及其介导的IGF-1R/IRS1/AKT信号通路激活
SKBR3-R细胞相较于SKBR3细胞,对赫赛汀的敏感性降低(P < 0.01),IC50值分别为220.53±12.21 μg/mL和23.52±2.02 μg/mL(图 1A)。
图 1.

SKBR3及SKBR3-R细胞中IGF2表达
IGF2 expression in SKBR3 and SKBR3-R cells. A: SKBR3- R cells were significantly resistant to Herceptin; B: Compared with SKBR3 cells, there was no significant difference in IGF2 mRNA level between SKBR3-R cells and SKBR3 cells, but the expression of IGF2 protein was significantly increased (****P < 0.001).
SKBR3及SKBR3-R细胞条件培养基(CM)内,IGF2 mRNA相对表达量差异无统计学意义(P=0.129);IGF2蛋白表达水平差异有统计学意义(22.52±3.79 ng/mL vs 101.12±11.26 ng/mL,P < 0.01,图 1B)。
Western blot检测发现,SKBR3及SKBR3-R细胞中蛋白相对含量p-IGF1R(0.20±0.10 vs 1.02±0.43,P < 0.01);p-Akt(S473)(0.32±0.12 vs 1.22±0.34,P < 0.01);p-S6K(0.50±0.15 vs 1.35±0.60,P < 0.05);PTEN(1.39±0.55 vs 0.60±0.14,P < 0.05)差异均有统计学意义(图 2)。
图 2.

SKBR3-R, SKBR3细胞内信号蛋白磷酸化水平及PTEN蛋白表达量
The phosphorylation level of signal protein and the expression of PTEN protein in SKBR3- R and SKBR3 cells. *P < 0.05, **P < 0.01.
2.2. IGF1-R/HER2异源二聚体形成
免疫沉淀法结果显示,SKBR3- R细胞CM中IGF1R/HER2异源二聚体与HER2含量比值高于SKBR3细胞[(70±12.30)% vs(17±1.95)%,P < 0.01,图 3)]。
图 3.

SKBR3-R、SKBR3细胞内IGF1-R/HER2异源二聚体含量
The IGF1-R/HER2 heterodimer in SKBR3-R and SKBR3 cells. ***P < 0.01.
2.3. miR-98-5p与IGF2靶向相互作用
检索生物信息学数据库TargetScan(http://www.targetscan.org/vert_72/),预测IGF2 mRNA的3'-UTR中许多具有保守结合位点的miRNAs。通过context scores和Pct对预测结果的可能性进行评分,其中miR-98-5p具有高靶向结合可能性(图 4)。荧光素酶报告实验发现,miR-98-5p inhibitor增强了SKBR3细胞中野生型报告基因的荧光素酶活性(P < 0.05),而不是突变结合位点型(P > 0.05)。miR-98-5p mimic抑制了SKBR3-R细胞中野生型报告基因的荧光素酶活性(P < 0.05),而不是的突变型的(P > 0.05,图 5)。
图 4.

miR-98-5p与IGF2 mRNA 3’UTR端存在相互作用
The interaction between miR- 98- 5p and IGF2 mRNA 3'UTR.
图 5.

miR-98-5p的抑制剂和模拟对野生型、突变型荧光素酶报告基因活性的影响
Affection of inhibitors and mimics of miR-98-5p in Wilder type and mutant luciferase reporter gene activity. *P < 0.05.
2.4. miR-98-5p靶向调控IGF2蛋白表达
SKBR3细胞中导入miR-98-5p inhibitor时,细胞内IGF2含量增加(P < 0.01);同样将SKBR3-R细胞中导入miR- 98- 5p mimic时,细胞内IGF2含量下降(P < 0.01,图 6)。
图 6.

miR-98-5p调控IGF2蛋白表达
The miR-98-5p regulates the IGF2 protein expression. IGF2 protein expression was significantly up-regulated by miR-98-5p inhibitors (***P < 0.01), miR-98-5p mimics significantly down-regulated IGF2 protein expression (**P < 0.01).
2.5. miR-98-5p对SKBR3细胞侵袭性的影响
SKBR3空白对照组侵袭细胞数为75.23±11.12,导入miR-98-5p mimic后侵袭细胞数21.89±7.23,差异有统计学意义(P < 0.01);导入miR- 98-5p inhibit后侵袭细胞数为98.91±9.52,差异有统计学意义(P < 0.05,图 7)。
图 7.

miR-98-5p对SKBR3细胞侵袭性影响
The invasive effect of miR-98-5p on SKBR3 cells. miR-98-5p inhibitor significantly promoted SKBR3 invasion (*P < 0.05), and miR-98-5p mimic significantly inhibited SKBR3 invasion (***P < 0.01).
2.6. 裸鼠异种移植肿瘤模型建立及相关分子表达
赫赛汀能抑制SKBR3细胞异种移植肿瘤的生长,但对SKBR3-R细胞异种移植肿瘤生长影响减小。第6周测量肿瘤最大径分别为5.5±1.7 mm和27.5±5.8 mm,差异具有统计学意义(P < 0.05,图 8)。达到实验终点后,切取肿瘤组织,免疫组化发现赫赛汀耐药肿瘤组织中IGF2、磷酸化IGF-1R(p-IGF1R)、Akt(p-Akt)、S6K(p-S6K)含量水平高于赫赛汀敏感肿瘤组织(图 9)。
图 8.

SKBR3-R细胞异种移植肿瘤对赫赛汀的敏感性显著降低
The sensitivity of SKBR3-R cell xenografts to Herceptin was significantly decreased (P < 0.05).
图 9.

相较于SKBR3,SKBR3-R细胞异种移植肿瘤组织内IGF2、p-IGF1R、p-Akt、p-S6K水平升高
The levels of IGF2, P-IGF1R, P-Akt and P-S6K in SKBR3-R cell xenograft tumor tissue were increased, compared with SKBR3. Scate bar: 50 μm.
2.7. 二氢杨梅素在体内增加SKBR3-R细胞异种移植瘤对赫赛汀敏感性
裸鼠移植肿瘤体积达到~100 mm3时,将小鼠随机分3组,第6周瘤体积达到最大,3组分别为213.3±10.6 mm3、605.5±8.8 mm3、689.3±20.3 mm3,差异有统计学意义(P < 0.05,图 10)。
图 10.

二氢杨梅素在体内增加SKBR3-R细胞异种移植瘤对赫赛汀敏感性
Dihydromyricetin increases the sensitivity of SkBR3- R xenografts to Herceptin in vivo (*P < 0.05).
2.8. 二氢杨梅素在体内通过miR-98-5p调节IGF2转录后表达水平
miR-98-5p在实验组相对表达量4.32±0.88、对照组1.19±0.25、空白组1.10±0.27,差异有统计学意义(P < 0.01)。IGF2 mRNA在3组相对表达量差异无统计学意义(P > 0.05)。IGF2蛋白表达量在实验组、对照组、空白组的差异有统计学意义(75.83±3.29 vs 208.3±12.11 vs 218.5±13.71,P < 0.01,图 11)。
图 11.
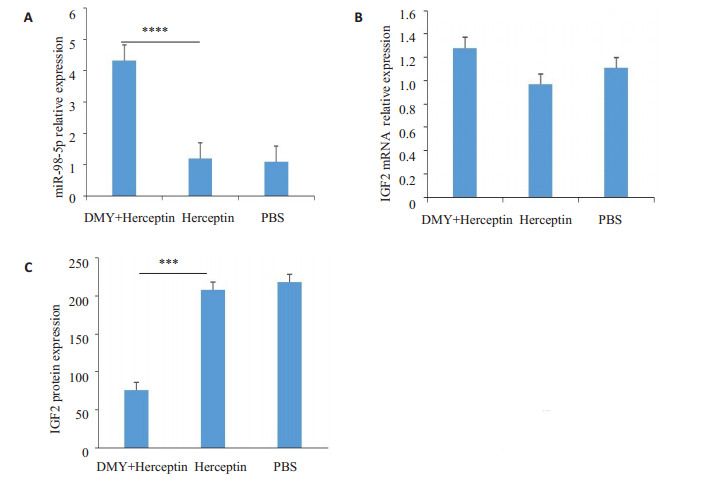
二氢杨梅素在体内通过miR-98-5p调节IGF2转录后表达水平
Dihydroarxin regulates post-transcriptional IGF2 expression levels in vivo through miR-98-5p. A: Dihydromyristine significantly up-regulated miR- 98- 5p levels in tumor tissues (****P < 0.01); B: Dihydromyricetin had no significant effect on IGF2 mRNA level in tumor tissue (P > 0.05); C: Dihydromyricetin significantly reduced the level of IGF2 protein in tumor tissue (***P < 0.01).
3. 讨论
HER2属于生长因子受体家族成员,其在乳腺癌中过表达是促进癌细胞侵袭增殖的重要因素,与患者的预后密切相关[7]。抗HER2靶向药物赫赛汀可有效阻滞HER2信号传导,起到抗肿瘤作用,HER2阳性乳腺癌患者的生存期得到显著提高,但是耐药患者的预后依然较差[8]。攻克耐药是临床面临的重大挑战。HER2的特殊性在于体内缺乏天然配体,受体通过与自身或者其他生长因子受体家族形成同源或异源二聚体,激活下游信号通路,如PI3K/AKT通路[9]。胰岛素样生长因子1受体(IGF-1R)信号通路的异常激活在赫赛汀耐药中的重要性已越来越受到重视[10, 11],寻找调控信号通路的特异性靶点来逆转赫赛汀耐药,是当前基础研究的热点[12, 13]。有研究发现,在HER2阳性人乳腺癌细胞中,IGF2/IGF-1R/IRS1信号被负反馈抑制,以维持基本的细胞生存和增殖[14]。当这种负反馈被打破后,IGF-1R可通过自身下游信号通路激活使细胞对赫赛汀敏感性降低。本研究证实了上述结论,我们进一步发现赫赛汀诱导耐药的SKBR3-R细胞中IGF-1R/HER2异源二聚体含量显著增多,细胞通过这种方式对赫赛汀产生耐药。有研究亦有报导,但没有分析二聚体形成的原因[15]。虽然IGF1R与HER2有着共同的AKT/mTOR下游信号通路,但IGF- 1R胞内区特有的信号分子胰岛素受体底物1(IRS1)是否激活是与HER2介导下游信号通路相鉴别的重要方法。研究表明,IRS1激活会通过AKT信号通路促进肿瘤生长[16]。IGF2/IGF-1R/IRS1信号通路还与恶性肿瘤细胞之间的黏附过程有关,对癌细胞表型维持以及抗肿瘤治疗耐药过程中起了重要作用[17]。本研究发现,随着IGF2水平的升高,SKBR3细胞的侵袭性显著增强,同时对赫赛汀敏感性显著降低。有研究亦发现IGF2水平升高促进乳腺癌细胞的转移[18]。本研究发现赫赛汀耐药乳腺癌细胞高表达IGF2,并且细胞膜内IRS1磷酸化水平显著升高。细胞内IGF2水平升高后,激活IGF1- R/HER2异源二聚体大量形成,并通过IGF1- R下游IRS1介导的信号通路旁路激活AKT/ mTOR,可能是导致SKBR3-R细胞对赫赛汀耐药的重要原因。
本研究发现,SKBR3- R细胞与SKBR3细胞内IGF2 mRNA水平并无显著差异,而IGF2蛋白含量在耐药细胞中却显著升高。提示很可能IGF2在mRNA转录后受到了调控。IGF2在肿瘤中表达水平受到上游基因调控在其他肿瘤中常有报道[19-21]。MicroRNA是生物体内最常见非编码RNA之一,它们的主要功能就是结合目标mRNA并调控转录。检索生物信息学数据库TargetScan(http://www.targetscan.org/vert_72/),预测IGF2 mRNA的3'-UTR中许多具有保守结合位点的miRNAs。Context scores和Pct对预测结果的可能性进行评分,其中miR-98-5p具有高靶向结合可能性。同时miR-98-5p也已被证实在多种癌症中均具有抑制肿瘤生长和转移的作用[22, 23],本研究进一步通过荧光素酶报告基因确定了miR-98-5p与IGF2存在靶向作用关系,表明miR-98-5p参与了IGF2的表达调控。本研究发现转染了miR-98-5p mimic的SKBR3细胞,IGF2蛋白表达下降,侵袭性显著降低,验证了miR-98-5p/IGF2调控轴在细胞侵袭中的重要作用。
在我们既往研究中发现,黄酮类天然化合物DMY有显著抑制乳腺癌细胞增殖的能力,可能的机制就是抑制PI3K/AKT/mTOR信号通路的激活[5]。并且通过体内实验验证了DMY在裸鼠体内的安全有效的灌胃剂量为25 mg/g·d[24]。本研究在前期研究基础上发现,DMY显著降低了SKBR3-R裸鼠异种移植肿瘤组织内AKT/mTOR信号通路关键分子磷酸化水平,同时有效地逆转了赫赛汀耐药。肿瘤组织中miR-98-5p表达量在含DMY治疗组显著高于未加入DMY治疗组,而IGF2蛋白水平正好相反。提示DMY可能是通过miR-98-5p下调IGF2表达,进而抑制IGF-1R下游信号通路的旁路激活,逆转细胞对赫赛汀耐药。对于DMY通过microRNA途径调控效应蛋白的表达,在既往的研究中同样有报道[25]。其具体机制有待进一步研究。
综上所述,HER2过表达的乳腺癌细胞中IGF2高表达可促进IGF-1R/HER2异源二聚体形成,并激活下游信号通路造成赫赛汀耐药。二氢杨梅素可以诱导miR-98-5p表达,降低IGF2水平,从而逆转HER2阳性乳腺癌细胞对赫赛汀耐药。本研究首次探究了SKBR3细胞中miR-98-5p /IGF2调控轴参与对赫赛汀耐药以及二氢杨梅素逆转细胞耐药的可能机制,为临床上克服赫赛汀继发耐药提供新的思路,值得进一步深入研究。
Biography
张明亮,博士,副主任医师,副教授,硕士生导师,E-mail: zhangmingliang@bbmc.edu.cn
Funding Statement
安徽省高校自然科学基金(KJ2019A0399);蚌埠医学院转化医学重点项目(BYTM2019024)
Contributor Information
张 明亮 (Mingliang ZHANG), Email: zhangmingliang@bbmc.edu.cn.
钱 军 (Jun QIAN), Email: qianjun215036@sina.com.
References
- 1.Wang WJ, Wu MJ, Chang J, et al. Role of human epidermal growth factor receptor 2 as a prognostic factor for survival in esophageal carcinoma: evidence from 2872 subjects. Minerva Med. 2016;107(5):328–41. [PubMed] [Google Scholar]
- 2.Gradishar WJ, Moran MS, Abraham J, et al. NCCN guidelines® insights: breast cancer. J Natl Compr Canc Netw. 2021;19(5):484–93. doi: 10.6004/jnccn.2021.0023. [DOI] [PubMed] [Google Scholar]
- 3.Vernieri C, Milano M, Brambilla M, et al. Resistance mechanisms to anti-HER2 therapies in HER2-positive breast cancer: current knowledge, new research directions and therapeutic perspectives. Crit Rev Oncol Hematol. 2019;139:53–66. doi: 10.1016/j.critrevonc.2019.05.001. [DOI] [PubMed] [Google Scholar]
- 4.Hackshaw MD, Danysh HE, Henderson M, et al. Prognostic factors of brain metastasis and survival among HER2-positive metastatic breast cancer patients: a systematic literature review. BMC Cancer. 2021;21(1):967–78. doi: 10.1186/s12885-021-08708-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.张 明亮, 潘 成武, 王 岗, et al. 二氢杨梅素通过抑制胰岛素样生长因子1受体下游磷脂酰肌醇3-激酶/蛋白激酶B信号途径增强赫赛汀对乳腺癌细胞的抑制作用. 转化医学杂志. 2017;6(6):340-4, 349. doi: 10.3969/j.issn.2095-3097.2017.06.006. [DOI] [Google Scholar]
- 6.Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1) Eur J Cancer. 2009;45(2):228–47. doi: 10.1016/j.ejca.2008.10.026. [DOI] [PubMed] [Google Scholar]
- 7.Haji F, Hurvitz SA. Can women with HER2-positive metastatic breast cancer be cured. Clin Breast Cancer. 2021;21(6):526–31. doi: 10.1016/j.clbc.2021.06.012. [DOI] [PubMed] [Google Scholar]
- 8.Chen J, Colosimo M, Lim E. The management of HER2-positive early breast cancer: current and future therapies. Asia Pac J Clin Oncol. 2021;17(Suppl 6):3–12. doi: 10.1111/ajco.13655. [DOI] [PubMed] [Google Scholar]
- 9.Arteaga CL, Chinratanalab W, Carter MB. Inhibitors of HER2/neu (erbB-2) signal transduction. Semin Oncol. 2001;28(6 suppl 18):30–5. doi: 10.1053/sonc.2001.29722. [DOI] [PubMed] [Google Scholar]
- 10.Browne BC, Eustace AJ, Kennedy S, et al. Evaluation of IGF1R and phosphorylated IGF1R as targets in HER2-positive breast cancer cell lines and tumours. Breast Cancer Res Treat. 2012;136(3):717–27. doi: 10.1007/s10549-012-2260-9. [DOI] [PubMed] [Google Scholar]
- 11.Gallardo A, Lerma E, Escuin D, et al. Increased signalling of EGFR and IGF1R, and deregulation of PTEN/PI3K/Akt pathway are related with trastuzumab resistance in HER2 breast carcinomas. Br J Cancer. 2012;106(8):1367–73. doi: 10.1038/bjc.2012.85. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Christodoulou C, Oikonomopoulos G, Koliou GA, et al. Evaluation of the insulin-like growth factor receptor pathway in patients with advanced breast cancer treated with trastuzumab. Cancer Genomics Proteomics. 2018;15(6):461–71. doi: 10.21873/cgp.20105. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Lenz G, Hamilton A, Geng S, et al. T-darpp activates IGF-1R signaling to regulate glucose metabolism in trastuzumab-resistant breast cancer cells. Clin Cancer Res. 2018;24(5):1216–26. doi: 10.1158/1078-0432.CCR-17-0824. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Luo L, Zhang Z, Qiu N, et al. Disruption of FOXO3a-miRNA feedback inhibition of IGF2/IGF-1R/IRS1 signaling confers Herceptin resistance in HER2-positive breast cancer. Nat Commun. 2021;12(1):2699–708. doi: 10.1038/s41467-021-23052-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Chang CY, Kazmin D, Jasper JS, et al. The metabolic regulator ERRα, a downstream target of HER2/IGF-1R, as a therapeutic target in breast cancer. Cancer Cell. 2011;20(4):500–10. doi: 10.1016/j.ccr.2011.08.023. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Gorgisen G, Yaren Z. Insulin receptor substrate 1 overexpression promotes survival of glioblastoma cells through AKT1 activation. Folia Neuropathol. 2020;58(1):38–44. doi: 10.5114/fn.2020.94005. [DOI] [PubMed] [Google Scholar]
- 17.Zhou H, Qian W, Uckun FM, et al. IGF1 receptor targeted theranostic nanoparticles for targeted and image-guided therapy of pancreatic cancer. ACS Nano. 2015;9(8):7976–91. doi: 10.1021/acsnano.5b01288. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Molnár K, Mészáros Á, Fazakas C, et al. Pericyte-secreted IGF2 promotes breast cancer brain metastasis formation. Mol Oncol. 2020;14(9):2040–57. doi: 10.1002/1878-0261.12752. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Xing S, Tian Z, Zheng W, et al. Hypoxia downregulated miR-4521 suppresses gastric carcinoma progression through regulation of IGF2 and FOXM1. Mol Cancer. 2021;20(1):9–17. doi: 10.1186/s12943-020-01295-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Younis S, Naboulsi R, Wang X, et al. The importance of the ZBED6-IGF2 axis for metabolic regulation in mouse myoblast cells. FASEB J. 2020;34(8):10250–66. doi: 10.1096/fj.201901321R. [DOI] [PubMed] [Google Scholar]
- 21.Zhao X, Li J, Liu HQ, et al. Effects of down-regulation of IGF2 gene on the biological characteristics of HCT116 colon cancer stem cells. Chin J Oncol. 2019;41(8):580–6. doi: 10.3760/cma.j.issn.0253-3766.2019.08.005. [DOI] [PubMed] [Google Scholar]
- 22.Liu SX, Zhou Y, Zhou YN, et al. Mechanism of miR-98 inhibiting tumor proliferation and invasion by targeting IGF1R in diabetic patients combined with colon cancer. Oncol Lett. 2020;20(2):1719–26. doi: 10.3892/ol.2020.11707. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.谢 竞, 赵 晓燕, 赵 冰, et al. miR-98-5p靶向CCR7对乳腺癌细胞MCF-7运动能力的影响及其机制研究. 中国现代应用药学. 2020;37(20):2446–52. [Google Scholar]
- 24.张 明亮, 刘 先富, 陈 晨, et al. 二氢杨梅素对乳腺癌模型小鼠的抑瘤作用及其对小鼠肝、肾毒性的影响. 牡丹江医学院学报. 2019;40(4):6-8, 5. [Google Scholar]
- 25.Yang D, Tan S, Yang Z, et al. Dihydromyricetin attenuates TNF-α-induced endothelial dysfunction through miR-21-mediated DDAH1/ADMA/NO signal pathway. Biomed Res Int. 2018;2018:1047810. doi: 10.1155/2018/1047810. [DOI] [PMC free article] [PubMed] [Google Scholar]


