Abstract
目的
基于GEO数据库和网络药理学方法研究龙杞方治疗糖尿病肾脏病(DKD)的作用机制,并通过动物实验进一步验证龙杞方治疗DKD的信号通路。
方法
利用GEO、TCMSP、CNKI、ChemDraw、SwissTarget Prediction等数据库获得龙杞方和DKD靶点,VENNY获得龙杞方-DKD交集靶点,String进行蛋白互作分析,R包进行KEGG和GO富集分析,Cytoscape 3.7.2软件构建网络图。动物实验验证分析,40只健康雄性SD大鼠随机分为5组(8只/组),采用腹腔内注射链脲佐菌素(STZ)诱导的DKD大鼠模型,龙杞方低剂量组(1 g·kg-1·d-1),龙杞方中剂量组(2 g·kg-1·d-1),龙杞方高剂量组(2 g·kg-1·d-1),空白组和模型组采用等体积水灌胃;HE染色观察大鼠肾脏形态,检测肾功能情况;Western blot检测炎症指标NF-κB、p-NF-κB蛋白表达水平。
结果
龙杞方共760个主要靶点,通过GEO数据库获得差异基因共1026个,通过VENNY数据库获得龙杞方-DKD交集靶点共61个,通过PPI网络互作获得的核心靶点为MYC、EGF、CASP3、VEGFA、CCL2、SPP1、VCAM1、ICAM1。GO分析龙杞方主要与核受体活性、配体激活转录因子活性等有关,KEGG发现龙杞方主要通过干预NF-κB、TNF、PI3K-AKT等炎症信号通路有关。动物实验显示龙杞方高、中、低剂量干预后DKD大鼠的肾功能指标(Scr、BUN、UALB、UACR)与模型组比较有显著改善(P < 0.05);HE染色观察出龙杞方高、中、低剂量干预DKD大鼠与模型组对照,肾小球和肾小管结构和排列改善明显,效应强度为:龙杞方高剂量组 > 中剂量组 > 低剂量组;Western blot结果显示龙杞方高、中、低剂量干预DKD大鼠,与模型组比较,可以使NF-κB、p-NF-κB表达显著下调,效应强度为:龙杞方高剂量组 > 中剂量组 > 低剂量组。
结论
龙杞方通过多成分、多靶点、多信号通路治疗DKD,龙杞方可能通过抑制炎症信号通路NF-κB起到保护肾功能的作用。
Keywords: 网络药理学, 龙杞方, 糖尿病肾脏病, 动物实验, NF-κB
Abstract
Objective
To study the therapeutic mechanism of Longqi Fang (LQF) for diabetic kidney disease (DKD) based on GEO database and network pharmacology.
Methods
LQF and DKD targets were obtained using the databases including GEO, TCMSP, CNKI, ChemDraw, and SwissTarget Prediction, and LQF-DKD intersection targets were obtained with VENNY. String was used for protein-protein interaction (PPI) analysis, and R package for KEGG and GO enrichment analysis. Cytoscape 3.7.2 software Network graphs were constructed. The results of network pharmacology analysis were verified in SD rat models of DKD by daily treatment of the rats with LQF at low (1 g/kg), medium (2 g/kg), and high (2 g/kg) doses, and kidney pathology was observed with HE staining and the changes in renal function were assessed. Western blotting was used to detect the expression levels of NF-κB and p-NF-κB proteins.
Results
We identified 760 main targets of LQF, and obtained 1026 differential genes using GEO database and 61 LQF-DKD intersection targets using Venny database. The core targets obtained through PPI network analysis included Myc, EGF, CASP3, VEGFA, CCL2, SPP1, VCAM1 and ICAM1. Go analysis showed that LQF affects mainly nuclear receptor activity and ligand activated transcription factor activity. KEGG analysis showed that LQF affects inflammatory signaling pathways by interfering with NF-κB, TNF, and PI3K-AKT. In rat models of DKD, treatment with LQF resulted in significant improvements of the renal functions (P < 0.05) and glomerular and tubular structure and arrangement in a dose-dependent manner. Western blotting results showed that LQF dose-dependently downregulated NF-κB and p-NF-κB expressions in the rat models.
Conclusion
The therapeutic mechanism of LQF for DKD involves multiple components, targets and signal pathways that mediate an inhibitory effect on NF-κB signaling pathway to protect the renal function.
Keywords: network pharmacology, Longqi Fang, diabetic kidney disease, animal experiments, nuclear factor-κB
糖尿病(DM)是我国目前患病率最高的慢性疾病之一[1],伴随着我国老龄化的进展和生活方式的改变,我国糖尿病的发病率也不断升高[2],在2018年国际糖尿病联合会发布的《IDF全球糖尿病概览·第九版》[3]中指出截止2019年20~70岁全球糖尿病患者的数量达到4.63亿,而我国糖尿病患者的数量达到1.164亿,高居全球第一,其患病率约占总人口的10.9%。糖尿病肾脏病[4](DKD)是最令人担忧的糖尿病慢性微血管并发症之一,也是终末期肾病(ESRD)的主要原因[5]。DKD患者的全因死亡率约为无肾病的糖尿病患者的30倍[6]。现代医学治疗DKD的主要方法以控制血糖、调节脂质代谢、控制血压、抗氧化应激、抑制炎症因子等为主,但是临床疗效欠佳,最终方式以肾脏血液净化为主[7],故寻找有效阻止/延缓早期DKD的药物尤为重要。
龙杞方是郭宏敏教授的经验方[8](专利:ZL201310565771.0),在治疗早期DKD患者方面疗效显著,其组成主要为:制黄精、干地龙、红景天、川芎、荷叶、三七粉、葛根、生地、枸杞,以黄精为君药。长期临床观察发现龙杞方能有效改善早期慢性肾功能不全患者的尿蛋白水平[9, 10],相关的实验研究发现龙杞方能有效改善胰岛素抵抗、对血管炎症因子有抑制作用,能起到保护血管内皮细胞的作用[11]。但由于龙杞方由多味中药组成,成分多而复杂,其靶点多,作用机制多,目前无法完全阐明龙杞方治疗DKD的药理机制。因此,本研究采用网络药理学方法,获得龙杞方治疗DKD的潜在靶点和信号通路,探讨龙杞方治疗DKD的可能机制,并通过动物实验进一步验证分析,为龙杞方的临床应用以及DKD相关疾病基础与临床研究提供一定的理论依据。
1. 资料和方法
1.1. 网络药理学方法
1.1.1. 糖尿病肾脏病GEO芯片筛选差异基因
通过NCBI基因表达数据库(GEO)中GEO datasets以“Diabetic kidney disease”作为为检索词,获取GSE30528和GSE30529相关芯片,其芯片分别对应肾小球及肾小管,两组芯片为同一实验,两者的注释文件为同一平台GPL571。对获得的芯片数据进行二次分析,使用limma包对芯片数据的差异基因进行分析,为了得到更多的差异基因,将显著差异基因的筛选条件设定为P及校正后的P均小于0.05,logFC的绝对值大于1,得到名为“diff”的差异基因文件,运用phearmap包,分别筛选出上调与下调基因,绘制差异基因的热图,运用plot包绘制火山图。
1.1.2. 龙杞方潜在活性成分和靶点筛选
通过TCMSP数据库,输入龙杞方中9味中药名称,即三七、地龙、荷叶、红景天、葛根、地龙、枸杞、川芎、生地黄、黄精,搜索得到各药化学成分,通过口服生物利用度(OB)及类药性(DL)的筛选条件(OB≥30%,DL≥0.18)进行筛选。在TCMSP中无法获取相关药物药物成分和靶点的中药,使用中国知网数据库和PubMed数据库进行检索,获取中药化学成分有关的文献,搜集其有效化学成分,使用ChemDraw软件绘制相关化合物的分子结构,以sdf(*. sdf)格式保存文件。将获得的中药化学成分的sdf格式文件上传到Swiss ADME平台,对候选化合物和类药性相关参数进行预测,预测标准为:Pharmacokinetics项筛选肠胃吸收为“High”,同时Druglikeness项中Lipinski、Ghose、Veber、Egan、Muegge,这5个类药性预测中有≥2个以上为“Yes”的化合物,符合上述标准的为类药性和口服利用度较好的活性化合物。将获得的活性化合物以sdf格式文件上传至SwissTargetPrediction平台,“Organism”选择“Homo Sapiens”,筛选条件为probability > 0.1,预测潜在靶点,建议活性化合物-靶点数据库。
1.1.3. 蛋白互作网络构建及核心靶点筛选
通过VENNY软件得到的龙杞方与DKD的交集靶点导入到STRING数据库,物种设置为“Homo sapiens”,最低相互作用阈值设置为“High confidence(0.400)”,构建PPI网络。将PPI网络的tsv文件导入Excel表格,利用R软件进行可视化处理,并选出核心靶点。
1.1.4. GO和KEGG分析
利用R软件对上述筛选出的药物疾病共有靶点进行GO和KEGG分析,种属选为“Homo sapiens”,以P≤0.01且从小到大排序作为筛选条件,选取符合条件的前20的KEGG通路及GO生物过程、细胞成分、分子功能,绘制GO和KEGG气泡图及柱状图。
1.1.5. 构建“龙杞方-成分-靶点-通路-疾病”网络图
通过对获得20条主要信号通路及其相关靶点及其映射的龙杞方成分,通过汇入Cytoscape 3.7.2软件中,构建“龙杞方-成分-靶点-通路-疾病”网络图。
1.2. 动物实验
1.2.1. 动物
SPF级SD大鼠40只,雄性,体质量180~ 200 g,购于南通大学动物实验中心。实验动物生产许可证号:SCXK(苏)2019-0001。实验动物使用许可证:SYXK(苏)2017-0007。
1.2.2. 药物、试剂与仪器
中药:龙杞方由干地龙、制黄精、枸杞、葛根、生地黄、红景天、三七粉、川芎、荷叶组成,为江苏省中医院老年科临床专用方,其中药生药由南京市高淳中医院药剂科提供,按高、中、低剂量制成,其制备方法:将配方量干地龙、制黄精、枸杞、葛根、生地黄、红景天、三七粉、川芎、荷叶混合,放入3倍质量的蒸馏水,浸泡1~2 h左右,再加入3倍质量蒸馏水,煎煮1h,将滤液收集,使用同样的方法再重复煎煮3次,最后将所有收集的滤液汇总浓缩成浸膏进行过滤,按照高、中、低剂量将生药剂量定为4 g生药/mL、2 g生药/mL、1 g生药/mL,保存在4 ℃冰箱中备用。
链脲佐菌素(STZ,Sigma);染色剂试剂盒、苏木精染液(BASO);伊红染液(BASO);NF-κB多克隆抗体(EnoGene);P-NF-κB多克隆抗体(EnoGene)。
1.2.3. STZ大鼠诱导的糖尿病肾脏病大鼠模型建立及药物干预方案
基于国内外DKD大鼠模型的造模方法[12],采用“高脂饲料喂养+单侧肾切除+STZ腹腔注射”3种措施建立改良型的DKD大鼠模型。
所有大鼠在实验室适应性喂养1周后,按照随机数字表将40只大鼠随机分为正常组(8只)和造模组(32只);正常组8只大鼠给予普通饲料喂养,造模组大鼠32只大鼠予高脂饲料喂养。32只造模组大鼠在高脂饲料喂养4周后,腹腔内注射丙戊酸钠进行麻醉,然后以俯卧位将其固定在鼠板上,消毒后沿大鼠左侧背部肋弓下缘纵向切开约3 cm大小切口,将左侧肾脏充分暴露,之后将肾周组织分离,对左侧肾门血管进行结扎后摘除左侧肾脏,最后将切口逐层缝合。术后3 d内在大鼠腹腔内注射青霉素钠(20万U/d)以预防感染。大约7 d后,造模组大鼠手术创面愈合后,在大鼠右侧腹腔内注射STZ(35 mg/kg),72 h后对大鼠尾静脉进行采血,3次随机血糖(RBG)监测均 > 16.7 mmol/L,则提示DKD大鼠模型成功建立。若3次RBG中有 < 16.7 mmol/L,再次注射STZ(35 mg/kg),直至DKD大鼠模型成功建立。
给药方案:将32只造模大鼠按照随机数字表分为模型组8只,龙杞方高剂量组,中剂量组和低剂量组各8只,模型组自造模成功后不做任何干预,其余3组大鼠采用“按动物体表面积比率换算等计量法”计算出每组药物的临床等效剂量。龙杞方高剂量为20 g生药/kg,中剂量为10 g生药/kg,低剂量为5 g生药/kg,龙杞方药液按高、中、低剂量制成,生药剂量分别为4 g生药/mL、2 g生药/mL、1 g生药/mL,各组按照设定的剂量每日灌胃给药,给药体积为1 mL/200 g,连续给药8周。在最后1次灌胃结束后1 d取材,取材前隔夜禁食禁水 > 10 h。
1.2.4. 肾脏组织HE染色流程
大鼠肾脏切除固定后,通过乙醇阶梯脱水、二甲苯透明、石蜡包埋等多个步骤后,使用切片机制片,片厚5 µm,依据HE染色试剂盒说明进行染色,并对肾脏组织进行HE评分。
1.2.5. Wesrtern blot实验
对获得大鼠肾脏组织依据实验要求进行,提取总蛋白→凝胶电泳分离→转膜→抗体孵育→ECL显色等多重步骤,检测NF-κB多克隆抗体、P-NF-κB多克隆抗体蛋白。
1.2.6. 统计学方法
应用GraphPad Prism 5.0和SPSS 25.0统计软件进行分析,采用t-test检验对两组间均数进行比较,采用One-way Anova(Dunnett)对多组间比较。以均数±标准差记录正态分布定量资料,采用单因素方差分析及LSD法两两比较,不满足方差分析条件时采用Wilcoxon秩和检验,当P < 0.05为差异有统计学意义。
2. 结果
2.1. 网络药理学结果
2.1.1. GEO数据库芯片获取
依据上述方法,通过对正常基因和DKD肾脏组织标本进行分析,GSE30528芯片中符合P及校正后的P均小于0.05,logFC的绝对值大于1为筛选条件的差异基因有542个,其中上调的基因75个,下调的基因467个,绘制前40位的差异基因热图(图 1A),差异基因火山图(图 1C);在GSE30529芯片中符合P及校正后的P均小于0.05,logFC的绝对值大于1为筛选条件的差异基因有484个,其中上调的基因303个,下调的基因181个,绘制前40位的差异基因热图(图 1B),差异基因火山图(图 1D)。
图 1.
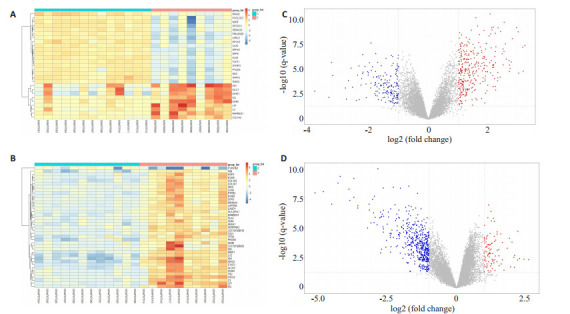
Heat map and volcano map of GSE30528 and GSE30529 differential genes. A: Heat map of the differential genes in the top 40 positions of GSE30528 chip. B: Volcano map of the differential genes of GSE30528 Chip. C: Heat map of the differential genes in the top 40 positions of GSE30529 chip. D: Volcano map of the differential genes of GSE30529 chip.
2.1.2. 龙杞方有效成分和靶点
通过检索TCMSP平台只获取了三七、荷叶、葛根、川芎、枸杞、黄精的所有成分,按照OB≥30%,DL≥0.18的标准筛得其对应的有效成分,其中三七有效成分7个,荷叶有效成分14个,川芎有效成分6个,枸杞有效成分35个,葛根有效成分3个,黄精有效成分9个。其对应的中药靶点三七223个,川芎39个,枸杞321个,荷叶358个,葛根76个,黄精133个。对于无法获得的中药红景天、地龙、生地黄,我们通过检索生地黄[13, 14]、地龙[15, 16]、红景天[17]的相关文献检索其化合物,并通过Swiss ADME平台获得红景天有效成分47个,地龙有效成分36个,生地黄有效成分52个。通过SwissTarget Prediction平台预测并收集中药对应化合物的靶点,其中红景天有效成分47个,地龙有效成分36个,生地黄有效成分52个,核心靶点生地黄1008个,红景天1092个,地龙931个。将所有的中药靶点经过汇总去重后获得的靶点760个。
2.1.3. 龙杞方-糖尿病肾脏病的共同靶点
将龙杞方的所有靶点与GSE30528、GSE30529的差异基因取交集,获得龙杞方与DKD相关发病机制的61个交集靶点基因,并通过Venny 2.1.0软件(http://bioinfogp.cnb.csic.es/tools/venny)绘制韦恩图(图 2)。
图 2.

Venn diagram of Longqi Fang and GSE30528 and GSE30529 differential genes.
2.1.4. PPI网络及龙杞方治疗DKD的主要靶点
将2.1.3项下得到的龙杞方作用与DKD的交集靶点导入到STRING数据库,物种设置为“Homo sapiens”,最低相互作用阈值设置为“High confidence(0.150)”,构建PPI网络(图 3)。使用Cytoscape软件中的Network-Analyzer分析互作节点的度值,Degree值作为标准,找到排名前30的核心靶点,并使用R语言绘制核心靶点的柱状图(图 4)。得到龙杞方治疗DKD的核心靶点为MYC、EGF、CASP3、VEGFA、CCL2、SPP1、VCAM1、ICAM1。
图 3.

杞方治疗DKD靶点PPI图
PPI network of the targets of Longqi Fang for treatment of diabetic kidney disease.
图 4.

龙杞方治疗DKD前30位核心靶点条形图
Bar chart of the top 30 core targets of Longqi Fang for diabetic kidney disease.
2.1.5. GO和KEGG分析
龙杞方治疗DKD的GO功能分析提示,KEGG通路富集分析结果共37条信号通路,其中主要有AGEs-RAGE、HIF-1、PI3K-Akt,NF-κB、TNF信号通路可能为重要的龙杞方治疗DKD的信号通路(图 5);其中20条与DKD密切相关的通路(表 1);利用R软件绘制前20名信号通路气泡图(图 6)。
图 5.

交集靶点GO功能分析
GO function analysis of the intersection targets.
表 1.
龙杞方治疗DKD KEGG通路富集分析
KEGG pathway enrichment analysis of Longqi Fang against DKD
| ID | Description | p.adjust | geneID | Count |
| hsa04933 | AGE-RAGE signaling pathway in diabetic complications | 3.14E-05 | CASP3/VEGFA/F3/ICAM1/CCL2/VCAM1/PRKCB/COL3A1 | 8 |
| hsa05418 | Fluid shear stress and atherosclerosis | 3.14E-05 | VEGFA/HMOX1/ICAM1/CCL2/VCAM1/PLAT/NQO1/KDR/HSP90AB1 | 9 |
| hsa04020 | Calcium signaling pathway | 0.000253191 | VEGFA/EGF/PRKCB/KDR/HRH1/HTR2B/FGF1/MYLK/EDNRA/FLT1 | 10 |
| hsa04650 | Natural killer cell mediated cytotoxicity | 0.001273051 | CASP3/IFNGR1/ICAM1/PRKCB/SYK/FYN/LCK | 7 |
| hsa04510 | Focal adhesion | 0.002172736 | VEGFA/EGF/PRKCB/SPP1/KDR/FYN/MYLK/FLT1 | 8 |
| hsa05207 | Chemical carcinogenesis-receptor activation | 0.00243623 | VEGFA/EGF/RB1/MYC/PRKCB/AHR/NR1I3/HSP90AB1 | 8 |
| hsa04066 | HIF-1 signaling pathway | 0.00243623 | IFNGR1/VEGFA/EGF/HMOX1/PRKCB/FLT1 | 6 |
| hsa04010 | MAPK signaling pathway | 0.003430192 | CASP3/VEGFA/EGF/MYC/PRKCB/KDR/PLA2G4A/FGF1/FLT1 | 9 |
| sa05219 | Bladder cancer | 0.003456589 | VEGFA/EGF/RB1/MYC | 4 |
| hsa01521 | EGFR tyrosine kinase inhibitor resistance | 0.003588057 | VEGFA/EGF/PRKCB/KDR/AXL | 5 |
| hsa05167 | Kaposi sarcoma-associated herpesvirus infection | 0.00549286 | CASP3/IFNGR1/VEGFA/RB1/MYC/ICAM1/SYK | 7 |
| hsa04614 | Renin-angiotensin system | 0.007730096 | MME/KLK1/CPA3 | 3 |
| hsa04151 | PI3K-Akt signaling pathway | 0.008028541 | VEGFA/EGF/MYC/SPP1/KDR/SYK/FGF1/FLT1/HSP90AB1 | 9 |
| hsa05417 | Lipid and atherosclerosis | 0.008028541 | CASP3/CASP1/HSPA5/ICAM1/CCL2/VCAM1/HSP90AB1 | 7 |
| hsa04370 | VEGF signaling pathway | 0.008048184 | VEGFA/PRKCB/KDR/PLA2G4A | 4 |
| hsa04064 | NF-kappa B signaling pathway | 0.008048184 | ICAM1/VCAM1/PRKCB/SYK/LCK | 5 |
| hsa04014 | Ras signaling pathway | 0.010016525 | VEGFA/EGF/PRKCB/KDR/PLA2G4A/FGF1/FLT1 | 7 |
| hsa04668 | TNF signaling pathway | 0.010016525 | CASP3/ICAM1/CCL2/VCAM1/IRF1 | 5 |
| hsa05164 | Influenza A | 0.010155883 | CASP3/CASP1/IFNGR1/ICAM1/CCL2/PRKCB | 6 |
| hsa04726 | Serotonergic synapse | 0.010155883 | CASP3/PRKCB/ALOX5/PLA2G4A/HTR2B | 5 |
图 6.

KEGG富集分析气泡图
Bubble chart of KEGG pathway enrichment analysis.
2.1.7. 构建“龙杞方-成分-靶点-通路-疾病”网络图
通过对获得20条主要信号通路中38个关键靶点及其映射的主要成分,将其汇入Cytoscape 3.7.2软件中,构建“龙杞方-成分-靶点-通路-疾病”网络图(图 10)。
图 10.
龙杞方对DKD模型大鼠肾脏病理影响
Effect of Longqi Fang on pathological changes of rat kidneys (HE staining, original magnification: ×200).
A: Blank group; B: Model group; C: Low-dose group; D: Medium-dose group; E: High-dose group.

图 7.
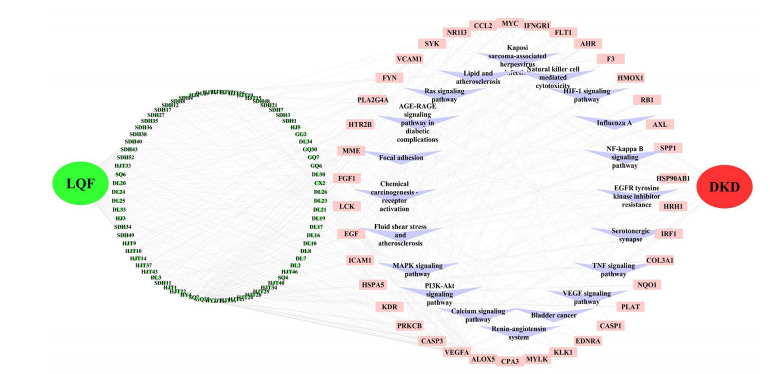
“龙杞方-成分-靶点-通路-DKD”网络图
Diagram of Longqi Fang-component-target-signaling pathway-DKD network. LQF nodes represent Longqi Fang, green nodes represent the component, pink square nodes represent the target proteins, purple diamond nodes represent signaling pathways and DKD nodes represent diabetic kidney disease.
2.2. 动物实验结果
2.2.1. 生化指标检测
模型组大鼠血清生化指标Scr、BUN、UALB、UACR较正常组大鼠显著升高(P < 0.01),龙杞方各剂量组大鼠经治疗后,血清生化指标Scr,BUN,以及尿蛋白指标UALB、UACR较模型组显著降低(P < 0.01),效应强度为:龙杞方高剂量组 > 中剂量组 > 低剂量组(表 2、图 8)。
表 2.
各组大鼠肾功能指标
Renal function index of the rats in each group (Mean± SD, n=8)
| Index | Blank group | Model group | High-dose group | Medium-dose group | Low-dose group |
| **P < 0.01 vs model group; Scr: Serum creatinine; BUN: Blood urea nitrogen; UALB: Urinary microalbumin; UACR: Urinary albumin/creatinine ratio. | |||||
| Scr (μmol/L) | 88.65±10.85** | 271.12±20.21 | 176.01±19.66** | 218.66±10.93** | 243.73±15.45** |
| BUN (mmol/L) | 6.62±0.70** | 23.52±1.87 | 11.39±0.93** | 14.12±0.77** | 19.15±1.05** |
| UALB (g/L) | 0.57±0.19** | 1.39±0.30 | 0.76±0.16** | 0.93±0.25** | 0.76±0.16** |
| UACR (μg/μmol) | 1.74±0.62** | 6.27±0.89 | 3.61±0.64** | 4.19±0.90** | 4.75±0.45** |
图 8.
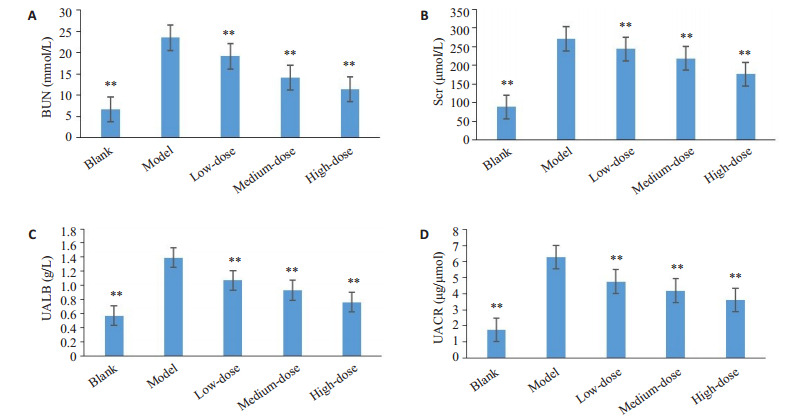
各组大鼠肾功能指标
Renal function index of rats in each group. A: UACR; B: BUN; C: Scr; D: UALB. **P < 0.01 vs model group.
2.2.2. Western blot结果
与模型组对比,药物浓度在高剂量(4 mg/mL)、中剂量(2 mg/mL)时NF-κB、P-NF-κB蛋白表达均有所下调(P < 0.01)。与模型组对比,药物浓度在低剂量(1 mg/ mL)时NF-κB、P-NF-κB的蛋白表达水平有所下调(P < 0.05,表 3、图 9)。
表 3.
龙杞方对DKD大鼠肾脏组织NF-κB、p-NF-κB的蛋白表达水平
Western blot analysis of the expression of NF-κB and p-NF-κB in kidney tissue of DKD rats after treatment with Longqi Fang (Mean±SD, n=3)
| Items | Blank group | Model group | High-dose group | Medium-dose group | Low-dose group |
| ##P < 0.01 vs normal group. *P < 0.05, **P < 0.01 vs model group. | |||||
| NF-κB | 1.01±0.02** | 4.68±0.12## | 3.85±0.20##* | 2.96±0.11##** | 2.74±0.08** |
| p-NF-κB | 0.95±0.05** | 2.43±0.18## | 2.01±0.02##* | 1.69±0.11##** | 1.39±0.01** |
图 9.

龙杞方DKD大鼠肾脏组织NF-κB、p-NF-κB的Western blot检测
Western blot analysis of the expression of NF-κB and p-NF-κB in kidney tissue of DKD rats after treatment with Longqi Fang.
2.2.3. HE染色结果
对构建DKD大鼠模型,使用不用剂量的龙杞方进行干预,HE染色结果显示模型组的肾小管上皮细胞重度变性坏死,管腔轻微增大,腔内见大量透明管型;肾小球内细胞数增多、毛细血管扩张,系膜基质无增生,球囊腔无扩大;间质无炎细胞浸润,无纤维组织增生。龙杞方干预组与模型组相比,改善明显,效应强度为:龙杞方高剂量组 > 中剂量组 > 低剂量组(图 10)。
3. 讨论
DKD是糖尿病重要的微血管并发症之一,由于其发病机制复杂,目前尚无统一定论,但普遍认为与炎症反应、遗传因素、代谢紊乱、氧化应激、血流动力学等相关[18, 19]。根据流行病学统计研究,20%~40%的糖尿病患者会出现DKD,预计到2030年,世界范围内的DM患者将达到3.66亿,而DKD患者将超过1亿,开展防治DKD的研究工作已经刻不容缓[20, 21]。现代医学认为DKD的发病机制与多重因素有关,如持续的高血糖状态引起的糖基化合物增加,氧化应激反应增强,肾脏血流动力学的改变[22]。现代中医学家仝小林院士[23-25]认为DKD在中医上属于“消渴肾病”的范畴,认为其发病的病机主要为痰浊、肾虚、血瘀导致,导师郭宏敏教授使用龙杞方治疗DKD患者,临床疗效显著,全方以标本同治为治则,具有活血化瘀、升清降浊、益气养阴、清热剔络之功效,切合DKD患者痰浊、肾虚、血瘀的发病机制。目前龙杞方在临床上使用较为广泛,但是缺乏有效的理论和实验基础,对龙杞方作用于DKD的多靶点、多途径的作用机制缺乏客观的认识。本文通过GEO数据库结合网络药理学研究方法,通过“疾病、药物、靶标、通路”有机结合,进一步研究龙杞方作用于DKD的研究机制。
本次研究得出龙杞方治疗DKD的61个交集靶点,并通过PPI网络互作分析以及R语言软件获得龙杞方治疗DKD的前8位的主要靶点为MYC、EGF、CASP3、VEGFA、CCL2、SPP1、VCAM1、ICAM1,说明龙杞方可能是通过作用以上靶点从而对DKD发挥直接或者间接的调控作用。并通过“龙杞方-成分-靶点-通路-DKD”网络图筛选出龙杞方治疗DKD的主要核心成分为槲皮素、山奈酚。研究发现槲皮素[26]调控NF-κB信号通路,减轻炎症反应,抑制DKD大鼠的肾脏纤维化。Chen等[27]研究发现山奈酚可以通过抑制NF-κB信号通路减轻高血糖诱导的心脏损伤。
通过GO和KEGG分析龙杞方治疗DKD具有多成分、多靶点、多通路的特点,发现龙杞方可能通过上皮细胞增殖的调控、内皮细胞调控、白细胞-细胞粘附等过程发挥保护DKD大鼠的作用,其作用机制可能与PI3K-Akt、NF-κB、TNF等炎症信号通路相关。
NF-κB作为核转录因子的代表,不仅在正常的生理活动中,其异常活化也与许多疾病紧密相关[28],研究报道[29]肾病患者中NF-κB表达的水平的增高显著,其形成的信号通路表达水平高低可作为肾病预后的判断标准。动物实验结果显示,龙杞方通过调控NF-κB信号通路进一步改善DKD的病理生理功能。NF-κB信号通路是多种信号通路的枢纽,NF-κB向细胞核内转移并导致促炎因子启动,导致细胞炎症反应增加,组织炎症损伤[30, 31]。在高血糖状态下,导致NF-κB激活,参与高血糖诱导下细胞凋亡[32]。相关实验研究[33]表明通过抑制NF-κB信号通路的磷酸化激活可以有效改善DKD的病程进展。通过HE病理染色可以发现龙杞方可能通过抑制NF-κB信号通路,减轻DKD大鼠的炎症反应,减缓DKD大鼠肾脏纤维化的进展。
本研究通过不同浓度的龙杞方对DKD大鼠进行干预,观察其对肾功能损伤指标的改善情况。发现相关肾功能指标Scr,BUN、UALB、UACR均有显著变化,效应强度为:龙杞方高剂量组 > 中剂量组 > 低剂量组。表明龙杞方可有效改善DKD大鼠的肾功能。通过对DKD大鼠的临床症状有较为明显的改善,说明龙杞方在改善DKD大鼠的蛋白尿、肌酐、尿素氮以及临床症状上有较为明显的疗效,具有保护肾脏的作用。
综上所述,通过GEO数据库与网络药理学分析龙杞方治疗DKD的核心靶点,GO和KEGG分析以及筛选得到龙杞方治疗DKD的核心信号通路和分子机制。通过动物实验证实龙杞方能有效改善DKD大鼠的肾功能,同时龙杞方可以抑制炎症信号通路NF-κB,减轻炎症反应,抑制肾脏纤维化起到保护肾脏的作用。
Biography
邢磊,博士,E-mail: xingleize@163.com
Funding Statement
江苏省中医药科技发展项目基金(YB201940);南京市中医药青年人才培养项目(ZYQ20065);南京市卫生科技计划项目(YKK21201)
Contributor Information
邢 磊 (Lei XING), Email: xingleize@163.com.
郭 宏敏 (Hongmin GUO), Email: hongminguo789@163.com.
References
- 1.中华医学会糖尿病学分会 中国2型糖尿病防治指南(2013年版) 中国糖尿病杂志. 2014;22(8):2–42. [Google Scholar]
- 2.Wang LM, Gao P, Zhang M, et al. Prevalence and ethnic pattern of diabetes and prediabetes in China in 2013. JAMA. 2017;317(24):2515–23. doi: 10.1001/jama.2017.7596. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Boulton A. Strengthening the international diabetes federation (IDF) Diabetes Res Clin Pract. 2020;160:108029. doi: 10.1016/j.diabres.2020.108029. [DOI] [PubMed] [Google Scholar]
- 4.中华医学会糖尿病学分会微血管并发症学组 糖尿病肾病防治专家共识(2014年版) 中华糖尿病杂志. 2014;6(11):792–801. doi: 10.3760/cma.j.issn.1674-5809.2014.11.004. [DOI] [Google Scholar]
- 5.余江毅. 糖尿病肾脏病中西医结合防治专家共识(2019)[C]. 第十二次全国中西医结合内分泌代谢病学术大会暨糖尿病、甲状腺疾病高峰论坛论文资料汇编, 2019: 61-6+60.
- 6.Sagoo MK, Gnudi L. Diabetic nephropathy: an overview. Methods Mol Biol. 2020;2067:3–7. doi: 10.1007/978-1-4939-9841-8_1. [DOI] [PubMed] [Google Scholar]
- 7.葛景利. CRP、Hcy与西宁地区2型糖尿病肾病患者营养状况的关系研究[D]. 青海大学, 2021.
- 8.郭宏敏, 陈卫平. 一种治疗血管内皮炎症损伤的中药组合物及其制备方法[P]. CN103566184A, 2014.
- 9.张静. 养阴剔络方干预老年代谢综合征(阴虚血瘀证)慢性肾损害的临床研究[D]. 南京: 南京中医药大学, 2011.
- 10.洪丽芬. 养阴剔络方干预老年代谢综合征阴虚血瘀证早期肾损害的临床研究[D]. 南京: 南京中医药大学, 2011.
- 11.朱 春龙, 郭 宏敏. 养阴剔络方对人脐静脉内皮细胞炎症机制的作用. 长春中医药大学学报. 2014;30(3):405–7. [Google Scholar]
- 12.郝 朋, 巴图德力根 糖尿病肾病大鼠模型制备研究进展. 中国民族医药杂志. 2015;21(11):61–3. doi: 10.3969/j.issn.1006-6810.2015.11.033. [DOI] [Google Scholar]
- 13.陈 金鹏, 张 克霞, 刘 毅, et al. 地黄化学成分和药理作用的研究进展. 中草药. 2021;52(6):1772–84. [Google Scholar]
- 14.冯 卫生, 李 孟, 郑 晓珂, et al. 生地黄化学成分研究. 中国药学杂志. 2014;49(17):1496–502. [Google Scholar]
- 15.张 玉, 董 文婷, 霍 金海, et al. 基于UPLC-Q-TOF-MS技术的广地龙化学成分分析. 中草药. 2017;48(2):252–62. [Google Scholar]
- 16.张 玉, 魏 文峰, 霍 金海, et al. 基于UPLC-Q-TOF-MS技术的广地龙血清药物化学初步研究. 中药材. 2017;40(4):848–53. [Google Scholar]
- 17.霍 佳丽, 王 建华, 吴 志军, et al. 新疆大花红景天化学成分的HPLC-MS研究. 天然产物研究与开发. 2012;24(10):1405–7. doi: 10.3969/j.issn.1001-6880.2012.10.020. [DOI] [Google Scholar]
- 18.Selby NM, Taal MW. An updated overview of diabetic nephropathy: Diagnosis, prognosis, treatment goals and latest guidelines. Diabetes Obes Metab. 2020;22(Suppl 1):3–15. doi: 10.1111/dom.14007. [DOI] [PubMed] [Google Scholar]
- 19.Ahmed SS. Update on diagnosis and management of early stage diabetic kidney disease. Am J Med Sci. 2019;9(3):114–24. [Google Scholar]
- 20.Ling W, Huang Y, Huang YM, et al. Global trend of diabetes mortality attributed to vascular complications, 2000 – 2016. Cardiovasc Diabetol. 2020;19(1):182. doi: 10.1186/s12933-020-01159-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.柯 倩, 宇 传华, 刘 晓雪, et al. 基于GBD数据的中国慢性肾病疾病负担现状及趋势分析. 公共卫生与预防医学. 2021;32(5):1–5. doi: 10.3969/j.issn.1006-2483.2021.05.001. [DOI] [Google Scholar]
- 22.Gohda T, Murakoshi M, Koshida T, et al. Concept of diabetic kidney disease - paradigm shift from albuminuria-based to GFRbased kidney disease- Juntendo Med J. 2019;65(6):510–6. doi: 10.14789/jmj.2019.65.JMJ19-R16. [DOI] [Google Scholar]
- 23.王 新苗, 杨 浩宇, 顾 成娟, et al. 黄芪、水蛭粉、大黄治疗糖尿病肾病经验: 仝小林三味小方撷萃. 吉林中医药. 2020;40(1):5–7. [Google Scholar]
- 24.贾淑明, 赵锡艳, 逄冰, 等. 仝小林教授辨治糖尿病肾病要点[C]//. 世界中医药学会联合会方药量效研究专业委员会成立大会暨第二届国际方药量效关系与合理应用研讨会论文集, 2014: 475-80.
- 25.李 次艳, 李 迈, 杨 丽霞, et al. 仝小林院士治疗糖尿病并发症的学术思想. 中医研究. 2021;34(9):67–70. doi: 10.3969/j.issn.1001-6910.2021.09.20. [DOI] [Google Scholar]
- 26.Chen P, Shi QY, Xu XJ, et al. Quercetin suppresses NF-κB and MCP-1 expression in a high glucose-induced human mesangial cell proliferation model. Int J Mol Med. 2012;30(1):119–25. doi: 10.3892/ijmm.2012.955. [DOI] [PubMed] [Google Scholar]
- 27.Chen XM, Qian JC, Wang LT, et al. Kaempferol attenuates hyperglycemia-induced cardiac injuries by inhibiting inflammatory responses and oxidative stress. Endocrine. 2018;60(1):83–94. doi: 10.1007/s12020-018-1525-4. [DOI] [PubMed] [Google Scholar]
- 28.Wang HQ, Wang SS, Chiufai K, et al. Umbelliferone ameliorates renal function in diabetic nephropathy rats through regulating inflammation and TLR/NF-κB pathway. Chin J Nat Med. 2019;17(5):346–54. doi: 10.1016/S1875-5364(19)30040-8. [DOI] [PubMed] [Google Scholar]
- 29.Lu SY, Zhang HL, Wei XJ, et al. 2-dodecyl-6-methoxycyclohexa-2, 5-diene-1, 4-Dione isolated from Averrhoa carambola L. root ameliorates diabetic nephropathy by inhibiting the TLR4/MyD88/NF-κB pathway. Diabetes Metab Syndr Obes. 2019;12:1355–63. doi: 10.2147/DMSO.S209436. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Zhu Y, Ling YL, Wang XA. Alantolactone mitigates renal injury induced by diabetes via inhibition of high glucose-mediated inflammatory response and macrophage infiltration. Immunopharmacol Immunotoxicol. 2020;42(2):84–92. doi: 10.1080/08923973.2020.1725039. [DOI] [PubMed] [Google Scholar]
- 31.Qian L, Lu C, Yi T. Fibroblast growth factor-1 prevents diabetic nephropathy through an anti-JNK/NF-kappa B signal pathway. Diabetes. 2017;2017:66. [Google Scholar]
- 32.Sifuentes-Franco S, Padilla-Tejeda DE, Carrillo-Ibarra S, et al. Oxidative stress, apoptosis, and mitochondrial function in diabetic nephropathy. Int J Endocrinol. 2018;2018:1875870. doi: 10.1155/2018/1875870. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Chen MF, Liou SS, Hong TY, et al. Gigantol has protective effects against high glucose-evoked nephrotoxicity in mouse Glomerulus mesangial cells by suppressing ROS/MAPK/NF-κB signaling pathways. Molecules. 2018;24(1):80. doi: 10.3390/molecules24010080. [DOI] [PMC free article] [PubMed] [Google Scholar]


