Abstract
Das Immunsystem ist ein den äußeren Gegebenheiten anpassbares und nahezu ubiquitär vorhandenes Abwehrsystem höherer Organismen, das vor allem Schädigungen durch Krankheitserreger oder Toxine verhindern soll. Zudem kann es fehlerhafte oder entartete körpereigene Zellen erkennen und zerstören. Das immunologische Netzwerk des Menschen besteht aus verschiedenen Organen und Organsystemen, verschiedenen immunaktiven Zelltypen sowie extra- und intrazellulären Signalmolekülen und Signalkomplexen. Unterteilt wird das Immunsystem in das angeborene und erworbene Immunsystem. Pathologische Zustände, die kurz oder länger andauern können, reichen von den angeborenen Störungen der Autoinflammationserkrankungen bis hin zu den zahlreichen Autoimmunerkrankungen. Diese überschießenden Immunreaktionen werden durch verschiedenste Stimuli getriggert. Therapeutisch können bei überschießenden Reaktionen unspezifische Immunsuppressiva oder direkte Immunzellhemmer bzw. Antikörper eingesetzt werden.
Schlüsselwörter: Angeborene Immunität, Erworbene Immunität, Antikörper, Autoimmunität, Molekulare Mimikry
Abstract
The immune system is a human defense system that can be adapted to external conditions and is present ubiquitously throughout the organism. Its main purpose is to prevent damage caused by pathogens or toxins. In addition, it is capable of recognizing and destroying defective or degenerated endogenous cells. The immunological network in the body consists of various organs and organ systems, different immunoactive cell types as well as extra- and intracellular signaling molecules and signal complexes. The immune system is divided into the innate immune system and the acquired immune system. Pathological conditions, which may be short- or long-lasting, range from the congenital disorders of autoinflammation to the numerous autoimmune diseases, triggered by various stimuli. From a treatment perspective, nonspecific immunosuppressants or direct immune cell inhibitors or antibodies can be used for excessive reactions.
Keywords: Immunity, innate; Immunity, adaptive; Antibodies; Autoimmunity; Molecular mimicry
Lernziele
Nach Lektüre dieses Beitrags
können Sie die verschiedenen Komponenten des Immunsystems benennen.
können Sie die Mechanismen des angeborenen und erworbenen Immunsystems nachvollziehen.
können Sie beurteilen, warum es bei Fehlfunktionen des Immunsystems zu überschießenden Immunreaktionen kommen kann.
können Sie die Begriffe Autoinflammation und Autoimmunität erklären und unterscheiden.
können Sie die Zielstrukturen der immunsuppressiven Medikamente benennen.
Einleitung
Unabhängig davon, welche Erkrankung diagnostiziert und in der internistischen Praxis behandelt wird: Das Immunsystem mit seinen zahlreichen und hochvariablen Effektorzellen und -molekülen wird diesen Prozess konstant und aktiv begleiten, sei es durch Mithilfe bei der Abwehr von Erregern oder durch die pathologische Aktivierung des angeborenen oder erworbenen Immunsystems. In jedem Fall ist die Kenntnis der immunologischen „Mitspieler“
Immunologische „Mitspieler“
essenziell für das Verständnis der immunologischen Vorgänge und der hieraus resultierenden therapeutischen Möglichkeiten.
Fallbeispiel
Eine Sportstudentin stellt sich bei Ihnen vor, die ohne klinische Symptome, Infektzeichen oder Inflammationsparameter über eine zunehmende und objektiv messbare Leistungsminderung klagt. Zwei Laborwerte sind pathologisch, einer davon ein immunologischer. Sie setzen ein mildes Immunsuppressivum (ein früheres Malariamedikament) ein und die Patientin zeigt eine Vollremission aller Symptome. Wie könnte die Diagnose lauten? Vier Jahre später ist sie Sportlehrerin und fährt mit ihrer Klasse in das Skischullandheim bei bestem Wetter und Tiefschnee. In den letzten beiden Tagen und nach ihrer Rückkunft zeigt sie an den lichtexponierten Hautarealen schmerzende exanthematöse Veränderungen ohne wesentliche Abheilungstendenz und wiederum einen ähnlichen Leistungsverlust. Sie stellt sich wiederum bei Ihnen vor und fragt, ob es sich hierbei um dieselbe oder eine andere Erkrankung handelt? Zwei immunologische Laborparameter geben Ihnen die Antwort und nach einer immunsuppressiven Behandlung erreichen Sie wieder eine Vollremission. Wie könnte die Diagnose lauten? Zwei Jahre später hat die Patientin nach einer längeren Zugfahrt spontan eine tiefe Beinvenenthrombose und fragt Sie erneut, ob das mit den Vorerkrankungen zusammenhängen könnte. Sie bestimmen einen immunologischen Laborwert und geben ihr eine Antwort, wie könnte diese lauten?
Aufbau des Immunsystems
Das Immunsystem (von lateinisch immunis = unbestimmt, frei) ist ein den äußeren Gegebenheiten anpassbares und nahezu ubiquitär vorhandenes Abwehrsystem des Menschen, das vor allem Schädigungen durch Krankheitserreger
Krankheitserreger
verhindern soll. Zudem ist es in der Lage, fehlerhafte oder entartete körpereigene Zellen
Körpereigene Zellen
zu erkennen und zu zerstören. Das immunologische Netzwerk im Körper besteht aus
solitären Organen (z. B. Milz),
disseminierten Organen (Lymphknoten),
verschiedenen Zelltypen (z. B. Lymphozyten) sowie
- extra- und intrazellulären Signalmolekülen und Signalkomplexen, beispielsweise
- Zytokinen,
- Inflammasomen und
- „neutrophil extracellular traps“.
Unterteilt wird das Immunsystem in das ab der Geburt jederzeit verfügbare angeborene und das sich über das gesamte Leben entwickelnde und erneuernde erworbene Immunsystem. Das adaptive Immunsystem ersetzt nach der Reifung nicht das angeborene Immunsystem, sondern die verschiedenen Bestandteile des Immunsystems unterstützen sich stets gegenseitig.
Angeborenes Immunsystem
Die angeborene Immunantwort ist die unmittelbare Reaktion
Unmittelbare Reaktion
des Immunsystems auf als fremd erkannte Zellen, Oberflächenmoleküle und dem Organismus gefährliche lösliche Moleküle. Im Unterschied zur adaptiven Immunantwort ist die Struktur der beteiligten Proteine im Genom individuell festgelegt. Die Reaktion des angeborenen Immunsystems mit dessen Vielzahl von Zelltypen und löslichen Faktoren ist notwendigerweise schnell und effizient. Nur Minuten nach dem Eindringen werden die meisten Erreger erkannt und angegriffen, und bereits nach wenigen Stunden sind sie im Normalfall vollständig neutralisiert.
Erworbenes (adaptives) Immunsystem
Die spezifische oder adaptive Immunabwehr entwickelte sich im Laufe der Wirbeltierevolution später als die angeborene Immunabwehr. Ihre Hauptfunktion besteht in der immunologischen Variabilität
Immunologische Variabilität
gegenüber im Lebensraum ständig wechselnden Erregern und Toxinen, wofür sie aber deutlich längere Reaktionszeiten von bis zu 14 Tagen benötigt. In diesem Zeitraum sind die Zellen der adaptiven Immunabwehr in der Lage, spezifische Oberflächenstrukturen (Antigene) der Fremdkörper zu erkennen, weitere spezifische zelluläre Abwehrmechanismen zu aktivieren und Antikörper zu bilden.
Merke
Nach Ausreifung des angeborenen Immunsystems arbeitet dieses während des ganzen Lebens mit dem erworbenen Immunsystem zusammen.
Die wichtigsten zellulären Komponenten sind hierbei die antigenpräsentierenden Zellen
Antigenpräsentierende Zellen
(z. B. dendritische Zellen), welche die Erreger aufnehmen, verarbeiten und den Abwehrzellen „zeigen“. Daneben spielen T‑Lymphozyten
T‑Lymphozyten
, welche die zellvermittelte Immunantwort gewährleisten, und B‑Lymphozyten
B‑Lymphozyten
, die für die humorale Immunität, das heißt die Antikörperbildung verantwortlich sind, eine entscheidende Rolle. Für den immunologischen Langzeitschutz sorgen die langlebigen B‑Zellen, die sogenannten Plasmazellen
Plasmazellen
, die bei erneutem Kontakt mit dem Krankheitserreger in noch schnellerer Reaktionszeit eine entsprechende Abwehrreaktion garantieren. Alle diese Mechanismen werden regelhaft auch für die verschiedenen Tot- und Lebendimpfungen genutzt.
Allergien
Eine Besonderheit des erworbenen Immunsystems ist die Allergie (von altgriechisch allos = fremd; ergon = Reaktion; Fremdreaktion), die überschießende Abwehrreaktion
Überschießende Abwehrreaktion
des Immunsystems auf körperfremde, eigentlich harmlose Umweltstoffe, die Allergene. Die allergische Reaktion, die meist durch Eosinophile
Eosinophile
und Immunglobulin E
Immunglobulin E
(IgE) vermittelt wird, richtet sich mit ihren Effektormolekülen (IgE, Histamin) vor allem gegen Lunge, Verdauungstrakt, Haut, Schleimhaut oder hämatologische Antigene. Die allergischen Reaktionen können leicht verlaufen, unbehandelt aber auch letal enden. Unterschieden werden drei „Früh“-Allergietypen von einem Spättyp.
Typ-I-Allergie.
Bei der am häufigsten auftretenden Typ-I-Allergie (Soforttyp, anaphylaktischer Typ) werden vermittelt durch IgE-Antikörper Entzündungsmediatoren
Entzündungsmediatoren
, wie Histamin und Prostaglandine, aus basophilen Granulozyten und Mastzellen freigesetzt. Die hierdurch hervorgerufene kutane oder systemische Entzündungsreaktion erfolgt innerhalb von Sekunden bis Minuten, eine nachfolgende Reaktion ist aber auch nach einigen Stunden möglich (verzögerte Sofortreaktion). Typische Entitäten der Typ-I-Allergie sind
das allergische Asthma,
Nahrungs- und Arzneimittelallergien sowie
der anaphylaktische Schock.
Typ-II-Allergie.
Bei der Typ-II-Allergie bilden sich innerhalb eines halben Tages Immunkomplexe
Immunkomplexe
aus membranständigen Antigenen (zelluläre Oberflächenantigene oder Fremdstoffe wie Medikamente) und Immunglobulin-G(IgG)- oder Immunglobulin-M(IgM)-Antikörpern. Nachfolgend kommt es zur Aktivierung des Komplementsystems
Komplementsystem
und zur Zytolyse
Zytolyse
. Klinisch wichtig sind hierdurch bedingte Zytopenien
Zytopenien
aller blutbildenden Reihen und Transfusionsreaktionen.
Typ-III-Allergie.
Charakteristikum der Typ-III-Allergie (Immunkomplextyp) ist ebenfalls eine Immunkomplexbildung aus IgG- und IgM-Antikörpern und den verschiedensten Allergenen. Hierdurch werden ebenfalls Komplementfaktoren aktiviert (C3a, C5a), gefolgt von einer Phagozytose
Phagozytose
der Immunkomplexe und Freisetzung zell- und gewebeschädigender Enzyme, wie Kollagenasen, Elastase und Myeloperoxidase. Diese Reaktion tritt ebenfalls nach 6–12 h ein. Beispiele sind die allergische Vaskulitis und die exogen-allergische Alveolitis.
Typ-IV-Allergie (Spättyp).
Der Spättyp (auch Typ-IV-Allergie genannt) ist eine zelluläre Reaktion
Zelluläre Reaktion
durch spezifisch sensibilisierte T‑Zellen. Hierbei werden Lymphokine
Lymphokine
aus sensibilisierten T‑Lymphozyten freigesetzt, es kommt zur Chemotaxis und Aktivierung von Makrophagen und mononukleären Zellen sowie nachfolgend zu einer heftigen Entzündungsreaktion
Heftige Entzündungsreaktion
. Nach 12–72 h treten dann Entitäten wie das allergische Kontaktekzem oder Arzneimittelexantheme auf, auch die Transplantatabstoßung
Transplantatabstoßung
folgt diesem Mechanismus.
Effektorzellen
Die wichtigsten Bestandteile des angeborenen und erworbenen Immunsystems sind hochmobile Effektorzellen
Hochmobile Effektorzellen
, wie Granulozyten oder natürliche Killerzellen (NK-Zellen). Bei Bedarf wandern neutrophile Granulozyten durch chemotaktische Reize aus dem Blutgefäß in das bedrohte Gewebe ein. Sie sezernieren dann vor allem proteolytische Enzyme
Proteolytische Enzyme
. Neutrophile Granulozyten, Monozyten/Makrophagen und dendritische Zellen können durch Phagozytose den Erreger selbst neutralisieren oder durch die Produktion von Immunmodulatoren
Immunmodulatoren
und Zytokinen die Immunreaktion des Organismus steuern und weitere Abwehrzellen zum Ort der Entzündung locken.
Neutrophile Granulozyten
Neutrophile Granulozyten machen in der Regel mehr als 50 % der Leukozyten aus. Entscheidend ist ihre Mobilität
Mobilität
und Effektivität durch die Inhaltsstoffe der zytotoxischen Granula
Zytotoxische Granula
. Aktiviert werden die Granulozyten durch Zytokine, die am Ort der Infektion gebildet werden. Nach Einwanderung in das betroffene Gewebe werden die Inhaltsstoffe der Granula freigesetzt, unter anderem saure Hydrolasen, Defensine (30 % des Inhalts), Myeloperoxidase und Proteasen, wie Elastase, Kollagenase, Neuraminidase und Cathepsin G. Nach Lyse der Bakterien durch diesen aggressiven Mix werden diese dann durch Phagozytose eliminiert.
Eosinophile Granulozyten
Eosinophile Granulozyten machen etwa 3–5 % der Granulozyten aus. Ihren Namen beziehen sie vom Farbstoff Eosin, mit dem sie angefärbt werden können. Auch Eosinophile sind zur Chemotaxis befähigt, enthalten in ihren Granula basische Proteine
Basische Proteine
(unter anderem Enzyme) und können diese durch Exozytose nach Stimulation durch Antikörper der IgE-Klasse freisetzen, vor allem zur Parasitenabwehr
Parasitenabwehr
.
Basophile Granulozyten
Basophile Granulozyten (< 2 %) besitzen Granula, die multifunktionale Moleküle wie Heparin enthalten. Daneben bilden sie toxische Mediatoren wie Histamin
Histamin
und den plättchenaktivierenden Faktor. Wichtige Funktionen des Histamins, das auch von Mastzellen produziert wird, sind dessen Mitwirkung an der Abwehr körperfremder Stoffe, aber auch die Beteiligung an allergischen Reaktionen. Klinisch führt eine Histaminfreisetzung zu Jucken, Schmerz und Kontraktion der glatten Muskulatur, insbesondere des Bronchialbaums. Sie fördert auch die Permeabilität der Gefäßwände und nachfolgend die typischen Schwellungen an Haut und Schleimhäuten. Histamin wirkt zudem chemotaktisch auf verschiedene Abwehrzellen, unter anderem eosinophile Granulozyten und T‑Zellen.
Merke
Die wichtigste Funktion von Granulozyten ist die Freisetzung von fremdkörperdegradierenden Enzymen aus ihren Granula.
Makrophagen
Makrophagen reifen aus Monozyten
Monozyten
(mononukleäre Leukozyten) heran, phagozytieren vor allem Pathogene
Pathogene
und können die adaptive Immunabwehr aktivieren. Makrophagen spielen auch bei der Beseitigung von Toxinen
Toxine
(beispielsweise Teer aus Zigarettenrauch in der Lunge) eine entscheidende Rolle. Sie finden sich disseminiert in allen Geweben, erkennen und phagozytieren eingedrungene Erreger. Zusätzlich aktivieren die Makrophagen die adaptive Immunabwehr. Hierzu werden die phagozytierten Erreger intrazellulär in einzelne Peptide (Epitope
Epitope
) zerlegt und durch Haupthistokompatibilitätskomplex(MHC)-II-Moleküle auf der Oberfläche präsentiert. Die so präsentierten Antigene
Präsentierte Antigene
können mittels eines Schlüssel-Schloss-Prinzips von T‑Helferzellen erkannt werden, die daraufhin eine adaptive Immunantwort gegen den Erreger (oder Toxine) initiieren.
Natürliche Killerzellen
Natürliche Killerzellen sind ebenfalls Teil der angeborenen Immunabwehr. NK-Zellen können infizierte Zellen vernichten, ohne vorher mit dem Krankheitserreger selbst in Kontakt gekommen zu sein. Zur Erkennung von selbst und fremd erkennen NK-Zellen vor allem den MHC-I-Komplex
MHC-I-Komplex
, der auf nahezu allen gesunden Körperzellen vorkommt. Wird eine Zelle aber beispielsweise mit Viren infiziert oder entartet sie, so geht häufig der MHC-I-Komplex auf der Oberfläche verloren, die veränderte Zelle wird als fremd erkannt und die NK-Zell-Aktivierung führt zur Zerstörung.
Dendritische Zellen
Dendritische Zellen sind Zellen des Immunsystems, die sich aus Monozyten oder Vorläufern der T‑Zellen entwickeln. Sie können ebenfalls phagozytieren und stimulieren die adaptive Immunabwehr, indem sie die Antigene des phagozytierten Materials den T‑Lymphozyten präsentieren. Eine dendritische Zelle kann hierbei über tausend antigenspezifische T‑Zellen aktivieren. Dendritische Zellen sind auch an der Immuntoleranz
Immuntoleranz
gegenüber körpereigenen (Selbst‑)Antigenen beteiligt.
Merke
Makrophagen, NK-Zellen und dendritische Zellen bilden die erste Verteidigungslinie gegen Pathogene und den Organismus bedrohende Stoffe und Moleküle.
T-Lymphozyten
T‑Lymphozyten entstehen im Knochenmark aus den Lymphoblasten und wandern in den Thymus, wo sie ausreifen (T = thymusabhängig). T‑Zellen tragen an ihrer Oberfläche einen T‑Zell-Rezeptor
T‑Zell-Rezeptor
(TCR), mit dem jede T‑Zelle jeweils ein spezifisches Antigen erkennen kann. Im Gegensatz zu den B‑Lymphozyten, die auch variable Antigene erkennen, erkennen T‑Zellen nur Antigene, die im Komplex mit MHC-Molekülen auf den Oberflächen körpereigener Zellen präsentiert werden. Die T‑Zellen werden je nach Funktion weiter nach Oberflächenmarkern
Oberflächenmarker
unterschieden. Bei den T‑Helferzellen ist es das CD4-Protein
CD4-Protein
(„cluster of differentiation“), bei den zytotoxischen T‑Zellen das CD8-Protein
CD8-Protein
.
T-Helferzellen
T‑Helferzellen haben eine zentrale Rolle in Immunreaktionen. Sie erkennen über ihren spezifischen TCR Antigene, die ihnen von den antigenpräsentierenden Zellen (dendritische Zellen, Makrophagen, B‑Lymphozyten) auf MHC-II-Komplexen dargeboten werden. Die Botenstoffe der Helferzellen (Lymphokine) haben hierbei unterschiedliche Funktionen. Helferzellen vom Subtyp TH1
Subtyp TH1
verstärken die zelluläre Immunantwort, TH2-Zellen
TH2-Zellen
stimulieren die Produktion von (Auto‑)Antikörpern. Daneben existieren regulatorische T‑Zellen
Regulatorische T‑Zellen
(Treg-Zellen), die neben dem CD4-Rezeptor noch weitere Proteine an ihrer Oberfläche tragen (CD25/FoxP3).
Zytotoxische T-Zellen
Zytotoxische T‑Zellen können Antigene erkennen, die ihnen mithilfe der MHC-I-Komplexe präsentiert werden. Körpereigene Zellen, die von Krankheitserregern befallen sind, melden so ihren Zustand an das Immunsystem. Die zytotoxischen T‑Zellen heften sich dann mit ihren TCR an diese Körperzellen; bei diesem Vorgang spielt ihr CD8-Rezeptor
CD8-Rezeptor
eine entscheidende Rolle. Wenn sich noch weitere Rezeptoren, beispielsweise der CD28-Rezeptor
CD28-Rezeptor
der zytotoxischen T‑Zellen, an das fremde Eiweiß geheftet haben, beginnen die T‑Zellen, sich schnell zu vermehren, und schütten Substanzen aus, welche die infizierte oder krankhaft veränderte Zelle absterben lassen (sogenannte Apoptose
Apoptose
, programmierter Zelltod).
B-Lymphozyten
B‑Lymphozyten (B-Zellen, von Bursa Fabricii bei Vögeln oder „bone marrow“ bei Säugern) sind die entscheidende Zellart der kurz und lang wirksamen Antikörperproduktion
Antikörperproduktion
. Bei Säugetieren werden die B‑Zellen im Knochenmark gebildet. Bei der Reifung des Immunsystems im Kindesalter „lernen“ die B‑Zellen, selbst von fremd zu unterscheiden, die sogenannte klonale Selektion, obwohl dieser Begriff immunologisch nicht ganz korrekt ist und eigentlich Klonselektionstheorie
Klonselektionstheorie
(„clonal selection theory“) heißen müsste. Kurz zusammengefasst wird hierbei durch Kontakt mit einem Antigen aus Millionen von Vorläuferzellen nur derjenige Klon selektioniert, der das Antigen an seinen passenden Rezeptor binden kann (Schlüssel-Schloss-Prinzip mit einem MHC-Protein Klasse I oder Klasse II). Die für die Vielzahl von Variationen von notwendigen Antikörperspezifitäten geschieht aber auch während des späteren Lebens durch sogenannte somatische Mutation bzw. intramolekulare Rekombination der vielen codierenden Gene. Um die Immunbalance
Immunbalance
zu halten, führt sowohl die Über- als auch die Unterstimulation zu einem Absterben (Apoptose) der nicht benötigten B‑Zellen. Bindet eine B‑Zelle später an das Antigen, das zu ihrem Rezeptor passt, können die von aktivierten T‑Helferzellen produzierten Zytokine weitere B‑Zellen aktivieren. Diese aktivierten B‑Zellen können sich daraufhin zu antikörperproduzierenden Plasmazellen oder zu B‑Gedächtniszellen entwickeln. B‑Zellen können aber auch nicht zellgebundene Antigene erkennen, beispielsweise Toxine, und dagegen neutralisierende Antikörper bilden.
Merke
Lymphozyten sind der variable Teil des Immunsystems, sie sind hochmobil und agieren in der schnellen Antwort, wie auch im Langzeitschutz, unter anderem durch Bildung von (lang wirksamen) Antikörpern.
Effektormoleküle
Interleukine
Interleukine (IL; „zwischen den Leukozyten wirkend“) sind körpereigene Botenstoffe aus der Gruppe der Zytokine, die von den Zellen des Immunsystems gebildet werden. Die Durchnummerierung von IL‑1 bis über -40 ist nicht ganz konstant, da einige Zytokine, wie Tumor-Nekrose-Faktor (TNF) oder verschiedene Adipokine, die ebenfalls Signale zwischen Immunzellen transportieren, einer anderen Nomenklatur folgen. Die meisten IL stimulieren aber Leukozyten zu Reifung, Teilung und Wachstum, letztendlich bedingen sie deren Aktivierung. Auf der anderen Seite gibt es sinnvollerweise auch dämpfende Interleukine
Dämpfende Interleukine
, da das Immun- bzw. Entzündungsgeschehen ja auch physiologisch wieder „abgestellt“ werden muss, hierzu zählen unter anderem IL-10, IL-11 und konzentrationsabhängig IL‑2 und IL‑4.
Antikörper
Neben den immunologischen Botenstoffen, in der Regel Zytokinen und Chemokinen, sind vor allem Antikörper für die Immunabwehr zuständig. Ein typischer IgG-Antikörper hat die Form eines Y, wobei der „obere“ Anteil variabel ist und an das Antigen bindet, der „untere“ an Zellen und Gefäße binden und so die Immunantwort weiter aktivieren kann. Physiologisch haben Antikörper mehrere Funktionen – zum einen die Bindung und funktionelle Neutralisierung
Funktionelle Neutralisierung
von nicht körpereigenen oder entarteten Zellen und schädlichen Agenzien (Proteine, Zucker, Toxine etc.), zum anderen die sogenannte Opsonisierung
Opsonisierung
, die „Sichtbarmachung“ des Antigens für phagozytierende Zellen. Zusätzlich wird hierbei das Komplementsystem aktiviert, das dann einen Membranangriffskomplex
Membranangriffskomplex
bildet, der die Zellmembranen von Pathogenen perforiert und so unschädlich macht.
Komplementsystem
Das Komplementsystem hat zusätzlich die Aufgabe, Proteasen
Proteasen
zu bilden, die einen Erreger irreversibel schädigen können. Dazu kommen Anaphylatoxine
Anaphylatoxine
, die gefäßerweiternd wirken und die (physiologisch notwendige) Entzündungsreaktion und Chemotaxis von Immunzellen weiter unterstützen.
Merke
Die wichtigsten löslichen Komponenten des Immunsystems sind Zytokine, Antikörper und das Komplementsystem.
Fehlfunktionen: angeboren und erworben
Autoinflammation
Autoinflammation ist eine durch das angeborene Immunsystem getriggerte Entzündungsreaktion, die in der Regel eine genetische Grundlage
Genetische Grundlage
hat, aber durch externe Trigger wie Infektionen oder Noxen aktiviert werden kann. Durch die nachfolgende Freisetzung von Entzündungsmolekülen kommt es häufig zu periodischen Fieberschüben
Periodische Fieberschübe
, deshalb wurde der Begriff Autoinflammation auch erstmals in den 1990er-Jahren nach Charakterisierung der ersten periodischen Fiebersyndrome eingeführt. Weitere Erkrankungen mit autoinflammatorischen Aspekten und geringeren genetischen Anteilen reichen von der juvenilen Arthritis (Morbus Still) bis zur Gicht, da auch Harnsäurekristalle das zentrale Steuerungsmolekül – das Inflammasom – zur Ausschüttung von Zytokinen stimulieren können.
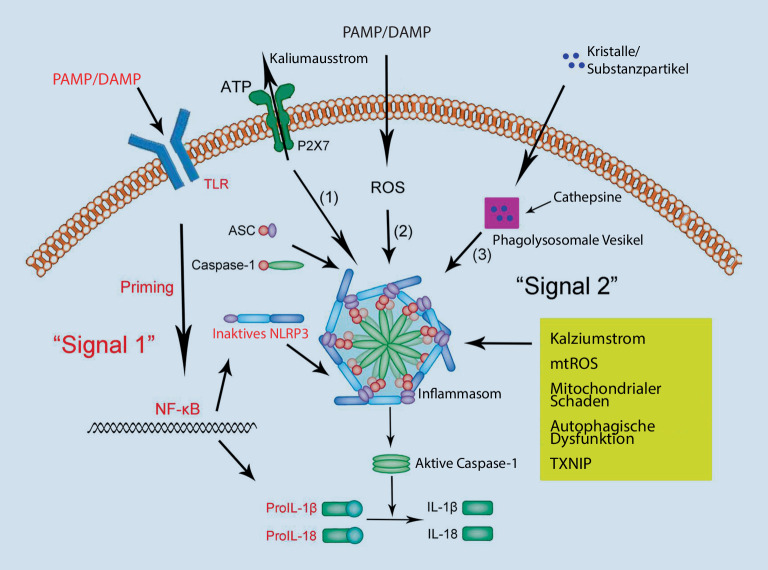
Inflammasom
Inflammasomen sind Multiproteinkomplexe des angeborenen Immunsystems, die sich im Zytosol befinden und Entzündungsreaktionen steuern. Das wichtigste sezernierte Zytokin ist das proinflammatorische Interleukin-1β
Interleukin-1β
(IL-1β). Daneben wird ein weiteres Molekül, Gasdermin
Gasdermin
, aktiviert, das den proinflammatorischen Zelltod, die Pyroptose
Pyroptose
, induziert. Inflammasomen werden durch verschiedene Oberflächenrezeptoren des angeborenen Immunsystems, die sogenannten „pattern recognition receptors“ (PRR
PRR
), aktiviert, die verschiedene pathogenassoziierte molekulare Muster („pathogen-associated molecular patterns“ [PAMP
PAMP
]) oder die Zelle bedrohende Moleküle („danger-associated molecular patterns“ [DAMP
DAMP
]) erkennen können. Diese verschiedenen Inflammasomrezeptoren aktivieren in einer Enzymkaskade Caspase‑1
Caspase‑1
, die dann die proinflammatorischen Zytokine IL-1β und Gasdermin freisetzt. Ein kürzlich identifiziertes Inflammasom ist „NLR family pyrin domain-containing 3“ (NLRP3
NLRP3
; auch Cryopyrin genannt), das durch eine Vielzahl an Stimuli aktiviert werden kann (Abb. 1). Hierzu gehören verschiedene Kristalle (Harnsäurekristalle, Dioxide, Aluminiumhydroxid) sowie bakterielle und virale Komponenten.
Ungebremst führt die Inflammasomaktivierung zu entzündlichen Systemerkrankungen
Entzündliche Systemerkrankungen
, geprägt durch Fieber, Hautausschlag, Arthritiden und Serositiden. Auch bei Unreife des erworbenen Immunsystems kann eine Inflammasomerkrankung den Organismus schwer schädigen. Ein Syndrom ist die inflammatorische Multisystemerkrankung des Neugeborenen („neonatal onset multisystem inflammatory disease“ [NOMID
NOMID
]). Aufgrund der bekannten Funktion von IL‑1 als Steuerungsmolekül kann die antagonisierende Therapie mit dem Interleukin-1-Rezeptor-Antagonisten Anakinra zu einer Normalisierung der Symptome führen.
Die Interferonopathien
Interferonopathien
sind eine Gruppe genetisch bedingter seltener Erkrankungen, die durch eine Fehlfunktion des angeborenen Immunsystems hervorgerufen werden. Die Interferone IFN‑α und IFN‑β werden als wesentliche Effektorzytokine der Immunantwort auf Viren und andere intrazelluläre Erreger hierbei massiv überstimuliert. Diese Aktivierung der Interferonsignalkaskade
Interferonsignalkaskade
resultiert dann in überschießenden Entzündungsprozessen sowie dem Verlust der Immuntoleranz. Das klinische Spektrum ist sehr breit und sowohl durch Autoinflammation als auch durch Autoimmunität gekennzeichnet. Die bekannteste Interferonopathie ist das Aicardi-Goutières-Syndrom
Aicardi-Goutières-Syndrom
(AGS), eine systemisch entzündliche Erkrankung, die sich im Säuglingsalter als Enzephalopathie mit Dystonie und Krämpfen manifestiert und von Fieberschüben begleitet wird. Das AGS ähnelt in vielem dem systemischen Lupus erythematodes, der inzwischen auch in die Interferonopathiefamilie aufgenommen wurde. Beide Erkrankungen können mit kälteinduzierten kutanen entzündlichen Läsionen der Akren, mit Arthritiden, antinukleären Antikörpern oder Lymphopenie einhergehen.
Merke
Als Autoinflammation bezeichnet man eine genetisch bedingte pathologisch überschießende Entzündungsreaktion, die meist nach bestimmten Stimuli rezidivierend auftritt und in schweren Organschäden resultieren kann.
Autoimmunität
Kommt es nach der Neutralisation und Beseitigung eines Erregers oder eines Fremdkörpers nicht zu einer Drosselung oder Beendigung der Immunantwort durch regulatorische T‑Zellen oder hemmende Zytokine (wie oben beschrieben), kann es zu einer protrahierten oder sogar überschießenden Entzündungs- oder Immunantwort kommen, die dann sekundär Gewebe oder Organe schädigt. Ein aktuelles Beispiel für eine überschießende Entzündungsreaktion ist die Hyperinflammation
Hyperinflammation
bei einer „coronavirus disease 2019“ (COVID-19
COVID-19
).
Die Autoimmunität ist einer der wichtigsten pathogenen Vorgänge, die (entzündlichen) Autoimmunerkrankungen
Autoimmunerkrankungen
zugrunde liegen. Autoimmunerkrankungen können alle Lebewesen mit entwickeltem Immunsystem betreffen, wobei sie (ohne Therapie) in der Regel letal sind. Ohne lebensrettendes synthetisches Schilddrüsenhormon wäre auch die blandeste Hashimoto-Thyreoiditis nicht mit dem Leben vereinbar. Viele Autoimmunerkrankungen sind daher durch die „überlange“ Lebensdauer des modernen Menschen bedingt – eine überlebenskompatible Psoriasis kann bei Tieren auftreten, eine rheumatoide Arthritis und die meisten entzündlichen Darmerkrankungen wurden bei Säugern dagegen noch nicht nachgewiesen. Die zentralen Effektormoleküle der Autoimmunität, die Autoantikörper
Autoantikörper
, können hierbei am gleichen Organ destruktiv, unter anderem beim Morbus Hashimoto, oder auch (zunächst) stimulierend wirken, etwa beim Morbus Basedow. Viele Autoimmunerkrankungen sind bei Frauen häufiger oder dominanter ausgeprägt als bei Männern, was teils hormonell und teils genetisch bedingt ist. Prototyp aller Autoimmunerkrankungen ist der systemische Lupus erythematodes, gefolgt von vielen Kollagenosen und Vaskulitiden. Ein zentraler Mechanismus für die Entstehung von Autoimmunität ist die molekulare Mimikry.
Merke
Als Autoimmunität wird der nicht durch den Organismus selbst limitierbare Angriff des Immunsystems auf körpereigene Moleküle, Zellen und Oberflächen bezeichnet, der je nach Zielorgan in bestimmten organspezifischen oder systemischen Erkrankungsbildern resultiert. Autoantikörper sind die wichtigsten Effektormoleküle.
Molekulare Mimikry
Die molekulare Mimikry beruht darauf, dass die Bestandteile höherer Lebewesen von „einfacheren“ wie Viren und Bakterien abstammen bzw. dass deren Oberflächenantigene strukturell zum Teil denen der höheren ähneln. Dies führt im Normalfall (geringe Antigenkonzentration bei wenigen, nicht bedrohlichen Erregern) dazu, dass der Wirtsorganismus gegen diese „eigenen“ Moleküle keine Antikörper bildet, die Immuntoleranz aufrechterhält und nicht nutzlos Energie für eine massive Aktivierung des Immunsystems bereitstellt. Falls jedoch selbstreaktive B‑ und T‑Zellen zu sehr stimuliert werden und Autoantikörper in größerer Menge bilden, können diese an Mimikry-Moleküle binden und die oben angegebenen Entzündungs- und Destruktionsmechanismen aktivieren. Da die körpereigenen „Mimikry-Moleküle“ nicht eliminiert werden können, solange das Organ existiert, kommt es zu einem protrahierten selbstverstärkenden Mechanismus. Ein infektiologisches Beispiel ist die Chagas-Krankheit
Chagas-Krankheit
. Die Trypanosomen führen zu einer protrahierten Entzündung des Herzmuskels (Myokarditis) durch die Immunreaktion gegen das wirtseigene Myosin. Ein toxikologisches Beispiel ist Zigarettenrauch
Zigarettenrauch
, der in der Lunge zur Citrullinierung von Oberflächenproteinen führt, wobei dann im Falle der rheumatoiden Arthritis
Rheumatoide Arthritis
kontinuierlich Antikörper gegen citrullinierte Peptide gebildet werden. Auch für den Morbus Crohn
Morbus Crohn
, der ebenfalls bei Rauchern aktiver verläuft, wird dieser Zusammenhang vermutet.
Merke
Die molekulare Mimikry ist eine der Hauptursachen der Autoimmunität.
Übergreifend: „extracellular traps“
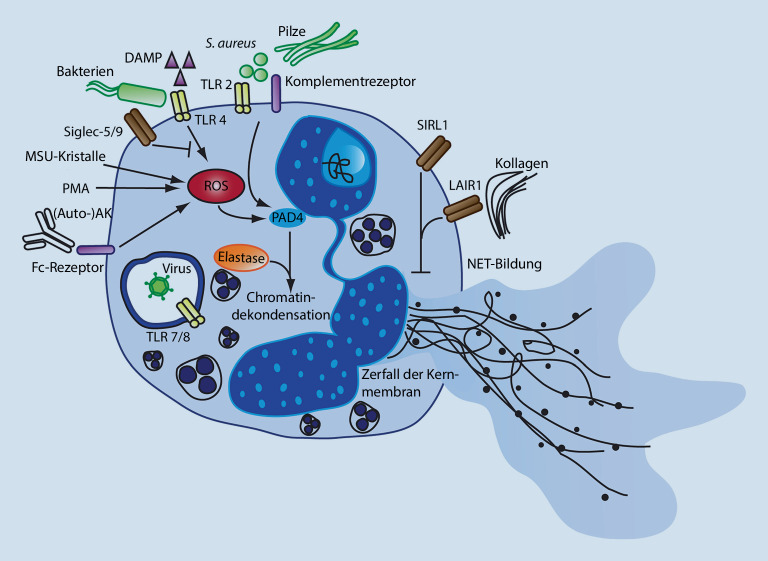
Die „neutrophil extracellular traps“ (NET; „neutrophile extrazelluläre Fallen“), die erst vor etwa 15 Jahren nachgewiesen wurden, sind immunologisch aktive extrazelluläre Faserverbände
Extrazelluläre Faserverbände
, die Pathogene binden und hauptsächlich aus der DNA neutrophiler Granulozyten bestehen. Bei Aktivierung durch Pathogene sezernieren hierbei Neutrophile granuläre Proteine und Chromatin
Chromatin
, die sich dann extrazellulär zu einer faserigen Matrix verbinden. Hierin verfangen sich Pathogene, vor allem Bakterien und Pilze, und werden durch antimikrobielle Proteine
Antimikrobielle Proteine
(Elastase, Myeloperoxidase, Histone und viele andere), die an die nukleäre DNA gebunden sind, neutralisiert. Dieser Prozess ist unabhängig von der phagozytischen Aktivität der Abwehrzellen. NET finden sich nicht nur im Gewebe, sondern zirkulieren auch im Blut. Die intravaskuläre NET-Bildung
Intravaskuläre NET-Bildung
ist aber streng kontrolliert. Die Aktivierung wird unter anderem durch Thrombozyten reguliert, die den Toll-like-Rezeptor 4 (TLR-4) des angeborenen Immunsystems exprimieren. Die Thrombozyten werden durch zirkulierende Pathogene aktiviert, binden dann an Neutrophile und stimulieren die Bildung von NET.
Bei überschießender Bildung von NET kommt es dahingegen durch den Überschuss an zellschädigenden Enzymen zur proinflammatorischen NETose
Proinflammatorische NETose
. Bezüglich Autoimmunerkrankungen sind vor allem beim systemischen Lupus erythematodes NET in die pathophysiologischen Vorgänge involviert, da die Exposition extrazellulärer Histonkomplexe in NET eine Hyperstimulation des Immunsystems mitbedingen kann (Abb. 2). In jüngerer Zeit wurde dieser Wirkmechanismus auch für Eosinophile gezeigt („eosinophil extracellular traps“; EETose
EETose
). Eosinophile spielen wahrscheinlich bei eosinophilen Erkrankungen wie der eosinophilen Granulomatose mit Polyangiitis, dem hypereosinophilen Syndrom und den Immunglobulin-G4(IgG4)-assoziierten Erkrankungen eine pathophysiologische Rolle.
Merke
Auch außerhalb der Zelle liegende Multimolekülkomplexe wie die NET können aktiv für und gegen den Organismus immunologisch aktiv werden.
Therapeutische Angriffspunkte
Entsprechend den inzwischen detaillierten Kenntnissen der Funktionen des angeborenen und erworbenen Immunsystems können je nach Bedarf breit oder selektiv die Effektorzellen und -moleküle gehemmt werden. Die Spanne reicht von den ubiquitär eingreifenden Kortikosteroiden
Kortikosteroide
über die verschiedenen Zellhemmer
Zellhemmer
wie Methotrexat, Leflunomid und Ciclosporin bis hin zu den spezifisch neutralisierenden Antikörpern
Neutralisierende Antikörper
gegen B-Zellen, Zytokinen sowie auf Antikörperbasis aufgebauten Kostimulationshemmern. Des Weiteren sind auch direkt wirkende Antikörper gegen Erreger wie das „severe acute respiratory syndrome coronavirus 2“ (SARS-CoV-2) im Einsatz. Weniger weit fortgeschritten ist der klinische Einsatz von Stimulatoren der natürlichen Gegenregulationsmechanismen wie Aktivatoren der regulatorischen T‑Zellen. Übertreibt man die Immunaktivierung, wie mit der gut gemeinten Stimulation durch Eigenbluttherapie oder pharmakologisch durch einen über CD28-Antikörper ausgelösten Zytokinsturm, kann man auch heftigste und teils letale Entzündungs- und Immunreaktionen auslösen.
Fortsetzung des Fallbeispiels.
Die Patientin hat einen für antinukleäre Antikörper (ANA) positiven systemischen Lupus erythematodes, der zunächst unter der Diagnose undifferenzierte Kollagenose mit Hydroxychloroquin in Remission gebracht wurde. Nach Erfüllung der Klassifikationskriterien sowie Nachweis von Doppelstrang-DNA und Histonantikörpern sprach er gut auf Azathioprin an. Später entwickelte sich eine Thrombose bedingt durch die Bildung von Kardiolipinantikörpern.
Fazit für die Praxis
Das angeborene und das erworbene Immunsystem arbeiten nach der Reifung lebenslang konstant zusammen, um Erreger und pathogene Stoffe möglichst schnell und effizient aus dem Organismus zu beseitigen.
Jede der verschiedenen zellulären oder molekularen Komponenten des Immunsystems hat ihre spezifische Rolle in den immunologischen Prozessen des Körpers.
Aberrante Reaktionen des Immunsystems können jederzeit und mit variabler Geschwindigkeit auftreten. Die Autoinflammation und ihre assoziierten Erkrankungen sind genetisch dominiert. Die Entwicklung einer Autoimmunerkrankung benötigt mehr äußere Einflüsse.
Zielstrukturen der immunsuppressiven Medikamente sind die Effektorzellen und Moleküle des Immunsystems.
CME-Fragebogen
Welche Zelle gehört nicht zum angeborenen Immunsystem?
T‑Zelle
B‑Zelle
Dendritische Zelle
Makrophage
Natürliche Killerzelle
Welches Effektormolekül ist immunsuppressiv?
Interleukin‑1
Interleukin‑6
Interleukin-10
Interleukin-18
Tumor-Nekrose-Faktor‑α
Welches Zytokin ist mit dem systemischen Lupus erythematodes assoziiert?
Interferon‑α
Interleukin‑1
Adiponektin
Interleukin-40
Makrophagenaktivierender Faktor
Welcher Molekülkomplex wird von Neutrophilen extrazellulär gebildet?
Inflammasom
Komplement
Toll-like-Rezeptor
NET
Autoantikörper
Welcher Begriff passt nicht zur Autoinflammation?
Inflammasom
„NLR family pyrin domain-containing 3“ (NLRP3)
Immunglobulin E (IgE)
Interferon
Caspase
Welche Zellen sind verantwortlich für das Langzeitimmungedächtnis?
Plasmazellen
Regulatorische T‑Zellen
Dendritische Zelle
Granulozyten
Natürliche Killerzellen
Welche Erkrankung gehört zu den autoinflammatorischen Erkrankungen?
Antiphospholipidsyndrom
Morbus Basedow
Morbus Hashimoto
Rheumatoide Arthritis
Gicht
Welche immundämpfenden Zellen sind die wichtigsten?
Regulatorische T‑Zellen
Regulatorische Makrophagen
Regulatorische dendritische Zellen
Regulatorische Eosinophile
Regulatorische Killerzellen
Welches Immunsuppressivum bindet an Zellen?
Interleukin-1(IL-1)-Rezeptor-Antikörper
Tumor-Nekrose-Faktor(TNF)-Antikörper
CD20-Antikörper
Interleukin-6(IL-6)-Antikörper
Interleukin-17(IL-17)-Antikörper
Welcher Begriff gehört nicht zum erworbenen Immunsystem?
Antikörper
Autoantikörper
Plasmazelle
Komplementsystem
Immunglobulin E (IgE)
Einhaltung ethischer Richtlinien
Interessenkonflikt
Gemäß den Richtlinien des Springer Medizin Verlags werden Autoren und Wissenschaftliche Leitung im Rahmen der Manuskripterstellung und Manuskriptfreigabe aufgefordert, eine vollständige Erklärung zu ihren finanziellen und nichtfinanziellen Interessen abzugeben.
Autoren
U. Müller-Ladner: A. Finanzielle Interessen: U. Müller-Ladner gibt an, dass kein finanzieller Interessenkonflikt besteht. – B. Nichtfinanzielle Interessen: Professur für Innere Medizin mit Schwerpunkt Rheumatologie, Justus-Liebig-Universität Gießen, Campus Kerckhoff, Benekestraße 2, 61231 Bad Nauheim, President Elect der Deutschen Gesellschaft für Innere Medizin.
Wissenschaftliche Leitung
Die vollständige Erklärung zum Interessenkonflikt der Wissenschaftlichen Leitung finden Sie am Kurs der zertifizierten Fortbildung auf www.springermedizin.de/cme.
Der Verlag
erklärt, dass für die Publikation dieser CME-Fortbildung keine Sponsorengelder an den Verlag fließen.
Für diesen Beitrag wurden vom Autor keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Shao BZ, Xu Z-Q, Han B-Z, Su D-F, Liu C. NLRP3 inflammasome and its inhibitors: a review. Front Pharmacol. 2015;6:262. doi: 10.3389/fphar.2015.00262. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Van Avondt K, Hartl D. Mechanisms and disease relevance of neutrophil extracellular trap formation. Eur J Clin Invest. 2018;48(Suppl. 2):e12919. doi: 10.1111/eci.12919. [DOI] [PubMed] [Google Scholar]
- 3.Peter HH, Pichler M, Müller-Ladner U. Klinische Immunologie. 3. Elsevier; 2012. [Google Scholar]
- 4.Murphy W, Casey C. Janeway Immunologie. 9. Wiesbaden: Springer Spektrum; 2018. [Google Scholar]
- 5.Bröker B, Schütt C, Fleischer B. Grundwissen Immunologie. Wiesbaden: Springer Spektrum; 2019. [Google Scholar]
- 6.Dragoni G, De Hertogh G, Vermeire S. The role of citrullination in inflammatory bowel disease: a neglected player in triggering inflammation and fibrosis? Inflamm Bowel Dis. 2021;27:134–144. doi: 10.1093/ibd/izaa095. [DOI] [PubMed] [Google Scholar]