Les cancers du sein et de la prostate sont les cancers les plus répandus au Canada; ils surviennent en effet chez environ 1 femme sur 8 et 1 homme sur 8, respectivement1. Le taux de survie prévu après 5 ans chez les patients atteints de l’un ou l’autre de ces cancers se situe à environ 90 %1. La thérapie endocrinienne est le fondement de la prise en charge de ces cancers hormonosensibles. Bien que les thérapies endocriniennes soient associées à un prolongement de la survie et du délai avant la progression de la maladie, les effets indésirables peuvent être lourds à porter et réduire l’observance2,3. Les médecins de première ligne jouent un rôle essentiel dans les soins des patients cancéreux et des survivants du cancer. Cet article effectue un survol de la thérapie endocrinienne, surtout des agents contre le cancer du sein et de la prostate, y compris des indications, des perles cliniques et des effets indésirables courants, et leur prise en charge.
Qu’est-ce que la thérapie endocrinienne?
La thérapie endocrinienne est utilisée pour traiter les cancers qui se servent des hormones ou des voies de signalisation hormonales pour croître ou survivre. Au niveau cellulaire, la signalisation endocrinienne dans les cellules cancéreuses stimule la prolifération cellulaire, réduit le temps disponible pour réparer l’ADN et augmente le risque de mutation4. La thérapie endocrinienne agit principalement en perturbant la signalisation endocrinienne, en bloquant la synthèse hormonale ou en ciblant les récepteurs hormonaux5,6. En contexte de traitement adjuvant, ces thérapies prolongent la survie globale et réduisent le risque de récidive du cancer, alors qu’en contexte métastatique, elles pourraient alléger le fardeau des symptômes7,8. Le type et la durée de la thérapie endocrinienne sont déterminés par le stade du cancer au diagnostic, les caractéristiques moléculaires, les indicateurs du pronostic, la génomique du cancer, la résistance endocrinienne et la tolérance aux effets toxiques.
La thérapie endocrinienne se compose de corticostéroïdes, d’hormones thyroïdiennes, d’analogues de la somatostatine et d’hormones reproductives. Les corticostéroïdes, fréquemment associés à la chimiothérapie pour rendre les 2 plus efficaces, sont utilisés pour le traitement des cancers hématologiques (c.-à-d. leucémies, lymphomes et myélomes multiples)5. Les hormones thyroïdiennes (lévothyroxine) sont utilisées pour inhiber la croissance de la thyroïde après une chirurgie ou la radiothérapie contre le cancer de la thyroïde, ou comme hormonothérapie substitutive après résection de la glande thyroïde9. Les analogues de la somatostatine (octréotide) sont au cœur du traitement des tumeurs neuroendocriniennes et sont utilisés surtout pour alléger le fardeau des symptômes associés au syndrome carcinoïde8. Finalement, et c’est là le sujet de cet article, les hormones reproductives sont fréquemment utilisées pour le traitement des cancers qui nécessitent des hormones mâles ou femelles pour croître, comme les cancers du sein et de la prostate.
Thérapie endocrinienne pour le cancer du sein
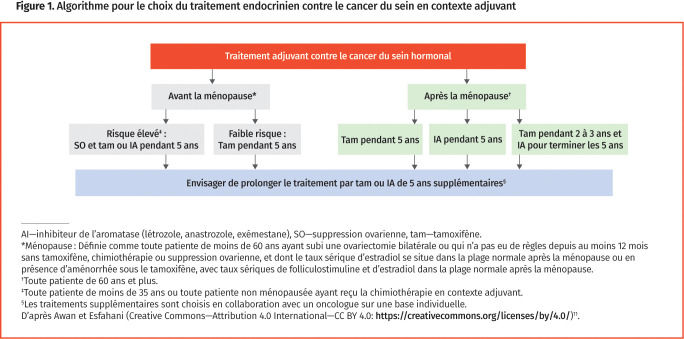
Plus de 75 % des cancers du sein sont nourris par les œstrogènes ou la progestérone10. Comparativement aux cancers du sein qui n’expriment pas de récepteurs hormonaux, les cancers qui expriment les récepteurs des œstrogènes ou les récepteurs de la progestérone sont habituellement associés à une meilleure survie11. La thérapie endocrinienne est une pierre angulaire du traitement adjuvant et du traitement en contexte métastatique des cancers du sein à récepteurs hormonaux positifs; elle est également parfois utilisée comme traitement néoadjuvant. Le choix du schéma endocrinien est habituellement déterminé par des facteurs cliniques, pathologiques et génétiques, y compris l’état ménopausique de la femme. Les principales thérapies endocriniennes du cancer du sein sont les modulateurs sélectifs des récepteurs des œstrogènes (p. ex. tamoxifène), les inhibiteurs de l’aromatase (p. ex. létrozole, anastrozole, exémestane) et la suppression ovarienne (c.-à-d. par agonistes de la gonadolibérine ou par chirurgie). En contexte de traitement adjuvant, le choix du schéma endocrinien est en plus déterminé par les catégories de risque faible ou élevé, les patientes de moins de 35 ans au diagnostic ou nécessitant la chimiothérapie adjuvante après la chirurgie étant jugées être à risque élevé (Figure 1)11. Les inhibiteurs des kinases dépendantes des cyclines 4 et des kinases dépendantes des cyclines 6 (p. ex. ribociclib, palbociclib), les agents de dégradation sélectifs des récepteurs œstrogènes (p. ex. fulvestrant) et les inhibiteurs de la mTOR (cible mammalienne de la rapamycine) (p. ex. évérolimus) sont d’autres traitements plus récents, surtout utilisés en contexte métastatique.
Figure 1.
Algorithme pour le choix du traitement endocrinien contre le cancer du sein en contexte adjuvant
Patientes non ménopausées. En contexte de traitement adjuvant chez les patientes non ménopausées à risque standard, le tamoxifène est l’agent de première intention recommandé à une dose orale de 20 mg par jour pendant un minimum de 5 ans11. Le traitement adjuvant par le tamoxifène pendant 5 à 10 ans est associé à une réduction absolue statistiquement significative de la mortalité par cancer du sein à 15 ans (moyenne [ET] 9,2 % [1 %])12,13. Chez les patientes non ménopausées à risque élevé de récidive, le tamoxifène est recommandé, ou un inhibiteur de l’aromatase, en plus de la suppression ovarienne suivant une discussion avec la patiente sur les risques et les bienfaits11.
Perle clinique : Vu le risque que la stimulation ovarienne induise la production d’œstrogènes, il faudrait éviter les inhibiteurs de l’aromatase en monothérapie chez les patientes non ménopausées. Chez les patientes à risque élevé, les inhibiteurs de l’aromatase peuvent être jumelés à la suppression ovarienne. La reprise des règles durant un traitement par inhibiteur de l’aromatase justifie la mesure du taux sérique d’estradiol et une demande de consultation urgente en oncologie.
Patientes ménopausées. En contexte de traitement adjuvant chez les patientes ménopausées, les inhibiteurs de l’aromatase sont la thérapie endocrinienne de choix pendant un minimum de 5 ans. Une dose quotidienne orale de 2,5 mg de létrozole, de 1 mg d’anastrozole ou de 25 mg d’exémestane peut être utilisée. Comparativement au tamoxifène, les inhibiteurs de l’aromatase sont associés à une réduction absolue statistiquement significative du risque de récidive à 10 ans (3,6 %) et à une augmentation de la survie globale (2,1 %)14.
Perle clinique : Une réduction des récidives du cancer du sein a été démontrée chez les patientes qui passent du tamoxifène à un inhibiteur de l’aromatase dans les deux premières années de la thérapie endocrinienne (2,0 %)14. Par conséquent, les femmes qui atteignent la ménopause après 2 ou 3 ans sous le tamoxifène devraient se voir proposer une substitution dans leur régime endocrinien pour des inhibiteurs de l’aromatase.
Durée de la thérapie endocrinienne. La durée de la thérapie endocrinienne adjuvante est habituellement de 5 ans14. Le prolongement jusqu’à 10 ans de la thérapie endocrinienne par le tamoxifène ou un inhibiteur de l’aromatase réduit encore plus le risque de récidive du cancer du sein chez les patientes à risque élevé14. Un oncologue doit peser minutieusement les bienfaits et les effets indésirables potentiels du traitement prolongé11.
Effets indésirables et prise en charge. Une très grande majorité de patientes subit des effets indésirables difficiles à tolérer, ce qui pousse quelque 30 % des patientes à observer leur traitement de manière sous-optimale ou à l’abandonner3. Le rôle du généraliste dans le dépistage actif et la prise en charge de ces effets indésirables est impératif pour alléger le fardeau des symptômes, optimiser l’observance et prévenir les complications rares, mais potentiellement graves11. Les bouffées de chaleur sont l’un des effets indésirables les plus souvent signalés par les patientes sous le tamoxifène; elles surviennent en effet chez presque 80 % d’entre elles15. La prise en charge repose sur la promotion des modifications du mode de vie (alimentation, vêtements, literie) et le recours à un inhibiteur sélectif de la recapture de la sérotonine ou d’un inhibiteur de la recapture de la sérotonine et de la noradrénaline11. Les inhibiteurs de l’aromatase causent des arthralgies douloureuses chez la moitié des patientes11. L’exercice physique régulier, la massothérapie et l’acupuncture aident à soulager ces effets indésirables; il peut également s’avérer utile de passer à un autre inhibiteur de l’aromatase11. L’ostéoporose découle aussi parfois du traitement par inhibiteur de l’aromatase; le traitement repose sur les suppléments de calcium et de vitamine D, et sur des ostéodensitométries régulières11. Le Tableau 1 présente un résumé des effets indésirables courants de la thérapie endocrinienne contre le cancer du sein, et leur prise en charge respective11.
Tableau 1.
Traitement endocrinien du cancer du sein : effets indésirables et prise en charge
| AGENT ENDOCRINIEN ET EFFETS INDÉSIRABLES |
PRISE EN CHARGE |
|---|---|
| Tamoxifène | |
|
|
|
|
|
|
|
|
|
|
| Inhibiteurs de l’aromatase | |
|
|
|
|
|
|
|
|
AINS—anti-inflammatoire non stéroïdien, IRSN—inhibiteur de la recapture de la sérotonine-noradrénaline, ISRS—inhibiteur sélectif de la recapture de la sérotonine, TEV—thromboembolie veineuse.
D’après Awan et Esfahani (Creative Commons—Attribution 4.0 International—CC BY 4.0: https://creativecommons.org/licenses/by/4.0/).11
Thérapie endocrinienne pour le cancer de la prostate
Environ 75 % des cancers de la prostate sont diagnostiqués à un stade précoce; les autres cas présentent une maladie nodale régionale ou métastatique au diagnostic1. Le traitement anti-androgénique est le principal traitement du cancer de la prostate et, depuis 1994, il a considérablement réduit le taux de mortalité qui y est associé1. Plus particulièrement, le traitement anti-androgénique est le premier traitement à action générale du cancer régional ou avancé, et il est associé à la radiothérapie comme traitement néoadjuvant, concomitant ou adjuvant dans les cas localisés ou localement avancés de cancer de la prostate16. Les agents thérapeutiques bloquent l’action ou la production d’androgènes dans l’organisme, ou ils en réduisent la production dans les testicules, ce qui ralentit la croissance des cellules cancéreuses17. La privation androgénique est assurée par des moyens chirurgicaux (orchidectomie) ou médicaux. Les traitements médicaux sont notamment l’ablation androgénique gonadale à l’aide d’agonistes de l’hormone lutéinisante (p. ex. leuprolide, triptoréline, goséréline) ou d’antagonistes de l’hormone lutéinisante (p. ex. dégarélix, rélugolix); d’antagonistes des récepteurs androgéniques (p. ex. bicalutamide, enzalutamide, apalutamide, darolutamide); et d’inhibiteurs de la synthèse des androgènes surrénaliens (acétate d’abiratérone, kétoconazole)18. La castration médicale est surveillée en évaluant le taux de testostérone en circulation. Le choix du traitement du cancer de la prostate dépend d’une multitude de facteurs, dont le stade et le grade du cancer au diagnostic, le risque de progression de la maladie, la survie attendue, les comorbidités et les antécédents familiaux, de même que les préférences du patient et le profil d’effets indésirables des traitements proposés16,17. En outre, puisque l’instauration d’un agoniste de l’hormone lutéinisante est associée à une poussée de testostérone, un antagoniste des récepteurs androgéniques est recommandé durant les 2 à 4 premières semaines du traitement16,18.
Chez les patients dont la maladie présente un risque intermédiaire à élevé, le traitement anti-androgénique associé à la radiothérapie a démontré qu’il pouvait prolonger la survie. Le traitement se poursuit habituellement pendant 4 à 6 mois dans les cas à risque intermédiaire, alors que les patients à risque élevé reçoivent un traitement anti-androgénique continu afin de traiter la maladie systémique occulte et de réduire le risque de récidive16,19. Le traitement anti-androgénique est le plus souvent utilisé dans les cas de cancer métastatique de la prostate, comme traitement intermittent ou continu19. Il vaut la peine de mentionner que l’abiratérone a démontré qu’il pouvait augmenter le taux de corticostimuline (ACTH) en raison d’une réduction de la production de cortisol, ce qui cause des effets indésirables substantiels en raison de l’excès de minéralocorticoïde (p. ex. hypertension, rétention liquidienne, hypokaliémie)20. Les glucocorticoïdes sont ajoutés à l’abiratérone pour réduire ces effets indésirables : 5 mg de prednisone orale deux fois par jour est la posologie standard16,20. Le Tableau 2 énumère les agents contre le cancer de la prostate, y compris leur mode d’action et leurs indications20.
Tableau 2.
Traitements du cancer de la prostate, modes d’action et indications
| CLASSE* | CIBLE | AGENT | MODE D’ACTION | INDICATIONS | EFFETS INDÉSIRABLES NOTABLES |
|---|---|---|---|---|---|
| Antagoniste des récepteurs non stéroïdiens des androgènes (première génération) | RA | Bicalutamide, flutamide, nilutamide | Inhibe de façon concurrentielle et réversible la liaison de la testostérone et de la DHT au domaine de liaison du RA | En association avec les agonistes de la GnRH dans les atteintes métastatiques | Bouffées de chaleur, douleur, infection, douleur abdominale |
| Antagoniste des récepteurs non stéroïdiens des androgènes (deuxième génération) | RA | Apalutamide, darolutamide, enzalutamide | Inhibe de façon concurrentielle et réversible la liaison de la testostérone et de la DHT au domaine de liaison du RA; et inhibe en aval la translocation du RA au noyau depuis le cytoplasme, recrute des coactivateurs, et se lie à l’ADN | CPRC, CPSCm, CPRCnm (en association avec le TAA) | Fatigue, hypertension, crises convulsives (enzalutamide), arthralgie, nausée, bouffées de chaleur |
| Inhibiteur de la biosynthèse des androgènes | Enzyme stéroïdienne CYP 17A1 (17α-hydroxylase et C17,20-lyase) | Abiratérone | L’acétate d’abiratérone (promédicament) est converti in vivo en abiratérone qui inhibe le CYP 17A1 exprimé dans les tumeurs des surrénales, des testicules et de la prostate | CPRCm, CPSCm (en association avec la prednisone et le TAA) | Hypokaliémie, hypertension, œdème, insuffisance surrénalienne, hépatotoxicité |
| Antagonistes de la GnRH | Récepteur de la GnRH | Dégarélix, rélugolix | Inhibe de façon concurrentielle et réversible les récepteurs de la GnRH dans l’hypophyse, ce qui bloque la libération de FSH et de LH | Cancer de la prostate avancé | Réaction au point d’injection (dégarélix), bouffées de chaleur, fatigue, prise pondérale, hépatotoxicité |
| Agonistes de la GnRH | Récepteur de la GnRH | Histréline, goséréline, leuprolide, triptoréline | Stimulation continue du récepteur de la GnRH qui entraîne une hausse initiale du taux de FSH, de LH, de testostérone et de DHT, suivie d’une réduction | Cancer de la prostate avancé (dont le CPRCm) | Douleurs généralisées, bouffées de chaleur et sudation, troubles gastro-intestinaux |
CPRC— cancer de la prostate résistant à la castration, CPSCm—cancer de la prostate métastatique sensible à la castration, CPRCnm—cancer de la prostate non métastatique résistant à la castration, CYP—cytochrome P450, DHT—5a-dihydrotestostérone, FSH—folliculostimuline, GnRH—gonadolibérine, LH—hormone lutéinisante, RA—récepteurs des androgènes, TAA—traitement anti-androgénique.
Les agents dans une classe donnée ne sont pas tous homologués pour toutes les indications de leur classe.
Reproduit de Desai et coll.20 avec la permission d’Oxford University Press pour le compte de l’Endocrine Society.
Perle clinique : Le traitement anti-androgénique n’est pas recommandé en monothérapie dans les cas de cancer de la prostate localisé, sauf en présence d’une contre-indication au traitement curatif local, comme des comorbidités ou un pronostic inférieur à 5 ans16.
Effets indésirables et prise en charge. Même si le traitement anti-androgénique a amélioré les résultats oncologiques, il est néanmoins associé à plusieurs effets indésirables incapacitants qui affectent la qualité de vie17–19. En retour, les soins aux patients sous traitement anti-androgénique sont optimisés par une approche multidisciplinaire qui inclue la collaboration active entre spécialistes et généralistes traitants18,19. Le traitement anti-androgénique peut avoir des effets indésirables sur divers systèmes et appareils, et toucher la santé des os, la fonction sexuelle et la santé mentale; il peut aussi entraîner la maladie cardiovasculaire et des conséquences métaboliques18,19. Le dépistage régulier et la prise en charge prompte des effets indésirables potentiels sont de première importance18. Le Tableau 3 présente les effets indésirables courants du traitement endocrinien du cancer de la prostate et leur prise en charge18.
Tableau 3.
Résumé des effets indésirables du traitement endocrinien du cancer de la prostate et de leur prise en charge
| COMPLICATION | SOMMAIRE DES ÉVÉNEMENTS | PRISE EN CHARGE |
|---|---|---|
| Maladie cardiovasculaire |
|
|
| Modification de la composition corporelle |
|
|
| Variation des paramètres métaboliques |
|
|
| Santé des os |
|
|
| Bouffées de chaleur | s.o. |
|
| Événements mammaires |
|
|
| Fonction cognitive |
|
|
| Fatigue et anémie | s.o. |
|
| Affaiblissement de la fonction sexuelle |
|
|
| Qualité de vie |
|
|
DE—dysfonction érectile, DMO—densité minérale osseuse, EP—embolie pulmonaire, GnRH—gonadolibérine, IMC—indice de masse corporelle, PDE5—phosphodiestérase 5, RT—radiothérapie, s.o.—sans objet, TAA—traitement anti-androgénique, TVP—thrombose veineuse profonde.
Reproduit avec la permission de Kokorovic et coll.18 ©2021 Canadian Urological Association ou ses concédants.
Conclusion
La thérapie endocrinienne est la pierre angulaire du traitement des cancers du sein et de la prostate. Bien qu’elles soient associées à un prolongement de la survie et à un risque réduit des récidives du cancer, les thérapies endocriniennes sont aussi associées à des effets indésirables pénibles sur les plans psychologiques et physique1,3,12–15,17,18. Les médecins de famille sont des fournisseurs essentiels de soins aux patients cancéreux et aux survivants du cancer : leur contribution au dépistage et à la prise en charge des effets indésirables liés à la thérapie endocrinienne est de la plus haute importance pour soutenir et optimiser la santé générale et la qualité de vie de ces patients. L’Encadré 1 fournit des ressources utiles pour guider les généralistes dans ce travail important18,21–25.
Encadré 1. Ressources utiles aux généralistes.
Cancer du sein
Evidence-based approaches for the management of side effects of adjuvant endocrine therapy in patients with breast cancer21 : https://www.sciencedirect.com/science/article/abs/pii/S1470204520306665
American Society of Clinical Oncology guideline. Neoadjuvant chemotherapy, endocrine therapy, and targeted therapy for breast cancer22 : https://pubmed.ncbi.nlm.nih.gov/33507815/
Cancer de la prostate
BCGuidelines.ca. Medications for the management of prostate cancer side effects in primary care23 : https://www2.gov.bc.ca/assets/gov/health/practitioner-pro/bc-guidelines/prostatecancer-part2_appendixc.pdf
Guide de pratique de l’Association des urologues du Canada sur le traitement par privation androgénique : manifestations indésirables et stratégies de prise en charge18: https://www.cua.org/system/files/Guideline-Files/7355French_v2.pdf
Action Cancer Ontario. Traitement des symptômes et des effets secondaires24: https://www.cancercareontario.ca/fr/symptom-management
Effets cardiovasculaires des traitements endocriniens des cancers du sein et de la prostate
American Heart Association. Impact of hormonal therapies for treatment of hormone-dependent cancers (breast and prostate) on the cardiovascular system25 : https://www.ahajournals.org/doi/epub/10.1161/HCG.0000000000000082
Footnotes
Intérêts concurrents
Aucun déclaré
Cet article donne droit à des crédits d’autoapprentissage certifiés Mainpro+. Pour obtenir des crédits, allez à https://www.cfp.ca et cliquez sur le lien vers Mainpro+.
The English version of this article is available at https://www.cfp.ca on the table of contents for the April 2022 issue on page 271.
Références
- 1.Comité consultatif des statistiques canadiennes sur le cancer, Société canadienne du cancer, Statistique Canada, Agence de la santé publique du Canada . Statistiques canadiennes sur le cancer 2021. Toronto, ON: Société canadienne du cancer; 2021. Accessible à: https://cdn.cancer.ca/-/media/files/research/cancer-statistics/2021-statistics/2021-pdf-fr-final.pdf. Réf. du 29 janv. 2022. [Google Scholar]
- 2.Pilon D, LaMori J, Rossi C, Durkin M, Ghelerter I, Ke Xet al. Medication adherence among patients with advanced prostate cancer using oral therapies. Future Oncol 2022;18(2):231-43. Publ. en ligne du 3 nov. 2021. [DOI] [PubMed] [Google Scholar]
- 3.Berkowitz MJ, Thompson CK, Zibecchi LT, Lee MK, Streja E, Berkowitz JSet al. How patients experience endocrine therapy for breast cancer: an online survey of side effects, adherence, and medical team support. J Cancer Surviv 2021;15(1):29-39. Publ. en ligne du 17 août 2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Cleator SJ, Ahamed E, Coombes RC, Palmieri C. A 2009 update on the treatment of patients with hormone receptor-positive breast cancer. Clin Breast Cancer 2009;9(Suppl 1):S6-17. [DOI] [PubMed] [Google Scholar]
- 5.Hormone therapy to treat cancer. Bethesda, MD: National Cancer Institute. Accessible à : https://www.cancer.gov/about-cancer/treatment/types/hormone-therapy. Réf. du 8 janv. 2022. [Google Scholar]
- 6.Sleightholm R, Neilsen BK, Elkhatib S, Flores L, Dukkipati S, Zhao Ret al. Percentage of hormone receptor positivity in breast cancer provides prognostic value: a single-institute study. J Clin Med Res 2021;13(1):9-19. Publ. en ligne du 12 janv. 2021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Cao L, Sugumar K, Keller E, Li P, Rock L, Simpson Aet al. Neoadjuvant endocrine therapy as an alternative to neoadjuvant chemotherapy among hormone receptor-positive breast cancer patients: pathologic and surgical outcomes. Ann Surg Oncol 2021;28(10):5730-41. Publ. en ligne du 3 août 2021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Hofland J, Herrera-Martínez AD, Zandee WT, de Herder WW. Management of carcinoid syndrome: a systematic review and meta-analysis. Endocr Relat Cancer 2019;26(3):R145-56. [DOI] [PubMed] [Google Scholar]
- 9.Schlumberger M, Leboulleux S. Current practice in patients with differentiated thyroid cancer. Nat Rev Endocrinol 2021;17(3):176-88. Publ. en ligne du 18 déc. 2020. [DOI] [PubMed] [Google Scholar]
- 10.Howlader N, Altekruse SF, Li CI, Chen VW, Clarke CA, Ries LAet al. US incidence of breast cancer subtypes defined by joint hormone receptor and HER2 status. J Natl Cancer Inst 2014;106(5):dju055. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Awan A, Esfahani K. Endocrine therapy for breast cancer in the primary care setting. Curr Oncol 2018;25(4):285-91. Publ. en ligne du 14 août 2018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Early Breast Cancer Trialists’ Collaborative Group . Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. Lancet 2005;365(9472):1687-717. [DOI] [PubMed] [Google Scholar]
- 13.Early Breast Cancer Trialists’ Collaborative Group . Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials. Lancet 2015;386(10001):1341-52. Publ. en ligne du 23 juill. 2015. [DOI] [PubMed] [Google Scholar]
- 14.Loibl S, Poortmans P, Morrow M, Denkert C, Curigliano G. Breast cancer. Lancet 2021;397(10286):1750-69. Publ. en ligne du 1er avr. 2021. Errata dans : Lancet 2021;397(10286):1710. [DOI] [PubMed] [Google Scholar]
- 15.Day R. Quality of life and tamoxifen in a breast cancer prevention trial: a summary of findings from the NSABP P-1 study. National Surgical Adjuvant Breast and Bowel Project. Ann N Y Acad Sci 2001;949:143-50. [PubMed] [Google Scholar]
- 16.NCCN clinical practice guidelines in oncology: prostate cancer. Plymouth Meeting, PA: National Comprehensive Cancer Network; 2022. [DOI] [PubMed] [Google Scholar]
- 17.Edmunds K, Tuffaha H, Galvão DA, Scuffham P, Newton RU. Incidence of the adverse effects of androgen deprivation therapy for prostate cancer: a systematic literature review. Support Care Cancer 2020;28(5):2079-93. Publ. en ligne du 7 janv. 2020. [DOI] [PubMed] [Google Scholar]
- 18.Kokorovic A, So AI, Serag H, French C, Hamilton RJ, Izard JPet al. Guide de pratique de l’Association des urologues du Canada sur le traitement par privation androgénique : manifestations indésirables et stratégies de prise en charge. Can Urol Assoc J 2021;15(6):E307-22. Errata dans : Can Urol Assoc J 2021;15(7):E383.34127184 [Google Scholar]
- 19.Magee DE, Singal RK. Androgen deprivation therapy: indications, methods of utilization, side effects and their management. Can J Urol 2020;27(Suppl 1):11-6. [PubMed] [Google Scholar]
- 20.Desai K, McManus JM, Sharifi N. Hormonal therapy for prostate cancer. Endocr Rev 2021;42(3):354-73. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Franzoi MA, Agostinetto E, Perachino M, Del Mastro L, de Azambuja E, Vaz-Luis Iet al. Evidence-based approaches for the management of side-effects of adjuvant endocrine therapy in patients with breast cancer. Lancet Oncol 2021;22(7):e303-13. Publ. en ligne du 20 avr. 2021. [DOI] [PubMed] [Google Scholar]
- 22.Korde LA, Somerfield MR, Carey LA, Crews JR, Denduluri N, Hwang ESet al. Neoadjuvant chemotherapy, endocrine therapy, and targeted therapy for breast cancer: ASCO guideline. J Clin Oncol 2021;39(13):1485-505. Publ. en ligne du 28 janv. 2021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.BCGuidelines.ca . Appendix C: medications for the management of prostate cancer side effects in primary care. Vancouver, BC: Guidelines and Protocols and Advisory Committee, Gouvernement de la Colombie-Britannique; 2020. Accessible à : https://www2.gov.bc.ca/assets/gov/health/practitioner-pro/bc-guidelines/prostatecancer-part2_appendixc.pdf. Réf. du 15 janv. 2022. [Google Scholar]
- 24.Traitement des symptômes et des effets secondaires. Toronto, ON: : Action cancer Ontario. Accessible à : https://www.cancercareontario.ca/fr/symptom-management. Réf. du 6 janv. 2022. [Google Scholar]
- 25.Okwuosa TM, Morgans A, Rhee JW, Reding KW, Maliski S, Plana JCet al. Impact of hormonal therapies for treatment of hormone-dependent cancers (breast and prostate) on the cardiovascular system: effects and modifications: a scientific statement from the American Heart Association. Circ Genom Precis Med 2021;14(3):e000082. Publ. en ligne du 26 avr. 2021. [DOI] [PubMed] [Google Scholar]