Abstract
目的
实现可穿戴式心电信号的R峰检测,为准确估计心率、心率变异性等生理参数提供基础。
方法
采用全卷积网络预测R峰热图,对热图进行峰值定位获得R峰位置。引入心拍感知模块,联合心拍数量预测任务和R峰热图预测任务进行学习,提高卷积网络对全局上下文信息的提取能力。心拍感知模块预测的心拍数量还可估计R-R间期,用作峰值定位的峰间最小水平距离。为满足移动端的实时应用,采用深度可分离卷积减小模型的参数量和计算量。
结果
实验仅使用可穿戴式心电数据训练模型。测试中定位误差容忍度设置为150 ms时,本文方法在可穿戴式心电数据集和公开数据集LUDB上的R峰检测灵敏度均高达100%,真阳率均超过99.9%;对于时长10 s的ECG信号,R峰检测CPU耗时约为23.2 ms。
结论
本文方法对可穿戴式和常规心电信号的R峰检测均可达到良好效果,且满足R峰检测的实时性需求。
Keywords: 可穿戴式心电信号, R峰检测, 心拍感知, 卷积网络
Abstract
Objective
To develop a method for R-peak detection of ECG data from wearable devices to allow accurate estimation of the physiological parameters including heart rate and heart rate variability.
Methods
A fully convolutional neural network was applied to predict the R-peak heatmap of ECG data and locate the R-peak positions. The heartbeat-aware (HA) module was introduced to enable the model to learn to predict the heartbeat number and R-peak heatmap simultaneously, thereby improving the capability of the model for extraction of the global context. The R-R interval estimated by the predicted heartbeat number was adopted to calculate the minimum horizontal distance for peak positioning. To achieve real-time R-peak detection on mobile devices, the deep separable convolution was adopted to reduce the number of parameters and the computational complexity of the model.
Results
The proposed model was trained only with ECG data from wearable devices. At a tolerance window interval of 150 ms, the proposed method achieved R peak detection sensitivities of 100% for both wearable device ECG dataset and a public dataset (i.e. LUDB), and the true positivity rates exceeded 99.9%. As for the ECG signal of a 10 s duration, the CPU time of the proposed method for R-peak detection was about 23.2 ms.
Conclusion
The proposed method has good performance for R-peak detection of both wearable device ECG data and routine ECG data and also allows real-time R-peak detection of the ECG data.
Keywords: wearable device ECG data, R-peak detection, heartbeat-aware, convolutional neural network
心电信号中的R峰是确定心率和节律、以及检测其它波形特征点(图 1A)的基础。R峰的准确检测是心率变异性分析[1, 2]、心拍分割[3]和心律失常识别[4-7]重要的处理步骤。
图 1.

可穿戴式心电信号R峰示意图
Schematic diagram of R peaks in a wearable ECG signal. A: A heartbeat. B: Different forms of QRS complexes. C: R peaks of wearable device ECG signals.
现有的心电信号R峰检测方法主要为基于规则的决策法和基于深度学习的检测方法。基于规则的决策法[8-15]通常对心电信号进行时域或频域变换,增强R波分量,抑制其他波形和各种噪声分量,在增强R波分量的变换信号中以阈值法进行点检测,再通过启发式的后处理校正R峰位置。然而,规则难以涵盖心电信号的各种复杂情况,如QRS波群具有多种形态(图 1B)、可穿戴式心电信号存在复杂干扰(图 1C)、以及不同病人的心率差异大等;另外,规则的归纳依赖于丰富的领域知识,难以在各种心律失常事件中精确地检测出R峰,漏检率和误检率高。基于深度学习的检测方法比基于规则的决策法更鲁棒,文献[16]使用LSTM[17]检测R峰,文献[18, 19]使用UNet[20]检测R峰,存在模型的参数量和推理速度无法满足移动端R峰检测的实时性需求等问题。
针对上述问题,我们提出心拍感知卷积网络用于预测可穿戴式心电信号的心拍数量和R峰热图,对热图进行峰值定位获得R峰位置。心拍感知(HA)模块通过预测心电信号的心拍数量,为R峰检测任务引入全局上下文信息,提高卷积网络提取心电信号全局信息的能力,以实现R峰的准确检测。同时,心拍感知模块预测的心拍数量还可估计R-R间期用于辅助热图峰值定位,提高R峰检测的鲁棒性。进一步地,为实现移动端的实时R峰检测,我们采用深度可分离卷积[21]来轻量化卷积网络模型,减小模型的参数量和计算量。为检验模型的鲁棒性和泛化能力,本文实验中用可穿戴式心电数据训练模型,用可穿戴式心电数据和可公开获取的ECG数据集测试模型。
1. 材料和方法
1.1. 实验数据
实验数据包含两个独立的心电信号数据集,数据已经过脱敏处理,以实现病人信息的保密。私有数据集为心韵恒安医疗科技(北京)有限公司建立的可穿戴式12导联心电数据集,采集设备为可穿戴式心电记录仪CONX CC1612,收集日期为2020年9月~2021年9月。信号的采样频率为500 Hz,时长为15 s。可穿戴式心电数据集共有1056条来自不同受试者的数据,包含各种复杂的心电模式,涵盖ST段改变、房颤、房性心律、室性心律、房性早搏、室性早搏、束支阻滞等多种心律失常类型的数据。其中,训练集和测试集分别包含950和106条心电信号。可穿戴式心电数据集的R峰由三名心电专家进行标注和交叉验证。R峰位置的标注以心电信号Ⅱ导联为基准、其他导联为参考。
公开数据集为Lobachevsky大学建立的12导联心电信号特征点检测数据库Lobachevsky University Database(LUDB)[22]。信号的采样频率为500 Hz,时长为10 s。LUDB包含200条来自不同受试者的数据,在本实验中均作为测试集。数据的每个导联均具有R峰标注,为保持数据集间心电信号R峰标签的统一,实验中仅采用Ⅱ导联的R峰位置作为标签。
两个数据集均通过低频截止频率为0.05 Hz、高频截止频率为35 Hz[23]的五阶带通滤波器进行滤波,以去除基线漂移、工频干扰、肌电干扰和其他高频噪声。LUDB中ECG数据已经过标准化处理,实验中仅对可穿戴式心电信号进行z-score标准化,以保持数据集间ECG信号幅值分布的一致性。
1.2. 心拍感知方法
本文提出的心拍感知方法的总体框架如(图 2)所示,心拍感知卷积网络预测心拍数量和R峰热图,根据预测的心拍数量估计的R-R间期计算峰值定位的峰间最小水平距离,从热图中定位峰值,从而获得R峰位置。心拍感知卷积网络包含一个编码-解码模块和一个心拍感知模块,编码器从输入心电信号中提取特征,解码器将特征解码,输出R峰位置的热图。为提高编码- 解码器对全局上下文信息的捕获能力,引入心拍感知模块,通过心拍数量预测任务与R峰检测任务的多任务联合学习,辅助监督编码-解码器学习R峰的全局位置信息,减少误检和漏检。
图 2.

心拍感知方法框架
Framework of the heartbeat-aware method.
1.2.1. 心拍感知模块
针对可穿戴式心电信号中的复杂干扰,专家在定位R峰时通常会从信号全局中寻找模式相同并反复出现的部分,并根据上下文信息推理出R峰的位置,从而区分R峰与干扰、噪声等(图 3)。可见,ECG信号的全局上下文信息可辅助检测可穿戴式心电信号的R峰。
图 3.

存在干扰的可穿戴式心电信号
Wearable device ECG signals with interference.
为获取全局上下文信息,我们提出心拍感知模块与编码-解码器进行多任务学习(图 2)[24, 25],利用心拍数量预测任务与R峰检测任务的相关性,约束编码器学习两个任务间的共享表征,为编码-解码器引入心拍数量这一全局特征,监督编码-解码器学习R峰的位置上下文信息,抑制局部的干扰和噪声,提升R峰检测模型的性能。
心拍感知模块中,编码结果先经过一个卷积核尺寸为1×3、输出通道数为64的卷积层提取特征,再经过一个池化核尺寸和步长均为3的平均池化层处理,最后通过一个输入神经元个数为256的全连接层输出心拍数量。与通过注意力机制学习全局上下文信息的方法对比,联合简单的辅助任务进行多任务学习的方式更高效,不会给模型增加过多参数量和计算量,适用于移动端的实时R峰检测。此外,心拍感知模块预测的心拍数量还可估计R-R间期,用作峰值定位的自适应峰间最小水平距离。
1.2.2. 编码-解码模块
用卷积网络进行可穿戴式心电信号的R峰检测,可建模为密集预测任务,既需要捕获全局信息,也要合理地利用底层特征。UNet[20]中的U型结构和同一个层级的跳跃连接可以融合多个尺度的特征。因此,我们采用UNet架构用于R峰热图预测。如(图 4)所示,本文所用的UNet由编码器和解码器两部分组成,编码阶段的下采样和解码阶段的上采样的采样倍数均为2。本文实验中,采用最大池化操作实现下采样,采用最近邻插值实现上采样。为减少模型的参数量,各卷积层的输出通道数设置得比较小,如(图 4)特征图上的数字所示。
图 4.

编码器-解码器架构
Architecture of the encoder-decoder network.
1.3. 轻量化
采用轻量化卷积,可在保持性能的同时减小模型的参数量和计算量,实现移动端的实时R峰检测。如(图 4),我们保持网络架构不变,交替使用常规卷积和深度可分离卷积[21]。一维深度可分离卷积的参数量较常规一维卷积减小:
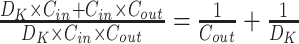 |
1 |
同时,一维深度可分离卷积的计算量也较常规一维卷积减小:
 |
2 |
式中,DK为卷积核的大小,Cin和Cout分别为输入和输出的通道数,Wout为输出特征图的长度。
1.4. 损失函数
可穿戴式心电信号R峰检测的心拍感知卷积网络的优化目标为:
 |
3 |
式中,LR为R峰检测损失,LHA为心拍感知损失。λ为权重系数,用于平衡R峰检测损失和心拍感知损失。实验中,λ的初始值设置为0.2。由于心拍感知损失收敛速度比R峰检测损失快,为加大卷积网络对R峰检测任务的关注度,模型训练过程中随着迭代次数的增加,λ逐渐减小至0.0002。
1.4.1. R峰检测损失
可穿戴式心电信号的干扰和噪声导致部分R峰难以被手工准确地定位和标注,为减小标注的不确定性给模型训练造成的干扰,我们生成以R峰对应的时间点为中心的高斯热图:
 |
4 |
式中,t为可穿戴式心电信号样本点对应的时间点,pR为R峰对应的时间点,σ为高斯分布的标准差,用以控制R峰标注的不确定性,实验中σ设置为4 ms。
针对R峰与背景点的数量不平衡问题,采用修正的Focal损失函数[26]作为R峰检测损失:
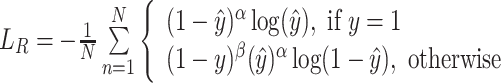 |
5 |
式中,α和β为Focal损失函数中的超参数,α和β分别用于调节正样本和负样本的的损失权重,训练时可通过减少负样本的权重让模型更专注于难学习的正样本。实验中,α = 2,β = 2;N为心电信号中的R峰数量;ŷ为编码-解码器预测的R峰热图。
1.4.2. 心拍感知损失
心拍感知的目标为预测可穿戴式心电信号中的心拍数量,采用平均绝对误差(MeanAbsolute Error, MAE)损失函数[27]:
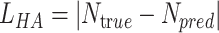 |
6 |
式中,Ntr ue为心电信号中真实的心拍数量,Npred为心拍感知模块预测的心拍数量。
1.5. R峰在线检测算法
为实现R峰在线检测,以重叠滑动窗口方式对心电信号进行分段R峰检测,如(算法1)所示。为减少计算量,将输入至模型的心电信号降采样到100 Hz,在模型输出R峰热图后将热图重采样至原始频率500 Hz。应用Scipy中的find_peaks函数定位热图峰值。心拍感知卷积网络输入的ECG信号时长为4.48 s。由于可穿戴式数据集中的信号时长为15 s,训练中每次迭代时随机从15 s信号中截取4.48 s用作网络的输入。针对可穿戴式心电数据中的噪声及干扰,采用多种数据扩增策略对训练集进行扩增,包括随机裁剪、随机屏蔽、随机导联屏蔽和随机导联翻转。
算法1:R峰在线检测
输入:ECG信号,滑动窗宽4.48 s,重叠时长1.28 s。
Step1初始化R峰热图Heatmap_0。
Step2将ECG信号降采样至100 Hz。
Step3获取R峰热图和心拍数量:Heatmap_t, Npred= HA-UNet(ECG);其中Npred为预测的心拍数量。
Step4将输出热图重采样至原始频率500 Hz。
Step5根据预测的心拍数量估算R-R间期:R-R间期= 4.48秒/Npred。
Step6将重叠部分的热图加权平均:Heatmap_t[重叠] = ((1-W) * Heatmap_t-1[重叠]+W * Heatmap_t[重叠])/2。
Step7定位热图峰值获取R峰:Rpeaks=find_peaks(heatmap, distance=R-R间期/2);若不使用自适应峰间最小水平距离,设置distance为160 ms。
Step8若相邻R峰间距过近,去除幅值较小的一个。
当ECG信号未结束时,重复Step2至Step8。
1.6. 实验设置
实验使用Python实现,深度学习框架为Pytorch。模型训练选用的优化器为Adam,采用预热训练策略。批处理大小设为256,迭代总次数设为2000。初始学习率设为0.0001,采用余弦退火策略调整学习率。
1.7. 评价指标
R峰检测结果定义:
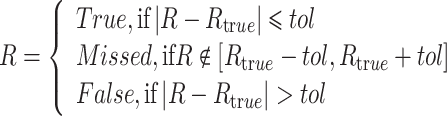 |
7 |
式中,tol是R峰定位的误差容忍度,如ANSI/AAMI-EC57:1998中建议的150 ms。正确检测、漏检以及误检的R峰数量分别表示为TP、FN、FP。不同方法和模型的R峰检测性能的定量评估,采用以下指标:
(1)灵敏度(Se):正确检测的R峰数量与真实的R峰数量之比。
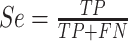 |
8 |
(2)真阳率(+P):正确检测的R峰数量与检出的R峰数量之比。
 |
9 |
(3)准确率(Acc)
 |
10 |
(4)误检率(DER):误检的R峰数量与真实的R峰数量之比。
 |
11 |
(5)R峰定位平均误差及其标准差(mean error± std):检出的R峰与真实R峰间的距离即为定位误差,所有R峰定位误差的平均值即为平均误差。
(6)平均R-R间期的平均误差(mean average R-R interval error ± std):真实R峰的R-R间期与检出R峰的R-R间期之差即为R-R间期误差,所有R-R间期误差的平均值即为平均误差。
(7)检测耗时(Time):算法检测R峰的CPU耗时,CPU型号为Intel(R) Core(TM) i5-10500。
1.8. 统计学方法
本文方法和其他R峰检测算法在可穿戴式心电数据集和LUDB上的R峰检测性能比较,使用SPSS对结果进行统计学分析,本文方法与其他R峰检测算法采用配对t检验。P < 0.05说明差异有统计学意义。
2. 结果
2.1. 心拍感知模块对R峰检测性能的影响
为验证心拍感知模块有助于提高模型的R峰检测性能,我们在可穿戴式心电数据集和LUDB[22]中进行消融实验。将R峰定位误差容忍度设为20 ms,结果如(图 5)所示。心拍感知卷积网络(HA-UNet)在可穿戴式数据集和LUDB中的R峰检测灵敏度分别为99.04%和98.42%,真阳率分别为98.99%和98.42%,及准确率分别为98.06% 和96.88%,均高于UNet(98.69% 和98.31%、98.64%和98.25%、97.37%和96.62%),可见加入心拍感知模块可提升模型的R峰检测性能。
图 5.

不同卷积网络模型的R峰检测结果
R-peak detection results of different convolutional neural network models.
此外,HA-UNet在可穿戴式数据集及LUDB[22]上心拍数量预测的MAE[27]分别为0.41和0.49,达到了较好的预测水平,表明编码器具有良好的全局上下文信息提取能力。
图 6中,HA-UNet能精确定位R峰,而UNet将部分异常Q波错误地识别为R波,表明心拍感知模块引入的全局上下文信息可提高R峰定位精确度。
图 6.

可穿戴式心电信号R峰检测结果示例
An example of R-peak detection of wearable device ECG data.
采用深度可分离卷积[21]轻量化HA-UNet(LHA-UNet)后,模型参数量从0.42 M减小为0.31 M。LHA-UNet在可穿戴式心电数据集和LUDB上的R峰检测灵敏度分别为99.09% 和98.80%,真阳率分别为98.99% 和98.80%,及准确率分别为98.11%和97.63%。
2.2. 不同导联集合对R峰检测性能的影响
不同导联体系的心电图机采集的信号通道数不等,为研究心电信号不同导联集合对LHA-UNet的R峰检测性能的影响,设置输入导联数量为12、9、6、3、2、1,在20 ms的定位误差容忍度下计算R峰检测的误检率。12导联为标准12导联,包括肢体导联Ⅰ、Ⅱ、Ⅲ、aVR、aVL、aVF,以及胸导联Ⅴ1、Ⅴ2、Ⅴ3、Ⅴ4、Ⅴ5、Ⅴ6;各导联子集具体为:9导联子集为12导联系统中真正采集的Ⅰ、Ⅱ、Ⅲ和胸导联,剩余的aVR、aVL、aVF是通过计算获取的;6导联子集为肢体导联,为6导联系统中采集的信号;3导联子集为Ⅱ、Ⅴ1、Ⅴ5,3导联系统中采集的信号接近标准12导联中的这3个导联;2导联子集为Ⅱ、Ⅴ5,这2个导联的R波最清晰;单导联子集为Ⅱ导联,Ⅱ导联通常作为R峰检测的基准导联。
图 7给出了轻量化HA-UNet对于不同导联集合的R峰误检率,可穿戴心电数据集中以3导联子集为输入时R峰误检率最小,为1.11%;LUDB[22]中以标准12导联为输入时R峰误检率最小,为2.40%。12导联输入在可穿戴式数据集中的误检率并非最低,但在LUDB中的检测性能最好,因为可穿戴式心电信号的干扰大,输入所有导联可能会引入较多噪声,导致R峰检测准确率下降;而LUDB的数据没有可穿戴式心电中的复杂干扰,输入12导联信号可获得较好的R峰检测性能。由于没有引入其他导联的噪声,使用导联数量较少的心电信号子集进行可穿戴式心电信号R峰检测时,误检率较低;但输入通道数减少导致在LUDB中的检测性能有所下降。
图 7.

轻量化HA-UNet以心电信号不同导联集合为输入的R峰误检率
DER of R-peak detection of LHA-UNet on different lead sets of ECG signals.
2.3. 与其他R峰检测算法的比较
实验将心拍感知方法与多种R峰检测算法进行详细对比,在可穿戴式心电数据集和公开数据库LUDB[22]中评估R峰检测算法,参考其他文献[28-30],设置R峰定位误差容忍度为150 ms,对所有方法/模型仅采用Ⅱ导联心电信号为输入。
轻量化HA-UNet的R峰检测性能优于Pantompkins[12]、Hamilton[13]、Martínez[14]和Lourenço[15]算法。轻量化HA-UNet在具有复杂干扰的可穿戴式心电数据集中的R峰检出率高达99.95%;在未使用任何公开数据进行模型训练的情况下,在LUDB中达到100% 的准确率。轻量化HA-UNet的R峰定位平均误差及其标准差、以及平均R-R间期的平均误差及其标准差都比其他R峰检测算法小(表 1~3)
表 1.
本文方法和其他4种R峰检测算法在可穿戴式数据集中的性能
Performance of the proposed method and 4 algorithms for R-peak detection on wearable ECG dataset
| Method | TP+FP | FN | FP | Se (%) | +P (%) | Acc (%) | DER (%) | Time (ms) |
| *P < 0.05, **P < 0.01 vs the proposed method. | ||||||||
| Pan-tompkins[12] | 2098 | 32 | 142 | 98.39* | 93.23** | 91.83** | 8.75 | 2.4 |
| Hamilton[13] | 2191 | 15 | 218 | 99.24* | 90.05** | 89.44** | 11.72 | 9.2 |
| Martinez[14] | 1943 | 273 | 228 | 86.27** | 88.27** | 77.39** | 25.20 | 3.7 |
| Lourengo[15] | 2184 | 45 | 241 | 97.74* | 88.97** | 87.17** | 14.39 | 37.6 |
| LHA-UNet | 1989 | 0 | 1 | 100 | 99.95 | 99.95 | 0.05 | 50.9 |
表 3.
本文方法和其他4种R峰检测算法的R峰定位误差及R-R间期误差
R-peak location error and R-R interval error of the proposed method and 4 algorithms of R-peak detection
| Method | Wearable ECG dataset | LUDB | |||
| Mean error±std (ms) | Mean average R-R interval error±std (ms) | Mean error±std (ms) | Mean average R-R interval error±std (ms) | ||
| Pan-tompkins[12] | -28.40±35.13 | 2.05±43.59 | -7.86±55.10 | -8.18±47.17 | |
| Hamilton[13] | -5.61±16.30 | -4.01±23.01 | -5.35±14.43 | -2.18±17.91 | |
| Martinez[14] | 2.24±17.85 | 12.31±424.64 | -1.05±8.25 | 3.45±382.42 | |
| Lourengo[15] | -0.84±15.95 | -7.14±43.28 | -1.81±11.67 | 0.52±90.13 | |
| LHA-UNet | 0.34±7.43 | -0.27±12.07 | -1.54±6.88 | 0.07±0.10 | |
表 2.
本文方法和其他5种R峰检测算法在LUDB中的性能
Performance of the proposed method and 5 algorithms for R-peak detection on LUDB
| Method | TP+FP | FN | FP | Se (%) | +P (%) | Acc (%) | DER (%) | Time (ms) |
| *P < 0.05, **P < 0.01 vs the proposed method. | ||||||||
| Pan-tompkins[12] | 1846 | 7 | 22 | 99.62** | 98.81** | 98.43** | 1.58 | 1.0 |
| Hamilton[13] | 1827 | 4 | 0 | 99.78** | 100 | 99.78* | 0.22 | 5.0 |
| Martinez[14] | 1762 | 111 | 42 | 93.94** | 97.62** | 91.83** | 8.36 | 3.2 |
| Lourengo[15] | 1814 | 33 | 16 | 98.20** | 99.12* | 97.35** | 2.68 | 17.3 |
| Chen et al.[16] | - | - | - | 100 | 99.86 | - | - | - |
| LHA-UNet | 1831 | 0 | 0 | 100 | 100 | 100 | 0 | 23.2 |
图 8中的心电信号存在高尖T波和干扰,由于对比算法的归纳能力有限,无法准确地检出R峰,并不适用于可穿戴式心电数据。然而,轻量化HA-UNet能够准确定位该心电信号所有的R峰,体现心拍感知方法的R峰定位较所对比的R峰检测算法鲁棒。
图 8.

不同方法在可穿戴式心电信号Ⅱ导联中的R峰检测结果示例
Representative R-peak detection results of different methods in wearable Ⅱ-lead ECG.
3. 讨论
针对可穿戴式心电信号具有复杂干扰、已有算法不能满足实际需求等问题,本文提出心拍感知模块,将编码器的编码结果输入到心拍感知模块中用以预测信号的心拍数量,通过R峰检测任务与心拍数量预测任务联合学习[24, 25],引入全局上下文信息辅助R峰检测,以减少R峰的漏检和误检。
通过交替使用常规卷积和深度可分离卷积[21],可减小模型的参数量和计算量,并提升模型泛化能力。在定位误差容忍度为20 ms时,轻量化HA-UNet的R峰检测准确率甚至高于HA-UNet。轻量化HA-UNet的CPU耗时与Pan-tompkins方法[12]相比较长,但在可穿戴式心电信号中R峰检测准确率(99.95%)远高于Pantompkins方法(91.83%),实际上毫秒级的处理速度已可满足R峰检测的实时性需求。
ECG信号R峰检测相关研究[28-30]中,大部分将定位误差容忍度设置为ANSI/AAMI-EC57:1998中建议的150 ms。然而,150 ms的定位误差容忍度对实际需求而言过于宽松。为此,我们进一步比较各R峰检测方法在容忍度为20 ms时的性能。Pan-tompkins[12]、Hamilton[13]、Martínez[14]、Lourenço[15]与轻量化HA-UNet在可穿戴式数据集中的R峰检测准确率分别为16.58%、62.73%、75.02%、85.01%及98.65%;在LUDB中的R峰检测准确率分别为15.30%、83.73%、89.70%、93.57% 及96.78%。可见,基于规则的决策法的R峰定位精确度过低,难以准确地估计心率、心率变异性等参数。
综上,心拍感知方法在可穿戴式心电信号R峰检测中准确率高,且泛化性强,计算速度满足R峰检测的实时性需求,是准确估计心率、心率变异性等生理参数的重要步骤。将来,我们会对R峰检测任务检出的R峰数量与心拍感知模块预测的心拍数量进行相互约束,进一步提升算法在可穿戴式心电信号R峰检测中的性能。
Biography
谭慧欣,硕士,E-mail: queenetam96@gmail.com
Funding Statement
国家重点研发计划(2018YFC2001203)
Contributor Information
谭 慧欣 (Huixin TAN), Email: queenetam96@gmail.com.
阳 维 (Wei YANG), Email: weiyanggm@gmail.com.
References
- 1.Baevsky RМ, Chernikova AG. Heart rate variability analysis: physiological foundations and main methods. Cardiometry. 2017;(10):66–76. doi: 10.12710/cardiometry.2017.10.6676. [DOI] [Google Scholar]
- 2.Catai AM, Pastre CM, de Godoy MF, et al. Heart rate variability: are You using it properly? Standardisation checklist of procedures. Braz J Phys Ther. 2020;24(2):91–102. doi: 10.1016/j.bjpt.2019.02.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Silva P, Luz E, Silva G, et al. Towards better heartbeat segmentation with deep learning classification. Sci Rep. 2020;10:20701. doi: 10.1038/s41598-020-77745-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Bae TW, Lee SH, Kwon KK. An adaptive Median filter based on sampling rate for R-peak detection and major-arrhythmia analysis. Sensors. 2020;20(21):6144. doi: 10.3390/s20216144. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Gupta V, Mittal M. r-peak based arrhythmia detection using hilbert transform and principal component analysis[C]//2018 3rd international innovative applications of computational intelligence on power, energy and controls with their impact on humanity (CIPECH). November 1-2, 2018, Ghaziabad, India. IEEE, 2018: 1-4.
- 6.邓 力, 傅 蓉. 基于心拍的端到端心律失常分类. 南方医科大学学报. 2019;39(9):1071–7. doi: 10.12122/j.issn.1673-4254.2019.09.11. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.甘 屹, 施 俊丞, 高 丽, et al. 基于深度学习并行网络模型的心律失常分类方法. 南方医科大学学报. 2021;41(9):1296–303. doi: 10.12122/j.issn.1673-4254.2021.09.02. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.陈 耿铎, 曾 有灵, 李 喆. 自适应双阈值心电信号检测算法研究. 暨南大学学报: 自然科学与医学版. 2018;39(3):262–8. [Google Scholar]
- 9.孙 亚楠, 吕 可嘉, 张 瑞. 一种新的心电信号R峰自动检测方法. 西北大学学报: 自然科学版. 2018;48(1):16–23. [Google Scholar]
- 10.孟 瑶. 基于可穿戴传感器的实时心电检测方法研究. 信息技术与网络安全. 2021;40(4):75–9. [Google Scholar]
- 11.赵 恺, 晏 炜宏, 李 永福. 基于局部方差的QRS波群和R峰检测算法. 微电子学与计算机. 2021;38(2):1–6. [Google Scholar]
- 12.Pan JP, Tompkins WJ. A real-time QRS detection algorithm. IEEE Trans Biomed Eng. 1985;BME-32(3):230–6. doi: 10.1109/TBME.1985.325532. [DOI] [PubMed] [Google Scholar]
- 13.Hamilton P. Open source ECG analysis[C]//Computers in Cardiology. September 22-25, 2002, Memphis, TN, USA. IEEE, 2002: 101-4.
- 14.Martinez JP, Almeida R, Olmos S, et al. A wavelet-based ECG delineator: evaluation on standard databases. IEEE Trans Biomed Eng. 2004;51(4):570–81. doi: 10.1109/TBME.2003.821031. [DOI] [PubMed] [Google Scholar]
- 15.Lourenço A, Silva H, Fred A. ECG-based biometrics: a real time classification approach[C]//2012 IEEE International Workshop on Machine Learning for Signal Processing. September 23-26, 2012, Santander, Spain. IEEE, 2012: 1-6.
- 16.Laitala J, Jiang MZ, Syrjälä E, et al. Robust ECG R-peak detection using LSTM[C]//Proceedings of the 35th Annual ACM Symposium on Applied Computing. Brno Czech Republic. New York, NY, USA: ACM, 2020: 1104-11.
- 17.Hochreiter S, Schmidhuber J. Long short-term memory. Neural Comput. 1997;9(8):1735–80. doi: 10.1162/neco.1997.9.8.1735. [DOI] [PubMed] [Google Scholar]
- 18.Vijayarangan S, R V, Murugesan B, et al. RPnet: a Deep Learning approach for robust R Peak detection in noisy ECG[C]//2020 42nd Annual International Conference of the IEEE Engineering in Medicine & Biology Society. July 20-24, 2020, Montreal, QC, Canada. IEEE, 2020: 345-8.
- 19.Zahid MU, Kiranyaz S, Ince T, et al. Robust R-peak detection in lowquality holter ECGs using 1D convolutional neural network. IEEE Trans Biomed Eng. 2022;69(1):119–28. doi: 10.1109/TBME.2021.3088218. [DOI] [PubMed] [Google Scholar]
- 20.Ronneberger O, Fischer P, Brox T. U-net: convolutional networks for biomedical image segmentation[M]//Lecture Notes in Computer Science. Cham: Springer International Publishing, 2015: 234-241.
- 21.Howard AG, Zhu M, Chen B, et al. Mobilenets: Efficient convolutional neural networks for mobile vision applications. arXiv preprint. 2017:1704.04861. [Google Scholar]
- 22.Kalyakulina AI, Yusipov Ⅱ, Moskalenko VA, et al. LUDB: a new open-access validation tool for electrocardiogram delineation algorithms. IEEEAccess. 2020;8:186181–90. [Google Scholar]
- 23.Kossmann CE, Brody DA, Burch GE, et al. Recommendations for standardization of leads and of specifications for instruments in electrocardiography and vectorcardiography (report of committee on electrocardiography, American heart association) JAPANES J Med Instrum. 1970;40(3):242–58. [Google Scholar]
- 24.Ruder S. An overview of multi-task learning in deep neural networks. arXiv preprint. 2017:1706.05098. [Google Scholar]
- 25.张 钰, 刘 建伟, 左 信. 多任务学习. 计算机学报. 2020;43(7):1340–78. [Google Scholar]
- 26.Duan KW, Bai S, Xie LX, et al. CenterNet: keypoint triplets for object detection[C]//2019 IEEE/CVF International Conference on Computer Vision (ICCV). October 27-November 2, 2019, Seoul, Korea (South). IEEE, 2019: 6568-77.
- 27.Peng H, Gong WK, Beckmann CF, et al. Accurate brain age prediction with lightweight deep neural networks. Med Image Anal. 2021;68:101871. doi: 10.1016/j.media.2020.101871. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Sereda I, Alekseev S, Koneva A, et al. ECG segmentation by neural networks: errors and correction[C]//2019 International Joint Conference on Neural Networks (IJCNN). July 14-19, 2019, Budapest, Hungary. IEEE, 2019: 1-7.
- 29.Moskalenko V, Zolotykh N, Osipov G. Deep learning for ECG segmentation[M]//Studies in Computational Intelligence. Cham: Springer International Publishing, 2019: 246-254.
- 30.Chen GL, Chen ML, Zhang JJ, et al. A crucial wave detection and delineation method for twelve-lead ECG signals. IEEE Access. 2020;8:10707–17. doi: 10.1109/ACCESS.2020.2965334. [DOI] [Google Scholar]


