Mit den mRNA-Vakzinen eröffnen sich ganz neue Möglichkeiten. Im nachfolgenden Beitrag erklären die Autoren anschaulich das Prinzip, nennen Vorteile und Limitationen. Darüber hinaus geben Sie einen interessanten Ausblick und nennen unter anderem Infektionskrankheiten, die in Zukunft Ziel der mRNA-Impfstoffentwicklung sein werden.
Impfungen retten Leben. Sie stellen eine der wichtigsten Säulen in der Prävention von Infektionskrankheiten dar. Teilweise können sie auch Krebserkrankungen verhindern, z. B. im Falle von HPV- assoziierten Tumoren.
Die ersten überlieferten Berichte über Impfversuche mittels Inokulation stammen aus der Zeit um 1500 n. Chr. aus China und Indien [1]. Bei diesen handelte es sich, wie bei der erfolgreichen Impfentwicklung gegen Kuhpocken durch Edward Jenner 1796, um Lebendimpfstoffe. Im weiteren Verlauf wurden proteinbasierte Totimpfstoffe entwickelt, die oft mit Adjuvanzien versehen wurden, um die Immunreaktion zu verstärken. Ein weiteres Prinzip der Impfstoffentwicklung ist der Polysaccharid-Impfstoff, wie er beispielsweise bei der Pneumokokkenimpfung verwendet wird. Mit der Entwicklung der mRNA-Impfstoffe hat nun ein völlig neues Zeitalter der Impfstoffentwicklung begonnen [2].

Was ist ein mRNA-Impfstoff?
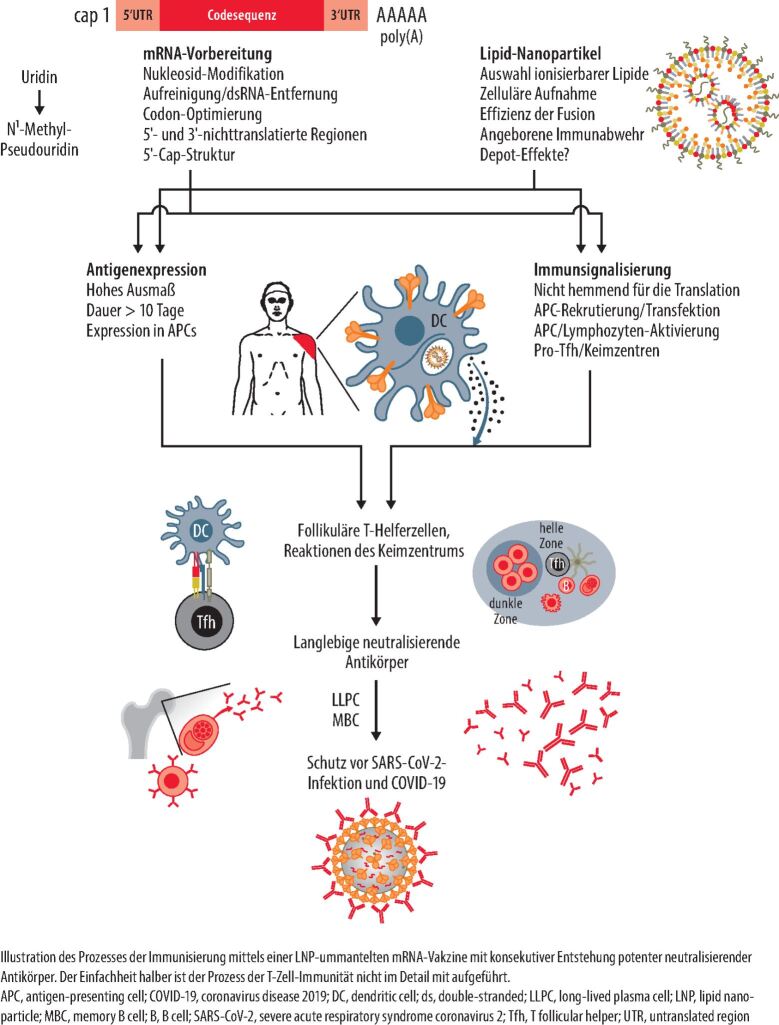
mRNA-Impfstoffe tragen Informationen für den Bauplan eines bestimmten Proteins in Form der Boten-Ribonukleinsäure (engl. messenger RNA, mRNA). Durch das Einbringen der mRNA in die Zelle kann der Körper selbst das codierte Protein herstellen [3]. Freie "nackte" RNA ist äußerst kurzlebig und wird innerhalb kürzester Zeit durch spezifische Enzyme, sog. RNAsen, abgebaut. Um die Degradation der mRNA zu verhindern, verwenden alle erfolgreich angewandten mRNA-Impfstoffe sog. Lipidnanopartikel (Lipid nano particles, LNPs), um die mRNA sicher in die Zielzelle zu schleusen [4]. Die mit dieser Lipidhülle ummantelte mRNA ist thermostabil und vor vorzeitigem Abbau geschützt.
Durch Endozytose kann die mRNA in die Zelle aufgenommen werden [5, 6]. Sobald dieser kritische Schritt erfolgreich überstanden und die mRNA in das Zytosol der Zielzelle gelangt ist, produziert der zelluläre Translationsmechanismus ein vollständiges und voll funktionsfähiges Protein (Abb. 1). Die mRNA befindet sich ausschließlich im Zytosol der Zielzelle und gelangt nie in den Zellkern. Sie kann auch nicht einfach in DNA (den Code unseres Erbguts) umgeschrieben werden, da die hierzu notwendigen Enzyme fehlen. Deshalb kann sie nicht in das Erbmaterial des Menschen eingebaut werden. Diese Sorge ist vollkommen unbegründet.
Wie wirkt ein mRNA-Impfstoff?
Das Ziel-Antigen (ein spezifisches Protein-Virusmerkmal) wird auf Basis der injizierten mRNA in der Zelle produziert und löst die gewünschte Immunreaktion aus. Das Antigen wird dabei so gewählt, dass es nicht erst nach Infektion der Zellen freigesetzt wird, sondern bestenfalls auf der Virusoberfläche erkennbar ist. Somit kann bereits die Infektion der Zellen verhindert werden. Im Falle des Impfstoffs gegen SARS-CoV-2 handelt es sich bei dieser Information um den Bauplan für das Spike-Protein.
Das Spike-Protein ist für den Eintritt in die Wirtszelle verantwortlich. Es ist selbst nicht infektiös und stellt keine lebende "abgeschwächte Virusform" dar [7]. Das nach der Impfung von den Körperzellen an den Ribosomen hergestellte Spike-Protein kann sowohl über Humane Leukozytenantigen(HLA)-Rezeptoren präsentiert als auch in die Blutbahn freigesetzt werden und hier zu antigenpräsentierenden Zellen gelangen. Beide Möglichkeiten führen sowohl zu einer humoralen als auch einer zellulären Immunantwort durch Produktion von Antikörpern bzw. Stimulation von T-Zellen (Abb. 1) [7].
Bei Kontakt des Körpers mit SARS-CoV-2 wird das an der Oberflächenstruktur vorhandene "echte" Spike-Protein schnell erkannt. Dabei binden die zirkulierenden, gegen SARS-CoV-2-Spike gerichteten neutralisierenden Antikörper an das Spike-Protein und "neutralisieren" es, sodass das Virus nicht in die Zelle eintreten kann. Außerdem unterstützen spezifische T-Zellen das Immunsystem. Sie können infizierte Zellen dadurch auch direkt eliminieren [8, 9]. Die Immunantwort nach einer mRNA-Impfung umfasst also sowohl den humoralen (Antikörper) als auch den zellulären Arm des Immunsystems (spezifische T-Gedächtniszellen). Aus diesem Grund kann eine Impfantikörper-Bestimmung auch nur einen Teil der Immunantwort abbilden.
Da es sich bei SARS-CoV-2 um ein sehr mutationsfreudiges Virus handelt, kann sich auch die Zielstruktur der mRNA-Impfstoffe rasch ändern. Eine Infektion mit einer neuen Virus-Variante kann weniger effektiv bekämpft werden. Generell besteht jedoch weiterhin eine gewisse Immunität.
Vorteile und Limitationen gegenüber herkömmlichen Impfstoffen
Bei herkömmlichen Impfstoffen dauert es oft sehr lange, bis die gewünschte Vakzine einsatzbereit ist. Die Proteine, die als Antigene fungieren sollen, müssen zunächst aus den Viren selbst gewonnen werden. Dies setzt eine vorherige Anzucht der Viren voraus. Bei der Herstellung des Influenza-Impfstoffs erfolgt dies in Hühnereiern, was das allergene Potenzial eines solchen Impfstoffs erklärt. Andere Impfstoffproteine werden in Zellkulturen gezüchtet. Auch die Aufreinigung der Virusbestandteile ist sehr zeitaufwendig. Bei neu auftretenden Virusvarianten muss der Prozess neu begonnen werden [7].
mRNA-Impfstoffe lassen sich hingegen relativ leicht und in großer Menge aus der DNA-Sequenz des Ziel-Virusproteins herstellen. Hierfür werden nur sehr kleine Virusmengen benötigt. Der rasche und sichere Herstellungsprozess ist daher im Vergleich zu herkömmlichen Vakzinen auch deutlich kostengünstiger. Als Antwort auf neue Virusmutationen kann der Impfstoff zudem sehr schnell durch eine veränderte Gensequenz angepasst werden [10].
Die mRNA-Vakzinen sind Totimpfstoffe. Im Gegensatz zu Lebendimpfstoffen ist daher die Anwendung bei immunsupprimierten Patienten, entsprechend der inaktivierten und Subunit-Impfstoffe, bedenkenlos möglich. Ein weiterer Vorteil liegt darin, dass die mRNA selbst adjuvante, immunstimulierende Eigenschaften besitzt. Die gleichzeitige Applikation von sog. Adjuvanzien (z. B. Aluminiumsalze, Öl-in-Wasser-Emulsionen, 3-O-Desacyl-monophosphoryl Lipid A) ist daher nicht erforderlich [11].
Während Adjuvanzien in Form von Restbestandteilen im Körper verbleiben können, werden die Komponenten eines mRNA-Impfstoffs rasch abgebaut [12]. Kürzlich konnte u. a. gezeigt werden, dass die für die COVID-19-Impfung verwendete mRNA eine ausgeprägte TLR7/8-vermittelte Typ-1-Interferon- und Interleukin-6-Antwort auslöst und damit eine robuste cytotoxische T-Zell(CTL)-, B-Zell- und natürliche Killerzell(NK)-Proliferation induziert, was eine effiziente antivirale Immunantwort ermöglicht [11].
Ein Nachteil der mRNA-Technologie besteht darin, dass man ausschließlich gegen Protein-Antigene immunisieren kann. Andere Zielstrukturen wie Polysaccharide können hier nicht als Zielantigen verwendet werden. Problematisch ist zudem die Notwendigkeit sehr niedriger Temperaturen für die Langzeit-Lagerung (-25 °C bis -15 °C bzw. -90 °C bis -60 °C, je nach Impfstoff). Es laufen jedoch bereits Studien zur Erprobung eines COVID-19-mRNA-Impfstoffs, der deutlich länger kühlschrankstabil ist sowie zu einer möglichen lyophilisierten Formulierung (BNT162b2, NCT04816669) [13].
Ausblick
Da es eine globale Antwort auf globale infektiologische Probleme wie die COVID-19-Pandemie braucht, wären modulare und mobile Produktionsstätten für mRNA-Impfstoffe von großem Vorteil. Damit könnte potenziell in allen Ländern der Welt Impfstoff lokal produziert und appliziert werden. Eine Initiative in diese Richtung stellen die sog. BioNTainer dar, die beispielsweise in afrikanischen Ländern eine lokale Produktionsstätte für mRNA-Impfstoffe ermöglichen sollen. Der BioNTainer wird so ausgestattet sein, dass er eine Reihe von mRNA-basierten Impfstoffen herstellen kann, die auf die Bedürfnisse des jeweiligen Landes abgestimmt werden sollen [14].
Nicht erst seit der Entwicklung der COVID-19-Impfstoffe wird die mRNA-Technologie angewandt. Erste Nukleinsäure-basierte Vakzine wurden Anfang der 1990er-Jahre erfolgreich in Tierversuchen eingesetzt, als man nach Injektion von mRNAs die entsprechend zu erwartenden codierten Proteine in der Maus nachweisen konnte [15]. 2008 gab es erste Erfolge bei der Entwicklung eines mRNA-Impfstoffs gegen Melanome. Über 50% der mRNA-Impfstoffe richten sich gegen verschiedene Krebserkrankungen.
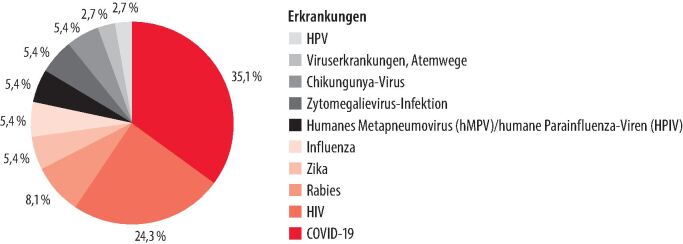
Zukünftig werden weitere relevante Infektionserkrankungen Ziel der mRNA-Impfstoffentwicklung sein. In der Entwicklungspipeline finden sich u. a. Impfstoffe gegen Dengue, Ebola, Malaria, das Marburg- und Lassafiebervirus sowie Tuberkulose, HIV, HSV-2 und Influenza (Abb. 2) [16]. Gegenstand aktueller Forschung ist zudem die sog. "self-amplifying mRNA": Diese Impfstoffe enthalten nicht nur mRNA, sondern auch eine Replikase, die ohne Hilfe des Ribosoms selbst die mRNA amplifiziert [17]. Die mRNA-Technologie hat also eine Zeitenwende eingeleitet und die kommenden Jahre werden vermutlich weitere Erfolge zeigen. Es bleibt spannend.

Autoren:
PD Dr. med. Ulrich von Both
Abteilung Pädiatrische Infektiologie, Kinderklinik und Kinderpoliklinik im Dr. von Haunerschen Kinderspital, LMU Klinikum, Ludwig-Maximilians-Universität Lindwurmstr. 4, D-80337 München, ulrich.von.both@med.lmu.de
Dr. med. Lena Teresa Birzele
Abteilung Pädiatrische Infektiologie, Kinderklinik und Kinderpoliklinik im Dr. von Haunerschen Kinderspital, LMU Klinikum, München
Fazit für die Praxis.
Die mRNA-Impfstoff-Technologie ist eine neue, sichere und kostengünstige Alternative zu herkömmlichen Impfstoffen.
Eine Immunisierung ist grundsätzlich nur gegen Proteinantigene möglich.
Aufgrund der zahlreichen Vorteile (relativ schnelle und sichere Entwicklung, rasche Anpassungsfähigkeit an neue Virusvarianten, kein Adjuvans erforderlich) eröffnen sich in Zukunft sowohl in der Infektiologie als auch bei anderen Erkrankungen (z. B. Krebstherapie, Diabetes) viele neue Möglichkeiten.
Supplementary Information
Interessenkonflikt
Die Autoren erklären, dass sie keine Interessenkonflikte anzugeben haben.
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.