Abstract
目的
基于脑-肠轴水平探究儿童功能性消化不良(functional dyspepsia,FD)与降钙素基因相关肽(calcitonin gene-related peptide,CGRP)、摄食抑制因子(nesfatin-1)及生长激素释放肽(ghrelin)等脑-肠肽水平的关系。
方法
回顾性选取2019年11月至2020年12月就诊于中国医科大学附属盛京医院FD患儿38例纳入FD组,另选取健康儿童34例纳入健康对照组。采集两组患儿的血清标本,应用酶联免疫吸附测定法分别测定两组儿童CGRP、ghrelin及nesfatin-1的血清水平并进行比较。同时对FD患儿FD症状进行评分,采用Spearman秩相关分析症状评分与脑-肠肽血清水平的相关性。
结果
FD组患儿血清nesfatin-1和CGRP水平均高于健康对照组(P<0.05);两组血清ghrelin水平差异无统计学意义(P>0.05)。nesfatin-1血清水平与早饱症状评分呈正相关(rs =0.553,P<0.001),与FD总评分未见明显相关性(rs =0.191,P=0.250);CGRP血清水平与腹痛症状评分呈正相关(rs =0.479,P=0.002),与嗳气症状评分呈正相关(rs =0.619,P<0.001),与FD总评分呈正相关(rs =0.541,P<0.001)。
结论
CGRP及nesfatin-1在FD的病理生理过程中可能发挥重要作用。
Keywords: 功能性消化不良, 降钙素基因相关肽, 摄食抑制因子, 生长激素释放肽, 儿童
Abstract
Objective
To study the association between functional dyspepsia (FD) and serum levels of brain-gut peptides including calcitonin gene-related peptide (CGRP), nesfatin-1, and ghrelin in children.
Method
A total of 38 children with FD who attended Shengjing Hospital of China Medical University from November 2019 to December 2020 were enrolled as the FD group. Thirty-four healthy children were enrolled as the control group. Serum samples were collected from all of the children. Enzyme-linked immunosorbent assay was used to measure serum levels of CGRP, ghrelin, and nesfatin-1 for comparison between the two groups. The scores of clinical symptoms were determined for the children with FD. Spearman rank correlation analysis was used to investigate the correlation of symptom scores with the serum levels of brain-gut peptides.
Results
The FD group had significantly higher serum levels of nesfatin-1 and CGRP than the control group (P<0.05), while there was no significant difference in the serum level of ghrelin between the two groups (P>0.05). The serum level of nesfatin-1 was positively correlated with the symptom score of early satiety (rs =0.553, P<0.001), but was not significantly correlated with the total score of FD (rs =0.191, P=0.250). The serum level of CGRP was positively correlated with the scores of abdominal pain (rs =0.479, P=0.002) and belching (rs =0.619, P<0.001) and the total score of FD (rs =0.541, P<0.001).
Conclusions
CGRP and nesfatin-1 may play an important role in the pathophysiological process of FD.
Keywords: Functional dyspepsia, Calcitonin gene-related peptide, Nesfatin-1, Ghrelin, Child
功能性消化不良(functional dyspepsia,FD)是指以反复发作的餐后早饱、饱胀感、上腹疼痛及烧灼感为特征,且经过医疗评估后不能归因于其他疾病的临床症候群。目前,其病理机制尚不明确,可能与胃肠运动障碍、内脏高敏感性、肠道菌群的改变及社会心理等因素相关,近年来脑-肠轴紊乱被认为是功能性腹痛的核心因素,罗马Ⅳ指南提出功能性胃肠病是脑肠相互作用障碍性疾病。脑-肠轴是神经系统及胃肠道之间的双向交互系统,通过这种交互作用大脑及情绪状态自上而下影响胃肠稳态及功能,胃肠系统自下而上影响脑功能及行为。神经系统通过中枢神经系统、自主神经系统及肠神经系统实现对胃肠道的调节。胃肠道产生多种信号分子通过血流穿过血脑屏障到达中枢,或直接作用于特异性受体实现对胃肠道的调节[1-2]。脑-肠肽是在神经系统及消化系统双重分布的小分子肽类物质,具有激素及神经递质的功能,是脑-肠轴的重要物质基础。
在Liu等[3]的研究中,婴儿期FD大鼠出现脑-肠肽水平降低及脑-肠轴受损,经药物治疗症状缓解后,脑-肠肽水平升高。He等[4]的研究表明药物可能通过调节脑-肠轴的稳态增强胃肠动力。Cordner等[5]提出FD临床表型与胃肥大细胞增生相关,而肥大细胞诱导的迷走神经活动可能为疼痛、焦虑及抑郁加剧的原因,提示腹痛与精神系统疾病之间存在基于脑-肠轴的自下而上的调节机制。以上研究均提示脑-肠轴在FD中发挥重要作用。
现国内外有较多研究表明降钙素基因相关肽(calcitonin gene-related peptide,CGRP)、摄食抑制因子-1(nesfatin-1)及生长激素释放肽(ghrelin)等脑-肠肽在FD的胃酸分泌、食物摄入、胃肠动力及疼痛传递等方面发挥重要作用,但多为成人研究或动物实验,儿童研究十分有限。本研究回顾性选取了38例就诊于中国医科大学附属盛京医院的FD患儿为研究对象,检测其血清中脑-肠肽水平,并与健康儿童进行对照分析,从而探究血清脑-肠肽与儿童FD的关系。
1. 资料与方法
1.1. 一般资料
回顾性选取2019年11月至2020年12月就诊于中国医科大学附属盛京医院小儿消化内科门诊的FD患儿38例纳入FD组,其中男18例,女20例,年龄3~13岁,平均年龄(6.9±2.9)岁;另选取就诊于发育儿科门诊的健康儿童34例纳入健康对照组,其中男22例,女12例,年龄3~12岁,平均年龄(6.2±2.9)岁。将两组儿童的一般资料进行比较,性别及年龄的差异无统计学意义(P>0.05)。本研究已通过中国医科大学附属盛京医院医学伦理委员会批准(2020PS813K)。
1.2. 纳入及排除标准
FD组纳入标准为:年龄3~14岁,性别不限。符合罗马Ⅳ的FD诊断标准[6],即诊断前至少2个月内出现符合以下1种或多种症状,且每个月至少4 d是有症状的,包括餐后饱胀、早饱、上腹疼痛或烧灼感,与排便无关;经过适当评估,上述症状不能用其他疾病完全解释。
FD组排除标准为:(1)患有或诊断过器质性胃肠道疾病,如:食管炎、消化性溃疡;(2)患有其他类型的功能性胃肠道疾病;(3)胃肠道畸形及发育异常;(4)患有精神神经系统疾病;(5)患有全身性疾病,如糖尿病或甲状腺疾病等;(6)拒绝进行相关检查或临床资料不完善。
健康对照组入选标准为:年龄3~14岁,性别不限,无消化系统症状,且经体格检查、血尿便常规、肝肾功能、心电图、腹部超声排除消化系统疾病的儿童。
1.3. 实验材料及方法
采集两组儿童的血清标本,应用酶联免疫吸附测定法,严格按照试剂盒说明书,分别测定两组儿童血清ghrelin(试剂盒购自美国SIGMA公司)、CGRP(试剂盒购自武汉优尔生生物公司)及nesfatin-1(试剂盒购自美国PHOENIX公司)的水平。同时使用功能性消化不良症状评分表对每名患儿症状进行评分。
1.4. FD症状评分
采用FD症状评分表[7]对患儿上腹痛、腹胀或上腹不适、早饱、食欲不振或食量减少、嗳气、恶心呕吐6个症状进行评分,每个症状又从严重程度及频率2个方面进行评估。严重程度分为5个等级:0分:无症状;1分:症状轻微可以被忽略;2分:症状不能被忽略,但可以忍受,不影响生活及学习;3分:症状严重,影响生活及学习;4分:症状极其严重,严重影响日常活动或需要休息。频率分为5个等级:0分:无;1分:<3次/周;2分:≥3次/周,非每日出现;3分:每日间断出现;4分:每日几乎持续出现。
1.5. 统计学分析
采用SPSS 21.0软件对数据进行统计分析及处理,符合正态分布的计量资料采用均数±标准差( )表示,不符合正态分布的计量资料采用中位数(四分位数间距)[M(P 25,P 75)]表示,两组间比较采用Mann-Whitney U检验。脑-肠肽水平与年龄的相关性及脑-肠肽水平与FD评分的相关性采用Spearman秩相关分析。P<0.05为差异有统计学意义。
2. 结果
2.1. FD组患儿评分结果
FD组患儿上腹痛评分为4(3,5)分,腹胀或上腹不适评分为2(0,2)分,早饱评分为3(0,4)分,食欲不振或食量减少评分为2(0,3)分,嗳气评分为2(0,4)分,恶心呕吐评分为1(0,2)分,总分为13.00(7.75,16.00)分。
2.2. 3种脑-肠肽在两组间的差异性比较
FD组血清nesfatin-1和CGRP水平均高于健康对照组(P<0.05);两组血清ghrelin水平比较差异无统计学意义(P>0.05)。见表1。
表1.
两组儿童3种脑-肠肽的血清水平比较
| 组别 | 例数 | nesfatin-1 (ng/mL) | CGRP (pg/mL) | ghrelin (ng/mL) |
|---|---|---|---|---|
| 健康对照组 | 34 | 19.3(14.4, 24.2) | 318(260, 371) | 3.2(1.9, 7.2) |
| FD组 | 38 | 21.5(19.0, 27.5) | 354(309, 462) | 3.4(2.3, 8.7) |
| Z值 | -2.375 | -2.662 | -0.761 | |
| P值 | 0.018 | 0.008 | 0.446 |
注:[nesfatin-1]摄食抑制因子-1;[CGRP]降钙素基因相关肽;[ghrelin]生长激素释放肽。
[M(P 25,P 75)]
2.3. 健康对照组中3种脑-肠肽水平与年龄的相关性分析
血清CGRP水平、nesfatin-1水平及ghrelin水平与年龄均无相关性(分别rs =-0.252、0.054、0.250,均P>0.05)。
2.4. FD组nesfatin-1及CGRP血清水平与FD症状评分相关性分析
nesfatin-1血清水平与早饱症状评分呈正相关(rs =0.553,P<0.001),与FD总评分未见明显相关关系(rs =0.191,P=0.250);CGRP血清水平与腹痛症状评分呈正相关(rs =0.479,P=0.002),与嗳气症状评分呈正相关(rs =0.619,P<0.001),与FD总评分呈正相关(rs =0.541,P<0.001)。见图1,表2。
图1. FD组脑-肠肽水平与FD症状评分相关性分析.
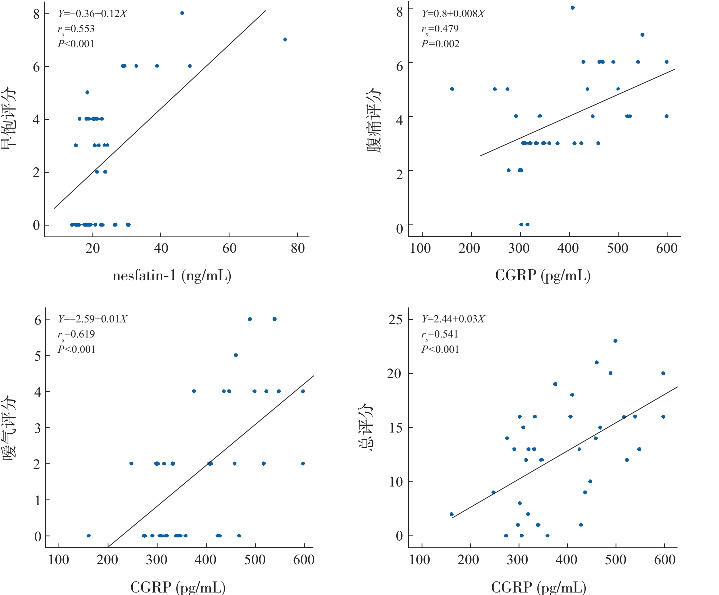
表2.
脑-肠肽血清水平与FD症状评分相关性分析
| 症状 | nesfatin-1 | CGRP | ||
|---|---|---|---|---|
| rs 值 | P值 | rs 值 | P值 | |
| 腹痛 | -0.215 | 0.195 | 0.479 | 0.002 |
| 腹胀或上腹不适 | -0.246 | 0.136 | 0.037 | 0.825 |
| 早饱 | 0.553 | <0.001 | 0.143 | 0.393 |
| 食欲不振或食量减少 | 0.004 | 0.980 | 0.148 | 0.377 |
| 嗳气 | 0.070 | 0.676 | 0.619 | <0.001 |
| 恶心呕吐 | 0.127 | 0.446 | 0.024 | 0.887 |
| 总分 | 0.191 | 0.250 | 0.541 | <0.001 |
注:[nesfatin-1]摄食抑制因子-1;[CGRP]降钙素基因相关肽。
3. 讨论
FD是常见的功能性胃肠病之一,主要表现为上腹痛、烧灼感、餐后饱胀及早饱。国外有研究显示每周有1.4%儿童出现上腹不适的症状,另一项研究显示5%~10%青少年具有消化不良症状[8]。因FD病理生理机制不明确,治疗效果常不理想。因此,研究其发病机制,寻找有效的治疗措施具有重要意义。
CGRP是一种由37个氨基酸构成的神经肽类物质,参与胃肠生理功能的调节及疼痛的传递。CGRP的生物合成与急慢性炎症反应及感觉通路的敏感化相关,能增强谷氨酸介导的神经递质的传递,而谷氨酸是伤害性初级传入神经元的主要神经递质。有研究[9-10]表明FD大鼠血清CGRP升高,且经治疗症状好转后逐渐下降,还有研究[11]表明FD患者胃黏膜CGRP水平与疼痛阈值呈负相关。本研究结果表明FD患儿空腹血清CGRP水平显著高于正常儿童,且FD患儿CGRP血清水平与腹痛、嗳气及FD总评分呈正相关。在一定程度上与上述研究结果一致,均提示CGRP与FD的发病机制密切相关,并且可能与腹痛及嗳气症状的产生有关。
ghrelin是一种由胃部的P/D1细胞产生的肽类物质,是生长激素促分泌素的内源性配体,其生理功能包括刺激食物摄入、调节胃酸分泌及促进胃排空等。因ghrelin具有多种消化道调节功能,考虑其可能与FD的病理生理机制相关。本研究结果显示FD组与健康对照组儿童血清ghrelin水平未见明显差异。目前FD与ghrelin相关性的研究尚无定论。大多数研究发现健康人与FD患者空腹ghrelin水平无显著差异[12-13]。然而Kim等[14]研究发现在FD患者中空腹血浆ghrelin水平与上腹疼痛程度呈负相关,与早饱程度呈正相关。还有研究表明FD大鼠ghrelin水平下降,上调ghrelin的表达可能是治疗FD的重要机制[15]。
nesfatin-1是一种由82个氨基酸构成的来源于核连蛋白2的肽类物质,由胃肠黏膜细胞及胰腺β细胞等内分泌细胞释放,并存在于肌肉及脂肪等外周组织中。nesfatin-1是食欲抑制因子及能量平衡的调节剂,在调节能量消耗及食物摄入方面发挥重要作用[16],还与内脏高敏感性相关[17]。此外,Jing等[18]的研究发现焦虑样FD大鼠模型血浆、下丘脑及胃组织中的nesfatin-1水平升高,提示其可以诱导焦虑样行为。在本研究中,FD组nesfatin-1血清水平显著高于健康对照组,与早饱症状的评分呈正相关,但与FD总评分未见明显相关关系,提示nesfatin-1在FD的发病中可能不参与直接作用,而与其中某种症状的产生相关。
FD症状的反复出现对儿童生长发育及学习生活产生重要影响,并且还对社会经济造成一定的压力,因此研究FD的发病机制,寻找有效的治疗措施具有重要意义。因儿童群体的特殊性,脑-肠肽相关的临床研究较少,大多数研究对象为动物及成年人。本研究收集了38例FD患儿的空腹血清进行脑-肠肽血清水平的检测,并且由专业人员对患儿的症状严重程度进行评分。结果表明CGRP及nesfatin-1在FD的病理生理过程中发挥重要作用,并且CGRP可能与腹痛及嗳气症状的产生相关,nesfatin-1可能与早饱症状的产生相关。研究中FD组与健康对照组的ghrelin血清水平未见明显差异,可能的原因为受到样本量及个体差异的影响。研究不足之处在于仅检测了血清中脑-肠肽水平,未对胃肠组织中脑-肠肽的表达进行检测;仅检测了治疗前的水平,未检测治疗后的水平,无法进行治疗前后的比较;并且可能存在一些影响脑-肠肽水平的未知因素,无法完全排除;此外,样本量较小,仍需大样本的研究。
利益冲突声明
所有作者均声明不存在利益冲突。
参考文献
- 1. Ding JH, Jin Z, Yang XX, et al. Role of gut microbiota via the gut-liver-brain axis in digestive diseases[J]. World J Gastroenterol, 2020, 26(40): 6141-6162. DOI: 10.3748/wjg.v26.i40.6141. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. Butler MI, Cryan JF, Dinan TG. Man and the microbiome: a new theory of everything?[J]. Annu Rev Clin Psychol, 2019, 15: 371-398. DOI: 10.1146/annurev-clinpsy-050718-095432. [DOI] [PubMed] [Google Scholar]
- 3. Liu J, Li F, Tang XD, et al. XiangshaLiujunzi decoction alleviates the symptoms of functional dyspepsia by regulating brain-gut axis and production of neuropeptides[J]. BMC Complement Altern Med, 2015, 15: 387. DOI: 10.1186/s12906-015-0913-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4. He Y, Yang C, Wang P, et al. Child compound Endothelium corneum attenuates gastrointestinal dysmotility through regulating the homeostasis of brain-gut-microbiota axis in functional dyspepsia rats[J]. J Ethnopharmacol, 2019, 240: 111953. DOI: 10.1016/j.jep.2019.111953. [DOI] [PubMed] [Google Scholar]
- 5. Cordner ZA, Li Q, Liu L, et al. Vagal gut-brain signaling mediates amygdaloid plasticity, affect, and pain in a functional dyspepsia model[J]. JCI insight, 2021, 6(6): 144046. DOI: 10.1172/jci.insight.144046. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Hyams JS, Di Lorenzo C, Saps M, et al. Functional disorders: children and adolescents[J]. Gastroenterology, 2016, 150(6): 1456-1468.e2. DOI: 10.1053/j.gastro.2016.02.015. [DOI] [PubMed] [Google Scholar]
- 7. Kim YS, Lee JS, Lee TH, et al. Plasma levels of acylated ghrelin in patients with functional dyspepsia[J]. World J Gastroenterol, 2012, 18(18): 2231-2237. DOI: 10.3748/wjg.v18.i18.2231. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. Hyams JS, Di Lorenzo C, Saps M, et al. Childhood functional gastrointestinal disorders: child/adolescent[J]. Gastroenterology, 2016, 150(6): 1456-1468.E2. DOI: 10.1053/j.gastro.2016.02.015. [DOI] [PubMed] [Google Scholar]
- 9. Zhu J, Tong H, Ye X, et al. The effects of low-dose and high-dose decoctions of fructus aurantii in a rat model of functional dyspepsia[J]. Med Sci Monit, 2020, 26: e919815. DOI: 10.12659/MSM.919815. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. 徐派的, 张红星, 杨云, 等. 电针对功能性消化不良模型大鼠胃肠动力及VIP和CGRP水平的影响[J]. 中国中西医结合杂志, 2017, 37(3): 360-364. DOI: 10.7661/CJIM.2017.03.0360. [DOI] [PubMed] [Google Scholar]
- 11. Mönnikes H, van der Voort IR, Wollenberg B, et al. Gastric perception thresholds are low and sensory neuropeptide levels high in helicobacter pylori-positive functional dyspepsia[J]. Digestion, 2005, 71(2): 111-123. DOI: 10.1159/000084625. [DOI] [PubMed] [Google Scholar]
- 12. Shindo T, Futagami S, Hiratsuka T, et al. Comparison of gastric emptying and plasma ghrelin levels in patients with functional dyspepsia and non-erosive reflux disease[J]. Digestion, 2009, 79(2): 65-72. DOI: 10.1159/000205740. [DOI] [PubMed] [Google Scholar]
- 13. Lee KJ, Cha DY, Cheon SJ, et al. Plasma ghrelin levels and their relationship with gastric emptying in patients with dysmotility-like functional dyspepsia[J]. Digestion, 2009, 80(1): 58-63. DOI: 10.1159/000215389. [DOI] [PubMed] [Google Scholar]
- 14. Kim YS, Lee JS, Lee TH, et al. Plasma levels of acylated ghrelin in patients with functional dyspepsia[J]. World J Gastroenterol, 2012, 18(18): 2231-2237. DOI: 10.3748/wjg.v18.i18.2231. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. Tang L, Zeng Y, Li L, et al. Electroacupuncture upregulated ghrelin in rats with functional dyspepsia via AMPK/TSC2/Rheb-mediated mTOR inhibition[J]. Dig Dis Sci, 2020, 65(6): 1689-1699. DOI: 10.1007/s10620-019-05960-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. St-Pierre DH, Martin J, Shimizu H, et al. Association between nesfatin-1 levels and metabolic improvements in severely obese patients who underwent biliopancreatic derivation with duodenal switch[J]. Peptides, 2016, 86: 6-12. DOI: 10.1016/j.peptides.2016.09.014. [DOI] [PubMed] [Google Scholar]
- 17. Zhou XP, Sha J, Huang L, et al. Nesfatin-1/NUCB2 in the amygdala influences visceral sensitivity via glucocorticoid and mineralocorticoid receptors in male maternal separation rats[J]. Neurogastroenterol Motil, 2016, 28(10): 1545-1553. DOI: 10.1111/nmo.12853. [DOI] [PubMed] [Google Scholar]
- 18. Jing FC, Zhang J, Feng C, et al. Potential rat model of anxiety-like gastric hypersensitivity induced by sequential stress[J]. World J Gastroenterol, 2017, 23(42): 7594-7608. DOI: 10.3748/wjg.v23.i42.7594. [DOI] [PMC free article] [PubMed] [Google Scholar]


