Abstract
COVID-19 (Coronavirus Disease 2019) ist eine durch SARS-CoV‑2 (schweres akutes respiratorisches Syndrom Coronavirus-2) verursachte Systemerkrankung, die häufig mit Hautmanifestationen einhergeht. Die 5 häufigsten Hautläsionen sind der Pseudo-Chilblain sowie makulopapulöse, urtikarielle, vesikuläre und livedoartige/nekrotisierende Hautveränderungen. Diese Hautläsionen haben eine diagnostische und prognostische Relevanz. So können beispielsweise bei Kindern typische Hautläsionen auf ein lebensbedrohliches inflammatorisches Syndrom hinweisen, das selten nach einer Corona-Infektion auftritt. Auch nach COVID-19-Impfungen wurden Hautveränderungen beschrieben. Diese zeigen meist einen komplikationslosen, selbstlimitierenden Verlauf und stellen daher in den allermeisten Fällen keine Kontraindikation zur Komplettierung des Impfstatus dar.
Schlüsselwörter: COVID-19-Vakzin, Herpes, Kinder, SARS-CoV‑2, Allergische Reaktion
Abstract
Coronavirus disease 2019 (COVID-19) is a systemic disease induced by severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) that frequently presents with skin manifestations. The five most common skin lesions are pseudo-chilblain and maculopapular, urticarial, vesicular, and livedo/necrotizing skin lesions. These skin lesions are of diagnostic and prognostic relevance. For example, in children, typical skin lesions may indicate a life-threatening inflammatory syndrome, which rarely occurs after corona infection. Skin lesions have also been described after COVID-19 vaccination. These usually show an uncomplicated, self-limiting course and therefore do not represent a contraindication for completing the vaccination status in the vast majority of cases.
Keywords: COVID-19 vaccine, Herpes, Children, SARS-CoV‑2, Allergic reaction
Das neue Virus SARS-CoV‑2 (schweres akutes respiratorisches Syndrom Coronavirus-2) führte zu einer Pandemie, die die Welt seit gut 2 Jahren in Atem hält. Es verursacht COVID-19 (Coronavirus Disease 2019). COVID-19 befällt neben multiplen Organen auch die Haut. Da Hautveränderungen das erste klinische Symptom von COVID-19 sein können, sind diese von diagnostischer Relevanz [38]. Auch die seit Dezember 2020 verfügbaren Impfstoffe können selten zu allergischen Reaktionen führen oder mit meist mild verlaufenden Hautsymptomen einhergehen.
Auftreten eines neuen Virus und zeitlich assoziierter Hautveränderungen
Im Dezember 2019 wurde die World Health Organization (WHO) offiziell über die Ausbreitung eines neuen Pneumonie verursachenden Virus in der Stadt Wuhan in China informiert [41]. Dieses Virus, das im Verlauf den Namen SARS-CoV‑2 erhielt, verursacht die Erkrankung COVID-19. Nachdem sich am 30.01.2020 SARS-CoV‑2 offiziell international verbreitet hatte [39], begann im März 2020 der erste große COVID-19-Ausbruch auf dem europäischen Kontinent in Italien [33].
Initial wurde primär von respiratorischen Beschwerden bei den Patienten berichtet [13], jedoch zeigte sich mit steigender Anzahl an Infektionen, dass auch Hautveränderungen im Zusammenhang mit COVID-19 auftreten können. So wurde im März 2020 erstmals über einen Patienten mit petechialem Exanthem bei positivem PCR(Polymerasekettenreaktion)-Test berichtet [22]. Fortan mehrten sich die Berichte hinsichtlich Hautveränderungen bei COVID-19.
Pathophysiologie
Die Pathomechanismen, die zu Hautveränderungen bei COVID-19 führen, sind komplex und noch nicht abschließend geklärt. Eine detaillierte Übersicht über die aktuell diskutierten Mechanismen würde einen eigenen Beitrag erfordern. Für Interessierte verweisen wir daher auf weiterführende Literatur [10, 21, 27]. Im Folgenden gehen wir auf einige ausgewählte, mögliche Mechanismen ein, die zur Erklärung der auftretenden Hautläsionen in der Literatur besprochen werden:
SARS-CoV‑2 kann Zellen der Haut direkt infizieren und hierdurch eine Entzündungsreaktion auslösen [5]. Die intrazelluläre Aufnahme des Virus wird dabei primär durch die Bindung des viralen Spike-Proteins an den Angiotensin-konvertierendes Enzym-2-Rezeptor (ACE2) vermittelt [24, 25]. ACE2 wurde mittels immunhistochemischer Färbungen auf Zelloberflächen vieler Hautzellen, beispielsweise in den Haarfollikeln, den Schweißdrüsen und an den Blutgefäßen, nachgewiesen [19]. Zudem zeigten mRNA-Analysen eine starke Expression des Rezeptors auf Keratinozyten [40]. Auch wir konnten elektronenmikroskopisch direkt intakte SARS-CoV-2-Viruspartikel in den Schweißdrüsen eines an COVID-19 verstorbenen Patienten nachweisen (Abb. 1).
SARS-CoV‑2 verursacht eine starke Typ-1-Interferon-induzierte Inflammation, die mit einer Aktivierung des Monozyten-Makrophagen-Systems einhergeht und in deren Folge es auch zur Induktion der intrinsischen und extrinsischen Gerinnung kommt [21]. Diese Gerinnungsstörungen können verschiedenste Hautveränderungen auslösen.
Pseudovirione, d. h. Bestandteile des eliminierten Virus, können auch noch Tage nach einer überstandenen SARS-CoV-2-Infektion den ACE2-Rezeptor binden und aktivieren. Darüber hinaus können Pseudovirione mit Antikörpern Aggregate bilden und so das Komplementsystem aktivieren [27].
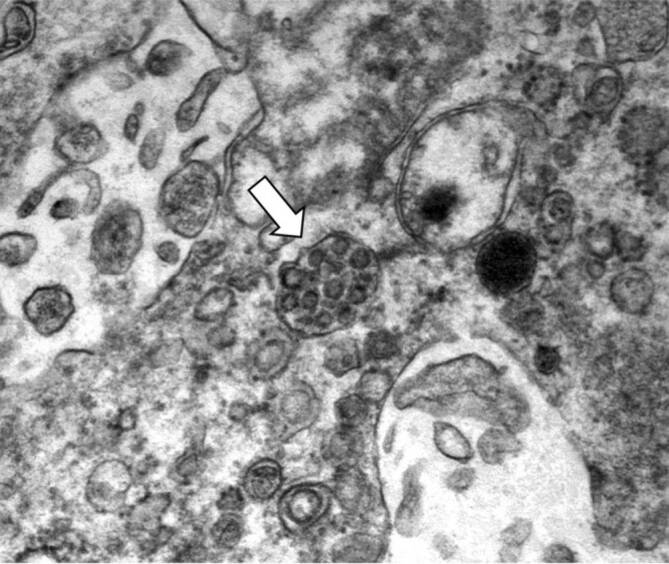
Die beiden zuletzt genannten Mechanismen liefern mögliche Erklärungen dafür, dass Hautsymptome verzögert auftreten können, auch wenn das Virus mittels PCR(Polymerasekettenreaktion)-Test bereits nicht mehr nachweisbar ist.
Die 5 häufigsten Hautveränderungen bei COVID‑19
Hautveränderungen bei COVID-19 sind sehr vielfältig und können das alleinige Symptom einer frühen SARS-CoV-2-Infektion sein [14]. Eine Studie aus Großbritannien zeigte, dass Hautveränderungen sogar stärker mit einem positiven SARS-CoV-2-Test korrelieren als das Symptom Fieber [38]. Daher sollte bei neu aufgetretenen, COVID-19-typischen Hautveränderungen ein SARS-CoV-2-Test erwogen werden.
Hautveränderungen können das alleinige Symptom einer frühen SARS-CoV-2-Infektion sein
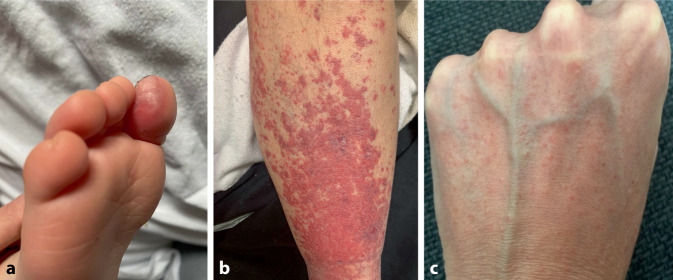
Hautveränderungen treten je nach Literaturquelle bei 5–20 % der COVID-19-Patienten auf [14]. Im Rahmen einer größeren Studie aus Spanien mit 405 Patienten konnten 5 häufige COVID-19-assoziierte Gruppen von Hautmanifestationen identifiziert werden [11]. Diese Einteilung wurde im Verlauf durch 2 Metastudien bestätigt [14, 36]. Die 5 häufigsten COVID-19-assoziierten Hautveränderungen umfassen den Pseudo-Chilblain sowie makulopapulöse, urtikarielle, vesikuläre und livedoartige/nekrotisierende Hautveränderungen (Tab. 1; [11, 14, 36]).
| Hautmanifestation | Häufigkeit (%) | Mittleres Alter (Jahre) | Besonderheiten |
|---|---|---|---|
| Pseudo-Chilblain | 40a | 23,2b | Häufig PCR negativc |
| Makulopapulös | 28a | 53,2b | Differenzialdiagnose: Arzneimittelexanthem |
| Urtikariell | 12,5a | 38,3b | Pruritus in 92 % der Fälled |
| Vesikulär | 11a | 48,3b | Am häufigsten initiales Zeichen von COVID-19 (8,5 %)b |
| Livedo-nekrotisch/vaskulär | 4a | 77,5b | Höchste assoziierte Mortalitätsratea |
Die häufigste (41 % aller Hautläsionen) und vielleicht auch bekannteste Hautmanifestation ist der Pseudo-Chilblain, umgangssprachlich auch als COVID-Zeh bezeichnet (Abb. 2; [36]). Dieser zeigt sich in Form von akral-lokalisierten, erythematösen Plaques, die selten auch Vesikel und Pusteln aufweisen. In 30 % der Fälle werden die Läsionen von Pruritus oder Schmerzen begleitet. Der Pseudo-Chilblain tritt eher im späten Krankheitsverlauf auf und ist mit einem milden Krankheitsgeschehen assoziiert [11]. Letzteres mag auch an dem mit 23,2 Jahren durchschnittlich jungen Alter der Patienten liegen [14]. Die meisten Patienten mit Pseudo-Chilblain wiesen einen negativen PCR-Test auf [23].
Die zweithäufigste Hautmanifestation (28 %) ist das makulopapulöse Exanthem (Abb. 2; [36]). Dieses kann eine fein-lamelläre Schuppung aufweisen und geht in 56 % der Fälle mit Pruritus einher. Die Verteilung kann sowohl akral als auch stammbetont sein und zusätzlich auch die Schleimhäute betreffen [11]. Das Exanthem tritt meist zeitgleich mit anderen COVID-19-Symptomen auf [14].
Urtikarielle Hautveränderungen kommen in 12,5 % der Fälle vor [36]. Sie sind fast immer mit Pruritus assoziiert (92 %) und sprechen gut auf Antihistaminika an. Die Urtikae sind entweder stammbetont oder disseminiert verteilt [11]. Diese Form der Hautmanifestation zeigt sich ebenfalls überwiegend zeitgleich mit anderen COVID-19-Symptomen [14].
Vesikuläre Hautveränderungen sind in etwa gleich häufig wie urtikarielle Hautmanifestationen [36]. Sie erscheinen als monomorphe, meist einzeln stehende Vesikel auf erythematösem Grund, die an Varizellen erinnern. Die Vesikel können jedoch auch konfluieren und hämorrhagisch imponieren. Sie zeigen sich hauptsächlich am Rumpf und an den Extremitäten [11]. Vesikuläre Hautläsionen wurden häufig als erstes klinisches Symptom von COVID-19 beschrieben [14] und sind daher von besonderer diagnostischer Relevanz.
Die seltensten COVID-19-assoziierten Hautmanifestationen (4 %) sind die Livedo-nekrotischen oder auch vaskulären Hautveränderungen (Abb. 2; [11, 14, 36]). Vaskuläre Hautveränderungen zeigen sich in Form von Livedo racemosa, Purpura, Ischämien und Nekrosen, prädominant am Stamm und den Extremitäten [11, 36]. Sie treten überwiegend bei hochbetagten Patienten auf [14] und gehen mit einer deutlich erhöhten Mortalitätsrate von bis zu 20 % einher [36]. Es entwickelten sich bei diesen Patienten vermehrt Pneumonien [11] und disseminierte intravasale Gerinnungsstörungen [26].
In zahlreichen Fallberichten und Fallserien wurden weitere Hautläsionen in zeitlicher Korrelation zu COVID-19 beschrieben. Diese sind deutlich seltener und machen weniger als 5 % aller Hautmanifestationen aus [36]. Zu nennen wären beispielsweise das Erythema exsudativum multiforme (EEM) [14, 34] und die palmoplantare Erythrodysästhesie [30]. Ferner wurde ein breites Spektrum an Pathologien der Hautanhangsgebilde beschrieben, wie beispielsweise Nagelveränderungen in Form von Mees-Bändern [17, 31] und die Erstmanifestation einer Alopecia areata 1 Monat nach Infektion [9].
Hautveränderungen bei Kindern mit COVID-19
Bei Kindern kommen Hautsymptome deutlich seltener vor als bei Erwachsenen. Hoang et al. zeigten, dass nur 0,25 % von 2445 infizierten Kindern Hautveränderungen aufwiesen [20]. Doch auch bei Kindern konnten die oben beschriebenen 5 häufigsten Gruppen von Hautläsionen beobachtet werden [1–3].
Darüber hinaus finden sich charakteristische Hautsymptome beim gefürchteten Kawasaki-artigen inflammatorischen Syndrom, das auch als pädiatrisches inflammatorisches multisystemisches Syndrom (PIMS) oder im Englischen als „multisystem inflammatory syndrome in children“ (MIS-C) bekannt ist. Das PIMS tritt meist Wochen nach einer SARS-CoV-2-Infektion auf. Aufgrund der häufigen Schocksymptomatik (57 %) und der Myokarditis mit ventrikulärer Funktionsstörung (76 %) kann die Erkrankung einen letalen Verlauf nehmen. Dabei sind die betroffenen Kinder und Jugendlichen im Median 7,9 Jahre alt (3,7 bis 16,6 Jahre). Diagnostisch bedeutsame Hautveränderungen, die während des PIMS auftreten, umfassen eine beidseitige Konjunktivitis, ein makulopapulöses Exanthem an Stamm und Extremitäten, akrale Erytheme und Schwellungen, Desquamation im Gesicht und am Perineum, eine gerötete Zunge sowie gerötete und rissige Lippen [2, 37]. Werden diese Hautveränderungen bei Kindern beobachtet, sollte auf kardiovaskuläre und gastrointestinale Symptome geachtet werden [37] und eine zeitnahe Krankenhauseinweisung erwogen werden.
Hautveränderungen nach COVID-19-Impfungen
Am 21.12.2020 erhielt das Mainzer Pharmaunternehmen BioNTech als erstes Unternehmen in Deutschland eine bedingte Zulassung für den Messenger-Ribonukleinsäure(mRNA)-basierten Impfstoff Comirnaty®. Weitere Impfstoffe folgten von Moderna (mRNA, Spikevax®, Cambridge/USA), AstraZeneca (Vektor, Vaxzevria®, Cambridge/Vereinigtes Königreich) und Johnson & Johnson (Vektor, Janssen®, New Brunswick/USA). Die mRNA-Impfstoffe setzten sich in der Europäischen Union als die am meisten verwendeten Impfstoffe durch [15].
Bereits in den Zulassungsstudien der mRNA-Impfstoffe zeigte sich, dass Impfstoff-assoziierte Hautveränderungen in Form von verzögerten Lokalreaktionen (ab dem 8. Tag) mit Schwellung und Erythem an der Injektionsstelle auftreten können [6]. Mit steigender Anzahl an Impfungen wurden weitere Hautreaktionen in zeitlicher Assoziation mit der Impfung beschrieben [12, 28, 29]. Interessanterweise traten die Impfreaktionen in über 80 % der Fälle bei Frauen auf [12, 28].
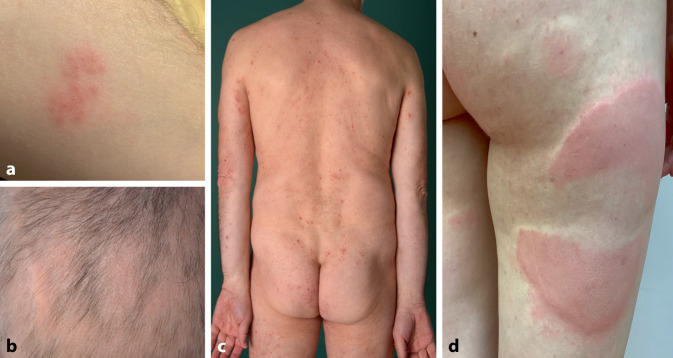
Die beste Datenlage zu Hautreaktionen nach COVID-19-Impfung existiert für mRNA-Impfstoffe [12, 28, 29]. McMahon et al. werteten 803 registrierte Fälle von Hautmanifestationen nach COVID-19-Impfung aus. In 94 % der Fälle wurde ein mRNA-Impfstoff verwendet. Dabei ergab sich folgende Liste der 7 häufigsten Hautveränderungen: Lokalreaktion (binnen eines Tages), verzögerte starke Lokalreaktion (nach 7 Tagen), Urtikaria (Abb. 3), morbilliformes Exanthem, Zoster-Reaktivierung, papulovesikuläre Reaktionen und Pityriasis-rosea-artige Reaktionen (Tab. 2; [29]).
| Hautmanifestation | Häufigkeit (%) | Lokalisation |
|---|---|---|
| Lokalreaktion | > 50b | Impfarmb |
| Verzögerte starke Lokalreaktion (nach 7 Tagen)b | 22a | Impfarmb |
| Urtikaria | 6,5a | Arme > Rumpf > Beineb |
| Morbilliformes Exanthem | 5,1a | Arme > Rumpf > Beineb |
| Zoster-Reaktivierung | 3,8a | Rumpf, Extremitäten, Gesichta |
| Papulovesikuläre Reaktionen | 3,0a | Rumpf und Extremitätena |
| Pityriasis-rosea-artige Reaktionen | 1,8a | Rumpfc |
Diese Hautnebenwirkungen führten bei Ärzten und v. a. bei Patienten zur Verunsicherung. Bei genauer Betrachtung der Datenlage sind die Hautveränderungen jedoch als eher mild und gut kontrollierbar einzustufen. Die meisten Hautreaktionen klangen binnen 14 Tagen komplikationslos ab. Eine Ausnahme bildeten Pityriasis-rosea-artige Reaktionen, die meist über 3 Wochen bis zur Abheilung benötigten. Therapeutische Maßnahmen erfolgten in 81 % der Fälle und bestanden hauptsächlich aus Antihistaminika, topischen Glukokortikosteroiden und/oder einer antiviralen Medikation bei Herpes-Reaktivierungen [12]. Die Wahrscheinlichkeit, nach der 1. Impfung auch auf die 2. Impfung Hautsymptome zu entwickeln, variiert je nach Literatur zwischen 8,5 % und 43 % [12, 28].
Die meisten Hautveränderungen sind als eher mild und gut kontrollierbar einzustufen
Darüber hinaus wurde eine Vielzahl an weiteren und selteneren Hautreaktionen im Zusammenhang mit der Impfung beschrieben wie das EEM, der Pseudo-Chilblain, die Erythromelalgie und Alopezien (Abb. 3; [29]). Diese Reaktionen, die auch nach einer SARS-CoV-2-Infektion auftreten, werden wahrscheinlich durch die künstlich mRNA-gesteuerte Produktion des Spike-Proteins ausgelöst [18].
Eine für die Patienten sehr unangenehme Impfreaktion ist die Reaktivierung eines Herpes zoster, die bei etwa 3,8 % der Patienten auftritt [12, 16, 29]. Zoster-Reaktivierungen treten im Median 7 Tagen nach der Impfung auf und betreffen überwiegend Frauen (69 %). Das mediane Erkrankungsalter liegt bei 46 Jahren. Die meisten Reaktivierungen treten nach der 1. Impfung auf (78 %) [16]. Es wurde bei keinem Patient ein erneuter Herpes zoster nach den Folgeimpfungen beschrieben [16]. Neben der Zoster-Reaktivierung wurde auch das Aufflammen anderer Dermatosen wie des Herpes simplex (Abb. 3), der atopischen Dermatitis und der Psoriasis oder seltener z. B. eines bullösen Pemphigoids, eines Lichen planus oder eines Granuloma anulare beobachtet [12, 29]. Laut Literatur und eigener Erfahrungen können auch zuvor kontrollierte Dermatosen nach einer durchgemachten COVID-19-Erkrankung exazerbieren [4].
Zudem beschrieben Catala et al. das erstmalige Auftreten von Dermatosen nach erfolgter COVID-19-Impfung: u. a. atopische Dermatitis (7/405 Patienten), Psoriasis (3/405 Patienten) oder bullöses Pemphigoid (2/405 Patienten). Die Autoren stützten sich dabei auf eine zeitliche Korrelation (Auftreten der Hautsymptome ≤ 3 Wochen nach COVID-19-Impfung) [12]. Aufgrund der schwachen Evidenz und kleinen Fallzahlen kann zum aktuellen Zeitpunkt kein sicherer Zusammenhang zwischen der Erstmanifestation der beschriebenen Dermatosen und einer COVID-19-Impfung hergestellt werden. Jedoch präsentierte sich auch an unserer Klinik ein 56-jähriger Patient mit der Erstmanifestation einer atopischen Dermatitis (Abb. 3). Diese habe sich 2 Wochen nach der 1. Impfung mit Comirnaty® (Biontech) entwickelt und sei nach der 2. und 3. Impfung abermals exazerbiert.
Ferner wurde die Bevölkerung initial durch die mediale Berichterstattung von schweren allergischen Reaktionen nach COVID-19-Impfungen verunsichert. Die statistische Auswertung der Daten zeigte jedoch, dass die Wahrscheinlichkeit für eine Anaphylaxie bei unter 0,1 % liegt [8]. Selbst bei einem ausgewählten Kollektiv von 429 Patienten mit einem hohen Risiko für eine allergische Reaktion reagierten nur 1,4 % der Personen mit einer leichten allergischen Reaktion und 0,7 % mit einer Anaphylaxie [35]. Für die allergischen Reaktionen scheinen allen voran Polyethylenglykol (PEG) (enthalten in Comirnaty® und Spikevax®) und Polysorbat 80 (enthalten in Vaxzevria® und Janssen®) verantwortlich zu sein. Patienten mit allergischen Reaktionen beispielsweise auf Laxanzien (PEG), Influenzaimpfungen (Polysorbat 80) oder Antikörpertherapien wie Humira® (Abbvie, North Chicago/USA) (Polysorbat 80) sollten vor einer Impfung eine spezifische allergologische Testung erhalten [7]. Auf der Homepage des Robert Koch-Instituts können die aktuellen Empfehlungen zum Vorgehen bei positiver Allergieanamnese vor COVID-19-Impfung und spezialisierte allergologische Testzentren abgerufen werden [32].
Fazit für die Praxis
Hautsymptome treten bei 5–20 % der an COVID-19-Erkrankten auf.
Die 5 häufigsten Hautveränderungen bei COVID-19 umfassen den Pseudo-Chilblain sowie makulopapulöse, urtikarielle, vesikuläre und livedoartige/nekrotisierende Hautveränderungen.
Hautläsionen, allen voran vesikuläre Hautveränderungen, können das erste Zeichen einer SARS-CoV-2-Infektion darstellen und sind somit auch von diagnostischer Relevanz.
Bei Kindern sollte bei Exanthemen und Enanthemen sowie gastrointestinalen und kardiovaskulären Beschwerden an das lebensbedrohliche PIMS (pädiatrisches inflammatorisches multisystemisches Syndrom) gedacht werden.
Das Anaphylaxierisiko nach einer COVID-19-Impfung liegt bei unter 0,1 %.
Hautreaktionen nach COVID-19-Impfung sind mannigfaltig und haben meist einen milden, selbstlimitierenden Verlauf. Aus diesem Grund sollten Hautreaktionen in den allermeisten Fällen kein Grund sein, die COVID-19-Impfung nicht fortzusetzen.
Acknowledgments
Danksagung
Wir bedanken uns herzlich für die Zurverfügungstellung von klinischen Fotos bei: Prof. Dr. med. Alexander Kreuter (Helios St. Elisabeth Klinik, Oberhausen), PD Dr. med. Hans-Joachim Schulze (Fachklinik Hornheide, Münster), Dr. med. Jens Würker (Praxis Dr. med. Jens Würker, Bonn).
Abkürzungen
- ACE2
Angiotensin-konvertierendes Enzym-2-Rezeptor
- COVID-19
Coronavirus Disease 2019
- EEM
Erythema exsudativum multiforme
- MIS‑C
Multisystem inflammatory syndrome in children
- mRNA
Messenger-Ribonukleinsäure
- PCR
Polymerasekettenreaktion
- PEG
Polyethylenglykol
- PIMS
Pädiatrisches inflammatorisches multisystemisches Syndrom
- SARS-CoV‑2
Schweres akutes respiratorisches Syndrom Coronavirus‑2
- WHO
World Health Organization
Einhaltung ethischer Richtlinien
Interessenkonflikt
M. Reinhart, D. Metze und S.A. Braun geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien. Für Bildmaterial oder anderweitige Angaben innerhalb des Manuskripts, über die Patienten zu identifizieren sind, liegt von ihnen und/oder ihren gesetzlichen Vertretern eine schriftliche Einwilligung vor.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Andina D, Belloni-Fortina A, Bodemer C, Bonifazi E, Chiriac A, Colmenero I, Diociaiuti A, El-Hachem M, Fertitta L, van Gysel D, Hernández-Martín A, Hubiche T, Luca C, Martos-Cabrera L, Maruani A, Mazzotta F, Akkaya AD, Casals M, Ferrando J, Grimalt R, Grozdev I, Kinsler V, Morren MA, Munisami M, Nanda A, Novoa MP, Ott H, Pasmans S, Salavastru C, Zawar V, Torrelo A, COVID-19, T. E. G. for the S. M. Skin manifestations of COVID-19 in children: Part 1. Clin Exp Dermatol. 2021;46:444–450. doi: 10.1111/ced.14481. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Andina D, Belloni-Fortina A, Bodemer C, Bonifazi E, Chiriac A, Colmenero I, Diociaiuti A, El-Hachem M, Fertitta L, van Gysel D, Hernández-Martín A, Hubiche T, Luca C, Martos-Cabrera L, Maruani A, Mazzotta F, Akkaya AD, Casals M, Ferrando J, Grimalt R, Grozdev I, Kinsler V, Morren MA, Munisami M, Nanda A, Novoa MP, Ott H, Pasmans S, Salavastru C, Zawar V, Torrelo A, COVID-19, T. E. G. for the S. M. Skin manifestations of COVID-19 in children: Part 2. Clin Exp Dermatol. 2021;46:451–461. doi: 10.1111/ced.14482. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Andina D, Belloni-Fortina A, Bodemer C, Bonifazi E, Chiriac A, Colmenero I, Diociaiuti A, El-Hachem M, Fertitta L, van Gysel D, Hernández-Martín A, Hubiche T, Luca C, Martos-Cabrera L, Maruani A, Mazzotta F, Akkaya AD, Casals M, Ferrando J, Grimalt R, Grozdev I, Kinsler V, Morren MA, Munisami M, Nanda A, Novoa MP, Ott H, Pasmans S, Salavastru C, Zawar V, Torrelo A, COVID-19, T. E. G. for the S. M. Skin manifestations of COVID-19 in children: Part 3. Clin Exp Dermatol. 2021;46:462–472. doi: 10.1111/ced.14483. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Aram K, Patil A, Goldust M, Rajabi F. COVID-19 and exacerbation of dermatological diseases: a review of the available literature. Dermatol Ther. 2021;34:e15113. doi: 10.1111/dth.15113. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Arkin LM, Moon JJ, Tran JM, Asgari S, Farrelly CO, Casanova J, Cowen EW, Mays JW, Singh AM. From your nose to your toes: a review of severe acute respiratory syndrome Coronavirus 2 pandemic—associated pernio. J Invest Dermatol. 2021;141(12):2791–2796. doi: 10.1016/j.jid.2021.05.024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, Diemert D, Spector SA, Rouphael N, Creech CB, McGettigan J, Khetan S, Segall N, Solis J, Brosz A, Fierro C, Schwartz H, Neuzil K, Corey L, Gilbert P, Janes H, Follmann D, Marovich M, Mascola J, Polakowski L, Ledgerwood J, Graham BS, Bennett H, Pajon R, Knightly C, Leav B, Deng W, Zhou H, Han S, Ivarsson M, Miller J, Zaks T. Efficacy and safety of the mRNA-1273 SARS-coV-2 vaccine. N Engl J Med. 2020;384:403–416. doi: 10.1056/NEJMoa2035389. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Banerji A, Wickner PG, Saff R, Stone CA, Robinson LB, Long AA, Wolfson AR, Williams P, Khan DA, Phillips E, Blumenthal KG. mRNA vaccines to prevent COVID-19 disease and reported allergic reactions: current evidence and suggested approach. J Allergy Clin Immunol Pract. 2021;9:1423–1437. doi: 10.1016/j.jaip.2020.12.047. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Blumenthal KG, Freeman EE, Saff RR, Robinson LB, Wolfson AR, Foreman RK, Hashimoto D, Banerji A, Li L, Anvari S, Shenoy ES. Delayed large local reactions to mRNA-1273 vaccine against SARS-CoV-2. N Engl J Med. 2021;384:1273–1277. doi: 10.1056/NEJMc2102131. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Capalbo A, Giordano D, Gagliostro N, Balampanos CG, Persechino F, Orrù F, Persechino S. Alopecia areata in a COVID-19 patient: a case report. Dermatol Ther. 2021;34:e14685–e14685. doi: 10.1111/dth.14685. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Cappel MA, Cappel JA, Wetter DA. Pernio (chilblains), SARS-CoV-2, and COVID toes unified through cutaneous and systemic mechanisms. Mayo Clin Proc. 2021;96:989–1005. doi: 10.1016/j.mayocp.2021.01.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Casas D, Catal A, Fern D. Classification of the cutaneous manifestations of COVID-19: a rapid prospective nationwide consensus study in Spain with 375 cases. Br J Dermatol. 2020;183(1):71–77. doi: 10.1111/bjd.19163. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Català A, Muñoz-Santos C, Galván-Casas C, Roncero Riesco M, Revilla Nebreda D, Solá-Truyols A, Giavedoni P, Llamas-Velasco M, González-Cruz C, Cubiró X, Ruíz-Villaverde R, Gómez-Armayones S, Mateo GMP, Pesqué D, Marcantonio O, Fernández-Nieto D, Romaní J, Iglesias PN, Carnero Gonzalez L, Tercedor-Sanchez J, Carretero G, Masat-Ticó T, Rodríguez-Jiménez P, Gimenez-Arnau AM, Utrera-Busquets M, Vargas Laguna E, Angulo Menéndez AG, San Juan Lasser E, Iglesias-Sancho M, Naranjo AL, Hiltun I, Cutillas ME, Polimon Olabarrieta I, Marinero Escobedo S, García-Navarro X, Calderón Gutiérrez MJ, Baeza-Hernández G, Bou Camps L, Toledo-Pastrana T, Guilabert A. Cutaneous reactions after SARS-CoV-2 vaccination: a cross-sectional Spanish nationwide study of 405 cases. Br J Dermatol. 2022;186:142–152. doi: 10.1111/bjd.20639. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, Qiu Y, Wang J, Liu Y, Wei Y, Xia J, Yu T, Zhang X, Zhang L. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020;395:507–513. doi: 10.1016/S0140-6736(20)30211-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Daneshgaran G, Dubin DP, Gould DJ. Cutaneous manifestations of COVID-19: an evidence-based review. Am J Clin Dermatol. 2020;21(5):627–639. doi: 10.1007/s40257-020-00558-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.ECDC (2022) Vaccine Tracker des European Center for Disease Prevention and Control. https://qap.ecdc.europa.eu/public/extensions/COVID-19/vaccine-tracker.html#distribution-tab. Zugegriffen: 15.03.2022
- 16.Fathy RA, McMahon DE, Lee C, Chamberlin GC, Rosenbach M, Lipoff JB, Tyagi A, Desai SR, French LE, Lim HW, Thiers BH, Hruza GJ, Fassett M, Fox LP, Greenberg HL, Blumenthal K, Freeman EE. Varicella-zoster and herpes simplex virus reactivation post-COVID-19 vaccination: a review of 40 cases in an International Dermatology Registry. J Eur Acad Dermatol Venereol. 2022;36:e6–e9. doi: 10.1111/jdv.17646. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Fernandez-Nieto D, Jimenez-Cauhe J, Ortega-Quijano D, Diaz-Guimaraens B, Dominguez-Santas M, Martinez-Rubio J. Transverse leukonychia (Mees’ lines) nail alterations in a COVID-19 patient. Dermatol Ther. 2020;33:e13863. doi: 10.1111/dth.13863. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Gambichler T, Boms S, Susok L, Dickel H, Finis C, Rached AN, Barras M, Stücker M, Kasakovski D. Cutaneous findings following COVID-19 vaccination: review of world literature and own experience. J Eur Acad Dermatol Venereol. 2021;36(2):172–180. doi: 10.1111/jdv.17744. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Hamming I, Timens W, Bulthuis MLC, Lely AT, Navis GJ, van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol. 2004;203:631–637. doi: 10.1002/path.1570. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Hoang A, Chorath K, Moreira A, Evans M, Burmeister-Morton F, Burmeister F, Naqvi R, Petershack M, Moreira A. COVID-19 in 7780 pediatric patients: a systematic review. EClinicalMedicine. 2020;24:100433. doi: 10.1016/j.eclinm.2020.100433. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Ionescu M-A. COVID-19 skin lesions are rarely positive at RT-PCR test: the macrophage activation with vascular impact and SARS-CoV-2-induced cytokine storm. Int J Dermatol. 2022;61:3–6. doi: 10.1111/ijd.15749. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Joob B, Wiwanitkit V. COVID-19 can present with a rash and be mistaken for dengue. J Am Acad Dermatol. 2020;82(5):e177. doi: 10.1016/j.jaad.2020.03.036. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Le Cleach L, Dousset L, Assier H, Fourati S, Barbarot S, Boulard C, Bourseau Quetier C, Cambon L, Cazanave C, Colin A, Kostrzewa E, Lesort C, Levy Roy A, Lombart F, Marco-Bonnet J, Monfort J-B, Samimi M, Tardieu M, Wolkenstein P, Sbidian E, Beylot-Barry M, Dermatology, the F. S. of Most chilblains observed during the COVID-19 outbreak occur in patients who are negative for COVID-19 on polymerase chain reaction and serology testing. Br J Dermatol. 2020;183:866–874. doi: 10.1111/bjd.19377. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Li M-Y, Li L, Zhang Y, Wang X-S. Expression of the SARS-CoV-2 cell receptor gene ACE2 in a wide variety of human tissues. Infect Dis Poverty. 2020;9:45. doi: 10.1186/s40249-020-00662-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Lu R, Zhao X, Li J, Niu P, Yang B, Wu H, Wang W, Song H, Huang B, Zhu N, Bi Y, Ma X, Zhan F, Wang L, Hu T, Zhou H, Hu Z, Zhou W, Zhao L, Chen J, Meng Y, Wang J, Lin Y, Yuan J, Xie Z, Ma J, Liu WJ, Wang D, Xu W, Holmes EC, Gao GF, Wu G, Chen W, Shi W, Tan W. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet. 2020;395:565–574. doi: 10.1016/S0140-6736(20)30251-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Magro C, Mulvey JJ, Berlin D, Nuovo G, Salvatore S, Harp J, Baxter-Stoltzfus A, Laurence J. Complement associated microvascular injury and thrombosis in the pathogenesis of severe COVID-19 infection: a report of five cases. Transl Res. 2020;220:1–13. doi: 10.1016/j.trsl.2020.04.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Magro C, Nuovo G, Mulvey JJ, Laurence J, Harp J, Crowson AN. The skin as a critical window in unveiling the pathophysiologic principles of COVID-19. Clin Dermatol. 2021;39(6):934–965. doi: 10.1016/j.clindermatol.2021.07.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.McMahon DE, Amerson E, Rosenbach M, Lipoff JB, Moustafa D, Tyagi A, Desai SR, French LE, Lim HW, Thiers BH, Hruza GJ, Blumenthal KG, Fox LP, Freeman EE. Cutaneous reactions reported after Moderna and Pfizer COVID-19 vaccination: a registry-based study of 414 cases. J Am Acad Dermatol. 2021;85:46–55. doi: 10.1016/j.jaad.2021.03.092. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.McMahon DE, Kovarik CL, Damsky W, Rosenbach M, Lipoff JB, Tyagi A, Chamberlin G, Fathy R, Nazarian RM, Desai SR, Lim HW, Thiers BH, Hruza GJ, French LE, Blumenthal K, Fox LP, Freeman EE. Clinical and pathologic correlation of cutaneous COVID-19 vaccine reactions including V-REPP: a registry-based study. J Am Acad Dermatol. 2022;86:113–121. doi: 10.1016/j.jaad.2021.09.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Nuno-Gonzalez A, Magaletsky K, Feito Rodríguez M, Mayor Ibarguren A, Beato MJ, Ruiz Bravo E, Pinto HP. Palmoplantar erythrodysesthesia: a diagnostic sign of COVID-19. J Eur Acad Dermatol Venereol. 2021;35:e247–e249. doi: 10.1111/jdv.17074. [DOI] [PubMed] [Google Scholar]
- 31.Preda-Naumescu A, Penney K, Pearlman RL, Brodell RT, Daniel CR, Nahar VK. Nail Manifestations in COVID-19: Insight into a Systemic Viral Disease. Ski Appendage Disord. 2021;7:433–438. doi: 10.1159/000518087. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Robert Koch-Institut (2021) 2021 Vorgehen bei positiver Allergieanamnese vor COVID-19-Impfung. https://www.rki.de/SharedDocs/FAQ/COVID-Impfen/Flowchart_Allergieanamnese.pdf?__blob=publicationFile. Zugegriffen: 15.03.2022
- 33.Saglietto A, D’Ascenzo F, Zoccai GB, De Ferrari GM. COVID-19 in Europe: the Italian lesson. Lancet. 2020;395:1110–1111. doi: 10.1016/S0140-6736(20)30690-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Sánchez-Velázquez A, Falkenhain D, Rivera Díaz R. Erythema multiforme in the context of SARS-Coronavirus-2 infection. Med Clin (Barc) 2020;155:141. doi: 10.1016/j.medcli.2020.04.016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Shavit R, Maoz-Segal R, Iancovici-Kidon M, Offengenden I, Haj Yahia S, Machnes MD, Lifshitz-Tunitsky Y, Niznik S, Frizinsky S, Deutch M, Elbaz E, Genaim H, Rahav G, Levy I, Belkin A, Regev-Yochay G, Afek A, Agmon-Levin N. Prevalence of allergic reactions after Pfizer-bioNtech COVID-19 vaccination among adults with high allergy risk. JAMA Netw Open. 2021;4:e2122255. doi: 10.1001/jamanetworkopen.2021.22255. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Tan SW, Tam C, Oh CC. Skin manifestations of COVID-19 : a worldwide review. JAAD Int. 2020;2:119–133. doi: 10.1016/j.jdin.2020.12.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Toubiana J, Poirault C, Corsia A, Bajolle F, Fourgeaud J, Angoulvant F, Debray A, Basmaci R, Salvador E, Biscardi S, Frange P, Chalumeau M, Casanova J-L, Cohen JF, Allali S. Kawasaki-like multisystem inflammatory syndrome in children during the covid-19 pandemic in Paris, France: prospective observational study. BMJ. 2020;369:m2094. doi: 10.1136/bmj.m2094. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Visconti AD, Bataille V, Rossi ND, Kluk J, Murphy R, Puig SD, Nambi R, Bowyer RCE, Murray B, Bournot A, Wolf J, Ourselin S, Steves CJD, Spector TD, Falchi MD. Diagnostic value of cutaneous manifestation of SARS-CoV‑2 infection. Br J Dermatol. 2021;184(5):880–887. doi: 10.1111/bjd.19807. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.WHO (2020) Statement on the second meeting of the International Health Regulations (2005) Emergency Committee regarding the outbreak of novel coronavirus (2019-nCoV). https://www.who.int/news/item/30-01-2020-statement-on-the-second-meeting-of-the-international-health-regulations-. Zugegriffen: 15.03.2022
- 40.Xue X, Mi Z, Wang Z, Pang Z, Liu H, Zhang F. High expression of ACE2 on keratinocytes reveals skin as a potential target for SARS-CoV-2. J Invest Dermatol. 2021;141:206–209.e1. doi: 10.1016/j.jid.2020.05.087. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, Zhao X, Huang B, Shi W, Lu R, Niu P, Zhan F, Ma X, Wang D, Xu W, Wu G, Gao GF, Tan W. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med. 2020;382:727–733. doi: 10.1056/NEJMoa2001017. [DOI] [PMC free article] [PubMed] [Google Scholar]