Abstract
目的
探讨单倍型造血干细胞移植(haplo-HSCT)治疗移植前微小残留病(Pre-MRD)阳性急性B淋巴细胞白血病(B-ALL)是否较全相合同胞造血干细胞移植(MSDT)具有生存优势,以及该作用是否受Pre-MRD的影响。
方法
对2009年6月至2018年6月在北京大学血液病研究所接受异基因造血干细胞移植(allo-HSCT)的998例移植前处于完全缓解(CR)的B-ALL患者进行回顾性分析,其中haplo-HSCT组788例、MSDT组210例,移植前用多参数流式细胞术(MFC)检测MRD水平。
结果
①全部998例B-ALL患者中,997例获得持续的完全供者嵌合状态,移植后100 d中性粒细胞、血小板植入率分别为99.9%(997/998)、95.3%(951/998),Ⅱ~Ⅳ度急性移植物抗宿主病(GVHD)发生率为26.6%(95%CI 23.8%~29.4%),3年慢性GVHD累积发生率为49.1%(95%CI 45.7%~52.4%),移植后3年白血病累积复发率(CIR)为17.3%(95%CI 15.0%~19.7%),非复发死亡率(NRM)为13.8%(95% CI 11.6%~16.0%),移植后3年无白血病生存(LFS)率、总生存(OS)率分别为69.1%(95%CI 66.1%~72.1%)、73.0%(95%CI 70.2%~75.8%)。②Pre-MRD阳性组(282例)患者移植后3年CIR高于Pre-MRD阴性组(716例)[31.6%(95%CI 25.8%~37.5%)对14.3%(95%CI 11.4%~17.2%),P<0.001]。③在Pre-MRD阳性组中,haplo-HSCT患者(219例)移植后3年CIR低于MSDT患者(63例)[27.2%(95%CI 21.0%~33.4%)对47.0%(95%CI 33.8%~60.2%),P=0.002]。④全部998例患者按照Pre-MRD结果分为阴性组(716例)、<0.01%组(46例)、0.01%~<0.1%组(117组)、0.1%~<1%组(87例)、≥1%组(32例);5组患者中,<0.01%组haplo-HSCT患者(40例)移植后3年CIR低于MSDT患者(6例)[10.0%(95%CI 0.4%~19.6%)对32.3%(95%CI 0%~69.9%),P=0.017],0.01%~<0.1%组haplo-HSCT患者(81例)移植后3年CIR也低于MSDT患者(36例)[20.4%(95%CI 10.4%~30.4%)对47.0%(95%CI 29.2%~64.8%),P=0.004];其他三组中,haplo-HSCT和MSDT患者移植后3年CIR差异无统计学意义。⑤在Pre-MRD<0.1%组(163例)中,haplo-HSCT患者(121例)移植后3年CIR低于MSDT患者(42例)[16.0%(95%CI 9.4%~22.7%)对40.5%(95% CI 25.2%~55.8%),P<0.001],3年LFS率、OS率均高于MSDT组[78.2%(95%CI 70.6%~85.8%)对47.6%(95%CI 32.2%~63.0%),P<0.001;80.5%(95%CI 73.1%~87.9%)对54.6%(95%CI 39.2%~70.0%),P<0.001],两组3年NRM差异无统计学意义[5.8%(95%CI 1.6%~10.0%)对11.9%(95%CI 2.0%~21.8%),P=0.188]。多因素分析显示,haplo-HSCT是Pre-MRD<0.1%组移植后低CIR(HR=0.248,95%CI 0.131~0.472,P<0.001)、高LFS率(HR=0.275,95%CI 0.157~0.483,P<0.001)和高OS率(HR=0.286,95%CI 0.159~0.513,P<0.001)的独立影响因素。
结论
haplo-HSCT治疗Pre-MRD<0.1%的B-ALL患者较MSDT具有生存优势。
Keywords: 单倍型造血干细胞移植, 人类白细胞抗原相合同胞供者移植, 微小残留病, 复发
Abstract
Objective
To investigate whether haplotype hematopoietic stem cell transplantation(haplo-HSCT)is effective in the treatment of pre transplant minimal residual disease(Pre-MRD)positive acute B lymphoblastic leukemia(B-ALL)compared with HLA-matched sibling donor transplantation(MSDT).
Methods
A total of 998 patients with B-ALL in complete remission pre-HSCT who either received haplo-HSCT(n=788)or underwent MSDT(n=210)were retrospectively analyzed. The pre-transplantation leukemia burden was evaluated according to Pre-MRD determinedusing multiparameter flow cytometry(MFC).
Results
Of these patients, 997(99.9%)achieved sustained, full donor chimerism. The 100-day cumulative incidences of neutrophil engraftment, platelet engraftment, and grades Ⅱ-Ⅳ acute graft-versus-host disease(GVHD)were 99.9%(997/998), 95.3%(951/998), and 26.6%(95%CI 23.8%–29.4%), respectively. The 3-year cumulative incidence of total chronic GVHD was 49.1%(95%CI 45.7%–52.4%). The 3-year cumulative incidence of relapse(CIR)and non-relapse mortality(NRM)of the 998 cases were 17.3%(95%CI 15.0%–19.7%)and 13.8%(95%CI 11.6%–16.0%), respectively. The 3-year probabilities of leukemia-free survival(LFS)and overall survival(OS)were 69.1%(95%CI 66.1%–72.1%)and 73.0%(95%CI 70.2%–75.8%), respectively. In the total patient group, cases with positive Pre-MRD(n=282)experienced significantly higher CIR than that of subjects with negative Pre-MRD[n=716, 31.6%(95%CI 25.8%–37.5%)vs 14.3%(95%CI 11.4%–17.2%), P<0.001]. For patients in the positive Pre-MRD subgroup, cases treated with haplo-HSCT(n=219)had a lower 3-year CIR than that of cases who underwent MSDT[n=63, 27.2%(95%CI 21.0%–33.4%)vs 47.0%(95%CI 33.8%–60.2%), P=0.002]. The total 998 cases were classified as five subgroups, including cases with negative Pre-MRD group(n=716), cases with Pre-MRD<0.01% group(n=46), cases with Pre-MRD 0.01%–<0.1% group(n=117), cases with Pre-MRD 0.1%–<1% group(n=87), and cases with Pre-MRD≥1% group(n=32). For subjects in the Pre-MRD<0.01% group, haplo-HSCT(n=40)had a lower CIR than that of MSDT[n=6, 10.0%(95%CI 0.4%–19.6%)vs 32.3%(95%CI 0%–69.9%), P=0.017]. For patients in the Pre-MRD 0.01%–<0.1% group, haplo-HSCT(n=81)also had a lower 3-year CIR than that of MSDT[n=36, 20.4%(95%CI 10.4%–30.4%)vs 47.0%(95%CI 29.2%–64.8%), P=0.004]. In the other three subgroups, the 3-year CIR was comparable between patients who underwent haplo-HSCT and those received MSDT. A subgroup analysis of patients with Pre-MRD<0.1%(n=163)was performed, the results showed that cases received haplo-HSCT(n=121)experienced lower 3-year CIR[16.0%(95%CI 9.4%–22.7%)vs 40.5%(95%CI 25.2%–55.8%), P<0.001], better 3-year LFS[78.2%(95%CI 70.6%–85.8%)vs 47.6%(95%CI 32.2%–63.0%), P<0.001]and OS[80.5%(95%CI 73.1%–87.9%)vs 54.6%(95%CI 39.2%–70.0%), P<0.001]than those of MSDT(n=42), but comparable in 3-year NRM[5.8%(95%CI 1.6%–10.0%)vs 11.9%(95%CI 2.0%–21.8%), P=0.188]. Multivariate analysis showed that haplo-HSCT was associated with lower CIR(HR=0.248, 95%CI 0.131–0.472, P<0.001), and superior LFS(HR=0.275, 95%CI 0.157–0.483, P<0.001)and OS(HR=0.286, 95%CI 0.159–0.513, P<0.001).
Conclusion
Haplo HSCT has a survival advantage over MSDT in the treatment of B-ALL patients with pre MRD<0.1%.
Keywords: Haploidentical stem cell transplantation, Human leukocyte antigen-matched sibling donor transplantation, Minimal residual disease, Relapse
目前,单倍型造血干细胞移植(haplo-HSCT)已被广泛用于恶性血液病的治疗[1]。尽管haplo-HSCT治疗急性髓系白血病(AML)和急性淋巴细胞白血病(ALL)获得与同胞全相合造血干细胞移植(MSDT)相当的疗效,但由于haplo-HSCT后病毒感染发生率高等原因,MSDT仍是有移植适应证白血病患者的首选移植方式[2]–[4]。Nagler等[5]发现接受haplo-HSCT治疗的ALL患者移植后2年累积复发率(CIR)低于MSDT(HR=0.66, P=0.004),而haplo-HSCT后的高非复发死亡率(NRM)使低CIR未转化为生存优势[5]。我们前期研究发现,对于移植前微小残留病(Pre-MRD)阳性的AML和ALL患者而言,haplo-HSCT较MSDT具有生存优势[6]–[7]。此外,haplo-HSCT也在治疗恶性血液病[8]、难治/复发AML[9]以及霍奇金淋巴瘤[10]–[11]方面较MSDT具有生存优势。对接受haplo-HSCT或MSDT的ALL患者而言,Pre-MRD水平越高,移植后CIR也越高[12]–[14]。Zhao等[13]的研究提示haplo-HSCT有可能克服<0.1%的Pre-MRD对ALL患者移植预后的不良影响。尽管此前的研究提示haplo-HSCT治疗Pre-MRD阳性ALL患者较MSDT具有生存优势,但作者未进行亚组分析[6]。根据此前的研究[5]–[7],[14]–[16],我们推测对于特定Pre-MRD水平的ALL患者而言,haplo-HSCT才能较MSDT显示出优势。为此,我们拟通过扩大患者数量来探讨haplo-HSCT是否较MSDT在治疗急性B淋巴细胞白血病(B-ALL)具有生存优势以及该优势是否受到Pre-MRD水平的影响。
病例与方法
1. 研究对象:本研究回顾性纳入了2009年6月至2018年6月在北京大学血液病研究所接受allo-HSCT、移植前处于血液学缓解(HCR)状态的998例B-ALL患者。供者选择[3],[6]:HLA相合同胞供者(MSD)作为首选;如果没有MSD,且无合适的无关供者(HLA-A、B、C、DR和DQ位点>8/10或HLA-A、B、DR位点>5/6),则选择单倍型供者。所有患者获得HCR后行2疗程巩固治疗后接受移植[3],[6],本研究经北京大学人民医院伦理委员会批准,所有供、患者均签署知情同意书。
2. 移植方案:造血干细胞动员、移植物采集和回输、预处理方案和移植物抗宿主病(GVHD)预防及移植后MRD干预参见文献[6],[13]。
3. MRD检测:MRD检测的时间点包括移植前(预处理前4周)、移植后1、2、3、4.5、6、9和12个月,1年后每6个月评估1次MRD[6],[13]。检测方法:①应用白血病相关免疫表型和/或与正常骨髓细胞表型相鉴别的方法借助MFC评估MRD;②借助实时定量聚合酶链反应技术(Q-PCR)测定WT1或BCR/ABL等泛白血病和(或)白血病特异基因评估MRD。具体参见文献[6],[13]。
4. 随访:中位随访时间为44(0.4~135)个月。主要观察终点是白血病CIR;次要观察终点包括造血植入、Ⅱ~Ⅳ度急性GVHD、慢性GVHD、NRM、无白血病生存(LFS)和总生存(OS)等。主要观察终点和次要观察终点的定义见文献[6],[13]。
5. 统计学处理:计数和计量资料用频率和中位数等进行描述统计。MSDT和haplo-HSCT组间供受者特征比较采用卡方检验或Fisher精确检验(分类变量)以及t检验或非参数检验。造血植入、急性和慢性GVHD、LFS以及OS等采用Kaplan-Meier进行描述和计算。单因素和多因素分析采用Cox模型进行统计,P<0.1的变量被纳入多因素分析。采用SPSS 19.0软件进行数据分析。NRM和CIR采用R软件进行竞争风险分析。
结果
1. 总体B-ALL患者的一般资料和移植结果:998例患者中男558例、女440例,中位年龄26(2~63)岁,其中Ph染色体阳性患者346例(34.7%)、移植前疾病状态≥第2次完全缓解(CR2)149例(14.9%)(表1)。所有患者均接受清髓预处理。全部998例中997例获得中性粒细胞植入,中位植入时间为移植后13(9~66)d,移植后100 d植入率为99.9%(997/998);中位血小板植入时间为15(4~418)d,移植后100 d植入率为95.3%(951/998)。移植后100 d Ⅱ~Ⅳ度急性GVHD发生率为26.6%(95%CI 23.8%~29.4%)。中位随访44(0.4~135)个月,3年慢性GVHD累积发生率为49.1%(95%CI 45.7%~52.4%),CIR为17.3%(95%CI 15.0%~19.7%),NRM为13.8%(95%CI 11.6%~16.0%);3年LFS、OS率分别为69.1%(95%CI 66.1%~72.1%)、73.0%(95%CI 70.2%~75.8%)。
表1. 接受allo-HSCT的998例急性B淋巴细胞白血病(B-ALL)及163例移植前微小残留病(MRD)<0.1%患者的临床资料.
| 临床特征 | 总体(998例) | 移植前MRD < 0.1% |
|||
| haplo-HSCT(121例) | MSDT(42例) | 统计量 | P值 | ||
| 年龄[岁,M(范围)] | 26(2~63) | 26(4~58) | 37(8~60) | −3.331 | 0.002 |
| 性别[例(%)] | 0.080 | 0.778 | |||
| 男 | 558(55.9) | 69(57.0) | 25(59.5) | ||
| 女 | 440(44.1) | 52(43.0) | 17(40.5) | ||
| Ph染色体[例(%)] | 1.218 | 0.270 | |||
| 阳性 | 346(34.7) | 58(47.9) | 16(38.1) | ||
| 阴性 | 652(65.3) | 63(52.1) | 26(61.9) | ||
| 移植前疾病状态[例(%)] | 1.661 | 0.286 | |||
| CR1 | 849(85.1) | 103(85.1) | 39(92.9) | ||
| ≥CR2 | 149(14.9) | 18(14.9) | 3(7.1) | ||
| 移植前病程[月,M(范围)] | 6.5(2.5~192.0) | 6.0(3.0~69.5) | 6.0(3.0~24.5) | −0.794 | 0.492 |
| 供受者性别组合[例(%)] | 7.735 | 0.052 | |||
| 女供男 | 195(19.5) | 25(20.7) | 15(35.7) | ||
| 女供女 | 144(14.4) | 15(12.4) | 9(21.4) | ||
| 男供女 | 290(29.1) | 37(30.6) | 7(16.7) | ||
| 男供男 | 369(36.9) | 44(36.4) | 11(26.2) | ||
| HLA位点不合[例(%)] | 169.745 | <0.001 | |||
| 0个位点 | 217(21.7) | 2(1.7) | 42(100) | ||
| 1个位点 | 27(2.7) | 0 | 0 | ||
| 2个位点 | 140(14.0) | 18(14.9) | 0 | ||
| 3个位点 | 614(61.5) | 101(83.5) | 0 | ||
| 供受者血型组合[例(%)] | 3.638 | 0.303 | |||
| 相合 | 554(55.5) | 68(56.2) | 24(57.1) | ||
| 主要不合 | 202(20.2) | 31(25.6) | 6(14.3) | ||
| 次要不合 | 195(19.5) | 17(14.0) | 10(23.8) | ||
| 主要不合+次要不合 | 47(4.7) | 5(4.1) | 2(4.8) | ||
| 供受者关系[例(%)] | 75.314 | <0.001 | |||
| 父母供子女 | 447(44.8) | 57(47.1) | 0 | ||
| 同胞供同胞 | 426(42.7) | 38(31.4) | 42(100) | ||
| 子女供父母 | 107(10.7) | 24(19.8) | 0 | ||
| 其他 | 18(1.8) | 2(1.7) | 0 | ||
| 移植物[例(%)] | 11.143 | 0.004 | |||
| G-PB+G-BM | 975(97.7) | 121(100) | 38(90.5) | ||
| G-PB | 23(2.3) | 0 | 4(9.5) | ||
| 移植物有核细胞[×108/kg,M(范围)] | 8.17(2.53~20.12) | 7.91(5.58~15.67) | 7.73(5.34~11.86) | −1.368 | 0.138 |
| 移植物CD34+细胞[×106/kg,M(范围)] | 2.43(0.38~12.66) | 2.25(0.84~8.07) | 2.45(0.90~6.39) | −0.918 | 0.404 |
| 移植后接受MRD指导干预[例(%)] | 163(16.3) | 32(26.4) | 21(50.0) | 6.463 | 0.011 |
| 仅减停免疫抑制剂 | 36(3.6) | 4(3.3) | 3(7.1) | ||
| 干扰素 | 57(5.7) | 13(10.7) | 7(16.7) | ||
| DLI | 34(3.4) | 5(4.1) | 5(11.9) | ||
| 靶向药物 | 36(3.6) | 10(8.3) | 6(14.3) | ||
注:allo-HSCT:异基因造血干细胞移植;haplo-HSCT:单倍型造血干细胞移植;MSDT:同胞全相合造血干细胞移植;CR1、CR2分别为第1、2次完全缓解;G-PB:粒细胞集落刺激因子(G-CSF)动员的外周血采集物;G-BM:G-CSF动员的骨髓采集物;DLI:供者淋巴细胞输注
2. 不同Pre-MRD水平对B-ALL患者预后的影响:998例患者分为Pre-MRD阴性组(716例)和阳性组(282例),结果显示阳性组患者移植后的CIR显著高于阴性组[31.6%(95%CI 25.8%~37.5%)对14.3%(95%CI 11.4%~17.2%),P<0.001]。Pre-MRD结果分为阴性组(716例)、<0.01%组(46例)、0.01%~<0.1%组(117组)、0.1%~<1%组(87例)、≥1%组(32例);5组患者中,<0.01%组中haplo-HSCT患者(40例)移植后3年CIR低于MSDT患者(6例)[10.0%(95%CI 0.4%~19.6%)对32.3%(95%CI 0%~69.9%),P=0.017],0.01%~<0.1%组haplo-HSCT患者(81例)移植后3年CIR也低于MSDT患者(36例)[20.4%(95%CI 10.4%~30.4%)对47.0%(95%CI 29.2%~64.8%),P=0.004];其他三组中,haplo-HSCT和MSDT患者移植后3年CIR差异无统计学意义。提示,haplo-HSCT有可能克服<0.1%的Pre-MRD水平对移植预后的不良影响。
3. haplo-HSCT和MSDT对Pre-MRD阳性B-ALL患者预后的影响:998例患者被分为Pre-MRD阴性接受haplo-HSCT(B1组)和MSDT组(B2组)以及Pre-MRD阳性接受haplo-HSCT(B3组)和MSDT组(B4组),结果显示B1组和B2组患者移植后3年CIR差异无统计学意义[14.5%(95%CI 11.3%~17.9%)对12.9%(95%CI 7.1%~18.7%),P=0.944],B3组移植后3年CIR显著低于B4组[27.2%(95%CI 21.0%~33.4%)对47.0%(95%CI 33.8%~60.2%),P=0.002],二者显著高于B1和B2组(P<0.01)。在Pre-MRD<0.01%和0.01%~<0.1%组,haplo-HSCT患者移植后3年CIR低于MSDT患者[Pre-MRD<0.01%组:10.0%(95%CI 0.4%~19.6%)对32.3%(95%CI 0%~69.9%),P=0.017;Pre-MRD 0.01%~<0.1%组:20.4%(95%CI 10.4%~30.4%)对47.0%(95%CI 29.2%~64.8%),P=0.004]。
4. haplo-HSCT和MSDT对Pre-MRD<0.1% B-ALL患者预后的影响:依据移植模式将163例对Pre-MRD<0.1%患者分为haplo-HSCT组(121例)和MSDT组(42例),haplo-HSCT组年龄低于MSDT组(P=0.002)、接受G-CSF动员的外周血采集物(G-PB),患者比例低于MSDT组(P=0.004);此外,haplo-HSCT组移植后接受MRD指导干预的患者比例低于MSDT组(P=0.011),详见表1。
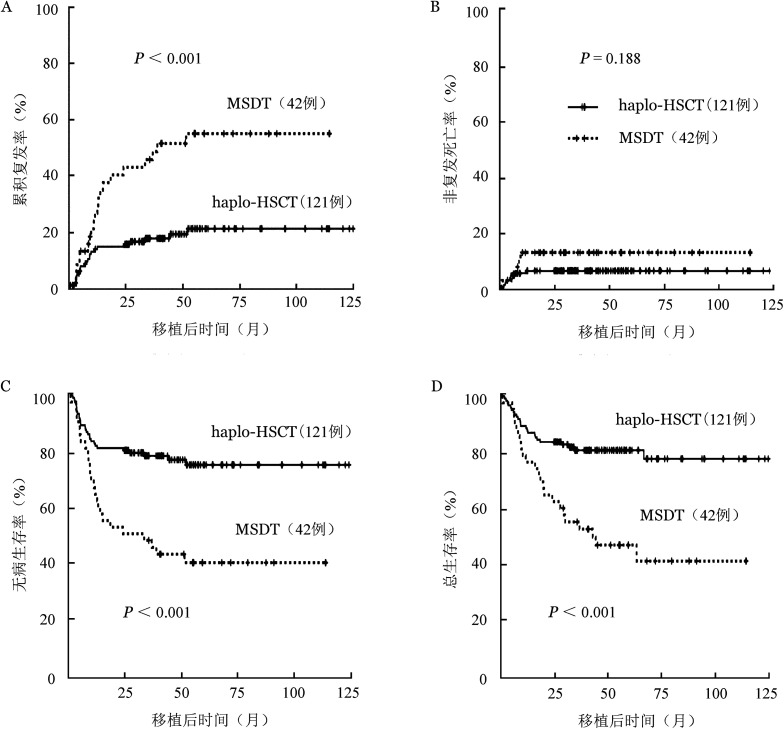
haplo-HSCT组的血小板植入率显著低于MSDT组[98%(119/121)对100%(42/42),P<0.001];haplo-HSCT组移植后3年CIR低于MSDT组[16.0%(95%CI 9.4%~22.7%)对40.5%(95%CI 25.2%~55.8%),P<0.001],LFS和OS均显著高于MSDT组[78.2%(95%CI 70.6%~85.8%)对47.6%(95%CI 32.2%~63.0%),P<0.001;80.5%(95%CI 73.1%~87.9%)对54.6%(95%CI 39.2%~70.0%),P<0.001](表2、图1)。单因素分析显示,影响CIR的变量有移植前CR状态(P=0.063)、移植模式(P<0.001)和发生慢性GVHD(P=0.008);影响NRM的变量有患者性别(P=0.083)和发生Ⅱ~Ⅳ度急性GVHD(P=0.044);影响LFS的变量有移植前CR状态(P=0.055)、移植模式(P<0.001)和发生慢性GVHD(P=0.002);影响OS的因素有移植前CR状态(P=0.020)和移植模式(P<0.001)。多因素分析显示,移植模式是移植后CIR(HR=0.248,P<0.001)、LFS(HR=0.275,P<0.001)和OS(HR=0.286,P<0.001)的独立影响因素(表3、图1)。病例配对分析显示,haplo-HSCT组较MSDT组具有更低的CIR[13.8%(95%CI 6.0%~21.6%)对45.0%(95%CI 28.6%~61.4%),P<0.001]、更高的LFS[80.9%(95%CI 72.3%~89.4%)对47.6%(95%CI 32.2%~63.0%),P<0.001]和OS[84.2%(95%CI 76.2%~92.2%)对54.6%(95%CI 39.2%~70.0%),P<0.001],多因素分析显移植模式是移植后CIR(HR=0.263,P<0.001)、LFS(HR=0.299,P<0.001)和OS(HR=0.263,P<0.001)的独立影响因素(表4)。
表2. haplo-HSCT和MSDT治疗移植前微小残留病(MRD)<0.1%急性B淋巴细胞白血病(B-ALL)患者的预后.
| 临床特征 | 总体(163例) | haplo-HSCT(121例) | MSDT(42例) | P值a |
| +100 d中性粒细胞植入率 | 100% | 100% | 100% | 1.000 |
| +100 d血小板植入率 | 95.7%(95%CI 92.5%~98.9%) | 94.2%(95%CI 90.0%~98.4%) | 100% | <0.001 |
| +100 d Ⅱ~Ⅳ度急性GVHD发生率 | 24.7%(95%CI 17.9%~31.3%) | 26.5%(95%CI 18.5%~34.5%) | 19.5%(95%CI 7.1%~31.9%) | 0.272 |
| 3年累积慢性GVHD发生率 | 51.1%(95%CI 42.5%~59.7%) | 49.0%(95%CI 39.2%~58.8%) | 58.7%(95%CI 41.3%~76.1%) | 0.491 |
| 3年累积复发率 | 22.4%(95%CI 15.9%~28.9%) | 16.0%(95%CI 9.4%~22.7%) | 40.5%(95%CI 25.2%~55.8%) | <0.001 |
| 3年非复发死亡率 | 7.4%(95%CI 3.3%~11.4%) | 5.8%(95%CI 1.6%~10.0%) | 11.9%(95%CI 2.0%~21.8%) | 0.188 |
| 3年无病生存率 | 70.2%(95%CI 63.0%~77.4%) | 78.2%(95%CI 70.6%~85.8%) | 47.6%(95%CI 32.2%~63.0%) | <0.001 |
| 3年总生存率 | 73.7%(95%CI 67.7%~80.7%) | 80.5%(95%CI 73.1%~87.9%) | 54.6%(95%CI 39.2%~70.0%) | <0.001 |
注:haplo-HSCT:单倍型造血干细胞移植;MSDT:同胞全相合造血干细胞移植;GVHD:移植物抗宿主病。a MSDT组与haplo-HSCT组比较
图1. 移植模式对移植前微小残留病<0.1%急性B淋巴细胞白血病患者造血干细胞移植预后的影响.
haplo-HSCT:单倍型造血干细胞移植;MSCT:同胞全相合造血干细胞移植;A:累积复发;B:非复发死亡;C:无病生存;D:总生存
表3. 移植前微小残留病(MRD)<0.1%急性B细胞淋巴细胞白血病(B-ALL)患者预后影响因素分析.
| 影响因素 | 单因素分析 |
多因素分析 |
||
| HR(95% CI) | P值 | HR(95% CI) | P值 | |
| 复发 | ||||
| 移植前疾病状态(≥CR2,CR1) | 2.083(0.961~4.512) | 0.063 | 3.031(1.351~6.800) | 0.007 |
| 移植模式(haplo-HSCT,MSDT) | 0.314(0.170~0.581) | <0.001 | 0.248(0.131~0.472) | <0.001 |
| 慢性GVHD(发生,未发生) | 0.402(0.205~0.788) | 0.008 | 0.345(0.174~0.682) | 0.002 |
| 非复发死亡 | ||||
| 性别(男,女) | 0.261(0.057~1.192) | 0.083 | ||
| Ⅱ~Ⅳ度急性GVHD(发生,未发生) | 3.209(1.034~9.953) | 0.044 | 3.209(1.034~9.953) | 0.044 |
| 无病生存 | ||||
| 移植前疾病状态(≥CR2,CR1) | 1.960(0.984~3.903) | 0.055 | 2.741(1.339~5.611) | 0.006 |
| 移植模式(haplo-HSCT,MSDT) | 0.342(0.199~0.586) | <0.001 | 0.275(0.157~0.483) | <0.001 |
| 慢性GVHD(发生,未发生) | 0.391(0.215~0.712) | 0.002 | 0.342(0.187~0.627) | 0.001 |
| 总生存 | ||||
| 移植前疾病状态(≥CR2,CR1) | 2.301(1.143~4.631) | 0.020 | 2.961(1.448~6.053) | 0.003 |
| 移植模式(haplo-HSCT,MSDT) | 0.325(0.183~0.575) | <0.001 | 0.286(0.159~0.513) | <0.001 |
注:CR1、CR2分别为第1、2次完全缓解;haplo-HSCT:单倍型造血干细胞移植;MSDT:同胞全相合造血干细胞移植;GVHD:移植物抗宿主病
表4. 移植前MRD<0.1%的B-ALL患者预后影响的单因素与多因素分析(MSDT与haplo-HSCT患者配比1∶2).
| 影响因素 | 单因素分析 |
多因素分析 |
||
| HR(95% CI) | P值 | HR(95% CI) | P值 | |
| 复发 | ||||
| 移植模式(haplo-HSCT,MSDT) | 0.271(0.135~0.546) | <0.001 | 0.263(0.130~0.530) | <0.001 |
| 慢性GVHD(发生,未发生) | 0.494(0.243~1.005) | 0.052 | 0.468(0.230~0.953) | 0.036 |
| 非复发死亡 | ||||
| 性别(男,女) | 0.150(0.019~1.181) | 0.072 | 0.150(0.019~1.181) | 0.072 |
| 无病生存 | ||||
| 移植模式(haplo-HSCT,MSDT) | 0.308(0.168~0.566) | <0.001 | 0.299(0.163~0.549) | <0.001 |
| 慢性GVHD(发生,未发生) | 0.473(0.252~0.886) | 0.019 | 0.451(0.241~0.847) | 0.013 |
| 总生存 | ||||
| 移植模式(haplo-HSCT,MSDT) | 0.263(0.135~0.512) | <0.001 | 0.263(0.135~0.512) | <0.001 |
注:MRD:微小残留病;B-ALL:急性B淋巴细胞白血病;CR:完全缓解;haplo-HSCT:单倍型相合造血干细胞移植;MSDT:同胞全相合造血干细胞移植;GVHD:移植物抗宿主病
讨论
本研究结果证实,haplo-HSCT治疗Pre-MRD阳性的B-ALL患者较MSDT具有生存优势,与此前其他学者[5],[15]和我们的研究结果[6]–[7],[18],[20]一致。更重要的是,我们还发现haplo-HSCT较MSDT的生存优势仅限于Pre-MRD<0.1%的B-ALL患者;在Pre-MRD阴性或≥0.1%的患者中,haplo-HSCT并未显示出较MSDT具有生存优势。本研究为以前的研究[5]–[7],[16]–[20]增添了新的内容,即对于移植前特定白血病负荷的B-ALL亚组人群,haplo-HSCT才能显示出较MSDT具有生存优势。
近年来,越来越多的研究显示haplo-HSCT治疗恶性血液病较MSDT具有更强的移植物抗白血病(GVL)作用[5]–[7],[18]–[20],然而,并非所有的报道都显示haplo-HSCT较强的GVL作用可转化为生存优势[5],[20];这可能与下列因素有关:①haplo-HSCT后NRM显著高于MSDT[5]。②多数研究报道的是恶性血液病患者总体人群,包括AML、ALL和骨髓增生异常综合征等[7]–[8];Luo等[8]发现对于接受allo-HSCT的恶性血液病患者而言,haplo-HSCT后5年CIR显著低于MSDT(14.2%对34%,P=0.008),但两组5年LFS和OS率并无统计学差异。因此,如何从恶性血液病患者总体人群筛选出能从生存上获益于haplo-HSCT更强GVL作用的亚组人群就显得尤为重要。本研究和我们此前的研究[6]–[7],[18],[20]均显示作为生物学标志的Pre-MRD不仅可用于筛选获益于单倍型供者更强GVL作用的ALL患者,而且还可用于筛选AML患者。
与此前研究[6],[18],[20]不同的是,我们在本研究中确定了Pre-MRD<0.1%的B-ALL患者是生存上可获益于haplo-HSCT更强GVL作用的亚组人群;在该亚组患者中,尽管接受MSDT的患者移植后复发干预的比例显著高于haplo-HSCT组,但haplo-HSCT组患者仍较MSDT组患者复发率低、生存好;haplo-HSCT较MSDT更强的GVL效应可能得益于单倍型相合T细胞较同胞相合T细胞具有更强的同种反应性,这在临床上表现为haplo-HSCT移植后的急性GVHD发生率显著高于MSDT[3]。我们的结果提示haplo-HSCT的GVL作用并非无限强于HLA相合同胞供者,对于Pre-MRD阴性患者,二类供者都具有足够的GVL作用;而Pre-MRD阴性患者接受两类移植后10%左右的CIR可能与MRD检测方法所致的假阴性结果有关[21]。对于Pre-MRD≥0.1%的B-ALL人群而言,haplo-HSCT和MSDT两种移植模式都不能克服移植前白血病负荷对预后的不良影响;该组人群中部分患者接受两类移植后均未复发一方面可能与MRD检测方法导致的假阳性结果有关[21],另一方面可能与白血病的生物学特性有关[22],即haplo-HSCT或MSDT仍对于部分Pre-MRD≥0.1%的B-ALL患者体内的白血病细胞具有GVL作用。此外,移植后白血病细胞能否被清除、疾病获得治愈,取决于白血病细胞和免疫细胞(包括T细胞和自然杀伤细胞)之间的强弱对比,Guo等[18]最近研究发现,免疫细胞和移植前白血病负荷的数量对比可能与其发挥GVL作用密切相关,这也部分解释了为什么对于移植前特定白血病符合范围内的患者(Pre-MRD<1%),haplo-HSCT才能显示出较MSDT更强的GVL作用。当然,明确的机制尚需深入研究。
本研究为回顾性研究,存在如下局限性:首先,我们的分析仅仅是限定在B-ALL人群,因此,有必要就T-ALL人群进行研究,以确定移植前白血病负荷是否影响haplo-HSCT或MSDT的GVL作用;其次,本研究为单中心分析,应该开展前瞻性、多中心研究以探讨哪个亚组的ALL患者人群可获益于haplo-HSCT更强的GVL效应[23]–[25];再次,我们在本研究中借助MFC方法来确定Pre-MRD的阴性和阳性,而采用Q-PCR方法检测MRD的敏感性和特异性优于MFC[17],[26],因此,对于具有特定融合基因(例如BCR/ABL)的患者应该探讨Q-PCR方法检测Pre-MRD在haplo-HSCT和MSDT对ALL患者预后影响中的价值。
本研究结果显示,对于Pre-MRD<1%的B-ALL患者,haplo-HSCT模式在生存方面优于MSDT,在有经验的移植中心,可选择haplo-HSCT模式治疗Pre-MRD<1%的B-ALL患者。
Funding Statement
基金项目:国家自然科学基金(81670168、81870141)
Fund program: The National Natural Science Foundation of China(81670168, 81870141)
Footnotes
利益冲突声明 本研究未接受任何医疗相关机构、个人资助
作者贡献声明 王志东:资料收集、数据分析、文章撰写;常英军:研究设计、数据分析、文章审核;其他作者:资料收集
References
- 1.Chang YJ, Huang XJ. Haploidentical stem cell transplantation: anti-thymocyte globulin-based experience[J] Semin Hematol. 2016;53(2):82–89. doi: 10.1053/j.seminhematol.2016.01.004. [DOI] [PubMed] [Google Scholar]
- 2.Wang Y, Liu QF, Xu LP, et al. Haploidentical vs identical-sibling transplant for AML in remission: a multicenter, prospective study[J] Blood. 2015;125(25):3956–3962. doi: 10.1182/blood-2015-02-627786. [DOI] [PubMed] [Google Scholar]
- 3.Wang Y, Liu QF, Xu LP, et al. Haploidentical versus matched-sibling transplant in adults with philadelphia-negative high-risk acute lymphoblastic leukemia: a biologically phase III randomized study[J] Clin Cancer Res. 2016;22(14):3467–3476. doi: 10.1158/1078-0432.CCR-15-2335. [DOI] [PubMed] [Google Scholar]
- 4.常 英军. 我如何选择异基因造血干细胞移植供者[J] 中华血液学杂志. 2016;37(8):643–649. doi: 10.3760/cma.j.issn.0253-2727.2016.08.003. [DOI] [Google Scholar]
- 5.Nagler A, Labopin M, Houhou M, et al. Outcome of haploidentical versus matched sibling donors in hematopoietic stem cell transplantation for adult patients with acute lymphoblastic leukemia: a study from the Acute Leukemia Working Party of the European Society for Blood and Marrow Transplantation[J] J Hematol Oncol. 2021;14(1):53. doi: 10.1186/s13045-021-01065-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Chang YJ, Wang Y, Xu LP, et al. Haploidentical donor is preferred over matched sibling donor for pre-transplantation MRD positive ALL: a phase 3 genetically randomized study[J] J Hematol Oncol. 2020;13(1):27. doi: 10.1186/s13045-020-00860-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.吴 蔚冰, 常 英军. 异基因造血干细胞移植最佳供者选择:HLA相合同胞供者总是首选吗?[J] 中国实用内科杂志. 2021;41(4):269–274. [Google Scholar]
- 8.Luo Y, Xiao H, Lai X, et al. T-cell-replete haploidentical HSCT with low-dose anti-T-lymphocyte globulin compared with matched sibling HSCT and unrelated HSCT[J] Blood. 2014;124(17):2735–2743. doi: 10.1182/blood-2014-04-571570. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Lu Y, Zhao YL, Zhang JP, et al. Unmanipulated haplo-identical donor transplantation compared with identical sibling donor had better anti-leukemia effect for refractory/relapsed acute myeloid leukemia not in remission status[J] Ann Hematol. 2021;99(12):2911–2925. doi: 10.1007/s00277-020-04283-0. [DOI] [PubMed] [Google Scholar]
- 10.Mariotti J, Devillier R, Bramanti S, et al. T cell-replete haploidentical transplantation with post-transplantation cyclophosphamide for hodgkin lymphoma relapsed after autologous transplantation: reduced incidence of relapse and of chronic graft-versus-host disease compared with HLA-identical related donors[J] Biol Blood Marrow Transplant. 2018;24(3):627–632. doi: 10.1016/j.bbmt.2017.11.030. [DOI] [PubMed] [Google Scholar]
- 11.Gauthier J, Poiré X, Gac AC, et al. Better outcome with haploidentical over HLA-matched related donors in patients with Hodgkin's lymphoma undergoing allogeneic haematopoietic cell transplantation-a study by the Francophone Society of Bone Marrow Transplantation and Cellular Therapy[J] Bone Marrow Transplant. 2018;53(4):400–409. doi: 10.1038/s41409-017-0018-z. [DOI] [PubMed] [Google Scholar]
- 12.Zhao X, Zhao X, Chen H, et al. Comparative analysis of flow cytometry and RQ-PCR for the detection of minimal residual disease in philadelphia chromosome-positive acute lymphoblastic leukemia after hematopoietic stem cell transplantation[J] Biol Blood Marrow Transplant. 2018;24(9):1936–1943. doi: 10.1016/j.bbmt.2018.03.015. [DOI] [PubMed] [Google Scholar]
- 13.Zhao XS, Liu YR, Xu LP, et al. Minimal residual disease status determined by multiparametric flow cytometry pretransplantation predicts the outcome of patients with ALL receiving unmanipulated haploidentical allografts[J] Am J Hematol. 2019;94(5):512–521. doi: 10.1002/ajh.25417. [DOI] [PubMed] [Google Scholar]
- 14.Bader P, Salzmann-Manrique E, Balduzzi A, et al. More precisely defining risk peri-HCT in pediatric ALL: pre- vs post-MRD measures, serial positivity, and risk modeling[J] Blood Adv. 2019;3(21):3393–3405. doi: 10.1182/bloodadvances.2019000449. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Eckert C, Henze G, Seeger K, et al. Use of allogeneic hematopoietic stem-cell transplantation based on minimal residual disease response improves outcomes for children with relapsed acute lymphoblastic leukemia in the intermediate-risk group[J] J Clin Oncol. 2013;31(21):2736–2742. doi: 10.1200/JCO.2012.48.5680. [DOI] [PubMed] [Google Scholar]
- 16.Gökbuget N, Dombret H, Bonifacio M, et al. Blinatumomab for minimal residual disease in adults with B-cell precursor acute lymphoblastic leukemia[J] Blood. 2018;131(14):1522–1531. doi: 10.1182/blood-2017-08-798322. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.王 欣玉, 常 英军, 刘 艳荣, et al. 多参数流式细胞术与实时定量PCR技术检测Ph阳性急性B淋巴细胞白血病异基因造血干细胞移植前微小残留病的预后意义比较[J] 中华血液学杂志. 2021;42(2):116–123. doi: 10.3760/cma.j.issn.0253-2727.2021.02.005. [DOI] [Google Scholar]
- 18.Guo H, Chang YJ, Hong Y, et al. Dynamic immune profiling identifies the stronger graft-versus-leukemia (GVL) effects with haploidentical allografts compared to HLA-matched stem cell transplantation[J] Cell Mol Immunol. 2021;18(5):1172–1185. doi: 10.1038/s41423-020-00597-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Yu S, Huang F, Wang Y, et al. Haploidentical transplantation might have superior graft-versus-leukemia effect than HLA-matched sibling transplantation for high-risk acute myeloid leukemia in first complete remission: a prospective multicentre cohort study[J] Leukemia. 2020;34(5):1433–1443. doi: 10.1038/s41375-019-0686-3. [DOI] [PubMed] [Google Scholar]
- 20.Li SQ, Fan QZ, Xu LP, et al. Different effects of pre-transplantation measurable residual disease on outcomes according to transplant modality in patients with philadelphia chromosome positive ALL[J] Front Oncol. 2020;10:320. doi: 10.3389/fonc.2020.00320. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.van Dongen JJ, van der Velden VH, Brüggemann M, et al. Minimal residual disease diagnostics in acute lymphoblastic leukemia: need for sensitive, fast, and standardized technologies[J] Blood. 2015;125(26):3996–4009. doi: 10.1182/blood-2015-03-580027. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Pui CH, Nichols KE, Yang JJ. Somatic and germline genomics in paediatric acute lymphoblastic leukaemia[J] Nat Rev Clin Oncol. 2019;16(4):227–240. doi: 10.1038/s41571-018-0136-6. [DOI] [PubMed] [Google Scholar]
- 23.Akahoshi Y, Igarashi A, Fukuda T, et al. Impact of graft-versus-host disease and graft-versus-leukemia effect based on minimal residual disease in Philadelphia chromosome-positive acute lymphoblastic leukemia[J] Br J Haematol. 2020;190(1):84–92. doi: 10.1111/bjh.16540. [DOI] [PubMed] [Google Scholar]
- 24.Yeshurun M, Weisdorf D, Rowe JM, et al. The impact of the graft-versus-leukemia effect on survival in acute lymphoblastic leukemia[J] Blood Adv. 2019;3(4):670–680. doi: 10.1182/bloodadvances.2018027003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Gassas A, Sung L, Saunders EF, et al. Graft-versus-leukemia effect in hematopoietic stem cell transplantation for pediatric acute lymphoblastic leukemia: significantly lower relapse rate in unrelated transplantations[J] Bone Marrow Transplant. 2007;40(10):951–955. doi: 10.1038/sj.bmt.1705853. [DOI] [PubMed] [Google Scholar]
- 26.Correia RP, Bento LC, de Sousa FA, et al. How I investigate minimal residual disease in acute lymphoblastic leukemia[J] Int J Lab Hematol. 2021;43(3):354–363. doi: 10.1111/ijlh.13463. [DOI] [PubMed] [Google Scholar]