Abstract
目的
探讨miR-20a-5p调控HOXB13基因表达抑制肺癌细胞系A549增殖的分子机制。
方法
转染HOXB13过表达质粒与HOXB13 siRNA到肺癌细胞系A549,通过qRT-PCR及Western blot实验检测HOXB13 mRNA及蛋白的表达水平;CCK-8及EdU实验检测HOXB13对肺癌细胞系A549细胞增殖的影响;利用生物信息学分析筛选HOXB13可能结合的miRNA;通过qRT-PCR检测转染miR-20a-5p mimic与miR-20a-5p inhibitor到肺癌细胞系后miR-20a-5p的表达水平;Western blot实验检测HOXB13在肺癌细胞系中的表达情况;CCK-8及EdU实验检测miR-20a-5p肺癌细胞系A549细胞增殖的影响;在A549细胞中共转染miR-20a-5p mimic及HOXB13过表达质粒,CCK-8及EdU实验检测A549细胞增殖能力。
结果
HOXB13促进了A549细胞的增殖(P<0.05);生物信息学筛选出HOXB13可能结合的miRNA为miR-20a-5p;在肺癌细胞系中过表达miR-20a-5p后,HOXB13蛋白表达量降低(P<0.05);而干扰miR-20a-5p表达后,HOXB13蛋白的表达量升高(P<0.05);细胞增殖实验结果显示,miR-20a-5p与HOXB13对细胞增殖的影响相反,miR-20a-5p及HOXB13同时过表达,细胞增殖情况介于单独过表达miR-20a- 5p及单独过表达HOXB13组之间(P<0.05)。
结论
miR-20a-5p调控HOXB13基因表达抑制肺癌细胞系A549的增殖。
Keywords: miR-20a-5p, 肺癌, 细胞增殖, A549, HOXB13
Abstract
Objective
To investigate the molecular mechanism by which miR-20a-5p regulates HOXB13 gene expression and inhibits lung cancer cell proliferation.
Methods
The expression levels of HOXB13 mRNA and protein in lung cancer A549 cells transfected with HOXB13 overexpression plasmid or HOXB13 siRNA were detected with real-time fluorescence quantitative PCR (qRT-PCR) and Western blotting. CCK-8 and EdU assays were used to examine the effect of modulation of HOXB13 expression on cell proliferation. We screened possible binding miRNAs of HOXB13 by bioinformatics analysis. In A549 cells transfected with miR-20a-5p mimic or miR-20a-5p inhibitor, the expression level of miR-20a-5p was detected by qRT-PCR and the protein expression of HOXB13 was determined with Western blotting. CCK-8 and EdU assays were used to assess the effect of miR-20a-5p overexpression on the proliferation of A549 cells. miR-20a-5p mimic and HOXB13 overexpression plasmids were co-transfected into A549 cells, and the changes in cell proliferation were evaluated with CCK-8 and EdU assays.
Results
HOXB13 overexpression obviously promoted the proliferation of A549 cells (P < 0.05). miR-20a-5p was identified as the potential binding miRNA of HOXB13. Overexpression of miR-20a-5p in A549 cells significantly decreased the expression of HOXB13 protein (P < 0.05), while interference of miR-20a-5p obviously increased HOXB13 expression (P < 0.05). The results of cell proliferation experiment showed that miR-20a-5p and HOXB13 had opposite effects on cell proliferation, and the cells overexpressing both miR-20a-5p and HOXB13 showed a lower proliferation activity than the cells overexpressing HOXB13 but higher than the cells overexpressing miR-20a-5p alone (P < 0.05).
Conclusion
miR-20a-5p inhibits proliferation of lung cancer cells by down-regulating the expression of HOXB13.
Keywords: miR-20a-5p, lung cancer, cell proliferation, A549, HOXB13
肺癌为全球致死率排名第一的恶性肿瘤[1]。近年来,肺癌的诊断、治疗技术取得了较大进展,但肺癌病人5年的存活期仍低于18%[2, 3]。研究肺癌的发生发展机制将为肺癌的诊断及治疗提供新的线索。同源盒蛋白B13(HOXB13)是一类前列腺谱系特异性转录因子[4]。截至目前,关于HOXB13的研究均在前列腺癌中[5],在其他癌症中的研究还较少。据报道,肺癌中HOXB13异常高表达,促进了肺癌的转移[6],而HOXB13对肺癌细胞增殖的影响还未见报道,还需深入研究肺癌中HOXB13对细胞增殖的影响及其上游调控机制。
miRNAs是一段长度为18~25 bp的非编码RNA,其参与调控了肿瘤细胞的多种进程(生长、增殖、凋亡和迁移)[7-9]。而在肺癌中,miRNA调控HOXB13的研究还未见报道,因此本研究通过3种生物信息学软件预测了可能结合HOXB13的miRNA,分析发现miR-20a-5p是其最可能结合的miRNA。有研究表明,miR-20a-5p在肺癌中抑制了血管的生成,并抑制了肺癌的进程[10]。而关于miR-20a-5p对肺癌细胞增殖的影响还未见报道。基于上述研究背景,我们推测miR-20a-5p可能通过调控HOXB13表达进而抑制了肺癌细胞的增殖。本文研究了HOXB13对肺癌细胞增殖的影响,并在体外探讨了miR-20a-5p对HOXB13的调控作用。
1. 材料和方法
1.1. 材料
1.1.1. 细胞株
人肺癌细胞株A549、H1299(中国科学院上海细胞库)。
1.1.2. 主要试剂
DMEM培养基(Gibco)、10%胎牛血清(Sigma)、Lipo3000(Invitrogen)、RNA提取试剂盒(飞捷生物)、CCK-8细胞增殖检测试剂盒(凯基生物)、RIPA蛋白裂解液(碧云天)、HOXB13 Ⅰ抗(Abcam)、GAPDH Ⅰ抗(Santa cruz)、山羊抗兔Ⅱ抗(Santa cruz)、山羊抗鼠Ⅱ抗(Santa cruz)。
1.2. 方法
1.2.1. 细胞培养
人肺癌细胞株A549、H1299用于含10%胎牛血清DMEM完全培养基进行培养,培养环境为37 ℃、5%的CO2,待细胞培养至对数生长期后进行后续实验。
1.2.2. miR-20a-5p转染
miR-20a-5p过表达及干扰(广州锐博生物有限公司)。将细胞铺到6孔板内,待细胞长到60%左右,按照转染试剂(Lipo3000)的说明书将等量的miR-20a-5p过表达及干扰转染到细胞。
1.2.3. HOXB13过表达与干扰
HOXB13 siRNA及HOXB13过表达质粒(上海吉玛生物科技有限公司)。将细胞铺到6孔板内,待细胞长到60%左右,按照转染试剂(Lipo3000)的说明书将HOXB13 siRNA及HOXB13过表达质粒转染到细胞。
1.2.4. Western blotting检测HOXB13蛋白表达情况
细胞转染24 h后,收集细胞,离心后弃上清。加入RIPA,冰上放置30 min。低温离心(12 000 g,10 min),吸取上清。加入5×的蛋白上样缓冲液,100 ℃,5 min。SDSPAGE电泳(10%)后,进行转膜(冰浴,300 mA 90 min),随后开始封闭(5% 脱脂奶粉,室温放置1 h)。最后加入HOXB13 I抗(1∶2000稀释),4 ℃放置过夜。随后,将膜取出加入1×TBST清洗3遍(10 min/遍)。清洗结束后,加入Ⅱ抗(1∶2000稀释),室温放置1 h,再将膜取出加入1×TBST清洗3遍(10 min/遍)。将洗好的膜放到曝光板上,正面朝上,加入显影液,化学发光成像仪曝光。
1.2.5. 生物信息学分析筛选HOXB13可能结合的miRNA
为找出可能调控HOXB13基因表达的miRNAs,通过3种不同的生物信息学软件(TargetScan、miRanda及PicTar)筛选可能结合HOXB13的miRNAs[11]。在候选miRNAs中,3种软件一致预测miR-20a-5p是HOXB13结合的miRNA。
1.2.6. qRT-PCR检测miR-20a-5p及HOXB13
转染细胞24 h后,加入胰酶消化并收集细胞,按照RNA提取试剂盒说明书上的方法提取总RNA。通过qRT-PCR法检测并定量HOXB13 mRNA含量(GAPDH作为内参基因)和miR-20a-5p(U6作为内参基因)。HOXB13和GAPDH引物序列(表 1)。数据计算使用2-△△法。
表 1.
GAPDH和HOXB13引物序列
The GAPDH and HOXB13 primer sequences
| Primer | Upstream sequence | Downstream sequence |
| GAPDH | 5ˈ-CCATGACAACTTTGGTATCGTGGAA-3ˈ | 5ˈ-GGCCATCACGCCACAGTTTC-3ˈ |
| HOXB13 | 5ˈ-GTGTTGCCAGGGAGAACAGA-3ˈ | 5ˈ-TTGTTAGCCGCATACTCCCG-3ˈ |
1.2.7. CCK-8检测细胞增殖情况
CCK-8试剂盒用于检测细胞增殖情况,检测转染后各组细胞4个时间点(0、24、48、60 h)的细胞活力。细胞相对增殖活性=(实验组A450 nm-N-空白对照组A450 nm-N)/(实验组A450 nm-0-空白对照组A450 nm-0),其中0表示第1个时间点测定值,N表示后面几个时间点测定值。
1.2.8. EdU实验
EdU试剂盒用于检测细胞增殖情况,检测转染后的各组细胞的增殖情况。具体步骤为:加入用培液稀释后的EdU溶液1 mL(培液:EdU溶液=1000 ∶1),37 ℃放置2 h;弃液体,PBS清洗3次,加入4%多聚甲醛200 μL/孔,固定30 min;弃液体,加入甘氨酸溶液(2 mg/mL)150 μL/孔,常温放置5 min;PBS清洗3次,加入200 μL/孔含0.5%的TritonX-100渗透液,放置10 min;PBS清洗1次;加入200 μL/孔的Appollo染色液,常温避光放置30 min;再用渗透液清洗3遍,10 min/遍;用DAPI进行细胞核染色30 min,PBS清洗2次;最后荧光显微镜(Olympus BX51)观察并拍照。
1.3. 统计学处理
使用SPSS V22.0软件进行数据处理及统计分析。定量资料以均数±标准差表示,组间比较采用单因素方差分析,P<0.05为差异具有统计学意义。
2. 结果
2.1. HOXB13促进了肺癌细胞的增殖
qRT-PCR及Western blotting实验结果显示,过表达HOXB13后HOXB13的表达量与对照组相比较明显提高(P<0.05),而转染HOXB13 siRNA后其表达量与对照组相比较降低(P<0.05,图 1A~C)。CCK-8试剂盒检测结果显示,HOXB13过表达组促进了肺癌A549细胞增殖(P<0.05);而HOXB13干扰后,肺癌A549细胞增殖受到了抑制(P<0.05,图 1D)。EdU实验结果显示,HOXB13过表达组EdU阳性细胞数明显高于对照组(P<0.05);而HOXB13干扰后,肺癌A549细胞EdU阳性细胞数明显低于对照组(P<0.05,图 1E、F)。
图 1.
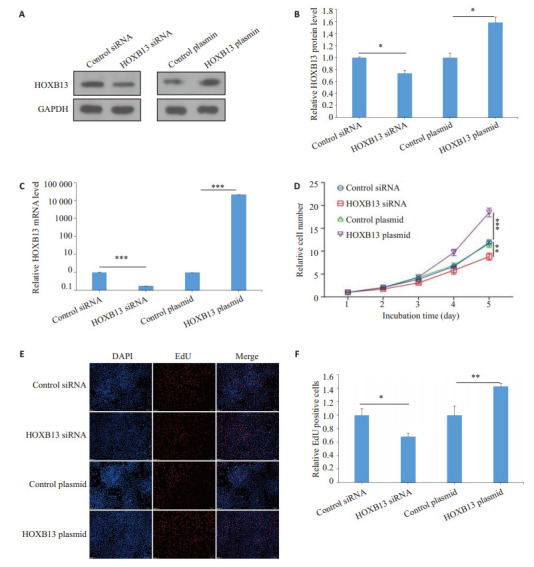
HOXB13对肺癌A549细胞增殖的影响
Effect of HOXB13 expression levels on proliferation of lung cancer A549 cells. A, B: Western blotting of HOXB13 expression in A549 cells transfected with HOXB13 siRNA or overexpression plasmid and quantitative analysis of the results. C: Expression level of HOXB13 mRNA. D: Viability of A549 cells transfected with HOXB13 siRNA or overexpression plasmid. E, F: EdU assays of the transfected cells (Original magnification: ×10). *P < 0.05, **P < 0.01, ***P < 0.001.
2.2. 预测并验证HOXB13调控的miRNA是miR-20a-5p
通过生物信息学分析预测出miR-20a- 5p是HOXB13结合的miRNA。为进一步验证miR-20a-5p是否调控HOXB13基因的表达,我们在2种肺癌细胞中干预miR-20a-5p的表达,24 h后通过qRT- PCR及Western blot检测。Western blot结果显示,过表达miR- 20a-5p后,细胞内的HOXB13蛋白表达水平与对照组相比降低;而干扰miR- 20a- 5p表达后,细胞内的HOXB13蛋白表达水平与对照组相比升高(P<0.05,图 2B, C)。qRT-PCR结果显示,干预miR-20a-5p表达后,细胞内的miR-20a-5p发生了明显变化(P<0.05,图 2E),且细胞内的HOXB13 mRNA水平变化没有发生变化(P>0.05,图 2D)。
图 2.
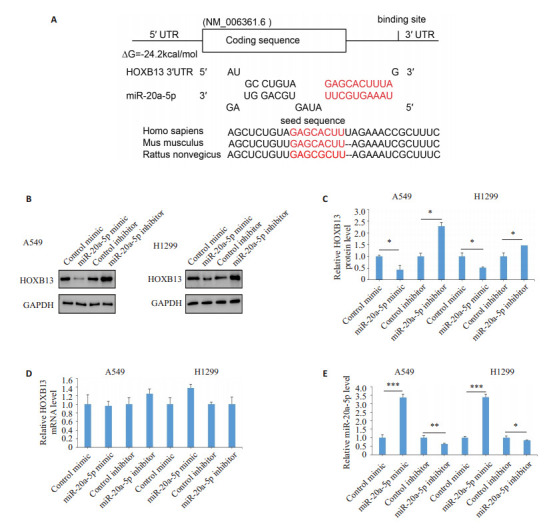
miR-20a-5p调控HOXB13基因表达
miR-20a-5p regulates HOXB13 expression. A: Duplex structures of miR-20a-5p and HOXB13 3′-UTR region. B, C: Western blotting of HOXB13 in A549 cells transfected with control mimic/inhibitor or miR-20a-5p mimic/inhibitor. D: qRT-PCR of HOXB13 mRNA transfected with control mimic/inhibitor or miR-20a-5p mimic/inhibitor. E: qRT-PCR of miR-20a-5p expression transfected with control mimic/inhibitor or miR-20a-5p mimic/inhibitor. *P < 0.05, **P < 0.01, ***P < 0.001.
2.3. miR-20a-5p抑制了肺癌细胞的增殖
在肺癌细胞内,干预miR-20a-5p表达后,通过CCK-8试剂盒检测肺癌细胞增殖能力,结果显示,miR- 20a-5p过表达抑制了肺癌细胞的增殖(P<0.05)。而miR-20a-5p表达降低后,其细胞增殖能力增加(P<0.05,图 3A、B)。EdU实验结果显示,miR-20a-5p过表达组EdU阳性细胞数明显低于对照组(P<0.05);而miR-20a-5p干扰后,肺癌A549细胞EdU阳性细胞数明显高于对照组(P<0.05,图 3C、D)。
图 3.
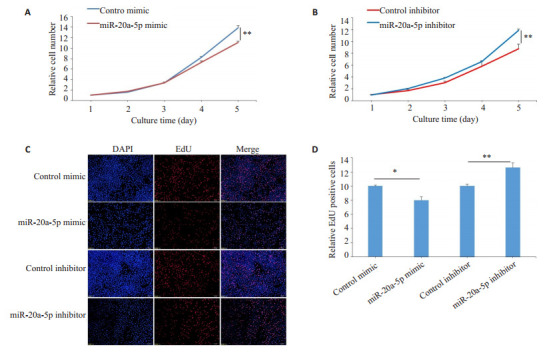
miR-20a-5p抑制了肺癌细胞的增殖
miR-20a-5p inhibits the proliferation of lung cancer cells. A: Proliferation curves of cells transfected with control mimic/miR-20a-5p mimic. B: Proliferation curves of cells transfected with control inhibitor/miR-20a-5p inhibitor. C, D: EdU assays of cells transfected with control mimic/inhibitor or miR-20a-5p mimic/ inhibitor (×10). *P < 0.05, **P < 0.01.
2.4. miR-20a-5p抑制HOXB13基因表达进而抑制肺癌细胞的增殖
为阐明miR-20a-5p是否通过调控HOXB13基因的表达影响肺癌细胞的增殖,我们在肺癌细胞中同时过表达miR-20a-5p及HOXB13,24 h后采用CCK-8法检测肺癌细胞增殖能力,结果显示:同时过表达miR-20a- 5p和HOXB13组对肺癌细胞增殖能力的影响位于单独转染miR-20a-5p过表达组及单独转染HOXB13过表达组之间,miR-20a-5p的过表达恢复了HOXB13基因过表达对细胞增殖的影响(P<0.05,图 4A)。EdU实验结果显示,同时过表达miR-20a-5p和HOXB13组的EdU阳性细胞比例介于单独转染miR-20a-5p过表达组及单独转染HOXB13过表达组之间(P<0.05,图 4B、C)。
图 4.
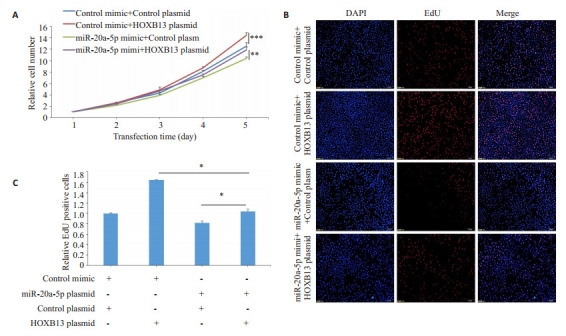
miR-20a-5p通过调控HOXB13基因表达抑制了肺癌细胞增殖
miR-20a-5p inhibits the proliferation of lung cancer cells by regulating HOXB13 gene expression. A: Proliferation curves of the cells transfected with (a) control mimic+control plasmid, (b) control mimic+HOXB13 plasmid, (c) miR-20a-5p mimic+control plasmid, and (d) miR-20a-5p mimic + HOXB13 plasmid. B, C: EdU assays of the transfected cells. *P < 0.05, **P < 0.01, ***P < 0.001.
3. 讨论
有研究报道HOXB13促进胶质母细胞瘤的增殖、迁移及侵袭[12-13];子宫内膜癌中HOXB13高表达,并可以作为一个肿瘤诊断标志物[14];HOXB13在胃癌中抑制了细胞的增殖、迁移及侵袭[15]。已有研究表明HOXB13在肺癌中高表达,且促进了肺癌的转移[6]。但关于HOXB13对肺癌细胞增殖的影响还未见报道。因此,本研究首先通过CCK-8细胞增殖实验,发现HOXB13促进了肺癌细胞的增殖,这一结果也验证了HOXB13可能在肺癌中促进了肺癌的进程。
miRNAs通过转录后调控机制调控靶基因的表达,在多种肿瘤中发挥不同的作用[16]。miR-20a-5p在胃癌[17]、鼻咽癌[18]、三阴乳腺癌[19]及头颈部鳞状细胞癌[20]中高表达且促进了癌症的进程,而在子宫内膜癌[21]、神经母细胞瘤[22]及肝癌[23]中低表达并可以作为一个抑癌miRNA发挥作用。截至目前,有关miR-20a-5p在肺癌中的研究还很少,尤其是miR-20a-5p对肺癌细胞增殖的研究还未见报道。本研究通过生物信息学预测并找到可能结合HOXB13的miRNA为miR-20a-5p,通过CCK-8细胞增殖实验及EdU实验发现,过表达miR-20a-5p可抑制肺癌A549细胞的增殖,而抑制miR-20a-5p会促进肺癌A549细胞增殖。结果表明miR-20a-5p抑制了肺癌细胞增殖,这一结果与HOXB13对肺癌细胞的增殖影响相反,与前人关于miR-20a-5p在肺癌中可能作为一个抑癌miRNA发挥作用的结果相一致[10]。
为验证miR-20a-5p与HOXB13基因是否存在调控关系,本研究在肺癌的2个细胞系中干预miR-20a-5p的表达,通过Western blot实验检测细胞内的HOXB13蛋白表达水平。结果表明,过表达miR-20a-5p后HOXB13蛋白的表达水平明显下降;而干扰miR-20a- 5p后HOXB13蛋白表达水平明显升高;但HOXB13的mRNA水平却没有变化。以上结果表明,miR-20a-5p在肺癌细胞中在转录后水平调控HOXB13基因的表达。
为进一步的验证在肺癌A549细胞中miR-20a-5p调控HOXB1基因表达,我们在肺癌A549细胞中共转染miR-20a-5p过表达和HOXB13过表达质粒,CCK-8及EdU实验结果表明共转染组的细胞增殖速率介于单独过表达miR-20a-5p组与单独过表达HOXB13组之间,说明细胞内miR-20a-5p过表达后逆转了HOXB13对肺癌A549细胞增殖的影响,说明miR-20a-5p通过调控HOXB13基因的表达抑制肺癌A549细胞的增殖。
综上所述,本研究发现HOXB13可以促进肺癌A549细胞的增殖,且证明了miR-20a-5p可以抑制肺癌A549细胞的增殖,并证实miR-20a-5p可以通过负调控HOXB13基因的表达进而抑制肺癌A549细胞的增殖。然而,miR-20a-5p负调控HOXB13基因表达具体是怎么影响肺癌细胞增殖,miR-20a-5p是否可以作为肺癌诊断的一个生物标志物,miR-20a-5p与肺癌中小细胞肺癌、鳞癌是否有关?这些问题还有待后续进一步研究。
Biography
刘海军,硕士,讲师,E-mail: liuhaijun@wnmc.edu.cn
Funding Statement
安徽省教育厅自然科学研究重点项目(KJ2021A0856);皖南医学院自然科学重点项目(2019Z07, WK2020Z14);2021年国家大学生创新创业计划项目(202110368029,202110368042)
References
- 1.Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015. CA Cancer J Clin. 2015;65(1):5–29. doi: 10.3322/caac.21254. [DOI] [PubMed] [Google Scholar]
- 2.Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA A Cancer J Clin. 2021;71(3):209–49. doi: 10.3322/caac.21660. [DOI] [PubMed] [Google Scholar]
- 3.Torre LA, Siegel RL, Jemal A. Lung Cancer Statistics. Adv Exp Med Biol. 2016;893:1–19. doi: 10.1007/978-3-319-24223-1_1. [DOI] [PubMed] [Google Scholar]
- 4.Zeltser L, Desplan C, Heintz N. Hoxb-13: a new Hox gene in a distant region of the HOXB cluster maintains colinearity. Development. 1996;122(8):2475–84. doi: 10.1242/dev.122.8.2475. [DOI] [PubMed] [Google Scholar]
- 5.Kim YR, Kim IJ, Kang TW, et al. HOXB13 downregulates intracellular zinc and increases NF-κB signaling to promote prostate cancer metastasis. Oncogene. 2014;33(37):4558–67. doi: 10.1038/onc.2013.404. [DOI] [PubMed] [Google Scholar]
- 6.Zhan J, Wang P, Li S, et al. HOXB13 networking with ABCG1/ EZH2/Slug mediates metastasis and confers resistance to cisplatin in lung adenocarcinoma patients. Theranostics. 2019;9(7):2084–99. doi: 10.7150/thno.29463. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Gandellini P, Giovannetti E, Nicassio F. microRNAs in cancer management: big challenges for small molecules. Biomed Res Int. 2015;201:982156–67. doi: 10.1155/2015/982156. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Kong YW, Ferland-McCollough D, Jackson TJ, et al. microRNAs in cancer management. Lancet Oncol. 2012;13(6):e249–58. doi: 10.1016/S1470-2045(12)70073-6. [DOI] [PubMed] [Google Scholar]
- 9.Yu XF. miR-93 suppresses proliferation and colony formation of human colon cancer stem cells. World J Gastroenterol. 2011;17(42):4711–9. doi: 10.3748/wjg.v17.i42.4711. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Han JL, Hu JP, Sun F, et al. microRNA-20a-5p suppresses tumor angiogenesis of non-small cell lung cancer through RRM2- mediated PI3K/Akt signaling pathway. Mol Cell Biochem. 2021;476(2):689–98. doi: 10.1007/s11010-020-03936-y. [DOI] [PubMed] [Google Scholar]
- 11.Yan L, Zhang Y, Li K, et al. miR-593-5p inhibit cell proliferation by targeting PLK1 in non small cell lung cancer cells. Pathol Res Pract. 2020;216(2):152786–93. doi: 10.1016/j.prp.2019.152786. [DOI] [PubMed] [Google Scholar]
- 12.Whitlock NC, Trostel SY, Wilkinson S, et al. MEIS1 down-regulation by MYC mediates prostate cancer development through elevated HOXB13 expression and AR activity. Oncogene. 2020;39(34):5663–74. doi: 10.1038/s41388-020-01389-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Wang X, Sun Y, Xu TY, et al. HOXB13 promotes proliferation, migration, and invasion of glioblastoma through transcriptional upregulation of lncRNA HOXC-AS3. J Cell Biochem. 2019;120(9):15527–37. doi: 10.1002/jcb.28819. [DOI] [PubMed] [Google Scholar]
- 14.Tong H, Ke JQ, Jiang FZ, et al. Tumor-associated macrophagederived CXCL8 could induce ERα suppression via HOXB13 in endometrial cancer. Cancer Lett. 2016;376(1):127–36. doi: 10.1016/j.canlet.2016.03.036. [DOI] [PubMed] [Google Scholar]
- 15.Geng H, Liu GL, Hu JD, et al. HOXB13 suppresses proliferation, migration and invasion, and promotes apoptosis of gastric cancer cells through transcriptional activation of VGLL4 to inhibit the involvement of TEAD4 in the Hippo signaling pathway. Mol Med Rep. 2021;24(4):722–8. doi: 10.3892/mmr.2021.12361. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Lee YS, Dutta A. microRNAs in cancer. Annu Rev Pathol Mech Dis. 2009;4:199–227. doi: 10.1146/annurev.pathol.4.110807.092222. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Li J, Ye D, Shen P, et al. Mir-20a-5p induced WTX deficiency promotes gastric cancer progressions through regulating PI3K/AKT signaling pathway. J Exp Clin Cancer Res. 2020;39(1):212–31. doi: 10.1186/s13046-020-01718-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Huang DB, Bian G, Pan YY, et al. MiR-20a-5p promotes radioresistance by targeting Rab27B in nasopharyngeal cancer cells. Cancer Cell Int. 2017;17:32–9. doi: 10.1186/s12935-017-0389-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Bai XD, Han GH, Liu Y, et al. MiRNA-20a-5p promotes the growth of triple-negative breast cancer cells through targeting RUNX3. Biomed Pharmacother. 2018;103:1482–9. doi: 10.1016/j.biopha.2018.04.165. [DOI] [PubMed] [Google Scholar]
- 20.Wu H, Pang P, Liu min-da, et al. Upregulated miR-20a-5p expression promotes proliferation and invasion of head and neck squamous cell carcinoma cells by targeting of TNFRSF21. Oncol Rep. 2018;40(2):1138–46. doi: 10.3892/or.2018.6477. [DOI] [PubMed] [Google Scholar]
- 21.He Y, Ma H, Wang J, et al. miR-20a-5p inhibits endometrial cancer progression by targeting Janus kinase 1. Oncol Lett. 2021;21(5):427–36. doi: 10.3892/ol.2021.12688. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Yu YB, Zhang J, Jin YQ, et al. miR-20a-5p suppresses tumor proliferation by targeting autophagy-related gene 7 in neuroblastoma. Cancer Cell Int. 2018;18:5–12. doi: 10.1186/s12935-017-0499-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Liu DL, Lu LL, Dong LL, et al. miR-17-5p and miR-20a-5p suppress postoperative metastasis of hepatocellular carcinoma via blocking HGF/ERBB3-NF-κB positive feedback loop. Theranostics. 2020;10(8):3668–83. doi: 10.7150/thno.41365. [DOI] [PMC free article] [PubMed] [Google Scholar]


