Abstract
Virale und paravirale Exantheme sind die häufigsten Exantheme des Kindesalters, die auch meist zu einer Vorstellung in der Praxis inklusive der Notaufnahme führen. Die Kenntnis der verschiedenen Krankheitsbilder ist entscheidend für die adäquate Diagnostik und Betreuung der kleinen Patient:innen, die entsprechende Aufklärung der Familie und ggf. das Minimieren des Infektionsrisikos. In der aktuellen Arbeit werden die kürzlich beschriebenen „reactive infectious mucocutaneous eruptions“ (RIME) und das „pediatric inflammatory multisystem syndrome“ (PIMS) vorgestellt. Zusätzlich werden wir einige atypische Manifestationen des Gianotti-Crosti-Syndroms und der Hand-Fuß-Mund-Erkrankung – wie z. B. die mit Mollusken assoziierte „Gianotti-Crosti-like reaction“ und das „eczema coxsackium“ – erläutern.
Schlüsselwörter: Paraviral, Reactive infectious mucocutaneous eruptions, Pediatric inflammatory multisystem syndrome, Gianotti-Crosti-like-reaction, Eczema coxsackium
Abstract
Viral and paraviral exanthems are the most common exanthems in children and are often the reason for a medical evaluation, especially in pediatric primary care and emergency rooms. Familiarity with the various eruptions is important for early diagnosis and patient management as well as minimizing the risk of infection. In this review, we present the newly described entities reactive infectious mucocutaneous eruptions (RIME) and the pediatric inflammatory multisystem syndrome (PIMS). In addition, atypical manifestations of Gianotti–Crosti syndrome and hand, foot, and mouth disease are discussed.
Keywords: Paraviral, Reactive infectious mucocutaneous eruptions, Pediatric inflammatory multisystem syndrome, Gianotti-Crosti-like reaction, Eczema coxsackium
Viren sind die häufigsten Auslöser für Exantheme im Kindesalter. Die frühzeitige Diagnosestellung und Abgrenzung zu Differenzialdiagnosen sind entscheidend für die Einleitung einer Therapie und die Vermeidung von Komplikationen. Neben den bekannten, klassischen viralen Exanthemen und den nichtklassischen/paraviralen Exanthemen, die zur Übersicht tabellarisch dargestellt werden sollen (Tab. 1 und 2), sind in den letzten Jahren auch neue Krankheitsbilder hinzugekommen, wie das „pediatric inflammatory multisystem syndrome“ (PIMS) im Rahmen einer SARS-CoV-2-Erkrankung oder die „reactive infectious mucocutaneous eruptions“ (RIME), die oft im Rahmen einer Mykoplasmeninfektion beobachtet werden, jedoch auch parainfektiös bei viralen Infektionen auftreten können. Bei einigen bekannten, paraviralen Exanthemen wie dem Gianotti-Crosti-Syndrom oder der Hand-Fuß-Mund-Erkrankung sollen weiterführende Aspekte beleuchtet werden wie die „Gianotti-Crosti-like reaction“ und andere atypische Manifestationsformen.
| Erreger | Exanthemmorphe | Extrakutane Symptome | Diagnostik | Verlauf | |
|---|---|---|---|---|---|
| Varizellen | VZV | Exanthem, am Haaransatz beginnend, mit teils Makulae, Papeln, Pusteln und hämorrhagischen Vesikeln („Heubner-Sternenkarte“), Kapillitium und Mundschleimhaut ebenso betroffen | Prodromi mit erhöhter Temperatur, Unwohlsein | VZV-PCR, VZV-Serologie | Im Kindesalter meist blander Verlauf, häufigste Komplikationen sind bakterielle Superinfektionen. Seltene Komplikationen sind u. a. die Varizellenpneumonie und die aseptische Meningoenzephalitis |
| Masern | Masernvirus (Paramyxovirus) | Enanthem am Gaumen, Koplik-Flecken (weiße punktförmige Effloreszenzen an Wangenschleimhaut gegenüber Backenzähnen), kraniokaudale Ausbreitung des Exanthems mit Beginn retroaurikulär, Ausbreitung zunächst am Stamm, dann an Extremitäten | Hohes Fieber, AZ-Minderung, Konjunktivitis, Lichtsensibilität, Rhinitis, trockener Husten | Impfung ist entscheidend, Serologie mit Masern-IgM (positiv 3 Tage nach Auftreten des Exanthems) |
Inkubationszeit: 8 bis 10 Tage bis zum Prodromalstadium, 14 Tage bis zum Exanthem, 3 bis 5 Tage vor Auftreten des Exanthems und bis zu 4 Tage nach Abblassen besteht Kontagiosität Schwere seltene Komplikationen sind die akute postinfektiöse Enzephalitis sowie die subakute sklerosierende Panenzephalitis |
| Röteln | Rubella-Virus | Makulopapulöses Exanthem | Lymphadenopathie insbesondere retroaurikulär, Fieber | Rötelnserologie | Risiko des Gregg-Syndroms (Rötelnembryopathie) |
| Erythema infectiosum (auch „Ohrfeigenkrankheit“) | Parvovirus B19 | Schmetterlingsförmiges Erythem auf Wangen und Nase, girlandenförmiges, makulöses Exanthem, v. a. Extremitäten betroffen | Gelenkschmerzen, Hydrops fetalis, aplastische Krise bei chronischer hämolytischer Anämie | Parvovirus-B19-Serologie | Nach Auftreten des Exanthems nicht mehr kontagiös |
| Exanthema subitum | HHV6, HHV7 | Makulopapulöses Exanthem | Initiales Fieber | HHV6-, HHV7-Serologie | Bis zu 5 Tage hohes Fieber vor Auftreten des Exanthems |
VZV Varizella-Zoster-Virus, PCR Polymerasekettenreaktion, AZ Allgemeinzustand, IgM Immunglobulin M, HHV humanes Herpesvirus
| Erreger | Exanthemmorphe | Extrakutane Symptome | Verlauf | Differenzialdiagnose | |
|---|---|---|---|---|---|
| „Papular-purpuric gloves and socks syndrome“ (PPGSS) | Meist Parvovirus B19, seltener CMV, Coxsackie, Hepatitis B, Masern, EBV | Juckendes, symmetrisches, scharf begrenztes Exanthem mit Schwellung an Händen und Füßen, vereinzelt petechial, zudem oft Enanthem enoral mit Erosionen und Petechien | Arthralgien, Unwohlsein, Fieber, Lymphadenopathie, respiratorische und gastrointestinale Symptome | Auftreten meist in Adoleszenz, Inkubationszeit bis zu 10 Tage, meist Abheilung nach 1 bis 2 Wochen. Im Gegensatz zum Erythema infectiosum besteht im Exanthemstadium noch Kontagiosität | Urticaria profunda, frühes Stadium eines Erythema exsudativum multiforme, Kawasaki-Syndrom |
| Pityriasis lichenoides et varioliformis acuta (PLEVA)/Pityriasis lichenoides chronica (PLC) | Assoziationen zu Herpesviren, Parvovirus B19, Toxoplasmen, HIV und bakteriellen Infektionen mit Streptokokken/Staphylokokken [5] |
PLEVA: plötzliches Auftreten eines Exanthems in Form von erythematösen Makulae, später Papulovesikel, die ulzerieren und nekrotisieren können. Nach Abheilung können Narben und Pigmentierungsstörungen persistieren PLC: Auftreten von rötlich-bräunlichen Makulae mit charakteristischer Schuppung |
Begleitend zum Exanthem können Fieber, Gelenkschmerzen und Juckreiz auftreten Kommt es zur Komplikation einer febrilen ulzeronekrotischen PLEVA mit bakterieller Superinfektion, Fieber und Allgemeinzustandsverschlechterung kann eine Reihe extrakutaner Symptome wie gastrointestinale und neurologische Beschwerden, Arthritis, Pneumonitis und Sepsis mit einer Mortalität von 25 % vorkommen [25] |
Zwei verschiedene Formen: Pityriasis lichenoides et varioliformis acuta (PLEVA) und Pityriasis lichenoides chronica (PLC), meist sind junge Erwachsene und Kinder von 5 bis 10 Jahren betroffen [5] Zur Diagnosesicherung empfiehlt sich eine Histologie. Therapeutisch können bei PLC Phototherapie (PUVA, UV-B), Makrolide (Erythromycin, Azithromycin) plus topische Steroide verwendet werden. Bei febriler ulzeronekrotischer PLEVA sind intensivmedizinische Maßnahmen erforderlich, ggf. Methotrexat und systemische Steroide |
DD bei PLEVA: Varizellen (bei VZV Schleimhautbeteiligung und Kapillitium betroffen), lymphomatoide Papulose DD bei PLC: Pityriasis rosea, Psoriasis guttata, Lues Stadium II PLEVA und PLC können in ein malignes Lymphom übergehen |
| Pityriasis rosea (Pityriasis rosea gigantea) | Assoziation mit HHV6 und HHV7 wird vermutet |
Ausgehend von einem Primärmedaillon, einer erythematösen ovalen Plaque, breitet sich in den nächsten Wochen ein Exanthem an Stamm und proximalen Extremitäten aus. Typisch ist eine colleretteartige Schuppung der einzelnen Läsionen Eine Sonderform bildet die Pityriasis rosea gigantea mit besonders großflächigem Primärmedaillon und großflächigen Exanthemherden [57], diese kann sowohl bei Erwachsenen als auch vereinzelt bei Kleinkindern auftreten [10] |
Meist keine extrakutanen Symptome, in einigen Fällen milde Allgemeinsymptomatik vorab mit Fieber und Kopfschmerzen | In einigen Fällen Prodromi mit Fieber, Unwohlsein, Kopfschmerzen, dann Auftreten des Primärmedaillons und konsekutiv des Exanthems. Aufgrund der Empfindlichkeit der Haut insgesamt kann es zur Ekzematisierung und zum protrahierten Krankheitsverlauf kommen. Meist selbstlimitierend, bei persistierendem Befund können topische Steroide und UV-B-Bestrahlung erwogen werden [51] | Lues Stadium II, Tinea corporis, Psoriasis guttata, Pityriasis lichenoides chronica, Arzneimittelexanthem |
| „Unilateral laterothoracic exanthem, unilateral mediothoracic exanthem“ | Pathogenese unklar, ist mit viralen Infektionen assoziiert | Einseitiges polymorphes, makulopapulöses Exanthem mit zentrifugaler Ausbreitung, meist lateral am Stamm lokalisiert, eine mediothorakale Ausbreitung ist ebenso beschrieben [12]. Auftreten auch in Assoziation mit Molluscum-contagiosum-Infektion [2] | Mögliches Prodrom mit leichtem Fieber und respiratorischen oder gastrointestinalen Beschwerden | Meist bei Kindern von 1 bis 5 Jahren, das Exanthem ist selbstlimitierend, meist Abheilung nach 4 Wochen | Kontaktdermatitis, Pityriasis rosea, Scharlach, Tinea, Gianotti-Crosti-Syndrom [38] |
CMV Zytomegalievirus, EBV Epstein-Barr-Virus, HIV humanes Immundefizienzvirus, PUVA Psoralen plus UV‑A, DD Differenzialdiagnose, VZV Varizella-Zoster-Virus, HHV humanes Herpesvirus
Gianotti-Crosti-Syndrom
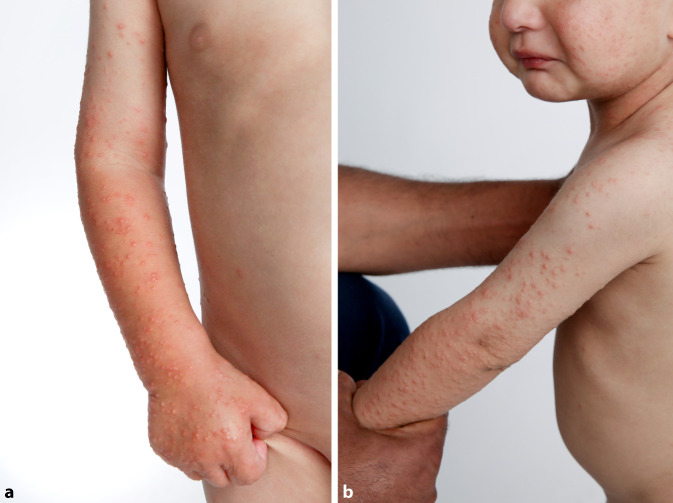
Das klassische Gianotti-Crosti-Syndrom (GCS, Syn. infantile papulöse Akrodermatitis), erstmals beschrieben durch Gianotti und Crosti Mitte der 1950er-Jahre, ist ein paravirales Exanthem, das v. a. bei Kindern im Alter von 1 bis 6 Jahren auftritt [38].
Pathogenese
Initial wurde eine Assoziation mit dem Hepatitis-B-Virus beschrieben, inzwischen geht man davon aus, dass das GCS in Assoziation mit verschiedenen Virusinfektionen, darunter Epstein-Barr-Virus (EBV), Zytomegalievirus (CMV), Coxsackie-Virus, Adenoviren, respiratorisches Synzytialvirus (RSV), Parvovirus B19, HHV(humanes Herpesvirus)6 und Rotavirus auftreten kann [38].
Klinik und Diagnostik
Im Rahmen der Virusinfektion können Fieber, respiratorische Symptome und eine Lymphadenopathie dem Auftreten der Hautveränderungen vorangehen [38]. Das Exanthem imponiert mit symmetrisch verteilten monomorphen erythematösen Papeln oder Papulovesikeln an Gesicht, Gesäß und Streckseiten der Extremitäten (Abb. 1), selten kommt es zu hämorrhagischen, Purpura-ähnlichen Hautveränderungen, die von einem milden Juckreiz begleitet sein können. Der Stamm ist meist nicht betroffen [38]. Bei Vorliegen einer atopischen Diathese besteht eine höhere Vulnerabilität, ein GCS zu entwickeln [11]. Es wird eine symptombezogene Untersuchung empfohlen. Sollten sich in der klinischen Untersuchung Hinweise für eine Lymphadenopathie und/oder Hepatosplenomegalie oder anamnestische Hinweise auf eine Hepatitisinfektion ergeben, wird eine weitere Diagnostik empfohlen. Andernfalls sind Routineserologien hinsichtlich der viralen Genese nicht erforderlich.
Therapie
Die Therapie erfolgt symptomatisch, meist kommt es nach 8 bis 12 Wochen zu einem Abheilen der Läsionen. Insbesondere bei dunklerem Hauttyp können postinflammatorische Hypopigmentierungen länger persistieren [38].
„Gianotti-Crosti-like reaction“
Neben dem klassischen Gianotti-Crosti-Syndrom ist eine „Gianotti-Crosti-like reaction“ (GCLR) begleitend zu einer Infektion mit Molluscum contagiosum beschrieben worden [3].
Pathogenese
Hierbei handelt es sich um eine späte Hypersensitivitätsreaktion auf Molluscum-contagiosum-Antigene [35], die in Effloreszenzen und Verteilung dem Gianotti-Crosti-Syndrom ähnelt. Mollusken werden durch das Molluscum-contagiosum-Virus, ein Pockenvirus, hervorgerufen und treten meist bei Kindern im Alter von 5 bis 10 Jahren auf [38].
Klinik
Bei der GCLR zeigen sich neben den Mollusken monomorphe Papeln, die typischerweise an den Streckseiten der Extremitäten (Ellenbogen, Knie) lokalisiert sind, selten an Gesicht, Stamm oder Gesäß [38]. Berger et al. berichten von Gianotti-Crosti-ähnlichen Reaktionen bei 4,9 % der Kinder mit Molluscum contagiosum [3]. In der betreffenden Studie trat eine GCLR bei 40 % der Kinder 1 Monat nach Behandlungsbeginn der Mollusken auf, sodass auch die Behandlung als potenzieller Trigger in Betracht kommt [3]. In einer aktuellen Studie von Bürgler et al., in der 26 Kinder im Alter von 3 bis 11 Jahren eingeschlossen wurden, wird der Hautbefund als plötzliches Auftreten von symmetrisch verteilten, erythematösen Papeln, Plaques und Papulovesikeln beschrieben, seltener zeigten sich urtikarielle oder targetoide Plaques an den Streckseiten der Extremitäten [6]. Insbesondere war die Haut oberhalb der großen Gelenke wie Knie und Ellenbogen, aber auch das Hautareal oberhalb der Achillessehne betroffen; 80 % der Kinder litten unter starkem Juckreiz. Zudem zeigten sich akut entzündliche Molluscum-contagiosum-Effloreszenzen bei 80 % der Kinder [6], die als spezifische Immunantwort aufzufassen sind und das Auftreten einer GCLR begünstigen. Bei den von GCLR betroffenen Kindern lag bei knapp der Hälfte eine Atopie vor [6].
Therapie
Fast alle Kinder wurden mit topischen Steroiden behandelt, bei stärker ausgeprägtem Befund erfolgte bei einem Viertel der Kinder die Gabe von systemischen Steroiden [6]. In allen Fällen zeigte sich ein gutes therapeutisches Ansprechen. Im Median gingen die Mollusken 9 Wochen nach Abheilen der GCLR zurück [6].
„Reactive infectious mucocutaneous eruptions“
„Reactive infectious mucocutaneous eruptions“ (RIME) umfassen postinfektiöse blasenbildende mukokutane Erkrankungen der Haut- und Schleimhaut, darunter auch das Krankheitsbilder der „mycoplasma pneumoniae induced rash and mucositis“ (MIRM), das durch Mycoplasma pneumoniae ausgelöst wird. Da die RIME jedoch durch ein breites Erregerspektrum, darunter auch Chlamydia pneumoniae und virale Trigger wie Influenza B und SARS-CoV‑2 ausgelöst werden können, hat sich RIME als Oberbegriff für diese Entität etabliert [20, 31, 50].
Pathogenese
Im Jahr 2015 wurden Mycoplasma-pneumoniae-assoziierte mukokutane blasenbildende Erkrankungen erstmals als eigene klinische Entität eingeordnet [7]. Zuvor wurden die verschiedenen Erscheinungsbilder der Haut‑/Schleimhauteffloreszenzen im Rahmen einer Mycoplasma-pneumoniae-Infektion der Gruppe von Erythema multiforme, Stevens-Johnson-Syndrom (SJS) und toxisch epidermaler Nekrolyse (TEN) zugeordnet [7, 45, 52].
Knapp 10 % der Pneumonien insbesondere bei Kindern ab 5 Jahren werden durch Mycoplasma pneumoniae verursacht, ebenso sind junge Erwachsene häufig betroffen. Bei Kindern kommt es gemäß einer aktuellen Studie in 22,7 % zur Beteiligung der Haut und Schleimhäute. MIRM/RIME wurde bei 7 % der Patienten beschrieben, wobei das männliche Geschlecht häufiger betroffen ist [7, 34]. Prädisponierende Faktoren für das Auftreten von RIME bei Mycoplasma-pneumoniae-Infektion sind respiratorische Symptome wie Pneumonie und Husten, Fieber sowie erhöhte Entzündungswerte (Blutkörperchensenkungsgeschwindigkeit [BSG] und C‑reaktives Protein [CRP]) [34, 36].
Die Pathogenese der RIME ist bislang nicht eindeutig belegt, jedoch werden direkte und indirekte Mechanismen vermutet. Mycoplasma pneumoniae konnte in Blasenflüssigkeit der Hauteffloreszenzen nachgewiesen werden [29, 32]. Weitere Theorien gehen davon aus, dass Immunkomplexe in Haut und Schleimhaut das Komplementsystem aktivieren [54] oder es zu einer Aktivierung von B‑Zellen und Plasmazellen kommt, welche die Immunantwort modifizieren [48]. Genetische Faktoren spielen ebenso eine Rolle [49].
Klinik und Diagnostik
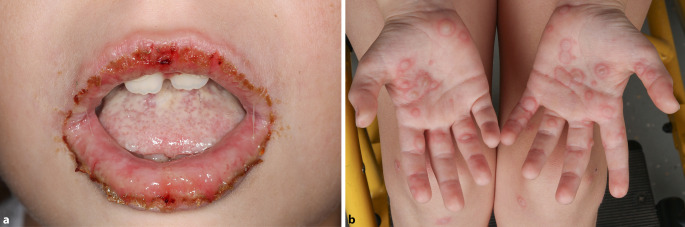
Mukokutane Manifestationen einer Mycoplasma-pneumoniae-Infektion zeigen ein sehr vielgestaltiges Bild mit teils alleiniger Schleimhautbeteiligung oder hauptsächlicher Schleimhautbeteiligung mit nur diskreter/moderater Hautbeteiligung [7]. In 94–100 % der Fälle sind die enoralen Schleimhäute betroffen (Abb. 2a), die okkulären Schleimhäute in 82–92 %, die urogenitalen in 63–78 % der Patienten [7]. Auch eine Beteiligung der analen und ösophagealen Schleimhäute ist beschrieben [41]. Hauteffloreszenzen sind selten (47 %) oder gar nicht (34 %) vorhanden [7, 9]. Schwere Komplikationen können eine intensivmedizinische Behandlung erforderlich machen [7].
Die Hautbeteiligung kann in Form von targetoiden, vesikulösen oder makulösen Hauteffloreszenzen auftreten (Abb. 2b). Um RIME gegenüber einem Herpes-assoziierten Erythema multiforme oder einem medikamenteninduzierten Stevens-Johnson-Syndrom/TEN abgrenzen zu können, helfen bestimmte Kriterien wie junges Alter der Patienten, prominente Schleimhautbeteiligung, meist nur dezente Hautbeteiligung und eine sehr gute Prognose [7].
Auch rezidivierende Verläufe von RIME sind beschrieben worden. In einer retrospektiven Fallserie zeigten sich Rezidive von Mykoplasmen-assoziierten RIME in 38 % der Fälle. Initial zeigten sich bei den von Rezidiven betroffenen Patienten eine stärkere Haut- und Schleimhautbeteiligung sowie eine längere Hospitalisierung und häufiger die Notwendigkeit einer parenteralen Ernährung. Die Rezidive hingegen gingen mit einer weniger schwerwiegenden Haut- und Schleimhautbeteiligung einher. Nichtsdestotrotz führten diese teilweise auch zu Hospitalisierungen und verlängertem Krankheitsverlauf. Zwischen den Rezidiven lagen Zeitspannen von 2 Monaten bis zu 2 Jahren [28]. Ferner sind auch bei viral induzierten RIME Rezidive beschrieben, unter anderem 2 Fallberichte, in denen die initialen Episoden am ehesten durch Mycoplasma pneumoniae getriggert und die Rezidive teils durch Viren wie Influenza A und SARS-CoV‑2 ausgelöst wurden [50].
Die Hautbeteiligung kann in Form von targetoiden, vesikulösen oder makulösen Hauteffloreszenzen auftreten
Bei klinischem Verdacht auf RIME werden Routinelaboruntersuchungen durchgeführt inklusive Entzündungswerte (CRP, BSG) sowie Abstriche auf Mykoplasmen, Chlamydien und eine Herpes simplex-Polymerasekettenreaktion (PCR) sowie eine Mykoplasmenserologie und Röntgenaufnahmen des Thorax [41]. Eine Hautprobe kann helfen, blasenbildende Autoimmundermatosen auszuschließen. Differenzialdiagnostisch kommen Kawasaki-Syndrom, medikamenteninduzierte epidermale Nekrolyse (DEN), Pemphigus vulgaris und Hand-Fuß-Mund-Erkrankung in Betracht [41].
Therapie
Patienten mit RIME sollten eine multimodale Therapie erhalten und insbesondere bei Beteiligung der okulären Schleimhäute von einem Augenarzt interdisziplinär mitbetreut werden. Bei Konjunktivitis können antibiotische Augentropfen Linderung bringen, um eine augenärztliche operative Intervention zu verhindern [47]. Bei manifester Mycoplasma-pneumoniae-Pneumonie sollte eine antibiotische Therapie erfolgen, primär mit Makroliden, bei Makrolidresistenz kann auf Tetracycline oder Fluorchinolone zurückgegriffen werden [53]. Zuzüglich zur antibiotischen Therapie hat sich eine systemische Steroidtherapie mit Methylprednisolon als effektiv erwiesen, bezüglich der Dosis liegen noch keine klaren Empfehlungen vor. Ebenso wurden Immunglobuline ggf. in Kombination mit Steroiden erfolgreich appliziert [33, 44]. Als weitere Therapieoptionen werden Ciclosporin und Infliximab beschrieben [9, 27]. Da RIME als eigene Entität ein sehr junges Krankheitsbild darstellt, fehlt es bislang noch an größeren Studien hinsichtlich des Verlaufs und der bestmöglichen Therapie.
Hand-Fuß-Mund-Erkrankung
Die Hand-Fuß-Mund-Erkrankung (HFME) ist gegenüber RIME abzugrenzen. Es handelt sich dabei um eine hochkontagiöse Exanthemerkrankung mit einem monomorphen Exanthem, das an den Akren sowie enoral lokalisiert ist und seinen Häufigkeitsgipfel im Sommer und Herbst hat. Die Hand-Fuß-Mund-Erkrankung ist das am besten bekannte enterovirale Exanthem.
Pathogenese
Auslöser der klassischen Hand-Fuß-Mund-Erkrankung ist Coxsackie-Virus A16, seltener sind A5, A6, A7, A9, A10, B1, B2, B3, B5 und Enterovirus 71 verantwortlich [38]. Die Coxsackie/Enteroviren sind eine Untergruppe der Picornaviridae. Enteroviren sind Auslöser verschiedenster Erkrankungen, insbesondere bei Neugeborenen und Kleinkindern können sie zu Gastroenteritis, Infektionen des oberen Atemtrakts, hämorrhagischer Konjunktivitis, Myositis, Myokarditis/Perikarditis, Enzephalitis und Meningitis führen [18, 38]. Die meisten Infektionen durch Enteroviren zeigen hingegen einen milden Verlauf. Klassisch für die Hand-Fuß-Mund-Erkrankung ist das plötzliche Auftreten von Fieber sowie einem charakteristischen Exanthem und Enanthem. Die Übertragung erfolgt fäkal-oral, selten auch über Schwimmbäder.
Klinik und Diagnostik
Nach einem Prodromalstadium von 2 bis 4 Tagen mit Fieber und Unwohlsein kommt es klassischerweise zum Auftreten eines distinkten Exanthems mit gräulich-weißen Vesikulae mit erythematösem Randsaum palmoplantar sowie dorsal und lateral der Finger und Zehen. Enoral zeigen sich aphthöse, schmerzhafte Läsionen, die aufgrund von Verweigerung der Nahrungsaufnahme zu Dehydratation und Gewichtsverlust führen können. In einigen Fällen (inkomplette Formen) sind nicht alle Areale betroffen, gelegentlich sind hingegen auch andere Körperareale als die klassischen betroffen [18]. Weitere makulopapulöse Effloreszenzen können an Gesäß, Oberschenkeln sowie am externen Genitale zu finden sein [38]. Rund 4 Wochen nach überstandener HFME kann es zu Nagelwachstumsstörungen sowie zum Ablösen der Nägel kommen, die im Verlauf physiologisch nachwachsen [38].
Die atypische HFME, meist ausgelöst durch Coxsackie-Virus A6, tritt häufig in Arealen von Entzündungen, vorangegangenen Verletzungen oder Traumata sowie Tinea oder Ichthyose auf [30]. Bei Kindern mit atopischem Ekzem treten die Hauteffloreszenzen v. a. in den von Ekzemen betroffenen Arealen auf und werden daher als Eczema coxsackium bezeichnet (Abb. 3; [38]). Mitunter kann die Abgrenzung zum Eczema herpeticatum eine Herausforderung darstellen.
Kürzlich ist zudem eine Incontinentia pigmenti coxsackium beschrieben worden. In diesem Fall triggert die Coxsackie-Virus-Infektion die Reaktivierung einer vorbekannten Incontinentia pigmenti, wobei die Effloreszenzen der atypischen Hand-Fuß-Mund-Erkrankung in den zuvor von vesikulösen, Incontinentia-pigmenti-Effloreszenzen betroffenen Arealen auftreten [24]. Als ursächlich werden Barrierestörungen sowie eine beeinträchtigte Immunantwort vermutet [26]. Die HFME ist eine klinische Diagnose, diese kann per Abstrich aus einer Vesikula und Virusnachweis per PCR abgesichert werden. Der Nachweis ist auch aus nasopharyngealem Sekret, Blut oder Liquor möglich [19].
Therapie
Die Therapie erfolgt symptomatisch. Anästhesierende Mundspüllösungen können Linderung bei schmerzhaften enoralen Läsionen bringen. Zur Prophylaxe sind eine gute Händehygiene sowie das Meiden des Kontakts mit Infizierten oder den von ihnen benutzten Gegenständen zu empfehlen. In den meisten Fällen nimmt die HFME einen unkomplizierten Verlauf. Jedoch haben Epidemien des Enterovirus 71 in Asien gezeigt, dass auch schwere bis tödliche Verläufe bei Kindern unter 5 Jahren mit Lungenödem und pulmonalen Blutungen vorkommen können [38].
„Pediatric inflammatory multisystem syndrome“/„multisystem inflammatory syndrome in children“
Das erst kürzlich beschriebene Hyperinflammationssyndrom „pediatric inflammatory multisystem syndrome“ (PIMS), auch unter „multisystem inflammatory syndrome in children“ (MIS-C) bekannt, ist eine Multisystemerkrankung, die meist ca. 2 bis 6 Wochen nach einer stattgehabten COVID-Erkrankung (positive SARS-CoV-2-Serologie) auftritt [4]. Aufgrund der oft sehr variablen klinischen Präsentation können die Diagnose und insbesondere die Abgrenzung zum Kawasaki-Syndrom eine Herausforderung darstellen. Bei Kindern beträgt die Wahrscheinlichkeit für die Entwicklung eines PIMS nach COVID-Infektion 0,14 % [37].
Pathogenese
Die Pathogenese ist noch nicht vollständig geklärt, es existieren jedoch verschiedene Hypothesen. Insgesamt wird von einer überschießenden Immunreaktion ausgegangen. Die Antibody-dependent-enhancement-Hypothese besagt, dass es durch die Bindung von Antikörpern an das SARS-CoV-2-Spike-Protein zu einer vermehrten Aufnahme des Antigen-Antikörper-Komplexes in die Zellen kommt, wodurch die Virusreplikation gesteigert wird [8, 14]. Ferner kann das SARS-CoV-2-Virus Autoantikörper aktivieren, die Interferon I und III blockieren, was in einer verzögerten Interferonantwort resultiert und somit zu einer protrahierten Viruselimination mit überschießender Zytokinfreisetzung führt [39, 42].
Klinik und Diagnostik
PIMS kann mit verschiedensten Symptomen abhängig vom betroffenen Organsystem einhergehen. In praktisch allen Fällen tritt Fieber auf, daher sollte bei Fieber unklarer Genese differenzialdiagnostisch immer ein PIMS in Betracht gezogen werden. Mehr als zwei Drittel der Kinder leiden unter gastrointestinalen Beschwerden wie Bauchschmerzen und Erbrechen, häufig treten ebenso kardiovaskuläre, respiratorische, neurologische, nephrologische sowie muskuloskeletale Beschwerden auf [15, 40]. Bei rund der Hälfte der Kinder zeigt sich ein Befall von Haut- und Schleimhäuten mit einem makulopapulösen Exanthem, einer Cheilitis sowie einer nicht exsudativen Konjunktivitis [1]. In einzelnen Fallberichten wurden weitere Hautmanifestationen beschrieben. So zeigte sich bei Patienten mit PIMS ebenso eine Purpura im Rahmen einer Ig(Immunglobulin)A-Vaskulitis [16], und in einem weiteren Fall wurden lokalisierte Hautexantheme im Genitalbereich und an den Füßen beschrieben [43].
Die Weltgesundheitsorganisation (WHO) definiert folgende Kriterien für die Diagnose eines PIMS [23]:
Alter jünger als 19 Jahre und Fieber über 48 h
und mindestens 2 der folgenden Kriterien:
Hautbeteiligung im Sinne eines Exanthems oder Entzündung der Haut- und Schleimhäute, nichtpurulente Konjunktivitis,
arterielle Hypotension/Schock,
myokardiale Dysfunktion, Perikarditis, Valvulitis oder Koronarpathologien (einschließlich echokardiographischer Zeichen oder erhöhtes Troponin/NT-proBNP),
Vorliegen einer Koagulopathie (Prothrombinzeit [PT], partielle Thromboplastinzeit [PTT], D‑Dimere-Erhöhung),
akute gastrointestinale Probleme (Durchfall, Erbrechen, Bauchschmerzen)
und
erhöhte Inflammationsparameter (CRP, Procalcitonin [PCT], BSG),
ohne das Vorliegen einer anderen eindeutigen Ätiologie, z. B. bakterielle Sepsis, Staphylokokken- oder Streptokokken-Toxic-Schock-Syndrom sowie Kawasaki (‑like) Syndrom oder Toxic-Schock (‑like) Syndrom
und
Evidenz einer COVID-19-Erkrankung (RT[reverse Transkriptase]-PCR, Antigentest, Serologie positiv) oder wahrscheinlicher Kontakt mit einem COVID-19-Fall
(übernommen aus [23]).
In einer aktuellen retrospektiven Studie mit einer kleinen Fallzahl war die Mehrzahl der an PIMS erkrankten Patienten übergewichtig bis adipös [4]. Es wird angenommen, dass Übergewicht für die Entwicklung eines PIMS prädisponiert [1]. Zudem wird PIMS gehäuft bei älteren Kindern, im Mittel 9 Jahren, und weniger bei Säuglingen und Kleinkindern beobachtet [13].
Die Abgrenzung zwischen PIMS und einem Kawasaki-Syndrom stellt eine klinische Herausforderung dar. Es haben sich jedoch einige Kriterien herausgebildet, welche die Unterscheidung erleichtern können. Kinder mit einem PIMS sprechen schlechter auf die Gabe von Immunglobulinen an. Sie sind meist älter und zeigen häufiger eine kardiale Beteiligung in Form einer Myokarditis und eine gastrointestinale Beteiligung. Laborchemisch liegt bei PIMS eine Thrombopenie und keine Thrombozytose wie beim Kawasaki-Syndrom vor [55].
Aufgrund der Nähe zum Kawasaki-Syndrom hat sich ebenso eine Einteilung von PIMS mit Bezugnahme auf das Kawasaki-Syndrom etabliert. So erfolgt die Einordnung in ein SARS-CoV-2-non-Kawasaki-PIMS (PIMS-Kriterien erfüllt und ≤ 1 Kawasaki-Symptom), SARS-CoV-2-PIMS und Kawasaki-Syndrom (PIMS Kriterien erfüllt und 2 bis 5 Kawasaki-Symptome), SARS-CoV-2-Kawasaki-Syndrom (PIMS-Kriterien nicht erfüllt, aber 2 bis 5 Kawasaki-Symptome zuzüglich eines positiven SARS-CoV-2-Nachweises) [22].
Bei Auftreten von PIMS ist die SARS-CoV-2-PCR meist bereits negativ und die Serologie positiv für SARS-CoV-2-Antikörper. Im Routinelabor zeigen sich die Entzündungsparameter (CRP, BSG, Ferritin) stark erhöht sowie eine Lymphopenie und Thrombozytopenie, ebenso erhöhte D‑Dimere [43, 56]. Bei Vorliegen einer kardialen Beteiligung können das nt-proBNP sowie Troponin erhöht sein.
Therapie
Derzeit existieren keine Leitlinien zur Behandlung von PIMS, die Empfehlungen basieren auf Expertenmeinungen und kleineren Fallkohorten. Konsens besteht über die Wichtigkeit einer interdisziplinären Betreuung der Patienten. Je nach klinischem Bild kommen intravenöse Immunglobuline – ggf. in Kombination mit systemischen Steroiden – sowie Aspirin zur Anwendung [21]. Bei Therapieresistenz sollten zuzüglich zur Weiterführung des Steroids der IL(Interleukin)-1-Rezeptorantagonist Anakinra und der IL-6-Rezeptorantagonist Tocilizumab erwogen werden [23, 46].
Fazit für die Praxis
Virale und paravirale Exantheme sind die häufigsten Exantheme des Kindesalters.
Die korrekte Einordnung der Symptome ist entscheidend für die adäquate Betreuung, das Vermeiden von Komplikationen und ggf. das Minimieren des Infektionsrisikos.
Die sog. „Gianotti-Crosti-like-reaction“ kann in Assoziation mit Mollusca contagiosa auftreten.
Die „reactive infectious mucocutaneous eruptions“ (RIME) umfassen EEM(Erythema exsudativum multiforme)-artige Erkrankungen der Haut- und der Schleimhäute, die häufig durch Mycoplasma pneumoniae, aber auch paraviral verursacht werden können.
Bei der atypischen Hand-Fuß-Mund-Erkrankung, auch als Eczema coxsackium bekannt, treten bei Atopikern in Bereichen vorheriger Ekzeme Papulovesikeln auf, die an ein Eczema herpeticatum erinnern (Eczema coxsackium).
PIMS („pediatric inflammatory multisystem syndrome“) ist eine seltene und schwerwiegende Multisystemerkrankung, die bei Kindern und Jugendlichen 2 bis 6 Wochen nach einer COVID-Infektion auftreten kann. Die Erkrankung ähnelt mit einem tagelang anhaltenden Fieber dem Kawasaki-Syndrom, und etwa 50 % der Patienten zeigen eine Haut- und/oder Schleimhautbeteiligung.
Einhaltung ethischer Richtlinien
Interessenkonflikt
J.E. Fromme, I. Tantcheva-Poór und R. Fölster-Holst geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien. Für Bildmaterial oder anderweitige Angaben innerhalb des Manuskripts, über die Patienten zu identifizieren sind, liegt von ihnen und/oder ihren gesetzlichen Vertretern eine schriftliche Einwilligung vor.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Ahmed M, Advani S, Moreira A, et al. Multisystem inflammatory syndrome in children: a systematic review. EClinicalMedicine. 2020;26:100527. doi: 10.1016/j.eclinm.2020.100527. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Baek YS, Oh CH, Song HJ, et al. Asymmetrical periflexural exanthem of childhood with concurrence of molluscum contagiosum infection. Clin Exp Dermatol. 2011;36:676–677. doi: 10.1111/j.1365-2230.2011.04049.x. [DOI] [PubMed] [Google Scholar]
- 3.Berger EM, Orlow SJ, Patel RR, et al. Experience with molluscum contagiosum and associated inflammatory reactions in a pediatric dermatology practice: the bump that rashes. Arch Dermatol. 2012;148:1257–1264. doi: 10.1001/archdermatol.2012.2414. [DOI] [PubMed] [Google Scholar]
- 4.Boeckelmann M, Glaser N, Dejas F, et al. „Pediatric inflammatory multisystem syndrome“-experiences from a Berlin children’s hospital. Monatsschr Kinderheilkd. 2022;170:139–145. doi: 10.1007/s00112-021-01394-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Bowers S, Warshaw EM. Pityriasis lichenoides and its subtypes. J Am Acad Dermatol. 2006;55:557–572. doi: 10.1016/j.jaad.2005.07.058. [DOI] [PubMed] [Google Scholar]
- 6.Bürgler C, Weibel L, Schwieger-Briel A, et al. Gianotti-Crosti syndrome-like reaction to molluscum contagiosum-clinical characteristics and response to treatment. J Dtsch Dermatol Ges. 2021;19:1746–1751. doi: 10.1111/ddg.14608. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Canavan TN, Mathes EF, Frieden I, et al. Mycoplasma pneumoniae-induced rash and mucositis as a syndrome distinct from Stevens-Johnson syndrome and erythema multiforme: a systematic review. J Am Acad Dermatol. 2015;72:239–245. doi: 10.1016/j.jaad.2014.06.026. [DOI] [PubMed] [Google Scholar]
- 8.Carter MJ, Shankar-Hari M, Tibby SM. Paediatric inflammatory multisystem syndrome temporally-associated with SARS-coV-2 infection: an overview. Intensive Care Med. 2021;47:90–93. doi: 10.1007/s00134-020-06273-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Chafranska L, Saunte DM, Behrendt N, et al. Pediatric toxic epidermal necrolysis treated successfully with infliximab. Pediatr Dermatol. 2019;36:342–345. doi: 10.1111/pde.13778. [DOI] [PubMed] [Google Scholar]
- 10.Chuh A. A Herald patch almost encircling the trunk-extreme pityriasis rosea gigantea in a young child. Pediatr Dermatol. 2016;33:e286–287. doi: 10.1111/pde.12923. [DOI] [PubMed] [Google Scholar]
- 11.Chuh A, Zawar V, Lee A, et al. Is Gianotti-Crosti syndrome associated with atopy? A case-control study and a postulation on the intrinsic host factors in Gianotti-Crosti syndrome. Pediatr Dermatol. 2016;33:488–492. doi: 10.1111/pde.12886. [DOI] [PubMed] [Google Scholar]
- 12.Chuh AA, Chan HH. Unilateral mediothoracic exanthem: a variant of unilateral laterothoracic exanthem. Cutis. 2006;77:29–32. [PubMed] [Google Scholar]
- 13.Ding Y, Yan H, Guo W. Clinical characteristics of children with COVID-19: a meta-analysis. Front Pediatr. 2020;8:431. doi: 10.3389/fped.2020.00431. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Dolhnikoff M, Ferreira Ferranti J, de Almeida Monteiro RA, et al. SARS-CoV-2 in cardiac tissue of a child with COVID-19-related multisystem inflammatory syndrome. Lancet Child Adolesc Health. 2020;4:790–794. doi: 10.1016/S2352-4642(20)30257-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Feldstein LR, Rose EB, Horwitz SM, et al. Multisystem inflammatory syndrome in U.S. children and adolescents. N Engl J Med. 2020;383:334–346. doi: 10.1056/NEJMoa2021680. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Felsenstein S, Willis E, Lythgoe H, et al. Presentation, treatment response and short-term outcomes in paediatric multisystem inflammatory syndrome temporally associated with SARS-coV-2 (PIMS-TS) J Clin Med. 2020;9(10):3293. doi: 10.3390/jcm9103293. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Fölster-Holst R. Infectious exanthemas in childhood. J Dtsch Dermatol Ges. 2020;18:1128–1155. doi: 10.1111/ddg.14301. [DOI] [PubMed] [Google Scholar]
- 18.Fölster-Holst R, Kreth HW. Viral exanthems in childhood—infectious (direct) exanthems. Part 1: classic exanthems. J Dtsch Dermatol Ges. 2009;7:309–316. doi: 10.1111/j.1610-0387.2008.06868.x. [DOI] [PubMed] [Google Scholar]
- 19.Fölster-Holst R, Kreth HW. Viral exanthems in childhood—infectious (direct) exanthems. Part 2: other viral exanthems. J Dtsch Dermatol Ges. 2009;7:414–419. doi: 10.1111/j.1610-0387.2008.06869.x. [DOI] [PubMed] [Google Scholar]
- 20.Goyal A, Hook K. Two pediatric cases of influenza B-induced rash and mucositis: Stevens-Johnson syndrome or expansion of the mycoplasma pneumoniae-induced rash with mucositis (MIRM) spectrum? Pediatr Dermatol. 2019;36:929–931. doi: 10.1111/pde.13921. [DOI] [PubMed] [Google Scholar]
- 21.Harwood R, Allin B, Jones CE, et al. A national consensus management pathway for paediatric inflammatory multisystem syndrome temporally associated with COVID-19 (PIMS-TS): results of a national Delphi process. Lancet Child Adolesc Health. 2021;5:133–141. doi: 10.1016/S2352-4642(20)30304-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Deutsche Gesellschaft für pädiatrische Infektiologie (2022) PIMS-Survey_Update. https://dgpi.de/pims-survey-update/. Zugegriffen: 03.04.2022
- 23.Deutsche Gesellschaft für pädiatrische Infektiologie (2020) Stellungnahme der DGPI, GPP, API, GKJR, DGPK und STAKOB zur klinischen Präsentation und zur medikamentösen Behandlung von Kindern mit COVID-19. https://dgpi.de/stellungnahmemedikamentoesen-behandlung-kindern-covid19/. Zugegriffen: 14.02.2022
- 24.Jefferson J, Grossberg A. Incontinentia pigmenti coxsackium. Pediatr Dermatol. 2016;33:e280–281. doi: 10.1111/pde.12926. [DOI] [PubMed] [Google Scholar]
- 25.Khachemoune A, Blyumin ML. Pityriasis lichenoides: pathophysiology, classification, and treatment. Am J Clin Dermatol. 2007;8:29–36. doi: 10.2165/00128071-200708010-00004. [DOI] [PubMed] [Google Scholar]
- 26.Lewis S, Rico T. Coxsackie eruption arising in areas of epidermolytic ichthyosis. Pediatr Dermatol. 2015;32:e132–133. doi: 10.1111/pde.12562. [DOI] [PubMed] [Google Scholar]
- 27.Li HO, Colantonio S, Ramien ML. Treatment of mycoplasma pneumoniae-induced rash and mucositis with cyclosporine [formula: see text] J Cutan Med Surg. 2019;23:608–612. doi: 10.1177/1203475419874444. [DOI] [PubMed] [Google Scholar]
- 28.Liakos W, Xu A, Finelt N. Clinical features of recurrent mycoplasma pneumoniae-induced rash and mucositis. Pediatr Dermatol. 2021;38:154–158. doi: 10.1111/pde.14472. [DOI] [PubMed] [Google Scholar]
- 29.Lyell A, Gordon AM, Dick HM, et al. Mycoplasmas and erythema multiforme. Lancet. 1967;2:1116–1118. doi: 10.1016/S0140-6736(67)90620-4. [DOI] [PubMed] [Google Scholar]
- 30.Mathes EF, Oza V, Frieden IJ, et al. „Eczema coxsackium“ and unusual cutaneous findings in an enterovirus outbreak. Pediatrics. 2013;132:e149–157. doi: 10.1542/peds.2012-3175. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Mazori DR, Nagarajan S, Glick SA. Recurrent reactive infectious mucocutaneous eruption (RIME): insights from a child with three episodes. Pediatr Dermatol. 2020;37:545–547. doi: 10.1111/pde.14142. [DOI] [PubMed] [Google Scholar]
- 32.Meseguer MA, de Rafael L, Vidal ML. Stevens-Johnson syndrome with isolation of mycoplasma pneumoniae from skin lesions. Eur. J, Clin. Microbiol. 1986;5:167–168. doi: 10.1007/BF02013977. [DOI] [PubMed] [Google Scholar]
- 33.Meyer Sauteur PM, Goetschel P, Lautenschlager S. Mycoplasma pneumoniae and mucositis—part of the Stevens-Johnson syndrome spectrum. J Dtsch Dermatol Ges. 2012;10:740–746. doi: 10.1111/j.1610-0387.2012.07951.x. [DOI] [PubMed] [Google Scholar]
- 34.Meyer Sauteur PM, Theiler M, Buettcher M, et al. Frequency and clinical presentation of mucocutaneous disease due to mycoplasma pneumoniae infection in children with community-acquired pneumonia. JAMA Dermatol. 2020;156:144–150. doi: 10.1001/jamadermatol.2019.3602. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Netchiporouk E, Cohen BA. Recognizing and managing eczematous id reactions to molluscum contagiosum virus in children. Pediatrics. 2012;129:e1072–1075. doi: 10.1542/peds.2011-1054. [DOI] [PubMed] [Google Scholar]
- 36.Olson D, Watkins LK, Demirjian A, et al. Outbreak of mycoplasma pneumoniae-associated Stevens-Johnson syndrome. Pediatrics. 2015;136:e386–394. doi: 10.1542/peds.2015-0278. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Ouldali N, Toubiana J, Antona D, et al. Association of intravenous immunoglobulins plus methylprednisolone vs immunoglobulins alone with course of fever in multisystem inflammatory syndrome in children. JAMA. 2021;325:855–864. doi: 10.1001/jama.2021.0694. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Paller A, Mancini A. Clinical pediatric dermatology. St. Louis, Missouri: Elsevier; 2022. [Google Scholar]
- 39.Park A, Iwasaki A. Type I and type III interferons—induction, signaling, evasion, and application to combat COVID-19. Cell Host Microbe. 2020;27:870–878. doi: 10.1016/j.chom.2020.05.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Rafferty MS, Burrows H, Joseph JP, et al. Multisystem inflammatory syndrome in children (MIS-C) and the coronavirus pandemic: current knowledge and implications for public health. J Infect Public Health. 2021;14:484–494. doi: 10.1016/j.jiph.2021.01.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Ramien ML. Reactive infectious mucocutaneous eruption: mycoplasma pneumoniae-induced rash and mucositis and other parainfectious eruptions. Clin Exp Dermatol. 2021;46:420–429. doi: 10.1111/ced.14404. [DOI] [PubMed] [Google Scholar]
- 42.Rowley AH. Understanding SARS-CoV-2-related multisystem inflammatory syndrome in children. Nat Rev Immunol. 2020;20:453–454. doi: 10.1038/s41577-020-0367-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Saez-De-Ocariz M, Gámez-González LB, Rivas-Larrauri F, et al. Kawasaki disease mimickers. Pediatr Int. 2021;63:880–888. doi: 10.1111/ped.14561. [DOI] [PubMed] [Google Scholar]
- 44.Santos RP, Silva M, Vieira AP, et al. Mycoplasma pneumoniae-induced rash and mucositis: a recently described entity. BMJ Case Rep. 2017;2017:bcr2017220768. doi: 10.1136/bcr-2017-220768. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Schalock PC, Dinulos JG. „Atypical“ Stevens-Johnson syndrome? Pediatrics. 2007;120:451–452. doi: 10.1542/peds.2007-1072. [DOI] [PubMed] [Google Scholar]
- 46.Schlapbach LJ, Andre MC, Grazioli S, et al. Best practice recommendations for the diagnosis and management of children with pediatric inflammatory multisystem syndrome temporally associated with SARS-coV-2 (PIMS-TS; multisystem inflammatory syndrome in children, MIS-C) in Switzerland. Front Pediatr. 2021;9:667507. doi: 10.3389/fped.2021.667507. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Shah PR, Williams AM, Pihlblad MS, et al. Ophthalmic manifestations of mycoplasma-induced rash and mucositis. Cornea. 2019;38:1305–1308. doi: 10.1097/ICO.0000000000001985. [DOI] [PubMed] [Google Scholar]
- 48.Simecka JW, Ross SE, Cassell GH, et al. Interactions of mycoplasmas with B cells: antibody production and nonspecific effects. Clin Infect Dis. 1993;17(1):S176–182. doi: 10.1093/clinids/17.Supplement_1.S176. [DOI] [PubMed] [Google Scholar]
- 49.Smith CC, Umapathy D. Erythema multiforme in a mother and daughter after M. pneumoniae infection; a coincidence? Br J Dermatol. 1987;117:533–534. doi: 10.1111/j.1365-2133.1987.tb04939.x. [DOI] [PubMed] [Google Scholar]
- 50.Song A, Nicholson C, Maguiness S. Recurrent reactive infectious mucocutaneous eruption (RIME) in two adolescents triggered by several distinct pathogens including SARS-CoV-2 and influenza A. Pediatr Dermatol. 2021;38:1222–1225. doi: 10.1111/pde.14780. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Valkova S, Trashlieva M, Christova P. UVB phototherapy for pityriasis rosea. J Eur Acad Dermatol Venereol. 2004;18:111–112. doi: 10.1111/j.1468-3083.2004.00803.x. [DOI] [PubMed] [Google Scholar]
- 52.Vanfleteren I, Van Gysel D, De Brandt C. Stevens-Johnson syndrome: a diagnostic challenge in the absence of skin lesions. Pediatr Dermatol. 2003;20:52–56. doi: 10.1046/j.1525-1470.2003.03012.x. [DOI] [PubMed] [Google Scholar]
- 53.Waites KB, Xiao L, Liu Y, et al. Mycoplasma pneumoniae from the respiratory tract and beyond. Clin Microbiol Rev. 2017;30:747–809. doi: 10.1128/CMR.00114-16. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Washburn LR, Cole BC, Gelman MI, et al. Chronic arthritis of rabbits induced by mycoplasmas. I. Clinical microbiologic, and histologic features. Arthritis Rheum. 1980;23:825–836. doi: 10.1002/art.1780230709. [DOI] [PubMed] [Google Scholar]
- 55.Weiss SL, Peters MJ, Alhazzani W, et al. Surviving sepsis campaign international guidelines for the management of septic shock and sepsis-associated organ dysfunction in children. Pediatr Crit Care Med. 2020;21:e52–e106. doi: 10.1097/PCC.0000000000002198. [DOI] [PubMed] [Google Scholar]
- 56.Whittaker E, Bamford A, Kenny J, et al. Clinical characteristics of 58 children with a pediatric inflammatory multisystem syndrome temporally associated with SARS-coV-2. JAMA. 2020;324:259–269. doi: 10.1001/jama.2020.10369. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Zawar V, Chuh A. Follicular pityriasis rosea. A case report and a new classification of clinical variants of the disease. J Dermatol Case Rep. 2012;6:36–39. doi: 10.3315/jdcr.2012.1095. [DOI] [PMC free article] [PubMed] [Google Scholar]