Abstract
Todos los coronavirus, incluido el SARS-CoV-2, codifican dos proteasas necesarias para el procesado de las poliproteínas pp1a y pp1ab. La proteasa principal 3CL (quimiotripsina-like) da lugar a la formación de las proteínas nsp11/16. La proteasa 3CL se ha constituido como una de las posibles dianas terapéuticas para el desarrollo de fármacos antivirales frente al SARS-CoV-2 debido a su secuencia y estructura altamente conservada entre todos los coronavirus. Durante la pandemia del SARS-CoV-1 se identificó un derivado hidroximetilcetona (PF-00835231) con una intensa actividad inhibidora frente a la proteasa 3CL. Las modificaciones químicas posteriores dieron lugar al derivado PF-07321332 (nirmatrelvir) que ha mostrado una elevada eficacia antiviral frente al SARS-CoV-2. Los datos de la compañía indican que es capaz de reducir un 89% el riesgo de hospitalización y fallecimiento de los pacientes infectados con apenas efectos adversos. Su eficacia mejora si se administra por vía oral en las primeras 24-48 horas y la duración del tratamiento se ha establecido entre 3-5 días. La forma comercial lleva asociada el antiviral ritonavir que ha mostrado enlentecer el metabolismo de nirmatrelvir, alargando su vida media. Este antiviral sería eficaz frente a las actuales y futuras variantes virales, ya que la 3CL no se modifica en ellas. La FDA aprobó este antiviral en noviembre de 2021 y la EMA está en fase de evaluación final.
Keywords: SARS-CoV-2, PF-07321332, Nirmatrelvir, PaxlovidTM, antiviral
Abstract
All coronavirus, including SARS-CoV-2, encode two pro-teases needed for the processing of PP1A and PP1AB polyproteins. The main protease 3CL (chemotripsine-like) gives rise to the formation of NSP11/16 proteins. The 3CL protease has been constituted as one of the possible therapeutic targets for the development of antiviral drugs against SARS-COV-2 due to its highly conserved sequence and structure among all coronaviruses. During the SARS-COV-1 pandemic, a hydroxymethyl ke-tone derivative (PF-00835231) was identified with an intense inhibitory activity against the 3CL protease. Subsequent chemical modifications gave rise to derivative PF-07321332 (nirmatrelvir) which has shown a high antiviral efficacy against SARS-COV-2. The company’s data indicate that it is capable of reducing 89% the risk of hospitalization and death of patients infected with hardly adverse effects. Its effectiveness improves if it is administered orally in the first 24-48 hours and the duration of treatment has been established between 3-5 days. The commercial form has been associated with the antiviral ritonavir that has shown the metabolism of nirmatrelvir, lengthening its average life. This antiviral would be effective against current and future viral variants, since 3CL is not modified in them. The FDA approved this antiviral in November 2021 and EMA is in the final evaluation phase.
Keywords: SARS-CoV-2, PF-07321332, Nirmatrelvir, PaxlovidTM, antiviral
INTRODUCCIÓN
Tras la emergencia y pandemia del SARS-CoV-2 se estableció la necesidad urgente de desarrollar fármacos antivirales específicos frente al mismo y plataformas vacunales de elevada eficacia. En estos momentos las vacunas han ganado la batalla frente a los antivirales, sin embargo éstos últimos serán una herramienta esencial en el control de la pandemia [1,2]. Los últimos datos comunicados por el directorio ClinicalTrials.gov muestran la existencia de 4.371 estudios basados en múltiples antivirales frente al SARS-CoV-2 [3]. A pesar de ello, sólo algunos ya han alcanzado la fase clínica final como molnupiravir (LagevrioTM), un análogo ribonucleósido de la citidina [4], auto-rizado por la Agencia Europea del Medicamente en noviembre de 2021 [5], y alguno de los derivados de la hidroximetilcetona, como nirmatrelvir (PF-07321332), que ha obtenido recientemente una autorización de emergencia por esta misma agencia (16 de diciembre de 2021) [6].
EL SARS-COV-2 Y LAS PROTEASAS
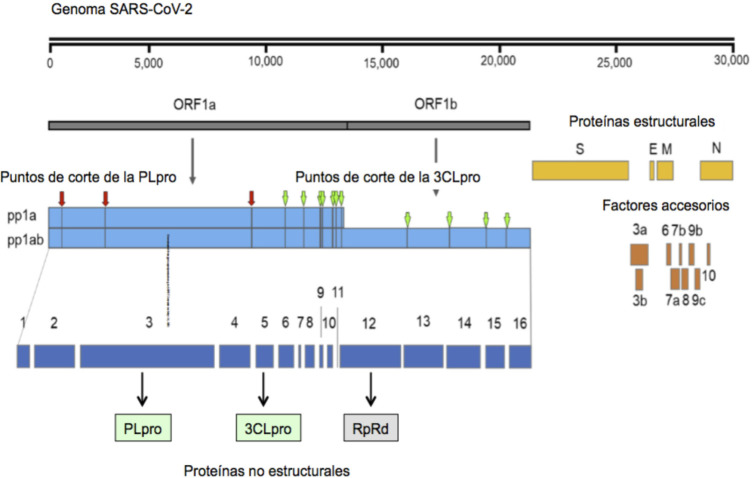
Todos los coronavirus, incluido el SARS-CoV-2, se caracterizan por presentar un genoma de ARN de una sola cadena (de unos 30.000 nucleótidos) de tipo ARN-mensajero (con un extremo 5´-Cap y un extremo 3´-poliA), es decir de tipo positivo. A diferencia de otros virus ARN se transcriben dando lugar a una poliproteína de una sola cadena (virus monocistrónico) que precisa ser hidrolizada por las proteasas virales, dando lugar a cada una de las diferentes proteínas que lo constituyen [7,8].
El SARS-CoV-2 produce a partir de zona replicativa dos poliproteínas solapadas derivadas de los ORF1a y ORF1b designadas como pp1a (nsp1-nsp11) y pp1ab (nsp1-16). Estas proteínas son inicialmente procesadas por dos proteasas de cisteína virales específicas designadas como proteasa papaína-like (PLpro) (nsp3) y proteasa quimotripsina-like (3CLpro o main proteasa, Mpro) (nsp5) dando lugar a unas 11-16 proteínas intermediarias y no estructurales, incluyendo a la ARN-polimerasa ARN-dirigida (nsp12) La PLpro da lugar a las proteínas nsp1-4 y la 3CLpro a las proteínas nsp5-11/16 (Figura 1) [9,10].
Figura 1.
Estructura esquemática del genoma del SARS-CoV-2, proteasas y puntos de corte de las mismas (modificado de Zhu et al.[14]).
La proteasa PLpro, está formada por 1.945 aminoácidos, determina la deubiquitinación de las proteínas celulares como el factor regulador 3 del interferón (IRF3), así como también inactiva el factor nuclear NF-kB que aumenta la respuesta celular de las células B (inmunidad humoral) [10]. La proteasa 3CLpro es un homodímero de 303 aminoácidos que está formada por tres dominios: dominio I (aminoácidos 8-101), dominio II (102-184) y dominio III (201-303); además cada monómero contiene dos regiones catalíticas N-terminal y C-terminal [11,12]. Esta proteasa hidroliza las uniones glicina-serina dentro de la secuencia de reconocimiento leucina-glicina-serina-alanina-glicina de la proteína pp1ab [1,10-12]. La integridad y funcionalidad de estas proteasas, altamente conservadas, es imprescindible y esencial en el proceso replicativo de estos virus [11-14].
La proteasa principal 3CLpro se ha constituido como una de las posibles dianas terapéuticas para el desarrollo de fármacos antivirales frente al SARS-CoV-2 debido a su secuencia y estructura altamente conservada entre todos los coronavirus [14-16]. Sin embargo, los primeros estudios realizados utilizando los inhibidores de la proteasa de forma individual frente al VIH lopinavir/ritonavir no han mostrado apenas eficacia en los adultos frente al SARS-CoV-2 [16,17]. Del mismo modo, el compuesto AG7088 que es un potente inhibidor de las proteasas 3CLpro de los rinovirus y picornavirus tampoco ha mostrado eficacia frente a las proteasas del SARS-CoV-2 [18-22]. Una de las ventajas de estos antivirales es que no se han descrito pro- teasas humanas análogas a la 3CLpro, de modo que sus posibles inhibidores no afectarían a las células ni presentarían efectos adversos [19-23]. Además, estos fármacos serían eficaces tanto en las actuales como en las futuras variantes genéticas del SARS-CoV-2, dado que su diana molecular no está relacionada con la proteína S de este virus (proteína hipervariable) [1,2].
EL ANTIVIRAL NIRMATRELVIR
Durante la pandemia causada por el SARS-CoV-1 entre los años 2002 y 2003 Hoffman et al. [23] identificaron una pequeña molécula (derivado hidroximetilcetona o PF-00835231) con intensa actividad inhibidora de la proteasa 3CLpro. Dado que las secuencias de las proteasas 3CLpro del SARS-CoV-1 y SARS-CoV-2 presentan una identidad del 96% y del 100% en el sitio activo [10,15,24], se iniciaron los estudios sobre la utilidad de este compuesto para tratar a los pacientes con la COVID-19 [17].
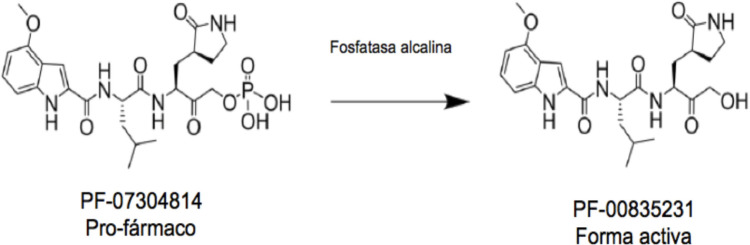
Boras et al. [17] describieron el profármaco fosfatado de este compuesto (designado PF-07304814) que ha mostrado mayor absorción y biodisponibilidad (Figura 2). Así mismo estudiaron la eficacia de este fármaco y observaron una intensa actividad antiviral frente al SARS-CoV-2 tanto en cultivos celu-lares como en ratones a una concentración efectiva de 0.5 µM. Este dato permite predecir que se alcanzaría esta concentración terapéutica en el ser humano con una dosis de 500 mg en infusión continua durante 24 horas. Así mismo han observado, en cultivos celulares, el efecto sinérgico entre el compuesto PF-00835231 y remdesivir, un análogo de la adenosina que interrumpe la replicación viral [19]. De este modo se podría utilizar esta combinación sinérgica en los pacientes graves o con elevadas cargas virales [17].
Figura 2.
Activación por parte de las fosfatasas alcalinas celulares del pro-fármaco PF-07304814 a su forma activa PF-07321332 (nirmatrelvir).
Hammond et al. [25] ha presentado recientemente los datos preliminares de un estudio con el fármaco antiviral nirmatrelvir, que es un potente inhibidor de la proteasa 3CLpro del SARS-CoV-2. Este fármaco es una modificación química del original descrito por Hoffman et al. [23], que se administra a una dosis experimental de 300 mg por vía oral cada 12 horas durante un período de 3 o 5 días. En el estudio aleatorizado, doble ciego, en Fase 2/3 EPIC-HR (Evaluation of Protease Inhibition for COVID-19 in High Risk Patients) realizado en 1.219 pacientes adultos no hospitalizados con infección demostrada por SARS-CoV-2 y elevado riesgo de progresión a enfermedad grave, por patologías previas, se demostró una reducción del 89% en el riesgo de hospitalización o fallecimiento por cualquier causa frente a placebo en pacientes tratados en los 3 primeros días desde el inicio de los síntomas. De este modo sólo el 0,8% de los pacientes que recibieron nirmatrelvir fueron hospitalizados durante los 28 días siguientes al inicio del tratamiento (sin ningún fallecimiento) (3/389 pacientes), mientras que en el grupo del placebo se hospitalizaron el 7% (con siete fallecimientos entre ellos), siendo estos datos estadísticamente significativos (27/385 pacientes) (p<0.0001).
Datos similares se observaron en los pacientes tratados en los primeros 5 días desde inicio de los síntomas. Sólo se hospitalizaron el 1% de los tratados con nirmatrelvir durante los 28 días siguientes, mientras que si lo hicieron el 6,7% del grupo placebo (p<0,0001). Globalmente a los 28 días del inicio de los síntomas no se comunicó ningún fallecimiento entre los que recibieron el inhibidor 3CLpro nirmatrelvir, pero si ocurrió en el 1.6% (10 casos) de los que recibieron placebo. Los efectos adversos detectados fueron muy parecidos entre los dos grupos (19-21%), la mayoría de ellos considerados como moderados. Los efectos adversos graves se produjeron en el 1,7% de los tratados con nirmatrelvir frente al 6.6% del grupo placebo y el cese de tratamiento se detectó en el 2.1% de los tratados con el antiviral (4,1% grupo placebo) [25].
Por su parte Owen et al. [26] han observado en ratones adaptados al SARS-CoV-2 que el tratamiento a la dosis de 300 mg/kg/2 veces al día les protegía de la infección intranasal por este virus. Además, comprobaron una disminución significativa de la carga viral en el tracto respiratorio y parénquima pulmonar, confirmando su potente efecto antiviral.
En un ensayo clínico de seguridad, tolerabilidad y farmacocinética se observó en adultos sanos (ClinicalTrial.gov. NCT04756531) que dosis bajas de ritonavir (100 mg) enlentecían el metabolismo y la desactivación de nirmatrelvir por la citocromo-oxidasa hepática, de modo que permanecía activo durante períodos mas prolongados y en concentraciones mas elevadas [25,26]. Además, nirmatrelvir se ha mostrado altamente eficaz en el bloqueo de la transcripción de las principales variantes del SARS-CoV-2 descritas hasta la actualidad [22]. La FDA aprobó la combinación nirmatrelvir más ritonavir (PaxlovidTM) el 6 de noviembre de 2021 para su comercialización y administración en humanos. La dosis recomendada sería de 300 mg del nuevo antiviral (dos pastillas de 150 mg) junto a una pastilla de ritonavir (100 mg) dos veces al día durante 5 días [27].
La administración oral de este antiviral y sus escasos efectos adversos podrían permitir su utilización generalizada al inicio de los primeros síntomas de infección por SARS-CoV-2. Como la mayoría de otros antivirales frente a los virus respiratorios, el tratamiento debería iniciarse en las primeras 24-48 horas tras la aparición de los síntomas, coincidiendo con la fase replicativa mas intensa del virus. Su utilización podría evitar las formas graves de la COVID-19 y disminuir los ingresos hospitalarios, tanto en pacientes vacunados como en los no vacunados e incluso en las reinfecciones por variantes distintas a la primoinfección, como la ómicron, actualmente en circulación masiva [28,29].
FINANCIACIÓN
Los autores declaran no haber recibido financiación para la realización de este estudio.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses
References
- 1.Ghahremanpour MM, Tirado-Rives J, Deshmukh M, Ippolito JA, Zhang CH, Cabeza de Vaca Iet al. Identification of 14 known drugs as inhibitors of the main protease of SARS-CoV-2. ACS Ned Chem Lett 2020; 11:2526-33. doi: 10.1021/acsmedchemlett.Oc00521. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Chen J, Ali F, Khan I, Zhu YZ. Recent progress in thd development of potential drugs against SARS-CoV-2. Curr Res Pharmacol Drug Discov 2021. doi: 10.1016/j.crphar.2021.100057. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Baig MH, Sharma T, Ahmad I, Abohashrh M, Alam MM, Dong JJ. Is PF-00835231 a pan-SARS-CoV-2 Mpro inhibitor?. A comparative study. Molecules 2021; 26:1678. doi: 10.3390/molecules26061678. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Reina J. Plitidepsina, un inhibidor del factor de elongación celular eEF1a y molnupiravir un análogo del ribonucleósido citidina, dos nuevos compuestos químicos con intensa actividad frente al SARS-CoV-2. Rev Esp Quimioterap 2021; 34:402-7. doi: 10.37201/req/042.2021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.European Medicines Agency . EMA issues advice on use of Lager-vrio (molnupiravir) for the treatment of COVID-19. Disponible en: https://www.ema.europa.eu/en/news/ema-issues-advice-use-lagevrio-molnupiravir-treatment-covid-19.
- 6.EMA issues advice on use of Paxlovid (PF-07321332 and ritonavir) for treatment of COVID-19. Disponible en: https://www.ema.europa.eu/en/news/ema-issues-advice-use-paxlovid-pf-07321332-ritonavir-treatment-covid-19.
- 7.Dai W, Zhang B, Jiang XM, Su H, Li J, Zhao Yet al. Structure-based design of antiviral drug candidates targeting the SARS-CoV-2 main protease. Science 2020; 368:1331-5. doi: 10.1126/science.abb4489. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Chia CS, Xu W, Ng PS. A patent review on SARS coronavirus main protease (3CLpro) inhibitors. Chem Med Chem 2021: 16:1-13. doi. 10.1002/cmdc.202100576. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Krichel B, Falke S, Hilgenfeld R, Redecke L, Uetrecht C. Processing of the SARS-CoV pp1a/ab nsp7-10 region. Biochem J 2020; 477:1009-19. doi: 10.1042/BCJ20200029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Mengist HM, Dilnessa T, Jin T. Structural basis of potential inhibitors targeting SARS-CoV-2 main protease. Front Chem 2021; 9:622898. doi. 10.3389/fchem.2021.622898. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Chitranshi N, Gupta VK, Rajput R, Godinez A, Pushpitha K, Shen Tet al. Evolving geographic diversity in SARS-CoV2 and in silico analysis of replicating enzyme 3CLpro targeting repurposed drug candidates. J Trans Med 2020;18:278.doi: 10.1186/s12967-020-02448-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Iketani S, Forouhar F, Liu H, Hong SJ, Lin FY, Nair MSet al. Lead compounds for the development of SARS-CoV-2 3CL protease inhibitors. Nat Commun 2021; 12:2016. doi: 10.1038/s41467-021-22362-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Gadlage MJ, Denison MR. Exchange of the coronavirus replicase polyprotein cleavage sites alters protease specificity and processing. J Virol 2010; 84:6894-8. doi: 10.1128/JVI.00752-10. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Zhu W, Shyr Z, Lo DC, Zheng W. Viral proteases as targets for coronavirus disease 2019 drug development. J Pharmacol Exp Ther 2021; 378:166-72. doi: 10.1124/jpet.121.000688. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Macchiagodena M, Pagliai M, Procacci P. Characterization of the non-covalent interaction between the PF-07321332 inhibitor and the SARS-CoV-2 main protease. J Mol Graph Model 2021; 110:108042. doi: 10.1016/j.jmgm.2021.108042. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Vincent S, Arokiyaraj S, Saravanan M, Dhanraj M. Moleculsr docking studies on the anti-viral effects of compounds from Kabasura Kudineer on SARS-CoV-2 3CLpro. Front Mol Biosci 2020; 7:613401. doi: 10.3389/fmolo.2020.613401. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Boras B, Jones RM, Anson BJ, Arenson D, Aschenbrenner L, Bakowski MAet al. Preclinical characterization of an intravenous coronavirus 3CL protease inhibitor for the potential treatment of COVID19. Nat Commun 2021; 12:6055. doi: 10.1038/s41467-021-26239-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Morse JS, Lalonde T, Xu S, Liu WR. Learning from the past: posible uregent prevention and treatment options for Severe Acute Respiratory Infections caused by 2019-nCoV. Chem Bio Chem 2020; 21:730-8. doi: 10.1002/cbic.202000047. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Zumla A, Chan JF, Azhar EI, Hui DS, Yuen KY. Coronaviruses: drug discovery and therapeutic options. Nat Rev Drug Discov 2016; 15:327-47. doi: 10.1038/nrd.2015.37. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Liu C, Boland S, Scholle MD, Bardiot D, Marchand A, Chaltin Pet al. Dual inhibition of SARS-CoV-2 and human rhnovirus with protease inhibitors in clinical development. Antiviral Res 2021; 187:105020. doi: 10.1016/j.antiviral.2021.105020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Gao K, Wang R, Chen J, Tepe JJ, Huang F, Wei GWet al. Perspectives on SARS-CoV-2 main protease inhibitors. J Med Chem 2021. doi: 10.1021/acs.jmedchem.1c00409. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.de Vries M, Mohamed AS, Prescott RA, Valero-Jimenez AM, Desvignes L, O´Connor Ret al. A comparative analysis of SARS-CoV-2 antivirals characterizes 3CLpro inhibitor PF-00835231 as a potential new treatment for COVID-19. J Virol 2021; 95:e01819-20. doi: 10.1128/JVI.01819-20. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Hoffman RL, Kania RS, Brothers MA, Ferre RA, Gajiwala KS, He Met al. Discovery of ketone-based covalent inhibitors of coronavirus 3CL proteases for the potential therapeutic treatment of COVID-19. J Med Chem 2020; 63:12725-47. doi: 10.1021/acs.jmedchem.0c01063. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Yan F, Gao F. An overview of potential targeting non-structural proteins 3 (PLpro and Mac1) and 5 (3CLpro/Mpro) of Sars-CoV-2. Comput Struct Biotechnol J 2021; 19:4868-83. doi: 10.1016/j.csbj.2021.08.036. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Hammond J, Leister-Tebbe H, Gardner A, Abreu P, Bao W, Wisenandle Wet al. Oral nirmatrelvir for high-risk, nonhospitalized adults with Covid-19. N Engl J Med 2022. doi: 10.1056/NEJMoa2118542. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Owen DR, Allerton CM, Anderson AS, Aschenbrenner L, Avery M, Berritt Set al. An oral SARS-CoV-2 Mpro inhibitor clinical candidate for the treatment of COVID-19. Science 2021; 374:1586-93. doi: 10.1126/science.ab14784. [DOI] [PubMed] [Google Scholar]
- 27.Paxlovid FDA approval status. drugs.com. 2021. (revisado 07/11/2021). https://www.drugs.com/history/paxlovid.html.
- 28.Ullrich S, Ekanayake KB, Otting G, Nitsche C. Main protease mutants of SARS-CoV-2 variants remain susceptible to PF-07321332. bioR-xiv 2021. doi: 10.1101/2021.11.28.470226. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Wang Z,Yang L. In the age of omicron variant: paxlovid raises new hopes of COVID-19 recovery. J Med Virol 2021. doi: 10.1002/jmv.27540. [DOI] [PubMed] [Google Scholar]