Abstract
Peripheral nerve damage is an important cause of seeking medical attention. It occurs when the continuity of structures is interrupted and the propagation of nervous impulses is blocked, affecting the functional capacity of individuals. To assess the effects of the immunosuppressants tacrolimus and cyclosporine on the regeneration of peripheral nerves, a systematic review of the literature was carried out. The articles included were published until September 2018 and proposed to evaluate the effects of the immunosuppressants tacrolimus and cyclosporine on nerve regeneration and neuroprotection, available in the MEDLINE, EMBASE, Cochrane Library, Web of Science, Oxford Pain Relief Database, and LILACS databases. The research analysed a total of 56 articles, of which 22 were included in the meta-analysis. Statistical analysis suggests the protective effect of tacrolimus in the regeneration of the number of myelinated axons (95% confidence interval [CI]: 0.93–2.39; p < 0.01); however, such effect was not observed in relation to cyclosporine (95%CI: - 0.38–1.18; p = 0.08) It also suggests that there is a significant relationship between the use of tacrolimus and myelin thickness (95%CI= 2.00–5.71; p < 0. 01). The use of immunosuppressants in the regeneration of peripheral nerve damage promotes an increase in the number of myelinated axons in general, regardless of the administered dose. In addition, it ensures greater myelin thickness, muscle weight and recovery of the sciatic functional index. However, heterogeneity was high in most analyses performed.
Keywords: nerve regeneration, peripheral nerve, immunosuppressive agents, FK506, tacrolimus, cyclosporine
Introduction
Peripheral nerves consist of structures that can be affected by injuries that can result in important motor and sensory impairments. 1 Peripheral nerve injuries (PNIs) cause interruption of the continuity of structures and block the propagation of nerve impulses, consequently affecting the functional capacity of individuals. 2 3 4 5 6
Peripheral nerve injuries are more frequent in the upper limbs, causing problems mainly in the functional abilities of the hand. Regeneration of the lesion in the post-trauma is of great complexity and the individual can present severe sequelae. Thus, PNIs, in addition to promoting functional impairments in the quality of life of the subjects, directly affect their finances due to the impossibility of carrying out daily activities, and indirectly due to the supporting care related to the treatment. 7
Therapeutic strategies for the treatment of PNIs represent a major challenge in regenerative medicine due to the complex biological conditions and to the lack of biomaterials for an effective repair of the nerves. 8 The treatment is classified into two modalities and depends exclusively on the type of lesion presented: in more severe situations, such as neurotmesis, surgical treatments are recommended, whereas for less severe conditions, such as axonotmesis and neuropraxia, pharmacological conservative treatments are indicated. 5
The development of drugs that promote the rate of nerve regeneration and increase the degree of functional restitution after injury can bring extremely important benefits for patients with PNI. Of these drugs, immunosuppressants were initially used to prevent allograft rejection. 9 10
Tacrolimus, also known as FK506 or Fujimycin (C 44 H 69 O 12 ), is a drug from the macrolide group, which was approved by the FDA (Food and Drug Administration) for the prevention of allograft rejection, but it also has nerve regeneration properties via immunosuppression. 11
Another important immunosuppressant to prevent organ transplant rejections is cyclosporine, which can significantly reduce morbidity when compared with early immunosuppression methods. Regarding nerve regeneration, the mechanism of action of cyclosporine is still contradictory. Some researchers reveal that the local effect of cyclosporin A (CsA) on peripheral nerve regeneration has been investigated after peripheral nerve transection in experimental models immunosuppressed with CsA. Most of these studies focused on the local effect of CsA on peripheral nerve regeneration rather than on allograft survival. 12 13 14 15
Considering the promising action of immunosuppressants, there is no consensus in the literature about the effectiveness of these drugs. Therefore, the objective of the present investigation is to review the scientific evidence of the repercussion of the use of immunosuppressants in the regeneration of PNIs.
Materials and Methods
The present work was conducted according to the PRISMA guidelines for reporting systematic reviews and was registered on the PROSPERO platform, which is available on the website ( http://www.crd.york.ac.uk/PROSPERO ).
The search strategy was performed by identifying the studies, without language restriction, published from the inception to September 2018 in the following electronic databases: MEDLINE (via PubMed), EMBASE, Cochrane Central Register of Controlled Trials, ISI Web of Science ( http://www.webofknowledge.com ), Oxford Pain Relief Database, and LILACS. As grey literature, potentially eligible articles were also searched in the bibliographic references of the materials searched in the aforementioned databases. First, the search was performed in MEDLINE and the following searches were adapted to the other databases.
The search terms used were: “ Peripheral Nerve Injuries ” (mesh), “ Peripheral Nerve Injury ,” “ Nerve Injuries, Peripheral ,” “ Nerve Injury, Peripheral .” For intervention: “ tacrolimus ” (mesh), “ Prograf ,” “ Prograft ,” “ FR900506 ,” “ FR 900506 ,” “ FR900506 ,” “ Anhydrous tacrolimus ,” “ tacrolimus , Anhydrous ,” “ tacrolimus Anhydrous ,” “ Anhydrous , tacrolimus ,” “ FK - 506 ,” “ FK 506 ,” “ FK506 ,” “ Cyclosporine ,” “ Cyclosporin ,” “ Cyclosporine A ,” “ Ciclosporin ,” “ Cyclosporin A ,” “ Neoral ,” “ Sandimmun Neoral ,” “ CyA - NOF ,” “ CyA NOF ,” “ Sandimmune ,” “ Sandimmun ,” “ CsA - Neoral ,” “ CsA Neoral ,” “ CsANeoral ,” “ OL 27-400 ,” “ OL 27 400 ,” “ OL 27400 ,” “ Cyclosporins ,” “ Immunosuppressive Agents ,” “ Agents , Immunosuppressive ,” “ Immunosuppressants .” For outcomes: “ Nerve Regeneration (mesh),” “ Nerve Regenerations ,” “ Regeneration , Nerve ,” “ Regenerations , Nerve ,” “ Neuronal Protection ,” “ Protection , Neuronal ,” “ Neural Protection ,” “ Protection , Neural ,” “ Neuron Protection ,” “ Protection , Neuron ”.
The PICO strategy used in the present review was: P, peripheral nerve injury; I, the use of immunosuppressants tacrolimus (FK-506) and/or CsA; C, the use of treatment without immunosuppressants; and O, outcomes related to nerve regeneration. The present review included all types of study designs in which the intervention is described as using the immunosuppressants tacrolimus (FK-506) and/or CsA, and in which the outcomes evaluated are related to peripheral nerve regeneration/neuroprotection. Reviews, duplicate studies, and editorial studies were excluded, in addition to in vitro investigations, studies performed in the central nervous system, and studies of degenerative nerve diseases. In cases of duplicate studies, the one with the largest sample size was considered.
Any type of outcome that indicates or measures nerve regeneration and/or neuroprotection after peripheral nerve injury was accepted; histological morphometric and immunohistochemical parameters of nerve regeneration, whether conventional or computed, such as counting motor neurons (myelinated axons) by microscopy, measuring myelin sheath thickness (morphometric analysis of axonal caliber), calculating the axon regeneration rate determined by radiolabelling, body weight and muscle mass gain, electroneurophysiological outcomes, and functional outcomes by assessment of motricity and sensitivity measured by usual or unusual tests.
The selection of studies and data extraction took place as follows: two authors worked independently and verified the abstract and title of the search results. Differences were resolved by discussion or consultation with a third author for consensus. All potentially relevant articles were investigated as full text. When there was no agreement, the third author who did not initially review the articles made the final decision. For studies that met the inclusion criteria, two authors independently extracted data using standardized data extraction models.
The instructions from the Cochrane Handbook for Systematic Reviews of Interventions were followed to assess the risk of bias.
Two authors independently handled the risk of bias in the included investigations by considering the following items: generation of proper sequence (selection bias); allocation sequence adequately concealed (selection bias); whether knowledge of assigned interventions was correctly warned during the study; evaluation of participants and staff (performance bias) evaluators of outcomes (detection bias); whether incomplete outcome data were adequately addressed (attrition bias); whether the study reports were free from the suggestion of selective reporting of results (reporting bias). The present study was apparently free of other problems that could put it at risk for bias. Disagreements arising from different interpretations were resolved by consensus. When additional information was needed for the review, the authors reassessed the study as soon as this information was made available by the authors of the investigated article.
Statistical analysis was performed using R 3.6.0 statistical software and RStudio interface version 1.2.1335 (R Foundation, Vienna, Austria). The meta-analysis was performed using the "meta" package and the "metacont." The random-effects inverse-variance method was used to aggregate the results. Studies that had multiple intervention and/or control groups had mean and standard deviation results grouped according to the methodology described by Higgins et al.. 16
Hedges g was used to estimate the effect size representing standardized mean differences (SMDs). Heterogeneity between studies was assessed using the Q test and the I 2 test. The I 2 test represents the amount of total variation that is explained by the variation between studies. I 2 values of ∼ 25, 50, and 75% indicate low, moderate, and high heterogeneity, respectively.
All meta-analyses performed showed heterogeneity in the studies; therefore, the effect size presented in the random-effects model indicator should be used.
Results
After identification of the articles, removal of duplicates, and exclusion following the eligibility criteria, 56 studies were included in the present research.
Furthermore, most authors chose to injure the sciatic 15 17 18 or tibial 19 20 21 22 23 24 25 nerve and the time of the studies ranged from 7 days 26 to 1 year of observation. 27
Even though, for most authors, the administration of tacrolimus or cyclosporine does not present side effects, some articles report episodes of rejection and adverse effects. 10 19 28
Of all studies, the most recurrent type of anaesthetic is pentobarbital 4 10 17 21 26 29 30 31 32 33 or ketamine 15 19 20 24 25 27 34 35 36 37 38 associated with medetomidine 20 25 35 or xylazine. 15 18 19 27 36 37 38
Of the 56 articles in question, only 22 were selected for meta-analysis ( Supplementary material – available online). The results obtained through the analysis of the studies are shown in the following figures.
As shown in Figure 1 , the combined SMD in the included studies was 1.66 (95% confidence interval [CI]: 0.93–2.39; p < 0.01), suggesting the protective effect of the use of tacrolimus regarding regeneration of the number of myelinated axons. The I 2 value was 89%, indicating high heterogeneity.
Fig. 1.

Rate of tacrolimus use with the number of myelinated axons.
Figure 2 shows an SMD of 1.70 (95%CI: 0.78–2.62; p < 0.01), indicating that a tacrolimus dose ≤ 2 mg exhibited a significant effect in the number of myelinated axons.
Fig. 2.

Rate of tacrolimus use (dose ≤ 2 mg) with the number of myelinated axons.
Figure 3 shows that tacrolimus at a dose > 2 mg also exhibited a significant relation with the number of myelinated axons, as the SMD was 1.54 (95%CI: 0.06–3.03; p < 0.01).
Fig. 3.
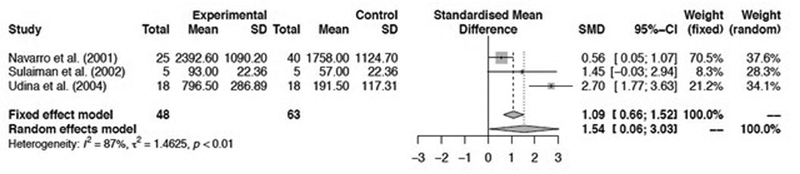
Rate of tacrolimus use (dose > 2 mg) with the number of myelinated axons.
When the use of cyclosporine for nerve regeneration was evaluated, the SMD value was 0.40 (95%CI: - 0.38–1.18; p = 0.08), showing no significant result of the use of this immunosuppressant in terms of number of myelinated axons in general. When specifically analysing the use of tacrolimus and myelin thickness, the SMD was 3.85 (95%CI = 2.00–5.71; p < 0.01), suggesting the existence of a significant relationship between both variables. Also, it was found that the use of tacrolimus was significantly correlated with muscle weight, since the SMD was 2.45 (95%CI = 0.68–4.22; p < 0.01).
It is suggested that there is a significant benefit for the sciatic functional index using tacrolimus, since an SMD of 3.34 was obtained (95%CI = 1.44–5.24; p < 0.01). When we evaluate the use of tacrolimus at a dose ≤ 2 mg and the sciatic functional index, an SMD of 3.76 was obtained (95%CI = 1.11–6.41; p < 0.01), suggesting a significant relationship. When using a tacrolimus dose of 2 mg, the SMD was 2.74 (95%CI = - 0.59–6.07; p < 0.01), indicating that there is a significant association between the use of tacrolimus at this dose and the sciatic functional index.
Discussion
The present systematic review evidences that the use of immunosuppressants in the regeneration of PNIs promotes an increase in the number of myelinated axons in general, regardless of the administered dose. In addition, it ensures greater myelin thickness, muscle weight and restoration of the sciatic functional index. However, heterogeneity was high in most analyses performed.
In line with most authors, investigations have shown that the immunosuppressant tacrolimus is related to an increase in the number of nerve fibers and in axonal diameter, in which axons could regenerate into various sizes and shapes. 4 17 21 35 38 39
It was also found that tacrolimus is considered an immunosuppressant with greater potency than cyclosporine; this result exposes the relationship between the use of these drugs with the number of myelinated axons. 17 19 21 40
Drug doses also show a relationship with the occurrence of their effects, although most results have shown that there is no dose-dependent effect based on the use of immunosuppressants. 4 10 21 37 39
Regarding the mechanism of action of nerve regeneration, the authors mention that the binding protein FKBP52 is responsible for the neurotrophic action of tacrolimus. There is a high expression of GAP-43, an essential protein for the formation of a growth cone and axonal elongation, in the presence of this drug in peripheral nerve injuries, causing this protein to be maintained or to have its expression reinduced. 21 37 40
Furthermore, the authors also highlighted the importance of using immunosuppressants, especially when the lesions were repaired with allografts, because tacrolimus significantly increases the rate of regeneration and its removal led to graft rejection, pronounced functional deterioration, and loss of fibers in regeneration. 10 35
Regarding myelin thickness and muscle weight, the authors found that tacrolimus doubled the number of regenerated motoneurons and the thickness of the myelin sheath. In addition, it promoted an increase in the rate of muscle weight recovery. 4 21 28 39 41
Regarding sciatic function, tacrolimus has been shown to be effective in recovering the sciatic functional index, although some authors have shown that these effects would occur incompletely. 4 36 42 43
Another factor to be emphasized are the adverse effects caused by tacrolimus and that were mentioned by the authors, such as weight gain, superficial lesions at the injection site, pruritus, nephrotoxicity or even death of animals. 10 19 28 This evidence reiterates the importance of using minimal doses of the drug to avoid these adverse effects, as the efficacy of the drug does not show a close relationship with the dose.
It is important to highlight the issues related to the risk of bias, considering the methodological quality of the included studies, selection, and confounding variables. Regarding structural and methodological aspects of the analysed texts, there was a lack of information in the following categories: abstract, objectives, ethical procedures, and collection procedures. The lack of information in these categories demonstrates a structural and methodological deficiency in the developed studies, resulting in incomplete work.
Furthermore, the noninclusion of other databases in the search for articles and publication bias, since investigations with negative results are most often not published or are published in journals not indexed in the selected databases, may interfere with generalization of the results of the present review.
Another important factor refers to the existence of few studies correlated to nerve regeneration procedures with grafts, and it is not possible to compare each nerve injury technique. The present review found a lack of standardization of anaesthetic substances, of doses of immunosuppressants, and of type of lesion. Thus, it is likely that there are misinterpretations, although this was an alternative to include and compare data from studies.
The limited number of studies and the methodological differences between them make it difficult to generalize the results. Furthermore, most of the studies included in this meta-analysis showed cross-sectional designs, making it difficult to analyse the causal relationship between the use of immunosuppressants and peripheral nerve regeneration. However, although it had many limitations, the results of the present study are consistent.
Regarding the high heterogeneity of studies in general, a possible justification for the relative variability of the results of experimental studies on nerve injuries is the variety of models and test methods used. Besides, there was no time nor language limitation, nor geographic aspects in the search for articles, which may influence in some way.
It should also be mentioned that the search strategy was carried out by only one researcher, which may contribute to some bias or loss of information/study during the execution of the process. Not all articles included provided the mean, standard deviation, or standard error values of the analysed variables; therefore, it is not possible to calculate the effect size for all investigations. It was also observed that the sample size was relatively small, favouring the development of type I errors, directly affecting the effect size value of the studied variables.
Final Considerations
The present study aimed to carry out a systematic review with meta-analysis of studies that address the issue of the repercussions of the pharmacological therapy of tacrolimus and cyclosporine in the regeneration of peripheral nerves, seeking to compile the results of studies that have been developed in recent years on the subject.
It was found that the effects of immunosuppressants on nerve regeneration were consistent, mainly due to the increase in the number of myelinated axons in general, in the myelin thickness, in the muscle weight, and in the sciatic functional index, regardless of the dose administered.
We hope that the present study can contribute to scientific knowledge and applications in the health context. In order to improve future research, authors of controlled studies should opt for a more robust sampling approach, improving the matching of the control group, because some variables can help to minimize differences between groups; to validate indirect protocols for assessing peripheral nerve damage; to provide more clarity on possible chronic complications that may compromise the neuronal function of those involved, improving the characterization of the sample; and to avoid underestimating or overestimating the experimental group or the control group.
Footnotes
Conflito de Interesses Os autores declaram não haver conflito de interesses.
Material Suplementar
Supplementary Material
Referências
- 1.Sasso L. Araranguá: Universidade Federal de Santa Catarina; 2017. Análise comparativa da fotobioestimulação e da sinvastatina após lesão por esmagamento do nervo ciático em camundongos [TCC - graduação em Fisioterapia] [Google Scholar]
- 2.Barbosa R I, Marcolino A M, de Jesus Guirro R R, Mazzer N, Barbieri C H, de Cássia Registro Fonseca M. Comparative effects of wavelengths of low-power laser in regeneration of sciatic nerve in rats following crushing lesion. Lasers Med Sci. 2010;25(03):423–430. doi: 10.1007/s10103-009-0750-8. [DOI] [PubMed] [Google Scholar]
- 3.Oliveira F B, Pereira V M, da Trindade A P, Shimano A C, Gabriel R E, Borges A P. Action of therapeutic laser and ultrasound in peripheral nerve regeneration. Acta Ortop Bras. 2012;20(02):98–103. doi: 10.1590/S1413-78522012000200008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Chen B, Song Y, Liu Z. Promotion of nerve regeneration in peripheral nerve by short-course FK506 after end-to-side neurorrhaphy. J Surg Res. 2009;152(02):303–310. doi: 10.1016/j.jss.2008.03.032. [DOI] [PubMed] [Google Scholar]
- 5.Luiz L. Uberlândia - MG: Universidade Federal de Uberlândia; 2015. Avaliação da lesão nervosa periférica por meio da eletromiografia de superfície [dissertação] [Google Scholar]
- 6.Wang C Z, Chen Y J, Wang Y H. Low-level laser irradiation improves functional recovery and nerve regeneration in sciatic nerve crush rat injury model. PLoS One. 2014;9(08):e103348. doi: 10.1371/journal.pone.0103348. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Lundborg G, Rosén B.Hand function after nerve repairIn: Acta Physiologica. Vol 189. Acta Physiol (Oxf);2007207–217. [DOI] [PubMed] [Google Scholar]
- 8.Yin Y, Xiao G, Zhang K. Tacrolimus- and Nerve Growth Factor-Treated Allografts for Neural Tissue Regeneration. ACS Chem Neurosci. 2019;10(03):1411–1419. doi: 10.1021/acschemneuro.8b00452. [DOI] [PubMed] [Google Scholar]
- 9.Tuma P, Ferreira M C, Nakamoto H A. Influência da imunossupressão na regeneração nervosa com utilização de aloenxertos. Estudo experimental em ratos. Acta Ortop Bras. 2008;16(01):41–44. [Google Scholar]
- 10.Udina E, Rodríguez F J, Verdú E, Espejo M, Gold B G, Navarro X. FK506 enhances regeneration of axons across long peripheral nerve gaps repaired with collagen guides seeded with allogeneic Schwann cells. Glia. 2004;47(02):120–129. doi: 10.1002/glia.20025. [DOI] [PubMed] [Google Scholar]
- 11.Grinsell D, Keating C P. Peripheral nerve reconstruction after injury: a review of clinical and experimental therapies. BioMed Res Int. 2014;2014:698256. doi: 10.1155/2014/698256. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Taskinen H S, Röyttä M. Cyclosporin A affects axons and macrophages during Wallerian degeneration. J Neurotrauma. 2000;17(05):431–440. doi: 10.1089/neu.2000.17.431. [DOI] [PubMed] [Google Scholar]
- 13.Meirer R, Babuccu O, Unsal M. Effect of chronic cyclosporine administration on peripheral nerve regeneration: a dose-response study. Ann Plast Surg. 2002;49(01):96–103. doi: 10.1097/00000637-200207000-00015. [DOI] [PubMed] [Google Scholar]
- 14.Konofaos P, Terzis J K. FK506 and nerve regeneration: past, present, and future. J Reconstr Microsurg. 2013;29(03):141–148. doi: 10.1055/s-0032-1333314. [DOI] [PubMed] [Google Scholar]
- 15.Mohammadi R, Heydarian H, Amini K. Effect of local administration of cyclosporine A on peripheral nerve regeneration in a rat sciatic nerve transection model. Chin J Traumatol. 2014;17(01):12–18. [PubMed] [Google Scholar]
- 16.Higgins J P, Green S.Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0. The Cochrane Collaboration 2011[updated March 2011]. Available fromhttp://handbook.cochrane.org/
- 17.Navarro X, Udina E, Ceballos D, Gold B G. Effects of FK506 on nerve regeneration and reinnervation after graft or tube repair of long nerve gaps. Muscle Nerve. 2001;24(07):905–915. doi: 10.1002/mus.1088. [DOI] [PubMed] [Google Scholar]
- 18.McGrath A M, Brohlin M, Wiberg R. Long-Term Effects of Fibrin Conduit with Human Mesenchymal Stem Cells and Immunosuppression after Peripheral Nerve Repair in a Xenogenic Model. Cell Med. 2018;10:2.155179018760327E15. doi: 10.1177/2155179018760327. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Jost S C, Doolabh V B, Mackinnon S E, Lee M, Hunter D. Acceleration of peripheral nerve regeneration following FK506 administration. Restor Neurol Neurosci. 2000;17(01):39–44. [PubMed] [Google Scholar]
- 20.Ogden M A, Feng F Y, Myckatyn T M. Safe injection of cultured schwann cells into peripheral nerve allografts. Microsurgery. 2000;20(07):314–323. doi: 10.1002/1098-2752(2000)20:7<314::aid-micr2>3.0.co;2-w. [DOI] [PubMed] [Google Scholar]
- 21.Sulaiman O AR, Voda J, Gold B G, Gordon T. FK506 increases peripheral nerve regeneration after chronic axotomy but not after chronic schwann cell denervation. Exp Neurol. 2002;175(01):127–137. doi: 10.1006/exnr.2002.7878. [DOI] [PubMed] [Google Scholar]
- 22.Myckatyn T M, Ellis R A, Grand A G. The effects of rapamycin in murine peripheral nerve isografts and allografts. Plast Reconstr Surg. 2002;109(07):2405–2417. doi: 10.1097/00006534-200206000-00035. [DOI] [PubMed] [Google Scholar]
- 23.Sobol J B, Lowe J B, III, Yang R K, Sen S K, Hunter D A, Mackinnon S E. Effects of delaying FK506 administration on neuroregeneration in a rodent model. J Reconstr Microsurg. 2003;19(02):113–118. doi: 10.1055/s-2003-37817. [DOI] [PubMed] [Google Scholar]
- 24.Brenner M J, Fox I K, Kawamura D H. Delayed nerve repair is associated with diminished neuroenhancement by FK506. Laryngoscope. 2004;114(03):570–576. doi: 10.1097/00005537-200403000-00034. [DOI] [PubMed] [Google Scholar]
- 25.Snyder A K, Fox I K, Nichols C M. Neuroregenerative effects of preinjury FK-506 administration. Plast Reconstr Surg. 2006;118(02):360–367. doi: 10.1097/01.prs.0000227628.43867.5b. [DOI] [PubMed] [Google Scholar]
- 26.Udina E, Ceballos D, Verdú E, Gold B G, Navarro X. Bimodal dose-dependence of FK506 on the rate of axonal regeneration in mouse peripheral nerve. Muscle Nerve. 2002;26(03):348–355. doi: 10.1002/mus.10195. [DOI] [PubMed] [Google Scholar]
- 27.Song Y, Wang Z, Wang Z, Zhang H, Li X, Chen B. Use of FK506 and bone marrow mesenchymal stem cells for rat hind limb allografts. Neural Regen Res. 2012;7(34):2681–2688. doi: 10.3969/j.issn.1673-5374.2012.34.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Sun H H, Saheb-Al-Zamani M, Yan Y, Hunter D A, Mackinnon S E, Johnson P J. Geldanamycin accelerated peripheral nerve regeneration in comparison to FK-506 in vivo. Neuroscience. 2012;223:114–123. doi: 10.1016/j.neuroscience.2012.07.026. [DOI] [PubMed] [Google Scholar]
- 29.Grumbles R M, Casella G TB, Rudinsky M J, Godfrey S, Wood P M, Thomas C K. The immunophilin ligand FK506, but not the P38 kinase inhibitor SB203580, improves function of adult rat muscle reinnervated from transplants of embryonic neurons. Neuroscience. 2005;130(03):619–630. doi: 10.1016/j.neuroscience.2004.09.024. [DOI] [PubMed] [Google Scholar]
- 30.Cottrell B L, Perez-Abadia G, Onifer S M.Neuroregeneration in composite tissue allografts: effect of low-dose FK506 and mycophenolate mofetil immunotherapy Plast Reconstr Surg 200611803615–623., discussion 624–625 [DOI] [PubMed] [Google Scholar]
- 31.Scharpf J, Strome M, Siemionow M. Immunomodulation with anti-alphabeta T-cell receptor monoclonal antibodies in combination with cyclosporine A improves regeneration in nerve allografts. Microsurgery. 2006;26(08):599–607. doi: 10.1002/micr.20294. [DOI] [PubMed] [Google Scholar]
- 32.Kvist M, Sondell M, Kanje M, Dahlin L B. Regeneration in, and properties of, extracted peripheral nerve allografts and xenografts. J Plast Surg Hand Surg. 2011;45(03):122–128. doi: 10.3109/2000656X.2011.571847. [DOI] [PubMed] [Google Scholar]
- 33.Udina E, Gold B G, Navarro X. Comparison of continuous and discontinuous FK506 administration on autograft or allograft repair of sciatic nerve resection. Muscle Nerve. 2004;29(06):812–822. doi: 10.1002/mus.20029. [DOI] [PubMed] [Google Scholar]
- 34.McGrath A M, Brohlin M, Kingham P J, Novikov L N, Wiberg M, Novikova L N. Fibrin conduit supplemented with human mesenchymal stem cells and immunosuppressive treatment enhances regeneration after peripheral nerve injury. Neurosci Lett. 2012;516(02):171–176. doi: 10.1016/j.neulet.2012.03.041. [DOI] [PubMed] [Google Scholar]
- 35.Grand A G, Myckatyn T M, Mackinnon S E, Hunter D A. Axonal regeneration after cold preservation of nerve allografts and immunosuppression with tacrolimus in mice. J Neurosurg. 2002;96(05):924–932. doi: 10.3171/jns.2002.96.5.0924. [DOI] [PubMed] [Google Scholar]
- 36.Utuk A, Sarikcioglu L, Demirel B M, Demir N. The immunosuppressive agent FK506 prevents subperineurial degeneration and demyelination on ultrastructural and functional analysis. Curr Neurovasc Res. 2009;6(04):252–258. doi: 10.2174/156720209789630320. [DOI] [PubMed] [Google Scholar]
- 37.Shahraki M, Mohammadi R, Najafpour A. Influence of Tacrolimus (FK506) on Nerve Regeneration Using Allografts: A Rat Sciatic Nerve Model. J Oral Maxillofac Surg. 2015;73(07):14380–1.438E12. doi: 10.1016/j.joms.2015.03.032. [DOI] [PubMed] [Google Scholar]
- 38.Tulaci K G, Tuzuner A, Karadas Emir H. The effect of tacrolimus on facial nerve injury: Histopathological findings in a rabbit model. Am J Otolaryngol. 2016;37(05):393–397. doi: 10.1016/j.amjoto.2016.06.003. [DOI] [PubMed] [Google Scholar]
- 39.Azizi S, Mohammadi R, Amini K, Fallah R. Effects of topically administered FK506 on sciatic nerve regeneration and reinnervation after vein graft repair of short nerve gaps. Neurosurg Focus. 2012;32(05):E5. doi: 10.3171/2012.1.FOCUS11320. [DOI] [PubMed] [Google Scholar]
- 40.Costa M P, Cunha A S, Silva C F. A utilização do tubo de ácido poliglicólico e FK506 na regeneração de nervos periféricos. Acta Ortop Bras. 2006;14(01):25–29. [Google Scholar]
- 41.Que J, Cao Q, Sui T. Tacrolimus reduces scar formation and promotes sciatic nerve regeneration. Neural Regen Res. 2012;7(32):2500–2506. doi: 10.3969/j.issn.1673-5374.2012.32.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Rustemeyer J, van de Wal R, Keipert C, Dicke U. Administration of low-dose FK 506 accelerates histomorphometric regeneration and functional outcomes after allograft nerve repair in a rat model. J Craniomaxillofac Surg. 2010;38(02):134–140. doi: 10.1016/j.jcms.2009.03.008. [DOI] [PubMed] [Google Scholar]
- 43.Kim Y T, Hei W H, Kim S. Co-treatment effect of pulsed electromagnetic field (PEMF) with human dental pulp stromal cells and FK506 on the regeneration of crush injured rat sciatic nerve. Int J Neurosci. 2015;125(10):774–783. doi: 10.3109/00207454.2014.971121. [DOI] [PubMed] [Google Scholar]





