Abstract
Chronischer Pruritus (Dauer ≥ 6 Wochen) betrifft ca. 91 % der Patienten mit atopischer Dermatitis (AD). Neben reinem Jucken werden häufig Begleitsensationen wie Schmerzen, Brennen, Stechen und Hitzegefühl berichtet. Der Leidensdruck betroffener Patienten ist dadurch hoch; Schlaf und Lebensqualität können stark beeinträchtigt sein. Im Fokus der Behandlung der AD steht daher auch die suffiziente Kontrolle des Pruritus. Neben einer intensiven rückfettenden Basispflege können topisch Kortikosteroide und Calcineurininhibitoren angewendet werden. Bei ausgeprägtem Hautbefund kann Phototherapie zur Abheilung von Ekzemen und Linderung des atopischen Pruritus beitragen. Im Hinblick auf Systemtherapien stehen mehrere zugelassene Biologika (Dupilumab, Tralokinumab) und Januskinase-Inhibitoren (Baricitinib, Upadacitinib, Abrocitinib) zur Verfügung, die über die Interferenz mit der Signaltransduktion proinflammatorischer Zytokine zu einer raschen Pruritusreduktion führen. Während Januskinase-Inhibitoren zu einer initial schnelleren Prurituslinderung führen, scheinen sich Biologika und Januskinase-Inhibitoren mit zunehmender Therapiedauer hinsichtlich ihrer antipruritischen Wirksamkeit anzugleichen.
Schlüsselwörter: Atopischer Pruritus, Therapieempfehlung, Biologika, Januskinase-Inhibitoren
Abstract
Chronic pruritus (duration ≥ 6 weeks) affects about 91% of patients suffering from atopic dermatitis (AD). Pruritus is often accompanied by sensations such as pain, burning, stinging, and heat, resulting in a high burden of affected patients; sleep and quality of life may be severely impaired. An important pillar of AD treatment is also to achieve sufficient control of pruritus. In addition to intensively used emollients, corticosteroids and calcineurin inhibitors have proven effective. In case of eczema affecting a large part of the body surface area (BSA), phototherapy may contribute to the healing of eczema and the relief of atopic pruritus. As to systemic therapies, several approved biologics (dupilumab, tralokinumab) and small molecules (baricitinib, upadacitinib, abrocitinib) lead to a rapid improvement of pruritus by interfering with the signal transduction of proinflammatory cytokines. While Janus kinase inhibitors initially lead to a faster relief of pruritus than biologics, the antipruritic efficacy of biologics and Janus kinase inhibitors seems to be similar in long-term use.
Keywords: Atopic itch, Therapy recommendation, Biologics, Janus-kinase inhibitors
Pruritus wurde bereits vor mehr als 40 Jahren in den Diagnosekriterien der atopischen Dermatitis (AD) von Hanifin und Rajka als Hauptkriterium definiert [17]. Fast jeder Patient mit AD (91 %) leidet täglich unter Jucken [10, 47], was eine starke Belastung darstellt.
91 % der AD-Patienten leiden täglich unter Pruritus
Schlaf und Lebensqualität sind signifikant beeinträchtigt; das Auftreten von Depressionen, Ängsten und suizidalem Verhalten ist vermehrt beschrieben [21].
Charakteristika des Pruritus bei AD
Atopischer Pruritus wird häufig von Schmerzen und neuropathischen Sensationen (z. B. Brennen, Hitzegefühl) begleitet [47].
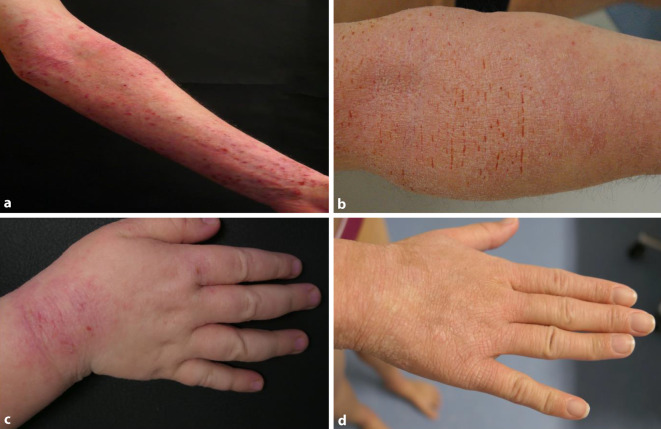
Bei einem Schub kommt es zu Pruritus, v. a. im Bereich der Kopf-Hals-Region, an Ellen- und Kniebeugen sowie den Unterarmen, dem oft direkt eine Kratzantwort folgt [18, 47]. Im Krankheitsverlauf kann der initial akute Pruritus chronifizieren; permanentes Kratzen kann zur Lichenifizierung der Ekzeme führen (Abb. 1; [55]).
Bei den meisten Patienten mit AD liegt generalisierter Pruritus vor [47], der intermittierend insbesondere abends auftritt, seltener kontinuierlich verläuft und auch auf nichtläsionaler Haut vorkommt [18, 47]. Auch nach dem Abklingen der Ekzeme kann der Pruritus persistieren.
Triggerfaktoren des Pruritus sind Hauttrockenheit, Hitze und Schwitzen, Stress, Typ-I-Sensibilisierungen sowie Kratzen [47]. Eine temporäre Linderung kann durch kaltes Wasser erreicht werden [18]. Patienten mit schwerer AD leiden unter einer höheren Krankheitslast mit stärkerem Pruritus als Patienten mit gering- oder mittelgradiger AD [8]. Pruritusintensität und Kratzhäufigkeit korrelieren positiv miteinander [10].
Messung von Pruritus in klinischen Studien und im Alltag
Derzeit ist Pruritus nicht objektiv messbar. Zur Beurteilung des Pruritus bzw. zur Bewertung des Pruritusverlaufs in klinischem Alltag und in klinischen Studien haben sich patientenseitige, monodimensionale Skalen bewährt [49]. Die vergleichende Bewertung der Pruritusreduktion in klinischen Studien wird allerdings aus den folgenden Gründen erschwert:
- Eine Standardisierung der Messung von Pruritus ist noch nicht global etabliert [49].
-
Es werden unterschiedliche Messinstrumente zur Erfassung der Pruritusintensität eingesetzt bzw. teils findet Pruritus nur als Begleitsymptom zusammengesetzter Gesamtscores zur Beurteilung von Krankheitsaktivität und Schweregrad der AD Berücksichtigung. Zu den Messinstrumenten zählen unter anderemVAS (visuelle Analogskala): Bewertung der Pruritusintensität zwischen 0 (kein Pruritus) und 10 (stärkster Pruritus) durch Einzeichnen auf einer 10 cm langen GeradeNRS (numerische Analogskala): numerische Bewertung des Pruritus auf einer Skala zwischen 0 (kein Pruritus) und 10 (schwerster Pruritus)SCORAD (Scoring Atopic Dermatitis): Erhebung des Pruritus der letzten 3 Tage auf einer VAS als Teil eines Gesamtscores [49]
- Die unterschiedlichen Messinstrumente werden in Bezug zu unterschiedlichen Zeitpunkten gesetzt [49].
- Die Studiendauern sind unterschiedlich gewählt, sodass die Pruritusreduktionen an den Endpunkten nicht unmittelbar vergleichbar sind (Tab. 1).
-
Umfangreiche Head-to-Head-Studien, in denen die unterschiedlichen Präparate hinsichtlich Effektivität, Langzeitwirkung und Sicherheit untersucht werden, fehlen noch.
| Dimension | Synonyme | Bezugszeitpunkt | Einsatz in klinischen Studien (Prüfpräparate) |
|---|---|---|---|
| Pruritus NRS: schwerster | „Peak pruritus NRS“ (PP-NRS) | Letzte 24 h |
LIBERTY AD SOLO 1 und 2 (Dupilumab) [44] NCT02780167, JADE MONO‑1 und JADE MONO‑2 (Abrocitinib) [39, 40] |
| „Worst daily pruritus NRS“ | Letzte 24 h |
ECZTRA 1 und 2 (Tralokinumab) [53] BREEZE-AD 1 und 2 (Baricitinib) [45] |
|
| „Itch NRS“ | Letzte 24 h | ECZTRA 1 und 2 (Tralokinumab) [53] | |
| „Pruritus NRS“ | Letzte 24 h | AD Up (Upadacitinib und TCS) [35] | |
| „Average worst daily pruritus NRS“ | Letzte 24 h | Heads Up (Upadacitinib vs. Dupilumab) [7] | |
| „Weekly average worst pruritus NRS“ (WP-NRS) | Letzte Woche | Measure Up 1 und 2 (Upadacitinib) [15] | |
| „Worst pruritus NRS (weekly average)“ | Letzte Woche | ||
| „Weekly worst pruritus NRS (weekly WP-NRS)“ | Letzte Woche |
NRS „numerical rating scale“ (0–10), TCS topische Kortikosteroide
Einen Überblick über eingesetzte Instrumente zur Messung des Pruritus im Rahmen der RCTs („randomized controlled trials“) zu zugelassenen immunmodulierenden Therapien gibt Tab. 1.
Multimodales Therapiekonzept
Bei atopischem Pruritus ist eine schrittweise Therapie empfehlenswert, die das gesamte Spektrum von Emollienzien bis hin zu immunmodulierenden Systemtherapien umfassen kann [30]. Der Einsatz weiterer pruritusreduzierender Präparate (z. B. Gabapentinoide, Antidepressiva, Opioidmodulatoren) erfolgt bei AD im Off-label-Use. Supportiv sollten Patientenedukation, die z. B. im Rahmen von Schulungen angeboten wird, Stressreduktion und die Behandlung assoziierter Komorbiditäten erfolgen [52].
Hinsichtlich der Empfehlungen wird Bezug genommen auf die aktuelle gemeinsame europäische Konsensusleitlinie zur Therapie der AD von European Dermatology Forum (EDF), European Academy of Dermatology and Venereology (EADV), European Academy of Allergy and Clinical Immunology (EAACI) et al. [52]. Der Fokus dieses Beitrags liegt auf in Europa verfügbaren Therapien. Bezüglich derzeit in klinischer Erprobung befindlicher Präparate sei auf verfügbare Reviews verwiesen.
Antipruritische Lokaltherapien
Die konsequente Basispflege ist ein zentrales Therapieelement. Topische Kortikosteroide (TCS) können läsional sowohl in der Schubtherapie intensiviert als auch in der Erhaltungstherapie proaktiv eingesetzt werden und führen nicht nur zu einer Abheilung von Ekzemen, sondern auch zu einer Reduktion von Pruritus und Schlafbeeinträchtigung. Neben der geeigneten Galenik sollte die Therapie auf Patientenalter, Körperareale und betroffene Körperoberfläche („body surface area“, BSA) angepasst werden. Während TCS in der Schubtherapie ein- bis zweimal täglich appliziert werden sollten, reicht in der proaktiven Therapie die Anwendung zweimal wöchentlich. Eine Dosisreduktion der TCS sollte erst nach deutlicher Besserung des Pruritus erfolgen [52]. TCS können zudem unter feuchter Okklusion in Form von „wet wraps“ angewendet werden und führen durch einen kühlenden positiven Nebeneffekt ebenfalls zur Pruritusreduktion [30].
Die topischen Calcineurininhibitoren (TCI) Pimecrolimus und Tacrolimus können ebenfalls sowohl in der Akut- als auch in der Erhaltungstherapie eingesetzt werden. Ring et al. zeigten bereits 2008, dass nach einer Anwendungsphase von Pimecrolimus 1 % über 3 Monate zweimal täglich bzw., bei stabilem Hautbefund, bedarfsweise etwa jeder dritte Patient keinen Pruritus und etwa jeder zweite Patient nur noch milden Pruritus angab [37].
Die TCS-Dosis sollte erst nach deutlicher Besserung des Pruritus reduziert werden
Neben TCS und TCI bieten kühlende Externa und Lokalanästhetika wie Polidocanol eine gute Therapieergänzung mit potenzieller Prurituslinderung [37, 47].
Bisher klassische Balneotherapeutika bei AD, d. h., rückfettende Ölbäder, ggf. mit Zusatz von Lokalanästhetika, und Bleichebäder („bleach bath“), könnten zukünftig um probiotische Teilbäder erweitert werden, bei denen ebenfalls eine signifikante Pruritusreduktion beobachtet wurde [3].
Antipruritische Effekte sind für den Einsatz von Phototherapie bei AD beschrieben (UVB-311 nm, PUVA, UVA‑1; [13]), UVB-311 nm scheint dabei am effektivsten [36].
Antihistaminika: zurückhaltend empfohlen bei fehlendem Wirksamkeitsnachweis
Der Einsatz von H1-Antihistaminika (H1-AH) wird weiterhin kontrovers betrachtet, obwohl sie am häufigsten in der Pruritustherapie der AD eingesetzt werden und häufig in der klinischen Beobachtung prurituslindernde Effekte erzielen [51]. Drei systematische Cochrane-Reviews zeigen, dass der Einsatz von H1-AH allein [2, 50] bzw. in Kombination mit topischer Therapie [24] keine besondere antipruritische Wirksamkeit erreicht. Daher wird ihr Einsatz in der Leitlinie nicht generell empfohlen, kann aber bei insuffizienter Prurituslinderung unter topischer Therapie (TCS, Emollienzien) erwogen werden [52].
H1-AH der ersten Generation (z. B. Hydroxyzin, Clemastin) können bei erwachsenen Patienten mit AD bedingt durch ihre sedierende Wirkung additiv bei Schlafbeeinträchtigung eingesetzt werden [52].
Gabapentinoide bei Pruritus mit neuropathischen Sensationen
Die genaue antipruritische Wirksamkeit von Gabapentinoiden (Gabapentin, Pregabalin) ist bisher noch nicht vollständig aufgedeckt; eine Modulation von Juckreizwahrnehmung und eine reduzierte neuronale Hypersensibilisierung durch Interaktionen in Neuronen im Hinterhorn des Rückenmarks werden angenommen [23]. Gabapentinoide können v. a. bei AD mit zusätzlichen neuropathischen Sensationen oder Schmerzen trotz fehlender Leitlinienempfehlung oder RCTs in der üblichen Dosierung erwogen werden [30]. Eine genaue Aufklärung der Patienten insbesondere über Nebenwirkungen ist notwendig.
Opioidmodulatoren: sinnvolle Ergänzung bei starker Pruritusintensität
Prurituslindernde Wirkungen bei AD sind für Nalmefen [26] und Naltrexon beschrieben [12, 22]; ihr Routineeinsatz wird in der derzeitigen Leitlinie allerdings nicht empfohlen [52].
Anders als bei nephrogenem und cholestatischem Pruritus [4, 31] fehlt bezüglich des intravenösen Einsatzes von Naloxon bei AD noch Evidenz. Allerdings kann die Therapie im Off-label-Einsatz gerade bei AD-Patienten mit neuropathischen Prurituscharakteristika gemäß der klinischen Erfahrungen der Autoren erfolgreich additiv eingesetzt werden.
Opioidmodulierende Therapien können v. a. bei oraler Applikation zu Übelkeit, Müdigkeit und Kopfschmerzen führen [12].
Antidepressiva können pruritusdistanzierend und schlaffördernd wirken
Die selektiven Serotoninwiederaufnahmehemmer (SSRI) Paroxetin und Fluvoxamin werden leitliniengerecht nicht für den Routineeinsatz zur Pruritustherapie bei AD empfohlen [52], obwohl eine effektive antipruritische Wirksamkeit bestätigt werden konnte [48].
Das tetrazyklische Antidepressivum Mirtazapin kann v. a. nächtliches Jucken bei Erwachsenen reduzieren und schlaffördernd wirken [19].
Systemische Kortikosteroide in der Langzeittherapie: keine Empfehlung
Systemische Kortikosteroide können zwar kurzzeitig zur Behandlung der AD eingesetzt werden und führen auch zu einer starken Pruritusreduktion [25]. Sie sollten aber aufgrund von unerwünschten Arzneimittelwirkungen (UAWs) bei der AD nur kurzzeitig eingesetzt werden, z. B. in der Schubtherapie [30].
Immunsuppressiva: noch State of the Art?
Ciclosporin A und Dupilumab könnten effektiver für die Behandlung der AD bei erwachsenen Patienten sein als die Behandlungen mit Methotrexat oder Azathioprin (Beobachtungszeitraum 16 Wochen). Mycophenolatmofetil (1440 mg) und Ciclosporin A (3 mg/kg täglich) schienen bei schwerer AD gleichwertig in der Erhaltungstherapie über 30 Wochen zu sein [16].
Bei schwerer AD führte die Therapie mit Methotrexat (10–22,5 mg/Woche) bzw. Azathioprin (1,5–2,5 mg/kgKG/Tag) über 12 Wochen zu einer gleichwertigen Pruritusreduktion [38].
Unter dem Aspekt ihrer UAWs sollte der Einsatz von Immunsuppressiva gut überlegt werden
Aufgrund des erhöhten Risikos potenzieller unerwünschter Arzneimittelwirkungen bei allen immunsuppressiven Therapien mit zunehmender Therapiedauer sowie einer erhöhten Infektanfälligkeit – gerade vor dem Hintergrund der SARS-CoV-2(„severe acute respiratory syndrome coronavirus 2“)-Pandemie – sollte nach unserer Meinung der Einsatz der genannten Immunsuppressiva gut überlegt werden.
Neue immunmodulierende Therapien
Das Repertoire immunmodulierender Therapien hat in den letzten Jahren rasant zugenommen. Mehrere Biologika und Januskinase-Inhibitoren sind bereits zugelassen bzw. werden derzeit klinisch erprobt. Einen ausführlichen Überblick über die Ergebnisse der Prurituslinderung derzeit in Europa verfügbaren Systemtherapien in den vorherigen klinischen Studien gibt Tab. 2. Langzeit- und Anwendungsbeobachtungen sind jedoch bis dato begrenzt.
| Wirkstoff (Target), Applikation | Zulassung bei AD-Pat. | Dosierung (Erwachsene) | Beginn der Pruritusreduktion | Ausmaß der Pruritusreduktion |
|---|---|---|---|---|
| Biologika | ||||
| Dupilumab (IL-4/-13), s.c. | Pat. ≥ 6–11 J mit schwerer AD und Pat. ≥ 12 J und Erwachsene mit mittelschwerer und schwerer AD |
Einleitung: < 60 kg: 2 × 200 mg ≥ 60 kg: 2 × 300 mg Erhaltung: (Q2W) < 60 kg: 200 mg ≥ 60 kg: 300 mg |
LIBERTY AD SOLO 1: Signifikante Verbesserung des „peak pruritus (NRS)“ ≥ 4 Punkte unter Dupilumab 300 mg Q2W nach 2 Wochen [44] Signifikante Besserung des „peak pruritus NRS“ an Tag 2 unter Dupilumab 300 mg [9] |
LIBERTY AD SOLO 1 und 2: Verbesserung des „peak pruritus (NRS)“ ≥ 3 Punkte unter Dupilumab Q2W nach 16 Wochen bei 47 % der Pat. (LIBERTY AD SOLO 1) bzw. 51 % der Pat. (LIBERTY AD SOLO 2) [44] Bewertung des Pruritus nach 16 Wochen unter Dupilumab Q2W als „kein oder milder Pruritus“: 51,9 % der Pat. „moderater Pruritus“: 22,3 % der Pat. „schwerer Pruritus“: 5,7 % der Pat. [9] |
| Tralokinumab (IL-13), s.c. | Erwachsene mit mittelschwerer und schwerer AD |
Einleitung: 4 × 150 mg Erhaltung: 2 × 150 mg Q2W bzw. Reduktion auf 2 × 150 mg Q4W nach 16-wöchiger Behandlung bei (fast) erscheinungsfreier Haut |
ECZTRA 1 und 2: Signifikante Verbesserung des „worst daily pruritus NRS“ unter Tralokinumab 300 mg Q2W ab Woche 1 (p < 0,01) [53] |
ECZTRA 1, 2 und 3: Signifikante Verbesserungen des „weekly average of worst daily pruritus NRS“ um ≥ 4 Punkte unter Tralokinumab 300 mg Q2W nach 16 Wochen bei 20 % (ECZTRA 1), 25 % (ECZTRA 2) bzw. 45,4 % (ECZTRA 3, mit TCS) der Pat. [41, 53] |
| Small molecules | ||||
| Baricitinib (JAK-1/-2), p.o. | Erwachsene mit mittelschwerer und schwerer AD |
4 mg einmal tgl. 2 mg einmal tgl. bei: Pat. ≥ 75 J, Pat. mit chronischen oder rezidivierenden Infekten in der Anamnese, Pat. mit Kreatininclearance 30–60 ml/min |
BREEZE-AD1 und BREEZE-AD2 [45] Verbesserung des „Itch NRS“ in Woche 1 (4 mg) Woche 2 (2 mg) [45] BREEZE-AD7 [34] Signifikante Besserung des „Itch NRS“ ≥ 4 Punkte ggü. Placebo an Tag 4 |
Baricitinib 4 mg −36,6 % bzw. −47,2 % Verbesserung des „Itch NRS“ ggü. Baseline (BREEZE AD‑1 bzw. -2) nach 16 Wochen [33] Baricitinib 2 mg −29,4 % bzw. −46,9 % Verbesserung des „Itch NRS“ ggü. Baseline (BREEZE AD‑1 bzw. -2) nach 16 Wochen [33] |
|
Upadacitinib (JAK1 > JAK2, JAK3, TYK2), p.o. |
Pat. ≥ 12 J und Erwachsene mit mittelschwerer und schwerer AD |
30 mg einmal tgl.: Pat. mit hoher Krankheitslast 15 mg einmal tgl.: Pat. ≥ 65 J, Pat. mit Niereninsuffizienz |
Measure Up 1 und Measure Up 2 [15] Besserung des WP-NRS um ≥ 4 Punkte ggü. Baseline an Tag 2 (30 mg) bzw. Tag 3 (15 mg) |
Upadacitinib 30 mg + TCS (AD Up) [35] Verbesserung des WP-NRS an Woche 16 im Vergleich zum Baseline-Wert: − 66,9 % Upadacitinib 15 mg + TCS (AD Up) [35] Verbesserung des WP-NRS an Woche 16 im Vergleich zum Baseline-Wert: −58,1 % |
| Abrocitinib (JAK-1), p.o. | Erwachsene mit mittelschwerer und schwerer AD |
200 mg einmal tgl. 100 mg einmal tgl.: Pat. ≥ 65 J |
Phase-IIb-RCT (NCT02780167) Besserung des Pruritus NRS unter Abrocitinib an Tag 2 (200 mg) bzw. Tag 3 (100 mg) [46] |
NCT02780167, JADE MONO‑1 und -2 Besserung des Pruritus NRS bzw. des PP-NRS um ≥ 4 Punkte von 57,3 % (200 mg) bzw. 42,9 % (100 mg) an Woche 12 [40] (fast) pruritusfreie Pat. an Woche 12: 36,6 % (200 mg) bzw. 23,4 % (100 mg) [40] |
AD atopische Dermatitis, IL Interleukin, J Jahre, JAK Januskinase, NRS „numerical rating scale“, Pat. Patienten, PP „peak pruritus“, Q2W „once every 2 weeks“,Q4W „once every 4 weeks“, RCT „randomized controlled trial“, TCS topische Kortikosteroide, WP „worst pruritus“
Biologika: Dupilumab und Tralokinumab
Dupilumab, das die α‑Kette des IL(Interleukin)-4-Rezeptors blockiert, ist seit 2017 zur Behandlung der AD zugelassen. Bei schwerer AD mit starkem Pruritus wird das Biologikum als Therapie der ersten Wahl empfohlen [30]. Die antipruritische Wirksamkeit und die Sicherheit wurden in mehreren RCTs mit hohem Evidenzlevel für Jugendliche und Erwachsene (auch ≥ 65 Jahre) nachgewiesen [28, 29]. Signifikante Verbesserungen des Pruritus wurden nach 1–2 [43, 44] bzw. 16 Wochen gemessen [1, 27]. In Woche 16 gaben ca. 50 % der mit Dupilumab behandelten Patienten an, keinen oder nur noch milden Pruritus zu verspüren [9]. Die häufigsten UAWs waren Konjunktivitis und Reaktionen an der Injektionsstelle [1, 44].
Tralokinumab, ein monoklonaler IL-13-Antikörper, verhindert über die Bindung von IL-13 die Interaktion des Zytokins und seinen Rezeptoren (Heterodimer aus der α‑Kette des IL-4-Rezeptors und der IL-13-α1-Kette; IL-13-α2-Kette als „decoy receptor“; [54]). Eine Besserung des stärksten täglichen Pruritus (NRS) wurde bereits ab Woche 1 beobachtet [53]. Eine statistisch signifikante Besserung desselben um mehr als 4 Punkte wurde bei bis zu 25 % der mit Tralokinumab behandelten Patienten an Woche 16 festgestellt [53]. Zu den häufigsten UAWs zählen obere Atemwegsinfekte sowie Konjunktivitis [14, 41, 53].
Small molecules: Abrocitinib, Baricitinib, Upadacitinib
Für die Therapie der mittelschweren und schweren AD bei Erwachsenen sind in Europa aktuell Abrocitinib und Upadacitinib, beide Januskinase-1(JAK1)-Inhibitoren, sowie Baricitinib (v. a. JAK1-/2-Inhibitor) zugelassen [5, 20]. Die Januskinase-Inhibitoren zeigen eine große Effektivität mit wahrscheinlich bisher vergleichsweise einer der schnellsten Pruritusreduktionen (Therapieansprechen innerhalb weniger Tage), wobei der Einsatz im klinischen Alltag bei einigen Patienten ggf. mit Sicherheitsbedenken verbunden ist [32].
Unter Baricitinib wurde eine signifikante Verbesserung des Pruritus (NRS) um bis zu 50 % nach 16 Wochen verzeichnet [33].
Bei der Testung von Upadacitinib (15 vs. 30 mg) mit TCS erreichten bis zu ca. 64 % der Patienten (30-mg-Gruppe) eine Besserung des Pruritus um mehr als 4 Punkte an Woche 16 [35].
In den gepoolten Daten zu Abrocitinib wurde eine Besserung des Pruritus um mehr als 4 Punkte von bis zu 57 % (200-mg-Gruppe) an Woche 12 erzielt [40]. Bis zu 37 % der Patienten (Abrocitinib 200 mg) erreichten eine (nahezu) komplette Pruritusfreiheit im Vergleich zu Placebo [40].
Zu den häufigsten UAWs der Januskinase-Inhibitoren zählten Infektionen der oberen Atemwege, Nasopharyngitis, Follikulitis, Akne und Kopfschmerzen [34, 35, 40].
Vergleichende Bewertung zugelassener Small molecules und Biologika hinsichtlich der Pruritusreduktion
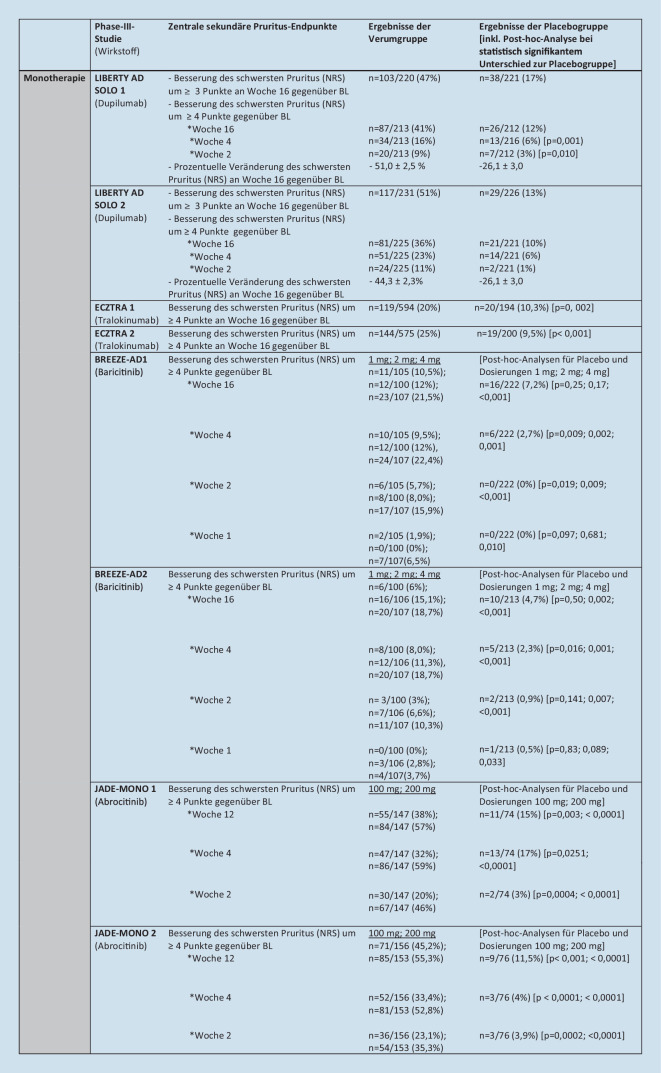
Der Vergleich zugelassener Small molecules und Biologika bei AD hinsichtlich der Pruritusreduktion ist bisher aufgrund fehlender umfangreicher Head-to-Head-Studien sowie fehlender Langzeitbeobachtungen unter Real-World-Bedingungen nur eingeschränkt möglich. Zum aktuellen Zeitpunkt liegen lediglich 2 Head-to-Head-Studien, in denen Upadacitinib (Heads Up) bzw. Abrocitinib (JADE COMPARE) mit Dupilumab unmittelbar verglichen werden [6, 7]. Darüber hinaus sind Netzwerkmetaanalysen verfügbar, in denen angenommen wird, dass Upadacitinib 30 mg einmal täglich und Abrocitinib 200 mg einmal täglich gegenüber Dupilumab 300 mg Q2W („once every 2 weeks“) den schwersten Pruritus (NRS) effektiver zu reduzieren vermögen [11, 42]. Eine Übersicht über zentrale sekundäre Endpunkte hinsichtlich der Pruritusreduktion der bisher zugelassenen Therapien in ihren zugehörigen ausgewählten Phase-III-Studien gibt Abb. 2.
In der Studie Heads Up wurden Upadacitinib (30 mg täglich) und Dupilumab (300 mg Q2W) bei erwachsenen Patienten verglichen [7]. Hinsichtlich des schwersten Pruritus (NRS) im Vergleich zur Baseline wurde für Upadacitinib eine signifikant stärkere durchschnittliche prozentuale Verbesserung bereits in Woche 1 (−31,4 %) gegenüber Dupilumab (−8,8 %) beobachtet (p < 0,01; [7]). Die signifikanten Unterschiede blieben auch an Woche 16 erhalten (Besserung unter Upadacitinib um 66,9 % vs. unter Dupilumab um 49 %; p < 0,01; [7]). Während unter Upadacitinib zunächst eine sehr rasche Pruritusreduktion festgestellt werden konnten, so wurde ebenfalls gezeigt, dass unter Dupilumab mit zunehmender Therapiedauer eine stetige Annäherung an Upadacitinib erfolgte (zum Vergleich: an Woche 24 erreichten 63 % der Patienten unter Upadacitinib eine Besserung des schwersten Pruritus sowie 55 % der Patienten unter Dupilumab, p = 0,03; [7]).
Auch Abrocitinib (200 mg p.o.) zeigte im Vergleich zu Dupilumab 300 mg Q2W s.c. zunächst eine deutliche Überlegenheit hinsichtlich der schnellen Besserung des schwersten Pruritus (NRS) um ≥ 4 Punkte [6]. Der Endpunkt wurde von ca. 32 bzw. 49 % der Patienten unter Abrocitinib (100 bzw. 200 mg) bzw. ca. 26 % unter Dupilumab an Woche 2 erreicht [6]. Auch in dieser Vergleichsstudie wurde gezeigt, dass sich die Pruritusreduktion beider Wirkstoffe mit zunehmender Behandlungsdauer anzugleichen scheint; ab Tag 57 bzw. noch deutlicher an den Tagen 85 bzw. 113 erreichten annähernd gleich viele Patienten eine Besserung des schwersten Pruritus (NRS) um ≥ 4 Punkte [6].
Während bei den Januskinase-Inhibitoren dementsprechend von einer schnelleren Pruritusreduktion ausgegangen werden kann, könnte es durchaus sein, dass sich Dupilumab, Upadacitinib und Abrocitinib bezüglich ihrer antipruritischen Wirksamkeit im Langzeitverlauf nicht signifikant unterscheiden [6, 7].
Empfehlungen für die Praxis
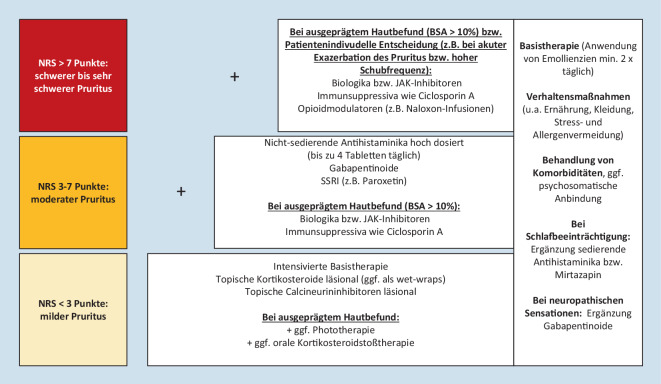
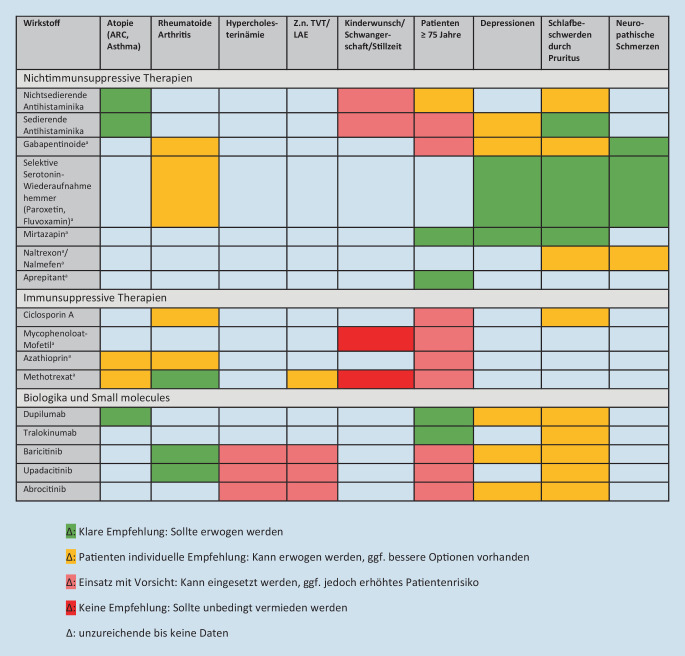
Basierend auf unserer klinischen Erfahrung haben wir eine stufenweise Therapieempfehlung erstellt, die eine Unterstützung bei der Auswahl geeigneter Therapien in Abhängigkeit von durchschnittlicher Pruritusintensität der letzten 24 h (NRS) und Hautbefund (Ausdehnung anhand der BSA) geben soll (Abb. 3). Einige Präparate, die zur Pruritustherapie eingesetzt werden, können günstige Effekte auf weitere Komorbiditäten (z. B. Depressionen, Asthma, rheumatoide Arthritis) haben bzw. sollten bei vulnerablen Patientengruppen (z. B. Schwangere, ältere Patienten) ggf. zurückhaltend eingesetzt werden. Daher haben wir auf Basis einer ausführlichen systematischen Literaturrecherche (pubmed.gov, embryotox.de), den Fachinformationen der zugelassenen Präparate sowie klinischen Erfahrung unsere Therapieempfehlungen für unterschiedliche Patientengruppen ausgearbeitet (Abb. 4).
Fazit für die Praxis
-
Den wichtigsten antipruritischen Ansatz stellt eine gute AD(atopische Dermatitis)-Therapie dar, bestehend aus Basispflege, UV- und Balneotherapien, Topika und Systemtherapien. Bei nicht ausreichender Prurituslinderung können folgende Präparate ergänzt werden:
Sedierende Antihistaminika und Mirtazapin bei Schlafbeeinträchtigung,
Gabapentinoide und Serotoninwiederaufnahmehemmer bei zusätzlichen neuropathischen Sensationen bzw. depressiven Komorbiditäten,
Opioidmodulatoren bei unbeherrschbarem, schwerstem Pruritus,
Biologika und Januskinase-Inhibitoren bei fehlender Kontrolle von Pruritus und Hautläsionen unter vorherigen Therapien.
Während Januskinase-Inhibitoren zunächst eine schnellere Pruritusreduktion zu erreichen scheinen, scheinen die Biologika im Langzeitverlauf der Therapie aufzuholen und eine vergleichbare Wirkung zu erreichen. Umfangreiche Head-to-Head-Studien sowie Langzeitbeobachtungen unter Real-World-Bedingungen liegen bisher nur begrenzt vor, werden aber sicherlich in Zukunft wichtige zusätzliche Informationen für die Therapie des Pruritus bei AD liefern.
Einhaltung ethischer Richtlinien
Interessenkonflikt
S. Müller, F. Witte und S. Ständer geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Agache I, Song Y, Posso M, et al. Efficacy and safety of dupilumab for moderate-to-severe atopic dermatitis: a systematic review for the EAACI biologicals guidelines. Allergy. 2021;76(1):45–58. doi: 10.1111/all.14510. [DOI] [PubMed] [Google Scholar]
- 2.Apfelbacher CJ, van Zuuren EJ, Fedorowicz Z, et al. Oral H1 antihistamines as monotherapy for eczema. Cochrane Database Syst Rev. 2013;2:CD007770. doi: 10.1002/14651858.CD007770.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Axt-Gadermann M, Chudomirova K, Noll M. Probiotische Teilbäder bei atopischer Dermatitis. Hautarzt. 2021;72(6):549–556. doi: 10.1007/s00105-021-04789-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Bergasa NV, Talbot TL, Alling DW, et al. A controlled trial of naloxone infusions for the pruritus of chronic cholestasis. Gastroenterology. 1992;102(2):544–549. doi: 10.1016/0016-5085(92)90102-5. [DOI] [PubMed] [Google Scholar]
- 5.Bieber T. Atopic dermatitis: an expanding therapeutic pipeline for a complex disease. Nat Rev Drug Discov. 2022;21(1):21–40. doi: 10.1038/s41573-021-00266-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Bieber T, Simpson EL, Silverberg JI, et al. Abrocitinib versus placebo or dupilumab for atopic dermatitis. N Engl J Med. 2021;384(12):1101–1112. doi: 10.1056/NEJMoa2019380. [DOI] [PubMed] [Google Scholar]
- 7.Blauvelt A, Teixeira HD, Simpson EL, et al. Efficacy and safety of upadacitinib vs dupilumab in adults with moderate-to-severe atopic dermatitis: a randomized clinical trial. JAMA Dermatol. 2021;157(9):1047–1055. doi: 10.1001/jamadermatol.2021.3023. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.de Bruin-Weller M, Pink AE, Patrizi A, et al. Disease burden and treatment history among adults with atopic dermatitis receiving systemic therapy: baseline characteristics of participants on the EUROSTAD prospective observational study. J Dermatolog Treat. 2021;32(2):164–173. doi: 10.1080/09546634.2020.1866741. [DOI] [PubMed] [Google Scholar]
- 9.Cork MJ, Eckert L, Simpson EL, et al. Dupilumab improves patient-reported symptoms of atopic dermatitis, symptoms of anxiety and depression, and health-related quality of life in moderate-to-severe atopic dermatitis: analysis of pooled data from the randomized trials SOLO 1 and SOLO 2. J Dermatolog Treat. 2020;31(6):606–614. doi: 10.1080/09546634.2019.1612836. [DOI] [PubMed] [Google Scholar]
- 10.Dawn A, Papoiu ADP, Chan YH, et al. Itch characteristics in atopic dermatitis: results of a web-based questionnaire. Br J Dermatol. 2009;160(3):642–644. doi: 10.1111/j.1365-2133.2008.08941.x. [DOI] [PubMed] [Google Scholar]
- 11.Drucker AM, Ellis AG, Bohdanowicz M, Mashayekhi S, Yiu ZZN, Rochwerg B, Di Giorgio S, Arents BWM, Burton T, Spuls PI, Küster D, Siegels D, Schmitt J, Flohr C. Systemic Immunomodulatory Treatments for Patients With Atopic Dermatitis: A Systematic Review and Network Meta-analysis. JAMA Dermatol. 2020;156(6):659–667. doi: 10.1001/jamadermatol.2020.0796. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Ekelem C, Juhasz M, Khera P, Mesinkovska NA. Utility of naltrexone treatment for chronic inflammatory dermatologic conditions: a systematic review. JAMA Dermatol. 2019;155(2):229–236. doi: 10.1001/jamadermatol.2018.4093. [DOI] [PubMed] [Google Scholar]
- 13.Garritsen FM, Brouwer MWD, Limpens J, et al. Photo(chemo)therapy in the management of atopic dermatitis: an updated systematic review with implications for practice and research. Br J Dermatol. 2014;170(3):501–513. doi: 10.1111/bjd.12645. [DOI] [PubMed] [Google Scholar]
- 14.Gutermuth J, Pink AE, Worm M, et al. Tralokinumab plus topical corticosteroids in adults with severe atopic dermatitis and inadequate response to or intolerance of ciclosporin A: a placebo-controlled, randomized, phase III clinical trial (ECZTRA 7) Br J Dermatol. 2022;186(3):440–452. doi: 10.1111/bjd.20832. [DOI] [PubMed] [Google Scholar]
- 15.Guttman-Yassky E, Teixeira HD, Simpson EL, et al. Once-daily upadacitinib versus placebo in adolescents and adults with moderate-to-severe atopic dermatitis (measure up 1 and measure up 2): results from two replicate double-blind, randomised controlled phase 3 trials. Lancet. 2021;397(10290):2151–2168. doi: 10.1016/S0140-6736(21)00588-2. [DOI] [PubMed] [Google Scholar]
- 16.Haeck IM, Knol MJ, Ten Berge O, et al. Enteric-coated mycophenolate sodium versus cyclosporin A as long-term treatment in adult patients with severe atopic dermatitis: a randomized controlled trial. J Am Acad Dermatol. 2011;64(6):1074–1084. doi: 10.1016/j.jaad.2010.04.027. [DOI] [PubMed] [Google Scholar]
- 17.Hanifin JM, Rajka G. Diagnostic features of atopic dermatitis. Acta Derm Venereol Suppl (Stockh) 1980;92:44–47. [Google Scholar]
- 18.Huet F, Faffa M-S, Poizeau F, et al. Characteristics of pruritus in relation to self-assessed severity of atopic dermatitis. Acta Derm Venereol. 2019;99(3):279–283. doi: 10.2340/00015555-3053. [DOI] [PubMed] [Google Scholar]
- 19.Hundley JL, Yosipovitch G. Mirtazapine for reducing nocturnal itch in patients with chronic pruritus: a pilot study. J Am Acad Dermatol. 2004;50(6):889–891. doi: 10.1016/j.jaad.2004.01.045. [DOI] [PubMed] [Google Scholar]
- 20.Klein B, Treudler R, Simon JC. JAK-inhibitors in dermatology—small molecules, big impact? Overview of the mechanism of action, previous study results and potential adverse effects. J Dtsch Dermatol Ges. 2022;20(1):19–24. doi: 10.1111/ddg.14668. [DOI] [PubMed] [Google Scholar]
- 21.Legat FJ. Itch in atopic dermatitis—what is new? Front Med (Lausanne) 2021;8:644760. doi: 10.3389/fmed.2021.644760. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Malekzad F, Arbabi M, Mohtasham N, et al. Efficacy of oral naltrexone on pruritus in atopic eczema: a double-blind, placebo-controlled study. J Eur Acad Dermatol Venereol. 2009;23(8):948–950. doi: 10.1111/j.1468-3083.2009.03129.x. [DOI] [PubMed] [Google Scholar]
- 23.Matsuda KM, Sharma D, Schonfeld AR, et al. Gabapentin and pregabalin for the treatment of chronic pruritus. J Am Acad Dermatol. 2016;75(3):619–625. doi: 10.1016/j.jaad.2016.02.1237. [DOI] [PubMed] [Google Scholar]
- 24.Matterne U, Böhmer MM, Weisshaar E, et al. Oral H1 antihistamines as ‘add-on’ therapy to topical treatment for eczema. Cochrane Database Syst Rev. 2019;1:CD012167. doi: 10.1002/14651858.CD012167.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Misery L, Belloni Fortina A, El Hachem M, et al. A position paper on the management of itch and pain in atopic dermatitis from the international society of atopic dermatitis (ISAD)/oriented patient-education network in dermatology (OPENED) task force. J Eur Acad Dermatol Venereol. 2021;35(4):787–796. doi: 10.1111/jdv.16916. [DOI] [PubMed] [Google Scholar]
- 26.Monroe EW. Efficacy and safety of nalmefene in patients with severe pruritus caused by chronic urticaria and atopic dermatitis. J Am Acad Dermatol. 1989;21(1):135–136. doi: 10.1016/S0190-9622(89)80353-6. [DOI] [PubMed] [Google Scholar]
- 27.Paller AS, Bansal A, Simpson EL, et al. Clinically meaningful responses to dupilumab in adolescents with uncontrolled moderate-to-severe atopic dermatitis: post-hoc analyses from a randomized clinical trial. Am J Clin Dermatol. 2020;21(1):119–131. doi: 10.1007/s40257-019-00478-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Patruno C, Napolitano M, Argenziano G, et al. Dupilumab therapy of atopic dermatitis of the elderly: a multicentre, real-life study. J Eur Acad Dermatol Venereol. 2021;35(4):958–964. doi: 10.1111/jdv.17094. [DOI] [PubMed] [Google Scholar]
- 29.Patruno C, Fabbrocini G, Longo G, et al. Effectiveness and safety of long-term dupilumab treatment in elderly patients with atopic dermatitis: a multicenter real-life observational study. Am J Clin Dermatol. 2021;22(4):581–586. doi: 10.1007/s40257-021-00597-5. [DOI] [PubMed] [Google Scholar]
- 30.Pavlis J, Yosipovitch G. Management of itch in atopic dermatitis. Am J Clin Dermatol. 2018;19(3):319–332. doi: 10.1007/s40257-017-0335-4. [DOI] [PubMed] [Google Scholar]
- 31.Pereira MP, Zeidler C, Ständer S. Improvement of chronic kidney disease-associated pruritus after treatment with intravenous naloxone. JAMA Dermatol. 2021;157(11):1380–1381. doi: 10.1001/jamadermatol.2021.3829. [DOI] [PubMed] [Google Scholar]
- 32.Puar N, Chovatiya R, Paller AS. New treatments in atopic dermatitis. Ann Allergy Asthma Immunol. 2021;126(1):21–31. doi: 10.1016/j.anai.2020.08.016. [DOI] [PubMed] [Google Scholar]
- 33.Reich K, DeLozier AM, Nunes FP, et al. Baricitinib improves symptoms in patients with moderate-to-severe atopic dermatitis and inadequate response to topical corticosteroids: patient-reported outcomes from two randomized monotherapy phase III trials. J Dermatolog Treat. 2020 doi: 10.1080/09546634.2020.1839008. [DOI] [PubMed] [Google Scholar]
- 34.Reich K, Kabashima K, Peris K, et al. Efficacy and safety of baricitinib combined with topical corticosteroids for treatment of moderate to severe atopic dermatitis: a randomized clinical trial. JAMA Dermatol. 2020;156(12):1333–1343. doi: 10.1001/jamadermatol.2020.3260. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Reich K, Teixeira HD, de Bruin-Weller M, et al. Safety and efficacy of upadacitinib in combination with topical corticosteroids in adolescents and adults with moderate-to-severe atopic dermatitis (AD Up): results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2021;397(10290):2169–2181. doi: 10.1016/S0140-6736(21)00589-4. [DOI] [PubMed] [Google Scholar]
- 36.Reynolds NJ, Franklin V, Gray JC, et al. Narrow-band ultraviolet B and broad-band ultraviolet A phototherapy in adult atopic eczema: a randomised controlled trial. Lancet. 2001;357(9273):2012–2016. doi: 10.1016/S0140-6736(00)05114-X. [DOI] [PubMed] [Google Scholar]
- 37.Ring J, Abraham A, de Cuyper C, et al. Control of atopic eczema with pimecrolimus cream 1 % under daily practice conditions: results of a 2000 patient study. J Eur Acad Dermatol Venereol. 2008;22(2):195–203. doi: 10.1111/j.1468-3083.2007.02368.x. [DOI] [PubMed] [Google Scholar]
- 38.Schram ME, Roekevisch E, Leeflang MMG, et al. A randomized trial of methotrexate versus azathioprine for severe atopic eczema. J Allergy Clin Immunol. 2011;128(2):353–359. doi: 10.1016/j.jaci.2011.03.024. [DOI] [PubMed] [Google Scholar]
- 39.Silverberg JI, Simpson EL, Thyssen JP, et al. Efficacy and safety of abrocitinib in patients with moderate-to-severe atopic dermatitis: a randomized clinical trial. JAMA Dermatol. 2020;156(8):863–873. doi: 10.1001/jamadermatol.2020.1406. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Silverberg JI, Thyssen JP, Simpson EL, et al. Impact of oral abrocitinib monotherapy on patient-reported symptoms and quality of life in adolescents and adults with moderate-to-severe atopic dermatitis: a pooled analysis of patient-reported outcomes. Am J Clin Dermatol. 2021;22(4):541–554. doi: 10.1007/s40257-021-00604-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Silverberg JI, Toth D, Bieber T, et al. Tralokinumab plus topical corticosteroids for the treatment of moderate-to-severe atopic dermatitis: results from the double-blind, randomized, multicentre, placebo-controlled phase III ECZTRA 3 trial. Br J Dermatol. 2021;184(3):450–463. doi: 10.1111/bjd.19573. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Silverberg JI, Thyssen JP, Fahrbach K, Mickle K, Cappelleri JC, Romero W, Cameron MC, Myers DE, Clibborn C, DiBonaventura M. Comparative efficacy and safety of systemic therapies used in moderate-to-severe atopic dermatitis: a systematic literature review and network meta-analysis. J Eur Acad Dermatol Venereol. 2021;35(9):1797–1810. doi: 10.1111/jdv.17351. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Simpson EL, Gadkari A, Worm M, et al. Dupilumab therapy provides clinically meaningful improvement in patient-reported outcomes (PRos): a phase IIb, randomized, placebo-controlled, clinical trial in adult patients with moderate to severe atopic dermatitis (AD) J Am Acad Dermatol. 2016;75(3):506–515. doi: 10.1016/j.jaad.2016.04.054. [DOI] [PubMed] [Google Scholar]
- 44.Simpson EL, Bieber T, Guttman-Yassky E, et al. Two phase 3 trials of dupilumab versus placebo in atopic dermatitis. N Engl J Med. 2016;375(24):2335–2348. doi: 10.1056/NEJMoa1610020. [DOI] [PubMed] [Google Scholar]
- 45.Simpson EL, Lacour J-P, Spelman L, et al. Baricitinib in patients with moderate-to-severe atopic dermatitis and inadequate response to topical corticosteroids: results from two randomized monotherapy phase III trials. Br J Dermatol. 2020;183(2):242–255. doi: 10.1111/bjd.18898. [DOI] [PubMed] [Google Scholar]
- 46.Simpson EL, Wollenberg A, Bissonnette R, et al. Patient-reported symptoms and disease impacts in adults with moderate-to-severe atopic dermatitis: results from a phase 2b study with abrocitinib. Dermatitis. 2021;32(1S):S53–S61. doi: 10.1097/DER.0000000000000725. [DOI] [PubMed] [Google Scholar]
- 47.Ständer S. Atopic dermatitis. N Engl J Med. 2021;384(12):1136–1143. doi: 10.1056/NEJMra2023911. [DOI] [PubMed] [Google Scholar]
- 48.Ständer S, Böckenholt B, Schürmeyer-Horst F, et al. Treatment of chronic pruritus with the selective serotonin re-uptake inhibitors paroxetine and fluvoxamine: results of an open-labelled, two-arm proof-of-concept study. Acta Derm Venereol. 2009;89(1):45–51. doi: 10.2340/00015555-0553. [DOI] [PubMed] [Google Scholar]
- 49.Vakharia PP, Cella D, Silverberg JI. Patient-reported outcomes and quality of life measures in atopic dermatitis. Clin Dermatol. 2018;36(5):616–630. doi: 10.1016/j.clindermatol.2018.05.011. [DOI] [PubMed] [Google Scholar]
- 50.van Zuuren EJ, Apfelbacher CJ, Fedorowicz Z, et al. No high level evidence to support the use of oral H1 antihistamines as monotherapy for eczema: a summary of a Cochrane systematic review. Syst Rev. 2014;3:25. doi: 10.1186/2046-4053-3-25. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Weisshaar E. Antihistaminika bei Pruritus : Das Ende einer Ära? Hautarzt. 2020;71(7):525–527. doi: 10.1007/s00105-020-04617-z. [DOI] [PubMed] [Google Scholar]
- 52.Wollenberg A, Barbarot S, Bieber T, et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J Eur Acad Dermatol Venereol. 2018;32(5):657–682. doi: 10.1111/jdv.14891. [DOI] [PubMed] [Google Scholar]
- 53.Wollenberg A, Blauvelt A, Guttman-Yassky E, et al. Tralokinumab for moderate-to-severe atopic dermatitis: results from two 52-week, randomized, double-blind, multicentre, placebo-controlled phase III trials (ECZTRA 1 and ECZTRA 2) Br J Dermatol. 2021;184(3):437–449. doi: 10.1111/bjd.19574. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Wollenberg A, Weidinger S, Worm M, et al. Tralokinumab in atopic dermatitis. J Dtsch Dermatol Ges. 2021;19(10):1435–1442. doi: 10.1111/ddg.14545. [DOI] [PubMed] [Google Scholar]
- 55.Yosipovitch G, Misery L, Proksch E, et al. Skin barrier damage and itch: review of mechanisms, topical management and future directions. Acta Derm Venereol. 2019;99(13):1201–1209. doi: 10.2340/00015555-3296. [DOI] [PubMed] [Google Scholar]