Abstract
目的
探讨儿童坏死性肺炎的临床特点及危险因素。
方法
回顾性分析2016年1月至2020年1月在首都儿科研究所附属儿童医院呼吸科住院的218例重症肺炎患儿的病例资料,根据是否发生肺坏死将患儿分为坏死性肺炎(necrotizing pneumonia, NP)组(96例)和非坏死性肺炎(non-necrotizing pneumonia, NNP)组(122例),比较两组临床特征(营养不良、热程、住院时间、影像学表现、治疗及转归随访情况)、实验室检查[白细胞、中性粒细胞比例、血小板计数(platelet,PLT)、C-反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、D-二聚体(D-dimer)、乳酸脱氢酶(lactate dehydrogenase,LDH)]和支气管镜下表现的差异,对坏死性肺炎相关临床危险因素进行Logistic回归分析,进一步通过受试者工作特征(receiver operating characteristic, ROC)曲线确定各指标最大诊断价值的临界值。
结果
两组患儿在年龄、性别、病原学分类、支气管镜下表现的差异无统计学意义(P>0.05),NP组患儿的影像学吸收时间长于NNP组(P < 0.05)。两组患儿营养不良、热程、住院时间、白细胞计数、中性粒细胞比例、CRP、PCT、D-dimer等指标的差异有统计学意义(P < 0.05)。6岁以下患儿的影像学吸收时间短于6岁以上者,病程10 d内进行支气管肺泡灌洗治疗的患儿影像学吸收时间短于病程10 d以上者,混合感染组的影像学吸收时间明显长于单一病原感染组。对两组病例进行Logistic回归分析发现,热程、住院时间、CRP、PCT、D-dimer是继发肺坏死的危险因素(分别为P < 0.001、P < 0.001、P < 0.001、P=0.013、P=0.001)。绘制热程、CRP、PCT、D-dimer的ROC曲线,发现当热程>11.5 d、CRP>48.35 mg/L、D-dimer>4.25 mg/L时,对于预测肺坏死的发生有一定诊断价值[ROC曲线下面积(area under ROC curve, AUC)分别为0.909、0.836、0.747,P均 < 0.001]。
结论
儿童坏死性肺炎的热程、住院时间长,混合病原感染的影像学吸收时间明显长于单一病原感染;与6岁以上组患儿及病程>10 d组患儿相比,6岁以下以及病程10 d内的患儿行电子支气管镜肺泡灌洗的疗效更具优势;炎症指标CRP、PCT、D-dimer明显升高,热程、CRP、PCT、D-dimer是重症肺炎继发肺坏死的危险因素,热程>11.5 d、CRP>48.35 mg/L、D-dimer>4.25 mg/L对诊断坏死性肺炎有较高预测价值。
Keywords: 儿童, 坏死性肺炎, 危险因素
Abstract
Objective
To investigate the clinical characteristics and risk factor analysis of necrotizing pneumonia in children.
Methods
A retrospective study was used to analyze the case data of 218 children with severe pneumonia hospitalized in the Department of Respiratory Medicine, Children's Hospital of Capital Institute of Pediatrics from January 2016 to January 2020, and they were divided into 96 cases in the necrotizing pneumonia group (NP group) and 122 cases in the non-necrotizing pneumonia group (NNP group) according to whether necrosis of the lung occurred. The differences in clinical characteristics (malnutrition, fever duration, hospitalization time, imaging performance, treatment and regression follow-up), laboratory tests [leukocytes, neutrophil ratio, platelet (PLT), C-reactive protein (CRP), procalcitonin (PCT), D-dimer, and lactate dehydrogenase (LDH)] and bronchoscopic performance between the two groups were compared, and Logistic regression analysis of clinical risk factors associated with necrotizing pneumonia was performed to further determine the maximum diagnostic value of each index by subject operating characteristic curve (ROC). The critical value of each index was further determined by the ROC.
Results
The differences in age, gender, pathogenic classification, and bronchoscopic presentation between the two groups of children were not statistically significant (P>0.05); whereas the imaging uptake time of the children in the NP group was higher than that in the NNP group (P < 0.05). The differences in malnutrition, fever duration, length of stay, white blood cell count, neutrophil ratio, CRP, PCT, and D-dimer were statistically significant between the two groups (P < 0.05). The imaging uptake time was lower in children under 6 years of age than in those over 6 years of age, and the imaging uptake time for bronchoalveolar lavage within 10 d of disease duration was lower than that for those over 10 d; the imaging uptake time was significantly longer in the mixed infection group than that in the single pathogen infection group. Logistic regression analysis of the two groups revealed that the duration of fever, hospital stay, CRP, PCT, and D-dimer were risk factors for secondary pulmonary necrosis (P < 0.001, P < 0.001, P < 0.001, P=0.013, P=0.001, respectively). The ROC curves for fever duration, CRP, PCT, and D-dimer were plotted and found to have diagnostic value for predicting the occurrence of pulmonary necrosis when fever duration >11.5 d, CRP >48.35 mg/L, and D-dimer > 4.25 mg/L [area under ROC curve (AUC)=0.909, 0.836, and 0.747, all P < 0.001].
Conclusion
Children with necrotizing pneumonia have a longer heat course and hospital stay, and the imaging uptake time of mixed pathogenic infections is significantly longer than that of single pathogenic infections. Children with necrotizing pneumonia under 6 years of age have more advantageous efficacy of electronic bronchoscopic alveolar lavage within 10 d of disease duration compared with children in the group over 6 years of age and children in the group with disease duration >10 d. Inflammatory indexes CRP, PCT, and D-dimer are significantly higher. The heat course, CRP, PCT, and D-dimer are risk factors for secondary lung necrosis in severe pneumonia. Heat course >11.5 d, CRP >48.35 mg/L, and D-dimer >4.25 mg/L have high predictive value for the diagnosis of necrotizing pneumonia.
Keywords: Child, Necrotizing pneumonia, Risk factors
坏死性肺炎(necrotizing pneumonia,NP)是指肺部多种病原体感染引起的肺实质正常组织结构的破坏,病程早期呈现肺实变,之后在肺实变区域出现液化坏死,坏死物质经支气管排出后形成多个囊腔或薄壁空洞,可相互融合成大的空洞。儿童NP病情严重,病程迁延,治疗周期长,可长期遗留肺结构和功能损害,严重危害儿童的生长发育。随着临床及影像学对儿童NP的认识逐渐提高,对于该病的报道也逐渐增多[1]。本研究探讨儿童NP的临床特点及危险因素,以期为临床早期识别、诊治及改善患儿预后提供依据。
1. 资料与方法
1.1. 研究对象
选取2016年1月至2020年1月在首都儿科研究所附属儿童医院呼吸科住院,确诊为NP的患儿96例(NP组)。随机选取同期住院,相似年龄、性别、感染病原的122例影像学未发生肺坏死的重症肺炎患儿为非坏死性肺炎(non-necrotizing pneumonia, NNP)组。NP组纳入标准:病初胸部X线片或肺部CT表现为大叶肺实变影,之后在肺实变影区域内出现液化坏死,形成多发含气空洞或低密度区,可有液气平面。NP组排除标准:患肺结核、先天性肺囊肿、肺脓肿等空洞性肺疾病者[2]。
NP组患儿96例,男54例,女42例,年龄3.20~ 7.90岁,中位年龄5.70岁。NNP组患儿122例,男57例,女65例,年龄3.50~7.70岁,中位年龄5.70岁。两组患儿年龄比较差异无统计学意义(Z=-0.06,P=0.952),性别比较差异无统计学意义(χ2=2.07,P=0.15),所有患儿均既往健康,无基础疾病。
1.2. 方法
两组患儿均根据病原学检查结果给予抗感染治疗,同时给予呼吸支持(鼻导管吸氧、无创或有创呼吸机支持),94例患儿静脉应用小剂量甲泼尼松龙,每天2~4 mg/kg,5~7 d;26例患儿静脉应用丙种球蛋白,总量2 g/kg,分3~5 d;174例患儿行支气管肺泡灌洗治疗;76例患儿行胸腔穿刺术,13例行胸腔闭式引流术,1例行胸腔廓清术。
回顾性分析比较两组患儿的一般资料(性别、年龄)、临床特征(热程、住院时间)、实验室检查[白细胞峰值、中性粒细胞比例峰值、血小板计数(platelet,PLT)峰值、C-反应蛋白(C-reactive protein,CRP)峰值、降钙素原(procalcitonin,PCT)峰值、D-二聚体(D-dimer)、乳酸脱氢酶(lactate dehydrogenase,LDH)峰值]的差异,总结病原学检查结果、影像学特点、支气管镜下表现、治疗随访情况等。细菌感染诊断标准为:痰、支气管肺泡灌洗液和/或胸腔积液培养出明确细菌,支气管肺泡灌洗液呼吸道病原学基因检测出明确细菌。支原体感染诊断标准为:血清特异性抗体滴度升高4倍以上,同时痰和/或支气管肺泡灌洗液肺炎支原体(Mycoplasma pneumoniae)核酸检测阳性。混合感染诊断标准为:存在以上两种病原感染或肺泡灌洗液核酸检测出同时存在其他病原。
1.3. 统计学分析
采用SPSS 17.0统计学软件,符合正态分布的计量资料用x±s表示,组间比较采用独立样本t检验,非正态分布数据用中位数(四分位间距)[M(P25,P75)]表示,组间比较采用秩和检验,计数资料用例数(%)表示,组间比较采用χ2检验,有序分类变量采用趋势检验。单因素分析显示有统计学意义的指标进行多因素Logistic回归分析,再通过受试者工作特征(receiver operator characteristic,ROC)曲线分析NP各预测指标中诊断价值最大的临界值。P < 0.05为差异有统计学意义。
2. 结果
2.1. 临床特征
两组患儿营养不良的发生率差异有统计学意义(χ2=4.135,P=0.001)。NP组热程为18(13,24)d,NNP组热程为8(6,11) d,NP组患儿热程明显高于NNP组(Z=-10.58,P < 0.001)。NP组患儿住院时间为12(8,15) d,NNP组住院时间7(5,10) d,NP组住院时间明显长于NNP组患儿(Z=-6.812,P < 0.001)。
2.2. 病原学分布
NP组患儿中,细菌感染31例(32.29%),其中肺炎链球菌(Streptococcus pneumoniae)14例、金黄色葡萄球菌(Staphylococcus aureus)7例、流感嗜血杆菌(Haemophilus influenzae)9例、铜绿假单胞菌(Pseudomona aeruginosa)1例;支原体感染38例(39.58%);混合感染25例(26.04%),其中支原体+肺炎链球菌9例、支原体+金黄色葡萄球菌5例、支原体+流感嗜血杆菌5例、支原体+铜绿假单胞菌3例、支原体+腺病毒2例、支原体+甲型流感病毒1例;未明确病原感染2例(2.09%)。
NNP组细菌感染41例(33.61%),其中肺炎链球菌19例、金黄色葡萄球菌8例、流感嗜血杆菌10例、铜绿假单胞菌4例;支原体感染40例(32.78%);混合感染38例(31.14%),其中支原体+ 肺炎链球菌12例、支原体+金黄色葡萄球菌7例、支原体+流感嗜血杆菌7例、支原体+铜绿假单胞菌4例、支原体+腺病毒5例、支原体+ 副流感病毒3例;未明确病原感染3例(2.47%)。两组患儿感染病原学差异无统计学意义(χ2=1.239,P=0.538)。
2.3. 实验室检查
所有患儿在入院3 d内行血常规、CRP、PCT、生化、凝血等相关化验检查。NP组和NNP组患儿外周血白细胞峰值、中性粒细胞比例峰值、CRP峰值、PCT峰值、D-dimer峰值(正常值范围0~0.55 mg/L)的差异有统计学意义(均P < 0.05,表 1)。
表 1.
NP组与NNP组各项实验室检查指标的比较
Comparison of laboratory indexes between NP group and NNP group
| Items | NP group (n=96) | NNP group (n=122) | Z/t/χ2 | P |
| Data are presented as x±s or M (P25, P75). NP, necrotizing pneumonia; NNP, non-necrotizing pneumonia; CRP, C-reactive protein; PCT, procalcitonin; LDH, lactate dehydrogenase. | ||||
| Leukocytes/(×109/L) | 15.33 (11.83, 22.97) | 10.56 (8.34, 13.45) | -6.325 | < 0.001 |
| Neutrophil ratio/% | 0.75 (0.65, 0.80) | 0.63 (0.51, 0.76) | -4.535 | < 0.001 |
| Platelet/(×109/L) | 421.56±149.87 | 411.75±133.27 | 0.522 | 0.602 |
| CRP/(mg/L) | 52 (33, 106) | 9 (4, 27) | -8.672 | < 0.001 |
| PCT/(μg/L) | 0.35 (0.16, 0.56) | 0.24 (0.12, 0.37) | -2.685 | 0.007 |
| D-dimer/(mg/L) | 5.11 (1.97, 10.59) | 1.52 (0.77, 3.19) | -6.375 | < 0.001 |
| LDH/(U/L) | 299 (252, 408) | 332 (274, 422) | -1.634 | 0.102 |
| Ferritin/(μg/L) | 173.03 (91.32, 445.53) | 137.03 (42.30, 333.32) | 0.318 | 0.570 |
2.4. 影像学特点
总结分析两组患儿的影像学表现,NP组为发现肺坏死病灶的胸部增强CT,NNP组为病程中病变范围最严重的胸部增强CT。NP组患儿胸部增强CT显示右肺病变38例(39.58%),左肺病变46例(47.92%),双肺病变12例(12.50%)。对两组患儿的影像学情况进行量化分析,两组影像学表现的分布差异无统计学意义(χ2=2.96,P=0.23,表 2)。
表 2.
NP组与NNP组患儿影像学表现
Imaging manifestations of children in NP group and NNP group
| Group | Total | Imaging manifestations, n (%) | ||
| Pleural effusion | Pneumothorax | Pleural thickening | ||
| Abbreviations as in Table 1. | ||||
| NP group | 96 | 55 (57.29) | 26 (27.08) | 72 (75.00) |
| NNP group | 122 | 59 (48.36) | 19 (15.57) | 49 (40.16) |
| χ 2 | 2.96 | |||
| P | 0.23 | |||
发病4~10 d的初次胸部X线片或胸部CT检查结果显示,患儿肺内存在大片实变影,NP组出现坏死的时间为病程第(13.10±3.54)天,NP组影像学好转(肺内实变及坏死区吸收范围达病变范围75%以上)的时间为32(19,42) d,影像学吸收(肺实变及空洞病灶基本消失或吸收范围达病变范围90%以上)的时间为45(35,72) d。
2.5. 支气管镜下表现
NP组的44例患儿于病程10 d内行支气管镜检查及肺泡灌洗术,52例患儿于病程10 d及以上行首次支气管镜检查及肺泡灌洗术。NNP组患儿在病程2周内有78例行支气管镜检查及肺泡灌洗术。镜下可见支气管黏膜充血水肿、白色或黄色黏性分泌物等炎性表现,根据分泌物多少程度分为少量(黏液分泌物占管腔1/3)、中量(黏液分泌物占管腔1/3~2/3)、大量(黏液分泌物占管腔2/3以上),两组患儿支气管镜下分泌物及管腔情况差异无统计学意义(表 3)。
表 3.
NP组与NNP组患儿支气管镜下表现
Bronchoscopic changes in children in NP group and NNP group
| Group | Total | Secretion under bronchoscope | Branch lumen | ||||
| Necrotic attachment | Erosion bleeding | Inflammatory stenosis | Plica hyperplasia | Lumen occlusion | |||
| Abbreviations as in Table 1. | |||||||
| NP group | 96 | 22 | 14 | 43 | 48 | 5 | |
| NNP group | 78 | 8 | 6 | 35 | 38 | 5 | |
| χ 2 | 6.643 | 1.023 | |||||
| P | 0.156 | 0.679 | |||||
2.6. 治疗转归及随访
所有入组患儿均经合理抗感染、对症治疗,体温均恢复正常,临床好转出院,无死亡病例。与NNP组相比,NP组住院时间长,治疗周期长,体温恢复正常的时间长。186例患儿进行了长期随访(NP组91例,NNP组95例),病例随访终点为肺实变及空洞病灶基本消失(病灶吸收范围至少达90%以上)或病程6个月。
NP组患儿影像学吸收时间明显长于NNP组(P < 0.05,表 4)。进一步在NP组中分析不同病原感染的影像学吸收时间,支原体感染组影像学吸收时间为(4.13±1.47)个月,影像学吸收时间为1、3、6个月内的患儿分别为12、16、9例;细菌感染组为(3.19±1.85)个月,影像学吸收时间为1、3、6个月内的患儿分别为9、13、9例;混合感染组为(4.46±2.58)个月,影像学吸收时间为1、3、6个月内的患儿分别为3、14、6例;细菌感染组与支原体感染组间差异无统计学意义(P>0.05),细菌感染组与混合感染组间,以及支原体感染组与混合感染组间差异有统计学意义(P < 0.05)。
表 4.
NP组与NNP组患儿影像学吸收情况
Imaging absorption of children in NP group and NNP group
| Group | n | Imaging absorption, n (%) | χ 2 | P | ||
| Within 1 month | Within 3 months | Within 6 months | ||||
| Abbreviations as in Table 1. | ||||||
| NP group | 91 | 24 (26.37) | 43 (47.25) | 24 (26.37) | 8.192 | < 0.001 |
| NNP group | 95 | 37 (38.95) | 42 (44.21) | 16 (16.84) | ||
NP组中,肺泡灌洗术的时机早晚(< 10 d或≥ 10 d)与患儿年龄(< 6岁或≥6岁)的交互作用对灌洗后影像学吸收时间有显著影响(F=5.954,P=0.020)。
进一步探究肺泡灌洗时机及患儿年龄对影像学吸收时间的影响,建立广义的线性模型,灌洗时机≥10 d的影像学吸收时间比灌洗时机 < 10 d的病例增加1.9 d。
2.7. NP的多因素Logistic回归分析
适当放宽纳入标准,并排除具有共线性的变量(白细胞峰值、中性粒细胞比例峰值),继而将营养不良、热程、住院时间、CRP、PCT、D-dimer等两组间有差异或有潜在差异的因素纳入多因素Logistic回归分析,结果显示热程、CRP、PCT、D-dimer是继发肺坏死的独立预测指标(分别为P < 0.001、P < 0.001、P=0.013、P=0.001,表 5)。
表 5.
NP各风险指标多因素Logistic分析
Multivariate Logistic analysis of risk indicators of NP
| Features | β | SE | P | OR | 95%CI | |
| Lower limit | Upper limit | |||||
| Abbreviations as in Table 1. | ||||||
| Fever duration | 0.481 | 0.092 | 0.000 | 1.697 1 | 0.326 | 0.676 |
| PCT | 0.074 | 0.030 | 0.013 | 1.178 3 | 0.006 | 0.260 |
| CRP | 0.037 | 0.010 | 0.000 | 1.037 3 | 0.018 | 0.057 |
| D-dimer | 0.272 | 0.080 | 0.001 | 5.167 2 | 0.679 | 0.815 |
2.8. NP独立预测指标的ROC临界值
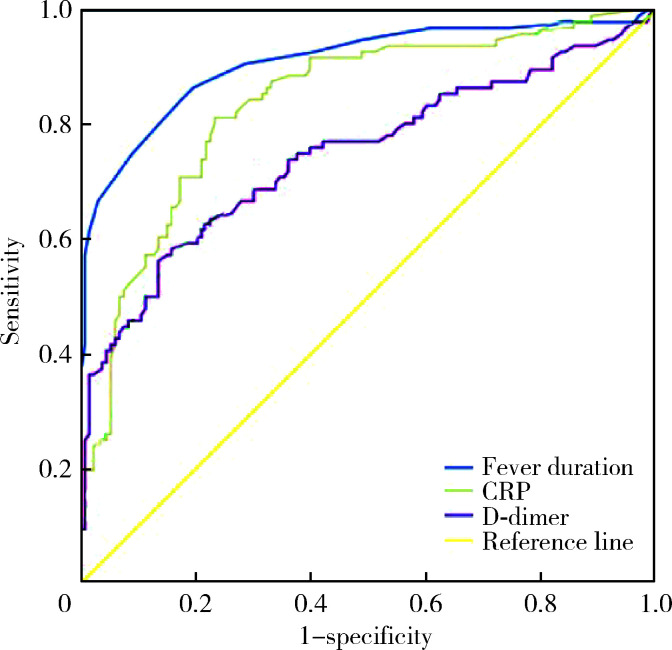
经单因素分析后,将有统计学意义的指标绘制ROC曲线,发现当热程>11.5 d、CRP>48.35 mg/L、D-dimer>4.25 mg/L时,对于预测肺坏死的发生有一定诊断价值[ROC曲线下面积(area under ROC curve, AUC)=0.909、0.836、0.747,P均 < 0.001],其中热程>11.5 d有较高诊断价值(AUC=0.909, P < 0.001, 图 1)。
图 1.
NP独立预测指标的ROC曲线
ROC curve of independent predictor of NP
NP, necrotizing pneumonia; ROC, receiver operating characteristic; CRP, C-reactive protein.
3. 讨论
NP是社区获得性肺炎的严重并发症,其特征是实变迅速发展为坏死和空洞,发病率和死亡率高,病程迁延,后遗症多发[3],可遗留肺结构和肺功能损害。既往报道NP患儿中最常见的病原菌为肺炎链球菌、金黄色葡萄球菌和肺炎支原体,亦有其他多种病原感染的报道[4]。本组病例的病原分析结果显示,单一病原肺炎支原体、肺炎链球菌、金黄色葡萄球菌、流感嗜血杆菌是主要的病原,肺炎支原体位于首位,这与近年来肺炎支原体逐渐成为儿童社区获得性肺炎的主要病原体,且重症支原体肺炎的发病逐年增加相一致。此外,随着病原学检测手段的逐渐进步,目前对于NP的病原学诊断更加全面,我们发现26.04%的NP病例为多种病原混合感染,呈现出多种病原混合感染的临床特点,其潜在机制尚不清楚,分析可能与宿主易感性和多种病原的毒力因素相互作用有关,因此,在临床中对于多种病原感染的重症肺炎及重症支原体肺炎要高度警惕NP的发生,早期监测肺部影像学变化。
NP的发病机制迄今仍不十分清楚,致病微生物本身的侵袭性和细胞因子介导的免疫反应在发病机制中起着关键作用。目前的研究认为,肺组织坏死是侵袭性病原菌相关的血管炎和静脉栓塞结果[5]。不同病原感染的肺坏死发病机制不同,肺炎链球菌感染后可诱导全身过度炎症反应,出现中性粒细胞浸润,部分侵袭力强的血清型可导致血流感染,造成肺内血管壁破坏,继发局部肺血栓形成[6]。金黄色葡萄球菌能分泌溶血毒素、杀白细胞素、血浆凝固酶等,造成肺组织坏死,随着坏死组织的进一步排出,局部出现空洞[7]。肺炎支原体黏附于宿主细胞后通过合成、分泌过氧化氢以及过度炎症反应造成肺损伤。
本研究显示,NP患儿的热程及住院时间均长于NNP组患儿,这与国内多项研究一致。有报道显示,发热时间的延长可能与肺坏死导致的肺实质进一步破坏有关[8],临床上患儿一旦出现NP的并发症,病情严重程度及治疗费用均会明显增加,造成社会经济负担加重,因此早期识别和积极治疗NP至关重要。本研究中NP组患儿外周血白细胞峰值、中性粒细胞比例峰值、CRP峰值、PCT峰值均明显高于NNP组,提示NP与严重全身炎症反应有关,监测炎症指标的变化可早期预警病变坏死,这一结论已有多项研究证实[9-10]。
近年来胸部增强CT检查在NP的诊断中起到了关键作用,它可以发现胸部X线片上不易显示的病变,因此被认为是NP最敏感的诊断手段[11-13]。肺坏死发生的部位可以是单侧肺也可以是双侧肺,NP组患儿以单侧受累为主(87.5%)。有研究报道,从出现症状到影像学发现肺坏死改变的时间为(21.0±6.9) d[14],本组NP患儿从出现临床症状到发生肺坏死的时间为(13.10±3.54) d,提示从症状出现到出现肺坏死的时间在2周左右,如患儿发热持续2周、炎症指标持续升高不降,要警惕NP的发生,及时行胸部增强CT检查可以发现NP的早期征象。临床上应结合患儿症状、实验室检查结果选择胸部增强CT的检查时机,避免漏诊及过度检查。
经过半年的随访发现,NP组的影像学吸收时间明显长于NNP组,NP组中不同病原的影像学吸收时间不同,混合感染组明显较单一病原感染组影像学吸收时间长,分析原因可能为混合感染病原的多种发病机制协同作用,促进肺坏死病变发展,减缓了肺部病变的吸收时间。提示对于多重病原混合感染肺坏死的患儿可延长影像学监测间隔时间及随访时间,减少胸部增强CT的检测次数,进一步减轻经济负担。
本研究分析两组中进行支气管镜检查及肺泡灌洗术的患儿发现,两组患儿在支气管镜下的表现无明显差异,但NP组灌洗时机早晚、患者年龄交互作用对影像学恢复时间有显著影响。患儿年龄与灌洗时机的交互作用可较大程度上影响影像学的吸收时间,6岁以下患儿的影像学吸收时间短于6岁以上者,10 d内行支气管肺泡灌洗术患儿的影像学吸收时间短于10 d以上者。其原因与儿童呼吸道解剖生理功能有关,婴幼儿气道狭窄,软骨柔软,支撑作用弱,黏膜柔嫩,血管丰富,感染时易发生黏液壅塞,此外,婴幼儿咳嗽反射弱,分泌物不易排出,因此,小年龄组患儿行支气管镜肺泡灌洗的疗效更具优势[15-16]。
此外,对于重症支原体感染患儿,应关注其发生闭塞性支气管炎的可能,在行支气管镜检查过程中应尽可能向深部探查,以尽早发现支气管闭塞情况。多项研究显示,重症肺炎早期行支气管镜检查及肺泡灌洗术可减少局部病原微生物及炎症因子,及早清除痰液、黏液栓及肉芽坏死组织,解除支气管阻塞,改善通气,降低管腔狭窄、闭塞的发生率,有利于肺复张。此外,支气管镜检查可获得支气管肺泡灌洗液,有助于NP的病原学诊断,对疾病的治疗有重要意义。因此,NP患儿的诊治应在积极抗感染治疗的基础上,可依据病情早期行支气管镜检查及肺泡灌洗,尤其是对于低年龄组的患儿,既有助于疾病的诊治,又有助于预后的改善,体现了支气管镜检查在NP诊治中的独特地位[17-19]。
为临床早期预测NP,我们绘制了ROC曲线,发现当热程>11.5 d、CRP>48.35 mg/L、D-dimer> 4.25 mg/L时,对于预测肺坏死的发生有一定诊断价值。NP组出现坏死的时间为病程第(13.10±3.54)天,ROC曲线诊断肺坏死的临界值为热程11.5 d,提示对于临床上经积极抗感染治疗仍持续发热超过11.5 d的患儿,应注意监测胸部增强CT,可早期发现肺坏死。另外,CRP升高是肺坏死的预警指标,提示重症肺部感染继发的全身炎症反应,在积极抗感染的基础上可酌情加用糖皮质激素抑制炎症反应,以期阻止或延缓肺坏死的进程。重症感染时血管内皮损伤,激活凝血系统,引起凝血功能异常,可导致局部微血栓形成,这是肺坏死发生的重要机制[20]。D-dimer是纤维蛋白的特异性降解产物,其升高反映继发性纤溶亢进和机体高凝状态,可作为血栓形成的分子标志物[21-22]。本研究显示,NP组D-dimer明显高于NNP组,提示肺坏死患儿血液处于高凝状态且存在微小血栓,需要采取积极抗凝治疗。本研究显示D-dimer>4.65 mg/L是肺坏死的独立预测指标,这与其他研究结果一致[23-24],我们建议D-dimer>4.65 mg/L时,根据病情可酌情考虑使用低分子肝素抗凝治疗。但由于本研究样本量较少,预测截点值存在一定局限性,尚需要更多的多中心、大样本临床数据研究进行验证,以进一步指导临床工作。
综上所述,儿童NP表现为热程、住院时间及影像学吸收时间长,炎症指标明显升高,热程、CRP、PCT、D-dimer是重症肺炎继发肺坏死的危险因素,当热程>11.5 d、炎症指标持续不降、存在高凝状态时,应及时行胸部增强CT明确肺坏死情况,尤其是对于6岁以下的患儿,应早期行支气管镜肺泡灌洗治疗,可改善预后。
Funding Statement
北京市科学技术委员会首都特色应用研究(Z181100001718116)
Supported by the Capital Characteristic Application Research Fund of Beijing Municipal Commission of Science and Technology (Z181100001718116)
References
- 1.Masters IB, Isles AF, Grimwood K. Necrotizing pneumonia: An emerging problem in children? Pneumonia (Nathan) 2017;9:11. doi: 10.1186/s41479-017-0035-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Krenke K, Sanocki M, Urbankowska E, et al. Necrotizing pneumonia and its complications in children. Adv Exp Med Biol. 2015;857:9–17. doi: 10.1007/5584_2014_99. [DOI] [PubMed] [Google Scholar]
- 3.Krutikov M, Rahman A, Tiberi S. Necrotizing pneumonia (aetiology, clinical features and management) Curr Opin Pulm Med. 2019;25(3):225–232. doi: 10.1097/MCP.0000000000000571. [DOI] [PubMed] [Google Scholar]
- 4.戴 菱蔓. 儿童坏死性肺炎的研究进展. 国际儿科学杂志. 2021;48(3):163–167. [Google Scholar]
- 5.Wang RS, Wang SY, Hsieh KS, et al. Necrotizing pneumonitis caused by Mycoplasma pneumoniae in pediatric patients: Report of five cases and review of literature. Pediatr Infect Dis J. 2004;23(6):564–567. doi: 10.1097/01.inf.0000130074.56368.4b. [DOI] [PubMed] [Google Scholar]
- 6.宾 松涛, 胡 晓琴, 王 继, et al. 儿童肺炎支原体坏死性肺炎30例临床分析. 疑难病杂志. 2021;20(2):144–147. [Google Scholar]
- 7.刘杰. 儿童坏死性肺炎临床特点分析[D]. 天津: 天津医科大学, 2020.
- 8.杨 男, 尚 云晓. 儿童肺炎链球菌感染致坏死性肺炎的临床特点及预测指标研究. 中华实用儿科临床杂志. 2020;35(8):573–577. doi: 10.3760/cma.j.cn101070-20191015-00990. [DOI] [Google Scholar]
- 9.张 园园, 戴 菱蔓, 周 云连, et al. 儿童细菌性坏死性肺炎与肺炎支原体坏死性肺炎临床特征及预后比较. 中华儿科杂志. 2019;57(8):625–630. [Google Scholar]
- 10.张 天骄, 刘 盈盈, 裴 亮. 儿童肺炎支原体肺炎并发坏死性肺炎的临床预测因素. 中国医科大学学报. 2022;51(1):79–82. [Google Scholar]
- 11.杨 男, 陈 宁, 尚 云晓. 儿童坏死性肺炎49例临床分析. 中华实用儿科临床杂志. 2017;32(4):280–283. doi: 10.3760/cma.j.issn.2095-428X.2017.04.010. [DOI] [Google Scholar]
- 12.刘 帅帅, 马 静, 张 忠晓, et al. 增强CT对儿童坏死性肺炎的诊断价值. 中华实用儿科临床杂志. 2021;36(4):267–270. [Google Scholar]
- 13.曾 洪武, 黄 文献, 陈 杰华, et al. 儿童坏死性肺炎的临床特点及胸部HRCT特征. 放射学实践. 2018;33(7):758–761. [Google Scholar]
- 14.杜 雪平, 郭 燕军. 儿童坏死性肺炎的临床特点及胸部CT特征. 影像研究与医学应用. 2020;4(10):68–69. [Google Scholar]
- 15.Wang X, Zhong LJ, Chen ZM, et a1. Necrotizing pneumonia caused by refractory Mycoplasma pneumonia pneumonia in children. World J Pediatr. 2018;14(4):344–349. doi: 10.1007/s12519-018-0162-6. [DOI] [PubMed] [Google Scholar]
- 16.王 敏敏. 儿童坏死性肺炎诊治进展. 国际儿科学杂志. 2021;48(8):529–533. [Google Scholar]
- 17.席 少婷, 蔡 栩栩. 儿童难治性肺炎支原体肺炎诊治进展. 国际儿科学杂志. 2020;47(6):384–388. [Google Scholar]
- 18.Takigawa Y, Fujiwara K, Saito T, et al. Rapidly progressive multiple cavity formation in necrotizing pneumonia caused by community-acquired methicillin-resistant Staphylococcus aureus positive for the Panton-Valentine leucocidin gene. Intern Med. 2019;58(5):685–691. doi: 10.2169/internalmedicine.1454-18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.王 晓丽, 郑 兴厂, 管 栋, et al. 胸部CT及可弯曲支气管镜在坏死性肺炎的应用价值. 中国小儿急救医学. 2020;27(11):830–833. [Google Scholar]
- 20.陈 鲁闽, 王 程毅, 宋 朝敏, et al. 重症肺炎患儿凝血指标与危重症评分的相关性分析. 中国小儿急救医学. 2013;20(4):380–382. [Google Scholar]
- 21.Graw-Panzer KD, Verma S, Rao S, et al. Venous thrombosis and pulmonary embolism in a child with pneumonia due to Mycoplasma pneumoniae. J Natl Med Assoc. 2009;101(9):956–958. doi: 10.1016/s0027-9684(15)31045-2. [DOI] [PubMed] [Google Scholar]
- 22.刘 金荣, 徐 保平, 李 惠民, et al. 肺炎链球菌坏死性肺炎20例诊治分析. 中华儿科杂志. 2012;50(6):431–434. [PubMed] [Google Scholar]
- 23.贺 艺璇, 张 春峰, 吴 润晖, et al. D-二聚体在肺炎支原体肺炎患儿病情及预后判断中的应用. 中华实用儿科临床杂志. 2019;34(22):1702–1706. [Google Scholar]
- 24.刘 帅帅, 马 静, 张 忠晓, et al. 儿童肺炎支原体坏死性肺炎的早期预测指标. 中华实用儿科临床杂志. 2021;36(8):601–604. [Google Scholar]