Prüfungssimulation
Fallschilderung
Ein 56-jähriger Mann stellt sich aufgrund subjektiv deutlich einschränkender Konzentrationsstörungen seit einer Woche bei seinem Hausarzt vor. Des Weiteren bestünden Rückenschmerzen und eine allgemeine Abgeschlagenheit seit einigen Monaten. Es ist ein medikamentös gut eingestellter arterieller Hypertonus bekannt, die Familienanamnese ist positiv für ein Bronchialkarzinom (Vater). Auf Nachfrage berichtet der Patient außerdem von deutlich gesteigertem Harndrang. Eine Blutzuckermessung zeigt normoglykämische Werte, in der körperlichen Untersuchung imponiert ein Wirbelsäulenklopfschmerz lumbal.
Prüfungsfragen
Welche weitere Diagnostik veranlassen Sie zunächst?
Welche Maßnahmen sind aufgrund der Hyperkalzämie zu veranlassen?
Welche weiteren Untersuchungen benötigen Sie noch, um die Verdachtsdiagnose zu sichern sowie für die Planung der Therapie?
Erläutern Sie das Therapiekonzept für diesen Patienten. Wie sähe es aus, wenn der Patient 76 Jahre alt wäre?
Welche Substanzklassen kommen in der Therapie des Multiplen Myeloms zum Einsatz?
Welche Parameter benötigen Sie zur Remissionskontrolle, und wie teilt sich diese ein?
Welche weiteren supportiven Maßnahmen sind zu berücksichtigen?
Welche Besonderheiten sind bei der Verordnung von immunmodulatorischen Substanzen zu beachten?
Antworten
Welche weitere Diagnostik veranlassen Sie zunächst?
Die beschriebenen Beschwerden können vielfältige Ursachen haben, aufgrund der Fatigue-Symptomatik, der Konzentrationsstörungen und des gesteigerten Harndrangs veranlassen Sie eine Blutuntersuchung inkl. eines Blutbilds, Leber- und Nierenparameter (Tab. 1). Außerdem bitten Sie den Patienten um eine Urinprobe, diese ist unauffällig.
| Parameter | Laborwert | Referenzbereich |
|---|---|---|
| Hämoglobin (g/dl) | 9,3 | 14,0–17,5 |
| Hämatokrit (%) | 30,3 | 36–48 |
| Erythrozyten (Mrd./ml) | 3,05 | 4,5–5,9 |
| Mittleres Erythrozytenvolumen, „mean corpuscular volume“, MCV (fl) | 94 | 80–94 |
| Mittlerer korpuskulärer Hämoglobingehalt, „mean corpuscular hemoglobin“, MCH (pg) | 31,8 | 26,0–34,0 |
| Mittlere korpuskuläre Hämoglobinkonzentration, „mean corpuscular hemoglobin concentration“, MCHC (g/dl) | 33,9 | 31,5–37,0 |
| Leukozyten (Mrd./l) | 9,8 | 3,8–11,0 |
| Thrombozyten (Mrd./l) | 137 | 150–400 |
| Natrium (mmol/l) | 139 | 135–145 |
| Kalium (mmol/l) | 3,7 | 3,5–4,6 |
| Kalzium (mmol/l) | 3,29 | 2,08–2,65 |
| Kreatinin (mg/dl) | 1,3 | 0,7–1,2 |
| Aspartat-Aminotransferase, AST (U/l) | 36 | < 50 |
| Alanin-Aminotransferase, ALT (U/l) | 27 | < 50 |
| C‑reaktives Protein (mg/l) | 35 | < 5 |
| Laktatdehydrogenase, LDH (U/l) | 335 | 120–246 |
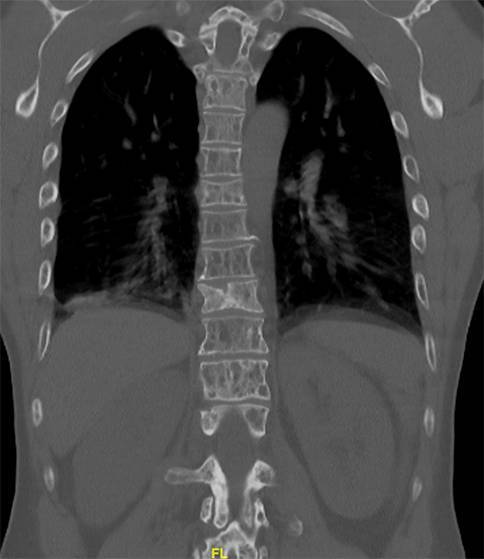
Hinsichtlich der Rückenschmerzen mit Klopfschmerz veranlassen Sie eine Bildgebung der Wirbelsäule (Abb. 1).
Welche Maßnahmen sind aufgrund der Hyperkalzämie zu veranlassen?
Ein ausgeglichener Kalziumspiegel ist aufgrund der Rolle als Elektrolyt bei der Zellmembranstabilität (Ruhemembranpotenzial) von hoher Relevanz, Abweichungen können lebensbedrohliche Folgen haben. Ein normaler Kalziumspiegel ist definiert als ein Gesamtkalzium von 2,2–2,65 mmol/l bzw. ionisiertes Kalzium von 1,15–1,35 mmol/l. Aufgrund der Proteinbindung bzw. Albuminabhängigkeit des Kalziumwerts ist insbesondere bei dem hier vorliegenden Krankheitsbild die Bestimmung des ionisierten Kalziums oder die Berechnung des korrigierten Kalziumwerts zu bevorzugen.
Payne-Formel:
gemessenes Gesamtkalzium +1 − (0,025 × Albumingehalt in g/l) = korrigiertes Kalzium.
- Da eine Hyperkalzämie in diesem Ausmaß lebensbedrohliche Folgen haben kann, ist sie als hämatoonkologischer Notfall zu betrachten und eine unmittelbare Krankenhauseinweisung indiziert. Mögliche Symptome betreffen diverse Organsysteme:
- kardial: Herzrhythmusstörungen (v. a. bradykard), Atrioventrikular(AV)-Block, QT-Verkürzung,
- renal: Polyurie (über eine erworbene ADH-Resistenz), Polydipsie, Exsikkose, Urolithiasis, Nephrokalzinose,
- gastrointestinal: Nausea, Erbrechen, Obstipation,
- neurologisch: kognitive Beeinträchtigungen, Lethargie, Verwirrtheit, Psychose, Bewusstseinsstörung bis Somnolenz und Koma (Cave: hyperkalzämische Krise!).
Es sollte eine engmaschige Überwachung inklusive EKG-Kontrollen gewährleistet werden. Die Therapie der Hyperkalzämie umfasst:
Volumengabe und forcierte Diurese mit physiologischer Kochsalzlösung (Cave: Hypokaliämie),
Gabe von Bisphosphonaten; bei Kontraindikationen (Niereninsuffizienz mit glomerulärer Filtrationsrate, GFR, < 30 ml/min) Gabe von Denosumab,
Gabe von Glukokortikoiden
und/oder Gabe von Kalzitonin.
Bisphosphonate senken nachhaltig den Kalziumspiegel, ihre Wirkung setzt jedoch erst nach etwa 24 h ein. In besonders schweren Fällen kann eine Dialyse notwendig werden. Zur kausalen Therapie und Vorbeugung einer erneuten Episode ist die Therapie der Grunderkrankung relevant [1].
Merke.
Eine hyperkalzämische Krise stellt einen internistischen Notfall mit lebensbedrohlichen Folgen dar und bedarf einer umgehenden Behandlung.
Welche weiteren Untersuchungen benötigen Sie noch, um die Verdachtsdiagnose zu sichern sowie für die Planung der Therapie?
Die Diagnosestellung eines Multiplen Myeloms (MM) erfolgt auf Basis der IMWG-Kriterien (International Myeloma Working Group; [2]; Tab. 2), die neben dem Vorliegen eines monoklonalen Proteins in Serum und/oder Urin eine Knochenmarkinfiltration durch monoklonale Plasmazellen von mindestens 10 % sowie durch Vorliegen von ≥ 1 SLiM-CRAB-Kriterium („sixty percent, light chains, magnetic resonance imaging, hypercalcemia, renal failure, anemia, bone lesions“) definiert ist. Bei den SLiM-CRAB-Kriterien handelt sich es um Marker der Endorganschädigung, ergänzt um spezifische Biomarker bzw. Parameter, die eine Therapieindikation darstellen und auch eine Abgrenzung zu der Vorstufe des Smoldering Myeloms bilden. Sie setzen sich zusammen aus:
S: ≥ 60 % Plasmazellinfiltration im Knochenmark,
Li: Quotient aus involvierten/nichtinvolvierten freien Leichtketten im Serum („serum free light chains“, SFLC) ≥ 100,
M: ≥ 1 fokale Läsion ≥ 5 mm in der Ganzkörper-Magnetresonanztomographie (GK-MRT),
C: Hyperkalzämie,
R: Nierenschädigung (Kreatinin ≥ 2 mg/dl bzw. glomeruläre Filtrationsrate (GFR) < 40 ml/min),
A: Anämie (Hb < 10 g/dl bzw. ≥ 2 g/dl unter dem unteren Grenzwert),
B: Knochenläsionen mit ≥ 1 osteolytischen Läsion in der Bildgebung.
| Multiples Myelom | Smoldering Myelom | Monoklonale Gammopathie unklarer Signifikanz | |
|---|---|---|---|
| M‑Protein | Nachweisbar |
≥ 3 g/dl (Serum) und/oder ≥ 500 mg/24 h (Urin) |
< 3 g/dl (Serum) und < 500 mg/24 h (Urin) |
| Plasmazellinfitration im Knochenmark | ≥ 10 % | 10–60 % | < 10 % |
| SLiM-CRAB-Kriterien | Nachweisbar | Nicht nachweisbar | Nicht nachweisbar |
SLiM-CRAB „sixty percent, light chains, magnetic resonance imaging, hypercalcemia, renal failure, anemia, bone lesions“
Merke.
Die SLiM-CRAB-Kriterien bilden die Behandlungsindikationen ab.
Die Knochenmarkuntersuchung ist damit essenzieller Bestandteil der Diagnosestellung und kann per se eine Therapieindikation darstellen, sodass diese auch durch eine histologische Diagnose „Plasmozytom“, z. B. aus einem Wirbelkörper oder einer anderen extramedullären Manifestation, nicht ersetzt werden kann. Es sind zytomorphologische, immunphänotypische und zytogenetische Untersuchungen aus dem Aspirat sowie die histologische Untersuchung einer Stanze notwendig (Tab. 3).
| Blut |
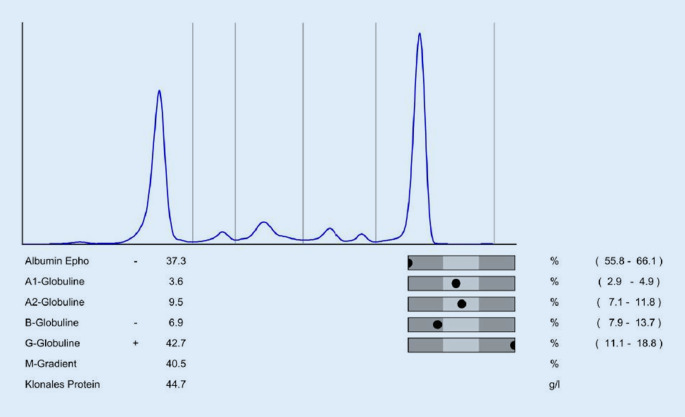
Blutbild inkl. Differenzialblutbild Elektrolyte inkl. korrigiertes Ca2+ Nierenretentionsparameter inkl. eGFR LDH, β2-Mikroglobulin, Albumin, Gesamtprotein, ALT, CRP Serumeiweißelektrophorese mit M‑Gradienten-Bestimmung (Abb. 2) Immunglobuline quantitativ: IgG, IgA, IgM (IgD bei IgD-MM) Immunfixation im Serum freie Leichtketten (κ und λ) im Serum sowie Quotient Zytomorphologie (Ausschwemmung Plasmazellen?) proBNP, Troponin T (Screening AL-Amyloidose) |
| 24-Stunden-Sammelurin |
Quantifizierung der Proteinurie (Gesamtprotein und Albumin) Urineiweißelektrophorese mit M‑Gradienten-Bestimmung Immunfixation |
| Knochenmarkpunktion |
Aspiration Zytomorphologie Durchflusszytometrie Zytogenetik (FISH; mindestens t(4;14), del17p13, gain 1q21 (inkl. Anzahl der Kopien), del1p32, t(14;16), t(11;14)) Biopsie (Histologie) |
| Bildgebungsverfahren |
Osteo-CT (Low-Dose-Ganzkörper-CT ohne Kontrastmittel) Ganzkörper-MRT FDG-PET-CT bei extramedullärer Manifestation |
ALT Alanin-Aminotransferase, CRP C-reaktives Protein, CT Computertomographie, eGFR geschätzte glomeruläre Filtrationsrate, FDG-PET-CT Fluordesoxyglukose-Positronenemissionstomographie-CT, FISH Fluoreszenz-in-situ-Hybridisierung, MRT Magnetresonanztomographie, proBNP „pro brain natriuretic peptide“
Auch die Bestimmung einer Urineiweißelektrophorese inkl. Bestimmung des M‑Gradienten aus dem 24-h-Sammelurin gehört zur vollständigen Aufarbeitung. Sie kann nicht durch eine Bestimmung aus dem Spontanurin ersetzt werden!
Außerdem sind für die Erhebung der Risikostratifizierung, die gemäß dem International Staging System (ISS) und Revised ISS (R-ISS) der IMWG-Kriterien erfolgt ([3]; Tab. 4), die Bestimmung von Albumin, LDH und β2-Mikroglobulin essenziell. Zum Ausschluss einer Plasmazellleukämie sollte eine zytomorphologische Begutachtung des peripheren Blutausstrichs erfolgen.
| ISS | R‑ISS | |
|---|---|---|
| Stadium I |
β2-Mikroglobulin < 3,5 mg/l und Albumin ≥ 3,5 g/dl |
β2-Mikroglobulin ≤ 3,5 mg/l und Albumin ≥ 3,5 g/dl und zytogenetisch Standardrisiko und LDH ≤ oberer Normwert |
| Stadium II |
Entweder: β2-Mikroglobulin < 3,5 mg/l und Albumin < 3,5 g/dl oder: β2-Mikroglobulin 3,5–5,4 mg/l |
Weder Stadium I noch III |
| Stadium III | β2-Mikroglobulin ≥ 5,5 mg/l bei jedem Albumin-Wert |
β2-Mikroglobulin ≥ 5,5 mg/l und zytogenetisch Hochrisiko oder LDH > oberer Normwert |
LDH Laktatdehydrogenase
Zur weiteren Planung der Therapie ist die Einschätzung der Organfunktionen relevant, daher sollten eine Lungenfunktionsuntersuchung und Echokardiographie durchgeführt werden.
Merke.
Für die Diagnosestellung eines MM ist eine Knochenmarkpunktion mit aussagekräftigem Material essenziell.
Erläutern Sie das Therapiekonzept für diesen Patienten. Wie sähe es aus, wenn der Patient 76 Jahre alt wäre?
Das primäre Therapiekonzept bei Patienten mit MM unterscheidet sich grundsätzlich anhand der Hochdosisfähigkeit der Patienten. Für Patienten, die aufgrund ihres Alters (i. d. R. ≤ 70 Jahre), Allgemeinzustands und ausreichend guter Organfunktionen für eine Hochdosistherapie infrage kommen, setzt sich die Erstlinientherapie folgendermaßen zusammen:
Induktionstherapie,
- Intensivierung, bestehend aus
- Stammzellmobilisierung und darauf folgender Hochdosis-Melphalan-Chemotherapie mit autologer Stammzellreinfusion, sowie anschließende
Lenalidomid-Erhaltungstherapie.
Die Festlegung auf die (Nicht‑)Hochdosisfähigkeit ist kein unveränderliches Statut, sondern sollte im Verlauf der Therapie stets überprüft werden. So kann sich z. B. der Performance-Status der Patienten im Laufe der ersten Therapiezyklen so deutlich verbessern, dass diese entgegen einer initialen Einschätzung einer Hochdosistherapie zugeführt werden können. Bei Patienten, die nicht für eine Hochdosistherapie geeignet sind, wird ein kontinuierlicher Therapieansatz verfolgt.
Bei Patienten mit Hochrisikozytogenetik oder anderweitigen Hochrisikomyelomen (insbesondere R‑ISS 3) ist eine primäre Tandemtransplantation empfohlen. Grundsätzlich sollte eine Therapie im Rahmen einer klinischen Studie bei allen Patienten evaluiert werden [4].
Merke.
Die Festlegung auf die (Nicht‑)Hochdosisfähigkeit ist kein unveränderliches Statut, sondern sollte im Verlauf der Therapie stets überprüft werden.
Welche Substanzklassen kommen in der Therapie des Multiplen Myeloms zum Einsatz?
In der Therapie des MM kommen v. a. folgende Substanzen zum Einsatz:
Proteasom-Inhibitoren (Bortezomib, Carfilzomib, Ixazomib),
immunmodulatorische Substanzen (Lenalidomid, Thalidomid, Pomalidomid),
Glukokortikoide (v. a. Dexamethason),
- monoklonale Antikörper
- (Daratumumab und Isatuximab gegen CD38, „cluster of differentiation 38“, und
- Elotuzumab gegen SLAM F7, „signaling lymphocytic activation molecule F7“),
Histon-Deacetylase-Inhibitoren (Panobinostat) sowie seit Kurzem
Antikörper-Immun-Konjugate (Belantamab-Mafodotin).
Die klassische Chemotherapie spielt v. a. im Rahmen der Hochdosistherapie (Melphalan) und vorherigen Stammzellmobilisierung (i. d. R. Cyclophosphamid-basiert) eine Rolle. Auch in späten Therapielinien bzw. bei hochaggressiven Verläufen können Chemotherapeutika wieder zum Einsatz kommen (z. B. Bendamustin, Cyclophosphamid, Cisplatin, Doxorubicin, Etoposid).
Für die Zukunft werden zunehmend zielgerichtetere und zelluläre Therapien erwartet; zwei CAR-T‑Zell-Präparate für das MM in späteren Therapiestadien sind seit kurzem zugelassen, einige bispezifische Antikörper stehen kurz vor der Zulassung.
Welche Parameter benötigen Sie zur Remissionskontrolle, und wie teilt sich diese ein?
Die Remissionskontrolle beim MM wird gemäß den Kriterien der IMWG [5] bestimmt und teilt sich ein in
PD (Krankheitsprogression),
SD (stabile Erkrankung),
PR (partielle Remission),
VGPR (sehr gute partielle Remission),
CR (komplette Remission),
sCR (stringente komplette Remission)
und ergänzend Negativität für MRD (minimale Resterkrankung).
Zur vollständigen Bestimmung wird
eine Serumeiweißelektrophorese inkl. M‑Protein-Bestimmung,
die Bestimmung der freien Leichtketten und
eine Immunfixation im Serum sowie
ein 24-h-Sammelurin mit Eiweißelektrophorese und Immunfixation
benötigt.
Um eine Remission anzugeben, bedarf es stets einer Bestätigung (d. h. 2 konsekutive Messungen). Vereinfachend liegt bei 50 % Reduktion der Parameter eine PR vor, bei Reduktion um mindestens 90 % eine VGPR. Wenn bei negativer Immunfixation in Serum und Urin der Verdacht auf eine CR besteht, muss eine Knochenmarkpunktion zur Bestätigung (< 5 % Plasmazellen) erfolgen. Im Fall von extramedullären Manifestationen ist außerdem eine Bildgebungsuntersuchung erforderlich (Tab. 5).
| M‑Protein Eiweißelektrophorese (Serum/Urin) | Immunfixation (Serum und Urin) | Quotient der freien Leichtketten im Serum | Extramedulläre Manifestation (falls vorhanden) | Plasmazellinfiltration im Knochenmark | |
|---|---|---|---|---|---|
|
Stringente CR (alle Kriterien erfüllt) |
– | Negativ | Normalisiert | Nicht nachweisbar | ≤ 5 %, immunhistochemisch keine klonalen Plasmazellen |
|
CR (alle Kriterien) |
– | Negativ | – | Nicht nachweisbar | ≤ 5 % |
|
VGPR (alle Kriterien) |
Serum: ≥ 90 % Reduktion + Urin: < 100 mg/24 h oder: kein M‑Protein in Serum und Urin nachweisbar |
Nachweisbar | – | – | – |
| PR |
Serum: ≥ 50 % Reduktion + ≥ 90 % Reduktion im Urin oder < 200 mg/24 h |
– | > 50 % Reduktion der Differenz (wenn M‑Protein nicht bestimmbar) | > 50 % Reduktion (obligat) | > 50 % Reduktion der Infiltration (sofern vor Therapie > 30 %) |
| SD | Weder Kriterien von sCR, CR, VGPR, PD erfüllt | ||||
| PD (mindestens 1 Kriterium) |
Serum: ≥ 25 % Anstieg + absolut ≥ 5 g/l und/oder ≥ 25 % Anstieg im Urin oder absolut ≥ 200 mg/24 h |
– | ≥ 25 % Anstieg der Differenz der freien Leichtketten, absolut mindestens 100 mg/l | Neuauftreten/Progress | ≥ 25 % Anstieg (gemessen am niedrigsten gemessenen Infiltrationsgrad) und absolut ≥ 10 % absolut |
| Refraktärität | Fortschreitende Erkrankung unter Therapie oder innerhalb von 60 Tagen nach Therapieende | ||||
CR komplette Remission, PD Krankheitsprogression, PR partielle Remission, sCR stringente komplette Remission, SD stabile Erkrankung, VGPR sehr gute partielle Remission
Im seltenen Fall asekretorischer Myelome kann eine Remissionskontrolle nur mittels Bildgebung (bei extramedullären Plasmozytomen, EMP, bzw. ossären Manifestationen) und Knochenmarkpunktion verlässlich erfolgen.
Merke.
Zu einer vollständigen Remissionsbeurteilung gehört immer auch ein 24-h-Sammelurin!
Welche weiteren supportiven Maßnahmen sind zu berücksichtigen?
Da bei diesem Patienten ausgeprägte Osteolysen der Wirbelsäule vorliegen (Abb. 1), ist eine wirbelsäulenchirurgische Vorstellung zur Stabilitätsbeurteilung sowie ggf. Planung einer Kyphoplastie oder größeren Stabilisierung indiziert.
Gemäß internationaler Empfehlungen ist bei Patienten mit MM die Einleitung einer antiresorptiven Therapie empfohlen. Diese erfolgt durch
zunächst monatliche Anwendung von Bisphosphonaten (v. a. Zoledronsäure) bzw. bei Kontraindikationen Denosumab.
Nach 2 Jahren wird das Intervall bei stabiler Erkrankungssituation auf 3‑Monats-Intervalle verlängert oder pausiert.
Wichtig ist eine zahnärztliche bzw. Mund-Kiefer-Gesichts(MKG)-chirurgische Vorstellung und Freigabe vor der Therapieeinleitung sowie
regelmäßige (mindestens 2 ×/Jahr) Vorstellungen unter Therapie aufgrund des Risikos antiresorptivainduzierter Osteonekrosen des Kiefers (ARONJ).
Es ist auf
eine Auffrischung der von der Ständigen Impfkommission (STIKO) empfohlenen Schutzimpfungen zu achten, insbesondere auch COVID‑19- und jährliche Influenzaimpfungen.
Nach einer Hochdosistherapie muss darüber hinaus der gesamte Impfschutz erneuert werden.
Da ein sekundärer Immunglobulinmangel bei Patienten mit MM eine häufige Erscheinung ist, die zu weiter erhöhtem Infektionsrisiko beitragen kann, kann bei ≥ 2 antibiotikapflichtigen Infekten/Jahr eine Substitution von Immunglobulinen parenteral erfolgen.
Darüber hinaus gelten auch für Patienten mit MM
Grundsätze der Infektionsprophylaxe (unter Proteasominhibition ist eine antivirale Prophylaxe mit Aciclovir verpflichtend!),
Magenschutz unter Therapie mit Kortison und nichtsteroidalen Antirheumatika (NSAR),
eine Schmerzeinstellung gemäß Stufenschema der Weltgesundheitsorganisation (WHO) sowie
die Berücksichtigung sozialmedizinischer Aspekte [4].
Merke.
Es besteht bei allen Patienten mit MM die Indikation zur Einleitung einer antiresorptiven Therapie.
Welche Besonderheiten sind bei der Verordnung von immunmodulatorischen Substanzen zu beachten?
Die Verordnung der immunmodulatorischen Substanzen (IMiD) Thalidomid, Lenalidomid und Pomalidomid bedarf der Registrierung im sog. T‑Register der Bundesopiumstelle des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) des Verschreibenden. Hintergrund ist die stark teratogene Wirkung der IMiD, aufgrund derer eine Schwangerschaft unter IMiD-Therapie unbedingt zu verhindern ist.
Die Ausgabe von T‑Rezepten an den Patienten bedarf einer gesonderten Aufklärung über den Umgang (insbesondere Schwangerschaftsverhütung) mit den Kapseln, die auf dem Rezept dokumentiert wird. Darüber hinaus muss der Patient über die Erhöhung des Thromboserisikos unter IMiD-Therapie und die daher verpflichtende Thromboseprophylaxe aufgeklärt werden. Weitere Aspekte des Aufklärungsgesprächs umfassen die Erhöhung des Sekundärmalignomrisikos, aufgrund dessen regelmäßige Vorsorgeuntersuchungen erfolgen sollen, das Risiko von Zytopenien und Infektionen (Patientenschulung zum Verhalten bei fieberhaften Infekten), Haut- sowie gastrointestinalen Nebenwirkungen.
Einhaltung ethischer Richtlinien
Interessenkonflikt
L. Leypoldt und K. Weisel geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien. Für Bildmaterial oder anderweitige Angaben innerhalb des Manuskripts, über die Patienten zu identifizieren sind, liegt von ihnen und/oder ihren gesetzlichen Vertretern eine schriftliche Einwilligung vor.
Footnotes
Dieser Beitrag erschien zuerst in Der Onkologe 2021 · 27 (Suppl 1):S27–S32 10.1007/s00761-021-00978-9
Literatur
- 1.Herold, et al. Innere Medizin. 2021. p. 587. [Google Scholar]
- 2.Rajkumar SV, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014;15(12):e538–e548. doi: 10.1016/S1470-2045(14)70442-5. [DOI] [PubMed] [Google Scholar]
- 3.Palumbo A, et al. Revised international staging system for multiple myeloma: a report from international myeloma working group. J Clin Oncol. 2015;33(26):2863–2869. doi: 10.1200/JCO.2015.61.2267. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Onkopedia-Leitlinie „Multiples Myelom“, Stand: Mai 2018
- 5.Kumar S, et al. International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma. Lancet Oncol. 2016;17(8):e328–e346. doi: 10.1016/S1470-2045(16)30206-6. [DOI] [PubMed] [Google Scholar]