Abstract
目的
构建预测极早产儿住院期间死亡风险的列线图模型。
方法
回顾性分析2015年1月至2019年12月郑州大学第三附属医院新生儿科收治的极早产儿1 714例的临床资料。按7∶3比率将1 714例极早产儿随机分为训练队列(1 179例)和验证队列(535例),通过logistic回归分析筛选独立预测因子并建立列线图模型,并由验证集评估列线图预测模型的可行性。最后,分别采用受试者工作特征曲线下面积(area under curve,AUC)、校准曲线和决策曲线分析对模型的鉴别能力、准确性和临床实用性进行评估。
结果
1 714例极早产儿中,住院期间死亡260例,存活1 454例。对训练集进行多因素logistic回归分析后筛选出胎龄<28周、出生体重<1 000 g、重度窒息、重度脑室内出血(intraventricular hemorrhage,IVH)、Ⅲ~Ⅳ级新生儿呼吸窘迫综合征(respiratory distress syndrome,RDS)、败血症、剖宫产、孕母产前使用糖皮质激素等8个变量建立列线图预测模型。训练队列中列线图模型预测极早产儿住院期间死亡发生的AUC为0.790(95%CI:0.751~0.828),验证队列中列线图模型预测极早产儿住院期间死亡发生的AUC为0.808(95%CI:0.754~0.861)。Hosmer-Lemeshow拟合优度检验显示出较好的拟合度(P>0.05)。决策曲线分析显示当训练队列和验证队列的阈值概率分别为10%~60%和10%~70%时对极早产儿进行临床干预具有较高的净收益。
结论
构建并验证了预测极早产儿住院期间死亡风险的预测模型,可帮助临床医生预测极早产儿住院期间的死亡概率。
Keywords: 死亡, 危险因素, 列线图, 预测模型, 极早产儿
Abstract
Objective
To establish a nomogram model for predicting the risk of death of very preterm infants during hospitalization.
Methods
A retrospective analysis was performed on the medical data of 1 714 very preterm infants who were admitted to the Department of Neonatology, the Third Affiliated Hospital of Zhengzhou University, from January 2015 to December 2019. These infants were randomly divided into a training cohort (1 179 infants) and a validation cohort (535 infants) at a ratio of 7∶3. The logistic regression analysis was used to screen out independent predictive factors and establish a nomogram model, and the feasibility of the nomogram model was assessed by the validation set. The area under the receiver operating characteristic curve (AUC), calibration curve, and decision curve analysis (DCA) were used to assess the discriminatory ability, accuracy, and clinical applicability of the model.
Results
Among the 1 714 very preterm infants, 260 died and 1 454 survived during hospitalization. By the multivariate logistic regression analysis of the training set, 8 variables including gestational age <28 weeks, birth weight <1 000 g, severe asphyxia, severe intraventricular hemorrhage (IVH), grade III-IV respiratory distress syndrome (RDS), and sepsis, cesarean section, and use of prenatal glucocorticoids were selected and a nomogram model for predicting the risk of death during hospitalization was established. In the training cohort, the nomogram model had an AUC of 0.790 (95%CI: 0.751-0.828) in predicting the death of very preterm infants during hospitalization, while in the validation cohort, it had an AUC of 0.808 (95%CI: 0.754-0.861). The Hosmer-Lemeshow goodness-of-fit test showed a good fit (P>0.05). DCA results showed a high net benefit of clinical intervention in very preterm infants when the threshold probability was 10%-60% for the training cohort and 10%-70% for the validation cohort.
Conclusions
A nomogram model for predicting the risk of death during hospitalization has been established and validated in very preterm infants, which can help clinicians predict the probability of death during hospitalization in these infants.
Keywords: Death, Risk factor, Nomogram, Predictive model, Very preterm infant
早产是重要的全球性健康问题,是新生儿死亡的主要原因,预防早产及合理管理早产儿是产科及新生儿科医生共同面临的挑战[1]。随着机械通气支持技术的进步及对肺发育不成熟治疗技术的提升,早产儿的存活率显著提高,但仍有一定的病死率和严重并发症的发生率[2-3]。早产并发症是早产儿近期不良结局的主要原因,而存活下来的早产儿在远期也更容易合并生长发育问题及神经系统等方面的问题,而极早产儿死亡、并发症及不良神经结局的发生率更高[4]。列线图(nomogram)是一种可视化的统计模型,根据筛选的预测指标在预测模型中所占比重来计算发生某种风险评分,并得出相关临床事件发生概率的大小,方便临床医生对疾病进行识别与处理[5]。我国早产儿的管理及救治水平与发达国家相比仍有一定差距,早产儿转归及长期预后也存在差异。本研究通过回顾性分析住院期间死亡与存活极早产儿的临床特征,分析不同因素对早产儿结局的影响,并通过筛选出的影响因素绘制极早产儿住院期间死亡风险列线图模型,为临床工作提供参考。
1. 资料与方法
1.1. 研究对象
选取2015年1月1日至2019年12月30日在郑州大学第三附属医院新生儿重症监护室住院的早产儿作为研究对象。其纳入标准为:(1)胎龄<32周;(2)出生后7 d内在郑州大学第三附属医院新生儿病房住院。排除标准为:(1)胎儿信息不完整;(2)孕母信息不完整;(3)患新生儿遗传代谢性疾病。该研究已获郑州大学第三附属医院医学伦理委员会批准(批准号:2022-064-01)及患儿家属的知情同意。
1.2. 资料收集
(1)围生期基本信息:孕母产前糖皮质激素使用、分娩方式、是否合并妊娠高血压综合征、是否多胎妊娠,以及是否有宫内窘迫、胎盘早剥、绒毛膜羊膜炎;(2)一般资料:性别、胎龄、出生体重、是否小于胎龄儿、机械通气情况、是否使用肺泡表面活性物质(pulmonary surfactant,PS);(3)住院期间并发症:低血糖、重度窒息、Ⅲ~Ⅳ级呼吸窘迫综合征(respiratory distress syndrome,RDS)、败血症、Ⅲ期坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、早产儿视网膜病变(retinopathy of prematurity,ROP)、中重度支气管肺发育不良(bronchopulmonary dysplasia,BPD)、重度脑室内出血(intraventricular hemorrhage,IVH)、脑室周围白质软化(periventricular leukomalacia,PVL);(4)住院转归情况。
1.3. 相关研究指标定义
产科疾病是产科医师依据第4版《实用妇产科学》[6]进行的疾病诊断。早产儿的并发症是指住院期间出现的疾病。新生儿败血症的诊断标准参考《新生儿败血症诊断及治疗专家共识(2019年版)》[7],确诊需要满足血培养或脑脊液培养中发现致病细菌。临床败血症的诊断要求有临床异常表现的情况下满足下列条件中任何一项:(1)血液非特异性检查≥2项阳性;(2)脑脊液检查呈化脓性脑膜炎改变。根据发生败血症的日龄,生后72 h内发生的为早发型败血症(early-onset sepsis,EOS),超过72 h发生的为晚发型败血症(late-onset sepsis,LOS)。中重度BPD的诊断标准参考2018年美国国立儿童健康与人类发育研究所提出的定义与分度标准[8]。其余住院期间并发症的诊断标准均参照第5版《实用新生儿学》[9]。
1.4. 研究对象分组
为建立和验证预测模型,对符合条件的极早产儿根据7∶3的比率,使用SPSS 22.0随机分为训练队列和验证队列。训练队列用于分析死亡的影响因素及建立列线图模型,验证队列用于内部验证。根据患儿住院期间预后分为存活组和死亡组。存活患儿包括治愈出院或好转出院;死亡患儿包括医院内救治无效死亡、放弃治疗后医院内死亡或出院时病情不稳定放弃治疗后死亡。
1.5. 统计学分析
采用SPSS 22.0统计软件对所有变量进行单因素logistic回归分析,选取P<0.05的因素纳入多因素logistic回归分析,采用LR向后法并根据赤池信息量准则(Akaike information criterion,AIC)选取最佳拟合模型,使用Stata 15.0绘制列线图。依靠区分度、校准度和临床净收益3个方面评估预测模型,以受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under curve,AUC)评估区分度;校准曲线和Hosmer-Lemeshow拟合优度检验评估校准度;决策曲线分析(decision curve analysis,DCA)评估临床有效性。
2. 结果
2.1. 一般资料
共纳入1 714例早产儿。使用SPSS 22.0统计软件按照7∶3的比率随机分为训练队列(n=1 179)和验证队列(n=535)。训练队列中存活患儿999例,死亡患儿180例;验证队列中存活患儿455例,死亡患儿80例。训练队列和验证队列中极早产儿的一般情况、母孕期资料、住院期间资料及死亡情况在两组间差异均无统计学意义(P>0.05),见表1。
表1.
训练队列与验证队列一般资料比较 [n(%)]
| 项目 | 训练队列(n=1 179) | 验证队列(n=535) | 值 | P值 |
|---|---|---|---|---|
| 一般情况 | ||||
| 胎龄<28周 | 127(10.77) | 66(12.34) | 0.902 | 0.342 |
| 出生体重<1 000 g | 162(13.74) | 75(14.02) | 0.024 | 0.877 |
| 男孩 | 664(56.32) | 313(58.50) | 0.717 | 0.397 |
| 双/多胎 | 391(33.16) | 182(34.02) | 0.121 | 0.728 |
| 小于胎龄儿 | 120(10.18) | 49(9.16) | 0.430 | 0.512 |
| 剖宫产 | 792(67.18) | 336(62.80) | 3.126 | 0.077 |
| 重度窒息 | 52(4.41) | 26(4.86) | 0.171 | 0.679 |
| 母孕期资料 | ||||
| 产前使用糖皮质激素 | 970(82.27) | 443(82.80) | 0.072 | 0.789 |
| 妊娠高血压综合征 | 362(30.70) | 142(26.54) | 3.071 | 0.080 |
| 宫内窘迫 | 260(22.05) | 117(21.87) | 0.007 | 0.932 |
| 胎盘早剥 | 88(7.46) | 41(7.66) | 0.021 | 0.885 |
| 绒毛膜羊膜炎 | 20(1.70) | 9(1.68) | <0.001 | 0.983 |
| 住院期间资料 | ||||
| 机械通气 | ||||
| 无 | 239(20.27) | 105(19.63) | ||
| ≤7 d | 590(50.04) | 274(51.21) | 0.211 | 0.900 |
| >7 d | 350(29.69) | 156(29.16) | ||
| 低血糖 | 9(0.76) | 8(1.50) | 2.008 | 0.156 |
| Ⅲ~Ⅳ级RDS | 296(25.11) | 119(22.24) | 1.644 | 0.200 |
| 使用PS | 1 097(93.04) | 503(94.02) | 0.562 | 0.453 |
| Ⅲ期NEC | 14(1.19) | 9(1.68) | 0.681 | 0.409 |
| ROP | 40(3.39) | 16(2.99) | 0.188 | 0.664 |
| 中重度BPD | 54(4.58) | 23(4.30) | 0.068 | 0.795 |
| 重度IVH | 49(4.16) | 21(3.93) | 0.050 | 0.823 |
| PVL | 32(2.71) | 18(3.36) | 0.550 | 0.458 |
| 败血症 | 276(23.41) | 123(22.99) | 0.036 | 0.849 |
| 死亡 | 180(15.27) | 80(14.95) | 0.028 | 0.867 |
注:[RDS]呼吸窘迫综合征;[PS]肺泡表面活性物质;[NEC]坏死性小肠结肠炎;[ROP]早产儿视网膜病变;[BPD]支气管肺发育不良;[IVH]脑室内出血;[PVL]脑室周围白质软化。
2.2. 影响极早产儿住院期间死亡的单因素分析
单因素logistic回归分析显示,胎龄<28周、出生体重<1 000 g、重度窒息、剖宫产、孕母产前使用糖皮质激素、机械通气、Ⅲ~Ⅳ级RDS、中重度BPD、重度IVH和败血症与极早产儿住院期间死亡风险相关(P<0.05),见表2。
表2.
极早产儿住院期间死亡影响因素的单因素logistic回归分析 [n(%)]
| 项目 | 存活组 (n=999) | 死亡组 (n=180) | P | OR(95%CI) |
|---|---|---|---|---|
| 一般情况 | ||||
| 胎龄<28周 | 71(7.1) | 56(31.1) | <0.001 | 5.903(3.968~8.782) |
| 出生体重<1 000 g | 89(8.9) | 73(40.6) | <0.001 | 6.976(4.825~10.085) |
| 男孩 | 562(56.3) | 102(56.7) | 0.919 | 1.017(0.738~1.401) |
| 双/多胎 | 322(32.2) | 69(38.3) | 0.110 | 1.307(0.941~1.815) |
| 小于胎龄儿 | 97(9.7) | 23(12.8) | 0.212 | 1.362(0.839~2.213) |
| 剖宫产 | 690(69.1) | 102(56.7) | 0.001 | 0.586(0.424~0.810) |
| 重度窒息 | 23(2.3) | 29(16.1) | <0.001 | 8.150(4.593~14.461) |
| 母孕期资料 | ||||
| 产前使用糖皮质激素 | 834(83.5) | 136(75.6) | 0.011 | 0.612(0.419~0.893) |
| 妊娠高血压综合征 | 309(30.9) | 53(29.4) | 0.359 | 0.921(0.773~1.098) |
| 宫内窘迫 | 213(21.3) | 47(26.1) | 0.155 | 1.304(0.905~1.879) |
| 胎盘早剥 | 75(7.5) | 13(7.2) | 0.893 | 0.959(0.520~1.768) |
| 绒毛膜羊膜炎 | 19(1.9) | 1(0.6) | 0.227 | 0.288(0.038~2.166) |
| 住院期间资料 | ||||
| 机械通气 | ||||
| 无 | 236(23.6) | 3(1.7) | ||
| ≤7 d | 465(46.5) | 125(69.4) | <0.001 | 1.554(1.229~1.966) |
| >7 d | 298(29.8) | 52(28.9) | ||
| 低血糖 | 6(0.6) | 3(1.7) | 0.147 | 2.805(0.695~11.320) |
| Ⅲ~Ⅳ级RDS | 214(21.4) | 82(45.6) | <0.001 | 3.069(2.207~4.269) |
| 使用PS | 927(92.8) | 170(94.4) | 0.424 | 1.320(0.668~2.610) |
| Ⅲ期NEC | 10(1.0) | 4(2.2) | 0.175 | 2.248(0.697~7.246) |
| ROP | 39(3.9) | 1(0.6) | 0.051 | 0.138(0.019~1.007) |
| 中重度BPD | 40(4.0) | 14(7.8) | 0.029 | 2.022(1.076~3.799) |
| 重度IVH | 26(2.6) | 23(12.8) | <0.001 | 5.482(3.052~9.849) |
| PVL | 28(2.8) | 4(2.2) | 0.660 | 0.788(0.273~2.275) |
| 败血症 | 212(21.2) | 64(35.6) | <0.001 | 2.048(1.457~2.880) |
注:[RDS]呼吸窘迫综合征;[PS]肺泡表面活性物质;[NEC]坏死性小肠结肠炎;[ROP]早产儿视网膜病变;[BPD]支气管肺发育不良;[IVH]脑室内出血;[PVL]脑室周围白质软化。
2.3. 影响极早产儿住院期间死亡的多因素分析
选择单因素分析有统计学意义的变量进行LR向后逐步回归分析,并根据AIC最小原则,建立了回归模型。进入该模型的变量包括:胎龄<28周、出生体重<1 000 g、孕母产前使用糖皮质激素、剖宫产、重度窒息、Ⅲ~Ⅳ级RDS、重度IVH、败血症,见表3。
表3.
极早产儿住院期间死亡影响因素的多因素logistic回归分析
| 变量 | B | SE | Wald | P | OR | 95%CI |
|---|---|---|---|---|---|---|
| 胎龄<28周 | 0.682 | 0.268 | 6.486 | 0.011 | 1.977 | 1.170~3.340 |
| 出生体重<1 000 g | 1.393 | 0.233 | 35.689 | <0.001 | 4.028 | 2.550~6.361 |
| 孕母产前使用糖皮质激素 | -0.381 | 0.223 | 2.919 | 0.088 | 0.683 | 0.442~1.058 |
| 剖宫产 | -0.416 | 0.196 | 4.492 | 0.034 | 0.660 | 0.449~0.969 |
| 重度窒息 | 1.272 | 0.336 | 14.316 | <0.001 | 3.566 | 1.846~6.891 |
| Ⅲ~Ⅳ级RDS | 0.943 | 0.191 | 24.264 | <0.001 | 2.567 | 1.764~3.736 |
| 重度IVH | 1.077 | 0.344 | 9.810 | 0.002 | 2.937 | 1.497~5.764 |
| 败血症 | 0.361 | 0.199 | 3.288 | 0.070 | 1.435 | 0.971~2.120 |
| 常数项 | -2.215 | 0.240 | 78.144 | <0.001 | 0.119 | - |
注:[RDS]呼吸窘迫综合征;[IVH]脑室内出血。
2.4. 极早产儿住院期间死亡风险的列线图的构建
根据以上多因素分析确定的影响因素绘制列线图(图1)。根据变量是否进行赋分,每个变量两个赋值点分别对应“0分”或“得分”,将各变量的得分相加,得到总分,即可得出极早产儿死亡的预测概率。例如某早产儿:若胎龄26周,得分为5分;出生体重900 g,得10分;剖宫产出生,得0分;无重度窒息,得0分;Ⅲ级IVH,得8分;Ⅱ级RDS,得0分;母产前使用糖皮质激素,得0分;住院期间未患败血症,得0分。则这个早产儿合计总分为23分,根据列线图(图1)总分23分对应的死亡概率在0.5~0.6之间,可预测该早产儿住院期间死亡概率在50%~60%之间。
图1. 极早产儿住院期间死亡风险的预测模型列线图 根据变量是否进行赋分,每个变量两个赋值点分别对应“0分”或“得分”,将各变量的得分相加,得到总分,即可得出极早产儿死亡的预测概率。.

2.5. 预测模型的验证
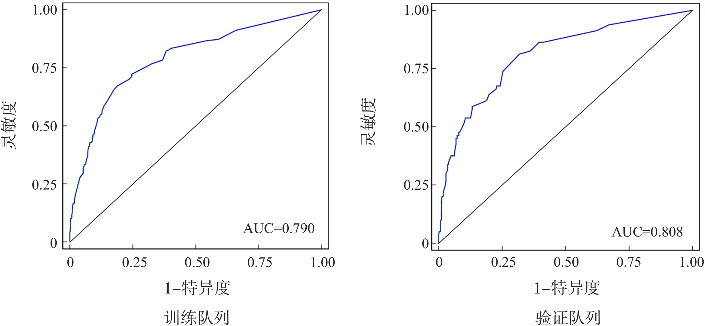
利用ROC曲线和Hosmer-Lemeshow检验对模型验证,训练队列和验证队列均对列线图模型进行验证,训练队列中列线图预测模型预测极早产儿住院期间死亡发生的AUC为0.790(95%CI:0.751~0.828),验证队列中列线图预测模型预测的 AUC为0.808(95%CI:0.754~0.861),提示模型鉴别能力良好,见图2。同时,Hosmer-Lemeshow拟合优度检验显示出较好的拟合度(训练队列P=0.204;验证队列P=0.475),其模型拟合曲线与训练队列和验证队列数据中的理想曲线之间的差异均无统计学意义,表明该模型预测概率与实际概率基本一致,具有较好准确性,见图3。
图3. 预测模型的校准曲线 横轴为列线图模型预测极早产儿住院期间发生死亡的概率,纵轴为实际发生的概率,黑实线代表最优型的预测效能,蓝色实线代表不同分组拟合出的预测概率曲线,代表列线图模型的预测效能,与黑实线越接近其列线图模型的预测效能越好。.

2.6. 预测模型的临床适用度
利用DCA评估预测模型的临床有效性,极早产儿住院期间死亡风险列线图的DCA见图4。结果显示,当训练队列和验证队列的阈值概率分别为10%~60%和10%~70%时对极早产儿进行临床干预具有较高的净收益。
图4. 预测模型的DCA分析 横坐标为阈概率,纵坐标代表实际净收益。“无”线表示所有极早产儿均不采取措施,其净收益为0,“全部”线表示所有极早产儿均采取措施得到的净收益,“预测模型”线表示列线图模型预测极早产儿发生住院期间死亡风险的净收益。.

图2. 极早产儿住院期间死亡的ROC曲线.
3. 讨论
新生儿中约一半为早产儿,我国是早产儿数量最多的国家之一,全球每年分娩早产儿1 500万,我国占7.8%,随着围生医学和新生儿重症医学的发展,早产儿存活率逐渐提高[10-11]。本研究回顾性分析了2015~2019年期间郑州大学第三附属医院收治的极早产儿的临床资料,纳入了22个变量对极早产儿住院期间死亡的影响因素进行分析。通过单因素和多因素logistic回归分析,并根据AIC最小原则,最终纳入胎龄<28周、出生体重<1 000 g、重度窒息、重度IVH、Ⅲ~Ⅳ级RDS、孕母产前使用糖皮质激素、剖宫产等8个因素绘制列线图模型,并进行了内部验证。通过该模型,可简单通过患儿一般情况、母孕期情况及住院期间并发症等临床情况对极早产儿住院期间是否发生死亡风险进行预测,为临床治疗提供有力的依据。
胎龄及出生体重是影响早产儿的关键因素。Schindler等[12]在一项多中心研究中,通过对4 454例极早产儿进行分析得出,胎龄22~25周、26~28周、29~31周极早产儿的病死率分别为34.1%、8.6%、1.9%。我国新生儿协作网[13]通过对2019年来自全国25个省57家三级医院收治的9 952例极早产儿进行分析得出,极早产儿在出院时的存活率为87.6%。在这些极早产儿中共有8 171例(85.5%)接受了完全医疗管理治疗,其中7 792例极早产儿存活出院,存活率为95.4%。在不同胎龄间的存活率分别为:<25周65.6%,26~27周89.0%,28~29周94.9%,30~31周98.3%。新生儿窒息是新生儿期死亡和儿童期神经发育障碍的主要原因[14-15]。在不同国家和地区,新生儿窒息的发生率及病死率有较大差异,我国新生儿窒息导致的病死率为0.25%~5%[16]。国内一项多中心研究通过对2 467例极早产儿的死亡危险因素进行分析得出,1 min Apgar评分≤3分是极早产儿早期死亡的危险因素[17]。廖鸣慧等[18]通过对湖南省2009~2019年期间新生儿死亡原因进行分析得出,新生儿窒息是导致新生儿死亡最主要的原因。Schindler等[12]对新南威尔士州和澳大利亚首都地区10个医院4 454例极早产儿进行分析后得出,合并重度IVH是导致其死亡的危险因素。在芬兰的一项研究中[19],通过对存活时间大于48 h的1 353例极早产儿进行死亡风险分析,重度IVH是死亡的危险因素。在中等收入国家,RDS是导致新生儿死亡的主要原因[20]。埃及的一项前瞻性研究中,通过对2017年7月至2018年7月收治的312例新生儿进行分析得出,共有145例(46.5%)患有呼吸系统疾病,最主要的呼吸系统疾病为RDS(49.6%),且是导致死亡的最主要原因[21]。新生儿败血症是引起新生儿死亡的重要原因之一,在新生儿死亡的人群中,16%的新生儿死于新生儿败血症[22]。Giannoni等[23]通过对2011年9月至2015年12月429例诊断为败血症的新生儿进行回顾性分析得出,瑞士新生儿败血症的发生率为1.43‰(活产儿),病死率为11%,并且在早产的患儿中,病死率更高。倪文泉等[24]通过对98例早产儿的死亡原因进行分析后得出,感染性疾病是早产儿死亡的第二大原因。
随着药物治疗的发展,孕妇产前应用糖皮质激素治疗通过模拟生理应激水平,提高了早产儿的存活率。我国一项多中心研究中通过对2 392例超低出生体重儿或超早产儿进行分析得出产前使用糖皮质激素可以改善其存活率[25]。在加拿大一项全国性的队列研究中,通过对43 456例胎龄<34周的早产儿进行回顾性分析得出,产前应用糖皮质激素可以降低早产儿的死亡及神经发育受损的风险[26]。在妊娠32周之前,阴道分娩可能存在一定的风险,目前对于分娩方式的选择仍有一定争议。多项报道认为阴道分娩会增加新生儿的病死率。Pierre等[27]回顾性研究了1997~2015年期间妊娠期<28周的产妇得出,阴道分娩的早产儿病死率是剖宫产分娩早产儿的2倍。Godeluck等[28]通过对法国两个经济不同地区的极早产儿进行分析得出,在相对发达地区,剖宫产是极早产儿死亡的保护因素。
本研究通过logistic回归分析,并根据AIC最小原则筛选出8个因素构建预测模型,列线图结果分别对8个危险因素进行评分,将8个影响因素的得分相加得到总分,根据总分可以得出极早产儿死亡的预测概率。使用随机抽样将符合条件的患儿分为训练队列和验证队列,以评价预测模型的效能,在对建立的列线图模型验证时,对模型的鉴别能力、准确性和临床实用性进行评估均有良好的效能。与以往的早产儿死亡预测模型[29]相比,本研究以极早产儿为研究对象并且建立了简单直观的列线图。本研究病例是在单中心中获得,通过回顾性研究建立了列线图模型,建立的模型缺乏外部数据的验证来证实模型的区分度、校准度及临床适用度。因此,在今后的研究中,有必要采取多中心研究,并选取外部数据对模型进行优化及验证。
综上所述,本研究纳入胎龄<28周、出生体重<1 000 g、重度窒息、重度IVH、Ⅲ~Ⅳ级RDS、孕母产前使用糖皮质激素、剖宫产等8个指标构建了极早产儿住院期间死亡预测的列线图模型,该模型可以帮助临床医生预测极早产儿住院期间的死亡概率,早期识别院内预后不良的高危患儿,从而更好地进行高质量的临床管理。
基金资助
河南省卫生计生科技创新型人才“51282”工程(2016088)。
参 考 文 献
- 1. Chawanpaiboon S, Vogel JP, Moller AB, et al. Global, regional, and national estimates of levels of preterm birth in 2014: a systematic review and modelling analysis[J]. Lancet Glob Health, 2019, 7(1): e37-e46. DOI: 10.1016/S2214-109X(18)30451-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. Lorch SA. A decade of improvement in neonatal intensive care: how do we continue the momentum?[J]. JAMA Pediatr, 2017, 171(3): e164395. DOI: 10.1001/jamapediatrics.2016.4395. [DOI] [PubMed] [Google Scholar]
- 3. Kaempf J, Morris M, Steffen E, et al. Continued improvement in morbidity reduction in extremely premature infants[J]. Arch Dis Child Fetal Neonatal Ed, 2021, 106(3): 265-270. DOI: 10.1136/archdischild-2020-319961. [DOI] [PubMed] [Google Scholar]
- 4. Pascal A, Govaert P, Oostra A, et al. Neurodevelopmental outcome in very preterm and very-low-birthweight infants born over the past decade: a meta-analytic review[J]. Dev Med Child Neurol, 2018, 60(4): 342-355. DOI: 10.1111/dmcn.13675. [DOI] [PubMed] [Google Scholar]
- 5. Wang Y, Sun K, Shen J, et al. Novel prognostic nomograms based on inflammation-related markers for patients with hepatocellular carcinoma underwent hepatectomy[J]. Cancer Res Treat, 2019, 51(4): 1464-1478. DOI: 10.4143/crt.2018.657. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. 徐丛剑, 华克勤. 实用妇产科学[M]. 4版. 北京: 人民卫生出版社, 2018: 149-206. [Google Scholar]
- 7. 中华医学会儿科学分会新生儿学组, 中国医师协会新生儿科医师分会感染专业委员会 . 新生儿败血症诊断及治疗专家共识(2019年版)[J]. 中华儿科杂志, 2019, 57(4): 252-257. DOI: 10.3760/cma.j.issn.0578-1310.2019.04.005. [DOI] [PubMed] [Google Scholar]
- 8. Higgins RD, Jobe AH, Koso-Thomas M, et al. Bronchopulmonary dysplasia: executive summary of a workshop[J]. J Pediatr, 2018, 197: 300-308. DOI: 10.1016/j.jpeds.2018.01.043. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. 邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 5版. 北京: 人民卫生出版社, 2019: 557-1027. [Google Scholar]
- 10. Hug L, Alexander M, You D, et al. National, regional, and global levels and trends in neonatal mortality between 1990 and 2017, with scenario-based projections to 2030: a systematic analysis[J]. Lancet Glob Health, 2019, 7(6): e710-e720. DOI: 10.1016/S2214-109X(19)30163-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Qiao J, Wang Y, Li X, et al. A lancet commission on 70 years of women's reproductive, maternal, newborn, child, and adolescent health in China[J]. Lancet, 2021, 397(10293): 2497-2536. DOI: 10.1016/S0140-6736(20)32708-2. [DOI] [PubMed] [Google Scholar]
- 12. Schindler T, Koller-Smith L, Lui K, et al. Causes of death in very preterm infants cared for in neonatal intensive care units: a population-based retrospective cohort study[J]. BMC Pediatr, 2017, 17(1): 59. DOI: 10.1186/s12887-017-0810-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Cao Y, Jiang S, Sun J, et al. Assessment of neonatal intensive care unit practices, morbidity, and mortality among very preterm infants in China[J]. JAMA Netw Open, 2021, 4(8): e2118904. DOI: 10.1001/jamanetworkopen.2021.18904. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Ao D, Guo S, Yun C, et al. Socio-demographic factors impact disabilities caused by perinatal asphyxia among Chinese children[J]. PLoS One, 2021, 16(3): e0248154. DOI: 10.1371/journal.pone.0248154. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. Mamo SA, Teshome GS, Tesfaye T, et al. Perinatal asphyxia and associated factors among neonates admitted to a specialized public hospital in South Central Ethiopia: a retrospective cross-sectional study[J]. PLoS One, 2022, 17(1): e0262619. DOI: 10.1371/journal.pone.0262619. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. 刘丽华, 张强, 曲丽. 四川省某三甲医院新生儿窒息的危险因素分析[J]. 广西医科大学学报, 2019, 36(4): 605-609. DOI: 10.16190/j.cnki.45-1211/r.2019.04.027. [DOI] [Google Scholar]
- 17. 江苏省NICU母乳喂养质量改进临床研究协作组 . 江苏省13家医院极早产儿死亡危险因素分析[J]. 中华新生儿科杂志, 2021, 36(5): 24-29. DOI: 10.3760/cma.j.issn.2096-2932.2021.05.006. [DOI] [Google Scholar]
- 18. 廖鸣慧, 黄群, 龙小兰, 等. 2009-2019年湖南省新生儿死亡情况分析[J]. 中国妇幼保健, 2020, 35(21): 3917-3920. DOI: 10.19829/j.zgfybj.issn.1001-4411.2020.21.002. [DOI] [Google Scholar]
- 19. Härkin P, Marttila R, Pokka T, et al. Survival analysis of a cohort of extremely preterm infants born in Finland during 2005-2013[J]. J Matern Fetal Neonatal Med, 2021, 34(15): 2506-2512. DOI: 10.1080/14767058.2019.1668925. [DOI] [PubMed] [Google Scholar]
- 20. Mwita S, Jande M, Katabalo D, et al. Reducing neonatal mortality and respiratory distress syndrome associated with preterm birth: a scoping review on the impact of antenatal corticosteroids in low- and middle-income countries[J]. World J Pediatr, 2021, 17(2): 131-140. DOI: 10.1007/s12519-020-00398-6. [DOI] [PubMed] [Google Scholar]
- 21. Baseer KAA, Mohamed M, Abd-Elmawgood EA. Risk factors of respiratory diseases among neonates in neonatal intensive care unit of Qena University Hospital, Egypt[J]. Ann Glob Health, 2020, 86(1): 22. DOI: 10.5334/aogh.2739. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22. Liu L, Oza S, Hogan D, et al. Global, regional, and national causes of child mortality in 2000-13, with projections to inform post-2015 priorities: an updated systematic analysis[J]. Lancet, 2015, 385(9966): 430-440. DOI: 10.1016/S0140-6736(14)61698-6. [DOI] [PubMed] [Google Scholar]
- 23. Giannoni E, Agyeman PKA, Stocker M, et al. Neonatal sepsis of early onset, and hospital-acquired and community-acquired late onset: a prospective population-based cohort study[J]. J Pediatr, 2018, 201: 106-114.e4. DOI: 10.1016/j.jpeds.2018.05.048. [DOI] [PubMed] [Google Scholar]
- 24. 倪文泉, 陈名武, 潘家华, 等. 98例早产儿死亡原因分析[J]. 中华全科医学, 2018, 16(9): 1475-1478. DOI: 10.16766/j.cnki.issn.1674-4152.000403. 30008826 [DOI] [Google Scholar]
- 25. 超未成熟儿与超低出生体重儿研究协作组 . 超未成熟儿与超低出生体重儿产前糖皮质激素使用情况及其对预后影响的多中心调查[J]. 中华围产医学杂志, 2020, 23(5): 302-310. DOI: 10.3760/cma.j.cn113903-20190823-00512. [DOI] [Google Scholar]
- 26. Melamed N, Murphy K, Barrett J, et al. Benefit of antenatal corticosteroids by year of birth among preterm infants in Canada during 2003-2017: a population-based cohort study[J]. BJOG, 2021, 128(3): 521-531. DOI: 10.1111/1471-0528.16511. [DOI] [PubMed] [Google Scholar]
- 27. Pierre C, Leroy A, Pierache A, et al. Is vaginal delivery of a fetus in breech presentation at an extremely preterm gestational age associated with an increased risk of neonatal death? A comparative study[J]. PLoS One, 2021, 16(10): e0258303. DOI: 10.1371/journal.pone.0258303. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28. Godeluck A, Gérardin P, Lenclume V, et al. Mortality and severe morbidity of very preterm infants: comparison of two French cohort studies[J]. BMC Pediatr, 2019, 19(1): 360. DOI: 10.1186/s12887-019-1700-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29. Sheikhtaheri A, Zarkesh MR, Moradi R, et al. Prediction of neonatal deaths in NICUs: development and validation of machine learning models[J]. BMC Med Inform Decis Mak, 2021, 21(1): 131. DOI: 10.1186/s12911-021-01497-8. [DOI] [PMC free article] [PubMed] [Google Scholar]


