Abstract
Introduction
La vaccination contre le coronavirus constitue l’une des pierres angulaires dans la gestion de la crise sanitaire liée au COVID-19. Alors que la vaccination confère une protection efficace chez les sujets immunocompétents, son immunogénicité dans la population atteinte de rhumatisme inflammatoire chronique (RIC) n’est pas clairement établie.
Méthodes
Nous avons conduit une étude monocentrique rétrospective évaluant la réponse sérologique après deux doses de vaccination contre le coronavirus chez des patients adultes atteints de RIC et traités par traitements ciblés ou biologiques (n = 123). Les titres d’anticorps IgG dirigés contre la protéine spike du coronavirus (SARS-CoV-2) ont été mesurés après la seconde dose de vaccin. De plus, nous avons conduit une recherche systématique jusqu’au 31 septembre 2021 dans les bases de données PUBMED, preprint et littérature grise non encore publiée des études observationnelles des taux sérologiques après vaccination chez des patients atteints de RIC traités par médicaments ciblés ou biologiques (numéro d’enregistrement PROSPERO : CRD42021259410). Les études rapportant la taille d’échantillon, la date, le pays d’origine, le taux de séroconversion ont été incluses. Nous avons ensuite conduit une méta-analyse afin d’identifier des facteurs associés à la séroconversion.
Résultats
Sur nos 123 patients (âge médian 66 ans écart interquartile (EI) 57–75), 69,9 % ont séroconverti après 2 doses de vaccination. Les patients ayant eu une séroconversion étaient plus âgés que ceux qui n’en ont pas eu. Les patients traités par rituximab sont ceux qui ont le moins répondu à la vaccination. Nous avons identifié 20 études de séroprévalence en plus de notre cohorte, représentant un total de 4423 patients dans 11 pays. La méta-analyse a confirmé un impact négatif sur le taux de séroconversion du rituximab et dans une moindre mesure de l’abatacept, du léflunomide et du méthotrexate.
Conclusion
Le rituximab diminue la réponse sérologique à la vaccination contre le SARS-Cov2 chez les patients atteints de RIC. Ce travail suggère également un impact négatif de l’abatacept, du méthotrexate ou du léflunomide particulièrement en cas d’association à un médicament biologique.
Mots clés: COVID-19, Vaccination anti-Sars-Cov2, Taux de séroconversion, Rhumatisme inflammatoire chronique, Maladie auto-immune, Méta-analyse
1. Introduction
Les patients traités par immunosuppresseurs ont un surisque infectieux. Les recommandations internationales préconisent une mise à jour du calendrier vaccinal avant le début du traitement immunosuppresseur [1]. Des travaux précédents sur la vaccination anti-pneumoccoccique ou anti-grippale ont montré une diminution de l’immunogénicité des vaccins chez les patients traités par médicaments immunosuppresseurs [2], [3], [4], [5]. Une revue de littérature récente publiée par Friedman MA et al. a mis en évidence l’impact négatif des traitements antirhumatismaux de fond conventionnels synthétiques (csDMARDs) tels que le méthotrexate et les médicaments biologiques tels que le rituximab ou l’abatacept sur l’immunogénicité de différents vaccins [6]. L’efficacité et la sécurité des vaccins contre la COVID-19 ont été évaluées dans de grands essais cliniques [7], [8], [9], [10], mais les patients atteints de rhumatismes inflammatoires chroniques (RIC) ont été exclus de ces essais en raison d’un risque théorique de poussée inflammatoire, d’induction de maladies inflammatoires [11] et d’une possible réponse immunitaire altérée en raison des traitements immunosuppresseurs. Bien que l’infection aiguë sévère par le coronavirus de type 2 (SARS-CoV-2) ne survienne pas nécessairement plus fréquemment en population immunodéprimée que chez des sujets sains [12], il a été montré qu’elle était en revanche plus sévère chez les patients traités par rituximab, mycophénolate mofétil ou corticostéroïdes à forte dose [13], [14], [15], [16], [17], [18]. C’est l’une des raisons pour laquelle, malgré des données limitées d’efficacité et de tolérance des vaccins contre la COVID-19 en population immunodéprimée, la vaccination de ces patients a été considérée comme prioritaire notamment dans les recommandations de l’American College of Rheumatology (ACR) [19].
Plusieurs études rapportent les taux de séroconversion après vaccination chez des patients atteints de RIC [20], [21], [22], [23], [24], [25], [26], [27], [28], [29], [30], [31], [32], [33], [34], [35], [36], [37], [38], [39]. Dans cette étude, notre objectif était de synthétiser les données d’immunogénicité des vaccins pour identifier des groupes à haut risque de mauvaise réponse et d’attirer l’attention des services de santé publique sur l’impact des traitements immunosuppresseurs dans la stratégie vaccinale.
2. Methodes
2.1. Design de l’étude de cohorte et patients
Des patients majeurs atteints de RIC ont été recrutés entre mars 2021 et septembre 2021 dans les services de rhumatologie et médecine interne du Centre Hospitalier Lyon Sud. Les patients ayant bénéficié d’un dosage sérologique d’anticorps IgG anti-spike après avoir reçu un schéma vaccinal complet avec 2 doses ont été inclus de manière rétrospective. Les patients présentant un antécédent d’infection à la COVID-19 confirmée par RT-PCR étaient exclus de cette étude. Grâce aux dossiers informatisés, les éléments du diagnostic, du suivi de l’activité de la maladie, les paramètres biologiques et les traitements reçus dans les 3 mois précédents la vaccination ont été recueillis. Les patients éligibles ont été informés. Les patients devaient remplir les critères d’inclusion suivants : avoir un diagnostic établi de RIC, un âge ≥ 18 ans, recevoir un traitement ciblé ou biologique, avoir reçu 2 injections de vaccin contre le coronavirus (BNT162b2 mRNA [Pfizer-BioNTech], mRNA-1273 [NIH-Moderna]), ChAdOx1 nCoV-19 [Oxford–AstraZeneca]), et avoir bénéficié d’une sérologie réalisée par un test commercial dosant les IgG (ou Ig totales) dirigées contre la protéine spike. Le seuil de positivité de chaque test a été utilisé pour définir les répondeurs et non répondeurs. Les titres d’anticorps ont été standardisés en BAU/mL conformément aux recommandations de l’organisation mondiale de la santé [40].
Les caractéristiques des patients à l’inclusion ont été analysées à l’aide de statistiques descriptives. Les variables catégorielles ont été comparées par chi-2 et les variables continues par le test non paramétrique de Wilcoxon. Afin d’identifier les facteurs associés à la séroconversion, une analyse par régression logistique univariée a été conduite puis une analyse multivariée incluant les paramètres présentant des différences significatives entre répondeurs et non répondeurs au seuil de significativité p < 0,1. Les Odds ratios (OR) sont présentés avec leur intervalle de confiance à 95 % (IC 95 %). Les différences sont considérées significatives lorsque p < 0,05. Les analyses ont été réalisées sur le logiciel R 4.0.3 (R Foundation for Statistical Computing, Vienna, Austria).
Le protocole de l’étude a été approuvé par le comité d’éthique des Hospices Civils de Lyon (Protocole numéro 21_572, avis favorable du 6 septembre 2021).
2.2. Méta-analyse
Le protocole de la méta-analyse a été enregistré avant le début de l’étude dans le registre international prospectif des revues systématiques (PROSPERO), disponible à partir du lien suivant : https://www.crd.york.ac.uk/prospero/display_record.php?ID=CRD42021259410, numéro d’enregistrement : CRD42021259410. L’étude a été conduite selon les recommandations internationales de méta-analyse des études observationnelles épidémiologiques (MOOSE) [41].
2.2.1. Stratégie de recherche de la littérature.
Nous avons consulté la base de donnée MEDLINE référençant les publications en anglais jusqu’au 31 septembre 2021 grâce à l’équation de recherche Pubmed (Document S1)[voir le matériel complémentaire accompagnant la version en ligne de cet article].
Le premier niveau de sélection a été réalisé par deux reviewers indépendants (MA et BL) sur la base de la lecture du titre et de l’abstract. Le deuxième niveau de sélection a également été réalisé par deux reviewers indépendants (MA et BC) en lisant l’article en intégralité. Les critères d’inclusion étaient les suivants :
-
•
patients présentant un RIC, traités par médicament conventionnel synthétique, un traitement ciblé ciblé ou biologique utilisés en pratique rhumatologique quotidienne (méthotrexate (MTX), léflunomide (LEF), hydroxychloroquine (HCQ), sulfasalazine (SLZ), corticostéroïdes (CS), anti-TNF, anti-IL-6 récepteur (anti-IL-6R), anti-IL-17, anti-IL-1R, abatacept, rituximab, bélimumab). Par exemple les patients présentant une maladie inflammatoire des intestins étaient inclus s’ils étaient traités par anti-TNF mais pas par vedolizumab ;
-
•
avoir reçu deux doses de vaccin contre le coronavirus ((BNT162b2 mRNA [Pfizer-BioNTech], mRNA-1273 [NIH-Moderna]), ChAdOx1 nCoV-19 [Oxford–AstraZeneca], CoronaVac [Sinovac Life Science Co.]), ou seulement une pour le vaccin Ad26.COV2.S [Jonhson and Jonhson] ;
-
•
cohorte incluant au moins 6 patients ;
-
•
données sérologiques rapportées selon les traitements.
Les critères d’exclusion étaient les suivants :
-
•
données insuffisantes concernant le traitement ou la maladie des patients ;
-
•
un antécédent d’infection à SARS-CoV2 (confirmée par RT-PCR) avant la vaccination ;
-
•
publication dans une autre langue que l’anglais.
2.2.2. Extraction des données et évaluation de la qualité des études incluses
Les données de chaque étude ont été extraites indépendamment par deux auteurs (MA et FC) : nom du premier auteur, titre de l’article, année et mois de publication, nom de la revue, pays d’origine dans lequel l’étude a été conduite (ou les pays dans le cas d’étude multicentrique), les effectifs, l’âge, le sexe, les traitements ciblés ou biologiques des participants. Nous avons également extrait de potentiels facteurs confondants tels que la co-prescription d’autres immunosuppresseurs. Les différences d’extraction entre les deux auteurs ont été résolues par consensus. La qualité des études incluses a été évaluée par un investigateur (MA) grâce aux critères de qualité de Newcastle-Ottawa qui explorent trois domaines d’interêt : sélection, comparabilité et la fiabilité du critère de jugement d’interêt des études de cohorte [42]. Les études avec un score ≥ 5 étoiles étaient considérées de bonne qualité alors que les études présentant un score < 5 étoiles étaient considérées de faible qualité.
2.2.3. Analyses statistiques.
La proportion de patients avec une sérologie SARS-CoV2 positive et l’intervalle de confiance à 95 % (IC 95 %) ont été estimés par transformation arcine pour l’ensemble des traitements et chacun des traitements individuellement. L’hétérogénéité entre les estimations de chaque étude a été évaluée par l’index I2 d’inconsistence [43], et le modèle effet aléatoire a été choisi a priori en raison d’une forte hétérogénéité attendue. Le biais de publication a été déterminé par l’aspect du funnel plot. Les analyses ont été réalisées sur R version 4.0.3 (R Foundation for Statistical Computing, Vienna, Austria) grâce aux packages « meta » et « metafor ».
3. Resultats
3.1. Cohorte
Au total, 123 patients (76,4 % de femmes) ont été inclus avec un âge médian de 66 ans (écarts interquartiles (EI) 57–75). Parmi eux, 92 patients (74,8 %) étaient atteints de polyarthrite rhumatoïde (PR), 17 (13,8 %) de spondyloarthrite (SpA) et 7 (5,7 %) de rhumatisme psoriasique (RP). La durée moyenne d’évolution de la maladie était de 18,6 (±10,9) ans. Aucun patient n’avait présenté d’antécédent d’infection COVID-19 symptomatique. Tous les patients ont reçu au moins deux doses de vaccin et 19 patients (15,4 %) en ont reçu trois. Les vaccins à ARN messagers étaient les plus fréquemment utilisés (pour 120 patients (97,6 %)), mais 3 patients (2,3 %) ont reçu un vaccin à adénovirus. La sérologie a été réalisée après une durée médiane de 47 jours EI (30–57) après la seconde injection.
Le taux global de réponse sérologique était de 69,9 % (86/123). Les caractéristiques des patients ayant séroconverti et ceux n’ayant pas séroconverti sont présentées dans le Tableau 1 . Il n’y avait pas de différence significative entre les deux groupes en terme de sexe, de durée d’évolution de la maladie, d’intervalle entre les deux doses de vaccin et de délai entre la deuxième dose et la sérologie. À noter, les patients sans séroversion étaient statistiquement plus âgés que ceux avec séroconversion (respectivement âge médian 74 ans EI(59-79) vs. 64 ans EI(56-73), p < 0,05).
Tableau 1.
Caractéristiques des populations de répondeurs et non-répondeurs.
| Effectif total n = 123 |
Répondeurs n = 86/123 (69,9 %) |
Non repondeurs n = 37/123 (30,1 %) |
|
|---|---|---|---|
| Âge, médiane (EI) | 66 [57–75] | 64 [56–73] | 74 [59–79]a |
| Sexe féminin, n (%) | 94 (76,4) | 65 | 29b |
| Vaccin | |||
| BNT162b2 ARNm [Pfizer-BioNTech], n (%) | 105 (85,4) | 72 | 33 |
| ARNm-1273 [NIH-Moderna], n (%) | 9 (7,3) | 8 | 1 |
| vaccine ARNm non précisé, n (%) | 6 (4,9) | 3 | 3 |
| ChAdOx1 nCoV-19 [Oxford–AstraZeneca], n (%) | 3 (2,44) | 3 | 0 |
| Nombre de jours entre les 2 doses, médiane (EI) | 30 [27–32] | 30 [28–33] | 28 [28–32]b |
| Délai entre la seconde dose et la sérologie, médiane (EI) | 47 [30–57] | 42 [28–63] | 57 [34–86]b |
| Maladies | |||
| PR, n (%) | 92 (74,8) | 59/92 | 33/92 |
| SpA, n (%) | 17 (13,8) | 15/17 | 2/17 |
| RP, n (%) | 7 (5 | 6/7 | 1/7 |
| Autres, n (%) | 7 (5 | 6/7 | 1/7 |
| Durée d’évolution, médiane (EI) | 17 [9–26] | 15 [8–24] | 19 [12–26]b |
| Traitements | |||
| Rituximab, n (%) | 43 (35,9) | 14/43(32,5) | 29/43(67,4) |
| J1/J15, n (%) | −20 (16,3) | −3/20 (15) | −17/20 (85) |
| J1 seul, n (%) | −23 (18,7) | −11/23 (47,8) | −12/23 (52,2) |
| Abatacept, n (%) | 6 (4,9) | 5/6 (83,3) | 1/6 (6,7) |
| Bélimumab, n (%) | 1 (0,8) | 1/1 (100) | 0/1 (0) |
| Anti-TNF, n (%) | 39 (31,7) | 34/39 (87,2) | 5/39 (12,8) |
| Monothérapie | − 13 (10,6) | − 12/13 (92,3) | − 1/13 (7,7) |
| + MTX | − 26 (21,1) | − 22/26 (84,6) | − 4/26 (15,4) |
| Tocilizumab, n (%) | 27 (21,9) | 26/27 (96,3) | 1/27 (3,7) |
| Monothérapie | − 14/27 (51,9) | − 14/14 (100) | − 0/14 (0) |
| + MTX | − 13/27 (48,1) | − 12/13 (92,3) | − 1/13 (7,7) |
| Ixékizumab, n (%) | 2 (1,6) | 2/2 (100) | 0/2 (0) |
| Anti-JAK, n (%) | 5 (4,1) | 4/5 (80) | 1/5 (20) |
EI : écarts interquartiles ; PR : polyarthrite rhumatoïde ; SpA : spondyloarthrite ; RP : rhumatisme psoriasique ; J1 : jour 1 ; J15 : jour 15 ; MTX : méthotrexate.
p < 0,05.
p non significatif (les comparaisons sont faites entre répondeurs et non-répondeurs).
Dans notre cohorte, nous avons retrouvé une séroconversion chez 34/39 (87,2 %) patients traités par anti-TNF et 26/27 (96,3 %) patients traités par anti-IL-6R. Parmi les patients traités par abatacept, 5/6 (83,3 %) ont séroconverti et 4/5 (80 %) patients traités par anti-JAK avaient une sérologie positive. Le rituximab était associé à une diminution significative du taux de séroconversion avec seulement 14/43 patients (32,6 %) qui ont séroconverti en comparaison à 72/80 (90 %) parmi les patients traités par les autres médicaments biologiques ou ciblés. Dans l’analyse multivariée (après ajustement sur l’âge et le délai entre la seconde dose et la sérologie), le rituximab était associé à un OR à 0,06 IC95 % [0,00–0,50] (p < 0,05) de séroconversion par rapport aux anti-TNF (Tableau 2 ).
Tableau 2.
Facteurs associés à la séroconversion : analyse univariée et multivariée.
| Analyse univariée |
Analyse multivariée |
|||
|---|---|---|---|---|
| Caractéristiques | ORa | IC 95 %a | ORa | IC 95 %a |
| Sexe féminin | 1,17 | 0,48–3,09b | ||
| Âge | 0,98 | 0,95–1,01b | ||
| Maladie | ||||
| Autre | – | – | ||
| PR | 0,30 | 0,02–1,85b | ||
| SpA | 1,25 | 0,05–15,7b | ||
| RP | 1,00 | 0,03–29,5b | ||
| Traitements Biologiques |
||||
| Anti-TNF | – | – | – | – |
| Autres | 0,88 | 0,16–6,73b | 1,04 | 0,07–27,8b |
| Rituximab | 0,07 | 0,02–0,21c | 0,07 | 0,00–0,67d |
| Anti-IL-6R | 3,82 | 0,57–75,6b | 1,94 | 0,14–47,2b |
| csDMARDs | ||||
| Aucun ou autre | – | – | ||
| MTX ou LEF | 0,59 | 0,26–1,30b | ||
| Dose de cortisone | 0,92 | 0,82–1,03b | ||
| Délai entre seconde dose et sérologie Sous-groupe rituximab |
0,99 | 0,98–1,00d | 0,96 | 0,92–1,00b |
| Nombre de cellules CD19+ | 1,01 | 0,99–1,05b | ||
| Nombre de cellules CD20+ | 1,01 | 0,99–1,05b | ||
| Délai entre les 2 doses de vaccin | 1,06 | 1,00, 1,14b | 0,99 | 0,98–1,19b |
| Durée d’évolution de la maladie | 0,98 | 0,95, 1,02b | ||
MTX : méthotrexate ; LEF : léflunomide.
OR : Odds ratio, IC : intervalle de confiance.
p non significatif.
p < 0,01.
p < 0,05.
En considèrant le sous-groupe de patients traités par rituximab, nous avons démontré que le délai entre la dernière perfusion et la première dose de vaccin était significativement plus long chez les répondeurs que chez les non-répondeurs (respectivement délai médian 174 (EI 161–240) jours chez les répondeurs vs 121 (IQR 73–188) jours chez les non-répondeurs).
Nous avons ensuite analysé l’impact du type de protocole de rituximab (i.e 1 g administré à jour 1 (J1) et J15 tous les 6 mois ou 1 g seulement à J1 tous les 6 mois ou plus) : dans le groupe J1 seul, 48 % des patients ont séroconverti, contre seulement 15 % dans le groupe J1/J15 (analyse univariée OR 0,19, IC 95 % 0,04–0,77), différence restant significative après ajustement sur le délai entre la dernière perfusion de rituximab et la première dose de vaccin OR 0,14, IC 95 % 0,018–0,74).
Le nombre moyen de cellules CD19 positives (lorsque cette donnée était disponible, n = 14) était plus élevé chez les patients ayant une sérologie positive (72/μL vs. 30/μL, p non significatif). À noter, 11 des patients traités par rituximab ont reçu une troisième dose de vaccination et seulement un patient a présenté une séroconversion après cette troisième dose.
Enfin, nous avons constaté dans notre cohorte que le titre moyen d’anticorps standardisé (n = 106) était significativement plus bas lorsque les patients étaient traités par combothérapie associant médicament biologique ou ciblé et méthotrexate comparativement à un traitement biologique ou ciblé en monothérapie sans méthotrexate (767 BAU/mL vs. 359 BAU/mL, test Wilcoxon p < 0,05).
3.2. Méta-analyse
Un total de 1179 publications a été identifié grâce à l’équation de recherche. Trente cinq résultats ont passé le premier niveau de sélection et finalement vingt articles provenant de 11 pays différents ont été inclus dans la méta-analyse en plus de notre étude de cohorte (Fig. 1 ). Les caractéristiques de ces études sont rapportées dans le Tableau 3 . La plupart de ces études (19/21) portent sur la réponse aux vaccins à ARN messagers (BNT162b2 mRNA [Pfizer-BioNTech], mRNA-1273 [NIH-Moderna]), une étude a utilisé ChAdOx1 nCoV-19 [Oxford–AstraZeneca], et une étude a utilisé le vaccin CoronaVac [Sinovac Life Science Co.]. Toutes les études ont mesuré les anticorps IgG dirigés contre la protéine spike en utilisant différents kit commerciaux. Les titres d’anticorps ont été mesurés entre 2 et 16 semaines après la seconde dose de vaccination. L’inspection visuelle du funnel plot n’indique pas de biais de publication (Document S2). Les critères NOS sont présentés dans le document S3. Le taux global de seroconversion après deux doses de vaccins (tous traitements confondus) était de 84,8 % (IC95 %78,9–89,8) avec un haut niveau d’hétérogénéité (I2 = 96 %).
Fig. 1.
Flow chart.
Tableau 3.
Caractéristiques des études incluses dans la méta-analyse.
| Source |
Participants |
Vaccin |
Sérologie |
||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Premier auteur | Effectifs selon la pathologie | Nombre total de participants, n | Sexe féminin, n | Âge, moyenne ou médiane | ARNm-1273 [NIH-Moderna] n | BNT162b2 ARNm [Pfizer-BioNTech] n | ChAdOx1 nCoV-19 [Oxford–AstraZeneca] n | CoronaVac [Sinovac Life Science Co.] n | Ad26.COV2.S [Jonhson and Jonhson] n | Méthode | Seuil de positivité (AU/mL) |
| Ammitzboll C. et al. | 73 PR 61 LS |
134 | 90 | 65,7 | – | 134 | – | – | – | Vitros | 1 |
| Auroux M. et al. | 92 PR 17 SpA 7 RP 7 autres |
123 | 94 | 65,3 | 9 | 105 | 3 | – | – | Siemens | 1 |
| Braun-Moscovici Y. et al. | 96 PR 30 RP 21 SpA 87 CTD 19 vascularites 11 autres |
264 | 201 | 57,6 | – | 264 | – | – | – | Abbott Architect | 50 |
| Furer V. et al. | 263 PR 165 RP 68 SpA 101 LS 19 myosites 93 vascularites |
686 | 475 | 59 | – | 686 | – | – | – | Diasorin | 15 |
| Geisen U.M. et al. | 8 PR 3 SpA 6 RP/Pso 2 LS 7 autres |
26 | 17 | 50,5 | NA | NA | NA | NA | NA | Euroimmun | NA |
| Haberman R.H. et al. | 22 PR 24 RP 5 autres |
51 | 36 | 56,01 | – | 51 | – | – | – | Euroimmun | 5,7 |
| Kappelman M.D. et al. | 171 MICI | 171 | 128 | 47,4 | 81 | 90 | – | – | – | Labcorp | 1 |
| Kennedy N.A. et al. | 20 MICI | 20 | NA | NA | – | 20 | – | – | – | Roche | 15 |
| Medeiros-Ribeiro A. et al. | RIC | 859 | 660 | 51 | – | – | – | 859 | – | NA | 69 |
| Mrak D. et al. | 33 PR 22 CTD 17 vascularites 2 autres |
74 | 57 | 61,7 | 13 | 61 | – | – | – | Roche | 1 |
| Rubbert-Roth A. et al. | 51 PR | 51 | 29 | 64,6 | 9 | 44 | – | – | – | Roche | 15 |
| Ruddy J.A. et al. | 180 PR 87 LS 24 myosites 105 CTD 8 vascularites |
404 | 385 | 44 | 204 | 198 | – | – | – | Roche | 0,79 |
| Simon D. et al. | 27 SpA 8 Pso 25 PR 16 autres |
84 | 55 | 53,1 | – | 84 | – | – | – | Euroimmun | NA |
| Simon D. et al. | 3 PR 1 myosites 4 autres |
8 | 5 | 53,5 | – | 8 | – | – | – | Euroimmun | 0,8 |
| Spiera R. et al. | 23 PR 10 LS 6 RP 19 CTD 20 vascularites 11 autres |
89 | 68 | 61,3 | 38 | 51 | – | – | – | Roche | NA |
| Veenstra J. et al. | RIC | 8 | 7 | 55,9 | NA | NA | NA | NA | NA | NA | 25 |
| Boekel L et al. | NA | 106 | NA | 63 | NA | NA | NA | NA | NA | In-house | 4 |
| Chiang TP et al. | 461 IA 283 CTD 216 LS 54 myosites 22 vascularites |
1039 | 875 | NA | 994 | – | – | 45 | Roche | NA | – |
| Moor MB. et al. | 6 PR 6 SLE 21 vascularites 15 CTD 48 autres |
96 | 51 | 67 | 38 | 58 | – | – | – | Euroimmun | 1,1 |
| Picchianti-Diamanti A et al. | 35 PR | 35 | 27 | 59 | – | 35 | – | – | – | Abbott Architect | 1,4 |
| Seror R et al. | 98 PR 15 RP |
113 | 81 | 61,8 | NA | NA | NA | NA | NA | NA | NA |
| Source |
Nombre de seroconversion/Nombre de patients traités |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Biologiques |
csDMARDs |
||||||||||||
| Premier auteur | Rituximab, n | Abatacept, n | Bélimumab, n | Anti-TNF, n | Anti-IL-6R, n | Anti-IL-17, n | Anti-JAK, n | MTX, n | HCQ, n | LEF, n | SLZ, n | GC, n | GC dose moyenne (mg/jour) |
| Ammitzboll C. et al. | 4/17 | 3/6 | 3/3 | 31/36 | 6/8 | – | 6/8 | 32/46 | 34/38 | 6/8 | – | 27/37 | NA |
| Auroux M. et al. | 14/43 | 5/6 | 1/1 | 34/39 | 26/27 | 2/2 | 4/5 | 40/59 | 1/1 | 6/11 | – | 17/28 | 6,54 |
| Braun-Moscovici Y. et al. | 24/46 | 5/8 | 9/11 | 63/63 | 35/35 | 4/5 | 9/9 | 68/78 | – | – | – | 76/92 | 5,6 |
| Furer V. et al. | 36/87 | 10/16 | 7/9 | 167/172 | 37/37 | 47/48 | 41/45 | 148/176 | 120/133 | 25/28 | – | 86/130 | 6,7 |
| Geisen U.M. et al. | – | – | 1/1 | 13/13 | 1/1 | 2/2 | – | – | 3/3 | 2/2 | 1/1 | 7/7 | NA |
| Haberman R.H. et al. | – | – | – | ??/31 | – | – | – | 18/25 | – | – | – | – | NA |
| Kappelman M.D. et al. | – | – | – | 122/132 | – | 38/39 | – | – | – | – | – | – | NA |
| Kennedy N.A. et al. | – | – | – | 17/20 | – | – | – | – | – | – | – | – | – |
| Medeiros-Ribeiro A. et al. | 8/19 | 20/49 | 17/30 | 86/131 | 33/45 | 26/28 | 15/18 | 131/219 | 182/254 | 84/121 | 61/71 | 188/330 | 5 |
| Mrak D. et al. | 29/74 | – | – | – | – | – | – | 10/24 | 3/7 | 2/4 | 1/1 | 8/22 | NA |
| Rubbert-Roth A. et al. | – | 4/5 | – | 17/18 | – | – | 8/12 | 24/28 | – | – | – | 16/17 | 5 |
| Ruddy J.A. et al. | 5/19 | 24/24 | 53/56 | 98/98 | 6/7 | 14/14 | 15/15 | 92/94 | 160/170 | 19/19 | 14/15 | 96/117 | 21 |
| Simon D. et al. | – | – | – | 11/11 | – | – | – | – | 3/3 | – | 1/1 | 10/10 | NA |
| Simon D. et al. | 0/8 | – | – | – | – | – | – | – | – | – | – | – | NA |
| Spiera R. et al. | 10/30 | 1/1 | 1/2 | 9/9 | 1/2 | 2/2 | 6/6 | 12/13 | 17/19 | 2/3 | 1/1 | 12/17 | NA |
| Veenstra J. et al. | – | – | – | 1/1 | – | 1/1 | 0/1 | 1/1 | 1/1 | – | – | 1/2 | NA |
| Boekel L et al. | 3/7 | – | – | 22/23 | – | – | – | 25/27 | – | – | – | 4/5 | NA |
| Chiang TP et al. | – | – | – | – | – | – | – | – | – | – | – | – | – |
| Moor MB. et al. | 47/96 | – | – | – | – | – | – | – | – | – | – | – | – |
| Picchianti-Diamanti A et al. | – | 12/13 | – | 7/7 | 8/8 | – | – | 5/5 | – | – | – | – | – |
| Seror R et al. | – | – | – | – | – | – | 100/113 | – | – | – | – | – | – |
MTX : méthotrexate ; GC : glucocorticoïdess ; HCQ : hydroxychloroquine ; LEF : léflunomide ; SLZ : sulfasalazine ; PR : polyarthrite rhumatoïde ; LS : lupus systémique ; SpA : spondyloarthrite ; Pso : psoriasis ; RP : rhumatisme psoriasique ; CTD : connectivite ; MICI : maladie inflammatoire chronique des intestins ; RIC : rhumatisme inflammatoire chronique ; csDMARDs : traitements de fond antirhumatismaux conventionnels synthétiques ; NA : non disponible.
Concernant les csDMARDS, l’hydroxychloroquine et la sulfasalazine étaient associés aux plus hauts taux de séroconversion (respectivement 88,0 % [IC 95 % 77,6–95,4 ; I2 = 85 %] pour l’hydroxychloroquine et 88,4 % [IC 95 % 81,1–94,2 ; I2 = 0 %] pour la sulfasalazine) (Fig. 2 ). Le méthotrexate (qu’il soit utilisé en monothérapie ou en combothérapie avec d’autres traitements) était associé à un plus faible taux de réponse sérologique à 81,9 % [IC 95 % 71,6–90,3 ; I2 = 90 %].
Fig. 2.
Forrest plots des taux de séroconversion en fonction de chaque DMARD conventionnel synthétique.
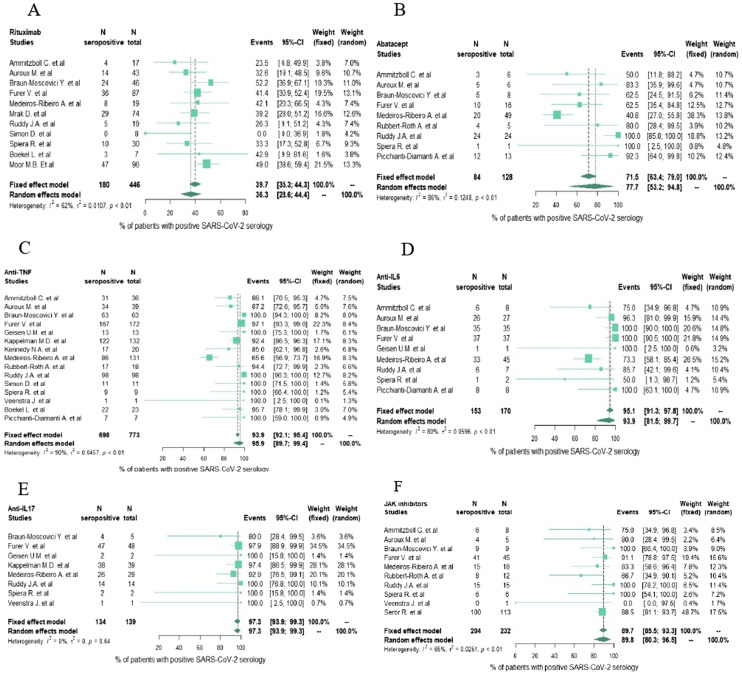
Parmi les patients traités par thérapie ciblée ou biologique (Fig. 3 ), le rituximab était associé aux plus bas taux de séroconversion avec seulement 36,3 % [IC 95 % 28,6–44,4 ; I2 = 62 %] de patients qui ont séroconverti. L’abatacept (qui cible CTLA-4 impliqué dans la co-stimulation entre les lymphocytes B et T) était associé à un taux de réponse sérologique à 77,7 % [IC 95 % 53,2-94,8 ; I2 = 86 %]. Le bélimumab (Document S4) était associé à une bonne réponse sérologique avec un taux de séroconversion de 84,3 % [IC 95 % 65,5–96,6 ; I2 = 70 %]. Les traitements anti-cytokiniques étaient associés à de bons taux de séroconversion respectivement 95,9 % [IC 95 % 89,7–99,4 ; I2 = 90 %] pour les anti-TNF, 93,9 % [IC,95 %,81,5–99,7 ; I2 = 80 %] pour les anti-IL-6R, 97,3 % [IC 95 % 93,9–99,3 ; I2 = 0 %] pour les anti-IL-17, 97,0 % [IC 95 % 76,5–100,0 ; I2 = 30 %] pour les anti-IL-1R (n = 15 patients, Document S4) et 89,8 % [IC 95 % 80,3–96,5 ; I2 = 65 %] pour les anti-JAK.
Fig. 3.
Forest plots des taux de séroconversion pour chaque traitement ciblé ou biologique.
4. Discussion
L’impact des DMARDs sur la réponse immune au vaccin est très clairement variable. Le principal facteur impactant négativement la réponse sérologique aux vaccins à ARN messagers apparaît être le type de traitement immunosuppresseur, plus que la maladie causale. Nous avons retrouvé dans notre méta-analyse un taux global de séroconversion tous traitements confondus de 84,8 %. À titre de comparaison, nous avons analysé le taux de séroconversion chez les individus sains inclus dans les groupes contrôles des cohortes de notre méta-analyse. Ainsi, 730/733 (99,5 %) individus sains avaient séroconverti (en excluant le groupe contrôle de l’étude de Meideros-Ribeiro et al. [27] qui a reçu le vaccin CoronaVac associé à une moins bonne réponse globale).
Dans notre cohorte, le rituximab était clairement associé à une forte diminution de la réponse sérologique, et ce résultat a été confirmé par notre méta-analyse.
De manière analogue aux résultats des travaux conduits par Furer et al. [22], Chung et al. [44], et Verhoeven et al. [45], le délai entre la dernière perfusion de rituximab et la première injection de vaccin semble avoir un impact critique sur la réponse sérologique : un délai court entre la dernière perfusion et la vaccination étant associé à une moins bonne réponse sérologique à la vaccination contre le SARS-Cov2. Nous avons trouvé dans notre cohorte ce même résultat avec un délai entre la dernière perfusion et la vaccination plus court chez les non-répondeurs que chez les répondeurs (respectivement délai médian 174 (EI 161–240) jours chez les répondeurs vs. 121 (EI 73–188) jours chez les non-répondeurs). Notre travail suggère également un impact du type de protocole de rituximab avec plus de patients répondeurs lorsqu’ils recevaient uniquement 1 g à chaque cycle comparativement à ceux qui recevaient 1 g à J1 et J15.
Dans notre cohorte, nous avons montré que le nombre de cellules CD19 positives était plus faible (bien que le seuil de significativité ne soit pas atteint en raison probablement d’un effectif faible) chez les patients du groupe rituximab qui n’ont pas séroconverti. Ce résultat est en accord avec les publications précédentes de Mrak et al. [28] et plus récemment de Stefanski et al. [46]. Nous savons que le rituximab est associé à une longue durée d’immunosuppression, d’au moins 6 à 9 mois [47]. C’est pourquoi les recommandations de l’ACR [19] préconisent de vacciner les patients 2 à 4 semaines avant la date théorique de la prochaine perfusion de rituximab (c’est à dire au moins 5 mois après la dernière perfusion). Il serait peut-être interessant de mesurer le nombre de cellules CD19+/CD20+ et de vacciner les patients uniquement lorsqu’elles sont détectables si le contrôle de la maladie permet d’attendre ce délai.
Nous n’avons pas évalué la réponse cellulaire induite par cette vaccination dans notre population. Sahin et al. ont précedemment rapporté l’induction par les vaccins à ARN messagers de sous-type de lymphocytes T poly-spécifiques [8]. Les données sont rares chez les patients traités par immunsuppresseurs. De manière intéressante, Mahil et al. ont démontré qu’une réponse cellulaire T spécifique contre le SARS-Cov2 (mesurée par le taux induit d’IFN gamma, d’IL-1 ou IL-12) était présente chez des patients traités par anti-TNF, méthotrexate ou anti-IL23 sans réponse sérologique après une dose de vaccination par BNT162b2 [48]. Bonelli et al. ont récemment publié des résultats similaires chez 4 patients traités par rituximab et sans réponse sérologique après 2 doses de vaccin BNT161b2 [49]. Cependant, nous ne savons pas à ce jour si cette réponse cellulaire sans réponse sérologique (particulièrement chez les patients traités par rituximab) est efficace pour prévenir l’infection à COVID-19 ou tout au moins les formes graves de la maladie.
Enfin, la persistance dans le temps de ces anticorps et l’efficacité de la protection qu’ils confèrent au cours du temps sont très largement inconnues chez les patients immunosupprimés. Particulièrement pour les patients traités par rituximab, les données concernant l’évolution des titres d’anticorps après la reprise du traitement restent rares. Les données des études prospectives actuellement en cours amélioreront nos connaissances en la matière.
Si l’on s’interesse aux autres thérapies ciblées ou biologiques, l’abatacept semble être associé à une diminution de la réponse sérologique, ce qui peut s’expliquer par le mécanisme d’action même de ce traitement ciblant CTLA-4 impliqué dans la co-stimulation entre le lymphocyte B et le lymphocyte T dans la réponse immunitaire. Nous avons observé un taux de séroconversion supérieur à 80 % avec les traitements ciblant les cytokines inflammatoires tels que le TNF, l’IL-1, l’IL-6 ou l’IL-17.
Afin d’améliorer la réponse sérologique des patients immunosupprimés, des données récentes ont montré l’impact positif d’une troisième dose de rappel vaccinal. Dans notre cohorte, 19 patients, tous traités par rituximab, ont reçu une troisième dose et seulement un patient a séroconverti. Dans une petite série de cas publiée par Felten R et al. [50], l’administration d’une troisième dose de vaccin a abouti à des titres d’anticorps plus importants chez les patients qui avaient séroconverti après 2 doses (7/10 patients), une activité neutralisante de ces anticorps plus forte chez 5/10 patients et une séroconversion chez un des 3 patients qui n’avait pas séroconverti après la deuxième dose. De manière similaire, Simon D et al. [51] ont démontré que la séroconversion intervient finalement après une troisième dose chez 26/33 patients traités par médicament biologique autre que le rituximab et chez 6/33 patients traités par rituximab.
Il a été montré que le méthotrexate pouvait altérer la réponse vaccinale contre le pneumocoque ou la grippe [4], [52], [53]. Pour ce qui concerne la vaccination contre le SARS-CoV2, les résultats sont discordants. Ammitzboll et al. ont montré que le taux de réponse des patients traités par méthotrexate en association avec un médicament biologique était plus faible que chez les patients traités par biologique en monothérapie [20]. Furer et al. ont montré que le méthotrexate en monothérapie était associé à des taux de séroconversion plus faible que chez les contrôles sains mais dans une ampleur bien moindre qu’avec le rituximab [22]. De plus, dans l’étude de Braun-Moscovici et al., les titres d’anticorps étaient plus faibles lorsque les patients étaient traités par méthotrexate [21]. Dans notre cohorte, le méthotrexate en association avec les médicaments biologiques ou ciblés était associé à une diminution significative des titres d’anticorps. Dans la méta-analyse, le taux de séroconversion reflète ce que nous pouvons voir à l’échelle globale d’une population de patients immunosupprimés. Il nous était impossible dans la grande majorité des cas de savoir si le méthotrexate était pris en monothérapie ou en association à d’autres médicaments. Des études prospectives sont donc nécessaires pour mieux comprendre l’impact du méthotrexate sur la réponse sérologique mais les données plaident pour un impact négatif. Il serait également intéressant de regarder l’impact de la dose de méthotrexate sur cette réponse sérologique. Par analogie avec ce qui est démontré pour la vaccination contre la grippe, certains auteurs ont suggéré d’arrêter pour quelques semaines le méthotrexate afin de maximiser les chances de réponse [19]. Cette approche doit prendre en considération le risque théorique de poussée inflammatoire de la maladie.
Enfin, concernant le type de vaccin utilisé chez les patients immunosupprimés, les recommandations de l’ACR [19] préconisent les vaccins à ARN messagers. En effet, les études menées avec les vaccins inactivés Coronavac montrent une réponse sérologique significativement moindre qu’avec les vaccins à ARN messagers [27]. Dans notre méta-analyse, cette étude a contribué en partie à l’hétérogénéité observée mais les résultats que nous avons présentés restent similaires lorsque cette étude est exclue de l’analyse.
Cette méta-analyse a donc confirmé l’impact négatif du rituximab sur le taux de séroconversion mais a également suggéré un impact négatif, mais moindre, de l’abatacept, du méthotrexate et du léflunomide. Une force de notre travail est que nous avons décidé d’étudier l’impact des traitements en condition de vie réelle. Nous avons selectionné rigoureusement les pathologies et les traitements utilisés en pratique rhumatologique quotidienne. En comparaison avec des méta-analyses publiées dans d’autres pathologies [54], nous avons sélectionné les études qui ne rapportaient les données sérologiques qu’après un schéma vaccinal complet avec deux doses de vaccination et ainsi analysé plus de 4500 patients. D’un autre côté, nous savons également que les études incluses dans cette méta-analyse sont principalement rétroscpectives et non exhaustives. De plus, les populations étudiées sont parfois hétérogènes en terme d’âge et de comorbidités.
En conclusion, nous avons démontré que les patients traités par immunosuppresseurs ont une réponse sérologique aux vaccins à ARN messagers altérée particulièrement lorsqu’ils sont traités par rituximab et possiblement par abatacept, méthotrexate et léflunomide. Dans cette population, une troisième dose de vaccination est fortement recommandée. Des études prospectives sont en cours et nous éclaireront sur l’efficacité et la persistence dans le temps de cette protection, et constitureront des données très intéressantes pour nos patients.
Contributions
Tous les auteurs ont contribué à la préparation du manuscrit.
Déclaration de liens d’intérêts
MA a reçu des honoraires de consultant par Bristol-Myers Squibb en dehors du domaine d’intérêt de ce travail.
FC a reçu des honoraires de consultant par Abbvie, Bristol-Myers Squibb, Janssen, Lilly, MSD, Novartis, Pfizer, Sanofi et des financements de travaux de recherche par Abbvie, Biogen, Celgene, Pfizer, Roche-Chugai, UCB en dehors du domaine d’inteéêt de ce travail.
EM a reçu des honoraires de consultant par BMS, Roche-Chugai, Abbvie, Galapagos, Pfizer, MSD, Novartis, UCB, Biogen, JanssenMedac, Fresenius, Amgen, Lilly, Sandoz en dehors du domaine d’intérêt de ce travail.
ID a reçu une bourse du ministère de la santé et de l’organisation à but non lucratif « Vaincre la mucoviscidose », des participations à des congrès par Zambon, en dehors du domaine d’intérêt de ce travail et a fait partie du comité de pilotage de Vertex.
BL, BC, AM, CC, JCL, SM déclarent ne pas avoir de liens d’intérêts.
Footnotes
Ne pas utiliser, pour citation, la référence française de cet article mais la référence anglaise de Joint Bone Spine avec le DOI ci-dessus.
Matériel complémentaire
Le matériel complémentaire (Document S1–S4) accompagnant la version en ligne de cet article est disponible sur http://www.sciencedirect.com et https://doi.org/10.1016/j.rhum.2022.07.002.
Supplément en ligne. Matériel complémentaire
Références
- 1.Furer V., Rondaan C., Heijstek M.W., et al. 2019 update of EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann Rheum Dis. 2020;79:39–52. doi: 10.1136/annrheumdis-2019-215882. [DOI] [PubMed] [Google Scholar]
- 2.Crnkic Kapetanovic M., Saxne T., Jönsson G., et al. Rituximab and abatacept but not tocilizumab impair antibody response to pneumococcal conjugate vaccine in patients with rheumatoid arthritis. Arthritis Res Ther. 2013;15:R171. doi: 10.1186/ar4358. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Migita K., Akeda Y., Akazawa M., et al. Effect of abatacept on the immunogenicity of 23-valent pneumococcal polysaccharide vaccination (PPSV23) in rheumatoid arthritis patients. Arthritis Res Ther. 2015;17:357. doi: 10.1186/s13075-015-0863-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Park J.K., Lee Y.J., Shin K., et al. Impact of temporary methotrexate discontinuation for 2 weeks on immunogenicity of seasonal influenza vaccination in patients with rheumatoid arthritis: a randomised clinical trial. Ann Rheum Dis. 2018;77:898–904. doi: 10.1136/annrheumdis-2018-213222. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Kobie J.J., Zheng B., Bryk P., et al. Decreased influenza-specific B cell responses in rheumatoid arthritis patients treated with anti-tumor necrosis factor. Arthritis Res Ther. 2011;13:R209. doi: 10.1186/ar3542. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Friedman M.A., Curtis J.R., Winthrop K.L. Impact of disease-modifying antirheumatic drugs on vaccine immunogenicity in patients with inflammatory rheumatic and musculoskeletal diseases. Ann Rheum Dis. 2021;80:1255–1265. doi: 10.1136/annrheumdis-2021-221244. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Polack F.P., Thomas S.J., Kitchin N., et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020;383:2603–2615. doi: 10.1056/NEJMoa2034577. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Sahin U., Muik A., Vogler I., et al. BNT162b2 vaccine induces neutralizing antibodies and poly-specific T cells in humans. Nature. 2021;595:572–577. doi: 10.1038/s41586-021-03653-6. [DOI] [PubMed] [Google Scholar]
- 9.Voysey M., Clemens S.A.C., Madhi S.A., et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2021;397:99–111. doi: 10.1016/S0140-6736(20)32661-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Baden L.R., El Sahly H.M., Essink B., et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2021;384:403–416. doi: 10.1056/NEJMoa2035389. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Ottaviani S., Juge P.-A., Forien M., et al. Polymyalgia rheumatica following COVID-19 vaccination: A case-series of ten patients. Joint Bone Spine. 2022;89:105334. doi: 10.1016/j.jbspin.2021.105334. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Quartuccio L., Valent F., Pasut E., et al. Prevalence of COVID-19 among patients with chronic inflammatory rheumatic diseases treated with biologic agents or small molecules: A population-based study in the first two months of COVID-19 outbreak in Italy. Joint Bone Spine. 2020;87:439–443. doi: 10.1016/j.jbspin.2020.05.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Avouac J., Drumez E., Hachulla E., et al. COVID-19 outcomes in patients with inflammatory rheumatic and musculoskeletal diseases treated with rituximab: a cohort study. The Lancet Rheumatology. 2021;3:e419–e426. doi: 10.1016/S2665-9913(21)00059-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.D'Silva K.M., Jorge A., Cohen A., et al. COVID-19 Outcomes in Patients With Systemic Autoimmune Rheumatic Diseases Compared to the General Population: A US Multicenter, Comparative Cohort Study. Arthritis Rheumatol. 2021;73:914–920. doi: 10.1002/art.41619. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.FAI2R/SFR/SNFMI/SOFREMIP/CRI/IMIDIATE consortium and. Severity of COVID-19 and survival in patients with rheumatic and inflammatory diseases: data from the French RMD COVID-19 cohort of 694 patients. Ann Rheum Dis. 2021;80:527–538. doi: 10.1136/annrheumdis-2020-218310. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Hasseli R., Mueller-Ladner U., Hoyer B.F., et al. Older age, comorbidity, glucocorticoid use and disease activity are risk factors for COVID-19 hospitalisation in patients with inflammatory rheumatic and musculoskeletal diseases. RMD Open. 2021;7:e001464. doi: 10.1136/rmdopen-2020-001464. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Schulze-Koops H., Krueger K., Vallbracht I., et al. Increased risk for severe COVID-19 in patients with inflammatory rheumatic diseases treated with rituximab. Ann Rheum Dis. 2020 doi: 10.1136/annrheumdis-2020-218075. [annrheumdis-2020-218075] [DOI] [PubMed] [Google Scholar]
- 18.Shin Y.H., Shin J.I., Moon S.Y., et al. Autoimmune inflammatory rheumatic diseases and COVID-19 outcomes in South Korea: a nationwide cohort study. The Lancet Rheumatology. 2021 doi: 10.1016/S2665-9913(21)00151-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Curtis J.R., Johnson S.R., Anthony D.D., et al. American College of Rheumatology Guidance for COVID-19 Vaccination in Patients With Rheumatic and Musculoskeletal Diseases: Version 2. Arthritis Rheumatol. 2021 doi: 10.1002/art.41877. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Ammitzbøll C., Bartels L.E., Bøgh Andersen J., et al. Impaired Antibody Response to the BNT162b2 Messenger RNA Coronavirus Disease 2019 Vaccine in Patients With Systemic Lupus Erythematosus and Rheumatoid Arthritis. ACR Open Rheumatol. 2021 doi: 10.1002/acr2.11299. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Braun-Moscovici Y., Kaplan M., Braun M., et al. Disease activity and humoral response in patients with inflammatory rheumatic diseases after two doses of the Pfizer mRNA vaccine against SARS-CoV-2. Ann Rheum Dis. 2021 doi: 10.1136/annrheumdis-2021-220503. [DOI] [PubMed] [Google Scholar]
- 22.Furer V., Eviatar T., Zisman D., et al. Immunogenicity and safety of the BNT162b2 mRNA COVID-19 vaccine in adult patients with autoimmune inflammatory rheumatic diseases and in the general population: a multicentre study. Ann Rheum Dis. 2021 doi: 10.1136/annrheumdis-2021-220647. [DOI] [PubMed] [Google Scholar]
- 23.Geisen U.M., Berner D.K., Tran F., et al. Immunogenicity and safety of anti-SARS-CoV-2 mRNA vaccines in patients with chronic inflammatory conditions and immunosuppressive therapy in a monocentric cohort. Ann Rheum Dis. 2021 doi: 10.1136/annrheumdis-2021-220272. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Haberman R.H., Herati R., Simon D., et al. Methotrexate hampers immunogenicity to BNT162b2 mRNA COVID-19 vaccine in immune-mediated inflammatory disease. Ann Rheum Dis. 2021 doi: 10.1136/annrheumdis-2021-220597. [annrheumdis-2021-220597] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Kappelman M.D., Weaver K., Boccieri M., et al. Humoral Immune Response to Messenger RNA COVID-19 Vaccines Among Patients With Inflammatory Bowel Disease. Gastroenterology. 2021 doi: 10.1053/j.gastro.2021.06.016. [S0016-5085(21)03127-9] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Kennedy N.A., Lin S., Goodhand J.R., et al. Infliximab is associated with attenuated immunogenicity to BNT162b2 and ChAdOx1 nCoV-19 SARS-CoV-2 vaccines in patients with IBD. Gut. 2021 doi: 10.1136/gutjnl-2021-324789. [DOI] [PubMed] [Google Scholar]
- 27.Medeiros-Ribeiro A.C., Aikawa N.E., Saad C.G.S., et al. Immunogenicity and safety of the CoronaVac inactivated vaccine in patients with autoimmune rheumatic diseases: a phase 4 trial. Nat Med. 2021 doi: 10.1038/s41591-021-01469-5. [DOI] [PubMed] [Google Scholar]
- 28.Mrak D., Tobudic S., Koblischke M., et al. SARS-CoV-2 vaccination in rituximab-treated patients: B cells promote humoral immune responses in the presence of T-cell-mediated immunity. Ann Rheum Dis. 2021 doi: 10.1136/annrheumdis-2021-220781. [annrheumdis-2021-220781] [DOI] [PubMed] [Google Scholar]
- 29.Ruddy J.A., Connolly C.M., Boyarsky B.J., et al. High antibody response to two-dose SARS-CoV-2 messenger RNA vaccination in patients with rheumatic and musculoskeletal diseases. Ann Rheum Dis. 2021 doi: 10.1136/annrheumdis-2021-220656. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Rubbert-Roth A., Vuilleumier N., Ludewig B., et al. Anti-SARS-CoV-2 mRNA vaccine in patients with rheumatoid arthritis. Lancet Rheumatol. 2021 doi: 10.1016/S2665-9913(21)00186-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Simon D., Tascilar K., Fagni F., et al. SARS-CoV-2 vaccination responses in untreated, conventionally treated and anticytokine-treated patients with immune-mediated inflammatory diseases. Ann Rheum Dis. 2021 doi: 10.1136/annrheumdis-2021-220461. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Simon D., Tascilar K., Schmidt K., et al. Brief Report: Humoral and cellular immune responses to SARS-CoV-2 infection and vaccination in B cell depleted autoimmune patients. Arthritis Rheumatol. 2021 doi: 10.1002/art.41914. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Spiera R., Jinich S., Jannat-Khah D. Rituximab, but not other antirheumatic therapies, is associated with impaired serological response to SARS- CoV-2 vaccination in patients with rheumatic diseases. Ann Rheum Dis. 2021 doi: 10.1136/annrheumdis-2021-220604. [annrheumdis-2021-220604] [DOI] [PubMed] [Google Scholar]
- 34.Veenstra J., Wang J., McKinnon-Maksimowicz K., et al. Correspondence on “Immunogenicity and safety of anti-SARS-CoV-2 mRNA vaccines in patients with chronic inflammatory conditions and immunosuppressive therapy in a monocentric cohort”. Ann Rheum Dis. 2021 doi: 10.1136/annrheumdis-2021-220736. [annrheumdis-2021-220736] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Boekel L., Steenhuis M., Hooijberg F., et al. Antibody development after COVID-19 vaccination in patients with autoimmune diseases in the Netherlands: a substudy of data from two prospective cohort studies. Lancet Rheumatol. 2021 doi: 10.1016/S2665-9913(21)00222-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Chiang T.P.-Y., Connolly C.M., Ruddy J.A., et al. Antibody response to the Janssen/Johnson & Johnson SARS-CoV-2 vaccine in patients with rheumatic and musculoskeletal diseases. Ann Rheum Dis. 2021 doi: 10.1136/annrheumdis-2021-221145. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Moor M.B., Suter-Riniker F., Horn M.P., et al. Humoral and cellular responses to mRNA vaccines against SARS-CoV-2 in patients with a history of CD20 B-cell-depleting therapy (RituxiVac): an investigator-initiated, single-centre, open-label study. Lancet Rheumatol. 2021 doi: 10.1016/S2665-9913(21)00251-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Picchianti-Diamanti A., Aiello A., Laganà B., et al. ImmunosuppressiveTherapies Differently Modulate Humoral- and T-Cell-Specific Responses to COVID-19 mRNA Vaccine in Rheumatoid Arthritis Patients. Front Immunol. 2021;12 doi: 10.3389/fimmu.2021.740249. [740249] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Seror R., Camus M., Salmon J.-H., et al. Do JAK inhibitors affect immune response to COVID-19 vaccination? Data from the MAJIK-SFR Registry. The Lancet Rheumatology. 2021 doi: 10.1016/S2665-9913(21)00314-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Infantino M., Pieri M., Nuccetelli M., et al. The WHO International Standard for COVID-19 serological tests: towards harmonization of anti-spike assays. Int Immunopharmacol. 2021;100 doi: 10.1016/j.intimp.2021.108095. [108095] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Stroup D.F., Berlin J.A., Morton S.C., et al. Meta-analysis of observational studies in epidemiology: a proposal for reporting. Meta-analysis Of Observational Studies in Epidemiology (MOOSE) group. JAMA. 2000;283:2008–2012. doi: 10.1001/jama.283.15.2008. [DOI] [PubMed] [Google Scholar]
- 42.Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses. Eur J Epidemiol. 2010;25:603–605. doi: 10.1007/s10654-010-9491-z. [DOI] [PubMed] [Google Scholar]
- 43.Higgins J.P.T., Thompson S.G., Deeks J.J., et al. Measuring inconsistency in meta-analyses. BMJ. 2003;327:557–560. doi: 10.1136/bmj.327.7414.557. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Chung S.H., Wener M., Bays A.M., et al. Correspondence on “SARS-CoV-2 vaccination in rituximab-treated patients: evidence for impaired humoral but inducible cellular immune response” by Bonelli et al. Ann Rheum Dis. 2021;80 doi: 10.1136/annrheumdis-2021-220957. [e165] [DOI] [PubMed] [Google Scholar]
- 45.Verhoeven F., Lepiller Q., Hecquet S., et al. SARS CoV-2 vaccine AND rituximab, timing might be a key for a better vaccine response. Joint Bone Spine. 2021;88:105258. doi: 10.1016/j.jbspin.2021.105258. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Stefanski AL, Rincon-Arevalo H, Schrezenmeier E, Karberg K, Szelinski F, Ritter J, et al. B cell numbers predict humoral and cellular response upon SARS-CoV-2 vaccination among patients treated with rituximab. Arthritis & Rheumatology https://doi.org/10.1002/art.42060. [DOI] [PMC free article] [PubMed]
- 47.Leandro M.J., Cambridge G., Ehrenstein M.R., et al. Reconstitution of peripheral blood B cells after depletion with rituximab in patients with rheumatoid arthritis. Arthritis Rheum. 2006;54:613–620. doi: 10.1002/art.21617. [DOI] [PubMed] [Google Scholar]
- 48.Mahil S.K., Bechman K., Raharja A., et al. The effect of methotrexate and targeted immunosuppression on humoral and cellular immune responses to the COVID-19 vaccine BNT162b2: a cohort study. Lancet Rheumatol. 2021 doi: 10.1016/S2665-9913(21)00212-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Bonelli M.M., Mrak D., Perkmann T., et al. SARS-CoV-2 vaccination in rituximab-treated patients: evidence for impaired humoral but inducible cellular immune response. Ann Rheum Dis. 2021 doi: 10.1136/annrheumdis-2021-220408. [DOI] [PubMed] [Google Scholar]
- 50.Felten R., Gallais F., Schleiss C., et al. Cellular and humoral immunity after the third dose of SARS-CoV-2 vaccine in patients treated with rituximab. Lancet Rheumatol. 2021 doi: 10.1016/S2665-9913(21)00351-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Simon D., Tascilar K., Fagni F., et al. Efficacy and safety of SARS-CoV-2 revaccination in non-responders with immune-mediated inflammatory disease. Ann Rheum Dis. 2021 doi: 10.1136/annrheumdis-2021-221554. [DOI] [PubMed] [Google Scholar]
- 52.Hua C., Barnetche T., Combe B., et al. Effect of methotrexate, anti-tumor necrosis factor α, and rituximab on the immune response to influenza and pneumococcal vaccines in patients with rheumatoid arthritis: a systematic review and meta-analysis. Arthritis Care Res (Hoboken) 2014;66:1016–1026. doi: 10.1002/acr.22246. [DOI] [PubMed] [Google Scholar]
- 53.Kapetanovic M.C., Saxne T., Sjöholm A., et al. Influence of methotrexate, TNF blockers and prednisolone on antibody responses to pneumococcal polysaccharide vaccine in patients with rheumatoid arthritis. Rheumatology (Oxford) 2006;45:106–111. doi: 10.1093/rheumatology/kei193. [DOI] [PubMed] [Google Scholar]
- 54.Sakuraba A., Luna A., Micic D. Serologic response to coronavirus disease 2019 (COVID-19) vaccination in patients with immune-mediated inflammatory diseases: a systematic review and meta-analysis. Gastroenterology. 2021 doi: 10.1053/j.gastro.2021.09.055. [S0016-5085(21)03604-0] [DOI] [PMC free article] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.