Abstract
Introduction
Les inhibiteurs de points de contrôle immunitaire ont révolutionné la prise en charge de nombreux cancers et ont permis d’obtenir une efficacité et une réponse durable pour certains patients. L’immunothérapie est associée à des effets secondaires en lien avec l’infiltration de cellules immunitaires dans les tissus normaux pouvant entraîner des réactions dysimmunitaires disproportionnées. Ces effets secondaires peuvent toucher n’importe quel organe, dont le poumon, pouvant parfois engager le pronostic vital. Ils peuvent ressembler à des événements de nature infectieuse, dont la COVID-19.
Observations
Nous rapportons le cas de 3 patients ayant présenté des toxicités pulmonaires sévères secondaires à l’immunothérapie entre mars et mai 2020 avec hypothèse initiale d’une pneumopathie à SARS-CoV-2. Après investigations approfondies, le diagnostic de toxicité pulmonaire à l’immunothérapie fut retenu, avec une évolution clinique et radiologique favorable suite à l’instauration d’une corticothérapie.
Conclusion
La toxicité pulmonaire secondaire à l’immunothérapie reste un effet indésirable rare, mais pouvant engager le pronostic vital. La démarche diagnostique impose d’éliminer plusieurs diagnostics différentiels. Le tableau clinique est réversible et l’évolution habituellement favorable après instauration d’une corticothérapie.
Mots clés: COVID-19, SARS-CoV-2, Cancer pulmonaire, Immunothérapie, IrAE, Pneumopathie immuno-induite
Abstract
Introduction
Immune checkpoint inhibitors have revolutionized the management of many cancers and achieved efficacy and durable response for some patients, including those with advanced cancers. However, immunotherapy is associated with side effects caused by the infiltration of immune cells into normal tissues, which can lead to disproportionate dysimmune reactions. While mostly of moderate intensity, these side effects can affect any organ, including the lung, the site of occasionally life-threatening interstitial lung disease. Their presentation can be similar to that of infectious pneumonia (COVID-19).
Observations
We report the cases of 3 patients who presented between March and May 2020 with severe pulmonary toxicities secondary to immunotherapy, which led to with an initial hypothesis of SARS-CoV-2 pneumonia. After extensive investigations, the diagnosis of pulmonary toxicity to immunotherapy was given, and the clinical and radiological course following the initiation of corticosteroid therapy was favorable.
Conclusion
Pulmonary toxicity secondary to immunotherapy remains a rare but potentially life-threatening side effect. The diagnostic approach requires the elimination of several differential diagnoses (infectious process, tumor progression, other etiologies of interstitial lung disease). This adverse event is reversible and evolution after initiation of corticosteroid therapy is usually favorable.
Keywords: COVID-19, Lung neoplasm, Immunotherapy, Immune-related adverse events (IrAE), Immune-related pneumonitis
Introduction
Les inhibiteurs de points de contrôle immunitaires (ICI) représentent une classe émergente de thérapie anticancéreuse qui a modifié, pour certains patients, le pronostic de tumeurs solides métastatiques tels que le cancer du poumon non à petites cellules, le mélanome, le cancer du rein, le cancer de la vessie ou le lymphome [1], [2], [3], [4]. Les ICI sont des anticorps qui ciblent les points de contrôle immunitaires situés soit sur les cellules T comme le PD-1 (nivolumab et pembrolizumab) et l’antigène 4 associé au lymphocyte T cytotoxique (ipilimumab, tremelimumab), soit sur les cellules néoplasiques comme le ligand PD-1 (durvalumab, atezolizumab et avelumab). Par ce procédé, ces traitements renforcent l’activation des cellules immunitaires, en particulier des lymphocytes T [5].
Les ICI sont associés à des effets indésirables liés au système immunitaire (« immune-related adverse events » ou IrAE) causés par l’infiltration de cellules immunitaires dans les tissus sains. Ces effets indésirables peuvent atteindre presque tous les organes : tissus endocriniens, peau, tractus gastro-intestinal, foie, poumons, cœur, reins, yeux, système nerveux, système musculo-articulaire et cellules hématologiques. Ils surviennent chez 85 % des patients et sont généralement d’intensité légère (grade 1 ou 2 selon la version 4 ou 5 de la Common Terminology Classification for Adverse Events(CTCAE)) [6], [7], [8], [9], [10], [11].
Parmi eux, la pneumopathie interstitielle (PI) est rare, survenant chez 2 % à 5 % des patients, d’intensité sévère chez 1 % d’entre eux, pouvant alors engager le pronostic vital (grade 3–5 CTCAE 4 ou 5) [12], [13], [14], [15], [16], [17]. La PI semble être plus fréquente chez les patients atteints de cancer du poumon traités par anti-PD-1/PDL-1 ou combinaison d’immunothérapies [11]. La présence d’une PI pré-existante semble majorer ce risque [18]. Cette toxicité pulmonaire se manifeste par des signes respiratoires cliniques non spécifiques (toux, dyspnée, fièvre) et nécessite donc de réaliser des examens complémentaires afin d’éliminer les diagnostics différentiels. Ces examens consistent essentiellement en la réalisation d’un bilan sanguin, d’une imagerie thoracique (tomodensitométrique) et d’une fibroscopie bronchique lorsque celle-ci est possible [19]. En effet, les pneumopathies d’origine infectieuse (bactérienne, fongique, virale) font partie des diagnostics à éliminer en priorité.
Nous décrivons ici 3 cas de patients hospitalisés durant la première vague de COVID-19 entre mars et mai 2020 et qui ont présenté une toxicité pulmonaire sévère à l’immunothérapie avec, comme diagnostic différentiel initial, une pneumopathie à SARS-CoV-2 évoquée en raison du contexte épidémique.
Cas 1
Il s’agit d’une patiente de 57 ans qui présente comme principaux antécédents une hypertension artérielle, une hépatite médicamenteuse à la fluoxétine (1980) et une bronchopneumopathie chronique obstructive (BPCO) modérée de stade Gold 2, post-tabagique (15 paquets-années (PA), sevrée). Elle est traitée par pembrolizumab pour un adénocarcinome pulmonaire de stade IV TTF1(-), PDL1 à 30 %. La première cure est réalisée le 29/01/2020.
Six semaines après l’instauration de l’immunothérapie (3 cycles), la patiente présente une fièvre à 40 °C, associée à une dyspnée d’effort (mMRC à 2) et une toux sèche. Il n’existe pas d’autres signes fonctionnels respiratoires ou extrathoraciques et la patiente n’est pas oxygénoréquérante (SpO2 à 98 % en air ambiant). Le bilan biologique révèle un syndrome inflammatoire avec une CRP à 50 mg/L, NT-ProBNP à 30 ng/L. Une PCR COVID-19 nasopharyngée revient négative ainsi que la PCR multiplex et les antigénuries légionnelle et pneumocoque.
Le scanner thoracique retrouve une stabilité des lésions tumorales connues, mais l’apparition d’un syndrome alvéolo-interstitiel diffus et de plages de verre dépoli en regard du lobe moyen et au niveau sous-pleural.
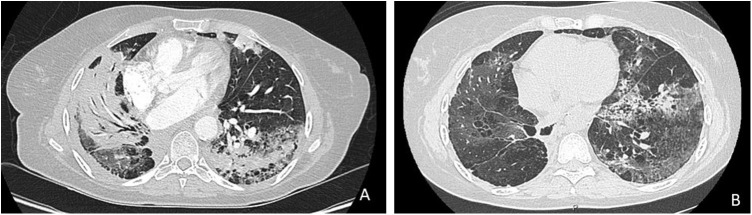
Dans l’hypothèse d’une infection bactérienne, une antibiothérapie par tazocilline est administrée. Quelques jours plus tard, la fièvre réapparaît, associée à une aggravation de la dyspnée au repos, avec désaturation (SpO2 à 85 % en air ambiant), nécessitant l’hospitalisation de la patiente en pneumologie, en secteur COVID dans l’hypothèse d’une pneumopathie à SARS-CoV-2. Une nouvelle PCR est réalisée le 09/04/20, revenant négative. Un nouveau scanner est effectué le 09/04/20 et retrouve, en comparaison à l’examen précédent, l’apparition d’une condensation lobaire moyenne systématisée associée à la coexistence d’infiltrats mixtes condensants et en verre dépoli de distribution péribronchovasculaire controlatéraux (Fig. 1 ).
Figure 1.
A. Coupe scanographique d’avril 2020 retrouvant des condensations bilatérales avec présence de verre dépoli au pourtour. B. TDM de réévaluation après 6 semaines de corticothérapie montrant une régression des condensations.
Afin d’éliminer un processus infectieux, une fibroscopie bronchique avec lavage bronchoalvéolaire (LBA) est réalisée. Les prélèvements infectieux (LBA avec PCR multiplex et COVID-19, PCR Pneumocystis, examen bactériologique sur aspiration) reviennent négatifs. L’analyse anatomopathologique du LBA retrouve une lymphocytose (40 % avec éléments de taille variable, aux noyaux irréguliers et formes plasmocytoïdes) associée à une polynucléose (18 % neutrophile, 17 % éosinophile) sans profil d’alvéolite immune. Dans l’hypothèse d’une toxicité pulmonaire secondaire à l’immunothérapie de grade 3 (CTACEv5), se manifestant sous la forme d’une pneumopathie organisée, une corticothérapie à la posologie de 1 mg/kg est débutée le 23/04/20. L’instauration de ce traitement permet une nette amélioration des symptômes respiratoires avec régression de l’oxygénorequérance, de la toux et de la dyspnée. Un scanner thoracique de réévaluation réalisé 6 semaines plus tard retrouve une régression des condensations connues (Fig. 1B).
Cas 2
Il s’agit d’un patient de 70 ans dont les antécédents sont marqués par une sclérodermie cutanée limitée (anticorps anticentromères positifs) et une BPCO post-tabagique (47 PA sevré) modérée Gold 1.
Le diagnostic de carcinome épidermoïde bronchique lobaire supérieur gauche, PDL1 à 40 %, de stade IIIB est porté en 2018. Un traitement par radiochimiothérapie concomitante a été réalisé de mai à juillet 2018 (3 cures de cisplatine-vinorelbine et radiothérapie externe de 66 Gy en 33 séances), puis un entretien par durvalumab d’août 2018 à octobre 2019 (24 cures). En avril 2020, soit à 6 mois de l’arrêt de l’immunothérapie, le patient rapporte une aggravation rapidement progressive de sa dyspnée sur quelques semaines qui devient présente au moindre effort (mMRC à 3), accompagnée d’une toux sèche. Il est, par ailleurs, apyrétique et ne présente aucun signe extrathoracique. Le bilan biologique retrouve un syndrome inflammatoire marqué (CRP 166 mg/L, PNN 8,5 G/L), NT-ProBNP peu élevé à 143 ng/L. Le patient est alors hospitalisé en secteur COVID dans l’hypothèse d’une pneumopathie à COVID-19. À son entrée, le patient est oxygénorequérant (SpO2 à 93 % sous 2 L/min) et présente des crépitants secs bilatéraux jusqu’à mi-champ.
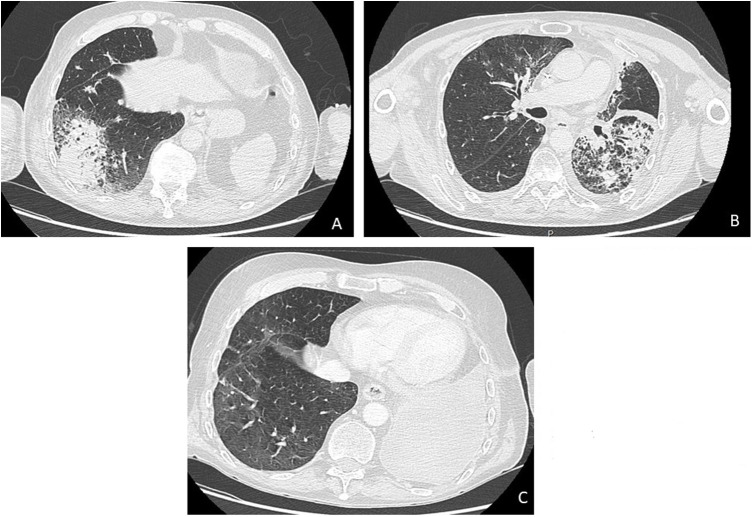
Les PCR nasopharyngées COVID-19 et multiplex sont négatives. Un angioscanner thoracique est réalisé le 15/04/2021 et met en évidence l’apparition de plages de condensation bilatérales prédominant dans les deux lobes inférieurs, associées à des épanchements pleuraux de faible abondance (Fig. 2A et B).
Figure 2.
A et B. Scanner du 15/04/2020 : plages de condensation bilatérales, prédominant dans les deux lobes inférieurs. C. Scanner de réévaluation en juin 2020 retrouvant une régression de la condensation lobaire inférieure droite après corticothérapie.
Une antibiothérapie probabiliste par ceftriaxone-spiramycine est initiée. En raison de l’absence d’amélioration du tableau respiratoire, une fibroscopie avec LBA est réalisée le 21/04/2021. Les prélèvements infectieux distaux (bactériologique, virologique, mycologique dont PCR Pneumocystis) reviennent négatifs. L’analyse anatomopathologique retrouve un LBA hémorragique avec contamination bronchique, polynucléose à polynucléaires neutrophiles à 43 %.
Le patient est finalement transféré en unité de soins intensifs le 22/04/2020 devant une insuffisance respiratoire aiguë hypoxémique. Devant la suspicion de pneumopathie organisée, potentiellement favorisée par l’immunothérapie (grade 4 CTACE), une corticothérapie avec bolus de 5 mg/kg (puis décroissance 2 mg/kg) est débutée le 23/04/20. L’évolution respiratoire est progressivement favorable avec sevrage possible de l’oxygène en quelques semaines. Une décroissance progressive de la corticothérapie est effectuée et le scanner thoracique réalisé à 8 semaines objective une régression des condensations (Fig. 2C).
Cas 3
Il s’agit d’un patient de 69 ans dont les antécédents principaux sont une hypertension artérielle, une fibrillation atriale, une dyslipidémie et une BPCO post-tabagique (40 PA, sevré) modérée Gold 2. Il est suivi pour un adénocarcinome bronchique, PDL1 à 0 %. Il est traité par atezolizumab depuis le 18/02/2020.
Après réalisation de 2 cures d’immunothérapie, le patient présente une nette majoration de sa dyspnée (mMRC à 3–4 versus 1–2), de façon rapidement progressive : l’auscultation pulmonaire retrouve la présence de crépitants secs à droite. La SpO2 en air ambiant est à 90 %. Un traitement antibiotique par pristinamycine a été initié sans que cela n’améliore les symptômes. Dans l’hypothèse d’une pneumopathie à COVID-19, le patient est hospitalisé en secteur COVID.
Il est oxygénorequérant à 2 L/min. Le bilan biologique retrouve une hyperleucocytose à 8,3 G/L et une CRP à 30 mg/L, NT-ProBNP à 2000 ng/L (similaire aux valeurs antérieures du patient, avec une échographie cardiaque sans arguments pour une insuffisance cardiaque aiguë). Les antigénuries légionnelle et pneumocoque sont négatives, la PCR COVID-19 nasopharyngée est négative.
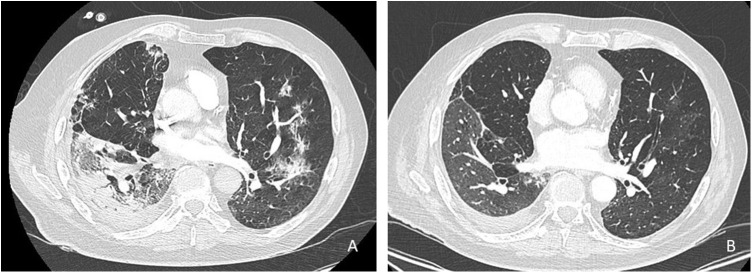
Le scanner thoracique du 12/04/20 met en évidence des condensations arciformes lobaires inférieures gauches et sous-pleurales lobaires moyennes avec quelques réticulations intralobulaire ainsi qu’un discret verre dépoli périphérique, pouvant être compatible avec une infection COVID-19. Sont apparues également des condensations systématisées lobaires inférieures droite avec verre dépoli périphérique (Fig. 3 ).
Figure 3.
A. TDM thoracique réalisé lors de l’hospitalisation : mise en évidence d’une condensation lobaire inférieure droite et condensations arciformes à gauche, évocateur de pneumopathie organisée. B. TDM de réévaluation 6 semaines après corticothérapie : régression des lésions.
Une fibroscopie bronchique permet la réalisation de prélèvements infectieux distaux : ceux-ci sont tous négatifs (PCR multiplex et COVID-19, bactériologie, culture et PCR Pneumocystis sur LBA). L’analyse anatomopathologique du LBA retrouve une polynucléose à neutrophiles (14 %), une lymphocytose (20 %), sans profil d’alvéolite immune. Dans l’hypothèse d’une toxicité pulmonaire de grade 3 secondaire à l’immunothérapie, une corticothérapie à 1 mg/kg/j est débutée sous couvert d’une antibiothérapie. L’évolution est progressivement favorable avec sevrage possible de l’oxygène et décroissance progressive de la corticothérapie. Un scanner thoracique de réévaluation est réalisé 6 semaines plus tard, montrant une régression des lésions de pneumopathie organisée (Fig. 3).
Discussion
Nous reportons 3 cas de patients ayant présenté une toxicité pulmonaire de l’immunothérapie avec comme diagnostic différentiel initial évoqué une pneumopathie à SARS-CoV-2.
Cette toxicité représente la cinquième cause d’irAES par ordre de fréquence après les toxicités cutanées, thyroïdiennes, hépatiques et coliques avec une fréquence [2,6–4,8 %] tous grades confondus et de [0,6–2,0 %] pour les toxicités de grade 3 et plus [20], [21], [22]. Elle est, cependant, la première cause de mortalité par irAEs (35 % des décès liés aux irAEs, 22 % pour les toxicités hépatiques, 15 % pour les toxicités neurologiques) chez les patients traités par anti-PD-1/PD-L1 [23].
Le risque de toxicité pulmonaire semble également augmenté chez les patients traités pour un cancer pulmonaire par anti-PD-1/PD-L1 et par combinaison d’immunothérapie (exemple : anti-CTLA4 + anti-PD-L1) [16], [17], [21]. La PI peut survenir à n’importe quel moment après initiation d’un traitement par immunothérapie. Dans l’étude de Delaunay et al. où cette toxicité a été diagnostiquée de façon rétrospective chez 64 des 1826 patients de la cohorte, le délai médian d’apparition de celle-ci était de 2,3 mois (0,2–27,4 mois) [12], comparable à l’étude de Naidoo et al. où ce délai médian était de 2,8 mois (9 jours–19,2 mois) avec plus de la moitié des patients qui présentaient un autre IrAE [15]. On peut également la voir survenir jusqu’à 1 an après l’arrêt de l’immunothérapie.
Cette hypothèse diagnostique doit donc être évoquée devant l’apparition de signes respiratoires chez un patient recevant ou ayant reçu ce traitement. L’illustration de cette toxicité par ces 3 cas rappelle qu’il est important d’éliminer les principaux diagnostics différentiels en réalisant un bilan exhaustif avant d’initier un traitement par corticoïdes. La pneumopathie infectieuse fait partie du principal diagnostic différentiel à éliminer. Le bilan biologique est non spécifique, un syndrome inflammatoire pouvant également être présent en cas de PI ou en raison de la pathologie tumorale. La fibroscopie bronchique permet de réaliser des prélèvements infectieux larges (aspiration bronchique et LBA avec analyse bactériologique, mycobactériologique, mycologique dont PCR Pneumocystis et virologique) [10], [12], [19], [24], [25]. L’analyse anatomopathologique du LBA apporte un argument supplémentaire pour ce diagnostic avec habituellement un profil d’alvéolite immune caractérisé par une hyperlymphocytose [12].
Le scanner thoracique tient également une place centrale pour établir ce diagnostic et éliminer les autres hypothèses pouvant être responsables de symptômes respiratoires chez ces patients, notamment la progression tumorale et les infections. La PI peut se présenter sous des formes scanographiques variées, comme illustré dans notre série de 3 cas, ainsi que dans d’autres études [12], [14], [15], [26]. Les lésions constatées sont le plus souvent bilatérales. Les principales anomalies retrouvées sont des plages de verre dépoli, des condensations ou encore des épaississements des septa inter- et intralobulaires permettant de proposer le plus fréquemment des patterns de pneumopathie organisée, pneumopathie d’hypersensibilité ou de PI non spécifique [6], [12], [27], [28]. Ces anomalies scanographiques ne sont pas spécifiques de ce diagnostic. Celles-ci peuvent être visualisées dans les pneumopathies infectieuses. En effet, dans la pneumopathie à COVID-19, on constate la présence de plages de verre dépoli multifocales, bilatérales, prédominant dans les régions périphériques, postérieures et basales, pouvant évoluer vers un aspect de « crazy-paving » (superposition de verre dépoli et de réticulations intralobulaires) et/ou de condensations [29]. La négativité des prélèvements infectieux réalisés en fibroscopie bronchique dans les territoires scanographiques atteints et l’absence de réponse à une antibiothérapie de première intention sont des arguments supplémentaires en faveur de ce diagnostic. Un autre diagnostic différentiel ou pouvant être associé à ce diagnostic est celui de l’insuffisance cardiaque aiguë, qu’il convient de rechercher en réalisant systématiquement un dosage des biomarqueurs cardiaques (NT-proBNP) et une échographique cardiaque.
Après élimination des diagnostics différentiels, il est recommandé par les sociétés savantes de cancérologie (ASCO, ESMO, SITC) [19], [30], [31] d’initier une corticothérapie intraveineuse à dose élevée à la phase initiale en cas de toxicité sévère (grade 3 ou 4 CTACEv5) pendant 48–72 heures, puis de diminuer la posologie, si l’évolution clinique est favorable, selon un protocole de décroissance progressive sur au moins 8 semaines [19], [24], [32]. Dans l’attente du résultat de l’ensemble des prélèvements infectieux, une antibiothérapie probabiliste est généralement associée à ce traitement.
Certains cas de PI réfractaires à la corticothérapie ont été décrits [33]. En cas d’évolution clinique non favorable après 48 heures de corticothérapie, d’autres traitements immunosuppresseurs peuvent avoir leur place (anti-TNF, cyclophosphamide, mycophenolate mofetil) [34]. Une toxicité pulmonaire sévère représente habituellement une contre-indication définitive à la reprise de l’immunothérapie.
Conclusion
La pneumopathie immuno-induite représente une toxicité relativement rare de l’immunothérapie, mais potentiellement sévère, pouvant engager le pronostic vital, qu’il convient d’évoquer devant tout symptôme respiratoire (dyspnée, toux, douleur thoracique) apparaissant ou se majorant en cours de traitement par immunothérapie ou dans l’année suivant son arrêt. Elle est plus fréquente chez les patients atteints de cancer pulmonaire traités par anti-PD1 ou combinaison d’immunothérapies et peut survenir à n’importe quel moment de la phase du traitement, voire plusieurs mois après arrêt de celui-ci.
La PI reste toujours un diagnostic d’élimination. La démarche diagnostique impose, comme illustré à travers les 3 cas cliniques présentés ici, d’éliminer les diagnostics alternatifs principaux que sont les pneumopathies infectieuses (essentiellement bactérienne, virale dont COVID-19, fongique dont la pneumocystose), la progression tumorale, l’insuffisance cardiaque et les autres étiologies de pneumopathies infiltrantes diffuses en s’aidant d’examens complémentaires tels qu’un bilan biologique, un bilan cardiaque, un scanner thoracique et une fibroscopie bronchique avec LBA.
Le traitement de première intention repose sur la corticothérapie à forte dose, administrée par voie intraveineuse en cas de toxicité sévère (grade 3–4 CTACEv5), suivie d’une décroissance progressive par voie orale sur au moins 8 semaines, permettant habituellement une évolution favorable. La survenue d’une pneumopathie sévère immuno-induite contre-indique habituellement la reprise de l’immunothérapie, bien que, selon la balance bénéfice-risque, la réintroduction de ce traitement puisse se rediscuter en réunion de concertation pluridisciplinaire dédiée.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Références
- 1.Reck M., Rodríguez-Abreu D., Robinson A.G., et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2016;375(19):1823–1833. doi: 10.1056/NEJMoa1606774. [DOI] [PubMed] [Google Scholar]
- 2.Powles T., Durán I., van der Heijden M.S., et al. Atezolizumab versus chemotherapy in patients with platinum-treated locally advanced or metastatic urothelial carcinoma (IMvigor211): a multicentre, open-label, phase 3 randomised controlled trial. Lancet. 2018;391:748–757. doi: 10.1016/S0140-6736(17)33297-X. [DOI] [PubMed] [Google Scholar]
- 3.Ansell S.M., Lesokhin A.M., Borrello I., et al. PD-1 blockade with nivolumab in relapsed or refractory Hodgkin's lymphoma. N Engl J Med. 2015;372:311–319. doi: 10.1056/NEJMoa1411087. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Robert C., Long G.V., Brady B., et al. Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med. 2015;372:320–330. doi: 10.1056/NEJMoa1412082. [DOI] [PubMed] [Google Scholar]
- 5.Mellman I., Coukos G., Dranoff G. Cancer immunotherapy comes of age. Nature. 2011;480:480–489. doi: 10.1038/nature10673. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Nishino M., Sholl L.M., Hatabu H., et al. Anti-PD-1 – related pneumonitis during cancer immunotherapy. N Engl J Med. 2015;373:288–290. doi: 10.1056/NEJMc1505197. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Hofmann L., Forschner A., Loquai C., et al. Cutaneous, gastrointestinal, hepatic, endocrine, and renal side-effects of anti-PD-1 therapy. Eur J Cancer. 2016;60:190–209. doi: 10.1016/j.ejca.2016.02.025. [DOI] [PubMed] [Google Scholar]
- 8.Postow M.A., Sidlow R., Hellmann M.D. Immune-related adverse events associated with immune checkpoint blockade. N Engl J Med. 2018;378:158–168. doi: 10.1056/NEJMra1703481. [DOI] [PubMed] [Google Scholar]
- 9.Fessas P., Possamai L.A., Clark J., et al. Immunotoxicity from checkpoint inhibitor therapy: clinical features and underlying mechanisms. Immunology. 2020;159:167–177. doi: 10.1111/imm.13141. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Kroschinsky F., Stölzel F., von Bonin S., et al. New drugs, new toxicities: severe side effects of modern targeted and immunotherapy of cancer and their management. Crit Care. 2017;21:89. doi: 10.1186/s13054-017-1678-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Lemiale V., Meert A.-P., Vincent F., et al. Severe toxicity from checkpoint protein inhibitors: what intensive care physicians need to know? Ann Intensive Care. 2019;9:25. doi: 10.1186/s13613-019-0487-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Delaunay M., Cadranel J., Lusque A., et al. Immune-checkpoint inhibitors associated with interstitial lung disease in cancer patients. Eur Respir J. 2017;50:1700050. doi: 10.1183/13993003.00050-2017. [DOI] [PubMed] [Google Scholar]
- 13.Porcu M., De Silva P., Solinas C., et al. Immunotherapy associated pulmonary toxicity: biology behind clinical and radiological features. Cancers (Basel) 2019;11:E305. doi: 10.3390/cancers11030305. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Suresh K., Voong K.R., Shankar B., et al. Pneumonitis in non-small cell lung cancer patients receiving immune checkpoint immunotherapy: incidence and risk factors. J Thorac Oncol. 2018;13:1930–1939. doi: 10.1016/j.jtho.2018.08.2035. [DOI] [PubMed] [Google Scholar]
- 15.Naidoo J., Wang X., Woo K.M., et al. Pneumonitis in patients treated with anti-programmed death-1/programmed death ligand 1 therapy. J Clin Oncol. 2017;35:709–717. doi: 10.1200/JCO.2016.68.2005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Abdel-Rahman O., Fouad M. Risk of pneumonitis in cancer patients treated with immune checkpoint inhibitors: a meta-analysis. Ther Adv Respir Dis. 2016;10:183–193. doi: 10.1177/1753465816636557. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Su Q., Zhu E.C., Wu J.-B., et al. Risk of pneumonitis and pneumonia associated with immune checkpoint inhibitors for solid tumors: a systematic review and meta-analysis. Front Immunol. 2019;10:108. doi: 10.3389/fimmu.2019.00108. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Duchemann B., Pluvy J., Crestani B., et al. Immune checkpoint blockade for patients with lung cancer and idiopathic pulmonary fibrosis. Eur J Cancer. 2021;145:179–182. doi: 10.1016/j.ejca.2020.12.016. [DOI] [PubMed] [Google Scholar]
- 19.Haanen J.B.G., Carbonnel F., Robert C., et al. Management of toxicities from immunotherapy: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28:iv119–iv142. doi: 10.1093/annonc/mdx225. [DOI] [PubMed] [Google Scholar]
- 20.De Velasco G., Je Y., Bossé D., et al. Comprehensive meta-analysis of key immune-related adverse events from CTLA-4 and PD-1/PD-L1 inhibitors in cancer patients. Cancer Immunol Res. 2017;5:312–318. doi: 10.1158/2326-6066.CIR-16-0237. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Nishino M., Giobbie-Hurder A., Hatabu H., et al. Incidence of programmed cell death 1 inhibitor-related pneumonitis in patients with advanced cancer: a systematic review and meta-analysis. JAMA Oncol. 2016;2:1607–1616. doi: 10.1001/jamaoncol.2016.2453. [DOI] [PubMed] [Google Scholar]
- 22.Ma K., Lu Y., Jiang S., et al. The relative risk and incidence of immune checkpoint inhibitors related pneumonitis in patients with advanced cancer: a meta-analysis. Front Pharmacol. 2018;9:1430. doi: 10.3389/fphar.2018.01430. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Wang D.Y., Salem J.-E., Cohen J.V., et al. Fatal toxic effects associated with immune checkpoint inhibitors: a systematic review and meta-analysis. JAMA Oncol. 2018;4:1721–1728. doi: 10.1001/jamaoncol.2018.3923. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Puzanov I., Diab A., Abdallah K., et al. Managing toxicities associated with immune checkpoint inhibitors: consensus recommendations from the Society for Immunotherapy of Cancer (SITC) toxicity management working group. J Immunother Cancer. 2017;5:95. doi: 10.1186/s40425-017-0300-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Cadranel J., Canellas A., Matton L., et al. Pulmonary complications of immune checkpoint inhibitors in patients with non-small cell lung cancer. Eur Respir Rev. 2019;28:190058. doi: 10.1183/16000617.0058-2019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Nishino M., Ramaiya N.H., Awad M.M., et al. PD-1 inhibitor-related pneumonitis in advanced cancer patients: radiographic patterns and clinical course. Clin Cancer Res. 2016;22:6051–6060. doi: 10.1158/1078-0432.CCR-16-1320. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Widmann G., Nguyen V.A., Plaickner J., et al. Imaging features of toxicities by immune checkpoint inhibitors in cancer therapy. Curr Radiol Rep. 2016;5:59. doi: 10.1007/s40134-017-0256-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Zhong L., Altan M., Shannon V.R., et al. Immune-related adverse events: pneumonitis. Immunotherapy. 2020;1244:255–269. doi: 10.1007/978-3-030-41008-7_13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Lodé B., Jalaber C., Orcel T., et al. Imagerie de la pneumonie COVID-19. J Imagerie Diagn Interv. 2020;3:249–258. [Google Scholar]
- 30.Schneider B.J., Naidoo J., Santomasso B.D., et al. Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: ASCO guideline update. J Clin Oncol. 2021;39:4073–4126. doi: 10.1200/JCO.21.01440. [DOI] [PubMed] [Google Scholar]
- 31.Brahmer J.R., Abu-Sbeih H., Ascierto P.A., et al. Society for Immunotherapy of Cancer (SITC) clinical practice guideline on immune checkpoint inhibitor-related adverse events. J Immunother Cancer. 2021;9:e002435. doi: 10.1136/jitc-2021-002435. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Brahmer J.R., Lacchetti C., Schneider B.J., et al. Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: American Society of Clinical Oncology Clinical Practice Guideline. J Clin Oncol. 2018;36:1714–1768. doi: 10.1200/JCO.2017.77.6385. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Andruska N., Mahapatra L., Hebbard C., et al. Severe pneumonitis refractory to steroids following anti-PD-1 immunotherapy. BMJ Case Rep. 2018 doi: 10.1136/bcr-2018-225937. [2018:bcr-2018-225937] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Thompson J.A., Schneider B.J., Brahmer J., et al. NCCN guidelines insights: management of immunotherapy-related toxicities, version 1.2020. J Natl Compr Canc Netw. 2020;18:230–241. doi: 10.6004/jnccn.2020.0012. [DOI] [PubMed] [Google Scholar]