Abstract
目的
探讨屎肠球菌QH06对溃疡性结肠炎(UC)大鼠肠道菌群与肠道免疫的影响及其机制。
方法
36只SPF级雄性Wistar大鼠随机分为正常对照组、UC模型组和屎肠球菌组(12只/组)。除正常对照组外,其余2组以5% TNBS/乙醇灌肠法建立UC模型。造模成功后屎肠球菌组用屎肠球菌QH06灌胃干预,剂量为0.21 g/kg,正常对照组和UC组用等体积的蒸馏水灌胃干预。干预14 d后用HE染色法观察各组大鼠结肠病理改变并评分,用RT-qPCR和ELISA法检测细胞因子IL-4、IL-10、IL-12和IFN-γ的mRNA和蛋白表达水平,用免疫组化和ELISA法检测TLR2蛋白表达量。利用IlluminaMiseq平台对各组大鼠肠道菌群测序同时进行生物信息学分析。最后肠道菌群和TLR2蛋白表达量、细胞因子等指标进行相关性分析。
结果
与正常对照组相比,UC组大鼠体质量下降(P < 0.01),结肠组织损伤严重,病理学评分显著升高(P < 0.01);ELISA和RT-qPCR结果显示,IFN-γ(P < 0.01),IL-12(P < 0.01),TLR2(P < 0.01)的蛋白表达水平和IFN-γ(P < 0.05),IL-12(P < 0.05),IL-10(P < 0.05)的mRNA表达水平上调。Illumina Miseq测序和分析显示,UC组大鼠肠道菌群多样性Shannon指数(P < 0.05)、Ace指数(P < 0.01)和Chao指数(P < 0.05)降低。Enterobacteriaceae(P < 0.01)增多,Burkholderiaceae(P < 0.05)减少。与UC组相比,屎肠球菌组大鼠体质量增加(P < 0.05),损伤减轻,病理学评分下降(P < 0.05),结肠组织中IFN-γ(P < 0.01),IL-12(P < 0.05)、TLR2蛋白表达量(P < 0.01)下调,IL-4蛋白表达量上调(P < 0.05),IFN-γ(P < 0.05)、IL-12(P < 0.05)的mRNA表达量下调,肠道菌群多样性Shannon指数(P < 0.05)、Ace指数(P < 0.05)和Chao指数(P < 0.05)升高。Enterobacteriaceae(P < 0.05)减少,Burkholderiaceae(P < 0.05)和Rikenellaceae(P < 0.01)增多;肠道菌群、细胞因子含量和TLR2蛋白表达量相关性分析结果显示,IFN-γ与Enterobacteriaceae呈正相关、而与Prevotellaceae,Desulfovibrionaceae、norank_o__Mollicutes _RF39,Clostridiales _vadinBB60 _group呈负相关;TLR2表达水平与Clostridiales_ vadinBB60_ group,norank_o__Mollicutes_RF39和Prevotellaceae呈负相关。
结论
屎肠球菌QH06能减轻TNBS诱导的UC大鼠的结肠黏膜损伤,其机制可能与普氏菌科等短链脂肪酸产生菌丰度的升高,TLR2介导的异常免疫反应的抑制有关。
Keywords: 屎肠球菌, 溃疡性结肠炎, 肠道菌群, TLR2, 细胞因子
Abstract
Objective
To investigate the effect of Enterococcus faecium QH06 on TNBS-induced ulcerative colitis (UC) in rats and explore the mechanisms in light of intestinal flora and intestinal immunity.
Methods
Thirty-six male Wistar rats were randomized equally into control group, UC model group, and E.faecium QH06 intervention group. The rats in the latter two groups were subjected to colonic enema with 5% TNBS/ethanol to induce UC, followed by treatment with intragastric administration of distilled water or E.faecium QH06 at the dose of 0.21 g/kg. After 14 days of treatment, the rats were examined for colon pathologies with HE staining. The mRNA and protein expression levels of IL-4, IL-10, IL-12, and IFN-γ in the colon tissues were detected using RT-qPCR and ELISA, and the expression of TLR2 protein was detected with immunohistochemistry and ELISA. Illumina Miseq platform was used for sequencing analysis of the intestinal flora of the rats with bioinformatics analysis. The correlations of the parameters of the intestinal flora with the expression levels of TLR2 and cytokines were analyzed.
Results
The rats with TNBS- induced UC showed obvious weight loss (P < 0.01) and severe colon tissue injury with high pathological scores (P < 0.01). The protein expression levels of IFN-γ, IL-12, and TLR2 (P < 0.01) and the mRNA expression levels of IFN-γ, IL-12 and IL-10 (P < 0.05) were significantly increased in the colon tissues of the rats with UC. Illumina Miseq sequence analysis showed that in UC rats, the Shannon index (P < 0.05) ACE (P < 0.01)and Chao (P < 0.05) index for the diversity of intestinal flora both decreased with a significantly increased abundance of Enterobacteriaceae (P < 0.01) and a lowered abundance of Burkholderiaceae (P < 0.05). Compared with the UC rats, the rats treated with E. faecium QH06 showed obvious body weight gain (P < 0.05), lessened colon injuries, lowered pathological score of the colon tissue (P < 0.05), decreased protein expressions of IFN- γ, IL- 12, and TLR2 and mRNA expressions of IFN- γ and IL-12 (P < 0.01 or 0.05), and increased protein expressions of IL- 4 (P < 0.05). The Shannon index ACE (P < 0.05) and Chao (P < 0.05) index of intestinal microflora were significantly increased, the abundance of Enterobacteriaceae was lowered and that of Burkholderiaceae and Rikenellaceae was increased in E.faecium QH06- treated rats (P < 0.01 or 0.05). Correlation analysis showed that IFN-γ was positively correlated with the abundance of Enterobacteriaceae, and IFN-γ was negatively correlated with the abundance of Prevotellaceae, Desulfovibrionaceae, norank_o_Mollicutes_RF39 and Clostridiales_vadinBB60_group; TLR2 was negatively correlated with Clostridiales_vadinBB60_group, norank_o_Mollicutes_RF39 and Prevotellaceae.
Conclusion
E.faecium QH06 can alleviate TNBS-induced colonic mucosal injury in rats, and its effect is mediated possibly by increasing the abundance of SCFA-producing bacteria such as Prevotellaceae and inhibiting abnormal immune responses mediated by TLR2.
Keywords: Enterococcus faecium, ulcerative colitis, intestinal flora, Toll-like receptor 2, cytokines
溃疡性结肠炎(UC)是一种慢性复发性炎症性肠道疾病,病因和发病机制至今尚未完全明确[1]。目前认为,遗传易感个体中肠道菌群的异常免疫应答可能在UC的发病机理中起主要作用[2]。由于UC发病过程中肠黏膜屏障的破坏和免疫系统的异常激活均与肠道菌群失衡有关,因此在治疗过程中应用微生态调节剂来调节肠道菌群失衡尤为重要。益生菌是可定植于肠道并在宿主体内发挥有益作用的一类活性细菌,大多数人的益生菌属于乳酸菌属和双歧杆菌属,主要通过调节肠道免疫功能和肠道菌群来发挥作用[3]。
屎肠球菌(E.faecium)属肠球菌属,是人及动物肠道中正常菌群的一部分。其一直被认为是医院获得性感染的主要原因[4],但近期研究发现部分屎肠球菌菌株具有益生作用[5]。研究显示,屎肠球菌定植可改善宿主肠道上皮防御能力,定期摄入屎肠球菌CRL183可减轻DSS诱导的大鼠结肠炎损伤[6, 7]。在饲料中添加屎肠球菌NCIMB11181可以提高饲料转化效率,减少沙门氏菌在宿主肠道中的定植[8]。从发酵饮料中分离得到的屎肠球菌OV3-6也具有良好的益生菌潜力[5]。此外,屎肠球菌在不同动物体内显示出不同的益生作用,其可通过黏附肠道表面形成保护屏障、降低肠道pH、维持菌群平衡,可用于幼畜的肠道保健和动物肠道菌群失调的防治[9, 10]。
研究发现Toll样受体(TLRs)通过对入侵机体的病原体产生免疫应答来维持内环境的稳定,某些常驻肠道细菌亚群通过TLR2信号通路诱导调节性免疫反应[11]。因此益生菌治疗UC过程中肠道菌群和TLR2蛋白表达的变化以及两者之间的相关性关系的检测,为UC发病机制和药物治疗机制的明确提供实验依据。
由上可知,部分屎肠球菌菌株具有肠道保护作用,但屎肠球菌QH06对肠道损伤是否具有修复作用未见报道。基于此,本研究中通过TNBS/乙醇灌肠法建立大鼠UC模型,用屎肠球菌QH06进行灌胃干预,检测结肠组织中炎症相关细胞因子IFN-γ、IL-12、IL-4和IL-10的mRNA和蛋白表达水平及Toll样受体2(TLR2)的蛋白表达水平,利用Illumina Miseq测序技术对大鼠结肠组织的肠道菌群进行测序并进行生物信息学分析。探讨屎肠球菌对Wistar大鼠UC的干预效果及其相关分子机制,为寻找治疗UC的新方法提供实验基础。
1. 材料和方法
1.1. 实验材料
1.1.1. 实验动物
鼠龄6~8周的SPF级雄性Wistar大鼠,体质量200±20 g(新疆医科大学实验动物中心),适应性饲养1周,保持室内温度25±3 ℃,相对湿度60%~80%,12 h明暗交替,自由饮食饮水。动物实验经新疆医科大学伦理委员会批准(许可证号:IACUC20180814-15)。
1.1.2. 主要仪器与试剂
TNBS(Sigma)、乙醇(分析纯,国产)、武汉基因美ELISA试剂盒(货号:IFN- γ JYM0654Ra、IL-4 JYM0647Ra、IL-10 JYM0654Ra、IL- 12 JYM1006Ra)、TLR2抗体(BIOSS, bs1019R)、Trizol RNA提取试剂(Invitrogen); 引物(上海生工基因)、Revert Aid First Strand cDNA Synthesis Kit逆转录试剂盒(Therom Scientific)、SYBR®Green Real-time PCR试剂盒(TaKaRa)、PCR仪(BIO-RAD)、全能型凝胶成像分析仪(BIO RAD-XR),分光光度计(NaNo DroP)、荧光定量PCR仪(ABI 7500,QuantStudioTM Real-Time PCR System)、荧光倒置显微镜(莱卡)、Illumina高通量测序仪(上海美吉生物)。
1.1.3. 实验药物
屎肠球菌QH06冻干粉购于山东中科嘉亿生物工程有限公司,产品规格:活性屎肠球菌含量≥1×1011 cfu/g,水分 < 6%。
1.2. 实验方法
1.2.1. TNBS/乙醇灌肠法建立大鼠UC模型
参照文献[12, 13]建立大鼠UC模型,5%的TNBS溶入等体积50%的无水乙醇中,用液体石蜡润滑的内径1.5 mm的硅胶灌缓慢注入保持仰卧姿势的大鼠结肠内(离肛门约8 cm处),注入完成后,轻轻拔出硅胶管并立即捏紧大鼠肛门使大鼠呈倒立姿势保持1 min左右,TNBS/乙醇混合液能充分吸收后将大鼠放入干净的清洁笼内,正常对照组大鼠注入相应体积的0.9%氯化钠溶液灌肠,待大鼠自行清醒,自由饮水。造模第3天开始用普通鼠饲料饲养。
1.2.2. 分组及给药
36只大鼠随机分为正常对照组(12只)和模型组(24只),模型组大鼠用TNBS/乙醇灌肠法构建大鼠UC模型,模型成功后将模型组大鼠随机分成UC组和屎肠球菌组(E.faecium组);屎肠球菌组用屎肠球菌QH06灌胃干预,剂量为0.21 g/kg;为了消除灌胃器械造成的实验差异,正常对照组和UC组灌胃等量的蒸馏水,灌胃14 d,2次/d。
1.2.3. 大鼠一般情况及体质量变化
每天观察大鼠的活动力、精神状况、毛色、粪便形状,干预前和干预结束时测定大鼠体质量,进行组间比较。
1.2.4. 标本采集
禁食24 h的大鼠麻醉后取整段结肠组织并分3部分:(1)高通量测序部分:用无菌眼科剪刀及眼科镊剪取1 cm左右大小的结肠组织,将其装入2 mL无菌冻存管后迅速置于液氮中冻存并用干冰送检;(2)组织病理学部分:剪取一部分结肠组织置于4%的多聚甲醛溶液中固定,用于HE染色;(3)分子实验部分:剪取一部分分装于灭菌EP管中,放入-80 ℃的冰箱保存,以上操作均为纵向剖开结肠组织后进行。
1.2.5. 组织病理学检测
用4%的多聚甲醛固定的结肠组织进行脱水、包埋,取4 μm组织切片,进行HE染色,参照文献[14]的组织学评分标标准,由病理科专业人员盲法阅片,评分为4个等级,评分越高,表明黏膜损伤及炎症程度越高(表 1)。
表 1.
结肠组织损伤评分等级标准
Criteria for colon tissue injury scoring
| Degree of inflammatory cell infiltration | Depth of inflammatory cell infiltration | Depth of ulcer | Lesion score | |
| The lesion score was based on the lesion type, with histopathology=inflammatory cell infiltration degree+inflammatory cell infiltration depth+ulcer depth. | ||||
| Degree of lesion | None | None | None | 0 |
| Mild | Mucous Layer | Colonic epithelium | 1 | |
| Moderate | Submucosa | Lamina propria mucosa | 2 | |
| Severe | Full-thickness colon | Muscularis mucosa | 3 | |
1.2.6. RT-qPCR法检测结肠组织中相关炎症因子的mRNA表达水平
用匀浆机充分研磨大鼠结肠组织,加入1 mL TRIzol,采用氯仿异丙醇法提取结肠组织总RNA,用NanoDrop超微分光光度计测定RNA样品浓度和纯度,并经凝胶成像仪鉴定后参照逆转录试剂盒说明取1μg RNA逆转录成cDNA。在GenBank数据库中查询大鼠IFN-γ、IL-12、IL-4、IL-10等mRNA序列,利用IDT引物设计网站设计引物(表 2)。在ABI 7500(QuantStudioTM Real-Time PCR System)系统下进行PCR扩增,PCR产物通过琼脂糖凝胶电泳鉴定。
表 2.
引物序列
Primersequences
| Gene | Primer sequence (5'→3') | |
| IFN-γ | F:AGGATGCATTCATGAGCATCGCC | R:TCAGCACCGACTCCTTTTCCGCT |
| IL-12 | F:AGTGTAACCAGAAAGGTGCGTTC | R:CCTGCAGGGTACACATGTCCATT |
| IL-4 | F:CGGCAACAAGGAACACCACGGA | R:AGCGTGGACTCATTCACGGTGC |
| IL-10 | F:AGCTGAAGACCCTCTGGATA | R:TGGCCTTGTAGACACCTTTG |
| β-actin | F:CTTCCTTCCTGGGTATGGAATC | R:CTGTGTTGGCATAGAGGTCTT |
1.2.7. ELISA法检测结肠组织中炎症因子和TLR2的蛋白表达水平
将冷冻的结肠组织样品中加入PBS(pH 7.4)后匀浆。样品应在4 ℃下操作。在2000~3000 r/min离心20 min后,收集上清液。分装上清液用于ELISA分析。操作步骤按ELISA试剂盒说明进行,大致如下:(1)标准品的稀释; (2)微孔板中加样; (3)加入HRP结合试剂(空白对照孔除外); (4)温育; (5)配液; (6)洗涤; (7)显色; (8)终止; (9)450 nm处用酶标仪测定吸光度; (10)用标准曲线计算结果。
1.2.8. 免疫组化法检测结肠组织中TLR2的蛋白表达水平
免疫组化实验步骤:制作石蜡切片→烤片1.5 h→二甲苯脱蜡→用梯度酒精进行脱水→自来水冲洗→蒸馏水冲洗→滴加内源性过氧化物酶阻断剂→PBS冲洗3次→柠檬酸修复液来抗原修复→蒸馏水冲洗2次→PBS冲洗2次→封闭→滴加一抗4 ℃过夜→PBS冲洗3次→滴加二抗37 ℃孵育30 min→显色→苏木素复染→脱水→透明→封片→干燥→阅片并使用Image-Pro Plus 6.0对相对光密度(IOD)进行量化。
1.2.9. 结肠组织标本16S rRNA多样性测序
具体流程如下:提取结肠组织总DNA后,对结肠组织总DNA的浓度和纯度进行测定。提取的DNA为模板,对16SrRNA V3-V4可变区进行PCR扩增。引物为338F:ACTCCT ACGGGAGGCAGCAG,806R:GGACTACHVGGGT WTCTAAT; 使用AxyPrep DNA Gel Extraction Kit对PCR产物纯化,使用NEXTFLEX® Rapid DNA-Seq Kit进行建库,利用Illumina公司的MiseqPE300平台进行测序。
1.3. 统计学分析
数据采用SPSS 21.0(IBM SPSS Statistics)软件进行统计,实验数据均采用均数±标准差描述,多组间比较采用单因素方差分析,计量资料服从正态性和方差齐性时采用LSD-t方法检验,方差不齐则采用秩和检验,P < 0.05为差异有统计学意义。
2. 结果
2.1. 屎肠球菌对UC大鼠体质量的影响
与正常对照相比,造模组大鼠造模后第2天起出现食欲减退、精神萎靡,活动量减少等现象,大部分大鼠出现稀便、粘液脓血便。造模第2天在正常对照组和UC组中,各随机选择2只大鼠,处理后对其结肠组织进行肉眼观察发现,UC组大鼠结肠组织出现充血、水肿和溃疡等情况。根据一般特征和结肠组织观察结果确定为UC模型造模成功。干预后,随着屎肠球菌干预时间的延长,逐渐出现大鼠增重、活动量增多、大便成形等现象。干预结束后测定的体质量结果显示,与正常对照组相比,UC组大鼠体质量明显降低(P < 0.01); 与UC组相比,屎肠球菌组大鼠体质量有显著升高(P < 0.05,图 1)。
图 1.
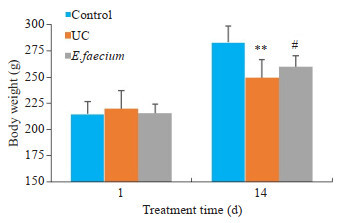
大鼠体质量变化
Changes of body weight of the rats in the 3 groups. **P < 0.01 vs control group. #P < 0.05 vs UC group.
2.2. 屎肠球菌减轻UC大鼠结肠组织损伤
与正常对照组相比,UC组大鼠结肠组织炎细胞浸润明显,腺体损伤严重,不同程度的腺体结构消失,溃疡深达肌层,表层可见纤维素样渗出物并夹杂着坏死组织。与UC组相比,屎肠球菌组大多数大鼠结肠组织溃疡面积缩小,见少许糜烂,但黏膜和黏膜下层仍有炎细胞浸润,部分上皮细胞增生和肉芽组织形成,可能是溃疡处于恢复状态,3例大鼠溃疡无明显好转(图 2)。
图 2.
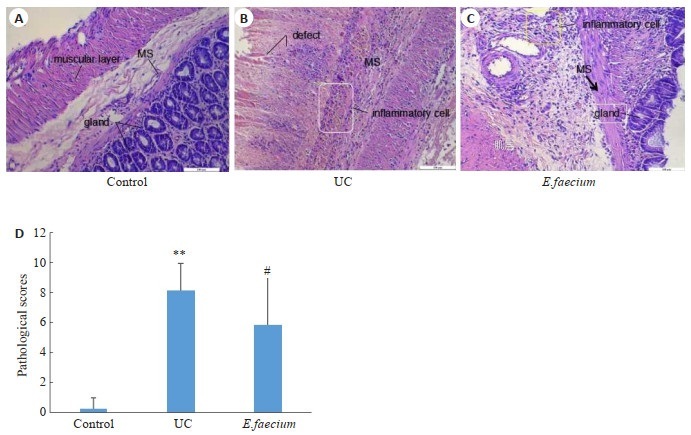
大鼠结肠组织病理变化
Pathological changes of the colon in the 3 groups (Original magnification: ×200). A: Control group. B: UC group. C: E.faecium group. D: Comparison of pathological scores of the colon among the 3 groups (n=8). **P < 0.01 vs control group. #P < 0.05 vs UC group.
2.3. 屎肠球菌对UC大鼠结肠组织中炎症因子表达的影响
与正常对照组相比,UC组IL-12和IFN-γ的蛋白表达水平明显上调,差异有统计学意义(P<0.01),IL-4和IL-10蛋白表达水平无统计学差异(P > 0.05); 与UC组相比,屎肠球菌组大鼠结肠组织IL-12、IFN-γ蛋白表达水平明显下调,差异有统计学意义(P < 0.01或P < 0.05),而IL-4蛋白表达水平明显上调(P < 0.05,图 3)。
图 3.
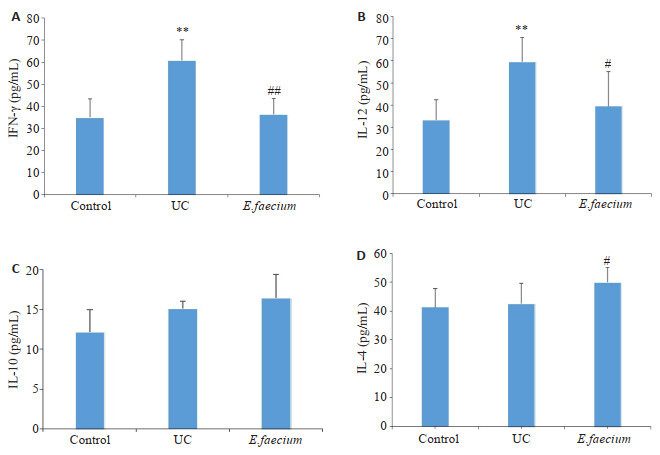
各组大鼠结肠细胞因子蛋白表达水平比较
Expression levels of cytokines in the colon in the 3 groups (n=6). A: IFN-γ. B: IL-12. C: IL-10. D: IL-4. **P < 0.01 vs control group. #P < 0.05 and ##P < 0.01 vs UC group.
2.4. 屎肠球菌对UC大鼠结肠组织炎症因子mRNA表达水平的影响
与正常对照组相比,UC组中IL-12、IFN-γ和IL-10的mRNA表达水平均明显上调,差异有统计学差异(P < 0.05); 与UC组相比,屎肠球菌组大鼠结肠组织IFN-γ和IL-12的mRNA表达水平明显下调,差异有统计学意义(P < 0.05,表 3)。
表 3.
各组大鼠结肠组织IFN-γ、IL-12、IL-4、IL-10的mRNA水平比较
Expression levels of IFN-γ, IL-12, IL-4, and IL-10 mRNA in the colon of the rats in each group (n=6)
| Gene | Control | UC | E.faecium | F | P |
| *P < 0.05 vs Normal group, #P < 0.05 vs UC group. | |||||
| IL-12 | 1.00±0.88 | 3.18±2.23* | 1.24±1.09# | 3.358 | 0.067 |
| IFN-γ | 1.00±0.64 | 3.97±0.62* | 2.84±0.44# | 40.021 | < 0.001 |
| IL-4 | 1.00±0.62 | 1.95±1.05 | 2.85±1.28 | 3.014 | 0.106 |
| IL-10 | 1.00 ± 0.57 | 3.18 ± 1.12* | 3.70 ± 1.78 | 5.202 | 0.022 |
2.5. 屎肠球菌对UC大鼠结肠组织中TLR2表达的影响
TLR2蛋白主要表达在结肠组织黏膜层、黏膜下层的胞质及胞膜中,为弥漫性黄色颗粒。正常对照组TLR2蛋白弱表达; UC组阳性区域较明显,染色深、分布密集。屎肠球菌组TLR2蛋白有不同程度的阳性表达(图 4A~C)。ELISA法检测3组大鼠结肠组织中TLR2蛋白表达情况结果显示,与正常对照组相比,UC组TLR2表达显著上调(P < 0.01)。与UC组相比,屎肠球菌组TLR2蛋白表达显著下调(P < 0.01,图 4D)。
图 4.
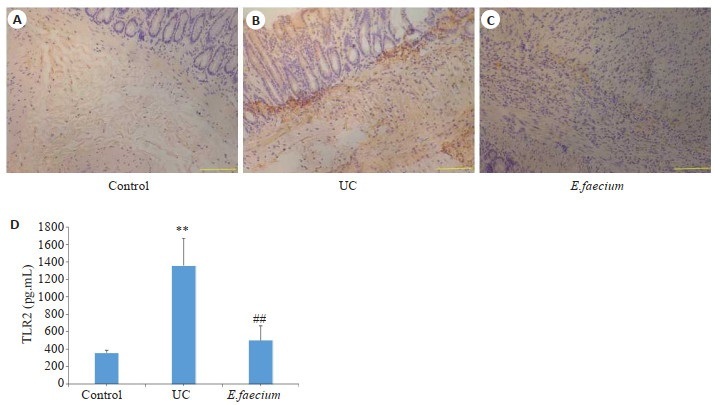
各组大鼠结肠组织TLR2表达
Expression level of TLR2 in the colon in the 3 groups (Scale bar=100 μm). A: control group. B: UC group. C: E. faecium group. D: Changes of TLR2 expression level in the 3 groups (n=6). **P < 0.01 vs control group. ##P < 0.01 vs UC group.
2.6. 屎肠球菌提高UC大鼠肠道菌群多样性
采用Rank-abundance曲线解释物种丰富度和均匀度。从图 5A可知,随着样本量的增加,曲线逐渐趋于平缓,说明随着样本量的增加基本不能增加新OTU数目。UC组曲线宽度小于正常对照组,说明UC组肠道菌群多样性较低。屎肠球菌组曲线宽度大于UC组,说明干预后UC大鼠的肠道菌群多样性升高。Pan和Core分析结果(图 5B、C)显示,随着样本量的增加,总OTU和核心OTU的增加趋势逐渐趋于平缓,说明各组样本量满足评估物种所需的总物种和核心物种数的要求。Rarefaction Curve(图 5D)和Shannon Curve(图 5E)结果显示,本次所测序的数据量合理。
图 5.
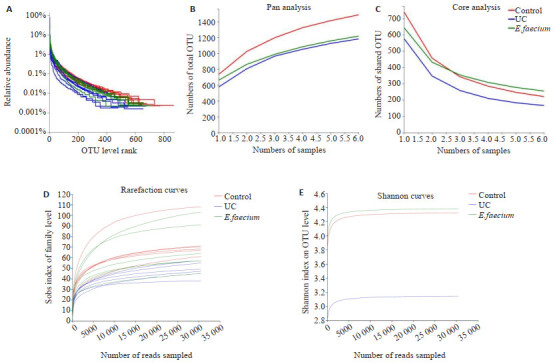
各组大鼠肠道菌群物种注释与评估
Annotation and evaluation of gut microbiota in the 3 groups (n=6). A: Relative abundance in OTU level. B: Pan analysis. C: Core analysis. D: Rarefaction curves in Sobs index. E: Shannon curves.
2.7. 各组大鼠肠道菌群Alpha多样性分析
采用Simpson、Shannon、Ace、Chao指数比较各组大鼠肠道菌群多样性。Simpson和Shannon反映微生物群落多样性,Ace和chao指数反映微生物群落丰富度。与正常对照组相比,UC组Shannon、Ace和Chao指数均降低(P < 0.05或P < 0.01),而Simpson指数升高(P < 0.05);与UC组相比,屎肠球菌组Shannon、Ace和Chao指数均升高(P < 0.05),而Simpson指数降低(P < 0.05)。说明UC组和正常对照组的肠道菌群多样性存在差异,UC组大鼠肠道所含的物种种类低于正常对照组。屎肠球菌QH06能够提高肠道菌群丰富度(表 4)
表 4.
3组OTU水平上alpha多样性比较
Comparison of microbiota diversity index in 3 groups (n=6, Mean±SD)
| Group | Index | |||
| Simpson | Shanon | ACE | Chao | |
| *P < 0.05 and **P < 0.05 vs control group, #P < 0.05 vs UC group. | ||||
| Control | 0.08±0.03 | 3.54±0.28 | 303.33±21.16 | 304.27±21.42 |
| UC | 0.29±0.24* | 2.58±0.90* | 241.13±33.59** | 248.14±40.34* |
| E.faecium | 0.08±0.02# | 3.55±0.29# | 310.04±44.76# | 316.88±49.48# |
2.8. 各组大鼠肠道物种组成分析
根据Venn图谱分析发现,3组共有832种共有物种,其中正常对照组和UC组共有1031种,正常对照组和屎肠球菌组共有978种,UC组和屎肠球菌组共有893种;其中每组特有的物种有:正常对照组312种、UC组92种、屎肠球菌组181种(图 6A); 在门水平上,3组共有的优势菌门为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)(图 6B),结果显示,UC组中变形菌门丰度明显高于正常对照组,屎肠球菌干预后其丰度明显下降; 同时UC组中厚壁菌门和拟杆菌门丰度明显低于正常对照组,屎肠球菌干预后其丰度升高; 在科水平上,正常对照组中丰度大于1%的菌有11种,UC组中9种,屎肠球菌组中11种; Bar图(图 6C)结果显示,UC组中丰度最高的菌为Enterobacteriaceae,屎肠球菌组中丰度最高的为Muribaculaceae; 在属水平上,UC组中大肠埃希菌.志贺菌属(Escherichia-Shigella)和克雷伯氏菌属(Klebsiella)等条件致病菌的丰度明显升高,屎肠球菌干预后其丰度下降,尤其Escherichia-Shigella的丰度下降尤为明显(图 6D)。
图 6.
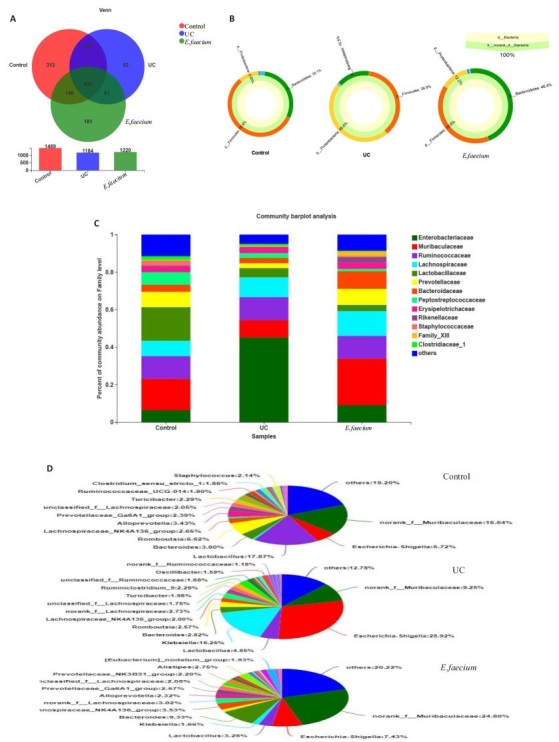
各组大鼠肠道菌群组成分析
Composition analysis of gut microbiota of rats in 3 groups (n=6). A: Venn diagram. B: Sunburst plot at phylum level. C: Bar plot at the family level. D: Pieplot at the genus level.
2.9. 与UC发生相关菌群在各组中的差异分析(属水平)
双歧杆菌(Bifidobacterium)和拟杆菌(Bacteroides)作为肠道中的优势菌,在营养和免疫调节中发挥关键作用[15],而阿克曼氏菌可产生短链脂肪酸,并且具有益生元效应[16]。本研究中,以上3种菌属丰度在UC组中均下降,而屎肠球菌QH06干预后丰度升高,其中双歧杆菌组间有统计学差异(P < 0.01)。Klebsiella的出现通常与癌症的发生有关[17],而Escherichia-Shigella是最典型的致病菌。本研究UC组大鼠中Klebsiella和Escherichia-Shigella丰度均明显升高,屎肠球菌干预后2者丰度明显下降,但在同组不同样本间的组内差异较大,最终导致组间无显著差异(图 7)。
图 7.
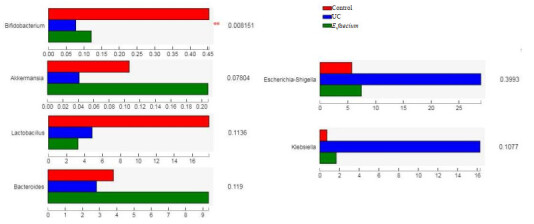
与UC发生相关菌属的差异分析
Analysis on the difference of bacteria correlated with UC occurrence (Genus level) (n=6).
2.10. 物种差异分析(科水平)
各组大鼠肠道菌群在科水平上进行组间差异检验,结果显示(图 8A),相对丰度前15的菌中,Enterobacteriaceae,Prevotellaceae,Peptostreptococcaceae,Rikenellaceae和Burkholderiaceae有组间差异; 进一步使用LEfSe分析软件对3组样本进行多级物种差异判别分析(LDA),找到与丰度有显著性差异的类群,本次分析中选择LDA阈值为4的物种。研究结果显示(图 8B),f__Peptostreptococcaceae, f__norank_o__Coriobacte-rialesc, Oxyphotobacteria和o__Micrococcales等菌在正常对照组中显著富集。o__Enterobacteriales,f__En-terobacteriaceae,c__Gammaproteobacteria在UC组中显著富集; p__Bacteroidetes,c__Bacteroidia,o__Bacte-roidales,f__Prevotellaceae,f__Shewanellaceae和o__Alteromonadales在屎肠球菌组中显著富集。
图 8.
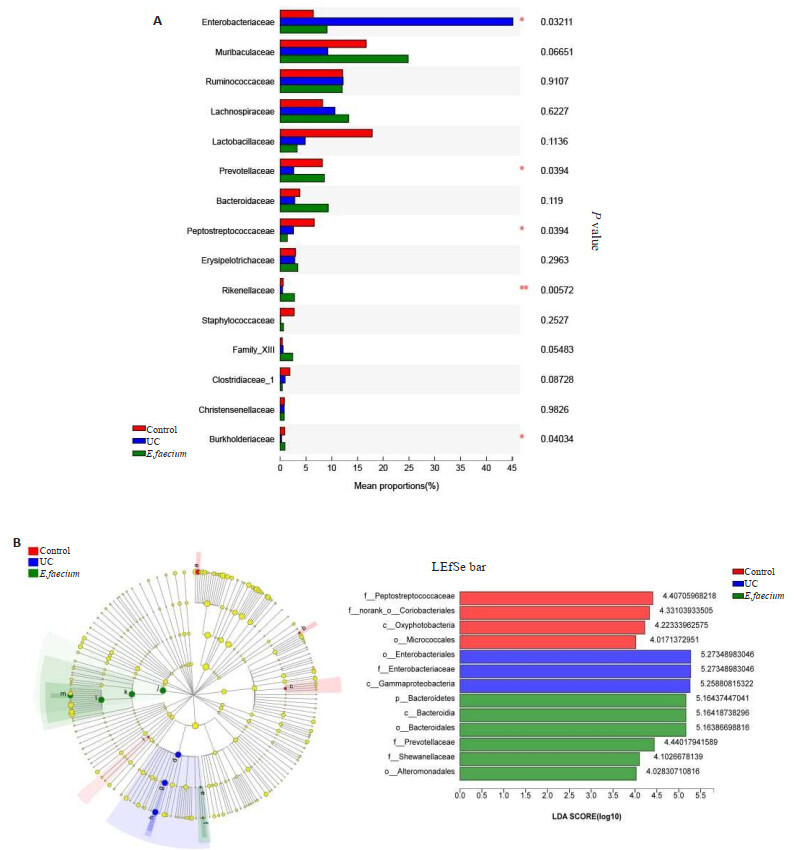
物种差异分析(科水平)
Species difference analysis (Family level). A: Analysis of the difference of intestinal microflora of rats in each group. Left: significant differences in the results of the comparison of bacteria; Right: the abundance of 15% of the comparison results; B: LEfSe analysis. The different color nodes in the left image represent the microbial groups that are significantly enriched in the corresponding groups and significantly influence the differences among groups. In contrast, the yellowish nodes show no significant difference among the groups or significantly affect the difference between groups. The image on the right shows LEfSe Bar. n=6.
2.11. 肠道菌群与炎症因子、TLR2相关性分析
通过Spearman相关系数分析各组大鼠肠道菌群与细胞因子、TLR2指标相关性。相关性结果显示(图 9),IFN-γ与Enterobacteriaceae呈正相关、而与Prevotellaceae、Desulfovibrionaceae、norank_o__Mollicutes_RF39、Clostridiales_vadinBB60_group呈负相关; 关; IL-10与Clostridiales_vadinBB60_group呈负相; IL-4和IL-12与Burkholderiaceae、Prevotellaceae呈负相关; TLR2与Clostridiales_vadinBB60_group、norank_o__Mollicutes_RF39和Prevotellaceae呈负相关。
图 9.
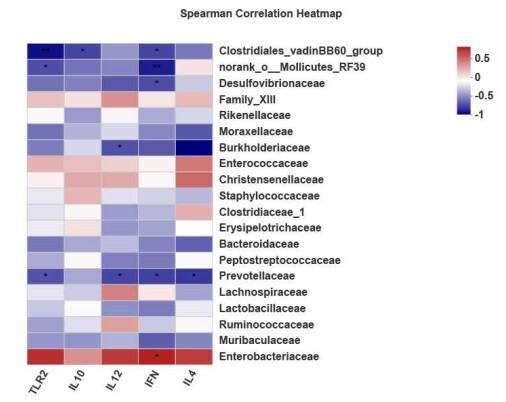
细胞因子、TLR2与肠道菌群相关性
Correlation Heatmap of cytokines, TLR2 and gut microbiota at the family level. The x-axis was cytokine and TLR2, and the y-axis was bacterium. The correlation R and P values were obtained by calculation. The R-value was shown in different colors, P-value: * 0.01 < P≤0.05, **0.001 < P≤0.01.
3. 讨论
UC发病过程中免疫系统的异常激活与肠道菌群失衡有关[2],因此除调节肠道免疫外,辅助应用益生菌、益生元和合生元等微生态调节剂调节肠道菌群失衡在UC的治疗中也尤为重要,其中益生菌通过调节宿主体内的肠道菌群、作用于肠道屏障、调节免疫等途径维持宿主肠道的健康[18]。大多数文献报道的益生菌属于乳酸菌属和双歧杆菌属[3, 19],而关于屎肠球菌作为益生菌的有效性的信息较少。本研究用屎肠球菌QH06干预TNBS/乙醇诱导的大鼠UC观察结肠组织中相关细胞因子、TLRs以及肠道菌群的变化。
IL-12和IFN-γ作为T细胞介质和UC相关的重要炎性细胞因子,可以诱导CD4+T细胞往Th1细胞的方向分化[20]。本研究发现,UC大鼠结肠组织中IL-12和IFN-γ的mRNA和蛋白表达水平均上调,说明UC组大鼠结肠组织中Th1细胞活化,释放IL-12和IFN-γ,使促炎因子释放量增多,加速UC的发生发展。CD4+T细胞可以被IL-4诱导分化为Th2细胞,Th2细胞分泌IL-4和IL-13介导体液免疫和超敏反应[21]。本研究发现UC组大鼠结肠组织中IL-4的mRNA和蛋白表达量均无显著变化,说明UC组大鼠结肠组织中促炎因子表达量高于抗炎因子,从而导致细胞因子平衡紊乱,促进UC的失衡性发展。益生菌具有调节肠道微生物群、抑制病原菌粘附、增强胃肠道屏障功能、诱导抗炎细胞因子和抑制促炎细胞因子等作用[22]。本研究中,屎肠球菌QH06干预后大鼠结肠组织中IL-12和IFN-γ等促炎因子的mRNA和蛋白表达量均降低,抗炎因子IL-4的蛋白表达量显著上调,说明屎肠球菌QH06具有抑制促炎因子的表达,促进抗炎因子表达的功能。
细胞因子间的平衡可能与TLRs有关,TLRs作为先天免疫的主要模式识别受体,能够识别各种病原体相关的分子,被认为是先天免疫和后天免疫之间的桥梁[23],当肠道菌群紊乱引起条件致病菌大量繁殖时,病原体识别表达于肠道黏膜多种细胞中的TLRs,通过TLRs介导的信号转导途径诱导相关基因的表达,触发和调节先天免疫并诱导获得性免疫,进而激活肠黏膜的炎症反应造成UC的病情发展[24]。因此肠道菌群、免疫和TLRs相关性研究有利于进一步阐明UC发生发展的分子机制。TLR2作为TLR家族的主要成员,识别与革兰氏阴性和革兰氏阳性细菌的病原相关分子模式,它的激活可能使固有单层的肠单核细胞转变为促炎性效应细胞[25]。研究报道显示,在DSS诱发的IBD小鼠在患病期间,TLR2明显上调,说明TLR2表达的变化和随后的先天免疫应答的改变是IBD发病的原因[26]。本研究结果显示,UC大鼠结肠组织中TLR2表达量明显上调,表达部位主要集中于黏膜层和黏膜下层,而屎肠球菌干预后UC大鼠结肠组织中TLR2表达量下调。研究报道显示[27],屎肠球菌干预后的健康狗结肠组织活检中TLR2和TNF-a的表达量减少,提示屎肠球菌对UC大鼠结肠组织黏膜损伤的修复作用可能与TLR2介导的信号通路的抑制有关。
肠道菌群紊乱是UC发生的主要原因已被大量的实验证明[3, 15]。目前的理论认为,肠道微生物组的改变会触发异常的黏膜免疫反应并导致慢性肠道炎性疾病的发展[28]。本研究通过高通量测序分析了屎肠球菌干预后的UC大鼠肠道菌群的变化。本研究Rank-abundance曲线和α多样性指数结果显示,UC组大鼠的肠道菌群多样性和丰富度下降,UC状态下大鼠肠道抵御环境变化的能力减弱,肠道菌群发生紊乱。屎肠球菌组Rank-abundance曲线和α多样性指数结果均明显高于UC组,屎肠球菌QH06干预后UC大鼠肠道菌群变得更为丰富,这有利于功能相近的物种及时代偿另一种功能缺陷的物种。
厚壁菌门会促进食物中的热量和各种营养元素的吸收。常驻胃肠道细菌拟杆菌负责维持黏膜稳态并为黏膜屏障提供保护,而变形菌门为UC组大鼠肠道中主要的优势菌[3, 29]。本研究中UC组大鼠结肠组织中厚壁菌门和拟杆菌门丰度明显下降,同时变形菌门丰度明显升高。UC组大鼠中厚壁菌、拟杆菌等优势菌的多样性及数量的减少和变形菌的增多可能给机会性微生物提供优势,引起侵略性免疫反应,导致UC的恶性发展。属水平研究结果显示,UC组大鼠中Klebsiella和Escherichia-Shigella等条件致病菌丰度明显升高,而双歧杆菌、阿克曼氏菌等益生菌或短链脂肪酸产生菌的丰度下降。在屎肠球菌QH06干预后,此趋势逆转, 说明屎肠球菌QH06对部分条件致病菌的生长具有抑制作用。科水平上进行的差异物种结果显示,肠杆菌科(Enterobacteriaceae),普氏菌科(Prevotellaceae),消化链球菌科(Peptostreptococcaceae),Rikenellaceae和Burkholderiaceae等物种3组间有差异。其中,UC组肠杆菌科丰度显著高于正常对照组,而肠杆菌科丰度与促炎因子IFN-γ表达量呈正相关。许多研究报道显示,在IBD患者中,潜在有害的变形菌门,特别是肠杆菌科的比例增加[30, 31],与本研究结果一致。本研究中与UC组相比,屎肠球菌干预后肠杆菌科丰度显著下降,而且正常对照组和屎肠球菌组间无显著差异。其说明屎肠球菌QH06通过抑制肠杆菌的生长影响IFN-γ的表达,抑制异常免疫炎症反应的放大,有利于溃疡的愈合。研究发现,在IBD患者中Rikenellaceae,Christensenellaceae,Ruminococcaceae和Tannerellaceae等丁酸产生菌的丰度减少,其与肠道炎症的发生和IBD的恶化有关[32-35]。本研究中,屎肠球菌QH06干预后肠杆菌科丰度下降的同时,为肠上皮提供能量的Rikenellaceae的丰度显著升高,说明屎肠球菌促进肠上皮细胞获得能量,对肠道营养吸收等功能的正常发挥至关重要,此可能为屎肠球菌组大鼠体重上升的原因之一。普氏菌科是一种短链脂肪酸(SCFA)产生菌,可维持肠道屏障的完整性和稳定性,促进胃肠道蠕动[36]。本研究中UC组普氏菌科丰度降低,而屎肠球菌干预后普氏菌科丰度升高,说明屎肠球菌QH06通过提高普氏菌科的丰度,促进SCFA的产生,给予肠上皮细胞提供能量,促进已被破坏的肠道屏障的愈合。Burkholderiaceae丰度在UC大鼠肠道中降低,此结果与结肠癌模型大鼠实验中所获得的结果一致[37]。本研究中屎肠球菌干预后Burkholderiaceae丰度恢复到正常水平,提示屎肠球菌可能促进Burkholderiaceae菌的生长。
研究报道显示,普氏菌主要激活TLR2,进而促进实验性结肠炎的Th1免疫应答[38],与本研究结果相反。本研究中普氏菌科丰度与TLR2,IFN-γ的表达呈负相关,提示UC大鼠肠道中普氏菌科丰度的降低,有利于TLR2的过表达,导致Th1细胞的过度分化,而促进IFN-γ等促炎因子的产生。而屎肠球菌通过促进普氏菌的产生,抑制TLR2过表达和IFN-γ的过量产生,有利于溃疡的愈合。然而,普氏菌科在炎症的产生过程中到底扮演什么样的角色需要进一步研究。
本次研究中屎肠球菌QH06对TNBS诱导的大鼠UC有一定的治疗效果,其对UC的干预作用机制可能与促炎细胞因子和TLR2蛋白表达的抑制有关。
Biography
库尔班乃木·卡合曼,学士,主管治疗师,E-mail: 381080450@qq.com
Funding Statement
国家自然科学基金(81760754)
Supported by National Natural Science Foundation of China (81760754)
Contributor Information
库尔班乃木·卡合曼 ( KUERBANNAIMU Kaheman), Email: 381080450@qq.com.
卡思木江·阿西木江 ( KASIMUJIANG Aximujiang), Email: Dinar0817@126.com.
References
- 1.Segal JP, LeBlanc JF, Hart AL. Ulcerative colitis: an update. Clin Med (Lond) 2021;21(2):135–9. doi: 10.7861/clinmed.2021-0080. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Kobayashi T, Siegmund B, le Berre C, et al. Ulcerative colitis. Nat Rev Dis Primers. 2020;6(1):74. doi: 10.1038/s41572-020-0205-x. [DOI] [PubMed] [Google Scholar]
- 3.Aximujiang K, Kaheman K, Wushouer X, et al. Lactobacillus acidophilus and HKL suspension alleviates ulcerative colitis in rats by regulating gut microbiota, suppressing TLR9, and promoting metabolism. Front Pharmacol. 2022;13:859628. doi: 10.3389/fphar.2022.859628. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Gao W, Howden BP, Stinear TP. Evolution of virulence in Enterococcus faecium, a hospital-adapted opportunistic pathogen. Curr Opin Microbiol. 2018;41:76–82. doi: 10.1016/j.mib.2017.11.030. [DOI] [PubMed] [Google Scholar]
- 5.Choeisoongnern T, Sirilun S, Waditee-Sirisattha R, et al. Potential probiotic Enterococcus faecium OV3- 6 and its bioactive peptide as alternative bio-preservation. Foods. 2021;10(10):2264. doi: 10.3390/foods10102264. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Celiberto LS, Bedani R, Dejani NN, et al. Effect of a probiotic beverage consumption (Enterococcus faecium CRL 183 and Bifidobacterium longum ATCC 15707) in rats with chemically induced colitis. PLoS One. 2017;12(4):e0175935. doi: 10.1371/journal.pone.0175935. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Sohail G, Xu XY, Christman MC, et al. Probiotic Medilac-S® for the induction of clinical remission in a Chinese population with ulcerative colitis: a systematic review and meta-analysis. World J Clin Cases. 2018;6(15):961–84. doi: 10.12998/wjcc.v6.i15.961. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Huang LQ, Luo LP, Zhang YR, et al. Effects of the dietary probiotic, Enterococcus faecium NCIMB11181, on the intestinal barrier and system immune status in Escherichia coli O78-challenged broiler chickens. Probiotics Antimicrob Proteins. 2019;11(3):946–56. doi: 10.1007/s12602-018-9434-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.蔺方瑞. 屎肠球菌BZ2所产抑菌物质的特性研究[D]. 呼和浩特: 内蒙古农业大学, 2017.
- 10.Roselli M, Finamore A, Britti MS, et al. The novel porcine Lactobacillus sobrius strain protects intestinal cells from enterotoxigenic Escherichia coli K88 infection and prevents membrane barrier damage. Nutr. 2007;137(12):2709–16. doi: 10.1093/jn/137.12.2709. [DOI] [PubMed] [Google Scholar]
- 11.Mishima Y, Oka A, Liu B, et al. Microbiota maintain colonic homeostasis by activating TLR2/MyD88/PI3K signaling in IL-10-producing regulatory B cells. Clin Invest. 2019;129(9):3702–16. doi: 10.1172/JCI93820. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Zhang JP, Huang JJ, Aximujiang K, et al. Thyroid dysfunction, neurological disorder and immunosuppression as the consequences of long-term combined stress. Sci Rep. 2018;8(1):4552. doi: 10.1038/s41598-018-19564-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Li QL, Shan QY, Sang XN, et al. Total glycosides of peony protects against inflammatory bowel disease by regulating IL-23/IL-17 axis and Th17/treg balance. Am J Chin Med. 2019;47(1):177–201. doi: 10.1142/S0192415X19500095. [DOI] [PubMed] [Google Scholar]
- 14.Long Y, Li SX, Qin JC, et al. Kuijieling regulates the differentiation of Treg and Th17 cells to ameliorate experimental colitis in rats. Biomed Pharmacother. 2018;105:781–8. doi: 10.1016/j.biopha.2018.06.011. [DOI] [PubMed] [Google Scholar]
- 15.Shen ZH, Zhu CX, Quan YS, et al. Relationship between intestinal microbiota and ulcerative colitis: mechanisms and clinical application of probiotics and fecal microbiota transplantation. World J Gastroenterol. 2018;24(1):5–14. doi: 10.3748/wjg.v24.i1.5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Kaulmann A, Bohn T. Bioactivity of polyphenols: preventive and adjuvant strategies toward reducing inflammatory bowel diseases-promises, perspectives, and pitfalls. Oxid Med Cell Longev. 2016:9346470. doi: 10.1155/2016/9346470. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Chetcuti Zammit S, Azzopardi N, Sant J. Mortality risk score for Klebsiella pneumoniae bacteraemia. Intern Med. 2014;25(6):571–6. doi: 10.1016/j.ejim.2014.04.008. [DOI] [PubMed] [Google Scholar]
- 18.刘 晨晨, 张 振玉. 益生菌对结直肠癌的防治作用及机制. 胃肠病学和肝病学杂志. 2015;24(7):769–72. [Google Scholar]
- 19.Le B, Yang SH. Efficacy of Lactobacillus plantarum in prevention of inflammatory bowel disease. Toxicol Rep. 2018;5:314–7. doi: 10.1016/j.toxrep.2018.02.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Butcher MJ, Zhu JF. Recent advances in understanding the Th1/Th2 effector choice. Fac Rev. 2021;10:30. doi: 10.12703/r/10-30. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Zhang Y, Zhang YG, Gu WP, et al. Th1/Th2 cell's function in immune system. Adv Exp Med Biol. 2014;841:45–65. doi: 10.1007/978-94-017-9487-9_3. [DOI] [PubMed] [Google Scholar]
- 22.Davoodvandi A, Marzban H, Goleij P, et al. Effects of therapeutic probiotics on modulation of microRNAs. Cell Commun Signal. 2021;19(1):4. doi: 10.1186/s12964-020-00668-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Seumen CHT, Grimm TM, Hauck CR. Protein phosphatases in TLR signaling. Cell Commun Signal. 2021;19(1):45. doi: 10.1186/s12964-021-00722-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Autenrieth DM, Baumgart DC. Microbiome and Gut Inflammtion. Dtsch Med Wochenschr. 2017;142(4):261–6. doi: 10.1055/s-0042-111608. [DOI] [PubMed] [Google Scholar]
- 25.Shmuel-Galia L, Aychek T, Fink A, et al. Neutralization of pro-inflammatory monocytes by targeting TLR2 dimerization ameliorates colitis. EMBO. 2016;35(6):685–98. doi: 10.15252/embj.201592649. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Brun P, Giron MC, Qesari M, et al. Toll-like receptor 2 regulates intestinal inflammation by controlling integrity of the enteric nervous system. Gastroenterology. 2013;145(6):1323–33. doi: 10.1053/j.gastro.2013.08.047. [DOI] [PubMed] [Google Scholar]
- 27.Schmitz S, Henrich M, Neiger R, et al. Stimulation of duodenal biopsies and whole blood from dogs with food-responsive chronic enteropathy and healthy dogs with Toll-like receptor ligands and probiotic Enterococcus faecium. Scand J Immunol. 2014;80(2):85–94. doi: 10.1111/sji.12186. [DOI] [PubMed] [Google Scholar]
- 28.Lane ER, Zisman TL, Suskind DL. The microbiota in inflammatory bowel disease: current and therapeutic insights. Inflamm Res. 2017;10:63–73. doi: 10.2147/JIR.S116088. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Zhang M, Sun KJ, Wu YJ, et al. Interactions between intestinal microbiota and host immune response in inflammatory bowel disease. Front Immunol. 2017;8:942. doi: 10.3389/fimmu.2017.00942. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Lavelle A, Lennon G, O'Sullivan O, et al. Spatial variation of the colonic microbiota in patients with ulcerative colitis and control volunteers. Gut. 2015;64(10):1553–61. doi: 10.1136/gutjnl-2014-307873. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Baldelli V, Scaldaferri F, Putignani L, et al. The role of Enterobacteriaceae in gut microbiota dysbiosis in inflammatory bowel diseases. Microorganisms. 2021;9(4):697. doi: 10.3390/microorganisms9040697. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Parada Venegas D, de la Fuente MK, Landskron G, et al. Short chain fatty acids (SCFAs)-mediated gut epithelial and immune regulation and its relevance for inflammatory bowel diseases. Front Immunol. 2019;10:277. doi: 10.3389/fimmu.2019.00277. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Waters JL, Ley RE. The human gut bacteria Christensenellaceae are widespread, heritable, and associated with health. BMC Biol. 2019;17(1):83. doi: 10.1186/s12915-019-0699-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Lo Presti A, Zorzi F, del Chierico F, et al. Fecal and mucosal microbiota profiling in irritable bowel syndrome and inflammatory bowel disease. Front Microbiol. 2019;10:1655. doi: 10.3389/fmicb.2019.01655. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Alam MT, Amos GCA, Murphy ARJ, et al. Microbial imbalance in inflammatory bowel disease patients at different taxonomic levels. Gut Pathog. 2020;12:1. doi: 10.1186/s13099-019-0341-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Larsen JM. The immune response to Prevotella bacteria in chronic inflammatory disease. Immunology. 2017;151(4):363–74. doi: 10.1111/imm.12760. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Ma FL, Song YL, Sun MY, et al. Exopolysaccharide produced by lactiplantibacillus plantarum-12 alleviates intestinal inflammation and colon cancer symptoms by modulating the gut microbiome and metabolites of C57BL/6 mice treated by azoxymethane/dextran sulfate sodium salt. Foods. 2021;10(12):3060. doi: 10.3390/foods10123060. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Zhang HS, DiBaise JK, Zuccolo A, et al. Human gut microbiota in obesity and after gastric bypass. Proc Natl Acad Sci USA. 2009;106(7):2365–70. doi: 10.1073/pnas.0812600106. [DOI] [PMC free article] [PubMed] [Google Scholar]


