Abstract
Das sich entwickelnde Gehirn ist in der Perinatalperiode besonders empfindlich für eine Vielzahl von Insulten, wie z. B. Extremfrühgeburtlichkeit und perinatale Asphyxie. Ihre Komplikationen können zu lebenslangen neurokognitiven, sensorischen und psychosozialen Einschränkungen führen; deren Vorhersage bleibt eine Herausforderung. Eine Schlüsselfunktion kommt der möglichst exakten Identifikation von Hirnläsionen und funktionellen Störungen zu. Die Prädiktion stützt sich auf frühe diagnostische Verfahren und die klinische Erfassung der Meilensteine der Entwicklung. Zur klinischen Diagnostik und zum Neuromonitoring in der Neonatal- und frühen Säuglingsperiode stehen bildgebende Verfahren zur Verfügung. Hierzu zählen zerebrale Sonographie, MRT am errechneten Termin, amplitudenintegriertes (a)EEG und/oder klassisches EEG, Nah-Infrarot-Spektroskopie, General Movements Assessment und die frühe klinische Nachuntersuchung z. B. mithilfe der Hammersmith Neonatal/Infant Neurological Examination. Innovative Biomarker und -muster (Omics) sowie (epi)genetische Prädispositionen sind Gegenstand wissenschaftlicher Untersuchungen. Neben der Erfassung klinischer Risiken kommt psychosozialen Faktoren im Umfeld des Kindes eine entscheidende Rolle zu. Eine möglichst akkurate Prognose ist mit hohem Aufwand verbunden, jedoch zur gezielten Beratung der Familien und der Einleitung von frühen Interventionen, insbesondere vor dem Hintergrund der hohen Plastizität des sich entwickelnden Gehirns, von großer Bedeutung. Diese Übersichtsarbeit fokussiert die Charakterisierung der oben genannten Verfahren und ihrer Kombinationsmöglichkeiten. Zudem wird ein Ausblick gegeben, wie innovative Techniken in Zukunft die Prädiktion der Entwicklung und Nachsorge dieser Kinder vereinfachen können.
Schlüsselwörter: Biomarker, Entwicklung nach Frühgeburtlichkeit, Prognose
Abstract
In the perinatal period the developing brain is extremely vulnerable for a variety of insults. Perinatal conditions, such as extreme prematurity, perinatal asphyxia, and their complications can lead to lifelong sensorimotor, cognitive and behavioral impairment. Prediction of long-term neurodevelopment of preterm and ill term infants at risk for brain injury at an early stage remains a big challenge. Identification of brain lesions and disturbed function is essential for an accurate diagnosis. Currently, the prediction of the outcome is based on a variety of diagnostic tools and clinical assessment of developmental milestones. Several methods for early diagnosis and neuromonitoring of brain injury are available, such as cerebral ultrasound, magnetic resonance imaging (MRI) at term-equivalent age as well as neuromonitoring tools, such as amplitude-integrated electroencephalography (aEEG) and/or conventional EEG and near-infrared spectroscopy (NIRS), general movements assessment (GMA) and clinical assessment by, e.g., the Hammersmith neonatal/infant neurological examination (HNNE/HINE), all of which require substantial personnel and also technical resources. As better biomarkers are urgently needed scientific investigations currently focus on identification of innovative biomarker patterns (omics) and (epi)genetic markers. Furthermore, the individual child’s development is determined not only by clinical risk factors, such as associated diseases but also by the socioeconomic environment. Estimation of the most accurate and early prognosis is cost-intensive, but crucial to adequately guide patients and counsel families. The initiation of early interventions is important as the plasticity of the developing brain is highest around birth and in the first few months of life. This review focuses on the characterization of the abovementioned diagnostic tools and the possibilities for combination for outcome prognosis. In addition, an outlook is given on how new technologies can facilitate the prediction of development and follow-up care of these children following perinatal brain injury.
Keywords: Biomarker, Development after prematurity, Prognosis
Einleitung
Durch große Fortschritte in der perinatalen Versorgung überleben mehr Kinder, insbesondere extrem Frühgeborene (FG) an der Grenze der Lebensfähigkeit [7]. Trotz enormer Anstrengungen, das unreife Gehirn zu schützen, persistieren neurologische Einschränkungen wie z. B. Zerebralparese (CP), Epilepsien, sensorische Störungen, kognitive Einschränkungen und Verhaltensauffälligkeiten [83]. Darüber hinaus gibt es weitere perinatale Hirnschädigungen, deren Ursachen oft unklar bleiben. Dazu zählen die Asphyxie, schwere Infektionen und Inflammation, arteriell-ischämische Schlaganfälle, Sinusvenenthrombosen, periventrikuläre venöse Infarkte, Hirnschädigungen durch Hypoglykämie und intrazerebrale Blutungen mit Komplikationen wie posthämorrhagische Ventrikelerweiterung oder Shunt-pflichtiger Hydrozephalus [33, 84, 88]. Für die Mehrzahl dieser Erkrankungen gibt es bisher keine kausale Therapie, daher stehen nur präventive und supportive Maßnahmen zur Verfügung. Bei FG sind dies z. B. die antenatale maternale Steroidgabe, verzögertes Abnabeln, Vermeidung von Blutdruckschwankungen und „minimal handling“, bei Reifgeborenen nach Asphyxie oder Schlaganfall z. B. die gezielte Behandlung (subklinischer) zerebraler Anfälle.
Die therapeutische Hypothermie (TH) ist die einzige Maßnahme, die als Standardtherapie der moderaten und schweren hypoxisch-ischämischen Enzephalopathie (HIE) eingesetzt wird. Trotz TH leiden Patienten mit moderater und schwerer HIE an neurologischen Langzeitfolgen (16–30 %), was die Suche nach additiven Therapiestrategien notwendig macht. Auch die Frage nach TH für leichtere Verläufe (HIE I) bleibt zu klären, da auch diese Kinder an Spätfolgen leiden [104].
Multiple Mechanismen (Hypoxie, Ischämie, Inflammation, Infektion, Hyperoxie, Exzitotoxizität, oxidativer Stress) sind in die Pathogenese der Hirnschädigung involviert [73, 97]. Antenatale Faktoren (z. B. maternale Inflammation, intrauterine Wachstumsretardierung) beeinflussen die Vulnerabilität des sich entwickelnden Gehirns. Die Ausprägung des Schadens hängt maßgeblich vom Grad der Hirnreife, der Schadensursache und dem genetischen Hintergrund ab [52]. Einige Arbeiten konnten zeigen, dass die individuelle Immunantwort und das Geschlecht wesentliche Einflussfaktoren sind [6, 44, 52]. Auch Reifungsprozesse der weißen Substanz unterscheiden sich signifikant zwischen den Geschlechtern [81].
Unterschiedliche molekulare Mechanismen, die die Langzeitentwicklung maßgeblich beeinflussen, charakterisieren jede Schadensphase bis hin zur Regeneration [8]. Vor dem Hintergrund der hohen Plastizität und Fähigkeit zur Regeneration des sich entwickelnden Gehirns ist eine Identifikation der Risikokinder notwendig. Nur so können gezielt frühe Interventionen zur Förderung der Entwicklung eingeleitet werden [89]. Auch zur Planung von Studien bezüglich innovativer neuroprotektiver Strategien ist die genaue Charakterisierung des Schadens notwendig [9].
Um die betroffenen Patienten korrekt zu identifizieren und unnötige elterliche Ängste zu vermeiden, ist die Frage nach einer frühen Vorhersage der neurologischen Langzeitentwicklung von größter Bedeutung, bleibt aber eine Herausforderung. Präzise Informationen zu klinischem Hintergrund, Komplikationen, Schwere der Symptomatik sowie Typ und Lokalisation der Hirnschädigung müssen zusammengetragen werden. Darüber hinaus kommt der Erfassung von psychosozialen Faktoren (sozioökonomischer Status der Eltern, Bildungsniveau, elterliche Belastung, Erziehungsverhalten, Sprachbarrieren) eine große Bedeutung zu [10].
Eine Schlüsselfunktion hat die Identifikation von Hirnläsionen und funktionellen Störungen. Zur klinischen Diagnostik in der Neonatal- und frühen Säuglingsperiode stehen im Wesentlichen bildgebende Verfahren, insbesondere Sonographie, Magnetresonanztomographie (MRT) am errechneten Termin (ET), Neuromonitoring, wie z. B. das amplitudenintegrierte (a)EEG und/oder das klassische EEG, Nah-Infrarot-Spektroskopie (NIRS), General Movements Assessment (GMA) sowie die frühe klinische Untersuchung mithilfe der Hammersmith Neonatal/Infant Neurological Examination (HNNE/HINE) zur Verfügung. Allen genannten Verfahren gemeinsam ist der hohe personelle und technische Aufwand. Daher sind diese Voraussetzungen nur in wenigen Zentren mit spezifischer Neuromonitoring-Expertise gegeben [4]. Gegenstand wissenschaftlicher Untersuchungen ist die Identifikation innovativer Biomarkermuster (Omics) und (epi)genetischer Prädispositionen.
Diese Übersichtsarbeit fokussiert die Aussagekraft der genannten Verfahren und deren Kombinationsmöglichkeiten. Zudem wird ein Ausblick gegeben, wie innovative Verfahren die Prädiktion der Entwicklungsprognose dieser Kinder vereinfachen können.
General Movements Assessment
Das GMA beurteilt die Spontanmotorik von Früh- und Neugeborenen und dient der frühen Identifikation von neurologischen Funktionseinschränkungen, wie einer CP oder anderen motorisch-kognitiven Dysfunktionen [28, 68]. Diese sensitive, nichtinvasive und kostengünstige Untersuchung erlaubt eine verlässliche Evaluation des sich entwickelnden Nervensystems bereits vor dem ET bis zum Alter von 5 Monaten [30]. Die Variabilität der Bewegungen ist ein zentraler Marker für ein funktionell intaktes Gehirn. Ausgehend vom Hirnstamm werden schon beim Fetus Bewegungen initiiert und durch weitere Hirnareale in ihrer Variabilität moduliert [28, 29]. Reduzierte Variabilität bis hin zur Monotonie charakterisieren funktionelle Störungen mit langfristigen Konsequenzen [30, 78].
Die Variabilität der Bewegungen ist ein zentraler Marker für ein funktionell intaktes Gehirn
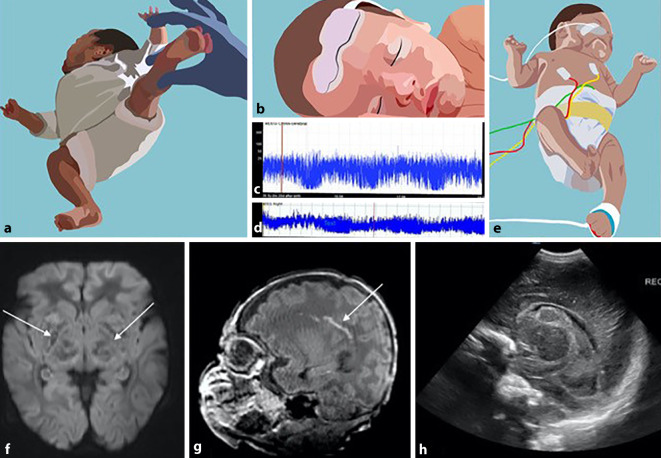
Als pathologische Bewegungsmuster werden „cramped-synchronized“ (CS) vor dem ET sowie die Abwesenheit von „fidgety movements“ (FM) im Alter von 3 bis 5 Monaten angesehen [27]. Die CS general movements sind spontane Muster mit steif-rigider und synchroner Bewegungsstruktur in Rumpf und Extremitäten (Abb. 1e). Die FM sind wechselnde, harmonisch-fließende Bewegungssequenzen von kleiner Amplitude in variablen und komplexen Bewegungssequenzen. Sie sind prädiktiv für das Auftreten eines CP general movement, wobei fehlende oder pathologische FM den besten Marker mit einer Sensitivität von 98 % und einer Spezifität von 95 % darstellen [57]. Die Bewertungen des motorischen Repertoires (Antigravitationsbewegungen, Haltungsmuster) und der Bewegungsqualität in der Bestimmung des revidierten Motor Optimality Score (MOS-R) erlaubten Aussagen zu Schweregrad und Art der CP [27]. Der maximale Score beträgt 28, der minimale 5. Scores zwischen 25 und 28 werden als optimal und Scores < 25 als reduziert angesehen [27]. Das Level im Gross Motor Function Classification System (GMFCS) korreliert mit dem MOS-R: Scores > 14 sind mit leichteren Beeinträchtigungen (GMFCS-Level I und II), MOS-R < 8 mit schweren Dysfunktionen assoziiert (GMSFCS-Level IV und V). Asymmetrische segmentale Bewegungen werden mit unilateraler CP und zirkuläre Armbewegungen mit dyskinetischer CP in Verbindung gebracht [27].
Im Alltag ist die Beobachtung der Spontanbewegungen durch einen qualifizierten Untersucher ausreichend. Bewährt hat sich die Videoaufzeichnung der Bewegungsmuster, insbesondere dann, wenn der MOS‑R erhoben werden soll. Die Limitation ist in der Personalintensität der Methode zu sehen. Sequenzielle Videoaufzeichnungen und die Erhebung des MOS‑R sind sehr zeitaufwendig.
Die Entwicklung automatisierter Verfahren zur Videoanalyse wird vorangetrieben. Trotz ihrer Leistungen können sie jedoch nur einen Bruchteil der Aufgaben bewältigen (z. B. einige binäre oder multiple Klassifikationen), die ein qualifizierter menschlicher Untersucher in wenigen Minuten löst (z. B. gleichzeitige Bewertung der Bewegungsmerkmale, Komplexität, Variabilität, altersspezifisches Repertoire, Körperhaltung und motorische Optimalität). Der komplette Ersatz menschlicher Untersucher durch vollautomatisierte Systeme ist daher in naher Zukunft unwahrscheinlich [86].
Hammersmith Neonatal/Infant Neurological Examination
Die HNNE/HINE ist eine einfache und gut etablierte Untersuchung von der Neugeborenenphase bis zum Ende des 2. Lebensmonats (HNNE) bzw. von 2 bis 24 Monaten (HINE), die sich als standardisiertes Verfahren für den klinischen Alltag sowie für Forschungszwecke eignet [74]. Die Durchführung dauert 5–15 min. Der HINE ist in folgende 3 Abschnitte unterteilt:
neurologische Untersuchung mit 26 Items (Hirnnerven, Körperhaltung, Bewegungen, Tonus, Reflexe und Asymmetrien; Abb. 1a). Jedes Item wird mit 0 bis 3 Punkten bewertet (Optimalitätsscore: max. 78 Punkte),
Grenzsteine der motorischen Entwicklung (8 Items),
Verhaltensstatus (3 Items).
Zur Beurteilung einer altersentsprechenden Entwicklung wird der Score an das korrigierte Alter bei Untersuchung und das Gestationsalter bei der Geburt adaptiert. Neben hilfreichen Cut-off-Scores zur Vorhersage einer CP wurden kürzlich Perzentilen für das Alter zwischen 3 und 7 Monaten vorgestellt [60, 68, 74]. Die HINE kann im Alter von 5 Monaten mit einer Sensitivität > 90 % eine CP vorhersehen [68]. Um Kinder mit einem Risiko für kognitive Entwicklungsverzögerungen zu identifizieren, können Cut-off-Scores von 58 mit 3, 64 mit 6 und 69 mit 12 korrigierten Monaten verwendet werden; diese zeigten eine ansteigende Korrelation in der Detektion einer Entwicklungsverzögerung im Mental Development Index der Bayley Scales of Infant Development (BSID) II im Alter von 24 Monaten [75, 76].
Die große Varianz der Punktwerte in HNNE/HINE erschwert die Diagnosestellung
Für die individuelle Prognose ist jedoch Vorsicht geboten, da eine große Varianz der Punktwerte die Diagnosestellung erschwert. Daher sollten diese Cut-off-Scores nicht isoliert angewendet werden. Die Kombination verschiedener Untersuchungsmodalitäten wie des frühen GMA, der zerebralen Bildgebung (MRT) und der HINE erhöht die Vorhersagekraft mit einer Sensitivität für den Nachweis einer CP > 97 % und einer Spezifität > 97 % [65].
Zerebraler Ultraschall
Der zerebrale Ultraschall (cUS) ist in der klinischen Routinediagnostik der Neonatologie nicht mehr wegzudenken. Er kann kostengünstig, jederzeit, patientennah und nichtinvasiv eingesetzt werden. Gerade die frühe und serielle bildgebende Untersuchung gibt im Alltag wertvolle Informationen sowohl zu Entstehung, Lokalisation und zeitlicher Entwicklung von größeren strukturellen Hirnläsionen, wie Ischämien und zerebrale Hämorrhagien, als auch zu Reifungsverzögerungen (Abb. 1h). Auch bei Hirnödem nach Asphyxie und zum Monitoring der posthämorrhagischen Ventrikelerweiterung und des Hydrozephalus ist er unverzichtbar. Bei größeren Läsionen hat der cUS einen hohen Stellenwert hinsichtlich der prognostischen Aussagekraft. Bei FG lässt sich die zystische periventrikuläre Leukomalazie (cPVL) des Marklagers sehr gut diagnostizieren [45]. Hingegen sind die herkömmlichen Techniken für die Detektion kleinerer Läsionen, z. B. der weitaus häufigeren diffusen Schädigung der weißen Substanz, nicht gut geeignet, und die MRT am ET ist (s. unten) zu bevorzugen.
Kleine FG sollten standardisiert nach einem festen cUS-Schema wiederholt untersucht werden, in der ersten Lebenswoche häufiger, dann in 14-tägigen bis monatlichen Abständen [105]. Auch bei akuten Insulten wie dem neonatalen Schlaganfall oder der HIE sind serielle cUS wichtig, um die Entwicklung der Schädigung zu beurteilen bzw. Hirndruck zu diagnostizieren. Zusätzliche metrische Bestimmungen von Hirnstrukturen erlauben die Beurteilung der Hirnreife [90, 109].
Kleine FG sollten standardisiert nach einem festen cUS-Schema wiederholt untersucht werden
Der cUS ist sehr stark vom Trainingsstand der Untersuchenden und der Leistungsfähigkeit des Gerätes abhängig und bietet einen räumlich limitierten Einblick in das unreife Gehirn. Die Wahl zusätzlicher Schallfenster, wie der posterioren Seitenfontanelle, erlaubt dem Geübten die Beurteilung des Kleinhirns und die Identifikation von Entwicklungsrisiken, da Kinder mit Kleinhirnläsionen ein schlechteres neurologisches Outcome zeigen [12].
Durch den gezielten Einsatz von Schallköpfen mit höherer Frequenz lässt sich die diagnostische Aussagekraft erhöhen [24]. Die Doppler-cUS erlaubt Aussagen zur intrazerebralen Perfusion und wird zur Diagnostik von arteriellen und venösen Ischämien in der Neonatalperiode eingesetzt [72, 88].
Neuere technische Entwicklungen werden Möglichkeiten eröffnen, Konnektivität sowie Schadens- und Reifungsprozesse besser darzustellen. Dazu zählen beispielsweise die Ultrafast-Doppler-cUS, der kontrastverstärkte und der funktionelle cUS [5, 21, 61]. Bis zur klinischen Implementierung dieser Techniken sollte bei Risikokindern der serielle cUS komplementär zur MRT eingesetzt werden; Letztere erlaubt eine deutlich bessere Beurteilung von strukturellen Veränderungen des Großhirns und des Zerebellums.
Magnetresonanztomographie
Der Einsatz der MRT hat zu einer grundlegenden Verbesserung des Verständnisses der physiologischen Hirnreifungsprozesse, aber auch der strukturellen Ursachen von Entwicklungsstörungen geführt. Mit standardisierten Techniken (T1-, T2-gewichtete Sequenzen) lassen sich anatomische Auffälligkeiten, aber auch neonatale Hirnläsionen exzellent darstellen. Für Neonaten wurden spezifische Protokolle entwickelt, die Bewegungen, geringem Hirnvolumen, veränderter Weichteilkontrastgebung und höherem Wassergehalt des unreifen Gehirns Rechnung tragen [23].
Lokalisation der Schädigungsmuster erlaubt Rückschlüsse auf motorische und kognitive Entwicklung
Nach HIE und HT stellt die MRT an den Tagen 5 bis 9 die Methode der Wahl zur Beschreibung des Ausmaßes der Schädigung dar (Abb. 1f). Zu diesem Zeitpunkt sind die meisten Kinder nicht mehr beatmet und können unter Spontanschlaf nach der Fütterung oder unter milder Sedierung problemlos untersucht werden [77, 87]. Anhand der Lokalisation der typischen Schädigungsmuster (Basalganglien, subkortikales Marklager, Kleinhirn etc.) lassen sich verschiedene Schweregrade einteilen sowie Rückschlüsse auf die motorische und spätere kognitive Entwicklung der Kinder ziehen [62]. Insbesondere das Ausmaß der subkortikalen Marklagerschädigung korreliert mit späteren intellektuellen Fähigkeiten [70]. Die Kombination mit zusätzlichen klinischen Biomarkern, wie z. B. der Protonen(1H)-Magnetresonanzspektroskopie oder dem aEEG, erlaubt darüber hinaus weitaus genauere Prognosen [64, 96]. Dies ist für die Planung von therapeutischen Interventionen und die Beratung der betroffenen Familien von großer Bedeutung.
Frühere MRT-Untersuchungen, vor dem 5. Lebenstag, können bei schwerer HIE für klinische Entscheidungen zur Therapiebegrenzung sein hilfreich. Jedoch ist dies bei beatmeten Kindern nicht an allen Zentren möglich, da ein MRT-kompatibles Monitoring benötigt wird [1].
In der initialen Diagnostik des neonatalen arteriell-ischämischen Schlaganfalls, der Sinusvenenthrombose [88], von neonatalen Infektionen und Hirnfehlbildungen ist die MRT nicht mehr wegzudenken. Darüber hinaus ist sie aufgrund der besseren Darstellung von strukturellen Auffälligkeiten ein wertvolles Instrument in der klinischen Routinediagnostik unklarer neurologischer Symptome beim Neonaten, wie z. B. zerebralen Krampfanfällen.
Bei FG ist die konventionelle MRT-Untersuchung am ET der zerebralen Ultraschalluntersuchung in der Routine überlegen. Die MRI detektiert z. B. punktförmige Läsionen im Centrum semiovale und der Corona radiata der weißen Substanz als Ausdruck einer diffusen Schädigung der weißen Substanz (Abb. 1g); diese sich lassen im cUS nicht darstellen . Sie lassen sich nach Zahl, Größe und Lokalisation in unterschiedliche Schweregrade einteilen. Oft gehen sie mit reduzierten Hirnvolumina einher (z. B. Thalamus) und sind in höherer Zahl und abhängig von der Lokalisation prognostisch ungünstig für die motorische und neurokognitive Entwicklung [100]. Auch zerebelläre Läsionen wie z. B. Blutungen lassen sich mit der MRT, insbesondere mit Einsatz der „Susceptibility-weighted-imaging“(SWI)-Sequenz, signifikant besser detektieren als mit dem cUS. Sie sind für die motorische Entwicklung im korrigierten Alter von 14 Monaten prognostisch ungünstig [12, 25]. Eine Studie an 221 FG zeigte, dass die Größe und Lokalisation von zerebellären Blutungen signifikant mit reduzierten motorischen und visomotorischen Fähigkeiten sowie mit externalisierten Verhaltensauffälligkeiten im Vorschulalter korreliert [34]. Es konnte belegt werden, dass sich reduzierte Hirnvolumina negativ auf die Entwicklung auswirken.
In den letzten Jahren wurde eine Reihe von Scoring-Systemen entwickelt, die jedoch für die Anwendung in der täglichen Routine sehr aufwendig sind [54, 92, 107]. Daher gilt es, an großen Kohorten einfache Scores zu entwickeln, die in kurzer Zeit Aussagen zum Hirnvolumen und zu relevanten Schädigungsmustern zulassen [3]. Mit einem solchen einfachen System ließen sich z. B. prognostische Aussagen zu motorischer und kognitiver Entwicklung bei 103 FG nach einer Hirnblutung (Grade II–IV/hämorrhagischer Infarkt) , die im Alter von 2 bis 3 Jahren nachuntersucht wurden, treffen [38, 47].
Insbesondere für Kohorten mit wenigen strukturellen Auffälligkeiten ist jedoch die prognostische Aussagekraft der MRT am ET eher gering, wie an einer Kohorte von 129 Kindern < 32 Schwangerschaftswochen deutlich gemacht werden konnte [22].
Zusätzliche MRT-Sequenzen werden nicht in der Routine eingesetzt und sind ggf. nur wissenschaftlichen Studien vorbehalten. Sie können aber bei bestimmten Fragestellungen relevant sein: Vorhandensein von Hämosiderinablagerungen (SWI), mikrostrukturelle Integrität des Gehirns („diffusion tensor imaging“, DTI), akute ischämische Läsionen (Diffusionsgewichtung), zerebrale Gefäßdarstellung (MR-Angiographie), Perfusion des Gehirns („arterial spin labeling“) und auch funktionelle MR-Untersuchungen („resting-state functional magnetic resonance imaging“). Quantitative Analysen erlauben Aussagen zu Hirnvolumina, mikrostruktureller Integrität und kortikaler Entwicklung. Quantitative MRT-Analysen, insbesondere von DTI-Sequenzen konnten eine Assoziation von mikrostukturellen Auffälligkeiten und veränderter neuronaler Konnektivität („brain connectome“) mit der späteren neurologischen Entwicklung feststellen. Innovative digitale Technologien zur Auswertung können wertvolle Informationen zu strukturellen Auffälligkeiten, mikrostruktureller Integrität, intrazerebralen neuronalen Verbindungen und Funktion liefern [23, 31, 37].
Amplitudenintegriertes Elektroenzephalogramm
Einsatz und Interpretation des konventionellen EEG erfordern die technischen und zeitlichen Voraussetzungen sowie die Expertise zur Befundung [71]. Daher wird seit vielen Jahren in der Neonatologie eine zeitlich komprimierte, kontinuierliche Ableitung, das aEEG, eingesetzt; dieses sollte aber das konventionelle EEG bei Auffälligkeiten nicht ersetzen. Nur wenige Zentren verfügen über ein kontinuierliches EEG-Monitoring für Neonaten [35].
Das aEEG-Neuromonitoring ist in der Neonatologie für viele Erkrankungen essenziell, da es kontinuierlich Aussagen zur kortikalen Gehirnfunktion erlaubt. Es wird bettseitig, nichtinvasiv eingesetzt, und seine Interpretation ist relativ einfach zu erlernen, jedoch zeitaufwendig. Neben der Beurteilung der Hintergrundaktivität und des Spontanschlafs („sleep-wave cyling“, SWC; Abb. 1c, d) erlaubt es durch seinen kontinuierlichen Einsatz die Detektion, und meist auch eine erste diagnostische Einordnung, von zerebralen Krampfanfällen. Insbesondere die subklinischen Anfälle, die bei Neonaten häufig sind, lassen sich detektieren [41]. Darüber hinaus trägt sein Einsatz entscheidend zur Evaluation von Behandlungsstrategien wie z. B. der Initiierung einer HT nach HIE [98] oder der Behandlung zerebraler Anfälle bei.
Das aEEG-Neuromonitoring ermöglicht kontinuierlich Aussagen zur kortikalen Gehirnfunktion
Kontinuierliches aEEG-Monitoring wird z. B. für Früh- und Neugeborene mit zerebralen Anfällen und nach perinataler Asphyxie empfohlen. Die Ableitung sollte bis nach dem Ende der Aufwärmphase fortgeführt werden, da in dieser Phase noch prognostisch ungünstige, oft subklinische, Anfällen auftreten können [17]. Bei neonatalem Schlaganfall und Sinusvenenthrombose, aber auch bei unklaren neurologischen Symptomen empfiehlt sich der Einsatz ebenfalls.
Das aEEG erlaubt prognostische Aussagen zur späteren neurologischen Entwicklung z. B. nach einer Asphyxie. Dabei korrelieren das Auftreten von Anfällen und die Zeit bis zur Normalisierung des SWC mit dem neurologischen Outcome im Alter von 2 Jahren [66].
Auch für das Neuromonitoring kleiner FG und die Beurteilung von Hirnschädigungen wie z. B. intrazerebralen Hämorrhagien ist das aEEG in den ersten postnatalen Tagen essenziell. Die über die Zeit der Hirnentwicklung zu beobachtende erhöhte Kontinuität des Hintergrundmusters, das Auftreten FG-spezifischer Wellen und das Auftreten des SWC lassen Aussagen zur Hirnreifung in Verhältnis zum Gestationsalter zu [42]. Verschiedene Klassifikationen (z. B. Burdjalov Score, Hellström-Westas-Atlas), mit denen sich die Überlebenschancen gut prognostizieren lassen, wurden verglichen. Die Orientierung am Hellström-Westas-Atlas erlaubt jedoch die bessere Langzeitprognose [14, 15, 55, 106].
Die optimale Beurteilung des aEEG/EEG erfordert eine hohe Expertise, da multiple Charakteristika wie Kontinuität, Amplitude, Frequenz, Symmetrie, Schlafstadien sowie wichtige klinische Informationen z. B. Medikamentenapplikation in die Beurteilung einfließen müssen. Daher wurden in den letzten Jahren automatisierte Klassifikationssysteme anhand von Machine Learning (ML) entwickelt und getestet [91]. Bisher eignen sie sich aber noch nicht für den klinischen Einsatz [69, 79].
Nur wenige Studien bei Neugeborenen haben das aEEG mit anderen Techniken wie z. B. der NIRS oder der MRT kombiniert [39]. Hüning et al. konnten aEEG-Auffälligkeiten in den ersten 72 Lebensstunden mit pathologischen strukturellen MRT-Befunden am ET korrelieren. Durch die Kombination beider Verfahren erhöht sich die prognostische Aussagefähigkeit für die neurologische Entwicklung (BSID III, [48]).
Nah-Infrarot-Spektroskopie
Die NIRS ist ebenfalls ein bettseitig anzuwendendes Neuromonitoring für kranke Neugeborene und gibt wertvolle Informationen zu Perfusion, Blutvolumen und Sauerstoffverbrauch. Studien haben ihre Anwendung z. B. bei offenem Ductus arteriosus Botalli, Anämie, Sepsis, HIE und Schlaganfall untersucht (Abb. 1b). Auch ihr Potenzial für die Steuerung von Sauerstoffzufuhr und -monitoring wurde evaluiert [94, 101].
Um NIRS in der klinischen Routine nutzen zu können, sind inzwischen neonatale Grenz- und Referenzwerte verfügbar [13]. Die NIRS kann Bestandteil eines multimodalen Neuromonitoring für kritisch kranke Neugeborene sein, wie z. B. bei schwerer HIE [16].
Die ideale Kombination der Fülle von Daten zu Vitalparametern, NIRS, aEEG/EEG-Rohdaten sowie ihrer automatisierten Auswertung und Detektion von Artefakten ist Gegenstand wissenschaftlicher Untersuchungen [43, 103].
Klinische Daten und Biomarker
Das Risiko für Langzeitfolgen nach perinataler Hirnschädigung, aber auch das Ansprechen auf bestimmte Therapien wird durch Komplikationen in der Perinatalperiode, individuelle Immunantworten, Umwelt- und familiäre Einflüsse sowie (epi)genetische Besonderheiten bestimmt. Nur die möglichst genaue Identifikation dieser Faktoren ermöglicht zielgerichtete Prognosen und Interventionen. Grunderkrankungen wie die bronchopulmonale Dysplasie bestimmen beispielhaft und entscheidend das spätere Outcome. Diese kann man mit der Wahl von schonenden Verfahren zur Surfactant-Applikation (z. B. „Less Invasive Surfactant Application“ [LISA]) oder Beatmung möglicherweise positiv beeinflussen [53, 63]. Genetische Prädispositionen wie Apolipoprotein(Apo)-E-Polymorphismen wiederum sind Risikofaktoren für das Auftreten einer intraventrikulären Blutung und auch für die spätere Entwicklung einer CP, wie in einer gemeinsamen Studie mit den German Neonatal Network (GNN) gezeigt wurde [26, 46]. Auch die Art der Ernährung, insbesondere mit Muttermilch, hat einen entscheidenden Einfluss auf die Entwicklung und sollte einbezogen werden [108].
Der mütterliche Bildungsstatus ist prognostisch extrem relevant
Am Beispiel der moderaten und schweren HIE mit nachfolgender HT erwies sich die Kombination von frühen klinischen Parametern mit Biomarkern wie der MRT als entscheidend, um die Vorhersagekraft zu erhöhen. Jede zusätzliche Information ist als Puzzlestein der Gesamtprognose zu bewerten [96]. Nicht zu vernachlässigen ist das psychosoziale Umfeld des Kindes, wobei insbesondere dem mütterlichen Bildungsstatus eine entscheidende Rolle zukommt, wie kürzlich an über 10.145 kleinen FG aus 12 Geburtskohorten gezeigt wurde [82]. Dieser ist, insbesondere für die Entwicklung von kognitiven Fähigkeiten, prognostisch extrem relevant [51].
Über die Neonatalperiode hinaus ist es unabdingbar, dass Risikokinder einer strukturierten Nachsorge mit definierten Testverfahren zugeführt werden, um motorische, sensorische und kognitive Störungen sowie Auffälligkeiten des Sozialverhaltens zu erkennen. Entscheidend ist, dass sie bis ins Schulalter betreut werden. Kognitive Beeinträchtigungen, z. B. der exekutiven Funktionen [49, 102], aber auch grafomotorische Schwierigkeiten lassen sich erst im Vorschulalter diagnostizieren [11, 18, 19, 50], erlauben dann die rechtzeitige Intervention vor der Einschulung. Es konnte gezeigt werden, dass 46,7 % der sehr kleinen FG eine Entwicklungsverzögerung der Grafomotorik, 45 % der Feinmotorik und 23,3 % der visuell-räumlichen Wahrnehmung im Vorschulalter (7 %, 12 %, 8 %) aufweisen [18].
Der Gemeinsame Bundesausschuss schreibt nur die Nachuntersuchung bis ins korrigierte Alter von 24 Monaten vor [36]. In anderen Systemen erfolgt diese bis ins Schulalter [95].
Auch bei Kindern mit HIE und HT wurden bei guter motorischer Entwicklung kognitive Beeinträchtigungen im Vorschulalter gesehen; die langfristige Begleitung und Anbindung an Zentren mit entsprechender Expertise sind hier ebenfalls zu empfehlen [59].
Getriggert durch die Erfahrungen der durch die „coronavirus disease 2019“ (COVID-19) ausgelösten Pandemie wird an App-Lösungen und telemedizinischen Verfahren gearbeitet, um dieser Patientengruppe den Zugang zur ambulanten Betreuung zu erleichtern und Verlaufsdaten zu erhalten [2, 20].
Neonatale Verbundforschung bietet wertvolle Plattformen, wie das „National Institute of Child Health and Human Development“ (NICHD, https://neonatal.rti.org/), das Vermont Oxford Network (https://public.vtoxford.org/) und auch in Deutschland das German Neonatal Network (GNN; www.vlbw.de), die Daten von vielen Kliniken kombinieren. In großen Kohorten lassen sich entwicklungsrelevante Risikofaktoren identifizieren, die in der einzelnen Klinik selten vorkommen. Auch zur Sicherung der Qualität tragen die Möglichkeiten des Vergleichs mit anderen Kliniken entscheidend bei. Rohdaten, die anderen Wissenschaftlern ebenso zugänglich gemacht werden, können zusätzlich wertvolle Informationen liefern. Idealerweise stehen populationsbasierte Daten in Form von verpflichtenden und finanzierten Registern zur Verfügung, wie z. B. in den skandinavischen Ländern [58].
Elektronische Patientenakten könnten eine Vielzahl von Informationen zur Prognose geben
Elektronische Patientenakten, die alle klinischen Daten lückenlos dokumentieren, sind ebenfalls wünschenswert. Allerdings sind diese in Deutschland noch nicht flächendeckend im Einsatz, könnten aber eine Vielzahl von Informationen zur Prognose, die individualisierte frühe Interventionen möglich machen, geben [56]. Innovative Technologien wie das ML werden in der Zukunft die Kombination von Parametern für den klinischen Gebrauch vereinfachen [93]. Eine Studie konnte an 230 kleinen FG anhand von einfachen klinischen Parametern und deren Kombination das Risiko für eine intrazerebrale Blutung in den ersten Lebenstagen vorhersagen [99]. He et al. entwickelten ein ML-Modell aus Brain-connectome-Daten und klinischen Parametern von 291 FG; dieses erlaubt Aussagen zur neurologischen Entwicklung im korrigierten Alter von 24 Monaten [40].
In Studien wird intensiv nach Biomarkern gesucht, die einen Beitrag zur Prognostizierung der Entwicklung leisten können. Bisher hat sich kein Einzelner als prognostisch so relevant erwiesen, dass er in der Routine einsetzbar ist. Untersucht wurden beispielsweise die Expression von inflammatorischen Proteinen, proapoptotischen Faktoren, neuronenspezifischen Proteinen, Metaboliten und microRNA [32, 85]. Zukünftige Hoffnungen liegen den neueren Omics-Technologien, womit sich individuelle Markermuster aus Serum, Urin, Stuhl und Liquor bestimmen lassen. Diese umfassen (epi)genetische Daten, Informationen zu Transkriptom, Proteom- und Metabolommuster sowie Mikrobiomdaten [80, 93].
Omics-Technologien werden nicht nur in Studien zu Prognose und Verlauf von Erkrankungen eingesetzt, sondern sollen auch der Entwicklung von Therapiestrategien, die auf den einzelnen Patienten personalisiert sind, dienen [67]. Die Herausforderung besteht in der Verarbeitung großer Datenmengen, die mit klinischen Informationen zusammengebracht werden müssen.
Zusammenfassung und Ausblick
Um Kinder mit perinataler Hirnschädigung optimal zu betreuen, bedarf es eines multidisziplinären Teams aus Neonatologen und Neuropädiatern mit Interesse und entsprechender Expertise im Bereich der neonatalen Neurologie sowie geschulter Pflegekräfte. Je nach Grunderkrankung sollten spezifische Neuromonitoring- und Untersuchungstechniken kombiniert eingesetzt werden, um Kinder, die frühe Interventionen benötigen, möglichst früh zu identifizieren. Klinische Standards für die einzelnen zerebralen Erkrankungen der Neonatalperiode erleichtern das Vorgehen in der Routine.
Klinische Versorgung:
gezielter Einsatz spezifischer Neuromonitoring- und Untersuchungstechniken bei Risikokindern,
enge Einbindung von Familien in die Versorgung, Erfassung der psychosozialen Faktoren,
Beginn von frühen Interventionen, ggf. schon in der Klinik,
frühe Nachuntersuchungen zur fundierten Entwicklungsprognose,
standardisierte Nachsorge in spezifischen Sprechstunden für Risikokinder bis ins Schulalter,
standardisierte Erfassung von motorischen, sensorischen, kognitiven und sprachlichen Fähigkeiten sowie des Verhaltens,
Implementierung elektronischer Patientenakten, einschließlich Registrierung der Vitalparameter und Neuromonitoring-Daten.
Forschung:
kosteneffektive Gestaltung einer möglichst genauen Bestimmung der Prognose durch Entwicklung automatisierter Auswertsysteme,
Studien zur Kombination der unterschiedlichen Monitoring- und Biomarkertechnologien mit klinischen Daten,
Entwicklung und Untersuchung von neuroprotektiven Interventionen,
Erhöhung der Adhärenz der Patienten durch telemedizinische Maßnahmen,
Bereitstellung von populationsbasierten Daten aus der klinischen Routineversorgung,
Einsatz von innovativen Technologien zur Verarbeitung großer Datenmengen.
Fazit für die Praxis
Das sich entwickelnde Gehirn ist in der Perinatalperiode besonders empfindlich für eine Vielzahl von Störungen, deren Komplikationen zu lebenslangen neurokognitiven, sensorischen und psychosozialen Einschränkungen führen können.
Zur klinischen Diagnostik in der Neonatal- und frühen Säuglingsperiode stehen im Wesentlichen bildgebende Verfahren, insbesondere Sonographie, Magnetresonanztomographie am errechneten Termin, Neuromonitoring, wie z. B. das amplitudenintegrierte und/oder das klassische EEG, Nah-Infrarot-Spektroskopie, General Movements Assessment sowie die frühe klinische Untersuchung mithilfe der Hammersmith Neonatal/Infant Neurological Examination zur Verfügung.
Gegenstand wissenschaftlicher Untersuchungen ist die Identifikation innovativer Biomarkermuster (Omics) sowie (epi)genetischer Prädispositionen.
Um Kinder mit perinataler Hirnschädigung optimal zu betreuen, bedarf es eines multidisziplinären Teams aus Neonatologen und Neuropädiatern mit entsprechender Expertise sowie geschulter Pflegekräfte.
Acknowledgments
Danksagung
Wir danken Lena Hüning für die Erstellung der Grafiken.
Einhaltung ethischer Richtlinien
Interessenkonflikt
U. Felderhoff-Müser und B. Hüning geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autorinnen keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Agut T, Leon M, Rebollo M, et al. Early identification of brain injury in infants with hypoxic ischemic encephalopathy at high risk for severe impairments: accuracy of MRI performed in the first days of life. BMC Pediatr. 2014;14:177. doi: 10.1186/1471-2431-14-177. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Albayrak B, Dathe A-K, Cordier L, et al. Clinical experience on video consultation in preterm follow-up care in times of the COVID-19 pandemic. Pediatr Res. 2020 doi: 10.1038/s41390-020-01169-9. [DOI] [PubMed] [Google Scholar]
- 3.Arulkumaran S, Tusor N, Chew A, et al. MRI findings at term-corrected age and neurodevelopmental outcomes in a large cohort of very preterm infants. Ajnr Am J Neuroradiol. 2020;41:1509–1516. doi: 10.3174/ajnr.A6666. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Austin T. The development of neonatal neurointensive care. Pediatr Res. 2019 doi: 10.1038/s41390-019-0729-5. [DOI] [PubMed] [Google Scholar]
- 5.Baranger J, Demene C, Frerot A, et al. Bedside functional monitoring of the dynamic brain connectivity in human neonates. Nat Commun. 2021;12:1080. doi: 10.1038/s41467-021-21387-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Beckmann L, Obst S, Labusek N, et al. Regulatory T cells contribute to sexual dimorphism in neonatal hypoxic-ischemic brain injury. Stroke. 2022 doi: 10.1161/STROKEAHA.121.037537:STROKEAHA121037537. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Bell EF, Hintz SR, Hansen NI, et al. Mortality, in-hospital morbidity, care practices, and 2-year outcomes for extremely preterm infants in the US, 2013–2018. JAMA. 2022;327:248–263. doi: 10.1001/jama.2021.23580. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Bendix I, Hadamitzky M, Herz J, et al. Adverse neuropsychiatric development following perinatal brain injury: from a preclinical perspective. Pediatr Res. 2019;85:198–215. doi: 10.1038/s41390-018-0222-6. [DOI] [PubMed] [Google Scholar]
- 9.Benninger KL, Inder TE, Goodman AM, et al. Perspectives from the society for pediatric research. Neonatal encephalopathy clinical trials: developing the future. Pediatr Res. 2021;89:74–84. doi: 10.1038/s41390-020-0859-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Bilgin A, Wolke D. Regulatory problems in very preterm and full-term infants over the first 18 months. J Dev Behav Pediatr. 2016;37:298–305. doi: 10.1097/DBP.0000000000000297. [DOI] [PubMed] [Google Scholar]
- 11.Bos AF, Van Braeckel KN, Hitzert MM, et al. Development of fine motor skills in preterm infants. Dev Med Child Neurol Suppl. 2013;4:1–4. doi: 10.1111/dmcn.12297. [DOI] [PubMed] [Google Scholar]
- 12.Boswinkel V, Steggerda SJ, Fumagalli M, et al. The CHOPin study: a multicenter study on cerebellar hemorrhage and outcome in preterm infants. Cerebellum. 2019;18:989–998. doi: 10.1007/s12311-019-01053-1. [DOI] [PubMed] [Google Scholar]
- 13.Bruckner M, Wolfsberger CH, Dempsey EM, et al. Normal regional tissue oxygen saturation in neonates: a systematic qualitative review. Pediatr Res. 2021 doi: 10.1038/s41390-021-01786-y. [DOI] [PubMed] [Google Scholar]
- 14.Bruns N, Blumenthal S, Meyer I, et al. Application of an amplitude-integrated EEG monitor (cerebral function monitor) to neonates. J Vis Exp. 2017 doi: 10.3791/55985. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Bruns N, Dransfeld F, Huning B, et al. Comparison of two common aEEG classifications for the prediction of neurodevelopmental outcome in preterm infants. Eur J Pediatr. 2017;176:163–171. doi: 10.1007/s00431-016-2816-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Chalak L, Hellstrom-Westas L, Bonifacio S, et al. Bedside and laboratory neuromonitoring in neonatal encephalopathy. Semin Fetal Neonatal Med. 2021;26:101273. doi: 10.1016/j.siny.2021.101273. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Chalak LF, Pappas A, Tan S, et al. Association between increased seizures during rewarming after hypothermia for neonatal hypoxic ischemic encephalopathy and abnormal neurodevelopmental outcomes at 2-year follow-up: a nested multisite cohort study. JAMA Neurol. 2021;78:1484–1493. doi: 10.1001/jamaneurol.2021.3723. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Dathe AK, Jaekel J, Franzel J, et al. Visual perception, fine motor, and visual-motor skills in very preterm and term-born children before school entry-observational cohort study. Children (Basel) 2020;7(12):276. doi: 10.3390/children7120276. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.de Kieviet JF, Piek JP, Aarnoudse-Moens CS, et al. Motor development in very preterm and very low-birth-weight children from birth to adolescence: a meta-analysis. JAMA. 2009;302:2235–2242. doi: 10.1001/jama.2009.1708. [DOI] [PubMed] [Google Scholar]
- 20.Demauro SB, Duncan AF, Hurt H. Telemedicine use in neonatal follow-up programs—what can we do and what we can’t—lessons learned from COVID-19. Semin Perinatol. 2021;45:151430. doi: 10.1016/j.semperi.2021.151430. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Demene C, Mairesse J, Baranger J, et al. Ultrafast Doppler for neonatal brain imaging. Neuroimage. 2019;185:851–856. doi: 10.1016/j.neuroimage.2018.04.016. [DOI] [PubMed] [Google Scholar]
- 22.Dewan MV, Herrmann R, Schweiger B, et al. Are simple magnetic resonance imaging biomarkers predictive of neurodevelopmental outcome at two years in very preterm infants? Neonatology. 2019;116:331–340. doi: 10.1159/000501799. [DOI] [PubMed] [Google Scholar]
- 23.Dubois J, Alison M, Counsell SJ, et al. MRI of the neonatal brain: a review of methodological challenges and neuroscientific advances. J Magn Reson Imaging. 2021;53:1318–1343. doi: 10.1002/jmri.27192. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Dudink J, Steggerda SJ, Horsch S, et al. State-of-the-art neonatal cerebral ultrasound: technique and reporting. Pediatr Res. 2020;87:3–12. doi: 10.1038/s41390-020-0776-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Duncan AF, Bann CM, Dempsey A, et al. Behavioral deficits at 18–22 months of age are associated with early cerebellar injury and cognitive and language performance in children born extremely preterm. J Pediatr. 2019;204:148–156.e4. doi: 10.1016/j.jpeds.2018.08.059. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Dzietko M, Schulz S, Preuss M, et al. Apolipoprotein E gene polymorphisms and intraventricular haemorrhage in infants born preterm: a large prospective multicentre cohort study. Dev Med Child Neurol. 2019;61:337–342. doi: 10.1111/dmcn.13987. [DOI] [PubMed] [Google Scholar]
- 27.Einspieler C, Bos AF, Krieber-Tomantschger M, et al. Cerebral palsy: early markers of clinical phenotype and functional outcome. J Clin Med. 2019;8(10):1616. doi: 10.3390/jcm8101616. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Einspieler C, Bos AF, Libertus ME, et al. The general movement assessment helps us to identify preterm infants at risk for cognitive dysfunction. Front Psychol. 2016;7:406. doi: 10.3389/fpsyg.2016.00406. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Einspieler C, Marschik PB. Central pattern generators und ihre Bedeutung für die fötale Motorik. Klin Neurophysiol. 2012;43:16–21. doi: 10.1055/s-0031-1286264. [DOI] [Google Scholar]
- 30.Einspieler C, Prechtl HF. Prechtl’s assessment of general movements: a diagnostic tool for the functional assessment of the young nervous system. Ment Retard Dev Disabil Res Rev. 2005;11:61–67. doi: 10.1002/mrdd.20051. [DOI] [PubMed] [Google Scholar]
- 31.Eyre M, Fitzgibbon SP, Ciarrusta J, et al. The developing human connectome project: typical and disrupted perinatal functional connectivity. Brain. 2021;144:2199–2213. doi: 10.1093/brain/awab118. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Felderhoff-Mueser U, Herold R, Hochhaus F, et al. Increased cerebrospinal fluid concentrations of soluble Fas (CD95/Apo-1) in hydrocephalus. Arch Dis Child. 2001;84:369–372. doi: 10.1136/adc.84.4.369. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Ferriero DM. Neonatal brain injury. N Engl J Med. 2004;351:1985–1995. doi: 10.1056/NEJMra041996. [DOI] [PubMed] [Google Scholar]
- 34.Garfinkle J, Guo T, Synnes A, et al. Location and size of preterm cerebellar hemorrhage and childhood development. Ann Neurol. 2020;88:1095–1108. doi: 10.1002/ana.25899. [DOI] [PubMed] [Google Scholar]
- 35.Garvey AA, Pavel AM, O’toole JM, et al. Multichannel EEG abnormalities during the first 6 hours in infants with mild hypoxic-ischaemic encephalopathy. Pediatr Res. 2021;90:117–124. doi: 10.1038/s41390-021-01412-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Gemeinsamer Bundesausschuss . Richtlinie über Maßnahmen zur Qualitätssicherung der Versorgung von Früh- und Reifgeborenen. 2022. [Google Scholar]
- 37.Girault JB, Munsell BC, Puechmaille D, et al. White matter connectomes at birth accurately predict cognitive abilities at age 2. Neuroimage. 2019;192:145–155. doi: 10.1016/j.neuroimage.2019.02.060. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Goeral K, Kasprian G, Huning BM, et al. A novel magnetic resonance imaging-based scoring system to predict outcome in neonates born preterm with intraventricular haemorrhage. Dev Med Child Neurol. 2021 doi: 10.1111/dmcn.15116. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Goeral K, Urlesberger B, Giordano V, et al. Prediction of outcome in neonates with hypoxic-ischemic encephalopathy II: role of amplitude-integrated electroencephalography and cerebral oxygen saturation measured by near-infrared spectroscopy. Neonatology. 2017;112:193–202. doi: 10.1159/000468976. [DOI] [PubMed] [Google Scholar]
- 40.He L, Li H, Wang J, et al. A multi-task, multi-stage deep transfer learning model for early prediction of neurodevelopment in very preterm infants. Sci Rep. 2020;10:15072. doi: 10.1038/s41598-020-71914-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Hellstrom-Westas L. Amplitude-integrated electroencephalography for seizure detection in newborn infants. Semin Fetal Neonatal Med. 2018;23:175–182. doi: 10.1016/j.siny.2018.02.003. [DOI] [PubMed] [Google Scholar]
- 42.Hellstrom-Westas L, Rosen I. Electroencephalography and brain damage in preterm infants. Early Hum Dev. 2005;81:255–261. doi: 10.1016/j.earlhumdev.2005.01.006. [DOI] [PubMed] [Google Scholar]
- 43.Hendrikx D, Thewissen L, Smits A, et al. Nonlinear transfer entropy to assess the neurovascular coupling in premature neonates. Adv Exp Med Biol. 2020;1232:11–17. doi: 10.1007/978-3-030-34461-0_2. [DOI] [PubMed] [Google Scholar]
- 44.Herz J, Bendix I, Felderhoff-Muser U. Peripheral immune cells and perinatal brain injury: a double-edged sword? Pediatr Res. 2022;91:392–403. doi: 10.1038/s41390-021-01818-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Hintz SR, Vohr BR, Bann CM, et al. Preterm neuroimaging and school-age cognitive outcomes. Pediatrics. 2018;142(1):e20174058. doi: 10.1542/peds.2017-4058. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Humberg A, Dzietko M, Schulz S, et al. Association of ApoE genotypes and recovery from intracerebral hemorrhage in very low birth weight infants. Stroke. 2022;53:514–522. doi: 10.1161/STROKEAHA.120.033432. [DOI] [PubMed] [Google Scholar]
- 47.Hüning B, Sirin S, Schweiger B, Schara U, Felderhoff-Müser U. Zerebrale Bildgebung in der Neonatologie: Rolle der MRT. Neuropadiatrie. 2014;13:70–80. [Google Scholar]
- 48.Hüning B, Storbeck T, Bruns N, et al. Relationship between brain function (aEEG) and brain structure (MRI) and their predictive value for neurodevelopmental outcome of preterm infants. Eur J Pediatr. 2018;177:1181–1189. doi: 10.1007/s00431-018-3166-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Hüning BM, Assing B, Weishaupt E, et al. Delay of gratification and time comprehension is impaired in very preterm children at the age of 4 years. Early Hum Dev. 2017;115:77–81. doi: 10.1016/j.earlhumdev.2017.09.018. [DOI] [PubMed] [Google Scholar]
- 50.Hüning BM, Jäkel J. Frühgeburtlichkeit und langfristige Nachsorge bis ins Schulalter. Kindh Entwickl. 2021;30:37–50. doi: 10.1026/0942-5403/a000326. [DOI] [Google Scholar]
- 51.Jansen L, van Steenis A, van den Berg-Huysmans AA, et al. Associations between neonatal magnetic resonance imaging and short- and long-term neurodevelopmental outcomes in a longitudinal cohort of very preterm children. J Pediatr. 2021;234:46–53.e2. doi: 10.1016/j.jpeds.2021.02.005. [DOI] [PubMed] [Google Scholar]
- 52.Johnston MV, Hagberg H. Sex and the pathogenesis of cerebral palsy. Dev Med Child Neurol. 2007;49:74–78. doi: 10.1017/S0012162207000199.x. [DOI] [PubMed] [Google Scholar]
- 53.Katz TA, Vliegenthart RJS, Aarnoudse-Moens CSH, et al. Severity of bronchopulmonary dysplasia and neurodevelopmental outcome at 2 and 5 years corrected age. J Pediatr. 2021 doi: 10.1016/j.jpeds.2021.12.018. [DOI] [PubMed] [Google Scholar]
- 54.Kidokoro H, Anderson PJ, Doyle LW, et al. Brain injury and altered brain growth in preterm infants: predictors and prognosis. Pediatrics. 2014;134:e444–453. doi: 10.1542/peds.2013-2336. [DOI] [PubMed] [Google Scholar]
- 55.Klebermass K, Olischar M, Waldhoer T, et al. Amplitude-integrated EEG pattern predicts further outcome in preterm infants. Pediatr Res. 2011;70:102–108. doi: 10.1203/PDR.0b013e31821ba200. [DOI] [PubMed] [Google Scholar]
- 56.Kumar N, Akangire G, Sullivan B, et al. Continuous vital sign analysis for predicting and preventing neonatal diseases in the twenty-first century: big data to the forefront. Pediatr Res. 2020;87:210–220. doi: 10.1038/s41390-019-0527-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Kwong AKL, Fitzgerald TL, Doyle LW, et al. Predictive validity of spontaneous early infant movement for later cerebral palsy: a systematic review. Dev Med Child Neurol. 2018;60:480–489. doi: 10.1111/dmcn.13697. [DOI] [PubMed] [Google Scholar]
- 58.Laugesen K, Ludvigsson JF, Schmidt M, et al. Nordic health registry-based research: a review of health care systems and key registries. Clin Epidemiol. 2021;13:533–554. doi: 10.2147/CLEP.S314959. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Lee-Kelland R, Jary S, Tonks J, et al. School-age outcomes of children without cerebral palsy cooled for neonatal hypoxic-ischaemic encephalopathy in 2008–2010. Arch Dis Child Fetal Neonatal Ed. 2020;105:8–13. doi: 10.1136/archdischild-2018-316509. [DOI] [PubMed] [Google Scholar]
- 60.Ljungblad UW, Paulsen H, Tangeraas T, et al. Reference material for Hammersmith infant neurologic examination scores based on healthy, term infants age 3–7 months. J Pediatr. 2022 doi: 10.1016/j.jpeds.2022.01.032. [DOI] [PubMed] [Google Scholar]
- 61.Maresca D, Payen T, Lee-Gosselin A, et al. Acoustic biomolecules enhance hemodynamic functional ultrasound imaging of neural activity. Neuroimage. 2020;209:116467. doi: 10.1016/j.neuroimage.2019.116467. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Martinez-Biarge M, Bregant T, Wusthoff CJ, et al. White matter and cortical injury in hypoxic-ischemic encephalopathy: antecedent factors and 2-year outcome. J Pediatr. 2012;161:799–807. doi: 10.1016/j.jpeds.2012.04.054. [DOI] [PubMed] [Google Scholar]
- 63.Mehler K, Broer A, Roll C, et al. Developmental outcome of extremely preterm infants is improved after less invasive surfactant application: developmental outcome after LISA. Acta Paediatr. 2021;110:818–825. doi: 10.1111/apa.15565. [DOI] [PubMed] [Google Scholar]
- 64.Mitra S, Kendall GS, Bainbridge A, et al. Proton magnetic resonance spectroscopy lactate/N-acetylaspartate within 2 weeks of birth accurately predicts 2-year motor, cognitive and language outcomes in neonatal encephalopathy after therapeutic hypothermia. Arch Dis Child Fetal Neonatal Ed. 2019;104:F424–F432. doi: 10.1136/archdischild-2018-315478. [DOI] [PubMed] [Google Scholar]
- 65.Morgan C, Romeo DM, Chorna O, et al. The pooled diagnostic accuracy of neuroimaging, general movements, and neurological examination for diagnosing cerebral palsy early in high-risk infants: a case control study. J Clin Med. 2019;8(11):1879. doi: 10.3390/jcm8111879. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Murray DM, Boylan GB, Ryan CA, et al. Early EEG findings in hypoxic-ischemic encephalopathy predict outcomes at 2 years. Pediatrics. 2009;124:e459–467. doi: 10.1542/peds.2008-2190. [DOI] [PubMed] [Google Scholar]
- 67.Neumann E, Schreeck F, Herberg J, et al. How paediatric drug development and use could benefit from OMICs: a c4c expert group white paper. Br J Clin Pharmacol. 2022 doi: 10.1111/bcp.15216. [DOI] [PubMed] [Google Scholar]
- 68.Novak I, Morgan C, Adde L, et al. Early, accurate diagnosis and early intervention in cerebral palsy: advances in diagnosis and treatment. JAMA Pediatr. 2017;171:897–907. doi: 10.1001/jamapediatrics.2017.1689. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.O’toole JM, Boylan GB. Quantitative preterm EEG analysis: the need for caution in using modern data science techniques. Front Pediatr. 2019;7:174. doi: 10.3389/fped.2019.00174. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.Perez A, Ritter S, Brotschi B, et al. Long-term neurodevelopmental outcome with hypoxic-ischemic encephalopathy. J Pediatr. 2013;163:454–459. doi: 10.1016/j.jpeds.2013.02.003. [DOI] [PubMed] [Google Scholar]
- 71.Pisani F, Spagnoli C, Fusco C. EEG monitoring of the epileptic newborn. Curr Neurol Neurosci Rep. 2020;20:6. doi: 10.1007/s11910-020-1027-7. [DOI] [PubMed] [Google Scholar]
- 72.Raets MM, Sol JJ, Govaert P, et al. Serial cranial US for detection of cerebral sinovenous thrombosis in preterm infants. Radiology. 2013;269:879–886. doi: 10.1148/radiol.13130401. [DOI] [PubMed] [Google Scholar]
- 73.Reich B, Hoeber D, Bendix I, et al. Hyperoxia and the immature brain. Dev Neurosci. 2016;38:311–330. doi: 10.1159/000454917. [DOI] [PubMed] [Google Scholar]
- 74.Romeo DM, Cioni M, Palermo F, et al. Neurological assessment in infants discharged from a neonatal intensive care unit. Eur J Paediatr Neurol. 2013;17:192–198. doi: 10.1016/j.ejpn.2012.09.006. [DOI] [PubMed] [Google Scholar]
- 75.Romeo DM, Cowan FM, Haataja L, et al. Hammersmith infant neurological examination in infants born at term: predicting outcomes other than cerebral palsy. Dev Med Child Neurol. 2022 doi: 10.1111/dmcn.15191. [DOI] [PubMed] [Google Scholar]
- 76.Romeo DM, Cowan FM, Haataja L, et al. Hammersmith infant neurological examination for infants born preterm: predicting outcomes other than cerebral palsy. Dev Med Child Neurol. 2021;63:939–946. doi: 10.1111/dmcn.14768. [DOI] [PubMed] [Google Scholar]
- 77.Rutherford M, Ramenghi LA, Edwards AD, et al. Assessment of brain tissue injury after moderate hypothermia in neonates with hypoxic-ischaemic encephalopathy: a nested substudy of a randomised controlled trial. Lancet Neurol. 2010;9:39–45. doi: 10.1016/S1474-4422(09)70295-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.Salavati S, den Heijer AE, Coenen MA, et al. The early motor repertoire in preterm infancy and cognition in young adulthood: preliminary findings. J Int Neuropsychol Soc. 2022 doi: 10.1017/S1355617721001351:1-12. [DOI] [PubMed] [Google Scholar]
- 79.Sanchez Fernandez I, Sansevere AJ, Gainza-Lein M, et al. Machine learning for outcome prediction in electroencephalograph (EEG)-monitored children in the intensive care unit. J Child Neurol. 2018;33:546–553. doi: 10.1177/0883073818773230. [DOI] [PubMed] [Google Scholar]
- 80.Sarafidis K, Begou O, Deda O, et al. Targeted urine metabolomics in preterm neonates with intraventricular hemorrhage. J Chromatogr B Analyt Technol Biomed Life Sci. 2019;1104:240–248. doi: 10.1016/j.jchromb.2018.11.024. [DOI] [PubMed] [Google Scholar]
- 81.Schmidbauer VU, Yildirim MS, Dovjak GO, et al. Different from the beginning: WM maturity of female and male extremely preterm neonates—a quantitative MRI study. Ajnr Am J Neuroradiol. 2022 doi: 10.3174/ajnr.A7472. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 82.Sentenac M, Benhammou V, Aden U, et al. Maternal education and cognitive development in 15 European very-preterm birth cohorts from the RECAP preterm platform. Int J Epidemiol. 2022;50:1824–1839. doi: 10.1093/ije/dyab170. [DOI] [PubMed] [Google Scholar]
- 83.Serenius F, Kallen K, Blennow M, et al. Neurodevelopmental outcome in extremely preterm infants at 2.5 years after active perinatal care in Sweden. JAMA. 2013;309:1810–1820. doi: 10.1001/jama.2013.3786. [DOI] [PubMed] [Google Scholar]
- 84.Sewell E, Roberts J, Mukhopadhyay S. Association of infection in neonates and long-term neurodevelopmental outcome. Clin Perinatol. 2021;48:251–261. doi: 10.1016/j.clp.2021.03.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 85.Shi Z, Luo K, Deol S, et al. A systematic review of noninflammatory cerebrospinal fluid biomarkers for clinical outcome in neonates with perinatal hypoxic brain injury that could be biologically significant. J Neurosci Res. 2021 doi: 10.1002/jnr.24801. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 86.Silva N, Zhang D, Kulvicius T, et al. The future of general movement assessment: the role of computer vision and machine learning—a scoping review. Res Dev Disabil. 2021;110:103854. doi: 10.1016/j.ridd.2021.103854. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 87.Sirin S, Goericke SL, Hüning BM, et al. Evaluation of 100 brain examinations using a 3 Tesla MR-compatible incubator-safety, handling, and image quality. Neuroradiology. 2013;55:1241–1249. doi: 10.1007/s00234-013-1241-y. [DOI] [PubMed] [Google Scholar]
- 88.Sorg AL, Klemme M, von Kries R, et al. Clinical diversity of cerebral sinovenous thrombosis and arterial ischaemic stroke in the neonate: a surveillance study. Neonatology. 2021;118:530–536. doi: 10.1159/000512526. [DOI] [PubMed] [Google Scholar]
- 89.Spittle AJ, Thompson DK, Olsen JE, et al. Predictors of long-term neurodevelopmental outcomes of children born extremely preterm. Semin Perinatol. 2021;45:151482. doi: 10.1016/j.semperi.2021.151482. [DOI] [PubMed] [Google Scholar]
- 90.Stein A, Prager S, Drommelschmidt K, et al. Corpus callosum-Fstigium Länge als einfacher Parameter zur Beurteilung des Gehirnwachstums bei Frühgeborenen zum Zeitpunkt 36+0 bis 36+6 SSW. 2022. [Google Scholar]
- 91.Stevenson NJ, Korotchikova I, Temko A, et al. An automated system for grading EEG abnormality in term neonates with hypoxic-ischaemic encephalopathy. Ann Biomed Eng. 2013;41:775–785. doi: 10.1007/s10439-012-0710-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 92.Storbeck T, Bruns N, Weiss C, et al. Correlation of lateral ventricular size and deep gray matter volume in MRI at term equivalent age with neurodevelopmental outcome at a corrected age of 24 months and with handedness in preterm infants. Eur J Pediatr. 2020;179:271–278. doi: 10.1007/s00431-019-03496-4. [DOI] [PubMed] [Google Scholar]
- 93.Tataranno ML, Vijlbrief DC, Dudink J, et al. Precision medicine in neonates: a tailored approach to neonatal brain injury. Front Pediatr. 2021;9:634092. doi: 10.3389/fped.2021.634092. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 94.Ter Horst HJ, Verhagen EA, Keating P, et al. The relationship between electrocerebral activity and cerebral fractional tissue oxygen extraction in preterm infants. Pediatr Res. 2011;70:384–388. doi: 10.1203/PDR.0b013e3182294735. [DOI] [PubMed] [Google Scholar]
- 95.The National Institute for Health and Care Excellence NICE guidance . Evidence-based recommendations developed by independent committees, including professionals and lay members, and consulted on by stakeholders. 2022. [Google Scholar]
- 96.Thoresen M, Jary S, Walloe L, et al. MRI combined with early clinical variables are excellent outcome predictors for newborn infants undergoing therapeutic hypothermia after perinatal asphyxia. EClinicalMedicine. 2021;36:100885. doi: 10.1016/j.eclinm.2021.100885. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 97.Thornton C, Rousset CI, Kichev A, et al. Molecular mechanisms of neonatal brain injury. Neurol Res Int. 2012;2012:506320. doi: 10.1155/2012/506320. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 98.Toet MC, Hellstrom-Westas L, Groenendaal F, et al. Amplitude integrated EEG 3 and 6 hours after birth in full term neonates with hypoxic-ischaemic encephalopathy. Arch Dis Child Fetal Neonatal Ed. 1999;81:F19–23. doi: 10.1136/fn.81.1.F19. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 99.Turova V, Sidorenko I, Eckardt L, et al. Machine learning models for identifying preterm infants at risk of cerebral hemorrhage. PLoS ONE. 2020;15:e0227419. doi: 10.1371/journal.pone.0227419. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 100.Tusor N, Benders MJ, Counsell SJ, et al. Punctate white matter lesions associated with altered brain development and adverse motor outcome in preterm infants. Sci Rep. 2017;7:13250. doi: 10.1038/s41598-017-13753-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 101.van Bel F, Mintzer JP. Monitoring cerebral oxygenation of the immature brain: a neuroprotective strategy? Pediatr Res. 2018;84:159–164. doi: 10.1038/s41390-018-0026-8. [DOI] [PubMed] [Google Scholar]
- 102.van Houdt CA, Oosterlaan J, van Wassenaer-Leemhuis AG, et al. Executive function deficits in children born preterm or at low birthweight: a meta-analysis. Dev Med Child Neurol. 2019;61:1015–1024. doi: 10.1111/dmcn.14213. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 103.Variane GFT, Chock VY, Netto A, et al. Simultaneous near-infrared spectroscopy (NIRS) and amplitude-integrated electroencephalography (aEEG): dual use of brain monitoring techniques improves our understanding of physiology. Front Pediatr. 2019;7:560. doi: 10.3389/fped.2019.00560. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 104.Victor S, Rocha-Ferreira E, Rahim A, et al. New possibilities for neuroprotection in neonatal hypoxic-ischemic encephalopathy. Eur J Pediatr. 2022;181:875–887. doi: 10.1007/s00431-021-04320-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 105.Wezel-Meijler G, de Vries LS. Cranial ultrasound—optimizing utility in the NICU. Curr Pediatr Rev. 2014;10:16–27. doi: 10.2174/157339631001140408120106. [DOI] [PubMed] [Google Scholar]
- 106.Wikstrom S, Pupp IH, Rosen I, et al. Early single-channel aEEG/EEG predicts outcome in very preterm infants. Acta Paediatr. 2012;101:719–726. doi: 10.1111/j.1651-2227.2012.02677.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 107.Woodward LJ, Clark CA, Bora S, et al. Neonatal white matter abnormalities an important predictor of neurocognitive outcome for very preterm children. PLoS One. 2012;7:e51879. doi: 10.1371/journal.pone.0051879. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 108.Young A, Beattie RM, Johnson MJ. Optimising growth in very preterm infants: reviewing the evidence. Arch Dis Child Fetal Neonatal Ed. 2022 doi: 10.1136/archdischild-2021-322892. [DOI] [PubMed] [Google Scholar]
- 109.Yuan J, Cao X, Deng Y. An exploratory study into a new head ultrasound marker for predicting neurodevelopmental outcomes in preterm infants. Ultrasound Q. 2021;38:43–48. doi: 10.1097/RUQ.0000000000000582. [DOI] [PubMed] [Google Scholar]