Abstract
La atención de pacientes con sospecha de un proceso infeccioso en los servicios de urgencias hospitalarios(SUH) se ha incrementado en la última década hasta suponer alrededor del 15-20% de todas las atenciones diarias. En la valoración inicial de estos enfermos se toman muestras para los distintos estudios microbiológicos en un 45% de los casos, donde predomina la obtención de hemocultivos (HC), en el 14,6% de todos ellos. La rentabilidad diagnóstica de estos HC es muy variable (2-20%). Los focos o procesos infecciosos más frecuentes sospechados o confirmados de las bacteriemias verdaderas(BV) en los SUH son la infección del tracto urinario (45%) y la infección respiratoria (25%). Por todo ello, la sospecha y confirmación de la BV tiene un relevante significado diagnóstico, pronóstico y obliga a cambiar algunas de las decisiones más importantes a tomar en el SUH. Entre otras, indicar el alta o ingreso, extraer HC y administrar el antimicrobiano adecuado y precoz. La intención de esta revisión es poner de manifiesto las evidencias científicas publicadas en los últimos cinco años, aclarar las controversias existentes actuales y comparar la capacidad para predecir bacteriemia de los últimos modelos predictivos publicados desde el año 2017 con los ya existentes en esa fecha, año en el que se publicó una revisión que dejaba abierta la propuesta de seguir buscando un modelo con un rendimiento adecuado para los SUH. Y así, a partir de ella, generar distintas recomendaciones que ayuden a definir el papel que pueden tener estos modelos o escalas en la mejora de la indicación de obtención de los HC, así como en la toma inmediata de otras decisiones diagnóstico-terapéuticas (administración precoz y adecuada del tratamiento antibiótico, solicitud de estudios complementarios y otras muestras microbiológicas, intensidad del soporte hemodinámico, necesidad de ingreso, etc.)
Keywords: Servicio de urgencias, Bacteriemia, Modelo predictivo, Hemocultivos, Biomarcadore, Procalcitonina
Abstract
The care of patients with a suspected infectious process in hospital emergency department (ED) has increased in the last decade to account for around 15-20% of all daily care. In the initial evaluation of these patients, samples are taken for the different microbiological studies in 45% of the cases, where obtaining blood cultures (BC) predominates, in 14.6% of all of them. The diagnostic yield of these BC is highly variable (2-20%). The most frequent suspected or confirmed foci or infectious processes of true bacteremia (TB) in the ED are urinary tract infection (45%) and respiratory infection (25%). For all these reasons, the suspicion and confirmation of TB has a relevant diagnostic and prognostic significance and requires changing some of the most important decisions to be made in the ED. Among others, indicate discharge or admission, extract BC and administer the appropriate and early antimicrobial. The intention of this review is to highlight the scientific evidence published in the last five years, clarify the current controversies and compare the ability to predict bacteremia of the latest predictive models published since 2017 with those already existing on that date, year in which a review was published that left open the proposal to continue searching for a model with adequate performance for ED. And so, based on it, generate different recommendations that help define the role that these models or scales can have in improving the indication for obtaining BC, as well as in the immediate making of other diagnostic-therapeutic decisions (administration early and appropriate antibiotic treatment, request for complementary studies and other microbiological samples, intensity of hemo-dynamic support, need for admission, etc.)
Keywords: Emergency department, Bacteraemia, Clinical prediction rule, Blood cultures, Biomarker, Procalcitonin
INTRODUCCIÓN
Impacto de la infección grave en el Servicio de Urgencias Hospitalario. La atención de pacientes con sospecha o confirmación de un proceso infeccioso en los servicios de urgencias hospitalarios (SUH) españoles se ha incrementado significativamente en la última década hasta suponer alrededor del 15-20% de todas las atenciones diarias en estos dispositivos [1,2]. Además, la gravedad de su presentación clínica (aquellos que cumplen criterios de sepsis, pacientes con comorbilidad relevante, inmunodeprimidos, ancianos o ante la sospecha de bacteriemia) y la mortalidad intrahospitalaria y a corto plazo (30 días), también han sufrido un incremento en la última década [1,2]. Incluso, durante el último año donde los SUH se han visto muy presionados por la pandemia de COVID-19 [3], tanto estos pacientes como los atendidos por infección bacteriana han aumentado su tasa de ingresos, la necesidad de cuidados intensivos y la mortalidad a corto plazo [4].
Obtención de hemocultivos y confirmación de bacteriemia verdadera desde el Servicio de Urgencias Hospitalario. En la valoración inicial de estos enfermos, en el propio SUH, se toman muestras para los distintos estudios microbiológicos hasta en un 45% de los casos [1,2]. Entre ellos predomina la obtención de hemocultivos (HC), que se lleva a cabo en el 14,6% de todos los pacientes atendidos con sospecha o confirmación de infección en los SUH [1,2,5]. Aunque, al contrario de lo que se podría suponer, se ha comunicado una menor tasa de solicitudes de procesamiento de HC desde los SUH en el año 2020 y, junto a ello, de aislamientos [6].
Se define como bacteriemia la presencia de bacterias en la sangre, que se pone de manifiesto por el aislamiento de éstas en los HC [7,8]. A pesar de las nuevas técnicas de detección rápida (del ADN del patógeno o por aplicación de espectrometría de masas, entre otras) [7-10], los HC permiten el diagnóstico etiológico de la infección, aportan información sobre la sensibilidad del microorganismo y favorecen la optimización del tratamiento antimicrobiano [7-11].
La rentabilidad diagnóstica de estos HC es muy variable (2-20%) [5,12-16], mientras que los considerados “HC contaminantes” pueden alcanzar incluso tasas del 30-50% de los aislamientos [6,13,15]. Por otro lado, los HC con aislamiento significativo en pacientes dados de alta desde urgencias (ASPAU) pueden representar un 3-5% de los extraídos en el SUH [13,15]. Estos hechos representan verdaderos problemas, al conllevar un incremento de las pruebas diagnósticas realizadas, la estancia hospitalaria, los costes y la administración de tratamientos antibióticos innecesarios o, en su caso, altas improcedentes en los casos de ASPAU [15-19].
La incidencia de bacteriemia comunitaria ha aumentado hasta 2 de cada 1.000 atenciones en los SUH españoles y a 10 episodios por cada 1000 ingresos hospitalarios desde estos dispositivos [5,6,12,13].
Epidemiología, etiología y relevancia de la bacteriemia. Los focos o procesos infecciosos más frecuentes sospechados o confirmados de las bacteriemias verdaderas (BV) o significativas en los SUH son la infección del tracto urinario (ITU) (45%) y la infección respiratoria (25%), respectivamente. En un segundo plano se sitúan la bacteriemia de foco desconocido y la infección intraabdominal (ambas en alrededor del 10% de los HC extraídos en el SUH) [5,6,12,13].
La etiología se debe a bacterias grampositivas en un 30-45%, gramnegativas en un 55-70% y anaerobios sobre el 1-3% [5,6,12-15]. Esta proporción puede cambiar, si la incidencia de HC contaminantes fuera excesiva, a favor de las grampositivas [14]. De forma global, las bacterias aisladas con mayor frecuencia de los HC obtenidos en los SUH son Escherichia coli, Streptococcus pneumoniae y Staphylococcus aureus [5,6,12-15].
La mortalidad a los 30 días de los pacientes con BV desde el SUH se ha cifrado entre 10-25% [12-15]. Ésta se relaciona con la gravedad de la situación clínica (existencia de sepsis-shock séptico), el tipo de foco primario (urinario, respiratorio, abdominal, sistema nervioso, desconocido) y las características de los pacientes (edad, comorbilidad, situaciones particulares, etc) [18,19].
Un dato relevante es que el 51% de las neumonías adquiridas en la comunidad (NAC) y el 36% de las ITU que se diagnostican en los SUH lo son en pacientes con ≥70 años [1,2,20,21], ya que en este subgrupo poblacional es más difícil establecer el diagnóstico, encontrar la indicación adecuada de extraer HC, se presentan con mayor gravedad clínica y las tasas de bacteriemia y mortalidad a corto y largo plazo son superiores [2,20-23].
Importancia de la sospecha y confirmación de bacteriemia en los Servicios de Urgencias Hospitalarios. Por todo ello, la sospecha y confirmación de la BV tiene un relevante significado diagnóstico, pronóstico y obliga a cambiar algunas de las decisiones más importantes a tomar de forma inmediata en el SUH. Entre otras, indicar el alta o ingreso, extraer HC y administrar el antimicrobiano adecuado y precoz [18,19,24,25].
Así, encontrar un modelo predictivo de bacteriemia útil y aplicable en todos los SUH que evite altas improcedentes e ingresos innecesarios, y sus consecuencias, se convirtió hace años en el objetivo de muchos autores [26-34] que combinan distintas variables clínicas, epidemiológicas y analíticas, entre las que se incluyen los biomarcadores de respuesta inflamatoria e infección (BMRII), ya que aumentan significativamente el poder predictivo de dichos modelos [35,36].
En este escenario clínico, en los últimos años, se ha acentuado la búsqueda de herramientas objetivas de ayuda para intentar establecer y predecir, ante la sospecha de infección grave, incluso en la primera valoración del paciente en el SUH (triaje) [37], un diagnóstico precoz, el pronóstico, la gravedad y, junto con la posible etiología bacteriana, la sospecha de bacteriemia (al ser estos factores claramente determinantes del pronóstico y la mortalidad de los procesos infecciosos) [2,24,37].
ESTRATEGIA DE LA REVISIÓN
La intención de esta revisión es poner de manifiesto la relevancia de las evidencias científicas publicadas en los últimos cinco años, aclarar las controversias existentes actuales y comparar la capacidad para predecir bacteriemia de los últimos modelos predictivos publicados desde el año 2017 con los ya existentes en esa fecha [26], año en el que se publicó una revisión que dejaba abierta la propuesta de seguir buscando un modelo con un rendimiento adecuado para los SUH [36] . Y así, a partir de ella, generar distintas recomendaciones que ayuden a definir el papel que pueden tener estos modelos o escalas en la mejora de la indicación de obtención de los HC [18,19], así como en la toma inmediata de otras decisiones diagnósticoterapéuticas (administración precoz y adecuada del tratamiento antibiótico, solicitud de estudios complementarios y otras muestras microbiológicas, intensidad del soporte hemodinámico, necesidad de ingreso, etc.) [2,11,24,38].
Esta revisión se ha realizado en tres fases:
1.- Se llevó a cabo una búsqueda en las plataformas de bases de datos que los autores creyeron más relevantes (PubMed, Web of Sciencie, Scopus y EMBASE) empleando y combinando como palabras clave: (“infección” o “infection”) y (“bacteriemia” o “bacteraemia”) y (“hemocultivos” o “blood cultures”) y (“biomarcadores” o “biomarkers) y (“procalcitonina” o “procalcitonin”) y (“modelo predictivo” o “clinical prediction rule”). En esta fase, se utilizaron filtros para seleccionar los artículos solo de pacientes adultos (> 14 años) y aquellos relacionados con los SUH, en idiomas inglés y español y desde 2016 hasta enero de 2022.
2.- De todos los encontrados en la búsqueda inicial se escogieron, a juicio de los autores, los artículos relevantes en relación con la capacidad o utilidad de los distintos modelos o escalas predictivas de bacteriemia en los HC obtenidos en la primera atención de los pacientes en el SUH. Así, se excluyeron los artículos elaborados con pacientes de planta de hospitalización o en medicina intensiva. Se amplió la búsqueda manualmente a otros artículos que se consideraron de interés y se recuperaron algunos, por su relevancia, de la anterior revisión [36]. De esta forma, de los 1.790 artículos que se encontraron en la búsqueda (editoriales, cartas científicas, originales, originales breves, revisiones y metaanálisis), se seleccionaron 259 para su revisión inicial.
3.- En última instancia, se eligieron por unanimidad los artículos que cumplían con los objetivos e intereses de la revisión establecidos por los autores sobre los que elaboró esta revisión.
BIOMARCADORES: PAPEL COMO FACTORES PREDICTIVOS DE BACTERIEMIA
Aunque en los últimos años se han relacionado múltiples factores independientes como predictores de bacteriemia en los SUH [18,36], lo más relevantes y repetidos han sido: signos vitales [a la cabeza presión arterial sistólica (PAS) ≤100 mmHg, pero también temperatura (Tª) >38,3°C, frecuencia cardiaca (FC) y frecuencia respiratoria (FR)], comorbilidad (índice de Charlson ≥3), situación funcional, existencia de criterios de sepsis (tanto clásicos de Sepsis-2 [39] con criterios de síndrome de respuesta inflamatoria sistémica (SRIS) ≥2 como de Sepsis-3 [40] con un quick Sepsis Related Organ Failure Assessment (qSOFA ≥2) y analíticos (leucocitosis ≥12.000/mm3, formas jóvenes o cayados >10% y trombopenia <150.000/mm3) [41-43]. Junto a estos factores mencionados y de forma muy significativa en los últimos tres años se ha validado la utilidad de los BMRII para predecir bacteriemia [35,36]. Entre ellos, por sus resultados y disponibilidad en los SUH españoles, destacan la proteína C reactiva (PCR), las interleucinas (IL) 6 y 8, el lactato, la proadrenomedulina (proADM), la presepsina, el dímero D y el receptor soluble del activador del plasminógeno de tipo uroquinasa (su-PAR) [35,36,44-51]. Pero, entre todos los BMRII, la procalcitonina (PCT) obtiene el mejor rendimiento predictivo sobre el resto para predecir bacteriemia y a su vez poder orientar hacia el patógeno causante de la infección, su evolución clínica (a sepsis grave y shock séptico) y la mortalidad [2,35,36,52-59]. De ahí que se han propuesto, desarrollado y validado diferentes modelos predictivos que incluyen, como una de sus variables con mayor peso, la PCT [52-59]. Además, un aspecto muy relevante hoy en día es que ya en el 89% de los SUH españoles existe disponibilidad para su uso, convirtiéndose en una herramienta útil y disponible de forma universal [60].
Procalcitonina. La PCT, es una proteína sintetizada primordialmente en la glándula tiroides y las células neuroendocrinas del pulmón, pero muchos otros tejidos pueden producir PCT en situaciones de infección bacteriana con/sin sepsis y con/ sin bacteriemia. En condiciones normales su concentración es casi indetectable (<0,05 ng/ml) [35]. Sus concentraciones se relacionan con el grado de respuesta inflamatoria local y sistémica, la carga bacteriana y/o la concentración de endotoxina [35,36]. Por su cinética se considera muy adecuada para su utilización en los SUH, ya que se eleva significativamente en el torrente sanguíneo a las 2-6 horas tras el estímulo bacteriano y los valores máximos se encontrarán a las 12-36 horas, ya que tiene una semivida de alrededor de 24 horas [35].
Para ser útil, la PCT debe proporcionar información adicional a la que se obtiene con los datos clínicos del paciente con infección y ayudar a la hora de tomar decisiones urgentes en los SUH [35]. No obstante, nunca puede sustituir ni a la exploración física y anamnesis, ni a las pruebas complementarias y microbiológicas que sean pertinentes [35,36]. En el caso de la predicción de bacteriemia, debería ser capaz de identificar en el propio SUH a los pacientes con una elevada probabilidad (incluso antes de que se manifiesten los signos y síntomas de una infección bacteriana grave como hipotensión, hiperlactacidemia o disfunción de órganos) de la existencia de bacteriemia y de la etiología bacteriana del cuadro [35]. Por lo tanto, aumentará la seguridad y acortará el tiempo del diagnóstico clínico de la infección bacteriana (frente a otras causas de respuesta inflamatoria sistémica o gravedad clínica), permitiendo el inicio del tratamiento antimicrobiano precoz y adecuado [29,39,40].
Dentro de sus reconocidas utilidades en el paciente con infección en el SUH destaca su capacidad de predecir BV concomitante, incluso con capacidad de predecir la existencia de hemocultivos contaminados [14,35]. Es conocido que existe una relación demostrada entre la mortalidad, la gravedad de situación clínica del paciente de acuerdo con los criterios de sepsis y SS, la confirmación de bacteriemia posterior y los valores de PCT en el momento de la extracción de los HC [2,5,35]. Cisneros et al [5] comunicaron que la frecuencia de bacteriemia aumentaba con la gravedad del cuadro clínico, desde el 17-31% en pacientes con criterios de sepsis y el 30-45% cuando existía SS. En otro estudio similar [61], realizado en 984 pacientes con sospecha de bacteriemia atendidos en urgencias, se obtuvieron HC positivos en el 1% de los casos cuando la PCT era <0,5 ng/ml, el 8% si la PCT era de 0,5-2 ng/ml, el 20% si >2 ng/ml y el 46% si era >10 ng/ml.
Aunque son múltiples los estudios publicados en la última década, uno de los trabajos más relevantes publicados es un metaanálisis [62] que incluye 58 estudios con 16.514 pacientes (3.420 con bacteriemia), donde el punto de corte (PC) en los distintos estudios varía de 0,1 a 17 ng/ml. Establece para todos los casos un área bajo la curva de la característica operativa del receptor (ABC-COR) de 0,79 con un PC óptimo de 0,5 ng/ml que obtiene una sensibilidad (S) del 76% (IC 95%: 72-80) y una especifidad (E) del 69% (IC 95%: 64-72). En este metaanálisis para el subgrupo de los 1.425 enfermos de los SUH los resultados fueron: ABC-COR de 0,78 con S del 76% (IC 95%: 69-82) y E del 68% (IC 95%: 61-75). Lo que confirma que la capacidad de predicción de BV con una PCT > 0,50 ng/ml, es similar o incluso mayor que la mayoría de los modelos que utilizan otras variables [35,36].
Por otro lado, y como valor añadido, algunos estudios además de predecir la existencia de BV, también han buscado las situaciones o el PC que pudiera predecir si el patógeno aislado sería gramnegativo o grampositivo. En este sentido, destaca el publicado por Thomas-Rüddel [63] sobre 4.858 pacientes, donde la PCT fue significativamente mayor en la bacteriemia por gramnegativos en comparación con la bacteriemia por gram-positivos (p <0,001). El ABC-COR fue de 0,72 (IC 95%:0,71-0,74) para la predicción de bacteriemia por gramnegativos en comparación con todos los demás resultados de hemocultivos, incluidos los hemocultivos negativos. El PC optimizado fue de 10 ng/ml (S del 69%, E del 35%). La PCT difirió significativamente entre grupos específicos de patógenos (p <0,001) con concentraciones más altas en Escherichia coli, Streptococcus spp y otras enterobacterias. De la misma forma, con un ABCCOR de 0,70 y un PC >2,54 ng/ml, otro estudio determina que a mayor concentración de PCT existe mayor probabilidad de que la bacteria sea gramnegativa [64]. En esta línea, un estudio español [65] sobre 474 NAC (17,9% con BV) llegó a establecer que con una PCT ≥0,95 ng/ml se consigue una ABC para predecir bacteriemia por S. pneumoniae de 0,98 (IC 95%: 0,90-0,99), con un valor predictivo negativo (VPN) del 98,8%.
NUEVOS MODELOS PREDICTIVOS
Hoy en día, si bien la técnica de extracción de los HC está bien protocolizada [3,8], todavía hay importantes controversias en relación a las indicaciones de cuándo debemos obtenerlos en el SUH [2,7,8]. La obtención de HC es una práctica creciente en la valoración inicial de los pacientes con sospecha de infección en el SUH [2,15-17]. Su obtención constituye aún un motivo de discusión, ya que comparadas con el resto de pruebas habituales en urgencias, requieren un mayor tiempo para su obtención, una buena técnica para evitar contaminaciones y carecen de utilidad diagnóstica inmediata [67]. En ellos, la sospecha y confirmación de bacteriemia tiene un importante significado diagnóstico, pronóstico y terapéutico. Pero, además, los HC también se obtienen en el SUH como garantía de continuidad asistencial, ya que del conocimiento de sus resultados dependerá el manejo y evolución posterior del paciente en su destino final [2,8,15].
En los últimos años se han propuesto distintos modelos predictivos para los SUH de distinta complejidad [26-36, 52-59]. En ellos, ha adquirido una gran relevancia el papel que pueden jugar los BMRII [35,36], y en especial la PCT [35,36, 52-59], como factores predictores independientes de bacteriemia. Se ha demostrado que su capacidad pronóstica puede igualar, e incluso superar, la que consiguen distintos modelos que no la incluyen [35,36].
Hasta hace unos años, el conocido modelo predictivo de bacteriemia de Shapiro et al [26]., ha sido el más utilizado, validado y la referencia para los SUH en todo el mundo [27,64]. Así, Shapiro et al [26]. publicaron una propuesta de modelo que clasificaba el riesgo de bacteriemia en tres grupos de bajo (<1%), moderado (7-9%) y alto (15-26%) riesgo, en función de unos criterios mayores y de unos criterios menores (Tabla 1). Según este modelo de decisión, estaría indicada la extracción de HC cuando se cumpliera un criterio mayor o, al menos, dos menores [26]. La escala de Shapiro original publicó un ABCCOR de 0,80 en la cohorte de validación y de 0,75 en la derivación [26], con una S del 94% (IC 95%: 89%-99%) y una E del 48% (IC 95%: 42%-53%).
Tabla 1.
Factores pronósticos de bacteriemia en el servicio de urgencias del modelo de Shapiro
| CRITERIOS MAYORES | Temperatura > 39,4°C (3 puntos) Sospecha clínica de endocarditis (3 puntos) Portador de catéter vascular (2 puntos) |
| CRITERIOS MENORES | Temperatura 38,3 – 39,3°C (1 punto) Edad > 65 años (1 punto) Tiritona (1 punto) Vómitos (1 punto) PAS < 90 mmHg (1 punto) Neutrofilia > 80% (1 punto) Leucocitos > 18.000/mm3 (1 punto) Porcentaje de cayados > 5% (1 punto) Trombopenia < 150.000 plaquetas/mm3 (1 punto) Creatinina > 2 mg/dl (1 punto) |
| RIESGO | - Alto: > 5 puntos (HC+: 15-25 %) - Moderado: 2-5 puntos (HC+: 7-9 %) - Bajo: 0-1 punto (HC+: < 1 %) |
PAS: presión arterial sistólica. HC+: hemocultivos positivos. Adaptado de Shapiro et al. [26].
Otros modelos más recientes [28], aunque útiles, no consiguen alcanzar el rendimiento del modelo de Shapiro [26]. Así, un estudio multicéntrico colombiano define un modelo combinando, que incluye la Tª ≥ 38°C, plaquetas < 150.000/mm3 y una puntuación <15 de la escala del coma de Glasgow, con el que se obtiene un ABC-COR de “solo” 0,68 (IC 95%: 0,65-0,72) [28].
Por otra parte, como ya se ha comprobado, cuando se incluye la PCT a estos modelos se incrementa significativamente su poder predictivo. La propuesta de Tudela et al [29]., que relacionó variables clínicas, analíticas y el índice de comorbilidad de Charlson, tras el análisis de regresión, define dos variables significativas (índice de Charlson ≥ 2 y una PCT >0,4 ng/ml, 1 y 2 puntos, respectivamente) con las que se establecieron 4 grupos de probabilidad creciente de bacteriemia y con un ABC-COR de 0,80 y un VPN del 95,3% (IC 95%: 90,8-97,6) para “descartar” la existencia de bacteriemia. En otro trabajo, un grupo español [61] añadió como un “nuevo criterio mayor” a los de los de Shapiro et al [26]. el objetivar una PCT >2 ng/ml, con lo que reclasificó a los pacientes mejorando la predicción de BV en los nuevos grupos de «riesgo moderado» y «riesgo alto» (del 8,9% al 12%) y (del 16% a 24%), respectivamente.
Contenti et al [51] consiguen un ABC-COR de 0,83 similar al modelo de Shapiro, pero solo con una variable, la PCT, aunque elevando el PC de ésta a concentraciones mayores de 2,25 ng/ml. Lo que confirma lo ya dicho anteriormente que la inclusión de la PCT en cualquier modelo o como factor individual, hoy en día, debería ser considerada en los SUH como sugieren distintos autores aunque con un PC menor (0,50 ng/ml) [36].
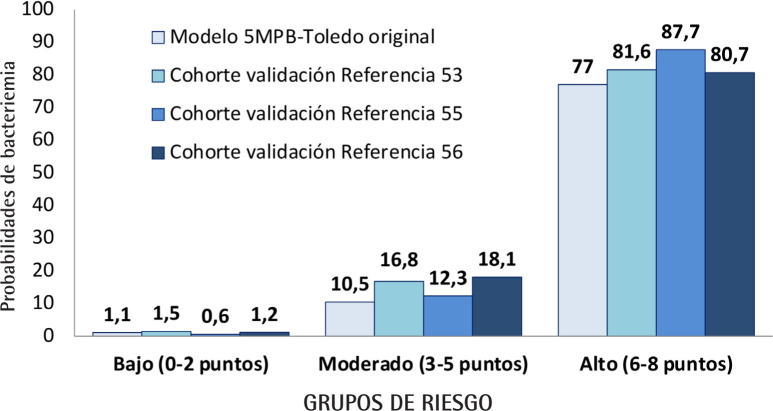
Nuevos modelos que incluyen procalcitonina. La escala original de puntuación 5MPB-Toledo [52] incluye variables fácilmente obtenibles en el primer momento de la atención de los pacientes con sospecha de infección grave: exploratorias (Tª y FR), de comorbilidad (índice de Charlson) y analíticas (recuento de leucocitos y concentración sérica de PCT). Con el análisis de 2.181 episodios de HC extraídos, 262 de ellos con BV (12%), se construyȍ un sistema de puntuación de riesgo en el que se asignó una puntuación a cada variable: Tª>38,3°C (1 punto), ín-dice de Charlson ≥3 (1 punto), FR ≥22 respiraciones por minuto (1 punto), leucocitos >12.000/mm3 (1 punto) y una PCT ≥0,51 ng/ml (4 puntos) [52]. Así, se categorizó a los pacientes en tres grupos distintos de bajo (0-2 puntos), moderado (3-5 puntos) y alto (6-8 puntos) riesgo (Figura 1), con una probabilidad de bacteriemia de 1,1%, 10,5% y 77%, respectivamente. El ABCCOR del modelo fue de 0,946 (IC 95%: 0,933-0,960), rendimiento superior al de todas las escalas antes comentadas [36]. Pero lo más relevante de este modelo (5MPB-Toledo) es que ya ha sido validado en distintos trabajos multicéntricos. El primero [53] con 3.843 episodios de HC, de ellos 839 con BV (21,83%) con una probabilidad de bacteriemia de 1,5%, 16,8% y 81,6%, para los grupos de bajo, moderado y alto riesgo. El ABC-COR del modelo de validación fue de 0,932 (IC 95%: 0,924-0,940). El rendimiento diagnóstico del modelo con un PC ≥ 5 puntos consigue una S del 94,76% (IC 95%: 92,97-96,12), E del 81,56% (IC 95%: 80,11-82,92) y un VPN del 98,24% (IC 95%: 97,62-98,70). En este estudio, además, se analizaron subgrupos con especial interés para los SUH: pacientes en tratamiento con corticoides, con inmunodepresión, dados de alta desde el propio SUH o aquellos que habían recibido antibioterapia en las 72 horas previas a la extracción de los HC. Además, recientemente se han publicado otro estudio que valida el modelo para el proceso infeccioso (NAC) [55] que origina más ingresos en el servicio de Medicina Intensiva y diagnósticos de sepsis y shock sépticos en los SUH y, a la vez, es el segundo foco más frecuente de BV de los HC obtenidos en el SUH [5,6,12-15]. Finalmente, también se ha validado el modelo en los pacientes mayores de 65 años [56], subgrupo que engloba hoy en día al 35% de los pacientes que se atienden el los SUH españoles por un proceso infeccioso [1,2].
Figura 1.
Probabilidades de bacteriemia según grupos de riesgo del modelo 5MPB-Toledo
5MPB-Toledo: Modelo predictivo de bacteriemia de 5 variables de Toledo;
Referencia 53.- Validación del modelo predictivo de bacteriemia (5MPB-Toledo) en los pacientes atendidos en el servicio de urgencias por infección. Enferm Infecc Microbiol Clin. 2022; 40: 102-112
Referencia 55.- Utilidad del modelo 5MPB-Toledo para predecir bacteriemia en el paciente con neumonía adquirida en la comunidad en el Servicio de Urgencias. Rev Esp Quimioter 2021;34:376-382
Referencia 56.- Utilidad del modelo 5MPB-Toledo para predecir bacteriemia en el paciente anciano. Infectio. 2022; 26: 128-136
En la figura 1 se muestran la probabilidad observada de cada grupo de riesgo del modelo original y los estudios de validación del 5MPB-Toledo.
En la tabla 2 se muestra el rendimiento predictivo del modelo 5MPB-Toledo y los distintos estudios y subgrupos de validación, así como los resultados con el PC elegido como óptimo fijado ≥ 5 puntos.
Tabla 2.
Rendimiento predictivo de bacteriemia verdadera del modelo 5MPB-Toledo original y en diferentes estudios y subgrupos, así como del punto de corte ≥ 5 puntos
| Estudio [referencia] Año publicación |
n = pacientes incluidos número BV (%) |
ABC-ROC (IC 95%) del modelo 5MPB-Toledo |
Rendimiento del punto de corte ≥5 | |||
|---|---|---|---|---|---|---|
| Sensibilidad % (IC 95%) |
Especificidad % (IC 95%) |
VPP % (IC 95%) |
VPN % (IC 95%) |
|||
| Original [52] 2020 |
n = 2.181 262 (12%) |
0,946 (0,933-0,960) | nd | nd | nd | nd |
| Validación [53] 2022 |
n = 3.843 839 (21,83%) |
0,932 (0,924-0,940) | 94,76 (92,97-96,12) |
81,56 (80,11-82,92) |
58,93 (56,25-61,57) |
98,24 (97,62-98,70) |
| Pacientes con antibioterapia en las 72 horas previas [53] 2022 |
n = 607 113 (18,56%) |
0,916 (0,883-0,948) | 93,00 (87,99-98,00) |
90,13 (87,54-92,73) |
65,00 (62,36-67,64) |
98,5 (97,86-99,14) |
| Pacientes dados de alta desde el SUH [53] 2022 |
n = 813 180 (22,19%) |
0,961 (0,945-0,977) | 91,42 (84,87-97,98) |
91,25 (89,22-93,28) |
49,62 (47,00-52,24) |
99,06 (98,44-99,68) |
| Pacientes con inmunodepresión [53] 2022 |
n = 541 98 (18,12%) |
0,908 (0,883-0,933) | 99,17 (97,56-100) |
82,38 (78,73-86,02) |
61,98 (59,50-64,46) |
99,76 (99,58-99,94) |
| Pacientes en tratamiento con corticoides [53] 2022 |
n = 215 49 (23,16%) |
0,921 (0,877-0,965) | 95,91 (90,37-100) |
80,93 (75,67-86,18) |
53,39 (50,73-56,05) |
98,88 (98,26-99,50) |
| Validación [55] 2021 |
n = 1.020 162 (15,9%) |
0,915 (0,898-0,933) | 97,5 (95,1-99,9) |
73,2 (70,2-76,2) |
40,9 (36,4-45,1) |
99,4 (99,1-99,8) |
| Validación [56] 2022 |
n = 2.401 579 (24,11%) |
0,908 (0,897-0,924) | 94 (92-96) |
77 (76-79) |
57 (54-60) |
97 (96-98) |
ABC-ROC (IC 95%): Área bajo la curva de la caracteríostica operativa del receptor; 5MPB-Toledo: Modelo predictivo de bacteriemia de 5 variables de Toledo; BV: bacteriemia verdadera; N=número; IC: intervalo de confianza; VPP: valor predictivo positivo;
VPN: valor predictivo negativo; nd: datos no disponibles
Referencia 52.- Modelo 5MPB-Toledo para predecir bacteriemia en los pacientes atendidos por infección en el servicio de urgencias. Emergencias. 2020;32:81-9.
Referencia 53.- Validation of a predictive model for bacteraemia (MPB5-Toledo) in the patients seen in emergency departments due to infections. Enferm Infecc Microbiol Clin. 2022; 40: 102-112. doi.org/10.1016/j.eimc.2020.12.007
Referencia 55.- Utilidad del modelo 5MPB-Toledo para predecir bacteriemia en el paciente con neumonía adquirida en la comunidad en el Servicio de Urgencias. Rev Esp Quimioter 2021;34:376-382
Referencia 56.- Utilidad del modelo 5MPB-Toledo para predecir bacteriemia en el paciente anciano. Infectio 2022; 26: 128-136
Los resultados de estos estudios permiten validar externamente un modelo de riesgo sencillo para predecir bacteriemia en los pacientes adultos atendidos por un episodio de infección en los SUH. Los excelentes ABC-COR obtenidos (tabla 2) y la distribución del porcentaje de BV en cada grupo de riesgo (Figura 1) clasifican a los pacientes en 3 categorías bien diferenciadas. Por su parte, el PC ≥ 5 puntos ofrece en todos ellos una S > 90%, una E > 73% y un VPN > al 97%, lo que representa una garantía evidente para descartar la existencia de bacteriemia en un paciente con diagnóstico clínico de infección. Todo ello supone, si el juicio clínico, el tipo de proceso y las características del paciente lo permiten, que estos puedan ser dados de alta con el tratamiento antimicrobiano adecuado y optimizar la decisión de extracción de los HC en el SUH con eficacia y seguridad [2,24,36].
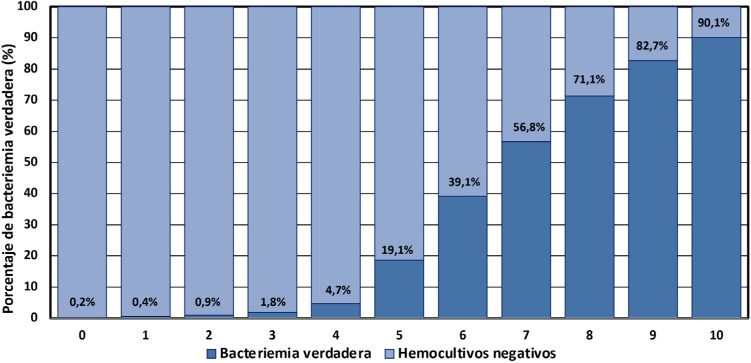
Recientemente, se ha publicado el modelo MPB-INFURGSEMES [59], que aunque se ha desarrollado con otra metodología (grupos de derivación y validación), en realidad añade dos variables más al modelo 5MPB-Toledo [59]. Se trata de un estudio elaborado en 71 SUH españoles con 4.439 casos (70% en el grupo de derivación y 30% en validación) con 889 BV (20,25%). Tras el análisis de regresión logística por el método de introducción, el modelo asignó una puntuación a cada variable de forma que cada paciente podría obtener de 0 a 10 puntos: PCT ≥ 0,51 ng/ml (4 puntos); Tª>38,3°C (1 punto); índice de Charlson ≥3 (1 punto); FR ≥22 respiraciones por minuto (1 punto); leucocitos >12.000/mm3 (1 punto); existencia de tiritona/escalofríos (1 punto) y recuento de plaquetas < 150.000/ mm3 (1 punto). El modelo consigue un excelente ABC-COR en la cohorte de derivación de 0,924 (IC 95%:0,914-0,934) y en la de validación de 0,926 (IC 95%: 0,910-0,942), superior a las publicadas anteriormente [35,36] y solo comparables a las del MPB-Toledo [52,53,55,56]. En este sentido, el MPB-INFURG-SEMES se compara por sus autores con el modelo de Shapiro en la muestra total obteniéndose un ABC-COR de 0,752 (IC 95%: 0.731-0.733) para los criterios de Shapiro (similar a la comunicada en los estudios de validación de dicho modelo) [26,27]. El PC de la escala MPB-INFURG-SEMES con mayor rendimiento conjunto e interés clínico es ≥ 5 puntos, de forma que obtiene una S del 95,94%, E de 76,28%, un VPP de 53,63% y un VPN del 98,50%. Finalmente, un dato relevante es destacado por los autores, que la mortalidad a 30 días de los pacientes con BV de su muestra fue del 16,7% frente al 8,7% cuando los hemocultivos fueron negativos [59]. Por todo ello, por la importancia para la toma de decisiones urgentes en el propio SUH y para estimar el pronóstico del paciente, los autores crearon una calculadora de la escala MPB-INFURG-SEMES (https://mpbscore.urgenciasclinico.com) para que esté disponible para cualquier clínico en los SUH (recordando que no está validada para pacientes de otros entornos como pacientes hospitalizados o de medicina intensiva, ambulatorios de atención primaria, institucionalizados en residencias, etc.). En la figura 2 se describe el riesgo de bacteriemia para cada paciente según la puntuación obtenida con el modelo MPB-INFURG-SEMES y se muestran las recomendaciones de actuación en los SUH para cada caso [59].
Figura 2.
Riesgo de bacteriemia verdadera según la puntuación obtenida en el modelo MPB-INFURG-SEMES y recomendaciones de actuación en el Servicio de Urgencias Hospitalario.
PUNTOS:
0-2 puntos: Riesgo muy bajo. Recomendación: se puede desaconsejar la obtención de hemocultivos.
3 puntos: Bajo riesgo. Recomendación: podría desaconsejarse la obtención de hemocultivos.
4 puntos: Bajo-moderado riesgo. Recomendación: la obtención de hemocultivos y la hospitalización debe valorarse individualmente.
5 puntos: Moderado-alto riesgo. Recomendación: se deben obtener hemocultivos y decidir lugar de hospitalización y antibioterapia
6-7 puntos: Alto riesgo. Recomendación: obtener hemocultivos, decidir ingreso (planta o medicina intensiva) y administrar antibióticos.
8-10 puntos: Riesgo muy alto. Recomendación: obtener hemocultivos, ingreso (planta o medicina intensiva) y administrar antibióticos.
SITUACIONES CLÍNICAS DE ESPECIAL INTERÉS
Algunos procesos, por su importancia cuantitativa y cualitativa (ITU y NAC) o situaciones especiales (pacientes ancianos, inmunodeprimidos y neutropénicos) [35,36], donde las manifestaciones clínicas son más inespecíficas y el pronóstico más incierto y difícil, merecen algunas consideraciones especiales.
Neumonía adquirida en la Comunidad. En la actualidad (sin incluir los episodios de neumonía por la COVID-19), el 1-2% de los pacientes que se atienden en los SUH se diagnostican de NAC [4,21,66]. Su incidencia oscila entre 2-5 casos/1.000 habitantes/año [2,21]. En su atención inicial se toman HC en el 15-20% de los episodios [2,21]. La NAC es responsable de la mayoría de sepsis y shock sépticos diagnosticados en los SUH. Asimismo, representa la primera causa de muerte y de ingreso en la unidad de cuidados intensivos (UCI) (2-10%) por enfermedad infecciosa desde los SUH [2,21]. Se le atribuye una mortalidad global del 10-14% a los 30 días según la edad y factores de riesgo asociados, entre ellos la coexistencia de bacteriemia que aumenta la mortalidad hasta el 20-25% [2,5,21]. En más del 75-80% de las NAC con bacteriemia se confirma S. pneumoniae como el patógeno causal [65,67].
La capacidad de la PCT para predecir o descartar la existencia de bacteriemia en la NAC ha sido confirmada por distintos autores, aunque el PC adecuado continua siendo el punto más controvertido, las distintas propuestas varían considerablemente en un intervalo entre 0,10-2 ng/ml [68]. Aunque se ha estimado como válido un PC ≥ 0,51 ng/ml para predecir bacteriemia en la NAC, cuando las concentraciones de PCT son superiores a 0,95 ng/ml, la probabilidad de predecir bacteriemia por S. pneumoniae es mucho mayor, con un ABC-COR de 0,97 (IC 95%: 0,90-0,99), una S del 95%, una E del 91% y un VPN del 99% [36,65,67,68]. Este aspecto es relevante incluso en las NAC afebril o con hipotermia que se presentan en el SUH con BV por S. pneumoniae que pueden representar hasta el 4,7% y 4,3%, respectivamente, de las BV en pacientes con NAC [68,69]. Por ello, y como se ha discutido la conveniencia o no de extrae HC en todos los pacientes con NAC en el SUH por su baja rentabilidad y alto coste [70], se justifica que en aquellos pacientes con NAC y una PCT ≥ 0,51 ng/ml se extraigan HC y se elija una antibioterapia adecuada para una posible NAC bacteriémica por S. pneumoniae [21,68].
Aunque se han publicado recientemente distintos mode-los predictivos de bacteriemia en pacientes con NAC, ninguno consigue el rendimiento del MPB-Toledo [52,55] o el MPB-INFURG-SEMES [59] en estos pacientes valorados en los SUH. Así, uno de ellos de Kim et al [71]., realizado en 8 SUH clasificó a los enfermos en grupos de bajo (1,2% de BV), moderado (7,2% de BV) y alto riesgo (31,5% de BV). El ABC-COR para el mode-lo de bacteriemia en la cohorte de validación externa fue de 0,81, mostrando una S y E de la sensibilidad y especificidad de 68% 81%, respectivamente. En este modelo se utiliza la PCR como BMRII. Este mismo rendimiento con ABC-COR significativamente menores a las de los modelos que incluyen la PCT, ya se habían publicado y validado hace años específicamente para las NAC siendo hasta ahora referencias para este proceso infeccioso, como en el caso de los modelos de Lee et al [72] y Falgera et al [73].
Por ello, y por los resultados antes comentados, los autores creen justificado y oportuno utilizar los modelos 5MPB-Toledo [52] y el MPB-INFURG-SEMES [59] que coinciden con las recomendaciones ya efectuadas anteriormente años atrás por distintas sociedades científicas para indicar la extracción de HC en el SUH en los episodios de NAC [21,36,68].
Infección del tracto urinario. La ITU es uno de los procesos infecciosos más frecuentes atendidos en los SUH, en la actualidad alrededor del 3-4% de los pacientes que se atienden se diagnostican de este proceso [1,2,20]. En su atención se toman muestras para estudios microbiológicos en un 66% de los casos [2,20]. Entre ellos, por detrás del cultivo de orina (52,8%), predomina la obtención de hemocultivos (HC) que se realiza en el 13,7% de pacientes con el diagnóstico de ITU en el SUH, aunque su indicación es variable [2,20]. Las ITU son responsables de un relevante número de los casos de sepsis y shock sépticos diagnosticados en los SUH (solo por detrás de las infecciones respiratorias de vías bajas) [2,20]. Aunque, la mortalidad intrahospitalaria y a los 30 días de los pacientes con ITU es inferior a la mayoría de las infecciones diagnosticadas en los SUH (3-5% frente al 10-15% de forma global) [4-7]. Pero, cuando existe bacteriemia asociada a la ITU la mortalidad puede aumentar hasta 3-4 veces más que en los mismos procesos sin bacteriemia [2,5,13,20].
Clásicamente, el interés de los BMRII en las ITU en los SUH [74] se ha centrado en distinguir las infecciones no complicadas de los casos de pielonefritis agudas (PNA) y las sepsis de origen urológico. Van Nieuwkoop et al [75], en un estudio de 581 pacientes adultos, encontraron que para distinguir una ITU no complicada de una PNA con una PCT > 0,25 ng/ml se obtenía una S del 95% (IC 95%: 0,89-0,98) y una E del 50% (IC 95%: 0,46-0,55), por lo que una PCT >0,25ng/ml debe hacer sospechar PNA, y valores >1 ng/ml bacteriemia y sepsis urológica [36,75]. En este estudio, con un PC > 0,25 ng/ml de PCT, consigue una S del 95% (IC 95%: 89%-98%) y E del 50% (IC 95%: 46%-55%) para sospechar bacteriemia [75]. No obstante, no se ha aclaró algo cuestionado desde hace años, y es a qué pacientes con ITU se les debería indicar la extracción de HC [36]. Julián et al [76], recomiendan obtener HC en los pacientes con ITU siempre que la PCT sea >1 ng/ml, ya que establecen que para un PC ≥ 1,16 ng/ml el rendimiento es muy importante con una S del 100%, una E del 97%, un VPN del 100%, y un ABC de 0,99 (IC95%: 0,98-1).
En realidad, en los últimos años se han publicado distintos modelos predictivos de BV en pacientes con ITU [77-79], pero todos ellos tienen una muestra muy limitada (menos de 400 pacientes con ITU) y unos resultados significativamente menores a los comentados anteriormente cuando se analizan los subgrupos de pacientes con ITU en los modelos 5MPB-Toledo [52] y MPB-INFURG-SEMES [59], por lo que no pueden ser recomendados de forma generalizada. Incluso alguno de ellos se ha comparado con el modelo de Shapiro obteniendo peores resultados que éste [78]. En relación a la utilidad del modelo 5MPB-Toledo en los pacientes con ITU (resultados no publicados de los autores) en una muestra de 1.499 episodios con 277 BV (18,5%) el ABC-COR del modelo fue de 0,937 (IC 95%:0,926-0,949) y el rendimiento diagnóstico del mode-lo con un PC ≥5 puntos consigue una S de 97,47% (IC 95%: 94,64-98,89), E de 76,68% (IC 95%: 74,18-79,00) y un VPN de 99,26% (IC 95%: 98,41-99,67). En este caso la probabilidad de BV en función del grupo de bajo (0-2 puntos), moderado (3-5 puntos) o alto (6-8 puntos) riesgo es de 1,2%, 11,1%, y 70,2%, respectivamente. Resultados en la línea del resto de estudios de validación de dicho modelo (figura 1). En este sentido, como ya se ha hecho con la NAC [24], la valoración de los enfermos con ITU en los SUH con los modelos elegidos de predicción de BV y gravedad clínica, pueden ser herramientas que optimicen las decisiones y lugar de tratamiento antimicrobiano [80].
Pacientes mayores. Un dato relevante es que el 51% NAC y el 36% de las ITU que se diagnostican en los SUH lo son en pacientes con ≥70 años [1,2,5,21], no en vano el 35% de los enfermos diagnosticados de procesos infecciosos en los SUH tienen más de 65 años. Y, es conocido, que en este subgrupo poblacional es más difícil establecer el diagnóstico, encontrar la indicación adecuada de extraer HC, se presentan con mayor gravedad clínica y las tasas de bacteriemia y mortalidad a corto y largo plazo son superiores [2,21].
En relación con este subgrupo etario, recientemente se han publicado pocos estudios, por lo que los clásicos siguen siendo la referencia [23,36,81,82]. Por ello, en este caso nos remitimos a los resultados del estudio de validación de los nuevos modelos [56]. En él se incluyeron 2.401 pacientes. De ellos, se consideró como BV a 579 (24,11%). Los resultados del riesgo de BV según la categorización de los grupos y el rendimiento del PC ≥ 5 puntos de la escala 5MPB-Toledo se pueden consultar en la tabla 2 y la figura 1. Según estos, en la actualidad, los autores también recomiendan estas escalas con PCT para valorar el riesgo de BV en los pacientes con sospecha de infección bacteriemia en los SUH.
PREVISIONES DE FUTURO
Aunque aún no son habituales en los SUH, se han publicado modelos de predicción a través de redes neuronales artificiales combinando varios BMRII como son la PCT, IL-6, lactato y dímero D. Aún así, son estudios con poca muestra y que consiguen un rendimiento prometedor (sensibilidad de 82% y especificidad de 85%) en los que la PCT con un PC > 2 ng/ml, es el factor que más peso aporta al método [83]. En este sentido, Choi et al [84], recientemente han publicado un estudio en el que desarrollan varios modelos de predicción con calculadoras que utilizan variables conseguidas en el triaje inicial del paciente (datos demográficos, signos vitales, nivel de triaje y analíticos urgentes) y que consiguen desde un ABC de 0,718 hasta un ABC de 0,853, superior a otros modelos pero no de forma significativa .
Otro trabajo recientemente publicado de Lee et al [85] usando inteligencia artificial y con una muestra retrospectiva de 622.771 hemocultivos y 38.752 BV consigue un ABC-COR de datos de 12 y 24 horas de 0,762 (IC 95%: 0,7617-0,7623) y 0,753 (IC 95%: 0,752-0,753), respectivamente.
Otra línea de estudio la aporta una propuesta de árboles de decisión donde se selecciona los pacientes (según la existencia de SRIS ≥2, qSOFA≥ 2, criterios de Shapiro o el MEDS) del grupo definido de alto riesgo de bacteriemia para realizar de forma urgente técnicas de detección rápida [86,87], el problema de estos modelos es que aunque consiguen una alta S, la E es muy baja, por lo que, de momento, no pueden ser recomendados de forma rutinaria.
En un futuro muy cercano, en la atención al paciente con infección grave en los SUH, en el propio triaje se dispondrá de escalas o modelos automáticos o electrónicos que seleccionarán a los pacientes con alta probabilidad de infección bacteria-na, a los que se les aplicará los modelos predictivos de bacteriemia y gravedad-mortalidad, de forma que se pueda optimizar el diagnóstico microbiológico (indicación de obtener HC) y las medidas terapéuticas (antibioterapia adecuada y precoz, control del foco) [2,88,89].
CONCLUSIONES Y RECOMENDACIONES
A partir de la evidencia acumulada sobre todo lo comentado de la capacidad de los nuevos modelos predictivos de bacteriemia con disponibilidad para ser evaluados, hoy en día, en los SUH, podemos decir que tanto el 5MPB-Toledo como el MPB-INFURG-SEMES representan herramientas útiles para la estratificación del riesgo real de BV en los pacientes atendidos en los SUH por los distintos procesos infecciosos que se valoran en dichos dispositivos. Ambos, son capaces de predecirla con variables fácilmente obtenibles en la primera valoración del paciente con sospecha o confirmación de padecer una infección. Pero, siempre, junto al juicio clínico y otras variables independientes del proceso y del paciente. De esta forma, facilitan la toma de decisión de indicación de obtención de HC y la estrategia diagnóstico-terapéutica. Además, se ha comprobado que consiguen un mayor rendimiento que el clásico modelo de Shapiro et al [26], hasta ahora la mayor referencia y más utilizado en los SUH [35,36].
FINANCIACION
Los autores declaran no haber recibido ninguna financiación para la realización de este estudio.
CONFLICTO DE INTERESES
- AJJ ha participado en reuniones científicas organizadas por Bayer, Boehringer, Esteve, GSK, Lilly, MSD, Pfizer, Tedec Meiji, Roche, Thermo Fisher Scientific, B.R.A.H.M.S. AG, ViroGates y Biomerieux.
- JGC ha participado en reuniones científicas organizadas por Bayer, Boehringer, GSK, MSD, Pfizer, Tedec Meiji, Thermo Fisher Scientific, Laboratorios Rubio, Rovi, LeoPharma, Sanofi, Bristol Myers Squibb, AstraZeneca, Novo Nordisk y Angelini.
- FJC ha participado en reuniones organizadas por MSD, Pfizer, Astellas, Gilead, Novartis, Astra-Zeneca, Tedec Meiji, Angelini, Bayer, GSK y ERN.
- RRD declara la no existencia de conflictos de intereses.
Ningún autor ha recibido compensación económica por participar en este trabajo.
References
- 1.Martínez Ortiz de Zárate M, González del Castillo J, Julián-Jiménez A, Piñera Salmerón P, Llopis Roca F, Guardiola Tey JM, et al. Estudio INFURG-SEMES: epidemiología de las infecciones atendidas en los servicios de urgencias hospitalarios y evolución durante la última década. Emergencias 2013; 25:368-78. [Google Scholar]
- 2.Julián-Jiménez A, Supino M, López Tapia JD, Ulloa González C, Vargas Téllez LE, González del Castillo J, et al. Puntos clave y controversias sobre la sepsis en los servicios de urgencias: propuestas de mejora para Latinoamérica. Emergencias 2019;31:123-135. PMid: [PubMed] [Google Scholar]
- 3.Julián-Jiménez A, García DE. Acerca de cómo los servicios de urgencias españoles hicieron frente a la primera oleada de pacientes durante la pandemia COVID-19. Emergencias. 2020;32:307-8. PMid: [PubMed] [Google Scholar]
- 4.Julián-Jiménez A, García DE, González Del Castillo J, Penna Guimaraes H, García-Lamberechts EJ, Menéndez E, et al. Puntos clave sobre la COVID-19 en los servicios de urgencias: propuestas de mejora para su atención en Latinoamérica. Emergencias. 2021;33:42-58. PMid: [PubMed] [Google Scholar]
- 5.Cisneros-Herreros JM, Cobo-Reinoso J, Puyol-Rojo M, Rodríguez-Baño J, Salavert-Lleti M. Guía para el diagnóstico y tratamiento del paciente con bacteriemia. Guías de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC). Enferm Infecc Microbiol Clin. 2007;25:111-30. doi: 10.1016/s0213-005x(07)74242-8. [DOI] [PubMed] [Google Scholar]
- 6.Mormeneo Bayo S, Moreno Hijazo M, Palacián Ruíz MP, Villuendas Usón MC. Impacto del SARS-CoV-2 en el diagnóstico de bacteriemia comunitaria en un hospital terciario. Rev Esp Quimioter. 2022;35: 80-83. doi: 10.37201/req/104.2021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Guna Serrano MR, Larrosa Escartín N, Marín Arriaza M, Rodríguez Díaz JC. Diagnóstico microbiológico de la bacteriemia y fungemia: hemocultivos y métodos moleculares. Enferm Infecc Microbiol Clin. 2019;37:335-40. doi: 10.1016/j.eimc.2018.03.005. [DOI] [PubMed] [Google Scholar]
- 8.Allerberger F, Kern WV. Bacterial bloodstream infection. Clin Micro-biol Infect. 2020;26:140-141. doi: 10.1016/j.cmi.2019.10.004 [DOI] [PubMed] [Google Scholar]
- 9.Oviaño M. Rapid identification of microorganisms directly from positive blood cultures by MALDI-TOF MS. Enferm Infecc Microbiol Clin. 2019;37:287-9. doi: 10.1016/j.eimc.2018.12.007 [DOI] [PubMed] [Google Scholar]
- 10.Vardakas KZ, Anifantaki FI, Trigkidis KK, Falagas ME. Rapid molecular diagnostic tests in patients with bacteremia: evaluation of their impact on decision making and clinical outcomes. Eur J Clin Microbiol Infect Dis. 2015;34:2149-60. doi: 10.1007/s10096-015-2466-y [DOI] [PubMed] [Google Scholar]
- 11.Freud Y, Philippon AL. Patients with infections in the emergency department: What should we look for?. Emergencias 2020;32:75-76. PMid: [PubMed] [Google Scholar]
- 12.López-Izquierdo R, Ramos-Sánchez MC, Eiros JM. Análisis estacional de los hemocultivos solicitados desde un servicio de urgencias hospitalario. Emergencias. 2021;33:70-1. PMid: [PubMed] [Google Scholar]
- 13.Rubio Díaz R, Nieto Rojas I, Julián-Jiménez A. Importancia de los resultados de los hemocultivos: especial atención para los solicitados desde los Servicios de Urgencias. Rev Esp Quimioter. 2020;33:459-61. doi: 10.37201/req/075.2020 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Zafar Iqbal-Mirza S, Serrano Romero de Ávila V, Estévez-González R, Rodríguez-González D, Heredero-Gálvez E, Julián-Jiménez A. Ability of procalcitonin to differentiate true bacteraemia from contaminated blood cultures in an emergency department. Enferm Infecc Microbiol Clin. 2019;37:560-568. doi: 10.1016/j.eimc.2019.01.012 [DOI] [PubMed] [Google Scholar]
- 15.Mòdoll Deltell JM, Tudela Hita P. Bacteriemia oculta o bacteriemia en pacientes adultos dados de alta desde Urgencias. Med Clin (Barc). 2014;142:111–3. doi: 10.1016/j.medcli.2013.09.010. [DOI] [PubMed] [Google Scholar]
- 16.Rubio Díaz R, Nieto Rojas I, Julián-Jiménez A. Importancia de la predicción de bacteriemia en los servicios de urgencias: seis años después. Enferm Infecc Microbiol Clin. 2021;39:102-10. doi: 10.1016/j.eimc.2020.04.006 [DOI] [PubMed] [Google Scholar]
- 17.Yunquera-Romero L, Márquez-Gómez I, Henares-López A, Morales-Lara MJ, Gallego Fernández C, Asensi-Díez R. Appropriateness of antimicrobial prescriptions in the emergency department of a tertiary hospital. Rev Esp Quimioter. 2018;31:209-16. PMid: [PMC free article] [PubMed] [Google Scholar]
- 18.Julián-Jiménez A. Rubio-Díaz R. Blood cultures in the emergency department: Can we predict cases of bacteremia? Emergencias. 2019;31:375-6. PMid: [PubMed] [Google Scholar]
- 19.Long B, Koyfman A. Best Clinical Practice: Blood Culture Utility in the Emergency Department. J Emerg Med. 2016;51:529-39. doi: 10.1016/j.jemermed.2016.07.003 [DOI] [PubMed] [Google Scholar]
- 20.Gálvez San Román JL, Jiménez Hidalgo C, Portillo Cano MM, García Sánchez M, Navarro Bustos C, Julián-Jiménez A, et al. (En representación del grupo INFURG-SEMES) . Características y cambios epidemiológicos de los pacientes con infección del tracto urinario en los servicios de urgencias hospitalarios. An Sist Sanit Navar. 2016;39:370-6. doi: 10.4321/S1137-6627/2016000100005 [DOI] [PubMed] [Google Scholar]
- 21.Julián-Jiménez A, Adán Valero I, Beteta López A, Cano Martín LM, Fernández Rodríguez O, Rubio Díaz R, et al. Recomendaciones para la atención del paciente con neumonía adquirida en la comunidad en los Servicios de Urgencias. Rev Esp Quimioter. 2018;31:186-202. doi: 10.4321/s1137-6627/2016000100005 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Martín-Sánchez FJ, González del Castillo J. Sepsis en el anciano: ¿están preparados los servicios de urgencias hospitalarios? Emergencias. 2015;27:73-4. PMid: [PubMed] [Google Scholar]
- 23.Lai CC, Chen SY, Wang CY, Wang JY, Su CP, Liao CH, et al. Diagnostic value of procalcitonin for bacterial infection in elderly patients in the emergency department. J Am Geriatr Soc. 2010;58:518-22. doi: 10.1111/j.1532-5415.2010.02730.x. [DOI] [PubMed] [Google Scholar]
- 24.Evans L, Rhodes A, Alhazzani W, Antonelli M, Coopersmith CM, French C, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med. 2021;47:1181-1247. doi: 10.1007/s00134-021-06506-y [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Tudela P, Giménez M, Mòdol JM. Hemocultivos en los servicios de urgencias, ¿hacia un nuevo enfoque? Med Clin (Barc). 2016;146:455-9. doi: 10.1016/j.medcli.2015.11.026 [DOI] [PubMed] [Google Scholar]
- 26.Shapiro NI, Wolfe RE, Wright SB, Moore R, Bates DW. Who needs a blood culture? A prospectively derived and validated prediction rule. J Emerg Med. 2008;35:255-64. doi: 10.1016/j.jemermed.2008.04.001 [DOI] [PubMed] [Google Scholar]
- 27.Jessen MK, Mackenhauer J, Hvass AMW, Ellermann-Eriksen S, Skibs-ted S, Kirkegaard H, et al. Prediction of bacteremia in the emergency department: An external validation of a clinical decision rule. CONSIDER Sepsis Network. Eur J Emerg Med. 2016; 23: 44–9. doi: 10.1097/mej.0000000000000203 [DOI] [PubMed] [Google Scholar]
- 28.Cuervo A, Correa J, Garcés D, Ascuntar J, León A, Jaimes F A. Desarrollo y validación de un modelo predictor para bacteriemia en pacientes hospitalizados por el servicio de urgencias con sospecha de infección. Rev Chilena Infectol. 2016; 33: 150-8. doi: 10.4067/S0716-10182016000200004. [DOI] [PubMed] [Google Scholar]
- 29.Tudela P, Lacoma A, Pract C, Mòdol J M, Giménez M, Barallat J, et al. Predicción de bacteriemia en los pacientes con sospecha de infección en urgencias. Med Clin (Barc). 2010; 135: 685-90. doi: 10.1016/j.medcli.2010.04.009. [DOI] [PubMed] [Google Scholar]
- 30.Su CP, Chen TH, Chen SY, Ghiang WC, Wu GH, Sun HY, et al. Predictive model for bacteremia in adult patients with blood cultures performed at the emergency department: a preliminary report. J Microbiol Immunol Infect. 2011;44:449-55. doi: 10.1016/j.jmii.2011.04.006. [DOI] [PubMed] [Google Scholar]
- 31.Coburn B, Morris A.M, Tomlinson G, Detsky AS. Does This Adult Pa-tient With Suspected Bacteremia Require Blood Cultures? JAMA. 2012;308:502-511. doi: 10.1001/jama.2012.8262 [DOI] [PubMed] [Google Scholar]
- 32.Eliakim-Raz N, Bates DW, Leibovici L. Predicting bacteraemia in validated models—a systematic review. Clin Microbiol Infect. 2015; 21: 295–301. doi: 10.1016/j.cmi.2015.01.023 [DOI] [PubMed] [Google Scholar]
- 33.Ching-Chi L, Chi-Jung W, Chih-Hsien C, Nan-Yao L, Po-Lin C, HsinChun L, et al. Prediction of community-onset bacteremia among febrile adults visiting an emergency department: rigor matters. Diagn Microbiol Infect Dis. 2012;73:168-73. doi: 10.1016/j.diagmicrobio.2012.02.009 [DOI] [PubMed] [Google Scholar]
- 34.Komatsu T, Takahashi E, Mishima K, Toyoda T, Saitoh F, Matsuoka J, et al. A Simple Algorithm for Predicting Bacteremia Using Food Consumption And Shaking Chills: A Prospective Observational Study. J Hosp Med. 2017;12:510-5. doi: 10.12788/jhm.2764. [DOI] [PubMed] [Google Scholar]
- 35.Julián-Jiménez A, Candel-González FJ, González del Castillo J. Utilidad de los biomarcadores de inflamación e infección en los servicios de urgencias. Enferm Infecc Microbiol Clin. 2014;32:177–90. doi: 10.1016/j.eimc.2013.01.005 [DOI] [PubMed] [Google Scholar]
- 36.Julián-Jiménez A, Candel González FJ, González del Castillo J. Utilidad de los biomarcadores para predecir bacteriemia en los pacientes con infección en urgencias. Rev Esp Quimioter. 2017;30:245-56. PMid: [PubMed] [Google Scholar]
- 37.Gómez-Angelats E. Triaje, predicción de ingreso y constantes vitales. Emergencias. 2020;32:381-2. PMid: [PubMed] [Google Scholar]
- 38.Carbó M, Fresco L, Osorio G, Monclús E, Ortega M. Factores predictivos de mortalidad en los pacientes con sepsis y un valor del indicador ‘Quick Sequential Organ Failure Assessment’ (qSOFA) de 2 o 3 puntos atendidos en un servicio de urgencias. Emergencias. 2020;32:169-76. PMid: [PubMed] [Google Scholar]
- 39.Levy MM, Fink M P, Marshall JC, Abraham E, Angus D, Cook D, et al. “2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference”. Intensive Care Med. 2003;29:530-8. doi: 10.1007/s00134-003-1662-x [DOI] [PubMed] [Google Scholar]
- 40.Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016;315:801-10. doi: 10.1001/jama.2016.0287. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Otani T, Ichiba T, Seo K, Naito H. Clinical prediction rule is more useful than qSOFA and the Sepsis-3 definition of sepsis for screening bacteremia. Am J Emerg Med. 2021;46:84-89. doi: 10.1016/j.ajem.2021.03.023 [DOI] [PubMed] [Google Scholar]
- 42.Hyak JM, Al Mohajer M, Musher DM, Musher BL. Clinical prediction of bacteremia and early antibiotics therapy in patients with solid tumors. Infect Control Hosp Epidemiol. 2021;28:1-7. doi: 10.1017/ice.2021.314 [DOI] [PubMed] [Google Scholar]
- 43.Zafar Iqbal-Mirza S, Estévez-González R, Serrano-Romero de Ávila V, de Rafael González E, Heredero-Gálvez E, Julián-Jiménez A. Factores predictores de bacteriemia en los pacientes atendidos en el Servicio de Urgencias por infección Rev Esp Quimioter. 2020;33:32-43. doi: 10.37201/req/075.2019 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Laukemann S, Kasper N, Kulkarni P, Steiner D, Rast AC, Kutz A, et al. Can We Reduce Negative Blood Cultures With Clinical Scores and Blood Markers? Results From an Observational Co-hort Study. Medicine (Baltimore). 2015;94:e2264. doi: 10.1097/MD.0000000000002264. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Tudela P, Prat C, Lacoma A, Mòdol JM. Biomarcadores y sospecha de infección en los servicios de urgencias. Med Clin (Barc). 2012;139:33-7. doi: 10.1016/j.medcli.2011.09.018. [DOI] [PubMed] [Google Scholar]
- 46.Anand D. Procalcitonin as a rapid diagnostic biomarker to differentiate between culture-negative bacterial sepsis and systemic inflammatory response syndrome: a prospective, observational, cohort study. J Crit Care. 2015;30:218:e7-12. doi: 10.1016/j.jcrc.2014.08.017. [DOI] [PubMed] [Google Scholar]
- 47.Loonen AJ, de Jager CP, Tosserams J, Kusters R, Hilbink M, Wever PC, van den Brule AJ. Biomarkers and molecular analysis to improve bloodstream infection diagnostics in an emergency care unit. PLoS One. 2014;9:e87315. doi: 10.1371/journal.pone.0087315 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Chotirmall SH, Callaly E, Lyons J, O’Connell B, Kelleher M, Byrne D, et al. Blood cultures in emergency medical admissions: a key patient cohort. Eur J Emerg Med. 2016, 23:38–43.doi: 10.1097/MEJ.0000000000000192. [DOI] [PubMed] [Google Scholar]
- 49.Naffaa M, Makhoul BF, Tobia A, Kaplan M, Aronson D, Azzam ZS, et al. Procalcitonin and interleukin 6 for predicting blood culture positivity in sepsis. Am J Emerg Med. 2014;32:448-51. doi: 10.1016/j.ajem.2013.12.058 [DOI] [PubMed] [Google Scholar]
- 50.Leli C, Ferranti M, Marrano U, Al Dhahab ZS, Bozza S, Cenci E, et al. Diagnostic accuracy of presepsin (sCD14-ST) and procalcitonin for prediction of bacteriemia and bacterial DNAaemia in patients with suspected sepsis. J Med Microbiol. 2016;65:713-9. doi: 10.1099/jmm.0.000278. [DOI] [PubMed] [Google Scholar]
- 51.Contenti J, Occelli C, Lemoel F, Ferrari P, Levraut J. Presepsin versus other biomarkers to predict sepsis and septic shock in patients with infection defined by Sepsis-3 criteria: the PREDI study of diagnostic accuracy. Emergencias. 2019. 31:311-7. PMid: [PubMed] [Google Scholar]
- 52.Julián-Jiménez A, Iqbal-Mirza SZ, de Rafael González E, EstévezGonzález R, Serrano-Romero de Ávila V, Heredero-Gálvez E, et al. Modelo 5MPB-Toledo para predecir bacteriemia en los pacientes atendidos por infección en el servicio de urgencias. Emergencias. 2020;32:81-9. PMid: [PubMed] [Google Scholar]
- 53.Julián-Jiménez A, García-Lamberechts EJ, González del Castillo J, Navarro Bustos C, Llopis-Roca F, Martínez-Ortiz de Zarate M, et al. Validation of a predictive model for bacteraemia (MPB5-Toledo) in the patients seen in emergency departments due to infections. Enferm Infecc Microbiol Clin. 2022; 40: 102-112. doi: 10.1016/j.eimc.2020.12.007 [DOI] [PubMed] [Google Scholar]
- 54.Lamy B, Sundqvist M, Idelevich EA; ESCMID Study Group for Bloodstream Infections, Endocarditis and Sepsis (ESGBIES) . Bloodstream infections-Standard and progress in pathogen diagnostics. Clin Microbiol Infect. 2020;26:142-150. doi: 10.1016/j.cmi.2019.11.017 [DOI] [PubMed] [Google Scholar]
- 55.Julián-Jiménez A, González del Castillo J, García-Lamberechts EJ, Rubio Díaz R, Huarte Sanz I, Navarro Bustos C, et al. Utilidad del modelo 5MPB-Toledo para predecir bacteriemia en el paciente con neumonía adquirida en la comunidad en el Servicio de Urgencias. Rev Esp Quimioter 2021;34:376-82. doi: 10.37201/req/043.2021 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Julián-Jiménez A, García-Lamberechts EJ, González del Castillo J, Rubio Díaz R, Huarte Sanz I, Navarro Bustos C, et al. Utilidad del modelo 5MPB-Toledo para predecir bacteriemia en el paciente anciano. Infectio 2022; 26:128-36. doi: 10.22354/in.v26i [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Thomas-Rüddel DO, Poidinger B, Kott M, Weiss M, Reinhart K, Bloos F; MEDUSA study group . Influence of pathogen and focus of infection on procalcitonin values in sepsis patients with bacteremia or candidemia. Crit Care. 2018;22:128. doi: 10.1186/s13054-018-2050-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Arévalo-Buitrago P, Morales-Cané I, Olivares Luque E, Guler I, Rodríguez-Borrego MA, López-Soto PJ. Capacidad predictiva de las escalas de alerta temprana en los servicios de urgencias hospitalarios: revisión sistemática y metanálisis. Emergencias. 2021;33:374-81. PMid: [PubMed] [Google Scholar]
- 59.Julián-Jiménez A, González Del Castillo J, García-Lamberechts EJ, Huarte Sanz I, Navarro Bustos C, Rubio Díaz R, et al. ; INFURG-SEMES investigators . A bacteraemia risk prediction model: development and validation in an emergency medicine population. Infection. 2022;50:203-221. doi: 10.1007/s15010-021-01686-7. [DOI] [PubMed] [Google Scholar]
- 60.Llopis-Roca F, López Izquierdo R, Miro O, García-Lamberechts JE, Julián Jiménez A, González del Castillo J. Mapa de la situación actual de la atención a la sepsis en los servicios de urgencias españoles. Rev Esp Quimioter 2022; 35:192-203. doi: 10.37201/req/150.2021 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Julián-Jiménez A, Timón-Zapata J, Laserna-Mendieta EJ, CabezasMartínez A. Utilidad de los hemocultivos en los servicios de urgencias. Rev Clin Esp. 2011;211:609-10. doi: 10.1016/j.rce.2010.12.017. [DOI] [PubMed] [Google Scholar]
- 62.Hoeboer SH, van der Geest PJ, Nieboer D, Groeneveld ABJ. The diagnostic accuracy of procalcitonin for bacteriemia: a systematic review and meta-analysis. Clin Microbiol Infect. 2015;21:474-81. doi: 10.1016/j.cmi.2014.12.026. [DOI] [PubMed] [Google Scholar]
- 63.Honore PM, De Bels D, Attou R, Redant S, Gallerani A, Kashani K. Influence of pathogen and focus of infection on procalcitonin values in sepsis: are there additional confounding factors? Crit Care. 2019:13;23:215. doi: 10.1186/s13054-019-2499-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Varela-Patiño M, Lopez-Izquierdo R, Velayos-Garcia P, Alvarez-Manzanares J, Ramos-Sánchez C, Carbajosa-Rodriguez V, MartinRodríguez F, Eiros JM. Usefulness of infection biomarkers for diagnosing bacteremia in patients with a sepsis code in the emergency department. Infez Med. 2020;28:29-36. PMid: [PubMed] [Google Scholar]
- 65.Julián-Jiménez A, Timón-Zapata J, Laserna-Mendieta EJ, Parejo R, Flores-Chacartegui M, Gallardo P. Capacidad de la procalcitonina para predecir bacteriemia en pacientes con neumonía adquirida en la comunidad. Med Clin (Barc). 2014;142: 285-292. doi: 10.1016/j.medcli.2013.05.046. [DOI] [PubMed] [Google Scholar]
- 66.González del Castillo J, Julián Jiménez A, Candel FJ. Neumonía comunitaria: selección del tratamiento empírico y terapia secuencial. Implicaciones del SARS-CoV-2. Rev Esp Quimioter. 2021;34: 599-609. doi: 10.37201/req/144.2021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Julián-Jiménez A, Timón J, Laserna EJ, Sicilia-Bravo I, Palomo MJ, Cabezas-Martínez A, et al. Poder diagnóstico y pronóstico de los biomarcadores para mejorar el manejo de la neumonía adquirida en la comunidad en los servicios de urgencias. Enferm Infecc Microbiol Clin. 2014; 32: 225-35. doi: 10.1016/j.eimc.2013.04.015. [DOI] [PubMed] [Google Scholar]
- 68.Julián-Jiménez A, González del Castillo J, Candel-González FJ. Utilidad y valor pronóstico de los biomarcadores en los pacientes con neumonía adquirida en la comunidad en los servicios de urgencias. Med Clin (Barc). 2017;148:501–10. doi: 10.1016/j.medcli.2017.02.024 [DOI] [PubMed] [Google Scholar]
- 69.Forstner C, Patchev V, Rohde G, Rupp J, Witzenrath M, Welte T, Burgmann H, Pletz MW; CAPNETZ Study Group . Rate and Predictors of Bacteremia in Afebrile Community-Acquired Pneumonia. Chest. 2020;157:529-39. doi: 10.1016/j.chest.2019.10.006 [DOI] [PubMed] [Google Scholar]
- 70.Zhang D, Yang D, Makam AN. Utility of Blood Cultures in Pneumonia. Am J Med. 2019;132:1233-8. doi: 10.1016/j.amjmed.2019.03.025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71.Kim B, Choi J, Kim K, Jang S, Shin TG, Kim WY, Kim JY, Park YS, Kim SH, Lee HJ, Shin J, You JS, Kim KS, Chung SP. Bacteremia Prediction Model for Community-acquired Pneumonia: External Validation in a Multicenter Retrospective Cohort. Acad Emerg Med. 2017;24:1226-34. doi: 10.1111/acem.13255. [DOI] [PubMed] [Google Scholar]
- 72.Lee J, Hwang SS, Kim K, Jo YH, Lee JH, Kim J, Rhee JE, Park C, Chung H, Jung JY. Bacteremia prediction model using a common clinical test in patients with community-acquired pneumonia. Am J Emerg Med. 2014;32:700-4. doi: 10.1016/j.ajem.2014.04.010 [DOI] [PubMed] [Google Scholar]
- 73.Falguera M, Trujillano J, Caro S, Menéndez R, Carratalà J, RuizGonzález A, Vilà M, García M, Porcel JM, Torres A; NAC-CALIDAD Study Group . A prediction rule for estimating the risk of bacteremia in patients with community-acquired pneumonia. Clin Infect Dis. 2009;49:409-16. doi: 10.1086/600291. [DOI] [PubMed] [Google Scholar]
- 74.Stalenhoef JE, Van Dissel JT, van Nieuwkoop C. Febrile urinary tract infection in the emergency room. Curr Opin Infect Dis. 2015; 28:106-11. doi: 10.1097/QCO.0000000000000121 [DOI] [PubMed] [Google Scholar]
- 75.Van Nieuwkoop C, Bonten TN, van’t Wout JW, Kuijper EJ, Groeneveld GH, Becker MJ, et al. Procalcitonin reflects bacteremia and bacterial load in urosepsis syndrome: a prospective observational study. Crit Care. 2010;14:R206. doi: 10.1186/cc9328. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 76.Julián-Jiménez A, Gutiérrez Martín P, Lizcano Lizcano A, López Gurrero MA, Barroso Manso A, Heredero Gálvez E. Utilidad de la procalcitonina y proteína C reactiva para predecir bacteriemia en las infecciones del tracto urinario en el servicio de urgencias. Actas Urol Esp. 2015;39:502-10. doi: 10.1016/j.acuro.2015.03.003. [DOI] [PubMed] [Google Scholar]
- 77.Fukui S, Inui A, Saita M, Kobayashi D, Naito T. Clinical prediction rule for bacteremia with pyelonephritis and hospitalization judgment: chi-square automatic interaction detector (CHAID) decision tree analysis model. J Int Med Res. 2022;50:3000605211065658. doi: 10.1177/03000605211065658. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.Sasaki S, Raita Y, Murakami M, Yamamoto S, Tochitani K, Hasegawa T, Fujisaki K, Fukuhara S. Added value of clinical prediction rules for bacteremia in hemodialysis patients: An external validation study. PLoS One. 2021;16:e0247624. doi: 10.1371/journal.pone.0247624 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.Lalueza A, Sanz-Trepiana L, Bermejo N, Yaiza B, Morales-Cartagena A, Espinosa M, García-Jiménez R, Jiménez-Rodríguez O, Ponce B, Lora D, Orellana MÁ, Fernández-Ruiz M, Bermejo S, Aguado JM. Risk factors for bacteremia in urinary tract infections attended in the emergency department. Intern Emerg Med. 2018;13:41-50. doi: 10.1007/s11739-016-1576-6 [DOI] [PubMed] [Google Scholar]
- 80.Ramos Lázaro J, Chico C, Jove N, Blázquez Fernández AB, Fernández Monasterio MM, Smithson A. Tratamiento antimicrobiano domiciliario endovenoso en hombres con infección del tracto urinario febril: diferencias entre el modelo de evitación de ingreso y el de alta precoz hospitalaria. Emergencias. 2021;33:399-402. PMid: [PubMed] [Google Scholar]
- 81.Julián-Jiménez A, Moreno-Alonso F, Morales-Casado MI, MuñozLópez D. Utilidad de procalcitonina y proteína C reactiva para predecir bacteriemia en el paciente anciano o con inmunodepresión. Enferm Infecc Microbiol Clin. 2015;33:365-8. doi: 10.1016/j.eimc.2014.09.020. [DOI] [PubMed] [Google Scholar]
- 82.Caterino JM, Scheatzle MD, Forbes ML, D’Antonio JA. Bacteremic elder emergency department patients: Procalcitonin and white count. Acad Emerg Med. 2004;11:393–6. doi: 10.1197/j.aem.2003.10.027. [DOI] [PubMed] [Google Scholar]
- 83.Su M, Chen H, Qiu J, Huang J. Four Biomarkers-Based Artificial Neural Network Model for Accurate Early Prediction of Bacteremia with Low-level Procalcitonin. Ann Clin Lab Sci. 2021;51:408-414. PMid: [PubMed] [Google Scholar]
- 84.Choi DH, Hong KJ, Park JH, Shin SD, Ro YS, Song KJ, Kim KH, Kim S. Prediction of bacteremia at the emergency department during triage and disposition stages using machine learning models. Am J Emerg Med. 2022;53:86-93. doi: 10.1016/j.ajem.2021.12.065. [DOI] [PubMed] [Google Scholar]
- 85.Lee KH, Dong JJ, Kim S, Kim D, Hyun JH, Chae MH, Lee BS, Song YG. Prediction of Bacteremia Based on 12-Year Medical Data Using a Machine Learning Approach: Effect of Medical Data by Extraction Time. Diagnostics (Basel). 2022;12:102. doi: 10.3390/diagnostics12010102 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 86.Mahmoud E, Al Dhoayan M, Bosaeed M, Al Johani S, Arabi YM. Developing Machine-Learning Prediction Algorithm for Bacteremia in Admitted Patients. Infect Drug Resist. 2021;14:757-65. doi: 10.2147/IDR.S293496 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 87.Andreassen S, Møller JK, Eliakim-Raz N, Lisby G, Ward L. A comparison of predictors for mortality and bacteraemia in patients suspected of infection. BMC Infect Dis. 2021;21:864. doi: 10.1186/s12879-021-06547-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 88.Sánchez-Bermejo R, Garvi-García M. Triaje: más allá del rojo y el azul. Emergencias. 2021;33:468-9. PMid: [PubMed] [Google Scholar]
- 89.Lamy B, Sundqvist M, Idelevich EA; ESCMID Study Group for Bloodstream Infections, Endocarditis and Sepsis (ESGBIES) . Bloodstream infections-Standard and progress in pathogen diagnostics. Clin Microbiol Infect. 2020;26:142-150. doi: 10.1016/j.cmi.2019.11.017. [DOI] [PubMed] [Google Scholar]