| Diretriz de Miocardites da Sociedade Brasileira de Cardiologia – 2022 | |
|---|---|
| O relatório abaixo lista as declarações de interesse conforme relatadas à SBC pelos especialistas durante o período de desenvolvimento deste posicionamento, 2021. | |
| Especialista | Tipo de relacionamento com a indústria |
| Amarino Carvalho de Oliveira Júnior | Nada a ser declarado |
| Aurea Lucia Alves de Azevedo Grippa de Souza |
|
| Bárbara Maria Ianni | Nada a ser declarado |
| Carlos Eduardo Rochitte | Nada a ser declarado |
| Claudio Tinoco Mesquita |
|
| Clerio F. Azevedo | Nada a ser declarado |
| Dhayn Cassi de Almeida Freitas | Nada a ser declarado |
| Dirceu Thiago Pessoa de Melo |
|
| Edimar Alcides Bocchi |
|
| Estela Suzana Kleiman Horowitz |
|
| Evandro Tinoco Mesquita |
|
| Fabiana G. Marcondes Braga |
|
| Fabio Fernandes |
|
| Guilherme H. Oliveira | Nada a ser declarado |
| Heinz-Peter Schultheiss | Nada a ser declarado |
| Humberto Villacorta |
|
| João Manoel Rossi Neto |
|
| João Marcos Bemfica Barbosa |
|
| José Albuquerque de Figueiredo Neto |
|
| Lídia Ana Zytynski Moura |
|
| Louise Freire Luiz | Nada a ser declarado |
| Ludhmila Abrahão Hajjar | Nada a ser declarado |
| Luis Beck-da-Silva |
|
| Luiz Antonio de Almeida Campos | Nada a ser declarado |
| Luiz Cláudio Danzmann |
|
| Marcelo Imbroise Bittencourt |
|
| Marcelo Iorio Garcia | Nada a ser declarado |
| Marcelo Westerlund Montera | Nada a ser declarado |
| Marcus Vinícius Simões |
|
| Monica Samuel Avila | Nada a ser declarado |
| Nadine Oliveira Clausell | Nada a ser declarado |
| Nilson Araujo de Oliveira Jr. |
|
| Odilson Marcos Silvestre | Nada a ser declarado |
| Olga Ferreira de Souza | Nada a ser declarado |
| Ricardo Mourilhe-Rocha | Declaração financeira A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: - AstraZeneca: Dapagliflozina; Boehringer: Empagliflozina; Novartis: Sacubitril/Valsartana. B - Financiamento de pesquisas sob sua responsabilidade direta/pessoal (direcionado ao departamento ou instituição) provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: - PROADI/SUS: Telemedicina; Boehriner: Empagliflozina. |
| Roberto Kalil Filho | Nada a ser declarado |
| Sadeer G. Al-Kindi | Nada a ser declarado |
| Salvador Rassi |
|
| Sandrigo Mangine |
|
| Silvia Marinho Martins Alves | Nada a ser declarado |
| Silvia Moreira Ayub Ferreira |
|
| Stéphanie Itala Rizk | Nada a ser declarado |
| Tiago Azevedo Costa Mattos | Nada a ser declarado |
| Vitor Barzilai | Nada a ser declarado |
| Wolney de Andrade Martins |
|
Sumário
1. Epidemiologia 149
2. Definição e Etiologia 150
2.1. Fator Genético na Etiopatogenia das Miocardites 151
3. Fisiopatogenia 151
4. Avaliação Diagnóstica 152
4.1. Critérios Diagnósticos de Suspeita de Miocardite 152
4.1.1. Fluxograma de Avaliação Diagnóstica 152
4.2. Avaliação Clínica: Situações Clínicas de Suspeição 152
4.3. Biomarcadores 154
4.3.1. Marcadores Laboratoriais de Agressão Inflamatória 154
4.3.2. Marcadores Laboratoriais de Pesquisa Etiopatogênica 155
4.4. Eletrocardiograma 155
4.4.1. Critério de diagnóstico por eletrocardiograma/ Holter/testes de estresse 156
4.4.2. Prognóstico 157
4.5. Eletrocardiograma 157
4.6. Ressonância Magnética Cardíaca 157
4.7. Medicina Nuclear 158
4.7.1. Radiotraçadores para Cintilografia por Emissão de Fóton Único (SPECT) 159
4.7.2. Radiotraçadores para Tomografia por Emissão de Pósitrons (SPECT) 160
4.7.3. Perspectivas Adicionais 161
4.8. Angiotomografia de Coronárias e Coronariografia 161
4.9. Biópsia Endomiocárdica: Indicações, Técnica e Complicações 162
4.9.1. Ponderações para Indicação 162
4.9.2. Prognóstico 163
4.9.3. Técnica 163
4.9.4. Complicações 164
4.10. Análise Histológica e Pesquisa Viral – Biologia Molecular e Genoma 164
4.10.1. Análise Histológica 164
4.10.2. Análise Imuno-histoquímica 164
4.10.3. Análise do Perfil Genético 165
4.10.4. Virologia 164
5. Tratamento 164
5.1. Fluxogramas Terapêuticos 164
5.2. Imunossupressão: Indicações e Tipos 164
5.3. Antivirais: Indicações e Tipos 168
5.4. IImunomodulação (Imunoglobulina – Imunoadsorção): Indicações e Tipos de Imunoglobulinas 169
5.4.1. Imunoadsorção 169
5.5. Terapêutica Cardioprotetora Convencional 169
5.5.1. Sem Disfunção Ventricular 169
5.5.2. Com Disfunção Ventricular Hemodinâmica Estável 170
5.5.3. Paciente com Disfunção Ventricular e Hemodinâmica Instável: Abordagem Terapêutica 170
5.6. Cuidados Gerais: Atividade Física e Vacinação 170
6. Situações Especiais 171
6.1. Miocardite Fulminante 171
6.1.1. Avaliação Diagnóstica 172
6.1.2. Abordagem Terapêutica 173
6.2. Sarcoidose 173
6.2.1. Diagnóstico 173
6.2.2. Tratamento e Prognóstico 175
6.2.3. Prognóstico 175
6.3. Células Igantes 176
6.3.1. Tratamento 176
6.3.2. Manifestação Clínica e Diagnóstico 178
6.4. Miocardite chagásica aguda e reagudização 179
6.4.1. Manifestações Clínicas e meios de Infecção, Reagudização nos Pacientes Imunossuprimidos 179
6.4.2. Diagnóstico 179
6.4.3. Tratamento 179
6.5. Miocardite por Doenças Tropicais 180
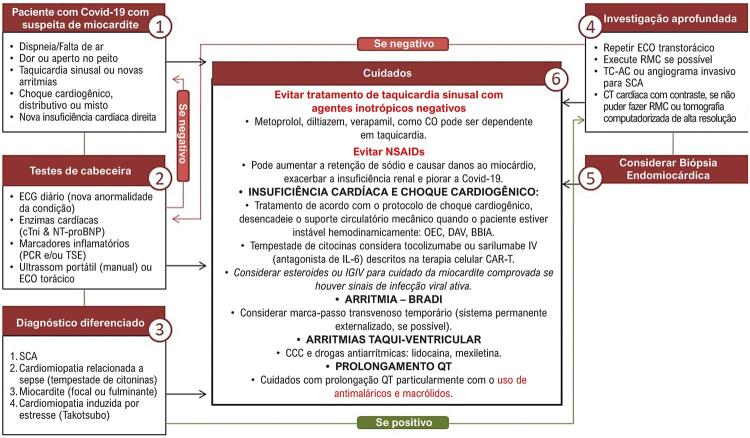
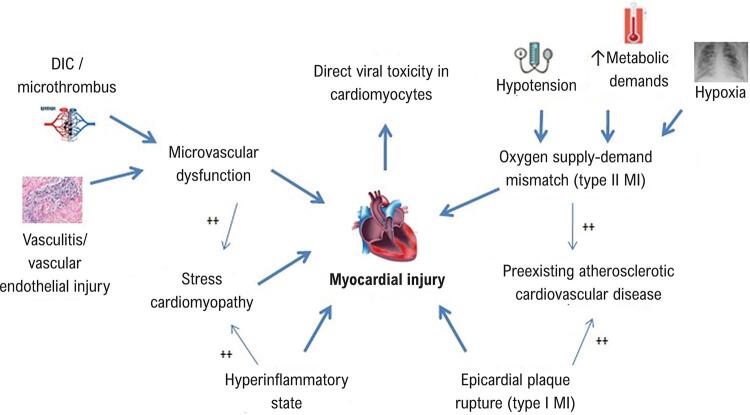
6.6. Miocardite por Covid-19 181
6.6.1. Possível Fisiopatologia da Miocardite Relacionada ao SARS-CoV-2 181
6.6.2. Lesão Miocárdica Viral Direta 181
6.6.3. Diagnóstico de Miocardite Relacionada à Covid-19 182
6.6.4. Laboratório 183
6.6.5. Eletrocardiograma 183
6.6.6. Imagem 184
6.6.7. Biópsia Endomiocárdica 184
6.7. Cardiotoxidade Aguda por Terapêutica Antineoplásica 185
6.7.1. Agentes Antineoplásicos Indutores de Cardiotoxidade Aguda 185
6.7.2. Diagnóstico da Cardiotoxidade Aguda 186
6.7.3. Tratamento da Cardiotoxidade Aguda 186
6.7.4. Prognóstico 188
6.7.5. Prevenção 188
6.8. Miocardite em Crianças e Adolescentes 189
6.8.1. Fatores Causais 189
6.8.2. Prognóstico 190
6.9. Miocardites com Envolvimento Pericárdico 192
6.9.1. Diagnóstico e Tratamento 192
6.10. Miocardite Simulando Infarto Agudo do Miocárdio 192
7. Cardite Reumática 193
8. Miocardites por Doenças Autoimunes 195
9. Manejo das Arritmias Cardíacas na Miocardite 196
9.1. Avaliação Não Invasiva e Invasiva das Arritmias na Fase Aguda e Crônica das Diversas Causa das Miocardites 196
9.2. Tratamento de Arritmias e Prevenção da Morte Súbita na Fase Aguda e Subaguda 197
10. Avaliação Prognóstica e Seguimento 198
10.1. Marcadores de Prognóstico e Evolução 198
10.2 Seguimento Ambulatorial nas Avaliações dos Métodos Complementares 198
Referências 199
1. Epidemiologia
A real incidência de miocardite é difícil de ser determinada, uma vez que as apresentações clínicas são muito heterogêneas e grande parcela dos casos cursa de forma subclínica, além de haver uma frequência muito baixa de emprego da biópsia endomiocárdica (BEM), o padrão-ouro para o diagnóstico. 1
Levantamento de diferentes séries de estudos necroscópicos em indivíduos jovens vítimas de morte súbita inexplicada mostrou incidência muito variável de miocardite, podendo corresponder por até 42% dos casos. 2 O Global Burden of Disease Study 2013 usou os códigos da Classificação Internacional de Doenças em análises estatísticas regionais e globais de 187 países, estimando a incidência anual de miocardite em torno de 22 casos para cada 100.000 pacientes atendidos. 3 Em coortes de pacientes com apresentação clínica de miocardiopatia dilatada de etiologia não definida, miocardite comprovada por BEM pode ser detectada em até 16% dos pacientes adultos, 4 e em até 46% de pacientes pediátricos. 5
Muitos estudos indicam maior prevalência da miocardite aguda em homens do que em mulheres 6 , 7 Alguns estudos sugerem que, em adultos, a manifestação clínica mais comum seja a miocardite linfocítica, com mediana de idade de 42 anos, enquanto pacientes com miocardite de células gigantes têm mediana de 43 anos de idade. 8 Entretanto, recém-nascidos e crianças exibem mais tipicamente apresentação de miocardite fulminante e são mais suscetíveis à patogenicidade induzida por vírus do que adultos. 9 , 10
A miocardite engloba um amplo espectro de prognósticos, dependendo da gravidade do quadro clínico inicial e da sua etiologia. Pacientes com sintomas leves e sem disfunção ventricular exibem com grande frequência resolução espontânea e excelente prognóstico. 11 No entanto, estima-se que cerca de 30% dos casos de miocardite mais graves, documentados com BEM e cursando com disfunção ventricular evoluam para miocardiopatia dilatada e insuficiência cardíaca (IC) com prognóstico reservado. Em pacientes pediátricos, o prognóstico parece ser pior, com relatos de sobrevida em 10 anos livre de transplante cardíaco de apenas 60%. 5
2. Definição e Etiologia
A miocardite pode ser definida como doença inflamatória do miocárdio, diagnosticada por critérios histológicos, imunológicos e imuno-histoquímicos. Os critérios histológicos incluem evidência de infiltrado inflamatório envolvendo o miocárdio associado com degeneração e necrose de cardiomiócitos e de origem não isquêmica. Os critérios imuno-histoquímicos quantitativos para identificar um infiltrado inflamatório anormal, indicativos de miocardite ativa, são: contagem de leucócitos ≥14 células/mm2, incluindo até 4 monócitos/mm2, com a presença de linfócitos-T CD3 positivos ≥7 células/mm2. 12
Adicionalmente, conforme o tipo celular, o tipo de infiltrado inflamatório observado no diagnóstico histológico pode classificar a miocardite em linfocítica, eosinofílica, polimórfica, miocardite de células gigantes e sarcoidose cardíaca. 13
Miocardite pode ser causada por uma grande variedade de agentes infecciosos, incluindo vírus, protozoários, bactérias, clamídias, rickéttsias, fungos e espiroquetas ( Tabela 1 ), bem como pode ser desencadeada por mecanismos não infecciosos como a miocardite tóxica (drogas, metais pesados, radiação), miocardite por mecanismos autoimunes e de hipersensibilidade (miocardite eosinofílica, colagenoses, induzida por vírus, rejeição do coração transplantado). 14 , 15
Tabela 1. – Etiologia da miocardite aguda*.
| 1 – Miocardite infecciosa | |
|---|---|
| Viral | |
| Vírus RNA | Vírus Coxsackie A e B, echo-vírus, poliovírus, vírus da influenza A e B, vírus sincicial respiratório, vírus da caxumba, vírus do sarampo, vírus da rubéola, vírus da hepatite C, vírus da dengue, vírus da febre amarela, vírus da Chikungunya, vírus Junin, vírus da febre de Lassa, Rabies virus , vírus da imunodeficiência humana-1 |
| Vírus DNA | Adenovírus, parvovírus B19, citomegalovírus, herpes-vírus humano-6, vírus Epstein-Barr, vírus varicela-zóster, herpes-vírus simples, vírus da varíola, vírus vaccinia |
| Bactérias | Staphylococcus, Streptococcus, Pneumococcus, Meningococcus, Gonococcus, Salmonella, Corynebacterium diphtheriae, Haemophilus influenzae, Mycobacterium (tuberculose) , Mycoplasma pneumoniae, Brucella |
| Espiroquetas | Borrelia (doença de Lyme), Leptospira (doença de Weil) |
| Fungos | Aspergillus, Actinomyces, Blastomyces, Candida, Coccidioides, Cryptococcus, Histoplasma, Mucormycoses, Nocardia, Sporothrix |
| Protozoários | Trypanosoma cruzi, Toxoplasma gondii, Entamoeba, Leishmania |
| Parasitas | Trichinella spiralis, Echinococcus granulosus, Taenia solium |
| Rickéttsias | Coxiella burnetii (Febre Q), R. Rickettsii (febre maculosa das Montanhas Rochosas), R. tsutsugamushi |
| 2 – Miocardite imunomediada | |
| Alérgenos | Toxoide tetânico, vacinas, doença do soro Drogas: penicilina, cefaclor, conchicina, furosemida, isoniazida, lidocaína, tetraciclina, sulfonamidas, fenitoína, fenilbutazona, metildopa, diuréticos tiazídicos, amitriptlina |
| Aloantígenos | Rejeição do coração transplantado |
| Autoantígenos | Miocardite linfocítica infecção-negativa, miocardite de células gigantes infecção-negativa associadas a distúrbios autoimunes: lúpus eritematoso sistêmico, artrite reumatoide, síndrome de Churg-Strauss, doença de Kawasaki, doença inflamatória intestinal, esclerodermia, polimiosite, miastenia grave, diabetes melito dependente de insulina, sarcoidose, granulomatose de Wegener, febre reumática, imunoterapia oncológica (inibidores de check-point imunológico) |
| 3 – Miocardite tóxica | |
| Drogas | Anfetaminas, antraciclinas, cocaína, ciclofosfamida, etanol, fluouracil, lítio, catecolaminas, hemetina, trastuzumab, clozapina, interleucina-2, inibidores de check-point imunológico |
| Metais pesados | Cobre, ferro, chumbo |
| Miscelânea | Picada de escorpião, picada de cobra, picada de aranha, picada de abelha e vespa, monóxido de carbono, inalantes, fósforo, arsênico, azida de sódio |
| Hormônios | Feocromocitoma |
| Agentes físicos | Radiação, choque elétrico |
Fonte: *Adaptada de Caforio et al.5
Dentre todos esses desencadeantes de miocardite, a infecção viral é a mais prevalente, particularmente em crianças. Os vírus cardiotrópicos mais prevalentes são: enterovírus, parvovírus B19 (PVB19), adenovírus, vírus influenza A, herpes-vírus humano (HHV), vírus Epstein-Barr, citomegalovírus, vírus da hepatite C e vírus do HIV. Algumas evidências sugerem que possa haver diferenças regionais em relação à prevalência dos diferentes agentes virais, com predomínio de adenovírus, parvovírus e herpes na população europeia 16 e preponderância de enterovírus na população americana. 17 Entretanto, parte dessas diferenças epidemiológicas pode ser decorrente de surtos de infecções virais específicas ocorrendo ao longo dos anos nas diversas regiões do mundo, bem como a diferenças nas técnicas de detecção viral, permanecendo o debate acerca da real influência da distribuição geográfica quanto às infecções virais cardiotrópicas. 18
Na América do Sul e, especialmente, em algumas regiões do Brasil, a miocardite chagásica causada pelo protozoário Trypanosoma cruzi é uma das causas mais prevalentes de miocardite aguda, particularmente frente ao registro recente de surtos de casos associados à transmissão oral na Amazônia brasileira. 19 Doenças sistêmicas autoimunes como a síndrome de Churg-Strauss e a síndrome hipereosinofílica estão associadas à miocardite eosinofílica. A miocardite de células gigantes e a sarcoidose, embora raras, revestem-se de especial importância clínica, uma vez que, se diagnosticadas precocemente, têm tratamento específico, o que pode garantir melhora do prognóstico. 20 , 21
Miocardite autoimune pode ocorrer como acometimento orgânico isolado ou manifestar-se no contexto de doenças autoimunes com manifestações sistêmicas, sendo as mais frequentes: sarcoidose, síndrome hipereosinofílica, esclerodermia e lúpus eritematoso sistêmico.
Novos imunoterápicos para tratamento do câncer podem estar associados ao risco de miocardite, sendo mais recentemente reconhecidos os casos vinculados ao uso dos inibidores de checkpoint imunológico, como nivolumab e ipilimumab. 22 - 24
2.1. Fator Genético na Etiopatogenia das Miocardites
Nas descrições clássicas da etiopatogenia da miocardite, as evidências de mecanismos envolvendo a atuação de vírus e reações autoimunes são bem documentadas. Pouco se fala a respeito da predisposição genética. Muitos autores acreditam que é provável que fenômenos genéticos possam contribuir para o desenvolvimento de miocardite viral e/ou autoimune. 12 , 25
Dados laboratoriais consistentes com este argumento foram documentados em um estudo com 342 familiares de pacientes com cardiomiopatia dilatada (CMPD), em que se constatou a presença de anticorpos cardíacos com intensidade maior do que foi observado no grupo controle. 26
Além disso, também é largamente reconhecida a probabilidade de uma interação complexa entre causas genéticas (predisposição individual) e não genéticas (ligadas ao agente agressor) na evolução final para cardiomiopatia dilatada. O problema é que as evidências científicas que suportam tal argumento são escassas. 27
Há evidências de que, em cepas de camundongos suscetíveis, a infecção e a inflamação desencadeiam reações autoimunes no coração, geralmente como resultado da necrose dos miócitos e subsequente liberação de autoantígenos anteriormente ocultos no sistema imunológico. As mesmas linhagens de animais geneticamente predispostas desenvolvem miocardite linfocítica ou de célula gigante autoimune e depois cardiomiopatia dilatada após imunização com autoantígenos cardíacos (p. ex., miosina cardíaca). 28
Além disso, há a evidência de que a miocardite pode estar presente em cardiomiopatias específicas (p. ex., cardiomiopatia arritmogênica), levando a alterações no fenótipo e progressão abrupta da doença. Nesse contexto, algumas mutações podem aumentar a suscetibilidade à miocardite. 29
Entretanto, no geral, a miocardite segue classificada como um distúrbio adquirido não familiar, com evidências de estudos experimentais que indicam que alterações genéticas possam proporcionar suscetibilidade maior a esta doença.
3. Fisiopatogenia
De forma simplificada, podemos dividir a fisiopatologia das miocardites em infecciosas e não infecciosas. As infecciosas são as mais comuns e incluem uma enorme gama de vírus, bactérias, protozoários, fungos e outros patógenos mais raros (ver Tabela 1 ). Os agentes virais são os mais comumente envolvidos e estudados experimentalmente. Do ponto de vista não infeccioso, a autoimunidade está presente, mediante doenças específicas, drogas e autoanticorpos; a predisposição genética exerce papel importante em ambas (ver Tabela 1 ).
Modelos murinos de miocardite viral sugerem que seu desenvolvimento apresenta três fases: aguda (alguns dias), subaguda (algumas semanas a meses) e crônica (desenvolvimento da miocardiopatia dilatada); 30 além disso, dois mecanismos patogênicos são descritos: lesão citopática direta induzida pelos microrganismos e resposta imune anticardíaca induzida pelos microrganismos.
A fase 1 corresponde à infecção inicial, que pode curar até mesmo sem sequela ou levar à IC ou morte, ou progredir para as fases 2/3. 31 Na maioria dos pacientes com miocardite viral, o patógeno é eliminado e o sistema imune reduz sua atividade sem outras complicações adicionais. Entretanto, em uma minoria de pacientes, o vírus não é eliminado, resultando em lesão miocárdica persistente e inflamação secundária à produção de anticorpos. 17 Assim, a miocardite viral poderia ser considerada um dos precursores para o desenvolvimento da miocardiopatia dilatada, sendo observada essa evolução em 21% dos casos de miocardite ao final de 3 anos. 32
Os enterovírus, em especial o Coxsackie B3 (CVB3), iniciam a miocardite por meio do acoplamento ao receptor CAR (Coxsackie vírus e adenovírus receptor) e DAF (do inglês, decay accelarating fator ), culminado em morte celular através de apoptose 33 ou necroptose. 34 Cardiomiócitos infectados tornam-se lisados, o que resulta em liberação citosólica de proteínas e produtos virais. Após a fase aguda, o curso da doença depende da base genética, podendo evoluir para miocardiopatia dilatada ou haver resolução. 35 - 39 Infecção por Coxsackie ativa respostas imunes inatas e adaptativas, incluindo, em primeiro momento, a produção de interferon e ativação de receptores toll-like (TLR). 40 Na resposta adaptativa, a deficiência de células T e B leva à persistência viral e piora evolutiva. 41 , 42
Outro aspecto importante é a produção de autoanticorpos específicos contra os cardiomiócitos, que ocorre por meio da liberação de peptídios cardíacos, havendo mimetismo molecular entre as proteínas cardíacas e os agentes virais. Na presença de citocinas coestimuladoras como TNF e IL1, esses anticorpos promovem resposta efetora de linfócitos T. 43
Outros vírus como o parvovírus B19 e o herpes-vírus-6 têm sido cada vez mais descritos em biópsias cardíacas, havendo uma tendência de redução de identificação de enterovírus e adenovírus. 44 No entanto, a presença desses microrganismos também tem sido observada em corações sem miocardite ou miocardiopatias de outras etiologias, tornando complexa a interpretação da associação entre a presença de agentes infecciosos no tecido cardíaco e o desenvolvimento de miocardite, bem como a influência da persistência desses agentes na evolução clínica. 45
Em relação às miocardites não infecciosas, modelos animais de miocardite autoimune envolvem linhagens suscetíveis geneticamente que demonstram a presença de linfócitos T CD4+ reativos a autoantígenos, como a cadeia pesada da miosina, na ausência de agentes infecciosos. 46 Além da resposta autoimune linfocitária, podemos observar respostas envolvendo macrófagos, como nas miocardites granulomatosas e eosinófilos nas situações de hipersensibilidade.
A miocardite de células gigantes é uma forma autoimune de agressão miocárdica e caracteriza-se histologicamente por um infiltrado de células gigantes multinucleadas, além de infiltrado inflamatório de células T, eosinófilos e histiócitos. A presença marcante de células CD8 (citotóxicas), liberação de citocinas inflamatórias e mediadores do estresse oxidativo leva a uma intensa agressão às células miocíticas e reposição por fibrose, culminando em rápida perda da função ventricular e evolução clínica desfavorável. Em 20% dos casos, existe associação com doenças autoimunes como tireoidite de Hashimoto, artrite reumatoide, miastenia grave, arterite de Takayasu, entre outras. 47 A sarcoidose tem caráter multissistêmico, envolvendo o pulmão em 90% dos casos, associada a acúmulo de linfócitos T, fagócitos mononucleares e granulomas não caseosos nos tecidos envolvidos. 48 , 49
Na miocardite induzida por drogas, a resposta de sensibilidade pode variar de horas a meses. Parte da justificativa da hipersensibilidade se dá em resposta a componentes quimicamente reativos que se ligam a proteínas promovendo modificações estruturais. Essas partículas são fagocitadas pelas células de defesa, por vezes macrófagos, os quais as apresentam na superfície dessas células aos linfócitos T. Como uma resposta de hipersensibilidade retardada, são liberadas citocinas como interleucina 5, estimulante de eosinófilos. Esse acúmulo de interleucina 5 promove um grande infiltrado eosinofílico com aumento da resposta de hipersensibilidade e maior lesão miocárdica. A predisposição genética parece favorecer esse padrão de resposta. 50
A síndrome hipereosinofílica pode ocorrer em associação a diversas doenças com manifestação sistêmica, como síndrome de Churg-Strauss, câncer, infecções parasitárias e helmínticas, ou estar relacionada a vacinações. Estas podem promover uma resposta inflamatória intensa no miocárdio, levando à lesão celular com disfunção e IC. 51 , 52 Do ponto de vista fisiopatológico, assim como em outros órgãos, ocorre um intenso infiltrado eosinofílico no miocárdio, infiltrado este que promove a liberação de mediadores altamente agressivos ao miócito, levando a necrose e perda da estrutura miocárdica. Entre os fatores agressores, estão a neurotoxina, derivada dos eosinófilos, a proteína catiônica do eosinófilo e a protease eosinofílica. Além desses fatores, a produção de citocinas inflamatórias como IL 1, TNF-alfa, IL 6, IL 8, IL3, IL5 e proteínas inflamatórias do macrófago promove a lesão e perda de miócitos, com evolução para disfunção miocárdica. 53
Mais recentemente, o nivolumab, droga antitumoral que atua como inibidor de checkpoint , tem sido considerado como causa de miocardite linfocitária. Possível mecanismo fisiopatológico sugere que as células miocárdicas poderiam compartilhar antígenos com as células tumorais, sendo, consequentemente, alvos de células T ativadas, resultando em infiltrado inflamatório e desenvolvimento de IC e distúrbios de condução. 54
4. Avaliação Diagnóstica
4.1. Critérios Diagnósticos de Suspeita de Miocardite
A suspeita clínica do diagnóstico de miocardite pelo consenso do grupo de doenças do miocárdio e pericárdio da sociedade europeia de cardiologia baseia-se na associação da apresentação clínica com exames complementares alterados sugestivos de lesão inflamatória miocárdica. 12 , 55
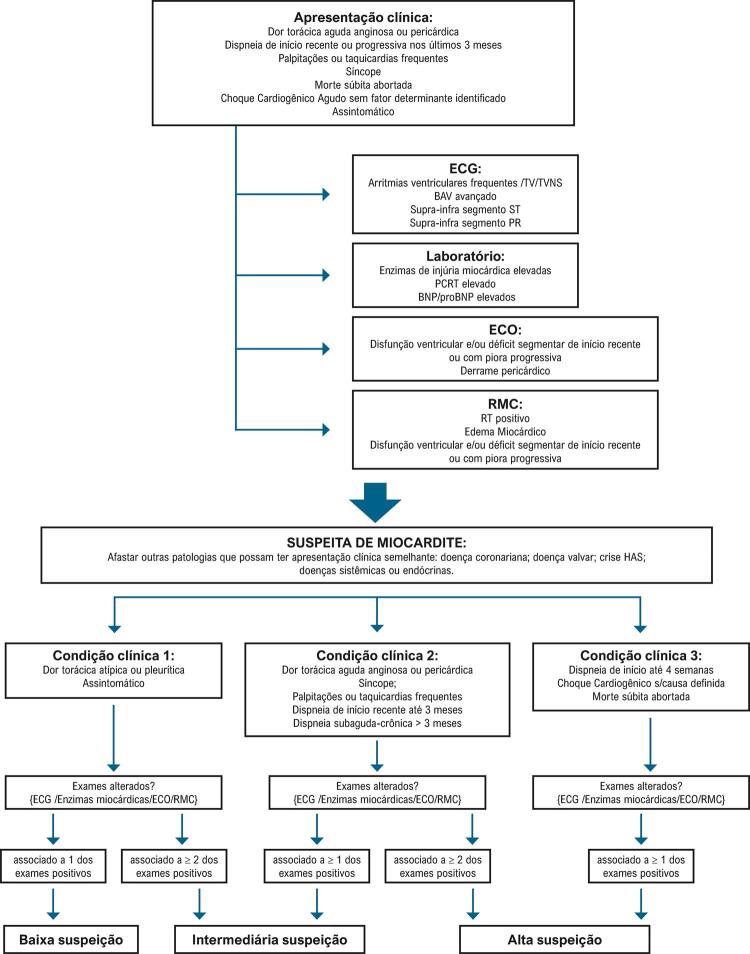
Por meio de análise das apresentações clínicas mais frequentes da miocardite e na acurácia diagnóstica dos métodos de avaliação complementar em prognosticar a presença de agressão inflamatória miocárdica, propõe-se estratificar a suspeita clínica diagnóstica de miocardite em três níveis: baixa, intermediária e alta suspeição diagnóstica ( Figura 1 ). 32 , 56 - 63 Esses critérios de suspeição foram estabelecidos por consenso de especialistas, e necessitam de validação futura por registros clínicos ou estudos multicêntricos.
Figura 1. – Algoritmo de estratificação de suspeita clínica diagnóstica de miocardite.
BAV: bloqueio atrioventricular; BNP: peptídeo natriurético B; BNP: peptídeo natriurético tipo B; ECG: eletrocardiograma; ECO: ecocardiograma transtorácico; HAS: hipertensão arterial; PCRT: proteína C reativa titulada; PR: segmento PR; RMC: ressonância magnética cardíaca; RT: realce tardio; ST: segmento ST; TV: taquicardia ventricular; TVNS: taquicardia ventricular não sustentada.
4.1.1. Fluxograma de Avaliação Diagnóstica
O fluxograma de avaliação diagnóstica da miocardite se baseia no grau de suspeita clínica e prognóstica do paciente (ver Figura 1 ). Os pacientes com baixa suspeita clínica apresentam um prognóstico favorável, sendo seguidos em acompanhamento clínico e avaliados quanto à necessidade de extratificação não invasiva de doença arterial coronariana (DAC). Os pacientes com suspeita intermediária com evolução clínica favorável têm a mesma linha de seguimento clínico e de investigação diagnóstica que os pacientes de baixo risco. Os pacientes que evoluem com manutenção ou piora clínica, função ventricular, arritmias ou bloqueio AV devem ser submetidos a coronariografia (CAT) e BEM. Os pacientes com alta suspeita diagnóstica, em geral, apresentam um pior prognóstico, devem ser submetidos a CAT e BEM, para definição etiológica, com objetivo de definir um tratamento específico para melhora do prognóstico. 32 , 56 , 64 , 65
4.2. Avaliação Clínica: Situações Clínicas de Suspeição
A miocardite pode se manifestar de diferentes formas, variando desde quadro leve e oligossintomático até quadro grave, associado a arritmias ventriculares, instabilidade hemodinâmica e choque cardiogênico. Raramente, pode se apresentar como morte súbita (variando de 8,6% a 12%), principalmente na infância ou em adultos jovens. 66 , 67
O quadro mais comum ocorre em pacientes jovens com dor torácica sugestiva de infarto agudo do miocárdio (IAM) com coronárias normais após infecção viral respiratória ou intestinal, embora os sintomas virais nem sempre precedam os quadros de miocardite (pode variar de 10% a 80% dos casos). 68 - 70 Apesar de ocorrer predominantemente em pacientes jovens, a síndrome pode surgir em qualquer idade. Pode ocorrer também quadro de miocardite subclínica, elevação transitória de troponina ou alterações eletrocardiográficas após quadro viral agudo, o qual se manifesta com sintomas inespecíficos como febre, mialgia, sintomas respiratórios ou gastrointestinais. 68 , 71
Há diferentes formas de apresentação dessa doença: 12 , 71 , 72
Quadro clínico semelhante à síndrome coronariana aguda (dor torácica, alterações eletrocardiográficas sugestiva de isquemia; elevação de marcadores de necrose miocárdica com coronárias normais).
Sintomas novos agudos de IC (entre 3 dias e 3 meses) na ausência de doença coronariana ou causa conhecida para os sintomas.
Sintomas de IC de início recente nos últimos meses (> 3 meses) na ausência de doença coronariana ou causa conhecida para os sintomas.
Condições ameaçadoras da vida: arritmias ventriculares inexplicadas e/ou síncope e/ou morte súbita abortada; choque cardiogênico sem doença coronariana associada.
A) Manifestação como dor torácica
Pacientes que se apresentam com dor torácica podem ter alterações eletrocardiográficas variáveis: supra ou infradesnivelamento do segmento ST; inversão de onda T ou ondas Q patológicas. Alterações segmentares ao ecodopplercardiograma e elevação de marcadores de necrose miocárdica, especialmente troponina, em pacientes com coronárias normais sugerem a hipótese de miocardite. 68 , 73 Na maioria dos estudos, esses pacientes têm bom prognóstico em curto prazo, sendo o grau de comprometimento ventricular preditor de risco de morte. 71 , 74 Uma minoria desenvolve miopericardite persistente e recorrente com função de ventrículo esquerdo (VE) normal que podem responder à colchicina. 75
B) Manifestação como insuficiência cardíaca aguda
A forma de apresentação pode ser aguda, associada ao aparecimento dos sintomas de IC em dias, mas também subagudo/crônico, cardiomiopatia de início recente em paciente sem causa aparente para a alteração de função miocárdica.
A apresentação da miocardite por sintomas de IC (dispneia, fadiga, intolerância ao exercício) pode ocorrer associada a leve comprometimento da função ventricular (fração de ejeção de ventrículo esquerdo [FEVE] entre 40% e 50%) que melhora em semanas a meses. Contudo, número menor de pacientes pode apresentar disfunção ventricular importante (FEVE <35%) e, destes, 50% desenvolvem disfunção de VE crônica; cerca de 25% necessitarão de transplante cardíaco ou dispositivo de assistência ventricular, enquanto os outros 25% terão melhora da função ventricular ao longo do seguimento; uma minoria dos casos pode evoluir com quadro de choque cardiogênico e necessidade de suporte circulatório mecânico. 68 , 76 - 79 O risco de morte ou necessidade de transplante está fortemente associado ao grau de comprometimento hemodinâmico e da função ventricular esquerda e direita, que podem responder ao tratamento medicamentoso padrão para IC. 80
A apresentação da doença na forma fulminante caracteriza-se pelo aparecimento abrupto (dias) dos sintomas de IC avançada. Esses pacientes, em geral, têm grave disfunção ventricular com pouca alteração dos diâmetros ventriculares. Trata-se de apresentação dramática que necessita de intervenção precoce. 68 , 81 Quando o quadro fulminante está associado à taquicardia ventricular persistente ou não há resposta à terapêutica padrão, o prognóstico é pior, e formas mais graves de miocardite, como miocardite de células gigantes, devem ser consideradas e investigadas. 8
C) Manifestação como insuficiência cardíaca crônica ou progressiva
Miocardite confirmada por critério imuno-hitopatológico está presente em até 40% dos pacientes com cardiomiopatia crônica que persistem sintomáticos a despeito do tratamento medicamentoso. A presença de inflamação acessada por histologia está associada a pior prognóstico. 71
D) Manifestação como condição ameaçadora da vida
Arritmias ou distúrbios de condução
Pacientes com miocardite podem, ainda, apresentar distúrbios do sistema de condução, tais como bloqueio atrioventricular (BAV) de 2° ou 3° grau ou total, principalmente aqueles que apresentam sinais ecocardiográficos de hipertrofia por edema intersticial. 82 A presença de bloqueio cardíaco ou arritmias ventriculares sintomáticas ou sustentadas em pacientes com cardiomiopatia deve levantar a suspeita de miocardite com causa definida (doença de Lyme; sarcoidose; displasia arritmogênica de ventrículo direito ou Chagas em áreas endêmicas). 71
Choque cardiogênico
Subgrupo pequeno de pacientes que se apresentam com quadro súbito de IC dentro de 2 semanas de quadro viral pode precisar de suporte inotrópico e/ou suporte circulatório mecânico. Em geral, ocorre recuperação da função ventricular quando sobrevivem ao quadro inicial, porém necessitam de instituição da terapêutica adequada o mais precoce possível. 71 , 81
A Tabela 2 resume as principais síndromes clínicas de suspeição de miocardite e sugere possíveis agentes responsáveis por cada forma de apresentação da doença. 83
Tabela 2. – Descrição do quadro clínico e possível causa das diferentes síndromes clínicas da miocardite.
| Síndrome clínica | Quadro clínico | Possível causa |
|---|---|---|
| Dor torácica aguda | Sintomas de angina; DAC afastada; alteração de segmento ST/T; arritmias; elevação de troponina I/T e NtproBNP intermitentes | Parvovírus B19 ou outros vírus com tropismo pelo coração associado ou não à pericardite |
| IC aguda | Dispneia; edema; disfunção sistólica e/ou diastólica de VE; alteração de ECG; elevação troponina I/T e NTproBNP intermitentes | Miocardite viral ou não viral ou cardiomiopatia inflamatória |
| IC crônica | Todos os sintomas de IC por algum tempo; DAC afastada; alterações do ECG como BRE, BRD, BAV; elevação troponina I/T e NtproBNP intermitentes | Miocardite focal viral ou não viral ou cardiomiopatia inflamatória |
| IC/arritmia ameaçadoras da vida | Choque cardiogênico; IC NYHA III/IV; troponina e NTproBNP elevados; arritmia grave; DAC afastada | Miocardite de células gigantes; miocardite eosinofílica; miocardite tóxica |
BAV: bloqueio atrioventricular; BRD: bloqueio de ramo direito; BRE: bloqueio de ramo esquerdo; DAC: doença arterial coronariana; ECG: eletrocardiograma; IC: insuficiência cardíaca; ST/T: segmento ST e onda T; VE: ventrículo esquerdo.
4.3. Biomarcadores
4.3.1. Marcadores Laboratoriais de Agressão Inflamatória
Nenhum biomarcador, isoladamente, é suficiente para diagnosticar miocardite; contudo, alguns biomarcadores podem ser úteis como marcadores prognósticos. A seguir, comentaremos acerca dos principais biomarcadores usados nessa avaliação.
Marcadores inflamatórios. Contagem de leucócitos, velocidade de hemossedimentação (VHS) e proteína C reativa (PC-R) podem estar elevadas em pacientes com miocardite. No entanto, não apresentam valor diagnóstico, pois são inespecíficos.
Troponinas. As troponinas são mais específicas que CPK e CKMB para lesões miocárdicas e estão frequentemente elevadas em pacientes com miocardite. 84 No entanto, troponinas normais não excluem o diagnóstico. Embora não sejam suficientes para estabelecer o diagnóstico de miocardite, podem sugerir o diagnóstico, desde que excluídas causas óbvias como IAM e IC aguda. Em um estudo pequeno, em que vários biomarcadores foram avaliados, troponinas foram preditores do diagnóstico de miocardite confirmada por biópsia, com área sob a curva de 0,87, sensibilidade de 83% e especificidade de 80%. 85 Troponina é útil para o diagnóstico de miocardite em pacientes com miocardiopatia de instalação aguda. 12 , 72
Peptídios natriuréticos. BNP e NT-proBNP podem estar elevados na miocardite. 86 No entanto, não são úteis para confirmação diagnóstica, uma vez que se elevam frente a diferentes causas de IC. Contudo, podem ser marcadores prognósticos. Em um estudo com miocardite confirmada por biópsia, entre vários biomarcadores avaliados, somente o NT-proBNP acima do último quartil (>4.245pg/mL) foi preditor de morte ou transplante cardíaco. 85
4.3.2. Marcadores Laboratoriais de Pesquisa Etiopatogênica
Sorologias virais. São de valor limitado no diagnóstico de miocardite, uma vez que anticorpos IgG de vírus cardiotrópicos são muito prevalentes na população geral na ausência de doença cardíaca viral. Em um estudo, não se observou correlação entre sorologia viral e achados da biópsia. 87 Em situações específicas, podem ser úteis a sorologia para hepatite C, pesquisa de vírus HIV em indivíduos de alto risco e doença de Lyme em áreas endêmicas. A pesquisa de marcadores sorológicas deve ser ditada pela elevada suspeição clínica para aquela doença ( Tabela 3 ).
Tabela 3. – Recomendações na avaliação laboratorial inicial da miocardite.
| Indicações | Classe | Nível de evidência |
|---|---|---|
| Uso de marcadores inflamatórios para o diagnóstico de miocardite | I | C |
| Biomarcadores de lesão miocárdica para auxiliar o diagnóstico de miocardite | I | B |
| BNP ou NT-ProBNP para auxiliar o diagnóstico e estratificação de prognóstico de miocardite | I | B |
| Investigação sorológica e/ou detecção de antígenos e/ou RT-PCR para diagnóstico de Covid-19 em casos suspeitos | I | B |
| Investigação sorológica e/ou detecção de antígenos e/ou RT-PCR para avaliação inicial de pacientes em situações especiais de suspeita de miocardite por etiologias específicas | IIa | C |
| Sorologias virais na investigação de rotina de todos os casos de miocardite | III | C |
BNP: peptídeo natriurético tipo B; RT-PCR: reação em cadeia de polimerase.
Marcadores imuno-histoquímicos e análise de genoma viral. São superiores aos critérios de Dallas e, portanto, úteis no diagnóstico etiológico. A taxa de complicações com a BEM é baixa ( Tabela 3 ). 88 - 90
4.4. Eletrocardiograma
O eletrocardiograma (ECG) é comumente solicitado para triagem de miocardite, mas com especificidade limitada, embora os pacientes frequentemente apresentem alguma alteração no ECG. 12 Taquicardia sinusal pode ser a forma mais comum de apresentação do ECG. 14 Algumas alterações no ECG são mais sugestivas de miocardite do que outras. Por exemplo, a elevação do segmento ST-T na miocardite é tipicamente côncava (em vez de convexa na isquemia miocárdica), difusa sem alterações recíprocas, transitória e reversível na evolução ( Figura 2 ). 91
Figura 2. - Curso evolutivo do padrão de repolarização precoce na miocardite aguda.
Adaptada de Oka et al.91
O padrão de repolarização precoce (RP) no ECG de alguns pacientes com miocardite aguda pode ser a evidência de inflamação/edema localizado no epicárdico do VE. Oka et al. 91 mostraram que o padrão de RP no ECG da miocardite aguda foi transitório, reversível e não estava associado a um pior prognóstico. 91
O BAV, na presença de dilatação leve do VE, pode ser devido a várias causas (incluindo laminopatia), mas também pode ser sugestivo de doença de Lyme, sarcoidose cardíaca ou miocardite de células gigantes. Ogunbayo identificou que, em 31.760 pacientes com diagnóstico primário de miocardite, o bloqueio cardíaco foi relatado em 540 (1,7%), sendo 21,6% com BAV de primeiro grau, 11,2% com BAV de segundo grau e 67,2% com BAV de alto grau. O BAV de alto grau apresentou associação independente com o aumento da morbimortalidade. 92
Recente metanálise mostrou que o alargamento de QRS esteve presente como característica precoce da miocardite fulminante. 93 Em um estudo em que pacientes internados agudamente com miocardite sem IC prévia foram submetidos à BEM, o alargamento do QRS foi preditor independente de morte cardíaca ou transplante cardíaco. 94
Uma proporção significativa de pacientes com miocardite aguda apresenta morte súbita cardíaca, presumivelmente por arritmia cardíaca. Estudo recente de Adegbala mostrou um total de 32.107 internações por miocardite aguda entre 2007 e 2014, nos EUA, das quais 10.844 (33,71%) apresentaram arritmias, sendo as mais comuns taquicardia ventricular (22,3%) e fibrilação atrial (26,9%), e a presença dessas arritmias teve impacto na mortalidade. 95
Resumidamente, o ECG fornece uma ferramenta conveniente para a estratificação de risco e a triagem inicial, mas com valor diagnóstico fraco. 14
4.4.1. Critério de diagnóstico por eletrocardiograma/ Holter /testes de estresse 12
O ECG de 12 derivações é prática usual na investigação diagnóstica e na avaliação prognóstica da miocardite ( Tabela 4 ). As alterações mais frequentemente associadas com a miocardite no ECG de 12 derivações e/ou Holter e/ou testes de estresse, com qualquer um dos seguintes: bloqueio atrioventricular de I a III graus ou bloqueio de ramo, alteração de ST/T (elevação de ST ou sem elevação do segmento ST, inversão da onda T), parada sinusal, taquicardia ou fibrilação ventriculares e assistolia, fibrilação atrial, redução da altura da onda R, atraso da condução intraventricular (complexo QRS alargado), ondas Q anormais, baixa voltagem, batimentos prematuros frequentes, taquicardia supraventricular.
Tabela 4. – Recomendações de eletrocardiograma para avaliação de miocardite.
| Indicações | Classe | Nível de evidência |
|---|---|---|
| Eletrocardiograma na suspeita de miocardite | I | C |
| Eletrocardiograma para avaliar prognóstico na miocardite | I | C |
4.4.2. Prognóstico
Alargamento do QRS, BAV de alto grau, taquicardia ventricular e fibrilação atrial aumentaram a mortalidade.
4.5. Ecocardiograma
O ecocardiograma tem um papel limitado no diagnóstico da miocardite propriamente dita. Trata-se de uma ferramenta muito importante na exclusão de outras patologias, devendo sempre ser realizada quando ocorre a suspeita clínica ( Tabela 5 ). 96 , 97 Não existe um achado ecocardiográfico específico, e as alterações encontradas apenas vão espelhar um quadro inflamatório miocárdico. Portanto, podemos evidenciar desde alterações segmentares (diagnóstico diferencial com as cardiopatias isquêmicas) até alterações difusas (hipocinesia global de um ou ambos os ventrículos). 98 , 99 Quando o acometimento é agudo e grave, as cavidades ventriculares são pequenas (não dilatadas) e podemos evidenciar a presença de edema miocárdico (aumento da espessura parietal), bem como derrame pericárdico, achados esses comuns na miocardite fulminante. O acometimento do ventrículo direito (VD) geralmente reflete um prognóstico mais reservado. 100
Tabela 5. – Recomendações para realização de ecocardiograma na avaliação inicial da miocardite.
| Indicações | Classe | Nível de evidência |
|---|---|---|
| Ecocardiograma para avaliação de estrutura e função cardíaca | I | C |
| Ecocardiograma para avaliação e estratificação prognóstica | I | C |
| Ecocardiograma para guiar a biópsia endomiocárdica | IIa | C |
Um papel interessante do ecocardiograma é como adjunto na realização da BEM, visando não só ao sítio ideal para a retirada dos fragmentos, mas também guiando o intervencionista e evitando complicações ( Tabela 5 ). 101
4.6. Ressonância Magnética Cardíaca
Na avaliação dos pacientes com miocardite, assim como na avaliação de outras cardiomiopatias não isquêmicas, a ressonância magnética cardíaca (RMC) apresenta grande utilidade na determinação dos parâmetros morfológicos e funcionais ventriculares. De fato, já foi amplamente validada para quantificar os volumes, a massa e a função tanto do VE quanto do VD, e é considerada, atualmente, a modalidade diagnóstica padrão-ouro para essa avaliação. Dada a sua alta resolução espacial e temporal, e devido a sua natureza tridimencional, que a torna independente de premissas geométricas, a RMC apresenta excelente acurácia e reprodutibilidade características especialmente úteis ao acompanhamento longitudinal dos pacientes. 102
Entretanto, o maior valor da RMC na avaliação dos pacientes com suspeita ou diagnóstico confirmado de miocardite consiste na sua capacidade de proporcionar detalhada caracterização tecidual. Dessa maneira, permite identificar tanto a lesão miocárdica inflamatória das fases aguda e subaguda quanto as lesões cicatriciais frequentemente presentes na fase crônica da doença. As principais técnicas de RMC classicamente utilizadas na caracterização da lesão miocárdica dos pacientes com miocardite são as sequências ponderadas em T2 (“ T2 imaging ”) e a técnica do realce tardio. 103 - 108
Nas imagens adquiridas pelas sequências ponderadas em T2, quanto maior for o conteúdo líquido de um determinado tecido, maior será sua intensidade de sinal. Portanto, essa técnica permite avaliar o edema miocárdico secundário ao processo inflamatório nos pacientes com miocardite aguda (“ edema imaging ”). 102 - 105 A técnica do realce tardio, por sua vez, permite identificar as regiões de necrose no caso das miocardites agudas ou subagudas, e as regiões de fibrose no caso das miocardites crônicas. 106 , 108 - 110 Cabe ressaltar que o padrão de realce tardio da miocardite é muito diferente daquele observado nos casos de IAM. A principal diferença é que, no caso do infarto, o realce tardio sempre acomete o subendocárdio. O acometimento pode até ser transmural, mas a camada subendocárdica sempre está envolvida. No caso da miocardite, o realce tardio é mais frequentemente mesoepicárdico, na maior parte das vezes poupando o endocárdio. Além disso, enquanto, no infarto, as regiões de realce tardio tendem a ser únicas, homogêneas e distribuídas de acordo com os territórios coronarianos, no caso da miocardite, as regiões de realce costumam ser multifocais, heterogêneas e esparsas, não respeitado os territórios coronarianos.
O Consenso de Lake Louise (CLL) original, 105 publicado em 2009, se baseava em três técnicas de RMC. Além da técnica de imagem ponderada em T2 (“ edema imaging ”) e da técnica do realce tardio, ambas mencionadas anteriormente, incluía também a chamada técnica do realce miocárdico precoce. Esta última acabou por ser excluída na atualização dos critérios diagnósticos, após ficar demonstrado que não adicionava valor diagnóstico incremental às demais técnicas. Na prática, o realce miocárdico precoce já não vinha sendo utilizado clinicamente na maior parte dos centros de RMC do mundo.
Recentemente, novas técnicas de RMC capazes de medir os tempos de relaxamento longitudinal (T1) e transversal (T2) do miocárdico foram introduzidas como métodos potencialmente sensíveis e específicos para a detecção de processo inflamatório miocárdico. 111 Em geral, os valores de T1 ou T2 são medidos pixel a pixel e apresentados na forma de mapas paramétricos, os chamados mapas T1 e T2 do miocárdio. O mapa T1 pode ser adquirido antes do contraste (T1 nativo) e 15 a 20 minutos após contraste (momento de relativo equilíbrio da concentração de gadolínio), permitindo, assim, o cálculo do volume extracelular do miocárdio (VEC ou ECV [do inglês, extracellular volume ]). O mapa T2 é usualmente adquirido apenas antes da administração do contraste.
A incorporação dos mapas T1 e T2 constituiu a motivação central para a recente atualização do CLL para o diagnóstico de miocardite pela RMC. De acordo com o novo consenso, 104 esse diagnóstico se baseia na presença de dois critérios principais que podem estar ou não associados a critérios de suporte ( Tabela 6 ). O primeiro critério diagnóstico principal tem por objetivo identificar a presença de edema miocárdico e se fundamenta na utilização de técnicas baseadas em T2: (1) técnica de imagem ponderada em T2 (“ edema imaging ”) e/ou (2) técnica de mapeamento T2. O segundo critério diagnóstico principal também permite detectar a presença de edema miocárdico, mas tem por objetivo primordial identificar a presença de necrose, fibrose e extravasamento capilar. Este segundo critério diagnóstico principal se fundamenta na utilização de técnicas baseadas em T1: (1) técnica do realce tardio e/ou (2) técnicas de mapeamento T1 (T1 nativo ou VEC).
Tabela 6. – Critérios para diagnóstico de miocardite, miopericardite ou perimiocardite.
| Critério Lake Louise atualizado 1 CRITÉRIO T2 POSITIVO + 1 CRITÉRIO T1 POSITIVO | Alvo diagnóstico |
|---|---|
| CRITÉRIOS PRINCIPAIS | |
| Imagem baseada no T2 | |
| Intensidade de sinal aumentada regional do VE (análise visual) ou | E |
| Intensidade de sinal global aumentada – relação ≥ 2 ou | |
| Tempos de T2 (mapa T2) aumentados global ou regionalmente | EDEMA |
| Imagem baseada no T1 | |
| Aumento regional ou global nos tempos de T1 (mapa T1) ou VEC ou | Aumento de T1 = edema (intra ou extracelular), hiperemia, extravasamento capilar, necrose, fibrose Aumento do VEC = edema (extracelular), hiperemia, extravasamento capilar, necrose, fibrose |
| Áreas com aumento de intensidade de sinal em padrão de distribuição não isquêmico em imagens de realce tardio | Realce Tardio = necrose, fibrose |
| CRITÉRIOS DE SUPORTE | |
| Derrame pericárdico nas imagens de cine-RM ou aumento de intensidade de sinal do pericárdio em imagens de realce tardio, mapa T1 ou mapa T2 | Inflamação pericárdica |
| Alteração de contratilidade do VE em imagens de cine-RM | Disfunção do VE |
VE: ventrículo esquerdo; RM: ressonância magnética; VEC: volume extracelular.
Os novos critérios para diagnóstico de miocardite, miopericardite ou perimiocardite e publicados em 2018 estão listados na Tabela 6 . 104
A acurácia da RMC na avaliação dos pacientes com suspeita de miocardite no primeiro CLL foi estimada em 78% (sensibilidade de 67% e especificidade de 91%). 105 Essas estimativas foram posteriormente confirmadas em uma metanálise que demonstrou acurácia de 83%, com uma sensibilidade de 80% e especificidade de 87%. 112 De modo similar, outra metanálise ainda mais recente demonstrou sensibilidade de 78% e especificidade de 88%, com uma área sob a curva (AUC) de 83%. 113 Ainda não existem dados consistentes avaliando a acurácia da RMC utilizando os critérios diagnósticos propostos na segunda versão do CLL. Entretanto, um pequeno estudo recente que incluiu apenas 40 pacientes com miocardite aguda demonstrou sensibilidade de 88% e especificidade de 96% da RMC utilizando os novos critérios revisados (ver Tabela 6 ). 114
As recomendações para o uso da RMC na avaliação diagnóstica e prognóstica dos pacientes com suspeita de miocardite aguda estão sumarizadas na Tabela 7 . 57 , 104 , 109 , 114 - 116
Tabela 7. – Recomendações para o uso da ressonância magnética cardíaca na avaliação diagnóstica dos pacientes com suspeita de miocardite aguda.
| Indicações | Classe | Nível de evidência |
|---|---|---|
| Avaliação de pacientes com elevação dos marcadores de necrose miocárdica e coronárias normais na avaliação angiográfica | I | B |
| Avaliação dos pacientes portadores de cardiomiopatia dilatada e suspeita de miocardite > 6 meses de evolução, com o objetivo de auxiliar na investigação etiológica, excluir possíveis diagnósticos diferenciais e proporcionar informações prognósticas | I | B |
| Reavaliação em até 4 semanas para pacientes com risco prognóstico intermediário ou alto após o episódio agudo, com o objetivo de diferenciar uma evolução não complicada de um curso complicado | IIa | B |
Com base no conjunto das evidências científicas acumuladas desde a primeira versão desta diretriz da SBC, podemos, hoje, indicar uma posição da RMC mais estruturada na tomada de decisão de pacientes com suspeita de miocardite como proposto na estratificação de risco a seguir, na Tabela 8 . 109 , 115 , 117 Tal estratificação deve ser integrada à estratificação de risco ampla que inclui a apresentação clínica e outros exames complementares.
Tabela 8. – Estratificação de risco e probabilidade da indicação de biópsia endomiocárdica baseada nos parâmetros de ressonância magnética cardíaca (RMC).
| Risco prognóstico | Parâmetro da RMC | Conduta sugerida | Indicação de biópsia |
|---|---|---|---|
| Baixo | T1 e T2, sem alteração Sem disfunção ventricular | Seguimento clínico | Sem indicação |
| Intermediário | T1 ou T2, positivos Realce tardio não extenso (<17g e 13% da massa do VE) Função normal ou leve disfunção do VE | Seguimento clínico Repetição da RMC em 1, 3 e 6 meses | Estável: sem indicação Progressão da disfunção: possível indicação |
| Alto | T1 ou T2, positivos Realce tardio extenso (>17g ou 13% da massa do VE), ou com envolvimento do septo interventricular, e/ou disfunção do VE moderada ou importante | Seguimento clínico Repetição da RMC em 1, 3 e 6 meses | Possível indicação |
VE: ventrículo esquerdo.
4.7. Medicina Nuclear
A medicina nuclear tem tido um papel crescente na avaliação do paciente com miocardite. Novos radiotraçadores e novos equipamentos têm traçado todo um novo espectro de contribuições para o manejo de pacientes com suspeita de doenças inflamatórias do miocárdio.
As alterações fisiopatológicas dos diversos tipos de miocardite vão formar a base para o uso das técnicas de medicina nuclear: o processo inflamatório que leva à lesão do miocárdio é caracterizado por infiltração de linfócitos e macrófagos no miocárdio, pelo aumento da permeabilidade vascular e pelo consumo aumentado de glicose no sítio de inflamação e pela necrose celular com redução da perfusão tecidual em comparação com o miocárdio íntegro. Essas características vão se traduzir pela maior captação de citrato de Gálio-67 no miocárdio (especialmente útil nos casos de sarcoidose), pelo aumento do acúmulo de glicose marcada com flúor radioativo (18F-FDG) e pela redução da perfusão miocárdica vista com traçadores com 99mTc-Sestamibi ou 201 Tálio. A Tabela 9 lista os principais radiotraçadores utilizados na miocardite.
Tabela 9. – Principais exames de medicina nuclear empregados em pacientes com suspeita ou diagnóstico de miocardite.
| Exame de medicina nuclear | Principais indicações | Vantagens | Desvantagens |
|---|---|---|---|
| Cintilografia com Gálio-67 | Miocardite e sarcoidose | Ampla disponibilidade | Menor sensibilidade |
| PET com 18F-FDG | Sarcoidose, miocardite lúpica, arritmias cardíacas inexplicáveis | Elevada sensibilidade, uso no acompanhamento da resposta ao tratamento | Menor disponibilidade, maior custo |
| Cintilografia com 123I-MIBG | Avaliação do risco de arritmias ventriculares | Identifica pacientes em risco de morte súbita | Menor disponibilidade de acesso |
PET 18F-FDG: tomografia por emissão de pósitrons 18F-fluorodesoxiglicose.
4.7.1. Radiotraçadores para Cintilografia por Emissão de Fóton Único (SPECT)
O citrato de Gálio-67 é um traçador consagrado para pesquisa de infecção em medicina nuclear que se liga a células inflamatórias em sítios de aumento de permeabilidade vascular graças à sua característica ligação com as proteínas transportadoras do ferro como a lactoferina e nos lisossomos leucocitários. O Gálio-67 tem baixa sensibilidade (36%) para detecção de miocardite em pacientes com miocardiopatia dilatada de início recente e não deve ser empregado de rotina com essa indicação ( Tabela 10 ). 118 O único tipo de miocardite com alto rendimento positivo para a cintilografia com Gálio-67 é a decorrente da sarcoidose, em que os granulomas com células gigantes são especialmente ávidos para a retenção do radiotraçador. A presença de cintilografia com Gálio-67 positiva é considerada como um critério maior para o diagnóstico de sarcoidose cardíaca pelo consenso de especialistas da Heart Rhythm Society (HRS). 119 Outro achado significativo observado em pacientes com sarcoidose cardíaca é a alteração de perfusão decorrente da presença de constrição microvascular miocárdica nos vasos circunjacentes aos granulomas. O defeito de perfusão observado na cintilografia em repouso pode desaparecer na imagem de estresse, um padrão denominado redistribuição reversa que pode ser associado à sarcoidose.
Tabela 10. – Recomendações para o uso dos exames de medicina nuclear na avaliação diagnóstica dos pacientes com suspeita de miocardite aguda.
| Indicações | Classe | Nível de evidência |
|---|---|---|
| PET com 18F-FDG para auxiliar no diagnóstico de miocardite | IIa | B |
| Cintilografia com Gálio-67 para auxiliar no diagnóstico de miocardite | IIb | B |
PET 18F-FDG: tomografia por emissão de pósitrons 18F-fluorodesoxiglicose.
A cintilografia com Gálio-67 pode ser empregada como alternativa a pacientes sem acesso ou que tenham contraindicação à realização de RMcom gadolínio (claustrofobia, alergia ao contraste, insuficiência renal) e pode contribuir em casos suspeitos de miocardite por critérios clínicos (febre, história recente de infecção respiratória ou intestinal, elevação de marcadores de necrose), sendo útil também no diagnóstico diferencial entre IAM com coronárias normais e miocardite, conforme o estudo de Hung et al., 120 em que a técnica se mostrou positiva quando realizada precocemente após o surgimento de sintomas. 120 Alguns casos de miocardite podem apresentar agressão regional no miocárdio e ser a etiologia de arritmias, onde os estudos com Gálio-67 podem demonstrar acúmulo focal em áreas dos ventrículos e até mesmo dos átrios isoladamente. 121
4.7.2. Radiotraçadores para Tomografia por Emissão de Pósitrons (SPECT)
O 18F-FDG é captado pelas células inflamatórias como transporte ativo de modo independente da ação da insulina. Dessa maneira, quando é realizada uma adequada supressão da captação de glicose pelo miocárdio, o PET com 18F-FDG se transforma em uma sensível ferramenta para diagnóstico de inflamação miocárdica e para acompanhamento da mesma em resposta ao tratamento ( Tabela 10 ).
O maior número de estudos do uso do PET com 18F-FDG na miocardite está concentrado na sarcoidose cardíaca, em que recente metanálise demonstrou sensibilidade de 84% e especificidade de 83%. 122 Para que o PET com 18F-FDG seja útil na sarcoidose ou em outras afecções inflamatórias cardíacas como miocardite, endocardite infecciosa ou na rejeição após transplante, é crucial o adequado preparo do paciente para evitar que insulina circulante leve a acúmulo não inflamatório de 18F-FDG no miocárdio. Entre os diversos esquemas de preparo indicados, o uso do jejum prolongado de 12 horas a 18 horas antes da injeção do radiotraçador é um dos mais aplicados, bem como a utilização de uma dieta rica em lipídios e proteínas, enquanto o uso da heparina não é consensual. 123 , 124 O marco diagnóstico de atividade inflamatória é a captação focal do 18F-FDG no miocárdio, enquanto há significado prognóstico a presença de captação de 18F-FDG no VD e a presença de captação inflamatória em áreas de hipoperfusão, as denominadas áreas de discordância ( mismatch ): metabolismo aumentado com perfusão reduzida. 124 A utilização do PET com 18F-FDG também é empregada para acompanhamento da resposta ao tratamento na sarcoidose cardíaca e para avaliação da atividade da doença extracardíaca. Um algoritmo proposto de acompanhamento é o da Figura 3 , adaptado de Young et al. 125
Figura 3. – Algoritmo proposto para diagnóstico e acompanhamento da resposta ao tratamento na sarcoidose cardíaca. PET 18F-FDG: tomografia por emissão de pósitrons 18F-fluorodesoxiglicose.
Adaptado de Young et al.125
A miocardite não associada à sarcoidose tem como técnica diagnóstica padrão a RMC. O aumento da intensidade de sinal das imagens pesadas em T2 (edema), o aumento do realce precoce de gadolínio (hiperemia) e a impregnação tardia de gadolínio no miocárdio (realce tardio para necrose) têm, combinados, sensibilidade de 67% e especificidade de 91% para o diagnóstico de miocardite. Entretanto, em muitos casos, há limitações para uso adequado da técnica como baixa qualidade do sinal nas imagens em T2, artefatos e impossibilidade do uso do contraste gadolínio. Nesses casos, o uso do PET 18F- FDG pode ser bastante útil na complementação da investigação diagnóstica, seja em equipamentos de PET-CT ou mais modernamente em equipamentos de PET-RM, que associam ao PET um equipamento de RM. 126 Estudos com PET-RM têm demonstrado que o PET é superior à RM na identificação de áreas de inflamação cardíaca em atividade. 127
O PET-CT com 18F-FDG tem sido utilizado em condições como lúpus eritematoso sistêmico, 128 miocardite de células gigantes, 129 esclerodermia 130 e até mesmo na cardite reumática, 131 como técnica para identificação de inflamação em atividade com sucesso. Outro uso recente do PET com 18F-FDG que vem crescendo é na investigação da etiologia de arritmias: sarcoidose cardíaca e miocardite crônica, incluindo doença de Chagas, como causa de arritmias ventriculares, 132 bem como na investigação de distúrbios de condução, especialmente indivíduos com menos de 50 anos de idade e bloqueio atrioventricular em que o PET tem identificado diversos casos de sarcoidose e mesmo de tuberculose cardíaca como causa do distúrbio de condução. 133 No estudo de Tung et al., 50% dos pacientes com miocardiopatia e arritmias ventriculares inexplicáveis tiveram o PET com 18F-FDG positivo, indicando a presença de miocardite não suspeita por outras técnicas. 134
4.7.3. Perspectivas Adicionais
Novos radiotraçadores têm sido avaliados em pacientes com inflamação miocárdica, como é o caso do 68Gálio-dotatate, que tem afinidade pelos receptores de somatostatina que estão expressos em células inflamatórias. Outro radiotraçador que tem sido analisado é o 123I-MIBG, que avalia o estado da inervação adrenérgica pré- sináptica cardíaca. Apesar de o radiotraçador não identificar de modo direto o estado inflamatório, ele tem relação importante com o risco aumentado de arritmias ventriculares, em especial, em pacientes com miocardite crônica chagásica, demonstrando as áreas de miocárdio viável que são denervadas e, por isso, mais vulneráveis à taquicardia ventricular sustentada. 135
4.8. Angiotomografia de Coronárias e Coronariografia
A miocardite aguda pode mimetizar IAM com dor torácica típica, anormalidades no ECG similares ao IAM com ou sem supradesnivelamento do segmento ST, elevação das enzimas cardíacas e instabilidade hemodinâmica. 136
Na suspeita de miocardite com apresentação parecida com um infarto, é necessário excluir DAC por coronariografia percutânea ou angiotomografia de coronárias. A cinecoronariografia de rotina também deve ser realizada durante a investigação de uma nova cardiomiopatia dilatada. 137
A análise de 46 publicações avaliando a fisiopatologia subjacente de IAM com artérias coronárias não obstrutivas (MINOCA) revelou um infarto típico na RMC em apenas 24% dos pacientes, miocardite em 33% e sem anomalia significativa em 26%. 138 A idade jovem e a PCR estavam associadas à miocardite, enquanto sexo masculino, hiperlipidemia tratada, alta razão de troponina e baixa PCR estavam associados ao IAM verdadeiro. 139
Como pacientes com miocardite aguda que imitam o IAM com supradesniveamento do segmento ST têm um prognóstico favorável, é importante estabelecer o diagnóstico correto para evitar tratamentos desnecessários e potencialmente perigosos. 139
A angiotomografia computadorizada de coronárias (angio-TC) é um exame simples e rápido, e fornece uma avaliação abrangente das características das artérias coronárias e do tecido miocárdico. Na prática, a aquisição da angio-TC em primeira passagem permite a avaliação da anatomia coronariana e do realce do ventrículo esquerdo. A aquisição tardia de angio-TC é realizada 3 a 5 minutos mais tarde, sem necessidade de reinjeção do meio de contraste, permitindo a captação de iodo em imagens tardias com contraste realçados de maneira semelhante à RM do coração. 140 , 141
A angio-TC e a RM do coração têm maneiras próprias e exclusivas de evitar uma angiografia coronariana invasiva, para excluir DAC (significativa) e para detectar outras doenças, como dissecção aguda da aorta, embolia pulmonar, miocardite ou cardiomiopatia de estresse. 142
A grande disponibilidade da angio-TC, combinada com a possibilidade de descartar síndrome coronariana aguda (SCA) com angiografia coronariana durante o mesmo exame, torna-a promissora no refinamento das imagens de miocardite aguda ( Tabela 11 ). 141
Tabela 11. – Indicação de angiotomografia computadorizada de coronárias na avaliação diagnóstica dos pacientes com suspeita de miocardite aguda.
| Indicação | Classe | Nível de evidência |
|---|---|---|
| Angiotomografia de coronárias para exclusão de coronariopatia obstrutiva grave na investigação de miocardite como alternativa à coronariografia em pacientes com probabilidade pré-teste baixa ou intermediária de DAC | I | C |
DAC: doença arterial coronariana.
Em crianças com suspeita de miocardite e doença de Kawasaki, a angiotomografia computadorizada pode ser usada na avaliação das anormalidades nas artérias coronarianas. 143
A última diretriz da European Society of Cardiology (ESC) sugere que, na ausência de doença arterial coronariana angiograficamente significativa (estenose ≥50%) ou condições preexistentes que poderiam explicar o cenário clínico, pacientes que têm pelo menos uma das cinco apresentações clínicas (dor torácica aguda; IC aguda ou com piora com ≤3 meses de dispneia, fadiga e/ou sinais de IC; IC crônica com >3 meses de dispneia, fadiga e/ou sinais de IC; palpitações, sintomas de arritmias inexplicáveis e/ou síncope e/ou morte abortada; choque cardiogênico inexplicável) e/ou certos testes diagnósticos de suporte (ECG, Holter , troponina, anormalidades de função ventricular e edema e/ou realce tardio do gadolínio com padrão miocárdico clássico) devem ser considerados como tendo “suspeita clínica de miocardite” e, assim, justificar uma avaliação adicional. 12 , 72
4.9. Biópsia Endomiocárdica: Indicações, Técnica e Complicações
A análise histopatológica do tecido do miocárdio é ferramenta importante para diagnóstico e prognóstico nos pacientes com miocardite. A biópsia endomiocárdica (BEM) utilizando critérios histopatológicos padronizados (critérios de Dallas) 144 e imuno-histoquímicos é o atual padrão-ouro para diagnóstico de miocardite. 137
Os critérios de Dallas, isoladamente, apresentam limitações, em virtude do alto grau de variabilidade interobservador na interpretação patológica e detecção de processos inflamatórios não celulares, diagnosticando em torno 10% a 20% dos pacientes. 15 Assim, de acordo com a definição da OMS, a imuno-histoquímica com o uso de painel de anticorpos monoclonais e policlonais é mandatória para diferenciar os componentes inflamatórios presentes. 145 , 146
A análise genômica viral no miocárdio doente, quando acoplada com as análises imuno-histoquímicas, melhorou a precisão e a utilidade diagnóstica e prognóstica da BEM. 147 É recomendada a triagem viral: enterovírus, influenza, adenovírus, citomegalovírus, vírus Epstein-Barr, parvovírus B19, herpes-vírus humano. 137
No entanto, como alguns genomas virais (p. ex., PVB19) podem ser detectados em corações normais e em doenças cardíacas isquêmicas e valvares, 148 pode ser necessário o uso complementar de mRNA específicos de DNA virais para definir infecção ativa. 149
4.9.1. Ponderações para Indicação
A BEM realizada precocemente na apresentação clínica grave auxilia no diferencial diagnóstico de tipos específicos de miocardite (células gigantes, alérgica, eosinofílica, sarcoidose) que implicam diferentes tratamentos (p. ex., imunossupressores) e prognóstico ( Tabela 12 ). 150
Tabela 12. – Recomendações para a utilização de biópsia endomiocárdica (BEM).
| Indicações | Classe | Nível de evidência |
|---|---|---|
| IC de início recente (<2 semanas), sem causa definida, não responsiva ao tratamento usual e com deterioração hemodinâmica | I | B |
| IC de início recente (2 semanas a 3 meses), sem causa definida e associada a arritmias ventriculares ou bloqueios atrioventriculares de segundo ou terceiro grau | I | B |
| Na presença de suspeita clínica de miocardite linfocítica grave, miocardite de células gigantes, miocardite eosinofílica necrosante | I | B |
| IC com início >3 meses e <12 meses, sem causa definida, não responsiva à terapia-padrão otimizada | IIa | C |
| IC decorrente de cardiomiopatia dilatada de qualquer duração, com suspeita de reação alérgica e/ou eosinofilia | IIa | C |
| Arritmias ventriculares frequentes na presença ou não de sintomas, sem causa definida | IIb | C |
| Suspeita clínica apoiada por métodos diagnósticos não invasivos de miocardite | IIb | C |
IC: insuficiência cardíaca.
Além disso, fornece diagnóstico diferencial de doenças que podem simular miocardite (cardiomiopatia arritmogênica do ventrículo direito, cardiomiopatia de Takotsubo, cardiomiopatia periparto, distúrbios inflamatórios/de armazenamento). 150
Atualmente, a principal indicação para BEM ocorre em pacientes com IC de início recente (menos de 2 semanas), acompanhada de apresentação clínica grave (instabilidade hemodinâmica, uso de suporte circulatório mecânico ou inotrópico, refratariedade ao tratamento clínico) ou arritmias de alto risco (arritmias ventriculares sustentada ou sintomática ou bloqueios cardíacos de alto grau) ( Tabela 12 ). 151 , 152
No entanto, sabe-se as recomendações antecedentes foram baseadas notadamente nos critérios de Dallas, nos quais diagnóstico, valor prognóstico e terapêutico é limitada. Com o uso da análise imuno-histoquímica e genômica viral, cresce a tendência de uma aplicação mais liberal da BEM na suspeita de miocardite clinicamente independente do padrão e gravidade da apresentação. 12
Por outro lado, o valor de BEM é questionável em pacientes que apresentam síndromes de baixo risco e respondem a tratamento padrão sem perspectiva de implicação terapêutica ou prognóstica. Finalmente, no cenário de síndromes de risco intermediário, a BEM deve ser considerada no caso de manutenção ou agravamento dos sintomas, disfunção ventricular, arritmias, distúrbios de condução ( Figura 4 ). 153
Figura 4. – Fluxograma terapêutico de miocardite com base no grau de suspeição clínica e no prognóstico.
BAV: bloqueio atrioventricular; BEM: biópsia endomiocárdica; BRA: bloqueador do receptor da angiotensina; CAT: coronariografia; DAC: doença arterial coronariana; ECG: eletrocardiograma; ECO: ecocardiograma transtorácico; ESV: extrassístoles ventriculares; IECA: inibidor da enzima de conversão; RMC: ressonância magnética cardíaca; TC: tomografia computadorizada.
4.9.2. Prognóstico
Enquanto os critérios de Dallas não são um preditor preciso de resultados clínicos, as evidências imuno-histológicas de inflamação miocárdica estão associadas a um risco aumentado de morte cardiovascular e necessidade de transplante cardíaco. 153
Na miocardite por células gigantes, a gravidade da necrose e fibrose está associada a um risco aumentado de morte e transplante. 154
A ausência ou presença de genomas enterovirais residuais em amostras repetidas correlacionou-se com a progressão para a cardiomiopatia em estágio terminal, enquanto depuração viral espontânea foi associada à melhora da função sistólica. 155
4.9.3. Técnica
O procedimento deve ser realizado no laboratório de hemodinâmica, por hemodinamicista com experiência na realização desse procedimento. A anestesia é local com sedação consciente, se necessário, sempre sob a supervisão do anestesiologista.
A BEM pode ser realizada de maneira segura, guiada por fluoroscopia direta, e deve ter auxílio do ecocardiograma na sua realização que servirá de guia para o posicionamento correto do biótomo para que se evite puncionar a parede livre do VD.
A RMC é particularmente útil para facilitar uma abordagem guiada, em virtude de sua utilidade na distinção entre miocárdio normal e doente, e tem sido avaliada para aumentar valores preditivos. 155
Não existem estudos comparativos para que se recomende a biópsia endocárdica do VD ou do VE; entretanto, a realização da BEM do VE deve ser criteriosamente analisada em casos de doença restrita ou predominante em VE.
As amostras devem ser obtidas no ventrículo direito, especialmente a porção distal do septo interventricular e a área trabeculada apical, evitando-se a parede livre do VD. O número de amostras dependerá da pesquisa a ser realizada. No caso de investigação de miocardite viral, devem ser 10 amostras (6 para pesquisa viral, 2 para hematoxilina-eosina e 2 para imuno-histoquímica). No caso de investigação de doenças infiltrativas ou de depósito, 6 fragmentos (2 para hematoxilina-eosina, 2 para imuno-histoquímica e 2 para microscopia eletrônica). As amostras para HE e imuno-histoquímica devem ser colocadas em frasco de formalina tamponada a 10% e não devem ser refrigeradas. As amostras para pesquisa viral devem ser colocadas em microtubos tipo Eppendorf® (sem soluções de transporte), e estes em recipientes com gelo seco, e rapidamente transferidas para refrigeradores –70 graus para armazenamento. As amostras para microscopia eletrônica devem ser acondicionadas em tubos Eppendorf® com solução oct.
A BEM pode ser repetida, se necessário, para monitorar a resposta à terapia dirigida à etiologia ou se houver suspeita de erro de amostragem em um paciente com progressão inexplicada de IC. 156
4.9.4. Complicações
Embora a BEM tradicional seja considerada um procedimento seguro, diferentes complicações foram relatadas.
Quando realizada em centros experientes, sua principal taxa de complicações é <1%, o que é semelhante ao da angiografia coronariana. 97 A utilização do ecocardiograma associado à fluoroscopia reduz de forma significativa a possibilidade de punção inadvertida que possa ocasionar perfuração miocárdica ou lesão de coronária. 155
Podemos distinguir complicações relacionadas ao acesso vascular e inserção da bainha e complicações relacionadas à remoção de amostras. As complicações relacionadas ao acesso vascular são: punção arterial incidental; sangramento prolongado; hematoma e dissecção vascular.
As comumente descritas são: reação vasovagal, BAV de graus variados, perfuração de parede livre de VD, pneumotórax, perfuração do septo interventricular, hematoma de sítio de punção, fístulas intracardíacas, hematoma retroperitoneal (acesso femoral), derrame pericárdico, deslocamento de trombos, tamponamento cardíaco, ruptura de cordoalhas tricúspides, arritmias ventriculares. 157
Em resumo, o risco da BEM depende da condição clínica dos pacientes, da experiência do operador e de todas as ferramentas tecnológicas disponíveis para prevenir, diagnosticar e gerenciar complicações.
4.10. Análise Histológica e Pesquisa Viral – Biologia Molecular e Genoma
4.10.1. Análise Histológica
A miocardite é definida como uma doença inflamatória do miocárdio diagnosticada por critérios histológicos e imuno-histológicos. De acordo com os critérios de Dallas, a miocardite ativa é histologicamente definida como uma infiltração inflamatória do miocárdio com necrose de miócitos adjacentes, enquanto a miocardite limítrofe é diagnosticada quando o infiltrado inflamatório está presente, mas não é demonstrada lesão/necrose nas próprias células cardíacas. 158
No entanto, os critérios de Dallas são considerados inadequados no diagnóstico de paciente com suspeita de miocardite clinicamente devido à sua limitação quanto à variabilidade na interpretação, falta de valor prognóstico e baixa sensibilidade em virtude de erro amostral. Essa limitação pode ser superada pelo envolvimento de manchas imuno-histológicas de células infiltrativas (leucócitos/linfócitos T/macrófagos) e antígenos de superfície (ICAM-1/HLA-DR).
Além do diagnóstico da miocardite, a avaliação histopatológica dos critérios histológicos é essencial para alcançar uma classificação da miocardite nas formas linfocítica, eosinofílica, célula gigante, granulomatosa e/ou polimórfica, que geralmente refletem etiopatogênese diferente do processo inflamatório. 12
Além disso, o exame histológico das seções de parafina por diferentes protocolos de coloração (HE, EvG, PAS, Azan) é usado para detectar morte celular do miocárdio, cicatrizes, fibrose, disfunções, alterações dos cardiomiócitos e condições vasculares patológicas. Amiloidose, depósitos de ferro, glicogênio e outras doenças de armazenamento podem ser excluídas ou especificadas por coloração adicional.
4.10.2. Análise Imuno-histoquímica
A imuno-histoquímica aumentou significativamente a sensibilidade da BEM e fornece informações sobre o prognóstico clínico. A precisão diagnóstica da imuno- histologia para detecção de inflamação é maior que a dos critérios histológicos. A avaliação imuno-histoquímica é baseada na análise de reação específica antígeno-anticorpo. Um valor >14 leucócitos/mm2 com presença de pelo menos linfócitos T >7 células/mm2 foi considerado um corte realista para se chegar ao diagnóstico de miocardite. 12
Quantificação de células infiltrativas adicionais, incluindo macrófagos (Mac- 1/CD69), células CD4+, CD8+, células citotóxicas (perforina) e quantificação do antígeno leucocitário humano (HLA-DR) e molécula intracelular de adesão celular- 1 (ICAM- 1) é obrigatória para caracterizar ainda mais as populações de células inflamatórias. Assim, a caracterização e a quantificação exata da inflamação do miocárdio é relevante para o prognóstico e para identificar diferentes marcadores de miocardite crônica/autoimune aguda, infecciosa, negativa por vírus (ver Figura 4 ).
Outras manchas de imunofluorescência devem ser usadas para definir a rejeição humoral na BEM de transplante cardíaco, como C3d e C4d, ou para subtipagem de formas amiloides.
4.10.3. Análise do Perfil Genético
Miocardite idiopática de células gigantes e sarcoidose cardíaca são distúrbios raros que causam IC aguda com choque cardiogênico e/ou arritmias ventriculares com risco de vida na ausência de outras etiologias e apresentam prognóstico extremamente ruim, com taxas de sobrevida em 4 anos inferiores a 20%. 159
O principal problema para o diagnóstico correto é o erro de amostragem pelo exame histológico das BEM. Foram identificados perfis genéticos diferenciais distintos que permitiram uma clara discriminação entre os tecidos que abrigam células gigantes e aqueles com miocardite aguda ou controles livres de inflamação. Além disso, os perfis gênicos específicos da doença mudam durante o tratamento eficaz e podem ser aplicados no monitoramento da terapia. 160
4.10.4. Virologia
Os genomas microbianos são determinados, quantificados e sequenciados usando métodos baseados em PCR, incluindo nested-PCR-RT e PCR quantitativo, determinando a análise da carga viral. A sequenciação do produto genético viral amplificado é obrigatória.
Em especial, é possível analisar todos os vírus que podem ser responsáveis pela doença. Os genomas de vírus cardiotrópicos mais comuns relatados no miocárdio são parvovírus B19 (B19V), enterovírus (EV), adenovírus (ADV), vírus da gripe, vírus do herpes humano-6 (HHV-6), vírus de Epstein-Barr, citomegalovírus, vírus da hepatite C e vírus da imunodeficiência humana (HIV) ( Tabela 13 ).
Tabela 13. – Vírus comuns na BEM.
| Vírus comuns na BEM | |
|---|---|
| Adenovírus | Parvovírus B19 |
| Arbovírus | Poliomielite |
| Arenavírus | Raiva |
| Coronavírus | Vírus sincisial respiratório |
| Coxsackie vírus (A, B) | Rubéola |
| Citomegalovírus | Vaccinia |
| Dengue | Varicela-zóster |
| Echo vírus | Varíola |
| Encefalomiocardite | Vírus da Zika |
| Epstein-Barr | HIV |
| Hepatite B | Influenza (A, B) |
| Hepatite C | Metapneumovírus |
| Herpes simples | Caxumba |
| Herpes-vírus 6 |
BEM: biópsia endomiocárdica.
O PVB19 é o vírus cardiotrópico predominante encontrado na miocardite. O impacto clínico no coração ainda está em discussão. O PVB19 cardiotrópico transcripcionalmente ativo com intermediários de replicação positiva nas BEM parece ser clinicamente relevante, porque os pacientes com miocardite caracterizados por PVB19 cardiotrópico transcricionalmente ativo com intermediários de replicação positivos têm uma expressão genética alterada em comparação aos pacientes com controle PVB19 latente. No entanto, a PCR pode resultar negativa, embora o organismo causal tenha origem viral, devido à depuração viral.
Embora se pense que os vírus sejam a causa mais comum de miocardite, os títulos virais não são úteis no diagnóstico e tratamento.
5. Tratamento
5.1. Fluxogramas Terapêuticos
A maioria das miocardites apresenta um prognóstico favorável com regressão espontânea dos sintomas clínicos e função ventricular preservada sem necessidade de intervenção terapêutica. O fluxograma terapêutico da miocardite na maioria dos pacientes é guiado por meio da suspeita diagnóstica, uma vez que somente uma minoria dos pacientes será submetida à investigação por BEM ( Figura 4 ). 65
Os pacientes com baixa suspeita diagnóstica de miocardite com apresentação clínica sem sinais de gravidade, função ventricular preservada e sem arritmias ventriculares apresentam evolução prognóstica favorável, sendo seguidos por acompanhamento clínico sem utilização de terapêutica medicamentosa. Nos pacientes com suspeita diagnóstica intermediária, com função ventricular preservada ou com disfunção ventricular com melhora evolutiva, a terapêutica é cardioprotetora com betabloqueadores, inibidores da enzima de conversão ou bloqueadores do receptor da angiotensina com objetivo de preservar ou melhorar a função ventricular. 12 , 55
Os pacientes com alta suspeita diagnóstica, que evoluem com algum dos indicadores de pior prognóstico, como piora clínica, instabilidade hemodinâmica, manutenção ou piora da disfunção ventricular, arritmias ventriculares frequentes e distúrbios de condução significativos, devem ser submetidos à BEM, com objetivo de pesquisa de inflamação e do agente etiológico, que oferecem a possibilidade de estabelecer terapêutica específica com imunossupressão, 161 , 162 imunomodulação 163 - 166 e antivirais, 167 - 170 que poderão trazer benefícios na melhora clínica, classe funcional, função ventricular e sobrevida 8 , 162 , 171 - 175 ( Figura 5 ).
Figura 5. – Fluxograma terapêutico da miocardite com base nos resultados da BEM.
CMPD: cardiomiopatia dilatada; PCR: reação em cadeia da polimerase
5.2. Imunossupressão: Indicações e Tipos
A terapêutica imunossupressora na miocardite tem como objetivo suprimir a resposta inflamatória e a atividade autoimune, visando como alvo à melhora clínica, da função ventricular, além de redução da mortalidade.
Na miocardite linfocitária, apesar do racional fisiopatológico para utilização de imunossupressão, com base na presença de inflamação miocárdica por meio da BEM, associada à pesquisa de genoma viral negativa, as evidências corroborando seu uso são limitadas. Fatores como a regressão espontânea da inflamação, a falta de uniformidade dos estudos quanto aos critérios diagnósticos, o reduzido número de pacientes na maioria dos ensaios, a heterogeneidade das características clínicas das populações estudadas e a ausência de estudos com objetivo principal de avaliar a redução da mortalidade de forma isolada dificultam a análise dos benefícios clínicos da terapêutica imunossupressora na miocardite linfocitária ( Tabela 14 ). 55 , 161 , 162 , 172 , 176 - 179
Tabela 14. – Análise dos benefícios clínicos da terapêutica imunossupressora na miocardite linfocitária.
| Autor | Desenho | Intervenção | Placebo | N | Doença | Duração dos sintomas | Inclusão | BEM vírus positivo | FEVE | Resultados |
|---|---|---|---|---|---|---|---|---|---|---|
| Parillo 1989 | Randomizado controlado | Prednisona | Não | 102 | <2 anos | Média 8m | Idiop | Sim Não | >35% | Neutro |
| Latham 1989 | Randomizado controlado | Prednisona | Não | 52 | MCD | < 2 anos Média 1,6 a 1,8 m | Idiop | Sim Não | <40% | Neutro |
| Wojnicz 2001 | Randomizado controlado, aberto | Prednisona + Azatioprina | Sim | 84 | MCD | >6 meses | HLA | Sim Não | <40% | Melhora FE |
| Wojnicz 2006 | Randomizado controlado, aberto, 2 centros | Atorvastatina | Não | 74 | MCD | >6 meses | HLA | Sim Não | <40% | Melhora FE/CF NYHA |
| Frustaci 2009 | Randomizado controlado, duplo cego, multicêntrico | Prednisona + Azatioprina | Sim | 85 | MCD | >6 meses | CD3>7 CD45>14 Vírus neg | Sim Sim | <45% | Melhora FE |
| Merken 2018 | Série de Casos | Prednsiona + azatioprina | Não | 180 | MCD | Média 8 a 11 m | CD3>7 CD45>14 Vírus neg | Sim Sim | <45% | Melhora sobrevida livre de TX/ FE |
BEM: biópsia endomiocárdica; CF NYHA: classe funcional da New York Heart Association; CMD: cardiomiopatia dilatada; FEVE: fração de ejeção de ventrículo esquerdo; HLA: antígeno de histocompatibilidade; TXC: transplante cardíaco.
No estudo MTT, 178 que incluiu pacientes com miocardite diagnosticada pelos critérios de Dallas associada à presença de disfunção ventricular, o uso de imunossupressão por 6 meses não demonstrou superioridade na melhora da função ventricular e de sobrevida em relação ao tratamento convencional, apesar de não ter realizado pesquisa de agentes infecciosos. O estudo italiano duplo-cego, randomizado, placebo-controlado TIMIC 162 demonstrou melhora da função ventricular com imunossupressão em pacientes com miocardite à biópsia (acima de sete linfócitos por campo), mais de 6 meses de IC e ausência de genoma viral na BEM. Dessa forma, apesar de momento evolutivo diferente em relação à fase mais aguda da miocardite, esse estudo demonstrou o benefício da imunossupressão na ausência de genoma viral no miocárdio. No entanto, a não identificação de vírus específicos define que não estão presentes os vírus pesquisados, não afastando a possibilidade de que outros microrganismos poderiam estar presentes. 162 Além disso, o achado qualitativo de microrganismos em BEM não estabelece uma relação causal indubitável com o desenvolvimento de miocardite/miocardiopatia, uma vez que podemos encontrar genoma viral em miocardiopatias de outras etiologias específicas e até mesmo em corações normais. 45 , 180 , 181 Tomando como exemplo o parvovírus B19, cuja presença no tecido miocárdico pela PCR qualitativa é comum, outras técnicas documentando a baixa quantidade de cópias 167 ou ausência de transcrição para RNA 182 poderiam inferir a não correlação com desenvolvimento de miocardite/miocardiopatia, permitindo a consideração de imunossupressão, mesmo com o genoma desse vírus presente.
No contexto da miocardite por doenças autoimunes, a utilização de imunossupressão é bem estabelecida, e, para cada entidade, diferentes estratégias podem ser consideradas, sendo a maioria envolvendo o uso de corticosteroide, geralmente combinado com outras drogas imunossupressoras ( Tabela 15 ). 183 - 188
Tabela 15. – Indicação de imunossupressão na miocardite por doença autoimune.
| Miocardite de células gigantes | Rara, porém fulminante, melhora de prognóstico com imunossupressão combinada | Corticosteroide em combinação (ciclosporina + azatioprina) |
|---|---|---|
| Sarcoidose | Doença sistêmica, principalmente pulmonar. Miocardite em 10%, bloqueios, taquiarritmias e disfunção ventricular | Corticosteroide em combinação (ciclofosfamida, metotrexato) imunobiológicos em casos refratários |
| Lúpus eritematoso sistêmico | Miocardite em 50%, pode ser subclínica; rara com imunossupressão atual; pode acelerar aterosclerose | Pulsoterapia com corticosteroide (depois VO em desmame), combinação (ciclofosfamida), plasmaférese, IVIg |
| Esclerose sistêmica | Miocardite ou secundária à hipertensão pulmonar. Arritmias, distúrbios de condução e disfunção ventricular | Corticosteroide em combinação (ciclosfamida, azatioprina) |
| Behçet | Miocardite é rara (0,5%), prognóstico ruim | Corticosteroide em combinação (colchicina, anticoagulação) |
| GEPA (Churg-Strauss) | Miocardite em até 50%; história de asma, presença de eosinofilia; dor torácica, palpitações até choque cardiogênico | Corticosteroide em combinação (ciclofosfamida) |
| Artrite reumatoide | Miocardite em 30%, pode ser subclínica; rara com imunossupressão atual; pode acelerar aterosclerose | Corticosteroide em combinação (metotrexate, imunobiológicos) |
Devido à gravidade do quadro clínico, apesar da baixa incidência, o diagnóstico de miocardite de células gigantes não pode ser postergado, e seu tratamento envolve imunossupressão intensiva combinada. Trabalho clássico de Cooper et al. 8 demonstrou aumento de sobrevida de 3 para 12 meses, quando comparado ao não uso de imunossupressão ou apenas corticosteroide em relação ao uso combinado de imunossupressão (corticosteroide e/ou azatioprina e/ou ciclosporina e/ou anticorpo antilinfócito). 8 Casuística mais recente demonstrou sobrevida de 58% em 5 anos com uso combinado de corticosteroide, ciclosporina e azatioprina. 189 Em casos refratários, existe a descrição do uso de anticorpo antilinfócito, 190 micofenolato 191 e sirolimo. 192
A miocardite eosinofílica pode ser secundária à reação de hipersensibilidade a drogas, doenças autoimunes (granulomatose eosinofílica com poliangeíte ou síndrome de Churg-Strauss), síndrome hipereosinofílica, infecções e câncer, ou idiopática, sendo a imunossupressão também considerada nesse contexto, habitualmente utilizando corticosteroide. Revisão recente dos casos de literatura demonstram presença de eosinofilia periférica em 75% dos casos, uso de imunossupressão em 80%, e combinação em 20% (especialmente Churg-Strauss e hipereosinofílica, com elevada mortalidade em 30 dias (13% hipereosinofílica, 17% idiopática, 23% Churg-Strauss e 40% por hipersensibilidade). 193
A terapêutica imunossupressora mais comumente utilizada nos pacientes com diagnóstico de miocardite envolve corticosteroide isoladamente ou em associação com azatioprina ( Tabela 16 ), havendo o diagnóstico por BEM de inflamação com ausência de infecção viral como determinantes para a realização da imunossupressão ( Tabela 17 ). Os pacientes submetidos à terapêutica imunossupressora devem ser clinicamente monitorados de modo contínuo quanto ao desenvolvimento de paraefeitos, pois estes podem aumentar de forma significativa tanto a morbidade quanto a mortalidade. 55
Tabela 16. – Terapêutica imunossupressora com corticosteroide.
|
|
|
Tabela 17. – Indicações da terapêutica imunossupressora na miocardite.
| Indicações | Classe | Nível de evidência |
|---|---|---|
| Na presença de miocardite positiva – por células gigantes, doenças autoimunes, sarcoidose e eosinofílica – associada à disfunção ventricular | I | B |
| Na presença de miocardite positiva com pesquisa viral negativa, comprovada por biópsia endomiocárdica, em pacientes com insuficiência cardíaca crônica, com objetivo de melhora clínica e da função ventricular | IIa | B |
| Na insuficiência cardíaca aguda não responsiva à terapêutica usual | III | C |
5.3. Antivirais: Indicações e Tipos
O prognóstico da cardiomiopatia inflamatória/miocardite é afetado negativamente pela persistência do vírus. O curso da cardiomiopatia viral é para certos vírus intimamente associados ao curso espontâneo da infecção viral, pois a eliminação espontânea do vírus é acompanhada de melhora clínica, enquanto isso não se aplica a pacientes que desenvolvem persistência do vírus. 194 - 197
Pacientes com genomas enterovirais e adenovirais em CEM devem ser tratados com interferon beta (IFN-ß) (4 milhões de unidades por via subcutânea a cada 48 horas na primeira semana, 8 milhões de unidades por via subcutânea a cada 48 horas a partir da segunda semana e por 6 meses). Pode ser demonstrado em um estudo não randomizado que a administração de IFN-ß em pacientes positivos para EV e ADV induziu a eliminação do vírus, reduziu a lesão do miocárdio e melhorou significativamente a sobrevida a longo prazo. 198 , 199 Em um estudo de fase 2 seguinte – betaferon em um teste de cardiomiopatia viral crônica (BICC) – 143 pacientes com sintomas de IC e confirmação por biópsia dos genomas de EV, ADV e/ou B19V foram aleatoriamente designados para tratamento duplo-cego e receberam placebo ou IFN-ß por 24 semanas, além do tratamento padrão da IC. Em comparação ao placebo, a eliminação e/ou redução da carga viral foram maiores nos grupos IFN-ß. O tratamento com IFN-ß foi associado a efeitos favoráveis na melhora da classe funcional da NYHA, qualidade de vida e avaliação global do paciente. Em análises retrospectivas, foi possível demonstrar que o tratamento com IFN-ß foi significativamente menos eficaz na eliminação da infecção por B19V. 171
O herpes-vírus humano 6 foi detectado em alta prevalência no tecido miocárdico de pacientes que apresentaram sintomas de IC em um cenário clinicamente suspeito de miocardite. Curiosamente, o HHV-6 é capaz de integrar seu genoma em telômeros de cromossomos humanos, o que permite a transmissão do HHV-6 através da linha germinativa. O HHV-6 integrado no cromossomo (ciHHV-6) parece estar associado a um risco aumentado de miocardite e pode levar a um agravamento da IC. O HHV-6 também não é eliminado pelo IFN-ß, mas os sintomas de reativação e insuficiência cardíaca do HHV-6 diminuem após um período de tratamento de 6 meses com ganciclovir seguido de valganciclovir (ganciclovir 1.000 mg/24h por via intravenosa por 5 dias, depois valganciclovir 900 mg/24h ou 1.800 mg/24h por 6 meses) em pacientes sintomáticos com ciHHV6 200 reativado (RNA mensageiro positivo).
A infecção por B19V do músculo cardíaco ainda é motivo de discussão. Os primeiros dados forneceram evidências de que inibidores antivirais da transcriptase reversa e análogos de nucleosídios como a telbivudina podem melhorar o resultado clínico de pacientes com DNA positivo de B19V e intermediários replicativos. 201 No entanto, agora é necessário agendar um grande estudo clínico randomizado, controlado por placebo, para avaliar os resultados.
5.4. Imunomodulação (Imunoglobulina – Imunoadsorção): Indicações e Tipos de Imunoglobulinas
O racional para uso das imunoglobulinas intravenosas (IVIG) no tratamento das miocardites está na sua ampla capacidade de interagir com o sistema imune. São capazes de estimular o sistema complemento e células imunológicas a liberarem citocinas anti-inflamatórias e inibirem a liberação de citocinas pró-inflamatórias. 83
As imunoglobulinas têm sido estudadas em diferentes cenários como na IC crônica; 202 , 203 na cardiomiopatia dilatada; 166 , 204 na cardiomiopatia periparto; 205 na miocardite aguda, 164 , 165 , 206 , 207 na miocardite fulminante 208 e nas miocardites virais. 167 , 169
Embora alguns desses estudos apontem para potencial benefício do uso de imunoglobulina, estudo randomizado controlado em pacientes adultos com cardiomiopatia dilatada de início recente (<6 meses) ou miocardite não demonstrou benefício do uso de imunoglobulina em relação à função ventricular quando comparado ao grupo controle. Houve melhora da função ventricular e até mesmo normalização em 36% dos casos ao longo do seguimento, independentemente do grupo de tratamento. Vale destacar que não foi realizada pesquisa viral na biópsia dos pacientes, e apenas 16% tinham quadro de miocardite comprovado por presença de inflamação na biópsia. 166
Em pacientes com miocardite aguda, os primeiros estudos apontavam para melhora da função ventricular e tendência a melhor prognóstico em 1 ano, com o uso de altas doses de IVIG. 164 No entanto, revisão sistemática realizada em 2005, envolvendo 62 estudos, encontrou apenas um estudo randomizado controlado sobre o tema, e não demonstrou benefício do uso da terapêutica em pacientes com miocardite aguda, concluindo serem insuficientes as evidências para recomendação rotineira do uso de IVIG nesse cenário. 207 Mais recentemente, estudo multicêntrico randomizado pequeno (41 pacientes) avaliou o prognóstico em curto prazo de pacientes com miocardite aguda ou cardiomiopatia de início recente, submetidos ao tratamento com IVIG comparado com pacientes que não receberam IVIG e revelou melhor sobrevida em curto prazo entre os pacientes que receberam IVIG sem diferença em relação à melhora da função ventricular que ocorreu nos dois grupos. No entanto, houve redução significativa de citocinas inflamatórias no grupo tratado. Tal estudo levanta a hipótese de potencial benefício das imunoglobulinas e sugere o mecanismo pelo qual tal benefício pode ser observado; no entanto, devido ao pequeno número de pacientes, o estudo não é suficiente para embasar a recomendação da terapêutica de forma irrestrita para pacientes com miocardite aguda. 209
No entanto, nas miocardites virais, há dados de literatura que demonstram benefício do uso de imunoglobulina. Em estudo piloto em pacientes com miocardite por parvovírus B19, o uso de IVIG gerou redução significativa da carga viral e melhorou a função cardíaca. 167 Em outra análise incluindo 152 pacientes com miocardite por adenovírus ou parvovírus B19, o uso de imunoglobulina também mostrou melhora da capacidade para o exercício; melhora da fração de ejeção de VE e melhora da classe funcional. Houve redução significativa da inflamação nos dois grupos de pacientes e redução expressiva da carga viral apenas entre os pacientes com miocardite por adenovírus; pacientes com parvovirose apresentaram persistência viral em torno de 40%. 169 Esses dados sugerem potencial benefício de uso de imunoglobulina em pacientes com miocardite viral com comprovação por BEM.
Os dados atuais, embora não sejam suficientes para recomendação rotineira da terapêutica, apontam para potencial benefício da imunoglobulina em pacientes com miocardite com inflamação comprovada por biópsia, especialmente nas miocardites virais por adenovírus e parvovírus B19.
5.4.1. Imunoadsorção
A patogênese da progressão para disfunção ventricular na cardiomiopatia dilatada envolve processos inflamatórios que podem ser identificados e quantificados por métodos imuno-histoquímicos, o que sugere relação causal entre miocardite e cardiomiopatia. 210 A presença de linfócitos, células mononucleares e aumento da expressão gênica de antígenos HLA é frequente, assim como anticorpos contra proteínas mitocondriais e de contratilidade; receptores B1 e receptores muscarínicos também têm sido descritos na cardiomiopatia dilatada. 211 - 214
A extração desses anticorpos cardíacos é possível por imunoadsorção, e alguns estudos têm testado a eficácia dessa metodologia no tratamento de pacientes com cardiomiopatia dilatada/miocardite. 215 , 216 Em estudo controlado pequeno, 25 pacientes foram randomizados para realizar imunoadsorção seguida de substituição por IgG ou manter tratamento padrão sendo observada redução significativa de inflamação miocárdica (células CD3; linfócitos CD4 e CD8, além de reduzir a expressão antígenos HLA classe II) no grupo tratado. 217 Em outros estudos pequenos randomizados, observa-se melhora da hemodinâmica e da função ventricular. 216
Dados atuais sugerem que imunoadsorção pode ser uma abordagem terapêutica nova e promissora para pacientes com cardiomiopatia dilatada e presença de anticorpos cardíacos. Contudo, até o momento, as evidências baseiam-se em estudos pequenos não controlados ou estudos controlados abertos comparados à terapia convencional, que precisam ter seus resultados confirmados por grandes estudos multicêntricos prospectivos randomizados. 218 No momento, está em andamento um estudo multicêntrico duplo-cego placebo-controlado que tem por objetivo avaliar os efeitos da imunoadsorção seguida de substituição por IgG em pacientes com cardiomiopatia dilatada. 219 Apenas após os resultados deste grande estudo poderemos estabelecer grau de recomendação para essa terapêutica no contexto da cardiomiopatia dilatada/miocardite.
5.5. Terapêutica Cardioprotetora Convencional
5.5.1. Sem Disfunção Ventricular
A abordagem terapêutica dos pacientes com miocardite com função ventricular preservada tem como objetivo a prevenção do desenvolvimento de disfunção ventricular ou de arritmias malignas. Nos pacientes com suspeita diagnóstica e risco intermediário, podemos utilizar betabloqueadores e inibidores da enzima conversora de angiotensina (IECA) ou bloqueadores dos receptores de angiotensina (BRA) pelo período mínimo de 12 meses, com objetivos de redução da mortalidade e morbidade. A decisão de manutenção da terapêutica além desse período será de acordo com a avaliação da função ventricular e potencial arritmogênico. Como não foram realizados ensaios clínicos em pacientes com esse perfil de miocardite, o manuseio do tratamento deve seguir as orientações da diretriz de insuficiência cardíaca crônica e aguda pela SBC.
5.5.2. Com Disfunção Ventricular Hemodinâmica Estável
O manejo terapêutico da disfunção ventricular na miocardite deve estar alinhado com as diretrizes atuais de IC. 55 , 220 , 221 As medicações recomendadas para todos os pacientes com disfunção ventricular sintomática e hemodinamicamente estáveis, como terapia cardioprotetora, salvo contraindicações, são conhecidas como terapia tripla – IECA ou BRA, betabloqueadores e antagonistas dos receptores mineralocorticoides. Os IECA/BRA e betabloqueadores podem ser iniciados em todos os indivíduos com ICFER mesmo que assintomáticos, salvo contraindicações, e devem ser mantidos quando ocorre normalização da função ventricular. A espironolactona, representante dos antagonistas de receptores mineralocorticoides no Brasil, deve ser iniciada quando o paciente já está em uso das demais medicações, mantendo sintomas (CF NYHA II-IV), devendo ser evitada em pacientes com creatinina >2,5 mg/dL ou com hipercalemia persistente ( Tabela 18 ).
Tabela 18. – Recomendações de medidas farmacológicas gerais na miocardite.
| Indicações | Classe | Nível de evidência |
|---|---|---|
| Tratamento com medicações modificadoras de prognóstico para pacientes com disfunção sistólica de ventrículo esquerdo, sintomáticos ou assintomáticos, de acordo com diretriz de insuficiência cardíaca vigente | I | C |
| Manutenção de uso de terapia com bloqueio neuro-hormonal após normalização da função ventricular | I | C |
| Considerar o uso de medicação com ação sobre bloqueio neuro-hormonal em pacientes com evidência de fibrose miocárdica sem disfunção | IIa | C |
5.5.3. Paciente com Disfunção Ventricular e Hemodinâmica Instável: Abordagem Terapêutica
Pacientes com miocardite aguda e presença de disfunção ventricular sistólica podem apresentar-se em distintos modelos clínicos. Assim como a resposta clínica à terapêutica é bastante variável, podendo ou não haver manifestação clara de baixo débito clínico ou evidência de hipervolemia sistêmica. O uso de inotrópicos se justifica, pelo menos em três situações: no contexto claro de baixo débito, em síndrome cardiorrenal em refratariedade à otimização diurética e na presença de SVO2 abaixo de 60% com critérios hemodinâmicos invasivos de baixo débito. Conforme a dinâmica do cuidado, deve-se discutir o monitoramento invasivo para os pacientes sem resposta clara à essa terapia ( Tabela 19 ). 222 - 225
Tabela 19. – Inotrópicos utilizados na miocardite com disfunção ventricular e hemodinâmica instável222-225.
| Dobutamina | Milrinona | Levosimendana | |
|---|---|---|---|
| Prática clínica em miocardite | Beta-agonista de ação seletiva B1, que promove o inotropismo por estimulação direta de betarreceptores. | Estudos experimentais em modelos murinos sugerem efeitos protetores relacionados à vasodilatação em miocardite da milrinona e levosimendana em detrimento da dobutamina. Age como um inibidor de fosfodiesterase em qualquer dose, aumentando a concentração de cálcio no cardiomiócito. A vasodilatação sistêmica contribui para o incremento no resultado de aumento de débito cardíaco. | Existem estudos experimentais em modelos murinos demonstrando a redução de apoptose celular e citocinas inflamatórias no uso de levosimendana em miocardite aguda. Entretanto, não há evidência robusta que recomende sua utilização como cardioprotetora em pacientes com miocardite ou seu benefício clínico frente a outros inotrópicos. Funciona como um sensibilizador do cálcio até 0,2mcg/kg/min; em doses maiores, funciona como um inibidor de fosfodiesterase, sem uso clínico testado. Não há evidência clínica de seu uso contínuo por mais de 48 horas. |
| Inotropismo | Moderado | Importante | Importante |
| Vasodilatação | Leve | Moderada a importante | Moderada a importante |
| Aumento de débito cardíaco | Pequeno a moderado | Importante e associado à vasodilatação | Importante |
| Risco de hipotensão | Pequeno | Importante e dose-dependente, assim como maior em pacientes com disfunção renal estabelecida | Importante, principalmente em caso de bolus realizado. Aumenta conforme o aumento da dose. |
| Risco de arritmias | Aumenta exponencialmente quando maior que 10mcg/kg/min | Aumenta em caso de dose de bolus (não recomendada) | Aumenta em caso de bolus inicial, também dose-dependente mais comum na dose de 0,2mcg/kg/min |
5.6. Cuidados Gerais: Atividade Física e Vacinação
A miocardite é uma importante causa de morte súbita em atletas, podendo ocorrer tanto na sua fase aguda como na fase crônica. Está relacionada não só ao grau de inflamação do miocárdio, mas também à deflagração de arritmias complexas e ao desenvolvimento de disfunção ventricular esquerda. 226 - 228
Atletas competitivos ou recreacionais portadores de miocardite ativa não devem praticar esportes competitivos ou exercícios físicos de alta intensidade até o término do período de convalescença. Não há consenso sobre esste período. Até recentemente, era estabelecido um período de, no mínimo, 6 meses após o início das manifestações clínicas. Atualmente, alguns especialistas já recomendam períodos menores, como de 3 meses, para a liberação de treinamentos e competições, dependendo da presença de sintomas, arritmias, disfunção ventricular, marcadores inflamatórios e alterações no ECG 12 , 229 ( Tabela 20 ).
Tabela 20. – Recomendações de exercício físico na miocardite para atletas e não atletas12,229.
| Indicações | Classe | Nível de evidência |
|---|---|---|
|
IIa | C |
| Com miocardite prévia, devem ser reavaliados periodicamente, especialmente nos primeiros 2 anos, pelo risco aumentado de recorrência e progressão silenciosa da doença. | IIa | C |
| Considera-se o retorno a atividades competitivas em atletas e não atletas assintomáticos, no período de 3 a 6 meses após o quadro miocardite, com realce tardio persistente na RMC se função de VE normal e ausência de arritmias no Holter de 24h e teste ergométrico, devendo ser seguido periodicamente pelo risco potencial de taquiarritmias. Na presença de realce tardio positivo na RMC, devem ser avaliados anualmente. | IIa | C |
RMC: ressonância magnética cardíaca; VE: ventrículo esquerdo.
O Consenso Europeu de Reabilitação Cardíaca e Prevenção recomenda que, nos pacientes portadores de IC, incluindo os indivíduos com miocardite, a prática de exercícios físicos deve ser de moderada intensidade (até 50% do VO2 pico ou 60% da frequência cardíaca máxima prevista), desde que não haja evidência laboratorial de inflamação ou arritmias. 230
Em função da pandemia pela Covid-19, os atletas profissionais necessitaram interromper ou postergar suas atividades profissionais pelo risco de contaminação. Com abrandamento das medidas de afastamento, temos o questionamento de como os atletas poderão retornar suas atividades de forma segura. Os atletas que foram acometidos pela Covid-19 podem vir a apresentar sintomas respiratórios, fadiga muscular e risco de eventos trombóticos. Em decorrências de tais riscos, um fluxograma com recomendações de avaliação clínica e de liberação de atividades tem o objetivo de fornecer um guia para retomada das atividades físicas ( Figura 6 ). 231
Figura 6. - Fluxograma de retomada de exercício para altas pós-Covid-19.
*História e exame físico na pesquisa de complicações pós-Covid: neurológico, gastrointestinal e dermatológico. ECG: eletrocardiograma; ECO: ecocardiograma transtoráxico; PCRT: proteína C reativa titulada; PFP: prova de função pulmonar; RMC: ressonância magnética cardíaca; TC de tórax: tomografia computadorizada de tórax; TECP: teste de exercício cardiopulmonar; Tp-AS: troponina de alta sensibilidade.
A vacinação segue as mesmas recomendações da imunização anual contra gripe e pneumococo feitas nos pacientes com IC e as demais vacinas disponíveis (caxumba, sarampo, rubéola, poliomielite). Não há evidências robustas de que estas predispõem a agudização ou o desenvolvimento de miocardite aguda para sobrepor os benefícios da imunização. 231 - 235 O mesmo racional se aplica na vacinação para Covid-19. Para serem vacinados, os pacientes não podem estar na fase aguda da miocardite, sendo o mais aconselhável cerca de 3 meses após o diagnóstico de miocardite ( Tabela 21 ).
Tabela 21. – Recomendações de vacinação na miocardite.
| Classe | Nível de evidência | |
|---|---|---|
| Vacina contra gripe, pneumococo, caxumba, sarampo, rubéola, poliomielite e para Covid-19. Os pacientes não devem estar na fase aguda de doença, sendo recomendado com mais de 3 meses do início da suspeita diagnóstica. | I | C |
6. Situações Especiais
6.1. Miocardite Fulminante
Miocardite fulminante pode ser definida contempora- neamente de forma pragmática, contemplando uma visão predominantemente clínica, independentemente de achados histológicos, em que existe: 1) apresentação clínica de sintomas graves de IC inferior a 30 dias; 2) instabilidade hemodinâmica com choque cardiogênico e arritmias com risco de vida (incluindo parada cardiorrespiratória recuperada ou abortada); e 3) necessidade de suporte hemodinâmico (inotrópicos ou assistência circulatória mecânica). 236 Além dos exames já citados recomendados em casos de miocardite, o uso da BEM na miocardite fulminante é recomendado, sendo usualmente positivo, demonstrando múltiplos focos inflamatórios, possibilitando caracterização histológica do tipo de miocardite em curso. 237 O curso clínico da miocardite fulminante é usualmente mais sombrio que outros tipos de miocardite não fulminantes, com menor chance de recuperação da função ventricular, maior mortalidade e maior chance de transplante cardíaco. 236 , 238
6.1.1. Avaliação Diagnóstica
O diagnóstico de miocardite fulminante envolve os critérios diagnósticos de miocardite per se envolvendo quadro clínico de IC aguda, elevação de troponinas e de marcadores inflamatórios, alterações inespecíficas no ECG, como inversões de onda T e/ou alterações de segmento ST, e alteração aguda da função ventricular. No cenário de choque cardiogênico, cateterismo cardíaco direito e angiografia coronária são essenciais para orientar o manejo. A ecocardiografia é ferramenta central no diagnóstico, uma vez que os pacientes com miocardite fulminante frequentemente não apresentam condições para submeterem-se à RM. Os achados ecocardiográficos são altamente dependentes da forma e do tempo de apresentação do paciente. Os pacientes com miocardite fulminante, em geral, apresentam dimensões diastólicas normais, mas aumento na espessura septal na apresentação, enquanto pacientes com miocardite viral aguda (não fulminante) podem apresentar-se com dimensões diastólicas tanto normal quanto aumentadas, mas espessura septal normal, consistente com outras formas de miocardiopatia dilatada. 15 , 64 , 72 , 98 , 239 , 240
A decisão de realizar uma BEM no momento do cateterismo cardíaco está conforme as da força-tarefa de 2013 da ESC15 A BEM pode ser considerada o procedimento diagnóstico inicial quando a RM não é possível (p. ex., choque, presença de dispositivos de metal), se operadores experientes e patologistas cardíacos estão disponíveis. De acordo com as diretrizes, portanto, as indicações para BEM estariam presentes para a maioria dos pacientes com miocardite fulminante ( Figura 4 ). Mais precisão pode ser alcançada quando adicionados análise do genoma viral, imuno-histologia ou biomarcadores transcriptômicos se houver incerteza diagnóstica apesar da histologia.
Além da confirmação diagnóstica, a realização de BEM na miocardite fulminante pode ser decisiva para definição terapêutica. A avaliação imuno-histoquímica tem sido considerada obrigatória em função das conhecidas limitações diagnósticas dos critérios de Dallas, principalmente variabilidade interobservador, que, estima-se, vem trazer confirmação diagnóstica em, no máximo, 20% dos casos. 15 , 64 , 72 , 239 , 240 De acordo com definição da OMS, para diagnóstico de miocardite ativa, é necessária a detecção imuno-histoquímica de infiltrados mononucleares (linfócitos T ou macrófagos) usando um ponto de corte de mais de 14 células/mm2, em adição à expressão aumentada de moléculas HLA classe II. 146
A detecção de genoma viral nos espécimes da biópsia é factível (ainda pouco disponível no Brasil) e, quando acoplada à análise imuno-histoquímica, aumenta a acurácia diagnóstica, além de prover a etiologia e informação prognóstica.
Para miocardites fulminantes, a indicação classe I, nível de evidência C, já era considerada mesmo quando levava-se em conta apenas a análise histológica (critérios de Dallas). A análise histológica convencional, amplamente disponível, permite diagnósticos etiológicos que podem levar a mudanças de condutas terapêutica e a tratamentos específicos, como em miocardites eosinofílicas necrotizantes, miocardites de células gigantes, sarcoidose, amiloidose e miocardites associadas a doenças autoimunes conhecidas.
6.1.2. Abordagem Terapêutica
Do ponto de vista do tratamento específico da miocardite, o reconhecimento do fator causal por meio da investigação histológica por BEM permite o estabelecimento de estratégias terapêuticas específicas, como a utilização de imunoglobulina nas miocardites virais e imunossupressão nas autoimunes sem presença viral, ou o uso de corticosteroide em pacientes com sarcoidose, miocardite eosinofílica necrotizante ou miocardite por células gigantes. Um ensaio clínico randomizado de imunossupressão em 85 pacientes com miocardite com comprovada ausência de persistência viral (TIMIC Study) demonstrou claro benefício sobre a fração de ejeção desses pacientes. No entanto, tratavam-se de pacientes com mais de 6 meses de diagnóstico e comprovada ausência de vírus. 162 Ensaios clínicos de imunossupressão em pacientes com miocardite fulminante não existem. Uma opção que tem sido testada é a utilização de altas doses de imunoglobulina, a qual se mostrou benéfica sobre a função ventricular e classe funcional e demonstrou benefício em sobrevida; 208 , 209 , 217 embora tenha sido demonstrado em um ensaio clínico com 62 pacientes, em que apenas 16% tinham miocardite comprovada por biópsia a ausencia de benefício. 166
O tratamento de suporte deve ser realizado com fármacos vasoativos e eventualmente vasopressores e em situações nas quais seja possível a introdução de vasodilatadores. O insucesso imediato no tratamento medicamentoso e acerto volêmico deve abrir perspectiva para indicação de suporte hemodinâmico com assistência circulatória. Os dispositivos mais utilizados são balão intra-aórtico, dispositivos percutâneos como tandem-heart e impella , circulação extracorpórea (ECMO) e ventrículos artificiais paracorpóreos, como ponte para recuperação ou ponte para transplante cardíaco ( Figura 7 ). Os dispositivos de curta duração têm sua indicação para suporte de 7 a 10 dias. 241 Após esse período e quando não se consegue a estabilização do paciente, a indicação de ECMO ou ventrículos artificiais pode dar suporte por período maior, possibilitando mais chance de recuperação da disfunção ventricular 242 (ver seção Choque cardiogênico ).
Figura 7. – Abordagem para estabilização inicial de pacientes com choque cardiogênico.
BIA: balão intra-aórtico; CRM: cirurgia de revascularização miocárdica; DAV: dispositivo de assistência ventricular; ECMO: extracorporeal membrane oxigentaion; ICP: intervenção coronariana percutânea; SCA: síndrome coronariana aguda. Adaptada de Kociol et al.63
6.2. Sarcoidose
6.2.1. Diagnóstico
A sarcoidose é uma doença inflamatória granulomatosa, de etiologia desconhecida, caracterizada por granulomas não caseosos, podendo acometer vários órgãos, especialmente: pulmões (90%), pele, linfonodos, sistema nervoso central, olhos, fígado, coração e outros órgãos. 243 Embora a sarcoidose cardíaca clinicamente manifesta só ocorra em 5% a 10% dos pacientes com sarcoidose, estudos em autópsias revelaram que o envolvimento cardíaco está presente em 20% a 30% de estudos com imagem cardíaca avançada; com o uso de CMR ou PET, demonstraram valores de 40% de comprometimento cardíaco. 244 - 246 Além das diferenças de definições para ela, outro fator que parece impactar no aumento da prevalência dessa doença é o aprimoramento dos métodos de imagem.
Atualmente, preconiza-se o uso das diretrizes da Sociedade Japonesa de Circulação (SJC) lançada em 2019 ( Tabela 22 , Figuras 8 e 9 ). Dentre as mudanças sugeridas neste documento, temos que o acúmulo anormalmente alto de marcadores no coração com tomografia por emissão de pósitrons por 18F-fluorodesoxiglucose (FDG)/tomografia computadorizada (FDG-PET/CT), que foi categorizado nas ‘’Diretrizes para o diagnóstico de envolvimento cardíaco em pacientes com sarcoidose’’, em 2006, foi promovido para os critérios maiores, bem como o realce tardio por gadolínio do miocárdio na RM com gadolínio. Nas atuais diretrizes da SJC, o paciente também é diagnosticado clinicamente com sarcoidose cardíaca quando demonstra achados clínicos fortemente sugestivos de comprometimento cardíaco e de sarcoidose pulmonar ou oftalmológica somados a, ao menos, dois dos cinco achados laboratoriais característicos da sarcoidose. Por fim, a definição da sarcoidose cardíaca isolada foi elaborada pela primeira vez.
Tabela 22. – Recomendações da SJC para o diagnóstico da sarcoidose cardíaca247.
| Critérios para envolvimento cardíaco |
|---|
| Os achados cardíacos devem ser avaliados com base nos critérios maiores e nos menores. Achados clínicos que satisfazem os seguintes 1) ou 2) sugerem fortemente a presença de comprometimento cardíaco. |
| 1. Dois ou mais dos cinco principais (a) a (e) são atendidos. |
| 2. Um dos cinco critérios principais (a) a (e) somados a dois ou mais critérios menores (f) a (h) são atendidos. |
| Critérios maiores |
| a. Bloqueio atrioventricular de alto grau (incluindo bloqueio atrioventricular completo) ou arritmia ventricular fatal (p. ex., taquicardia ventricular sustentada e fibrilação ventricular) |
| b. Afinamento basal do septo ventricular ou anatomia anormal da parede ventricular (aneurisma ventricular, afinamento do septo ventricular superior ou médio, espessamento da parede ventricular regional) |
| c. Disfunção contrátil do ventrículo esquerdo (fração de ejeção do ventrículo esquerdo inferior a 50% ou assinergia da parede ventricular focal) |
| d. Cintilografia com citrato 67Ga ou PET 18F-FDG revela acúmulo anormalmente alto de marcadores no coração |
| e. A RM com gadolínio revela atraso no contraste do miocárdio |
| Critérios menores |
| f. Achados anormais de ECG: arritmias ventriculares (taquicardia ventricular não sustentada, multifocais ou frequentes contrações ventriculares prematuras), desvio do eixo ou ondas Q anormais |
| g. Defeitos de perfusão na cintilografia de perfusão miocárdica |
| h. Biópsia endomiocárdica: infiltração de monócitos e fibrose intersticial miocárdica moderada ou grave. Diretrizes para o diagnóstico de sarcoidose cardíaca |
| Diretrizes para o diagnóstico de sarcoidose cardíaca |
| 1. Grupo de diagnóstico histológico (aqueles com achados positivos na biópsia do miocárdio): a sarcoidose cardíaca é diagnosticada histologicamente quando a biópsia endomiocárdica ou as amostras cirúrgicas demonstram granulomas não caseosos. |
| 2. Grupo de diagnóstico clínico (aquele com achados negativos da biópsia do miocárdio ou aqueles que não foram submetidos à biópsia do miocárdio): o paciente é diagnosticado clinicamente como sarcoidose cardíaca (1) quando granulomas não caseosos são encontrados em outros órgãos que não o coração, e achados clínicos fortemente sugestivos de comprometimento cardíaco anteriormente mencionado estão presentes; ou (2) quando o paciente demonstra no quadro clínico achados fortemente sugestivos de sarcoidose pulmonar ou oftálmica; pelo menos dois dos cinco achados característicos laboratoriais de sarcoidose (linfadenopatia hilar bilateral, atividade sérica alta de ECA ou níveis séricos elevados de lisozima, sIL-2R sério alto, acúmulo significativo de marcadores na cintilografia com citrato 67Ga ou PET 18F-FDG, alta porcentagem de linfócitos CD4/CD8, razão >3,5 no líquido do LBA). Os achados de imagem sugerem fortemente o envolvimento cardíaco anteriormente mencionado. |
| Diretrizes de diagnóstico para sarcoidose cardíaca isolada |
| Pré-requisitos |
| 1. Não serem observadas características clínicas da sarcoidose em outros órgãos além do coração (o paciente deve ser examinado detalhadamente para avaliar envolvimentos respiratórios, oftalmológicos e cutâneos de sarcoidose. Quando o paciente é sintomático, outras etiologias que podem afetar os órgãos correspondentes devem ser descartadas. |
| 2. A cintilografia com 67Ga ou o PET 18F-FDG não revela acúmulo anormal de marcadores em nenhum outro órgão que não o coração. |
| 3. A tomografia computadorizada do tórax não demonstra nos pulmões ou linfadenopatia hilar e mediastinal (eixo menor >10 mm). |
| Grupo de diagnóstico histológico |
| 1. A sarcoidose cardíaca isolada é diagnosticada histologicamente quando a biópsia endomiocárdica ou as amostras cirúrgicas demonstram granuloma não caseoso. |
| Grupo de diagnóstico clínico |
| 1. A sarcoidose cardíaca isolada é diagnosticada clinicamente quando o critério (d) e pelo menos três outros critérios maiores (a) a (e) são satisfeitos. Quando o paciente atende a pelo menos quatro critérios de envolvimento cardíaco que não incluam o critério (d) ou quando o paciente atende os critérios (b) e (d) mais um dos critérios restantes, suspeita-se que o paciente tenha sarcoidose cardíaca isolada. |
ECA: enzima conversora de angiotensina; ECG: eletrocardiograma; LBA: lavado broncoalveolar; PET 18F-FDG: tomografia por emissão de pósitrons 18F-fluorodesoxiglicose; RM: ressonância magnética. Adaptada de Terasaki et al.247
Figura 8. – Fluxograma diagnóstico de sarcoidose cardíaca, após o diagnóstico de lesões extracardíacas de sarcoidose.
ECG: eletrocardiograma; PET 18F-FDG: tomografia por emissão de pósitrons 18F-fluorodesoxiglicose; SPECT: tomografia computadorizada por emissão de fotón único. Adaptada de Terasaki et al.247
Figura 9. – Fluxograma de diagnóstico para sarcoidose cardíaca em pacientes que apresentam manifestações cardíacas e são fortemente suspeitos de sarcoidose cardíaca. BAV: bloqueio atrioventricular; ECA: enzima de conversão da angiotensina; FDG: fluorodesoxiglicose; PET 18F-FDG: tomografia por emissão de pósitrons 18F-fluorodesoxiglicose; SPECT: tomografia computadorizada por emissão de fóton único; TC: tomografia computadorizada;VE: ventrículo esquerdo. Adaptada de Terasaki et al.247.
6.2.2. Tratamento e Prognóstico
O tratamento imunossupressor da sarcoidose cardíaca baseia-se na experiência clínica e na opinião de especialistas em que faltam estudos randomizados. O objetivo do tratamento é reduzir a atividade inflamatória e a prevenção de fibrose e deve ser guiado pela magnitude do processo inflamatório e o grau de acometimento miocárdico. 248
Recomenda-se o tratamento imunossupressor nas seguintes situações: nos casos de disfunção ventricular esquerda, arritmias ventriculares, atividade hipermetabólica no PET-FDG, distúrbios de condução, realce tardio na RMC ou disfunção de ventrículo direito na ausência de hipertensão pulmonar. 248 - 250
Existem três linhas de tratamento na sarcoidose – primeira linha: corticosteroides; segunda linha: metotrexato e azatioprina nos casos intolerantes ou uso crônico de corticosteroides; e terceira linha: anticorpos anti-TNF (infliximab e andalimumab) nos casos de falha de tratamentos anteriores. 251
O fármaco de escolha é o corticosteroide. Em uma revisão sistemática do uso de corticosteroide em pacientes com distúrbios de condução ventricular, 27 de 57 pacientes (47,4%) melhoraram após tratamento. 252 No entanto, em vista da não previsibilidade de resposta, esses pacientes com distúrbios de condução e sarcoidose cardíaca devem receber um marca-passo ou cardiodesfibrilador implantável. 119 , 253
Estudos mais antigos que avaliaram o efeito do corticosteroide na função ventricular sugerem preservação da função ventricular nos casos de função normal ao diagnóstico, melhora da fração de ejeção ventricular nos casos de pacientes com disfunção leve a moderada e não melhora nos casos de disfunção ventricular importante. 119 No entanto, por outro lado, um estudo finlandês sugere uma melhora da função ventricular esquerda com o tratamento imunossupressor nos casos de função ventricular severamente comprometida (FEVE<35%), mas sem alterações nos casos de função normal ou moderamente diminuída no início do tratamento. Talvez tais diferenças estejam no diagnóstico e tratamentos precoces. 254
Nos casos de arritmia ventricular, os estudos são mais limitados; no entanto, a causa da arritmia parece ser secundária a cicatrizes e, talvez, o efeito do corticosteroide nesses pacientes seja pequeno benefício. 255 A ablação por cateter nos casos de taquicardia ventricular pode ser considerada após o implante de cardiodesfibrilador implantável ou falência das medicações antiarrítmicas. 256
O algoritmo de tratamento ( Figura 10 ) sugerido seria de doses iniciais de prednisona (30 mg/dia a 40 mg/dia) seguido da repetição do PET entre 4 a 6 meses, com o objetivo de avaliar a atividade da doença e guiar o tratamento farmacológico subsequente.
Figura 10. – Algoritmo de tratamento da sarcoidose.
ECG: eletrocardiograma; ECO: ecocardiograma; PET 18F-FDG: tomografia por emissão de pósitrons 18F-fluorodesoxiglicose.
Yokoyama et al. 257 compararam o uso de PET18F-FDG/CT antes e após utilização de corticosteroide em 18 pacientes com sarcoidose cardíaca, e observaram que a SUV max diminuiu significativamente em comparação com valores basais. Estudo recente utilizou o PET 18F-FDG/CT para diagnóstico e tratamento da sarcoidose cardíaca com doses baixas de corticosteroide e controle da doença em 1 ano do diagnóstico. 258
Medicamentos imunossupressores outros que corticosteroide são necessários devido ao longo tempo do tratamento, e são indicados nos pacientes que necessitam de uma dose de manutenção de prednisona >10 mg/dia e que não toleram efeitos colaterais do corticosteroide. 248 , 250
São sugeridos: metotrexato, 257 azatioprina, 258 ciclofosfamida 259 e inibidores do fator de necrose tumoral. 260 , 261 O tipo de fármaco utilizado pode ser determinado pelo tipo de acometimento extracardíaco; COMO evitar metotrexato, NO envolvimento hepático e estudos em pacientes com sarcoidose pulmonar, cutânea, ocular, neurológica e multissistêmica sugerem uma boa eficácia do infliximab ( Tabela 23 ). 262
Tabela 23. – Recomendações de terapia imunossupressora na sarcoidose.
| Indicação | Classe | Nível de evidência |
|---|---|---|
| Prednisona 30 a 40mg/d por 4 a 6 meses | IIa | B |
| Outros imunossupressores em caso de uso corticosteroide: | ||
| Azatioprina 50 a 200 mg/d | IIb | C |
| Metotrexato 10 a 20mg/semana | IIb | C |
| Infliximab em sarcoidose pulmonar, cutânea, ocular, neurológica e multissistêmica | IIb | C |
| Leflunomida 10 a 20 mg/d | IIb | C |
Tabela 24. – Indicação de CDI na sarcoidose.
| Indicações | Classe | Nível de evidência |
|---|---|---|
| Taquicardia ventricular/morte cardíaca abortada | I | C |
| FEVE <35 % a despeito de tratamento otimizado e período de imunossupressão e inflamação ativa | I | C |
| Síncope inexplicada de provável causa arrítmica | IIa | C |
| Fração de ejeção entre 35% e 49% e/ou FEVD <40% a despeito de tratamento otimizado e imunossupressor e evidência pela ressonância ou PET de extensa cicatriz miocárdica | IIa | C |
| Fração de ejeção entre 35% e 49% e/ou FEVD <40% a despeito de tratamento otimizado e imunossupressor | IIb | C |
CDI: cardiodesfibrilador implantável; FEVD: fração de ejeção de ventrículo direito; FEVE: fração de ejeção de ventrículo esquerdo; PET: tomografia por emissão de pósitron.
6.2.3. Prognóstico
A sarcoidose cardíaca tem um pior prognóstico quando comparada à miocardiopatia dilatada. Uma vez o coração estando acometido, o prognóstico torna desfavorável. O comprometimento cardíaco é responsável por 85% dos óbitos na doença. 183 , 243
Kandolin et al. 256 reportaram o efeito a longo prazo do tratamento imunossupressor na coorte finlandesa, e sobrevida livre de transplante em 1 ano, 5 anos e 10 anos foi 97%, 90% e 83%, respectivamente, durante o seguimento de 6,6 anos. Nesse estudo, a presença de IC e a função cardíaca antes do tratamento com corticosteroide foram os fatores mais importantes para estimativa do prognóstico, demonstrando que o tratamento precoce é importante.
A presença de realce tardio miocárdico avaliado pela RM aumentou em 30 vezes o risco de morte, morte súbita abortada ou implante de cardiodesfibrilador em um período de seguimento de 2,6 anos, 262 posteriormente confirmados em metanálises. Sugere que o limiar de 20% de massa de fibrose esteja associado com risco de eventos. 263
Em um estudo que utilizou PET, observou-se que 26% dos eventos adversos relatados, tais como taquicardia ventricular e morte, ocorreram nos casos de captação cardíaca ao PET em um seguimento de 1,5 ano. Por outro lado, a captação extracardíaca não se associou com eventos adversos no seguimento. 264
Outro dado interessante é que pacientes com sarcoidose cardíaca isolada têm pior prognóstico quando comparados com pacientes com sarcoidose sistêmica com comprometimento cardíaco. 265 Outro estudo finlandês observou elevada frequência de disfunção ventricular e anormalidades septais ao ecocardiograma e alta prevalência de realce tardio miocárdico pela ressonância e maior associação com sexo feminino e maior disfunção ventricular esquerda. 266 Nesse estudo, a presença de IC na apresentação, disfunção ventricular esquerda severa (<35%) e sarcoidose cardíaca isolada também esteve relacionada com o prognóstico. 254
O ecocardiograma com Strain (GLS <17,3) foi preditor independente de mortalidade, IC, hospitalização, novas arritmias e desenvolvimento de sarcoidose cardíaca. 267
Já biomarcadores séricos como BNP estiveram relacionados com desenvolvimento de IC, e a troponina, com desenvolvimento de arritmias fatais, 268 menor fração de ejeção e pior prognóstico. 269
6.3. Células Igantes
6.3.1. Tratamento
De acordo com Registro Internacional, a MCG é etiologia de 12% das miocardites fulminantes e 3,6% das miocardites não fulminantes. 242 Os alvos do tratamento são limitados porque não são conhecidos adequadamente os mecanismos da MCG, embora um mecanismo autoimune envolvendo inflamação miocárdica mediada por linfócitos-T tenha sido proposto. 270 , 271
A MCG tem um prognóstico pior que as miocardites eosinofílicas e linfocitárias e está mais frequentemente associada à IC, parada cardíaca, fibrilação e taquicardia ventricular, bloqueios ou simulação de IAM. 242 , 272 Sem tratamento, a evolução geralmente é fatal, com morte até os 5,5 meses de evolução. 271 Mesmo com tratamento, a MCG tem alta mortalidade ou necessidade de indicação precoce de suporte mecânico circulatório e/ou transplante cardíaco.
Recentemente, foi descrita sobrevida livre de transplante aos 5 anos de 42%. Como importantes marcadores de prognóstico de morte precoce ou necessidade de suporte mecânico ou transplante cardíaco, foram descritos os níveis de troponina e moderada/severa necrose ou fibrose na BEM. Também são marcadores de prognóstico níveis elevados de BNP/nt-proBNP e redução importante de FEVE. 191 O prognóstico reservado pode ser devido à lesão miocárdica ou recorrência da MCG. 273 Após transplante cardíaco, também tem sido descrita recorrência da MCG.
O diagnóstico precoce é crítico e baseia-se nos resultados da BEM, ou análise histológica de coração explantado durante transplante cardíaco, ou de fragmento de miocárdio obtido durante implante de dispositivo de assistência ventricular. 270 , 274 , 275 A sensibilidade da biópsia pode ser limitada pelo erro de amostragem. Fragmentos são obtidos preferencialmente da porção apical do septo do ventrículo direito, porque diminui o risco de complicações. Uma biópsia negativa não necessariamente exclui o diagnóstico de MCG. A sensibilidade da BEM aumentou de 68% para 93% depois de repetir o procedimento ( Tabela 25 ).
Tabela 25. – Recomendações de biópsia endomiocárdica (BEM) na avaliação diagnóstica na miocardite de células gigantes.
| Indicações | Classe | Nível de evidência |
|---|---|---|
| BEM ou análise de coração explantado durante transplante cardíaco, ou de fragmento miocárdico obtido durante implante de dispositivo de assistência mecânica em pacientes com quadro agudo de insuficiência cardíaca com grave comprometimento hemodinâmico ou fulminante | I | B |
| Suspeita de diagnóstico de miocardite associada com parada cardíaca, ou fibrilação ou taquicardia ventricular, ou bloqueios, ou simulação de infarto agudo do miocárdio | I | B |
O tratamento da MCG pode ser dividido em tratamento da IC com FEVEr provocada pela lesão miocárdica ou recorrência da MCG, das arritmias, bloqueios e o tratamento do provável mecanismo com imunossupressores.
O tratamento da IC, dos distúrbios hemodinâmicos, bloqueios e arritmias segue as mesmas orientações do tratamento da IC segundo as Diretrizes da SBC, quer seja medicamentoso e/ou com inotrópicos, marca-passo/desfibriladores e/ou suporte mecânico circulatório e transplante cardíaco. 242 O transplante cardíaco pode ter indicação mais precoce devido ao prognóstico reservado da MCG, mesmo com imunossupressores. A indicação de implante de cardiodesfibrilador pode ser feita para prevenção primária de morte súbita ou secundária com base na alta incidência de arritmias complexas e graves. 276 Foi descrito que 59% dos pacientes com MCG apresentaram taquicardica ventricular sustentada ou choques para arritmia ventricular complexa, apesar de estarem livres de IC grave.
A indicação de imunossupressores está baseada em resultados de série de casos ou de pequenos estudos randomizados, e foram utilizadas medicações imunossupressoras como prednisona, ciclosporina, azatioprina, micofenolato, everolimus, sirolimus ou globulina de coelho, globulina antitimocitária ou soro muromonab-CD3 para citólise de linfócito T. Após o diagnóstico inicial, em geral, utilizam-se corticosteroides em altas doses e/ou globulina de coelho, globulina antitimocitária ou soro muromonab-CD3, podendo já associar medicação para imunossupressão crônica. O uso de hemoadsorção também tem sido relatado ( Tabela 26 ). 277
Tabela 26. – Recomendações da terapêutica na miocardite de células gigantes.
| Indicações | Classe | Nível de evidência |
|---|---|---|
| Corticosteroide em doses altas em combinação com anticorpos antilinfocitários e/ou inibidores de calcineurina (ciclosporina ou tacrolimus) e/ou antiproliferativos (azatioprina ou microfenolato) | I | B |
| Imunossupressão de manutenção com corticosteroide e inibidor de calcineurina (ciclosporina ou tacrolimus) ou esquema tríplice acrescentando antiproliferativo (azatioprina ou micofenolato) | I | B |
| Transplante cardíaco | I | B |
| Indicação de cardiodesfibrilador para prevencão primária ou secundária de arritmias complexas ventriculares | I | B |
Em geral a imunosssupressão de manutenção é baseada na ciclosporina em esquema duplo ou triplo. 270 , 278 Entretanto, existem importantes limitações na avaliação do seu real benefício. Combinações das medicações prednisona, ciclosporina, azatioprina, micofenolato ou uso isolado ou combinado com RATG ou soro muromonab-CD3 têm sido feitos. Foi descrito que imunossupressão tripla pode aumentar a chance de estar vivo livre de transplante cardíaco para 58% aos 5 anos. 191 Contudo, tem que ser mantida a imunossupressão pela possibilidade de haver recorrência. A imunossupressão combinada (prednisona, ciclosporina e azatioprina) parece ser mais aceita, embora outras combinações tenham sido utilizadas, tais como ciclosporina com RATG, ou RATG com corticosteroides em altas doses. Não existem estudos comparativos para confirmar a melhor imunossupressão. 191 , 274 A utilização de ciclosporina associada a corticosteroides em altas dose ou muromonab-CD3 por 4 semanas diminui necrose, inflamação celular e células gigantes. 279
Transplante cardíaco está indicado com melhora da sobrevida a médio prazo, mas pode haver recorrência de 20% a 25%. 8 , 280 É o tratamento de escolha, apesar de maior risco de rejeição. 281
6.3.2. Manifestação Clínica e Diagnóstico
A miocardite de células gigantes é reconhecida como uma doença rápida e progressiva, na maioria das vezes fatal, se o paciente não for submetido a transplante cardíaco. Em boa parte dos casos, é associada a processo autoimune.
Dados do Giant Cell Myocarditis Study Group mostraram uma incidência predominante em adultos jovens, brancos, sem predomínio de sexo e com manifestação principal de IC aguda (75% dos casos), porém metade dos pacientes desenvolveu arritmia ventricular complexa na evolução da doença. A sobrevida média livre de transplante cardíaco foi de 5,5 meses. 8
Registro mais recente sobre miocardite de células gigantes mostrou incidência também em adultos jovens, mulheres, e as principais manifestações clínicas foram IC aguda, BAV e arritmias ventriculares. 274
Exames de imagem não apresentam nenhuma alteração específica na miocardite de células gigantes. O diagnóstico baseia-se nos achados característicos da BEM com infiltrado inflamatório difuso e misto, constituído principalmente por macrófagos, seguido em quantidade por linfócitos e células gigantes multinucleadas derivadas de macrófagos, tipicamente dispersas, e, ainda, com menor representação de eosinófilos e células plasmáticas. 282
6.4. Miocardite chagásica aguda e reagudização
6.4.1. Manifestações Clínicas e meios de Infecção, Reagudização nos Pacientes Imunossuprimidos
Nos últimos anos, a doença de Chagas aguda (DCA) vem apresentando aumento no número de casos tanto por transmissão oral ou vetorial quanto por quadros de reativação da doença em países da América Latina. Os principais meios de infecção da DCA, atualmente, são: transmissão oral (68,4%), vetorial (5,9%), vertical (0,5%), transfusional (0,4%), acidental (0,1%) e desconhecida (24,7%), como descrito em série de casos diagnosticados na Amazônia Brasileira. 19
A transmissão vetorial ocorre pelo hábito de os triatomíneos defecarem durante ou logo após a hematofagia, com a deposição de fezes contaminadas fazendo com que as formas infectantes do Trypanosoma cruzi atinjam a pele, mucosas e, posteriormente, a corrente sanguínea. O período de incubação é de 4 a 15 dias. A transmissão oral ocorre quando há a ingestão de alimentos ou bebidas contaminadas com parasitos. Atualmente, é a causa mais comum da doença aguda, ocasionando surtos em regiões endêmicas e não endêmicas. Seu período de incubação varia de 3 a 22 dias. 283
Os casos de DCA podem cursar com sinais e sintomas inespecíficos de síndrome infecciosa, tais como febre, mialgias, edema de face e artralgias; além de sinais relacionados com a porta de entrada como o chagoma de inoculação e sinal de Romaña na forma vetorial e quadros digestivos, podendo ocorrer hemorragias digestivas na forma oral. 284
Os casos agudos podem ou não cursar com miocardite e pericardite. Relatos de necrópsia mostram intensa inflamação aguda do epicárdico e miocárdio, observando-se atividade inflamatória intensa e difusa e dissociação extensa de fibras cardíacas, sendo observadas as formas amastigotas do parasita. 285 Sinais e sintomas compatíveis com IC variaram de 26% a 58%. Podem ocorrer casos graves com tamponamento cardíaco e choque cardiogênico por disfunção sistólica de VE. A letalidade na forma de transmissão oral variou de 2% a 5% nas maiores séries. A presença de alterações cardíacas em exames complementares variou de 33% a 70% de alterações eletrocardiográficas (bloqueio de ramo direito, BAV de primeiro grau, fibrilação atrial aguda, bloqueio divisional anterossuperior) e de 13% a 52% de alterações ao ecocardiograma, com derrame pericárdico sendo a alteração mais frequente (10% a 82%), e alterações de contração segmentar, comuns na fase crônica, são pouco encontradas na fase aguda. Apesar da ocorrência de casos graves de comprometimento cardíaco, a maioria dos pacientes cursa com função sistólica preservada com poucos casos de redução da fração de ejeção, e a maioria dos óbitos ocorre devido à presença de derrame pericárdico importante e tamponamento cardíaco. 286 , 287
6.4.2. Diagnóstico
Os exames parasitológicos diretos são os mais indicados para o diagnóstico da miocardite aguda. 288 Métodos indiretos, como a hemocultura e o xenodiagnóstico, têm baixa sensibilidade, não sendo ideais para utilização na fase aguda. Os exames sorológicos não são os melhores métodos para diagnóstico na fase aguda, mas podem ser feitos quando os exames parasitológicos diretos forem persistentemente negativos e a suspeita clínica persistir.
A pesquisa a fresco do parasita no sangue circulante é rápida e simples, além de ser mais sensível que o esfregaço corado. A condição ideal de coleta é com o paciente ainda febril e dentro de 1 mês do início dos sintomas. Métodos de concentração (Strout, micro-hematócrito, creme leucocitário) são recomendados quando a pesquisa a fresco resultou negativa, por serem mais sensíveis. São empregados também quando o quadro clínico agudo começou há mais de 1 mês. Resultados negativos na primeira análise não devem ser considerados definitivos, principalmente se os sintomas persistirem, a não ser que outra etiologia seja comprovada.
A PCR, sendo um método de diagnóstico molecular, vem se tornando mais importante para detectar infecção recente, visto que mostra resultados positivos dias a semanas antes que sejam detectadas tripomastigotas circulantes. 289 - 291 Pode ser feita em sangue periférico e no tecido obtido por BEM para detectar reativação precoce pós-transplante cardíaco, antes do aparecimento do quadro clínico ou de disfunção do enxerto. 292
A reativação da doença de Chagas no período pós-transplante cardíaco pode acontecer em 19,6% a 45% dos casos. 293 O quadro clínico pode ser de miocardite aguda, com vários graus de IC, frequentemente acompanhada de manifestações sistêmicas. Na pele, podem surgir eritema e nódulos subcutâneos, que devem ser biopsiados para pesquisa de ninhos de amastigotas. O monitoramento deve ser rotineiro, mesmo sem suspeita de reagudização. Quando não há sinais clínicos extracardíacos, a biópsia deve ser realizada.
6.4.3. Tratamento
O tratamento tripanosomicida está indicado nos pacientes com DCA com ou sem manifestações de miocardite e na reativação da doença crônica devido à imunossupressão (transplantados) ( Tabela 27 ). 294
Tabela 27. – Recomendações para o tratamento etiológico na miocardite chagásica aguda.
| Indicações | Classe | Nível de evidência |
|---|---|---|
| Infecção aguda, independentemente do mecanismo de transmissão | I | C |
| Reativação de infecção crônica pelo T. cruzi | I | C |
O benzonidazol é a droga disponível e recomendada para o tratamento da infeção pelo T. cruzi . 295 As informações a respeito desse tema, no entanto, são escassas, baseadas em estudos não randomizados, com número de pacientes e tempo de observação insuficientes. Embora a definição sobre os critérios de cura da doença permaneça controversa, existe um consenso atual de que o tratamento com benzonidazol deve ser realizado nas formas agudas e que existe um provável benefício a longo prazo. 296
A dose de benzonidazol em crianças é de 5 a 10mg/kg por dia, dividindo em duas tomadas, por 60 dias. Em adultos, a dose é de 5mg/kg. Reações adversas ocorrem em aproximadamente 30% dos pacientes, sendo as mais frequentes uma dermatite alérgica (30%) e uma neuropatia periférica sensitiva (10%).
6.5. Miocardite por Doenças Tropicais
As doenças tropicais são entidades infecciosas geralmente transmitidas por vetores e ocorrem nas regiões tropicais. Há pouca atenção dos governos, e os recursos destinados ao controle dessas doenças são escassos, com acometimento das populações vulneráveis em áreas com saneamento básico inadequado e sistemas de saúde deficitários. A Amazônia brasileira é região endêmica dessas doenças, muito embora outras regiões do país também sejam afetadas. Muitas das doenças tropicais causam miocardite e parecem contribuir para o aumento da carga das doenças cardíacas nos países em desenvolvimento. 297 As doenças tropicais que causam miocardite e são prevalentes no Brasil são malária, dengue, Chikungunya, Zika e febre amarela ( Tabela 28 ). Essas doenças devem ser consideradas na investigação das miocardites que ocorrem em áreas endêmicas.
Tabela 28. – Características das principais causas de miocardites tropicais.
| Agente | Vetor | Quadro clínico | |
|---|---|---|---|
| Malária | Plasmodium spp (protozoário) | Mosquito Anopheles |
|
| Dengue | Vírus da dengue | Mosquito Aedes aegypti |
|
| Chikungunya | Vírus da Chikungunya | Mosquito Aedes aegypti |
|
| Zika | Vírus da Zika | Mosquito Aedes aegypti |
|
| Febre amarela | Vírus da febre amarela | Mosquitos Haemagogus (silvestre) e Aedes aegypti (urbano) |
|
A malária é causada pelo protozoário do gênero Plasmodium (no Brasil, as espécies P. vivax e P. falciparum ), transmitido pela picada do mosquito Anopheles . A malária é endêmica na região Amazônica, onde mais de 155 mil casos foram diagnosticados no ano de 2019. O P. falciparum é responsável pelas formas mais graves da doença e tem sido mais associado ao desenvolvimento de miocardite. 298 Estudos de necrópsia de casos de malária grave mostram grande quantidade de parasitas no miocárdio e inflamação compatível com miocardite. A maioria dos estudos que reportam miocardite por malária consiste em séries de casos de pacientes internados, com avaliações de ECG, marcadores de lesão miocárdica e ecocardiograma. 299 Essas séries de casos contemplam casos graves e mostram alteração dos marcadores de lesão cardíaca em até 59% e alterações ecocardiográficas como redução da função sistólica em até 19% dos pacientes avaliados. Muitos estudos que associam a malária ao IAM exibem falhas na definição do desfecho avaliado, sendo provavelmente casos de miocardite descritos como infartos. Nos casos de malária aguda que evoluem com a forma grave da doença, a disfunção miocárdica devido à miocardite por malária deve ser considerada. A avaliação com biomarcadores de lesão miocárdica e a função ventricular devem ser avaliadas para otimização do manejo cardiovascular.
As arboviroses são as doenças causadas pelos arbovírus, que incluem o vírus da dengue, Zika, febre Chikungunya e da febre amarela. São transmitidas pela picada do mosquito Aedes aegypti . O envolvimento cardiovascular nas arboviroses vem sendo demonstrado especialmente na dengue, que é a arbovirose mais prevalente no Brasil. A dengue é também aquela que tem maior percentual de manifestações cardiovasculares descritas, com estudos prospectivos relatando que 48% dos pacientes com a forma grave desenvolvem miocardite. Um estudo de necrópsia de quatro casos fatais de dengue mostrou achados de miocardite com presença de edema, hemorragia, infiltrado mononuclear e presença de antígeno e replicação viral. 300
A Chikungunya é, dentre todas as arboviroses aqui mencionadas, a mais sintomática (80% dos casos); no entanto, normalmente se apresenta com sintomas leves e mais relacionados ao sistema osteoarticular. Ainda assim, a infecção pode se apresentar de maneira sistêmica e causar danos generalizados ou em órgãos específicos, como o coração. Um relato de caso em paciente com Chikungunya que desenvolveu dor torácica mostra ressonância com achados típicos de miocardite. 301 Diversas séries de casos em situações de epidemia pelo vírus relatavam percentual de até 37% de acometimento cardiovascular, geralmente quadros compatíveis com micoardite. 302
De todos as infecções tropicais aqui abordadas, a Zika é a que foi descoberta mais recentemente e também é a que apresenta o maior percentual de casos assintomáticos; quando tem manifestação clínica, esta ocorre predominantemente de forma congênita e envolvendo o sistema neurológico. Apesar disso, há alguns poucos estudos longitudinais envolvendo complicações não neurológicas dessa infecção em adultos, nos quais são apresentados desfechos cardiovasculares como IC, arritmias e IAM, bem como relatos de miocardite associada à Zika, 303 , 304 além de estudos prospectivos de Zika congênita em que são relatadas alterações ecocardiográficas sugestivas de dano cardiovascular, sendo que este quadro possivelmente não representa o real impacto na doença no coração, uma vez que não há muitos estudos longitudinais que avaliem isso.
A febre amarela é uma arbovirose tropical negligenciada, a qual por muito tempo esteve concentrada apenas no ciclo silvestre, com baixa incidência (pouco notificada) e pouca expansão geográfica, o que contribuiu para que poucos estudos e casos fossem adequadamente relatados, em especial envolvendo o sistema cardiovascular. Ainda assim, com a crescente urbanização dessa doença e a melhor compreensão de seus mecanismos fisiopatológicos, sua relação com o coração vem sendo demonstrada por alguns estudos, entre eles, o estudo PROVAR+, que relatou, respectivamente, percentuais de 48% e 52% de alterações ecocardiográficas e eletrocardiográficas, 305 além de análises post-mortem que isolaram o vírus no tecido cardíaco ou demonstraram dano miocárdico.
Portanto, muito embora a associação entre doenças tropicais e miocardite seja baseada em séries de casos e poucos estudos com diagnóstico bem-definido de miocardite, justifica-se a investigação diagnóstica das doenças comuns na região nos casos de miocardites em áreas endêmicas. Para tal, deve-se incluir a pesquisa de antígenos ou sorologias para arboviroses e gota espessa para pesquisa de malária. Nos casos de diagnóstico dessas doenças, um infectologista deve ser consultado para orientar o tratamento específico da malária ou o suporte nos casos de arboviroses. Uma outra situação clínica inclui pacientes com diagnóstico de arbovirose ou malária que evoluem com forma grave, especialmente choque; nesses casos, deve haver avaliação de lesão cardíaca com marcadores de necrose miocárdica e de função miocárdica com ecocardiograma para diagnóstico de acometimento miocárdico (miocardite), e o manejo deve incluir otimização da função miocárdica.
6.6. Miocardite por Covid-19
Coronavírus humanos têm sido associados à miocardite. 306 - 308 Entre os seres humanos, durante o surto de SARS de Toronto, o RNA do vírus da SARS-CoV foi detectado em 35% dos corações autopsiados. 309 Isso aumenta a possibilidade de danos diretos de cardiomiócitos pelo vírus 310 - 312 ( Tabela 29 ). 313
Tabela 29. – Estudos representativos abordando as manifestações cardiovasculares agudas da infecção por coronavírus e suas implicações clínicas311-313.
| Vírus | Tamanho da amostra | Manifestações cardiovasculares | Resultados |
|---|---|---|---|
| SARS | N=121 | Hipotensão, taquicardia, braquicardia, cardiomegalia e arritmia | Principalmente transitória |
| N=15 | Parada cardíaca | Morte | |
| N=46 | Compromisso diastólico subclínico sem envolvimento sistólico na ecocardiografia | Reversível na recuperação clínica | |
| MERS | N=1 | Miocardite aguda e insuficiência cardíaca aguda | Recuperada |
| Covid-19 | N=14 | Lesão miocardial (manifestando-se com aumento da troponina I cardíaca de alta sensibilidade) em cinco pacientes | Quatro pacientes necessitaram de cuidados intensivos |
| N=138 | Lesão cardíaca aguda (7,2%), choque (8,7%) e arritmia (16,7%) | A maioria dos pacientes necessitou de cuidados intensivos |
Fonte: Tabela adaptada de Xiong et al.313
6.6.1. Possível Fisiopatologia da Miocardite Relacionada ao SARS-CoV-2
Os mecanismos da lesão miocárdica não estão bem estabelecidos, mas provavelmente envolvem: lesão miocárdica secundária ao desequilíbrio entre oferta e demanda de oxigênio; lesão microvascular; resposta inflamatória sistêmica; cardiomiopatia por estresse; síndrome coronariana aguda não obstrutiva; e lesão miocárdica viral direta 314 ( Figura 11 ). 315
Figura 11. – Mecanismos potenciais de lesão miocárdica na Covid-19.
CID: coagulação intravascular disseminada; IAM: infarto agudo do miocárdio. Fonte: Adaptada de Atri D et al.315
6.6.2. Lesão Miocárdica Viral Direta
Relatos de casos de miocardite na Covid-19 fornecem evidências de inflamação cardíaca, mas não determinam o mecanismo. A infecção por SARS- CoV-2 é causada pela ligação da proteína Spike da superfície viral ao receptor da enzima conversora de angiotensina 2 (ECA-2) humana. No entanto, a proteína spike deve primeiro ser clivada nos locais S1/S2 e, subsequentemente, nos locais S2’ para permitir a ligação à ECA-2. A clivagem no local S1/S2 parece ser mediada pela protease serina 2 transmembrana (TMPRSS2) 316 , 317 ( Figura 12 ). 318
Figura 12. – Fisiopatologia proposta para miocardite por SARS-CoV-2. O SARS-CoV-2 utiliza a proteína spike (iniciada por TMPRSS2) para ligar o ACE2 para permitir a entrada de células. O SARS-CoV-2 intracelular pode prejudicar a formação de grânulos de estresse por meio de sua proteína acessória. Sem os grânulos de estresse, o vírus pode se replicar e danificar a célula. Os linfócitos T ingênuos podem ser preparados para antígenos virais via células apresentadoras de antígenos e cardiotropismo pelo HGF produzido pelo coração. O HGF liga o c-Met, um receptor de HGF nos linfócitos T. Os linfócitos T CD-8 iniciados migram para os cardiomiócitos e causam inflamação do miocárdio por citotoxicidade mediada por células. Na síndrome da tempestade de citocinas, na qual as citocinas pró-inflamatórias são liberadas na circulação, a ativação dos linfócitos T é aumentada e libera mais citocinas. Isso resulta em um ciclo de feedback positivo de ativação imune e dano do miocárdio.
CAA: célula apresentadora de antígeno; CHP: complexo principal de histocompatilbilidade; ECA2: enzima conversora de angiotensina 2; FCH: fator de crescimento de heapatócitos; IL-6: interleucina-6; SARS-CoV-2: síndrome respiratória aguda grave coronavírus 2. Fonte: Adaptada de Siripanthong B et al.318
Até o momento, temos apenas um relato de miocardite viral por SARS-CoV- 2 comprovada por biópsia com inclusões virais ou DNA viral detectado no tecido do miocárdio. 319 Contudo, não havia a presença de partículas virais no cardiomiócito, apenas no interior dos macrófagos no interstício cardíaco. Outro mecanismo hipotético de lesão viral direta ao miocárdio é por meio de uma vasculite mediada por infecção. O receptor ECA2 é altamente expresso em artérias e veias endoteliais. 320
Embora a ECA2 seja apenas levemente expressa no cardiomiócito, ela é altamente expressa nos pericitos. A Covid-19 pode atacar pericitos, essenciais para a estabilidade endotelial, causando disfunção endotelial, que leva a distúrbios microcirculatórios. Isso explica por que, embora a ECA2 seja apenas ligeiramente expressa nos cardiomiócitos, Covid-19 pode causar lesão cardíaca. 320 As autópsias mostram infiltrados inflamatórios compostos por macrófagos e, em menor grau, por células T e CD4+. 321 - 322 Esses infiltrados mononucleares estão associados a regiões de necrose de cardiomiócitos que, pelo Critério de Dallas, definem miocardite. 323
6.6.3. Diagnóstico de Miocardite Relacionada à Covid-19
A apresentação clínica da miocardite por SARS-CoV-2 pode variar desde aqueles com sintomas leves, como fadiga, dispneia e dor precordial; em casos mais graves, podemos ter choque cardiogênico. Os pacientes podem apresentar sinais de IC direita, com aumento da pressão venosa jugular, edema periférico e dor no quadrante superior direito. A apresentação mais emergente é miocardite fulminante, definida como disfunção ventricular e IC dentro de 2 a 3 semanas após a infecção pelo vírus. Os sinais precoces de miocardite fulminante geralmente se assemelham aos da sepse. 14 , 324 - 329
6.6.4. Laboratório
Elevações de troponina e NT-proBNP foram observadas nos casos de miocardite por Covid-19. 14 , 312 , 324 - 326
Valores anormais de troponina são comuns nos pacientes com Covid-19, em especial quando utilizamos troponina cardíaca de alta sensibilidade (hs-cTn). Estudos que avaliaram o curso clínico de pacientes com Covid-19 observaram hs- cTnI detectável na maioria dos pacientes, e hs-cTnI foi significativamente elevado em mais da metade dos pacientes que morreram. 327 , 328
Pacientes com Covid-19 geralmente demonstram elevação significativa do BNP ou NT-proBNP. O significado desse achado é incerto e não deve, necessariamente, desencadear uma avaliação ou tratamento para IC, a menos que haja clara evidência clínica para o diagnóstico. Em pacientes com Covid-19, o nível de BNP (NT-pro) também pode aumentar secundário ao estresse do miocárdio, como possível efeito de doença respiratória grave.
Devido à frequência e à natureza inespecífica dos resultados anormais de troponina ou peptídio natriurético entre pacientes com infecção por Covid-19, suas dosagens devem ser realizadas apenas se o diagnóstico de IAM ou IC estiver sendo considerado por motivos clínicos. Um resultado anormal de troponina ou peptídio natriurético não deve ser considerado evidência de IAM ou IC sem evidências corroboradoras. 329
6.6.5. Eletrocardiograma
Alterações no ECG comumente associadas à pericardite, como elevação de ST e depressão de PR, podem ser observadas na miocardite; 310 no entanto, esses achados não são sensíveis para a detecção da doença e sua ausência não é excludente.
Por exemplo, uma miocardite relacionada com Covid-19 não mostrou elevação do segmento ST nem depressão PR. 330 Outras anomalias no ECG, incluindo novo bloqueio de ramo, prolongamento do intervalo QT, padrão de pseudoinfarto, extrassístoles ventriculares e bradiarritmia com BAV avançado, podem ser observadas na miocardite. 331
Recentemente, foi publicada uma série de casos de pacientes com diagnóstico de Covid-19 que se apresentaram, em algum momento da infecção, com elevação do segmento ST no ECG. 332
6.6.6. Imagem
A European Society of Cardiology (ESC), em recente documento, aponta as condições que devem ser consideradas diante da necessidade do uso de qualquer método de imagem cardiovascular em pacientes com Covid-19: deve ser utilizada para casos em que venha a determinar uma mudança substancial na conduta, ou quando uma decisão para salvar a vida do paciente esteja em jogo; deve-se usar a modalidade de imagem com a melhor capacidade para atender a essa solicitação, considerando-se sempre a segurança da equipe médica em relação à exposição; exames não urgentes, eletivos ou de rotina devem ser adiados ou até mesmo cancelados. 333
Nesse sentido, a ecocardiografia transtorácica, embora tenha papel central na propedêutica cardiovascular desses pacientes, não deve ser rotineiramente indicada diante da corrente pandemia de Covid-19, sendo criteriosamente utilizada em casos específicos. 334
As recentes recomendações da Society of Cardiovascular Computed Tomography (SCCT) para uso da angio-TC coronariana no contexto da Covid-19 incluem insuficiência cardíaca aguda de causa desconhecida 335 , 336 ( Tabela 30 ). 337
Tabela 30. – Recomendações da Society of Cardiovascular Computed Tomography (SCCT) para uso da angiotomografia coronariana no contexto da Covid-19.
| Urgência | Condições | Tempo para realização do exame |
|---|---|---|
| Eletivos |
|
Em >8 semanas |
| Semiurgentes |
|
Em 4 a 8 semanas |
| Urgentes |
|
Em horas ou <2 a 4 semanas (a depender da gravidade) |
Descartar trombos quando RMC não factível. FA: fibrilação atrial; TAVI: implante transcateter da válvula aórtica. Fonte: adaptada de Araujo-Filho et al.337
O documento da ESC sugere que troponinas positivas, associadas à disfunção miocárdica ou arritmias graves não explicadas por outros métodos, podem ser indicação para RMC, caso o diagnóstico seja crucial para o tratamento e o paciente esteja estável o suficiente para ser transferido com segurança para realização do exame. 334
Nesse contexto, a atual orientação da Society for Cardiovascular of Magnetic Resonance (SCMR) sugere que um exame de RMC deva ser considerado de forma criteriosa e individualizada diante da suspeita de miocardite aguda com implicações imediatas no manejo do paciente. 337 Caso a RMC seja realizada, os resultados devem ser interpretados de acordo com os critérios de Lake Louise: (1) edema; (2) lesão celular irreversível; e (3) hiperemia ou extravasamento capilar 338 ( Tabela 31 ). 337
Tabela 31. – Recomendações da Society for Cardiovascular of Magnetic Resonance (SCMR) para uso da ressonância magnética cardíaca (RMC) no contexto da Covid-19.
| Condições | Tempo sugerido para o exame |
|---|---|
|
Dentro de 1 semana ou menos, a depender da gravidade |
| |
| |
| |
|
Nota 1: Escolhas baseadas em consenso de especialistas. Nota 2: Condições clínicas individuais e contraindicações ao exame devem ser mandatoriamente consideradas. Fonte: Araujo-Filho et al.337
6.6.7. Biópsia Endomiocárdica
Tanto a AHA como a ESC recomendam a BEM para o diagnóstico definitivo de miocardite, mas ambas as sociedades reconhecem suas limitações. 339 , 340 Na era SARS-CoV-2, a utilidade clínica e o papel da BEM, atualmente o padrão-ouro para confirmar o diagnóstico de miocardite, permanecem incertos; além disso, há grande dificuldade na realização de imagens não invasivas, como ecocardiografia e RMC, com medidas adequadas de precaução e isolamento. 341 , 342
Outro ponto a ser considerado é que em, em alguns casos, a infecção por SARS-CoV-2 pode não aparecer inicialmente com sinais e sintomas claros sugestivos de pneumonia intersticial, mas pode aparecer como miocardite sem sintomas respiratórios, às vezes complicada por choque cardiogênico com um curso fulminante. 14 , 316
Adicionalmente, existem poucas evidências sobre o tratamento terapêutico da miocardite associada ao SARSCoV-2. Há um relato de caso em que foi utilizada terapia precoce com glicocorticoides e imunoglobulinas, com benefício para o paciente. 316 Os corticosteroides têm sido utilizados em várias infecções respiratórias virais (influenza, SARS-CoV e MERS-CoV), demonstrando um benefício limitado e, em alguns casos, retardando a depuração viral e aumentando a mortalidade. 333
No entanto, o Grupo de Trabalho da ESC sobre doenças miocárdicas e pericárdicas indica o uso de esteroides em miocardites por doenças autoimunes comprovada, miocardite com vírus negativo somente após determinar a infecção ativa no BEM. 340 É evidente que, na prática real, a BEM nem sempre está disponível ,e seu papel na miocardite relacionada à SARS-CoV-2 ainda é desconhecido. Além disso, na ausência de estudos randomizados multicêntricos, o uso rotineiro de imunoglobulina também não é recomendado.
Em conclusão, acreditamos que existem lacunas significativas na avaliação do IAM em pacientes com SARS-CoV-2 que requerem uma análise diagnóstica completa, tratamentos priorizados e, ainda, estratégias mais agressivas, 318 , 319 se necessário, especialmente naqueles que desenvolvem choque cardiogênico durante a miocardite fulminante 332 - 342 ( Figura 13 ). 318
Figura 13. – Protocolo de diagnóstico e gerenciamento sugerido para miocardite relacionada a SARS-CoV-2.
BBIA: bomba de balão intra-aórtica; CCC: cardioversão por corrente contínua; DAV: dispositivo de assistência ventricular; DC: débito cardíaco; ECG: eletrocardiograma; IGIV: imunoglobulina intravenosa; IV: intravenoso; OEC: oxigenação por membrana extracorpórea; PCR: proteína C reativa; QT: intervalo QT; RMC: ressonância magnética cardiovascular; SCA: síndrome coronariana aguda; TC-AC: tomografia computadorizada angiograma coronário; TSE: taxa de sedimentação de eritrócitos. Fonte: Adaptada de Siripanthong et al.318
6.7. Cardiotoxidade Aguda por Terapêutica Antineoplásica
6.7.1. Agentes Antineoplásicos Indutores de Cardiotoxidade Aguda
A evolução do tratamento do câncer nas últimas décadas resultou em melhora da sobrevida e da qualidade de vida dos pacientes. 343 Entretanto, simultaneamente, com o aumento da longevidade, os fatores de risco cardiovasculares incidem por mais tempo e, associados a esse fato, adiciona-se o potencial risco de lesão ao sistema cardiovascular induzido pela quimioterapia, radioterapia e imunoterapia. 344 Estudos recentes demonstram que há dois períodos de maior ocorrência de doença cardiovascular no paciente oncológico: o primeiro ano após o diagnóstico e os anos após a cura, nos quais denominamos os pacientes como sobreviventes, grupo este que demonstra aumento significativo de mortalidade cardiovascular. 345 , 346
Dentre as toxicidades emergentes, destaca-se a miocardite. Mais recentemente, a miocardite relacionada ao tratamento do câncer ganhou importância devido à evolução da imunoterapia, mais especificamente relacionada aos inibidores de checkpoint imunológico (ICIs). 347 , 348 Contudo, ela tem o potencial de estar associada a qualquer terapia que module o sistema imunológico. Identificar a miocardite nos ensaios clínicos em oncologia é desafiador, dada sua relativa baixa incidência e alta taxa de mortalidade.
Devemos ressaltar que as recomendações a seguir são advindas de consensos de especialistas, dada a escassez de dados científicos a respeito do tema.
O modelo clássico de cardiotoxicidade é a disfunção ventricular causada pelas antraciclinas. 349 As antraciclinas são uma das classes mais utilizadas de quimioterápicos ainda nos dias de hoje. IC ocorre em até 30% dos pacientes, habitualmente após meses de tratamento, relacionada à dose cumulativa acima de 300 mg/m2. Na maioria dos casos, manifesta-se de forma subaguda ou crônica, após meses e anos do tratamento, com a irreversibilidade sendo sua característica predominante. A miocardite aguda relacionada às antraciclinas é manifestação rara, não apresentando relação com dose, sendo reversível na maioria dos casos. 350 O mecanismo de ação da toxicidade está diretamente ligado ao estresse oxidativo consequente a sua metabolização, além da inibição da topoisomerase IIb, que, em última instância, resulta em dano ao DNA do cardiomiócito, por disfunção mitocondrial e apoptose. 351
A ciclofosfamida é um agente alquilante tipo mostarda nitrogenada, que usualmente é parte de regimes de quimioterápicos que envolvem o uso concomitante de antraciclinas. Pode resultar em toxicidade aguda do tipo miocardite aguda hemorrágica e multifocal, caracterizada por endotelite, capilarite hemorrágica e trombogênese. 352
Os inibidores de checkpoint imunológicos (ICI) são o modelo atualmente mais estudado como indutor de miocardite, sendo os mais comumente utilizados o nivolumabe, o durvalimabe, o ipilimumabe, o pembrolizumabe e o atezolizumabe. 353 Essa terapia significou uma revolução no tratamento do câncer nos últimos anos, melhorando a sobrevida dos pacientes com câncer de pulmão, câncer de cabeça e pescoço, carcinoma renal, melanoma, entre outros. 354 O mecanismo de ação se dá pelo bloqueio da apoptose dos linfócitos T (anti-CTLA4, anti-PD1, anti-PDL1), culminando na ativação dos linfócitos por todo o organismo. Se isso, por um lado, reativa o linfócito e a imunidade antitumoral, por outro lado, os linfócitos T ativados podem desencadear miocardite grave, fatal em até 50% dos casos. Clinicamente, manifesta-se em torno de 0,2% dos pacientes, em média 30 a 90 dias após o início do tratamento. 355 , 356
6.7.2. Diagnóstico da Cardiotoxidade Aguda
A miocardite no paciente com câncer deve ser diagnosticada em situações de condições cardíacas sem diagnóstico primário alternativo (p. ex., síndrome coronariana aguda, traumatismo etc.). 357 A história clínica deve considerar o regime de droga, o tempo do tratamento, assim como a dose e outras comorbidades. O diagnóstico laboratorial inclui a dosagem de biomarcadores como troponina ultrassensível e NT-proBNP. No caso da miocardite por imunoterápico, a dosagem de CPK também é recomendada pela associação com miosite em até 20% dos casos. 358
O ECG pode ser útil para confirmar a suspeita de miocardite. Alterações comuns são arritmias ventriculares, alterações de ST-T, alterações do segmento PR, bradicardias e bloqueios. 357
O ecocardiograma é o exame de escolha para a abordagem diagnóstica da miocardite. É realizado no início e na evolução, acessando função de maneira evolutiva. Os achados mais comuns incluem disfunção sistólica difusa, anormalidades segmentares, alterações na esfericidade do ventrículo, espessamento de parede, derrame pericárdico e alterações no strain . 357
A RM é a modalidade de imagem de maior sensibilidade para o diagnóstico de miocardite, também tendo efeito de determinar o prognóstico. A combinação de achados da RMtem sido denominada Critérios de Lake Louise para o diagnóstico de miocardite aguda. Muitos avanços ocorreram no diagnóstico de miocardite por ressonância, e incluem avanços na caracterização tecidual por meio do MAPT1 e MAPT2 e cálcio do volume extracelular. 359
A BEM pode ser considerada para investigação da miocardite relacionada a quimioterápicos e imunoterápicos. Especialistas recomendam, sempre que possível, a realização da biópsia, pois, em muitos casos, antes de manifestação clínica expressiva, os achados anatomopatológicos já exprimem a gravidade das alterações patogênicas da miocardite do câncer. 360
A seguir, descrevemos os principais agentes antineoplásicos com potencial de induzir a miocardite com disfunção miocárdica ( Tabela 32 ).
Tabela 32. – Características da miocardite induzida pelo tratamento do câncer.
| Antraciclinas | Ciclofosfamida | Inibidores de checkpoint imunológico | |
|---|---|---|---|
| Incidência | 10% | 10% | 0,2% |
| Mortalidade | 20% | 20% | 50% |
| Manifestação clínica | IC aguda | IC aguda | IC aguda |
| Diagnóstico | Clínico, laboratorial, imagem e biópsia | Clínico, laboratorial, imagem e biópsia | Clínico, laboratorial, imagem e biópsia |
| Reversibilidade | Geralmente reversível | Geralmente reversível | Geralmente irreversível |
| Reexposição | Possível | Possível | Não recomendado |
IC: insuficiência cardíaca.
6.7.3. Tratamento da Cardiotoxidade Aguda
Após a suspeita do diagnóstico, o tratamento deve ser iniciado imediatamente, pois o tempo pode ser importante na determinação do curso da doença. Embora não haja grandes estudos prospectivos para orientar o tratamento na MICI, a imunossupressão é a pedra angular do tratamento.
Os esteroides intravenosos são amplamente utilizados nos eventos adversos relacionados à imunoterapia (EAri) e podem ser eficazes na MICI. 347 Altas doses de corticosteroides (p. ex., 1.000 mg por dia de metilprednisona por 3 dias, seguidas de 1 mg/kg de prednisona) são amplamente utilizadas e podem estar associadas a melhores resultados. 22 Mahmood et al. 22 relataram que 31% dos 35 pacientes receberam corticosteroides, e que altas doses foram associadas a níveis mais baixos de pico de troponina e menores taxas de MACE em comparação com doses reduzidas do corticoide. A Sociedade Americana de Oncologia Clínica (ASCO) recomenda 1 mg/kg de corticosteroides como dose inicial. 361 A duração dos esteroides não é clara, mas a ASCO recomenda uma redução durante 4 a 6 semanas em pacientes com EAri. Os biomarcadores cardíacos séricos (p. ex., troponinas, BNP) podem ser úteis para definir a necessidade de maior duração após o desmame.
Imunossupressão adicional também pode ser usada. Evidências anedóticas sugerem que pode ser eficazes outros imunossupressores, tais como imunoglobulina intravenosa, 362 infliximab, 363 micofenolato, 364 tacrolimus, 362 globulina antitimocítica, 365 , 366 plasmaférese, 362 abatacept 367 e alemtuzumab 368 . No estudo de Mahmood et al., 22 um pequeno número de pacientes recebeu outros imunossupressores não esteroides Dada a falta de dados robustos sobre sua eficácia no MICI, tais agentes geralmente são reservados para MICI refratário ou muito grave.
Sugerimos considerar a adição de imunossupressão não esteroide em pacientes que não demonstrem melhora sintomática, funcional ou de biomarcadores dentro de 24 a 48 horas após o início do corticosteroide. A escolha do segundo agente não é identificada, mas pode ser motivada pela disponibilidade e contraindicações. Vários e sequenciados imunossupressores podem ser necessários para alcançar remissão. 22
Recomendamos o início de altas doses de esteroides intravenosos no momento do diagnóstico de MICI (metilprednisona 1 mg/kg /dia). Os biomarcadores cardíacos (troponina e BNP) devem ser verificados em série. Se os biomarcadores cardíacos continuarem a aumentar, apesar da alta dose de esteroides, a plasmaférese deve ser iniciada. Um imunossupressor adicional deve ser adicionado se os biomarcadores cardíacos continuarem a aumentar ou se houver associação ou piora de arritmias ou IC ( Figura 14 ). A escolha do imunossupressor depende da experiência local e das comorbidades coexistentes ( Tabela 33 ).
Figura 14. – Proposta do curso terapêutico de imunossupressão, biomarcadores e avaliação da função ventricular.
ECO: ecocardiograma; CRM: cirurgia de revascularização miocárdica; IV: intravenoso.
Tabela 33. – Imunossupressores usados no tratatmento da MICI.
| Imunossupressor | Classe | Dose | Início | Duração |
|---|---|---|---|---|
| Metilprednisona | Corticosteroides | 1 mg/kg/dia | No diagnóstico | 2 a 3 dias |
| Prednisona | Corticosteroides | 40 a 60 mg/dia | Dia 2-3 | Desmame lento durante 4 a 8 semanas |
| Infliximab | TNF-alfabloqueador | 5 mg/kg | Dia 4-5 | Dose única (pode ser repetido em alguns meses) |
| Globulina antimonócito | ? | 10 a 30 mg/kg | Dia 2-3 | 7 a 14 dias |
| Tacrolimus | Inibidor da calcineurina | 0,10 a 0,15 mg/kg/dia | ? | ? |
| Micofenolato | Inibidor IMPDH | 1g 2×/dia | ? | ? |
| Abatacept | CTLA-4 agonista | 500 mg a cada 2 semanas | Dia 7-14 | Total de 5 doses |
| Alemtuzumab | Anti CD52 | 30 mg | ? | Dose única |
IMPDH: inosina 5-monofosfato desidrogenase.
Recomendamos a administração de uma dose única de infliximabe (5 mg/kg) se não houver contraindicações (por exemplo, tuberculose, hepatite). Alternativamente, podem ser usadas globulina antitimócita (10 a 30 mg/kg), alemtuzumabe (30 mg uma vez) ou abatacept (500 mg). Entre 3 a 5 dias após o início do corticosteroide, a função ventricular deve ser examinada (por ecocardiografia ou RMC). Pacientes que mostrem melhora significativa na função do VE (melhora da FEVE de pelo menos 5%) podem ser transferidos para corticosteroide oral (prednisona 40 a 60 mg por dia) por um longo tempo (4 a 8 semanas). Se os biomarcadores diminuírem e o paciente demonstrar resposta clínica, MMF ou tacrolimus podem ser utilizados para encurtar a cronicidade de esteroides. Dada a alta mortalidade e morbidade com o MICI, o ICI deve ser descontinuado mesmo em pacientes com cardiotoxicidade leve ( Tabela 33 ).
Dada a potencial reversibilidade do MICI, as terapias de suporte podem ser instituídas após cuidadosa consideração multidisciplinar do status da malignidade subjacente e do potencial de recuperação. Estratégias de suporte podem incluir suporte inotrópico, marca-passo temporário ou permanente, suporte circulatório mecânico temporário (p. ex., bomba de balão intra-aórtico, 6 dispositivos de assistência ventricular percutânea 369 ou oxigenação extracorpórea por membrana [ECMO]). 362 , 364 Uma avaliação cuidadosa do VD deve ser feita antes do início dos dispositivos de assistência do VE, pois MICI tem alta probabilidade de afetar o VD, 362 , 364 , 369 o que pode exigir suporte biventricular. 363 , 369 Ademais, devido ao ambiente protrombótico induzido pela neoplasia subjacente e EAri, é essencial excluir trombos do VE com RMC ou ecocardiograma com contraste, antes da inserção de dispositivos percutâneos de assistência do VE. 363 A terapia medicamentosa para IC deve ser iniciada conforme tolerado. Isso inclui bloqueadores da angiotensina (ACE, ARB, ARNi), betabloqueadores e antagonistas dos mineralocorticoides (p. ex. espironolactona).
A segurança de reiniciar o tratamento com ICI após a resolução da miocardite não é conhecida. Em um estudo com 40 pacientes que desenvolveram EAri (1 MICI) nos quais ICI for reintroduzido (43% com o mesmo agente), 22 (55%) desenvolveram EAri recorrentes em um seguimento de 14 meses. Extrapolando esses dados para o MICI, e dada a alta probabilidade de recorrência de EAri com a reintrodução, a ASCO recomenda a descontinuação permanente do ICI em todos os casos de MICI. 370 Há relato de reintrodução bem-sucedida em um caso de miocardite leve, 371 e a reintrodução de ICI pode ser tentada em casos selecionados de MICI leve e assintomática (grau I), 361 especialmente com ICI de baixo risco com pembrolizumab. No entanto, essa recomendação permanece controversa.
6.7.4 Prognóstico
O prognóstico da MICI é difícil de definir devido à sua rara ocorrência. Em um registro multicêntrico de 35 pacientes com MICI, quase metade (n = 16) desenvolveu eventos cardiovasculares adversos importantes ao longo de um período de 102 dias (6 mortes cardiovasculares, 3 choques cardiogênicos, 4 paradas cardíacas, 3 bloqueios cardíacos completos). 22 , 347 Em um registro francês de 30 pacientes com MICI em dois centros, oito pacientes morreram de complicações cardiovasculares. Um estudo recente que acompanhou 101 pacientes com MICI mostrou uma taxa de MACE de 51% durante um seguimento de 162 dias. 347 Entre 250 pacientes com MICI relatados ao Sistema de Notificação de Eventos Adversos da Administração Federal de Medicamentos dos EUA (FAERS), a taxa de mortalidade foi de 50%. 361 Não houve diferença na taxa de fatalidade por idade, sexo, ano de notificação ou tipo de ICI (proteína de morte celular antiprogramada-1/ligante de morte celular programada-1 vs. proteína de linfócito T anticitotóxica-4). 362 Mahmood et al. 22 descobriram que pacientes com MICI e troponina elevada na ocasião de alta hospitalar apresentaram taxas significativamente mais altas de MACE (troponina T de alta de ≥1,5 ng/mL: HR 4,0; IC95%: 1,5-10,9; p=0,003). Escudier et al. 348 relataram que 80% dos pacientes com MICI e doença de condução tiveram morte cardiovascular. Um estudo recente de pacientes com MICI relatou que o strain longitudinal global (GLS) obtido ao diagnóstico de MICI estava fortemente associado a MACE ao longo de um seguimento de 162 dias. 363 Dado o pequeno número de pacientes nesses estudos, é difícil identificar fatores de risco para mau prognóstico em pacientes que apresentam MICI. 364 - 368
No geral, as taxas de recuperação com a terapia apropriada foram substanciais. Um total de 67% dos pacientes que receberam esteroides teve recuperação da função do VE no registro francês do MICI. 347 Recuperação também foi descrita mesmo em pacientes com MICI fulminante que necessitaram de suporte hemodinâmico mecânico. 369 - 374
6.7.5. Prevenção
A maioria dos estudos publicados na prevenção da cardiotoxicidade induzida pela quimioterapia baseia-se nas antraciclinas e nos agentes anti-HER2.
A prevenção da cardiotoxicidade deve iniciar-se antes do tratamento do câncer, com uma avaliação do risco cardiovascular do paciente e uma interação entre o cardiologista e o oncologista, a fim de programar a melhor abordagem durante o tratamento oncológico.
Os pacientes sob maior risco de desenvolver a cardiotoxicidade são aqueles que apresentam os fatores de risco clássicos para doença cardiovascular (hipertensão arterial, diabetes melito, dislipidemia, tabagismo, obesidade, sedentarismo, entre outros) ou aqueles sob maior exposição a fármacos cardiotóxicos (doses cumulativas altas para antraciclinas, associações de fármacos cardiotóxicas e antecedente de quimioterapia ou radioterapia). 375 , 376
As principais recomendações para prevenção da cardiotoxicidade estão descritas na Tabela 34 .
Tabela 34. – Medidas para prevenção de cardiotoxicidade.
| Droga quimioterápica | Medida cardioprotetora |
|---|---|
| Identificar fatores de risco cardiovascular | |
| Tratar comorbidades (hipertensão arterial, diabetes melito, dislipidemia, tabagismo, sedentarismo, obesidade) | |
| Atividade física aeróbica de intensidade moderada | |
| Cuidados com arritmias: evitar drogas que prolongem o intervalo QT, ajustar distúrbios eletrolíticos | |
| Minimizar radiação cardíaca | |
| Antraciclinas | Limitar dose cumulativa (mg/m2): |
| Daunorrubicina < 800 | |
| Doxorrubicina < 360 | |
| Epirrubicina < 720 | |
| Mitoxantrona < 160 | |
| Idarrubicina < 150 | |
| Utilizar as formulações lipossomais | |
| Realizar infusão contínua | |
| Utilizar análogos menos cardiotóxicos (epirrubicina, idarrubicina) | |
| Avaliar uso de drogas cardioprotetoras (dexrazoxano, IECA, betabloqueadores, estatinas) | |
| Trastuzumabe | Avaliar uso de drogas cardioprotetoras (IECA, betabloqueadores) |
IECA: inibidor da enzima conversora de giotensina; QT: intervalo QT. Fonte: Adaptada de Zamorano et al.377
Entre as medicações cardioprotetoras, o dexrazoxano, um quelante de ferro, é a única medicação aprovada para a prevenção da cardiotoxicidade. Seu efeito contra a cardiotoxicidade por antraciclinas já foi comprovado em diversos estudos tanto na população adulta como na pediátrica. 376 - 383 As limitações para o uso do dexrazoxano é o custo elevado e alguns potenciais efeitos adversos, tais como interferência na eficácia das antraciclinas, risco de desenvolvimento de tumores secundários (evidência controversa) 384 , 385 e toxicidade medular. Seu uso está indicado em adultos com câncer de mama com estágio avançado ou metastático que receberam uma dose cumulativa prévia de 300 mg/m2 de doxorrubicina, 540 mg/m2 de epirrubicina, quando necessário a continuidade do tratamento com antraciclinas.
O uso de drogas cardiovasculares como betabloqueadores, IECA e bloqueadores do receptor da angiotensina (BRA) na prevenção da cardiotoxicidade secundária às antraciclinas é controverso e se baseia em poucos ensaios clínicos. 386 - 391 Algumas evidências demonstraram benefícios dos betabloqueadores e IECA em pacientes que utilizaram doses cumulativas de antraciclinas elevadas ou em pacientes de alto risco, com troponina positiva durante a quimioterapia. 386 , 390 Em doses cumulativas de antraciclina mais baixas, esse benefício não foi evidênciado com betabloqueadores, 389 , 392 mas houve uma discreta prevenção com o uso de BRA. 389
O ensaio clínico CECCY, 392 um estudo brasileiro, testou o uso de betabloqueadores para prevenção primária da cardiotoxicidade por antraciclinas, não demonstrou benefício do uso do carvedilol na prevenção relacionada a antraciclinas. Entretanto, o carvedilol esteve associado a valores atenuados de troponina e menor porcentagem de pacientes com aparecimento de disfunção diastólica.
Em relação ao uso do trastuzumabe, alguns estudos também apontam benefício para o uso de drogas cardiovasculares tanto na prevenção da cardiotoxicidade 393 , 394 quanto após o aparecimento da cardiotoxicidade, auxiliando na recuperação da disfunção ventricular. 395 A decisão da suspensão do tratamento quimioterápico, bem como seu retorno, deve ser feita em conjunto, pesando o risco e o benefício da manutenção do tratamento oncológico.
6.8 Miocardite em Crianças e Adolescentes
6.8.1. Fatores Causais
A miocardite em crianças e adolescentes apresenta particularidades em sua etiologia, e o seu diagnóstico pode ser subestimado pela similaridade de sua apresentação inicial com inúmeras viroses comuns na infância. Estima- se que mais de 83% dos pacientes compareceram aos serviços de urgência por duas ou mais visitas antes do diagnóstico. 396 Nas análises retrospectivas, a dor torácica foi referida predominantemente em crianças maiores de 10 anos, e os sinais mais comuns observados nos mais jovens foram taquipneia, febre e desconforto respiratório 397 ( Tabela 35 ). A aplicação de algoritmos para o diagnóstico em salas de emergência tem se mostrado promissora, com a possibilidade de aumentar o número de pacientes suspeitos ( Figura 15 ). 239 , 398 Em relação à etiologia, estudos avaliando a coleta de painel viral no quadro agudo e a confirmação por biópsias, observamos o parvovírus B19 como predominante, seguido pelos enterovírus, Coxsackievírus B e herpes-vírus humano. 398 Casos relacionados aos arbovírus – responsáveis por dengue, Zika e Chikungunya – t =êm sido descritos em regiões endêmicas ao redor do mundo. 399 Mais recentemente, com a pandemia de SARS-Cov2, têm sido relatadas apresentações com agressão miocárdica associada ou não à síndrome inflamatória multissistêmica com fisiopatologia ainda pouco esclarecida. 400 Sobreviventes ao tratamento dos cânceres da infância, principalmente os submetidos ao tratamento com antracíclicos e inibidores de checkpoint , constituem uma parcela de alto risco à instalação do processo inflamatório levando à IC na idade adulta. 401
Tabela 35. – Achados clínicos mais comuns na apresentação inicial das miocardites em crianças e adolescentes.
| Sinais e sintomas | Menores de 2 anos | Pré-escolares | Escolares e adolescentes |
|---|---|---|---|
| Específicos | Sinais de IC | Sinais de IC | Sinais de IC |
| História de doença viral nas últimas 3 a 6 semanas | História de doença viral nas últimas 3 a 6 semanas | Dor torácica | |
| Dor torácica (pouco comum) | Dor torácica (pouco provável) | História de doença viral pode não estar tão clara | |
| Inespecíficos | Febre | Dispneia aos esforços | Dispneia aos esforços |
| Letargia | Taquicardia em repouso | Taquicardia em repouso | |
| Irritabilidade | Fadiga muscular | Fadiga muscular | |
| Alteração da perfusão | Arritmias | Arritmias | |
| Hiporexia | Choque | Choque | |
| Taquicardia mantida em repouso | |||
| Arritmias | |||
| Choque |
IC: insuficiência cardíaca.
Figura 15. – Fluxograma de suspeita e investigação das miocardites em crianças e adolescentes.
BEM: biópsia endomiocárdica; BNP: peptídeo natriurético tipo B; CV: cardiovascular; ECG: eletrocardiograma; ECO: ecocardiograma; FEVE: fração de ejeção de ventrículo esquerdo; GI: gastrointestinal; IC: insuficiência cardíaca; PCR: proteína C reativa; RMC: ressonância magnética cardíaca; SNC: sistem nervoso central.
6.8.2. Prognóstico
É difícil estimar a incidência e a prevalência de miocardite na faixa etária pediátrica é devido ao amplo espectro de sintomas, que pode variar desde um quadro viral leve sem comprometimento hemodinâmico até um quadro de IC congestiva, com disfunção ventricular, arritmias e morte súbita. 164 , 402 - 405 Como os sintomas, muitas vezes, são inespecíficos, um significativo número de casos não é diagnosticado, o que dificulta a caracterização da real incidência e prognóstico. Entretanto, é a principal etiologia da miocardiopatia dilatada em crianças.
Com a melhora das unidades de terapia intensiva, incluindo a possibilidade de suporte mecânico à circulação, o prognóstico de crianças de todas as faixas etárias tem melhorado, com possibilidade de recuperação completa mesmo de casos com doença fulminante. 402
Os principais desfechos em paciente pediátricos incluem recuperação completa, progressão para miocardiopatia dilatada e morte ou transplante cardíaco. 405
Acredita-se que, em crianças com miocardite viral, o prognóstico tende a ser melhor do que nas miocardiopatias dilatadas. A sobrevida de pacientes pediátricos com miocardite pode ser de até 93%. Entretanto, um estudo multicêntrico englobando todas as faixas etárias demonstrou que existe uma significativa mortalidade em neonatos e lactentes. A sobrevida nessa faixa etária foi de 33% a 45%, e a melhora clínica, de 23% a 32%. Em crianças entre 1 e 18 anos, a sobrevida foi melhor, em torno de 78% e 80%, e a melhora clínica, entre 46% e 67%. 406 Em um estudo recente do Pediatric Cardiomyopathy Registry (PCMR), crianças com miocardite confirmada por biópsia tiveram uma sobrevida de 75% em 3 anos, e 54% do grupo normalizaram as dimensões e função ventricular, e apenas 20% permaneceram com anormalidades ecocardiográficas. 404
Em outro estudo com 28 pacientes com diagnóstico de miocardite, foi observado que apenas 17 sobreviveram e tiveram alta hospitalar, com vários graus de melhora da função cardíaca. Os demais 11 pacientes evoluíram para IC refratária, sendo necessário transplante cardíaco em sete casos, e ocorreu óbito em quatro casos. Preditores de mau prognóstico foram: fração de ejeção abaixo de 30%, fração de encurtamento abaixo de 15%, dilatação ventricular esquerda, regurgitação mitral moderada a severa. 406
Várias séries de casos envolvendo crianças que necessitaram de suporte mecânico à circulação por miocardite reportam taxa de sobrevida entre 67% e 83%. Para 21 pacientes com suporte mecânico com Berlin Heart Excor por miocardite ou miocardiopatia dilatada, 90% sobreviveram com alta hospitalar. 407
O prognóstico em miocardite comprovada por BEM depende da gravidade dos sintomas, da classificação histológica e biomarcadores. Miocardite aguda fulminante é associada com melhor sobrevida. Miocardite por células gigantes, apesar de rara, é associada com mau prognóstico, com uma sobrevida média de 5,5 meses, com uma taxa de mortalidade ou transplante de 89%. 406
Miocardite contribui para pelo menos 50% das miocar- diopatias dilatadas na infância. O desfecho de pacientes com miocardite viral é melhor que aqueles com miocardiopatia dilatada. Por esse motivo, deve-se sempre suspeitar de miocardite, instituir medidas de suporte precocemente, evitando que um paciente com miocardite seja encaminhado à lista de transplante sem a chance de recuperação. A indicação de transplante na miocardite só deve ser considerada quando a recuperação for desfavorável, apesar do manejo terapêutico adequado ( Tabela 36 ).
Tabela 36. – Principais informações sobre miocardites na criança e no adolescente.
| Miocardites na criança e no adolescente |
|---|
| Os principais desfechos incluem: recuperação completa, progressão para miocardiopatia dilatada e morte ou transplante cardíaco |
| Imunoglobulina endovenosa tem se tornado uma prática no tratamento das miocardites, porém o seu efeito na função cardíaca ainda não está completamente esclarecido |
| O espectro de manifestações clínicas da miocardite é muito amplo, desde um quadro viral leve até insuficiência cardíaca congestiva com choque cardiogênico com necessidade de suporte inotrópico ou mecânico à circulação |
| Apesar de a biópsia miocárdica ser considerada padrão-ouro para o diagnóstico de miocardite, em crianças, o risco de eventos adversos varia de 1% a 5% (taquiarritmias, hipotensão pela anestesia, alterações isquêmicas, perfuração ventricular). Portanto, essa prática não tem sido adotada de rotina5 |
| Fração de ejeção <42% e troponina elevada ao diagnóstico têm maior associação com mortalidade |
| Pacientes que sobrevivem à fase aguda têm um desfecho tardio melhor que aqueles que têm um quadro mais insidioso |
| Miocardite é a principal etiologia da miocardiopatia dilatada na infância |
A utilização de imunoglobulina (IVIG) tem se tornado parte do tratamento imunomodulatório em crianças com miocardite aguda em muitos centros, na dose standard de 2g/kg em 24 horas. Essa prática tem sido instituída desde a clássica publicação de Drucker et al., em 1994. 164 Foi demonstrada uma tendência à recuperação da função ventricular naqueles que receberam imunoglobulina. Em uma coorte de 94 pacientes com miocardiopatia de início recente, IVIG foi administrada em 22% dos pacientes, e o seguimento de 5 anos demonstrou uma maior taxa de recuperação quando comparados com os demais pacientes que não receberam imunoglobulina. 408
Em um estudo realizado em Taiwan com 94 pacientes, a avaliação da curva ROC identificou que a fração de ejeção <42% (sensibilidade 86,7% e especificidade de 82,8%) e a dosagem de troponina I >45ng/mL (sensibilidade de 62,6% e especificidade de 91%) tiveram a maior associação com mortalidade. 403
Vários estudos demonstraram que os pacientes que sobrevivem à fase aguda inicial têm um desfecho mais favorável a longo prazo, ao contrário daqueles com doença mais insidiosa.
Evidência histológica de miocardite como causa de miocardiopatia dilatada tem sido considerada um indicador prognóstico positivo para recuperação, com chances de cura entre 50% e 80% em 2 anos. 402 Da mesma forma, a evolução para IC crônica com necessidade de transplante cardíaco pode ocorrer tardiamente mesmo após a melhora clínica inicial.
6.9. Miocardites com Envolvimento Pericárdico
6.9.1. Diagnóstico e Tratamento
Miocardites e pericardites são doenças que, com frequência, se apresentam associadas na prática clínica e representam diferentes espectros dentro do grupo das síndromes inflamatórias miopericárdicas ( Tabela 37 ). 409 , 410 Isso se deve ao fato de ambas as doenças apresentarem agentes etiológicos comuns (especialmente virais). 411 No entanto, raramente o acometimento miocárdico e pericárdico ocorre na mesma intensidade. O mais comum é haver predomínio da miocardite (perimiocardite) ou da pericardite (miopericardite). 412 A distinção entre as diferentes formas de apresentação é relevante por ter impacto no prognóstico e tratamento. A miopericardite usualmente tem boa evolução, sem IC ou pericardite constritiva. 413 - 416 No cenário da miocardite aguda, o acometimento pericárdico (perimiocardite) tem importância prognóstica. No estudo de Di Bella et al., 417 que avaliou uma coorte de 467 pacientes com miocardite aguda viral/idiopática diagnosticada pela RMC, observou-se que aproximadamente 24% dos pacientes tinham acometimento pericárdico. Além disso, a presença de pericardite aumentou em 2,5 vezes o risco de eventos cardíacos (desfecho combinado de morte, transplante cardíaco, implante de CDI, hospitalização por IC descompensada). 416
Tabela 37. – Recomendação de avaliação nos casos de miocardite com suspeita de acometimento pericárdico.
| Indicação | Classe | Nível de evidência |
|---|---|---|
| No paciente com miocardite aguda com suspeita de acometimento pericárdico, a ressonância magnética cardíaca é indicada para elucidação diagnóstica nos casos duvidosos | I | C |
O diagnóstico de miocardite associada à pericardite aguda deve ser suspeitado nos pacientes que apresentam diagnóstico de miocardite e pelo menos dois dos seguintes critérios: dor torácica de caráter pleurítico, que pode ser difícil de identificar pela presença de dor pelo acometimento miocárdico; atrito pericárdico; alterações eletrocardiográficas sugestivas de pericardite com infra do segmento PR e supra de ST difuso com a concavidade para cima; derrame pericárdico novo ou piora do preexistente. O laboratório geralmente revela leucocitose com predomínio de linfócitos (nos quadros virais) e elevação da PCR e velocidade de hemossedimentação (VHS). A RMC é o exame não invasivo com melhor acurácia para avaliação de acometimento pericárdico no paciente com miocardite. 409 , 417 O exame revela a presença de inflamação, espessamento, derrame e massas no pericárdio, e está indicado em todo os casos com dúvida diagnóstica (grau de recomendação I, nível de evidência C). 409 , 418
No paciente com miocardite e acometimento pericárdico, o tratamento deve seguir as recomendações para tratamento da miocardite e depende essencialmente da causa de base. Nos casos virais/idiopáticos sem disfunção ventricular, o uso de AINEs para controle da lesão pericárdica deve ser considerado com cautela, em doses reduzidas, uma vez que, em estudos experimentais, os AINES revelaram aumento de mortalidade e piora da inflamação miocárdica. 411 , 419 , 420
6.10. Miocardite Simulando Infarto Agudo do Miocárdio
Estudos anteriores indicaram que 2,6% a 25% dos pacientes com suspeita de IAM revelaram-se como IAM sem doença arterial coronariana obstrutiva (MINOCA; do inglês, myocardial infarction with non-obstructive coronary artery ). Existem várias etiologias que podem ser atribuídas aos indivíduos com suspeita de IAM, mas com angiogramas sem lesões culpadas, dentre as quais miocardite aguda tem sido reconhecida como um fator particularmente importante. 421
É comum que as apresentações clínicas típicas do IAM, como dor no peito, elevação do segmento ST e marcadores séricos incrementais, apareçam em pacientes diagnosticados com miocardite. 422 , 423
Além disso, no cenário clínico de doença aguda com elevação de troponina, pode ser clinicamente desafiador diferenciar um IAM tipo 2 de causas de lesão miocárdica sem isquemia, principalmente a miocardite. O IAM tipo 2 é aquele secundário à isquemia devido ao aumento da demanda de oxigênio ou diminuição da oferta, causado, por exemplo, por espasmo da artéria coronária, embolia coronária, anemia, arritmias, hipertensão ou hipotensão. 424
O termo isquemia miocárdica é utilizado quando há evidências de valores elevados de troponina com pelo menos um valor acima do limite superior de referência (URL) do percentil 99. O termo injúria miocárdica é considerado se houver aumento e/ou queda dos valores de troponina. O diagnóstico de IAM é específico quando há lesão miocárdica aguda associado à evidência clínica de isquemia miocárdica aguda, exigindo tanto detecção de um aumento e/ou queda dos valores de troponina e a presença de pelo menos uma das seguintes condições: sintomas de isquemia miocárdica, alterações isquêmicas novas no ECG, desenvolvimento de ondas Q patológicas, evidência de imagem de nova perda de miocárdio viável ou de novas anormalidades do movimento da parede em um padrão consistente com um quadro isquêmico e/ou identificação de trombo coronário por angiografia ou autópsia. 424
As principais entidades clínicas que podem simular um IAM com supradesnível do segmento ST são: miocardite/pericardite, cardiomiopatia de Takotsubo, síndromes da onda J (usado para descrever tanto a síndrome de Brugada quanto a síndrome de repolarização precoce), anormalidades secundárias da repolarização (como bloqueio de ramo esquerdo, marca-passo ventricular e hipertrofia ventricular), distúrbios eletrolíticos (hipercalemia e hipercalcemia) e outras causas não isquêmicas (como síndrome de Wolff-Parkinson-White, embolia pulmonar, hemorragia intracraniana, hipotermia e pós-parada cardiorrespiratória), porém as alterações eletrocardiográficas evolutivas podem ajudar na diferenciação, além das diferenças nas histórias clínicas. 425
A caracterização tecidual in vivo com RMC permite a identificação de edema/inflamação nas síndromes coronarianas agudas/miocardite e diagnóstico de doenças crônicas e condições fibróticas (p. ex., em cardiomiopatias hipertróficas e dilatadas, estenose aórtica e amiloidose). 425 Na doença não isquêmica, o padrão e a distribuição do realce tardio (LGE; do inglês, late gadolinium enhancement ) podem oferecer pistas sobre etiologia e significado prognóstico. 425 A miocardite geralmente causa cicatrizes subepicárdicas/mesocárdicas, geralmente (embora nem sempre) em uma distribuição não coronariana, poupando o subendocárdio 426 , 427
Na miocardite, a imagem ponderada em T2 também pode identificar regiões de inflamação, caracteristicamente, em uma distribuição não coronariana. Por outro lado, o mapeamento T1 paramétrico está também disponível, fornecendo avaliação quantitativa e objetiva do edema/inflamação (p. ex., no IAM/miocardite). 426 , 427 Existe uma interação dinâmica entre inflamação e fibrose em vários precursores de IC, como IAM e miocardite. O diagnóstico precoce de IC com biomarcadores e imagem é fundamental; enquanto a RMC é útil para avaliar a extensão da lesão, medições seriadas de biomarcadores indicam se inflamação e fibrose são progressivas. 427
Clinicamente, caso de miocardite simulando IAM é extremamente complexo para os médicos fazerem um diagnóstico preciso. A definição da anatomia coronariana é mandatória, seja com a coronariografia ou com a angiotomografia de coronárias. Além disso, um diagnóstico correto de miocardite, por si só, é um desafio devido a padrões não específicos de sua apresentação clínica e a falta de um método de diagnóstico preciso e confiável. Embora seja recomendada a realização de BEM nas diretrizes como método ideal, o diagnóstico de miocardite na prática rotineira é geralmente baseado em considerações abrangentes do histórico médico dos pacientes, manifestações clínicas e exames complementares, dentre os quais a RMC, que tem vantagem significativa na detecção de anormalidades do miocárdio e na discriminação precisa de pacientes com miocardite daqueles com IAM verdadeiro. 421 - 423 , 425 - 427 Na Figura 16 , sugerimos um fluxograma de avaliação de paciente com IAM versus miocardite.
Figura 16. - Diagnóstico diferencial de dor torácica: IAM versus miocardite.
BEM: biópsia endomiocárdica; ECG: eletrocardiograma; ECO: ecocardiograma; IAM: infarto agudo do miocárdio; RMC: ressonância magnética cardíaca; Tn: troponina.
7. Cardite Reumática
Em 2018, a Organização Mundial da Saúde (OMS) reconheceu a endemia de febre reumática em países de baixa renda e orientou ação global focada em prevenção, diagnóstico e profilaxia secundária. 428 A febre reumática é uma doença bifásica, cujo surto agudo manifesta-se com variáveis combinações de artrite, cardite, coreia, lesões cutâneas e subcutâneas, e a miocardite ocorre em mais de 50% dos pacientes. 429 Cerca de 5% dos pacientes com miocardite reumática aguda apresentam manifestação clínica significativa que motivam atendimento médico e até 50% dos pacientes com cardite aguda evoluem para cardiopatia reumática crônica (fase tardia), caracteristicamente valvopatia mitral e/ou aórtica. 430 , 431 A prevalência de cardite reumática em nosso meio não é conhecida, mas várias informações evidenciam que se trata de condição frequente e subdiagnosticada. Em 2013, o Sistema Único de Saúde (SUS) brasileiro informou que ocorreram 5.169 hospitalizações relacionadas à febre reumática aguda. 432 Estima-se que, atualmente, cerca de 40 milhões de pessoas ao redor do mundo tenham cardiopatia reumática crônica e que essa doença leve a aproximadamente 300.000 mortes por ano. 433 Um estudo brasileiro realizado no estado de Minas Gerais, em 5.996 estudantes de 21 escolas, encontrou 0,42% de prevalência de cardiopatia reumática crônica, número 2 a 10 vezes maior à média documentada em países desenvolvidos. 434
A suspeita de cardite reumática deve ser feita concomitante à suspeita de surto agudo de febre reumática, inicialmente por meio da aplicação dos critérios de Jones, que foram revisados em 2015. 435 Recomenda-se estratificar epidemiologicamente o risco de causa reumática, sendo considerados de alto risco pacientes oriundos de regiões cuja incidência de febre reumática é maior que 2 por 100 mil escolares (5 a 14 anos) por ano, ou prevalência de sequela valvar reumática maior que 1 por 1.000 pessoas por ano. Estima-se que grande parte da população brasileira resida em regiões com essas características. Também houve inclusão de critérios ecocardiográficos e expansão da utilização dos critérios para diagnóstico de recidiva 436 ( Tabela 38 ). Portanto, a etiologia reumática deve ser considerada em pacientes com cardite em nosso meio, principalmente jovens, em regiões de baixa renda e/ou com antecedente de valvopatia reumática.
Tabela 38. – Critérios de Jones modificados em 2015.
| Primeiro surto de febre reumática | Recidiva de febre reumática |
|---|---|
| 2 critérios maiores; ou 1 critério maior e pelo menos 2 menores | 2 critérios maiores; ou 1 critério maior e pelo menos 2 menores; ou 3 critérios menores |
| População de baixo risco (<2/100.000 casos de febre reumática aguda por anos e <1/1.000 casos de sequela valvar reumática por ano) | População de risco moderado/alto risco (>2/100.000 casos de febre reumática aguda por anos e >1/1.000 casos de sequela valvar reumática por ano) |
| Critérios maiores | Critérios maiores |
|
|
|
|
|
|
|
|
|
|
| Critérios menores | Critérios menores |
|
|
|
|
|
|
|
|
| Evidência de infecção prévia pelo Streptococcus B-hemolítico do grupo A (cultura positiva de orofaringe; teste rápido positivo; escarlatina; títulos elevados de anticorpos antiestreptocócicos) | Evidência de infecção prévia pelo Streptococcus B-hemolítico do grupo A (cultura positiva de orofaringe; teste rápido positivo; escarlatina; títulos elevados de anticorpos antiestreptocócicos) |
PCR: proteína C reativa; VHS: velocidade de hemossedimentação.
Quando há documentação de surto agudo de febre reumática ou manifestação clínica de IC, é fundamental a busca ativa por cardite reumática. A cardite reumática é uma pancardite, acometendo em grau variável pericárdio, miocárdio e endocárdio, sendo esta a principal manifestação: valvulite aguda – presente em 90% dos casos, caracteristicamente por valvopatia regurgitativa aguda mitral e/ou aórtica. 437 Quando há sintomas, o principal mecanismo é a valvopatia aguda (preferencialmente mitral) e, menos frequente e com menos intensidade, miocardite e pericardite. 438 Portanto, o foco inicial da investigação é a detecção da valvopatia, podendo ser reconhecida por exame físico, mas é mandatória a realização ecocardiográfica, inicialmente transtorácica, reservando-se a avaliação transesofágica para situações infrequentes de janela inadequada. 439 O ECG de 12 derivações, além do alargamento do intervalo PR, pode demonstrar QT longo e alterações compatíveis com pericardite e sobrecarga de câmaras esquerdas. 440 Habitualmente, não há elevação de troponina e CKMB, indicando que o dano miocárdico é pequeno. 431 , 441 A radiografia de tórax pode ser útil em documentar cardiomegalia e congestão. 442 Após essa avaliação inicial, a hipótese diagnóstica pode ser: 443 , 444
Cardite subclínica: exame clínico sem alterações de alerta, ECG apenas com intervalo PR prolongado e/ou ecodopplercardiograma evidenciando regurgitação leve mitral e/ou aórtica
Cardite leve: taquicardia desproporcional à febre, sopro regurgitativo identificável, ECG apenas com intervalo PR prolongado, radiografia de tórax sem alterações de alerta e ecodopplercardiograma evidenciando regurgitação leve a moderada mitral e/ou aórtica
Cardite moderada: critérios da cardite leve associados a sintomas leves de IC e/ou QT longo e/ou cardiomegalia e congestão na radiografia e/ou dilatação leva a moderada de câmaras esquerdas
Cardite grave: sintomas limitantes de IC com regurgitação valvar importante e/ou cadiomegalia importante e/ou disfunção ventricular sistólica.
Dessa forma, a miocardite reumática, em si, é pouco exuberante, deve ser suspeitada quando há critérios para cardite reumática, IC manifesta, sem valvopatia aguda anatomicamente importante. Nessa situação, também é fundamental a avaliação minuciosa de possível diagnóstico diferencial de miocardite.
Pacientes com quadros leves, moderados e graves devem ter continuação da investigação diagnóstica com exames de imagem. A cintilografia com Gálio-67 apresenta alta sensibilidade e especificidade, é o exame mais estudado e deve ser o primeiro a ser realizado. 445 , 446 Cintilografia antimiosina é menos sensível, assim como o PET scan , sendo ambos opções em indisponibilidade do Gálio, ou quando há evidência de outros diagnósticos diferenciais. 447 , 448 A RM carece de trabalhos específicos para febre reumática, ainda mais que o acometimento é prioritariamente valvar, sendo mais um exame útil em diagnósticos diferenciais. 449 A BEM apresenta baixa sensibilidade, porém altíssima especificidade, sendo o achado de nódulos de Aschoff patognomônico de miocardite reumática. Sua indicação é em casos graves e refratários 450 ( Tabela 39 ).
Tabela 39. – Exames diagnósticos para cardite reumática.
| Indicações | Classe | Nível de evidência |
|---|---|---|
| Eletrocardiograma 12 derivações | I | B440 |
| Radiografia de tórax | I | C442 |
| Ecodopplercardiograma transtorácico | I | B436,439 |
| Ecodopplercardiograma transesofágico em situações de dificuldade de visualização transtorácica | I | C436,439 |
| VHS e PCR (ver critérios de Jones) | I | B436 |
| Antiestreptolisina O (ver critérios de Jones) | I | C436 |
| Antidexirribonuclease B com alternativa à antiestreptolisina O | IIa | C435 |
| Alfa-1 glicoproteína ácida para monitoramento da atividade inflamatória | IIa | C444 |
| Eletroforese de proteína (alfa-2 globulina) para monitoramento da atividade inflamatória | IIa | C444 |
| Troponina como critério diagnóstico | IIb | B431,441 |
| Cintilografia com Gálio-67 | IIa | B445,446 |
| PET 18F-FDG CT | IIb | B448 |
| Ressonância cardíaca | IIb | C449 |
| Biópsia endomiocárdica | IIb | C444,450 |
PCR: proteína C reativa; PET 18F-FDG: tomografia por emissão de pósitrons 18F-fluorodesoxiglicose; VHS: velocidade de hemossedimentação.
Para todos os pacientes com cardite reumática, apesar de se tratar de resposta imune tardia, recomenda-se erradicação estreptocócica. 451 O tratamento da forma subclínica e leve implica controle dos sintomas associados ao surto agudo e monitoramento da evolução. A forma moderada e grave implica uso de corticosteroides, inicialmente via oral, e pulsoterapia se refratariedade. 452 - 455 Medicações como iECA, furosemida, espironolactona e digoxina devem ser usadas se IC manifesta. 450 A refratariedade implica ponderar tratamento cirúrgico valvar na fase aguda ( Tabela 40 ). 456 - 457
Tabela 40. – Tratamento da cardite reumática.
| Indicações | Classe | Nível de evidência |
|---|---|---|
|
I | C444, 451 |
| Repouso, se caso moderado ou grave | IIa | C444 |
| Hospitalização para controle de sintomas em cardite moderada a grave | IIa | C444 |
| Prednisona 0,5 a 1 mg/kg/dia (máximo 50mg) via oral, pode ser dividida em 2 a 3 doses diárias, mantendo por 15 dias, com redução posterior semanal de 20% da dose em casos subclínicos a leves. Tempo total de 4 a 8 semanas. | IIb | B444,452,453 |
| Ácido acetilsalicílico 100mg/kg (máximo 3 a 4g) dividido em 4 doses ou Naproxeno 20mg/kg (máximo 1.000mg) dividido em 2 doses para casos subclínicos com artrite e/ou pericardite associada. Tempo total de 2 semanas. | I | B444,453 |
| Prednisona 1 a 2 mg/kg/dia (máximo 60mg) via oral, pode ser dividida em 2 a 3 doses diárias, mantendo por 15 dias, com redução posterior semanal de 20% da dose em casos moderados a graves. Tempo total em torno de 12 semanas. | I | B444,452,453 |
| Metilprednisolona 30mg/kg/dia em ciclos semanais em casos graves e refratários ao tratamento inicial. | IIb | B454,455 |
| Na presença de sinais/sintomas de disfunção ventricular, tratamento medicamentoso da IC com diurético e drogas com atuação neuro-hormonal | I | C450 |
|
I | B456,457 |
IC: insuficiência cardíaca.
8. Miocardites por Doenças Autoimunes
O envolvimento cardíaco nas doenças autoimunes pode incluir pericárdio, miocárdio, endocárdio, valvas e coronárias. Dentre as entidades, merecem destaque em relação à miocardite, a sarcoidose, a miocardite de células gigantes, a doença de Behçet, a granulomatose eosinofílica com poliangeíte, o LES, a esclerodermia e a artrite reumatoide. Existe uma evidente limitação em relação ao diagnóstico de miocardite e sua prevalência nas doenças autoimunes, porém devemos considerar essa possibilidade quando da presença de sinais e sintomas sugestivos de acometimento cardíaco, quer seja com arritmias, síncope, IC, dor torácica e elevação de marcadores de necrose miocárdica, especialmente em pacientes com antecedente de doença autoimune ou quando existe acometimento cardíaco associado a sintomas de inflamação atingindo outros sistemas.
A elevação de marcadores inflamatórios inespecíficos, incluindo PCR/VHS e de lesão miocárdica, como troponina e BNP, habitualmente está presente, porém sem especificidade. ECG e ECO devem ser realizados para todos os pacientes com doenças autoimunes na suspeita de acometimento cardíaco. 12 , 188 A RM pode ser utilizada como método sensível e específico para avaliação de miocardite, além de ampliar o raciocínio em relação a diagnósticos diferenciais. 458 , 459 Outro método não invasivo tem sido o PET, especialmente em situações de suspeita de sarcoidose. 243 A solicitação de marcadores de autoimunidade, como FAN, fator reumatoide e ANCA, deve ser considerada e orientada pela suspeita clínica. 460 A BEM é o padrão-ouro para o diagnóstico de miocardite, quer seja por doenças autoimunes ou outras etiologias; mediante utilização de técnicas além da histologia, consegue diferenciar o acometimento infeccioso em relação ao não infeccioso; além disso, pode identificar a presença de vasculite ou outras doenças miocárdicas não inflamatórias. 151 O tratamento da miocardite pelas doenças autoimunes foi discutido em outra sessão deste documento.
A elevação de marcadores inflamatórios inespecíficos, incluindo PCR/VHS e de lesão miocárdica, como troponina e BNP, habitualmente está presente, porém sem especificidade. ECG e ECO devem ser realizados para todos os pacientes com doenças autoimunes na suspeita de acometimento cardíaco. 12 , 188 A RM pode ser utilizada como método sensível e específico para avaliação de miocardite, além de ampliar o raciocínio em relação a diagnósticos diferenciais. 458 , 459 Outro método não invasivo tem sido o PET, especialmente em situações de suspeita de sarcoidose. 243 A solicitação de marcadores de autoimunidade, como FAN, fator reumatoide e ANCA, deve ser considerada e orientada pela suspeita clínica. 460 A BEM é o padrão-ouro para o diagnóstico de miocardite, quer seja por doenças autoimunes ou outras etiologias; mediante utilização de técnicas além da histologia, consegue diferenciar o acometimento infeccioso em relação ao não infeccioso; além disso, pode identificar a presença de vasculite ou outras doenças miocárdicas não inflamatórias. 151 O tratamento da miocardite pelas doenças autoimunes foi discutido em outra sessão deste documento.
9. Manejo das Arritmias Cardíacas na Miocardite
9.1. Avaliação Não Invasiva e Invasiva das Arritmias na Fase Aguda e Crônica das Diversas Causa das Miocardites
As arritmias cardíacas são manifestações relativamente frequentes no paciente com miocardite, podendo ocorrer em qualquer fase da doença. Os mecanismos arritmogênicos estão direta ou indiretamente relacionados ao grau de agressão inflamatória miocárdica. 55
Na fase aguda pela agressão viral e da resposta inflamatória, temos miocitólise associada à fibrose, que promovem a hiperatividade do sistema simpático e disfunção dos canais iônicos, especialmente na regulação do cálcio, criando o substrato eletrofisiológico para geração de arritmias. 461 Quanto maior o dano celular e o grau de comprometimento inflamatório, maior a probabilidade de ocorrência de arritmias ventriculares, sendo a reentrada o principal mecanismo arritmogênico.
Um amplo espectro de bradiarritmias e taquiarritmias ocorre no contexto da miocardite. BAV, alterações da repolarização ventricular e o prolongamento do intervalo QT são achados comuns na fase aguda da doença. Fibrilação atrial e taquicardias atriais também podem estar presentes no curso da miocardite aguda ou na fase crônica.
As arritmias ventriculares podem se manifestar através de extrassístoles e/ou taquicardias ventriculares. Estas podem ter um caráter monomórfico ou polimórfico e apresentarem-se de forma não sustentada ou sustentada (duração ≥30 segundos).
Os sintomas variam de acordo com a forma de apresentação da arritmia, o estado hemodinâmico e o grau de disfunção ventricular esquerda, podendo se manifestar por meio de palpitações, taquicardias, síncope ou morte súbita.
Os métodos diagnósticos diretos utilizados para avaliação não invasiva das arritmias são o ECG basal de 12 derivação, a eletrocardiografia ambulatorial contínua por 24 ou 48 horas (sistema Holter ) e o monitoramento de eventos (sistema Looper).
O ECG é geralmente alterado nos pacientes com miocardite, porém tais achados apresentam baixa sensibilidade e especificidade. 462 Ukena et al. 94 relataram que a duração prolongada do complexo QRS é um preditor independente para morte cardíaca ou transplante cardíaco em pacientes com suspeita de miocardite. O prolongamento do intervalo QTc acima de 440 ms, o desvio do eixo QRS e a presença de ectopias ventriculares, presentes no curso da miocardite, não parecem ser preditores independentes de pior prognóstico. O ECG é uma ferramenta de grande utilidade na detecção de bradiarritmias e taquiarritmias que se apresentam de forma sustentada.
Para documentação das arritmias que apresentam um caráter paroxístico, o monitoramento de eletrocardiografia ambulatorial pode ser utilizado. A duração do monitoramento depende da frequência dos sintomas e quanto mais esporádico mais difícil a sua documentação.
Através da eletrocardiografia ambulatorial por 24 horas ( Holter ), é possível a documentação de arritmias e anormalidades da condução atrioventricular. O Holter também nos auxilia na análise da distribuição nictemeral das arritmias, do sistema nervoso autônomo e do provável mecanismo eletrofisiológico. 463 Recomendamos a realização do Holter 24 horas na fase hospitalar para avaliação de possíveis arritmias assintomáticas e anormalidades intermitentes da condução atrioventricular ( Tabela 41 ). O Holter também pode ser recomendado na fase crônica da miocardite como método auxiliar para estratificação de risco de morte súbita. 463
Tabela 41. – Recomendações para a avaliação de arritmias na miocardite aguda.
| Indicação | Classe | Nível de evidência |
|---|---|---|
| Holter para pacientes de risco prognóstico intermediário e alto | I | C |
O real papel da avaliação invasiva por meio do estudo eletrofisiológico para estratificação do risco de morte súbita é ainda ponto de investigação em pacientes com miocardites. Um dos pontos a se considerar é que a reprodutibilidade de eventos arrítmicos significativos deve variar de acordo com a etiologia e o tipo de acometimento miocárdico. 464 Na sarcoidose cardíaca, por exemplo, encontramos alto grau de reprodutibilidade de eventos clínicos significativos com a estimulação elétrica programada, sendo esta útil na tomada de decisão. Nos pacientes que apresentaram taquicardia ventricular monomórfica não sustentada ou sustentada em algum momento da doença, importante realce tardio ou zonas de baixa voltagem ao estudo eletrofisiológico com mapeamento eletroanatômico parecem ter pior prognóstico, e estes achados podem auxiliar na estratificação do risco de morte súbita. 465 Na ausência de dados específicos, recomenda-se a utilização cautelosa desse método de estratificação do risco de morte súbita nesses pacientes, especialmente nos assintomáticos. 259
9.2. Tratamento de Arritmias e Prevenção da Morte Súbita na Fase Aguda e Subaguda
As arritmias podem estar associadas à miocardite principalmente na fase aguda, mas também na fase crônica, dependendo do grau de lesão tecidual, nos quais se destacam a inflamação e a fibrose residual, mas com uma base fisiológica ampla 466 , 467 ( Tabela 42 ). Podem estar presentes em 33,7% dos casos internados por miocardite, se apresentando tanto por taqui, quanto bradiarritmias e estão associados a morbidades como hipertireioidismo, idade, obesidade, IC, desequilíbrio eletrolítico e doença valvar. 95 A preexistência de cardiomiopatias como displasia arritmogênica do VD e canalopatias preexistentes está também associada à ocorrência de arritmias durante inflamação miocárdica. 468 , 469
Tabela 42. – Mecanismos potencialmente geradores de arritmia em pacientes com miocardites.
|
| Apoptose celular |
|
|
As bradiarritmias são geralmente associadas aos BAV, que podem ser de vários graus e ocorrem predominantemente na fase aguda; mesmo assim, são raras. Obongayo et al. 92 observaram uma prevalência de 1,7% de BAV, sendo somente 1,1% de bloqueios avançados na fase intra-hospitalar de 31.760 pacientes internados com o diagnóstico de miocardite a partir do banco de dados do Nationawide Inpatient Survey dos EUA. Nos casos de BAV avançado de 3º grau, houve associação com maior morbidade e mortalidade.
A fibrilação atrial pode ocorrer em até 9% dos pacientes com miocardite aguda na fase hospitalar e se associa a maior mortalidade hospitalar (RC:1,7 com IC 95% 1,1-2,7, p = 0.02); choque cardiogênico (RC: 1,9, com IC 95% 1,3-2,8, p < 0.001) e tamponamento cardíaco (RC: 5,6 com IC 95% 1.2-25.3, p = 0.002). 470
As arritmias ventriculares, as mais associadas à probabilidade de morte súbita, podem corresponder até aproximadamente um quarto de todas as arritmias registradas em pacientes internados por miocardite, sendo a taquicardia ventricular a mais frequente. 95
O manejo das arritmias na fase aguda deve seguir o princípio de transitoriedade do processo, e as ectopias frequentes ou taquicardias não sustentadas não devem ser tratadas por antiarrítmicos específicos, exceto o betabloqueador, quando indicado. O uso do marca-passo temporário pode ser utilizado em BAV avançados nesta fase, e a indicação de marca-passo definitivo ou cardiodesfibrilador implantado deve seguir as indicações convencionais ( Tabela 43 ).
Tabela 43. – Tratamento das arritmias e prevenção da morte súbita relacionadas à miocardite.
| Indicações | Classe | Nível de evidência |
|---|---|---|
| Tratamento com betabloqueador, espironolactona e sacubitril-valsartana para pacientes com disfunção sistólica de VE | I | C |
| Marca-passo provisório para bradiarritmias sintomáticas e/ou BAV avançado durante a fase aguda da miocardite | I | C |
| Terapia antiarrítmica com amiodarona na TVNS sintomática ou TV sustentada durante a fase aguda de miocardite | I | C |
| Implante de CDI na prevenção primária de MS em pacientes com cardiomiopatia dilatada na fase crônica (>6 meses), da miocardite com tratamento clínico otimizado CF II e III, FEVE ≤35% e expectativa de vida de pelo menos 1 ano | IIa | C |
| Indicação de CDI nas fases aguda e subaguda de miocardite (<6 meses) | III | C |
| Indicação de agentes antiarrítmicos para prevenção primária de arritmias cardíacas em pacientes com miocardite | III | C |
BAV: bloqueio atrioventricular; CDI: cardiodesfibrilador implantável; CF: classe funcional; FEVE: fração de ejeção de ventrículo esquerdo; MS: morte súbita; TV: taquicardia ventricular; TVNS: taquicardia ventricular não sustentada; VE: ventrículo esquerdo..
10. Avaliação Prognóstica e Seguimento
10.1. Marcadores de Prognóstico e Evolução
A miocardite se apresenta com ampla diversidade fenotípica. Grande parte de indivíduos com miocardite aguda, que se apresentam com cardiomiopatia dilatada aguda, evoluem com melhora do quadro em poucos dias. 14 Relatos de séries apresentam valores entre 10% e 20% de eventos cardiovasculares sérios a longo prazo e risco de recaída de 10%. 109
Inúmeros fatores têm sido envolvidos no prognóstico, quer sejam clínicos, quer sejam laboratoriais. A manutenção da função ventricular preservada durante o quadro agudo tem sido repetidamente relacionada com melhora espontânea sem sequelas. 15 Outras análises registram que níveis reduzidos da pressão arterial e da frequência cardíaca, síncope, disfunção sistólica do ventrículo direito, pressão arterial pulmonar elevada assim como classe funcional avançada da New York
Heart Association devem ter papel importante. 94 A etiologia também tem se mostrado valorosa no espectro prognóstico. Portadores de miocardite linfocítica aguda, que mantiveram função ventricular preservada, evoluíram com melhora espontânea e sem sequelas. Em contraposição, o Myocarditis Treatment Trial registrou que pacientes com IC e FEVE inferior a 45% apresentaram mortalidade de 56% em 4 anos. A miocardite de células gigantes e a eosinofílica evoluem de forma mais sombria. 14 Portadores de miocardite fulminante apresentam dramático prognóstico a curto prazo; no entanto, quando sobreviventes, apresentaram melhor prognóstico que várias outras etiologias. 17 , 98
O ECG mostrou valor prognóstico em avaliação recente. 471 A RM, exame de destacado valor no cenário do diagnóstico da miocardite, já apresentou utilidade com o uso da técnica do realce tardio; 109 contudo, em mais recente publicação, não confirmou valor preditivo, seja na melhora da função ventricular ou na remodelação em avaliação a longo prazo. 472 Apesar do avanço no diagnóstico, o prognóstico continua sendo um desafio, provavelmente por inúmeros fatores conhecidos ou não. É possível considerar as causas que variam enormemente com suas peculiaridades, apresentação clínica, envolvimento imunológico e genético, entre outras. 137
10.2 Seguimento Ambulatorial nas Avaliações dos Métodos Complementares
O seguimento clínico acompanhado do ECG deve acontecer continuamente nos pacientes que já apresentaram o diagnóstico. Diante do valor inegável da função ventricular, exames de imagem devem ser incluídos. O ecocardiograma surge como alternativa útil e de mais fácil acesso, trazendo a informação mais relevante nesse cenário ( Tabela 44 ).
Tabela 44. – Recomendações gerais de acompanhamento na miocardite473,474.
| Indicações | Classe | Nível de evidência |
|---|---|---|
| Acompanhamento clínico com eletrocardiograma dos pacientes de baixo risco com 1, 3, 6 e 12 meses, e anualmente a seguir | I | C |
| Acompanhamento por ecocardiograma dos pacientes de baixo risco com 1, 6 e 12 meses, e anualmente a seguir | I | C |
| Avaliação clínica laboratorial em pacientes com risco intermediário e com Holter e exames de imagem aos 1, 3 e 6 meses (ecocardiograma e/ou ressonância de acordo com disponibilidade), e anualmente a seguir | I | C |
| Entre pacientes portadores de miocardite de alto risco, realizar acompanhamento clínico e laboratorial com Holter e exames de imagem com 15 dias, 1, 3 e 6 meses (ecocardiograma ou ressonância de acordo com a disponibilidade), e anualmente a seguir | I | C |
Footnotes
Nota: Estas diretrizes se prestam a informar e não a substituir o julgamento clínico do médico que, em última análise, deve determinar o tratamento apropriado para seus pacientes.
Realização: Departamento de Insuficiência Cardíaca da Sociedade Brasileira de Cardiologia (DEIC-SBC)
Referências
- 1.Leone O, Veinot JP, Angelini A, Baandrup UT, Basso C, Berry G, et al. 2011 Consensus statement on endomyocardial biopsy from the Association for European Cardiovascular Pathology and the Society for Cardiovascular Pathology. Cardiovasc Pathol. 2012;21(4):245–74. [DOI] [PubMed]
- 2.Basso C, Calabrese F, Corrado D, Thiene G. Postmortem diagnosis of sudden cardiac death victims: microscopic and molecular findings. Cardiovasc Res. 2001;50(2):290–300. [DOI] [PMC free article] [PubMed]
- 3.GBD 2013 Risk Factors Collaborators; Forouzanfar MH, Alexander L, Anderson HR. Global, regional, and national incidence, prevalence, and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990–2013: A systematic analysis for the global burden of disease study 2013. Lancet. 2015;386(9995):743–800. [DOI] [PMC free article] [PubMed]
- 4.Felker GM, Hu W, Hare JW, Hruban RH, Baughman KL, Kasper EK. The spectrum of dilated cardiomyopathy. The Johns Hopkins experience in 1278 patients. Medicine(Baltimore) 1999;78:270–283. [DOI] [PubMed]
- 5.Towbin JA, Lowe AM, Colan SD, Sleeper LA, Orav EJ, Clunie S, et al. Incidence, causes, and outcomes of dilated cardiomyopathy in children. JAMA 2006;296(15):1867–76. [DOI] [PubMed]
- 6.Kyto V, Sipila J, Rautava P. Gender differences in myocarditis: A nationwide study in Finland. Eur Heart J. 2013(Suppl 1):3505.
- 7.Fairweather D, Cooper LT Jr, Blauwet LA. Sex and gender differences in myocarditis and dilated cardiomyopathy. Curr Probl Cardiol. 2013;38(1):7–46. [DOI] [PMC free article] [PubMed]
- 8.Cooper LT Jr, Berry GJ, Shabetai R. Idiopathic giant-cell myocarditis-natural history and treatment. Multicenter Giant Cell Myocarditis Study Group Investigators.N Engl J Med. 1997;336(26):1860-6. [DOI] [PubMed]
- 9.Saji T, Matsuura H, Hasegawa K, Nishikawa T, Yamamoto E, Ohki H, et al. Comparison of the clinical presentation, treatment, and outcome of fulminant and acute myocarditis in children. Circ J. 2012;76(5):1222–8. [DOI] [PubMed]
- 10.Amabile N, Fraisse A, Bouvenot J, Chetaille P, Ovaert C. Outcome of acute fulminant myocarditis in children. Heart. 2006;92(9):1269–73.. [DOI] [PMC free article] [PubMed]
- 11.Caforio AL, Calabrese F, Angelini A, Tona F, Vinci A, Bottaro S, et al. A prospective study of biopsy- proven myocarditis: prognostic relevance of clinical and aetiopathogenetic features at diagnosis. Eur Heart J. 2007;28(11):1326–33. [DOI] [PubMed]
- 12.Caforio AL, Pankuweit S, Arbustini E, Basso C, Gimeno-Blanes J, Felix SB, et al. Current state of knowledge on aetiology,diagnosis, managment, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group. Eur Heart J. 2013;34(33):2636-48. [DOI] [PubMed]
- 13.Aretz HT, Billingham ME, Edwards WD, Factor SM, Fallon JT, Fenoglio JJ Jr, et al. Myocarditis: a histopathologic definition and classification. Am J Cardiol Pathol. 1985;1(1)3-14. [PubMed]
- 14.Fung G, Luo H, Qiu Y, Yang D, McManus B. Myocarditis. Circ Res. 2016;118(3):496-514. [DOI] [PubMed]
- 15.Kindermann I, Barth C, Mahfoud F, Ukena C, Lenski M, Yilmaz A, et al. Update on myocarditis. J Am Coll Cardiol. 2012;59(9):779–92. [DOI] [PubMed]
- 16.Kühl U, Pauschinger M, Noutsias M, Seeberg B, Bock T, Lassner D, et al. High prevalence of viral genomes and multiple viral infections in the myocardium of adults with “idiopathic” left ventricular dysfunction. Circulation. 2005;111(7):887-93. [DOI] [PubMed]
- 17.Blauwet LA, Cooper LT. Myocarditis. Prog Cardiovasc Dis. 2010;52(4): 274-88. [DOI] [PMC free article] [PubMed]
- 18.Yilmaz A, Klingel K, Kandolf R, Sechtem U. A geographical mystery: do cardiotropic viruses respect national borders? J Am Coll Cardiol. 2008;52(1):82; [DOI] [PubMed]
- 19.Costa EG, Santos SO, Sojo-Milano M, Amador EC, Tatto E, Souza DS, et al. Acute Chagas Disease in the Brazilian Amazon: Epidemiological and clinical features. Int J Cardiol. 2017;235:176-8. Doi:10.1016/ijcard.2017.02.101 [DOI] [PubMed]
- 20.Nunes H, Freynet O, Naggara N, Soussan M, Weinman P, Diebold B, et al. Cardiac sarcoidosis. Semin Respir Crit Care Med. 2010;31(4):428-41. [DOI] [PubMed]
- 21.Cooper LT Jr. Giant cell and granulomatous myocarditis. Heart Fail Clin. 2005;1(3):431-7. [DOI] [PubMed]
- 22.Mahmood SS, Fradley MG, Cohen JV, Nohria A, Reynolds KL, Heinzerling LM, et al. Myocarditis in Patients Treated With Immune Checkpoint Inhibitors. J Am Coll Cardiol. 2018;71(16):1755-64. [DOI] [PMC free article] [PubMed]
- 23.Johnson DB, Balko JM, Compton ML, Chalkias S, Gorham J, Xu Y, et al. Fulminant Myocarditis with Combination Immune Checkpoint Blockade. N Engl J Med. 2016 Nov 3;375(18):1749-55. [DOI] [PMC free article] [PubMed]
- 24.Tocchetti CG, Galdiero MR, Varricchi G. Cardiac Toxicity in Patients Treated With Immune Checkpoint Inhibitors: It Is Now Time for Cardio-Immuno- Oncology. J Am Coll Cardiol. 2018 Apr 24;71(16):1765-7 [DOI] [PubMed]
- 25.Belkaya S, Kontorovich AR, Byun M, Mulero-Navarro S, Bajolle F, Cobat A, et al. Autosomal recessive cardiomyopathy presenting as acute myocarditis. J Am Coll Cardiol. 2017;69(13):1653–65. [DOI] [PMC free article] [PubMed]
- 26.Caforio AL, Keeling PJ, Zachara E, Mestroni L, Camerini F, Mann JM, et al. Evidence from family studies for autoimmunity in dilated cardiomyopathy. Lancet. 1994;344(8925):773-7. [DOI] [PubMed]
- 27.Cannata A, Artico J, Gentile P, Merlo M, Sinagra G. Myocarditis evolving in cardiomyopathy: when genetics and offending causes work together. Eur Heart J Suppl. 2019 ;21 (Suppl B):B90-B95. [DOI] [PMC free article] [PubMed]
- 28.Malkiel S, Kuan AP, Diamond B. Autoimmunity in heart disease: mechanisms and genetic susceptibility. Mol Med Today. 1996;2(8):336–42. [DOI] [PubMed]
- 29.Lopez-Ayala JM, Pastor-Quirante F, Gonzales-Carillo J, Lopez-Cuenca D, Sanchez-Munoz JJ, Olivia-Sandoval MJ, et al. Genetics of myocarditis in arrhythmogenic right ventricular dysplasia. Heart Rhythm. 2015;12(4):766-73. [DOI] [PubMed]
- 30.Kawai C. From myocarditis to cardiomyopathy: mechanisms of inflammation and cell death: learning from the past for the future. Circulation. 1999;99(8):1091-100. [DOI] [PubMed]
- 31.Maisch B, Noutsias M, Ruppert V, Richter A, Pankuweit S. Cardiomyopathies: classification, diagnosis, and treatment. Heart Fail Clin. 2012;8(1):53-78. [DOI] [PubMed]
- 32.D’Ambrosio A, Patti G, Manzoli A, Sinagra G, Di Lenarda A, Silvestri F, Di Sciascio G. The fate of acute myocarditis between spontaneous improvement and evolution to dilated cardiomyopathy: a review. Heart. 2001;85(5):499 –504. [DOI] [PMC free article] [PubMed]
- 33.Saraste A, Arola A, Vuorinen T, Kyto V, Kallajoki M, Pulkki K, et al. Cardiomyocyte apoptosis in experimental coxsackievirus B3 myocarditis. Cardiovasc Pathol. 2003;12(5):255-62. [DOI] [PubMed]
- 34.Zhou F, Jiang X, Teng L, Yang J, Ding J, He C. Necroptosis may be a novel mechanism for cardiomyocyte death in acute myocarditis.Mol Cell Biochem. 2017;442(1):11-8. [DOI] [PubMed]
- 35.Fairweather D, Rose NR. Cox sackievirus-induced myocarditis in mice: a model of autoimmune disease for studying immunotoxicity. Methods 2007; 41:118–22. [DOI] [PMC free article] [PubMed]
- 36.Kraft L, Erdenesukh T, Sauter M, Tschope C, Klingel K. Blocking the IL-1beta signalling pathway prevents chronic viral myocarditis and cardiac remodeling. Basic Res Cardiol. 2019;114(6):11. [DOI] [PubMed]
- 37.Afanasyeva M, Georgakopoulos D, Belardi DF, Bedja D, Fairweather D, Wang Y, et al. Impaired up-regulation of CD25 on CD4+ T cells in IFNgamma knockout mice is associated with progression of myocarditis to heart failure. Proc Natl Acad Sci USA. 2005;102(1):180-5. [DOI] [PMC free article] [PubMed]
- 38.Klingel K, Hohenadl C, Canu A, Albrecht M, Seemann M, Mall G, et al. Ongoing enterovirus-induced myocarditis is associated with persistente heart muscle infection: quantitative analysis of virus replication, tissue damage, and inflammation. Proc Natl Acad Sci USA. 1992;89(1):314-8. [DOI] [PMC free article] [PubMed]
- 39.Becher PM, Gotzhein F, Klingel K, Escher F, Blankenberg S, Westermann D, et al. Cardiac function remains impaired despite reversible cardiac remodeling after acute experimental viral myocarditis. J Immunol Res. 2017;2017:0 6590609 [DOI] [PMC free article] [PubMed]
- 40.Epelman S, Liu PP, Mann DL. Role of innate and adaptive imune mechanisms in cardiac injury and repair. Nat Rev Immunol; 2015;15(2):117-29. [DOI] [PMC free article] [PubMed]
- 41.Henke A, Huber S, Stelzner A, Whitton JL. The role of CD8+ T lymphocytes in coxsackievirus B3-induced myocarditis. J Virol. 1995;69(11):6720-8. [DOI] [PMC free article] [PubMed]
- 42.Leipner C, Borchers M, Merkle I, Stelzner A. Coxsackievirus B3-induced myocarditis in MHC class II-deficient mice. J Hum Virol.1999;2(2):102-14. [PubMed]
- 43.Rose NR. Myocarditis: infection versus autoimmunity. J Clin Immunol. 2009; 29(6):730–7. [DOI] [PubMed]
- 44.Błyszczuk P. Myocarditis in humans and in experimental animal models. Front Cardiovasc Med. 2019;6:64.doi: 10.3389/fcvm.2019.00064. [DOI] [PMC free article] [PubMed]
- 45.Mangini S, Higuchi Mde L, Kawakami JT, Reis MM, Ikegami RN, Palomino AP, et al. Infectious agents and inflammation in donated hearts and dilated cardiomyopathies related to cardiovascular diseases, Chagas’ heart disease, primary and secondary dilated cardiomyopathies. Int J Cardiol. 2015;178:55-6. [DOI] [PubMed]
- 46.Lv H, Havari E, Pinto S, Gottumukkala RV, Cornivelli L, Raddassi K, et al. Impaired thymic tolerance to alpha-myosin directs autoimmunity to the heart in mice and humans. J Clin Invest. 2011;121(4):1561-73. [DOI] [PMC free article] [PubMed]
- 47.Rosenstein ED, Zucker MJ, Kramer N. Giant cell myocarditis: most fatal of autoimmune diseases. Semin Arthritis Rheum. 2000;30(1):1-16. [DOI] [PubMed]
- 48.Baughman RP, Lower EE, du Bois RM. Sarcoidosis. Lancet. 2003;361(9363):1111-8. [DOI] [PubMed]
- 49.Thomas PD, Hunninghake GW. Current concepts of the pathogenesis of sarcoidosis. Am Rev Respir Dis.1987;135(3):747-60. [DOI] [PubMed]
- 50.Ginsberg F, Parrillo JE. Eosinophilic myocarditis. Heart Fail Clin. 2005;1(3):419-29. [DOI] [PubMed]
- 51.Taliercio CP, Olney BA, Lie JT. Myocarditis related to drug hypersensitivity. Mayo Clin Proc. 1985;60(7):463-8. [DOI] [PubMed]
- 52.Spodick DH. Eosinophilic myocarditis. Mayo Clin Proc. 1997;72(10):996. [DOI] [PubMed]
- 53.Narula N, McNamara DM. Endomyocardial biopsy and natural history of myocarditis. Heart Fail Clin. 2005;1(3):391-406. [DOI] [PubMed]
- 54.Gallegos C, Rottmann D, Nguyen VQ, Baldassarre LA. Myocarditis with checkpoint inhibitor immunotherapy: case report of late gadolinium enhancement on cardiac magnetic resonance with pathology correlate. Eur Heart J- Case Rep. 2019;3(1):1-4. [DOI] [PMC free article] [PubMed]
- 55.Montera MW, Mesquita ET, Colafranceschi AS, Olivei et al. I DIretrIz BrasIleIra de MIocardItes e PerIcardItes. Arq Bras Cardiol. 2013: 100 (4 supl. 1):1-36.
- 56.Anzin Mi, Merlo M, Sabbadini G, Barbati G, Finocchiaro G, Pinamonti B, et al. Long-term Evolution and Prognostic Stratification of Biopsy-Proven Active Myocarditis.Circulation. 2013;26;128(22):2384-94. [DOI] [PubMed]
- 57.Grun S, Schumm J, Greulich S, Wagner A, Schneider S, Bruder O, et al. Long-term follow-up of biopsy-proven viral myocarditis: predictors of mortality and incomplete recovery. J Am Coll Cardiol. 2012;59(18):1604-15. [DOI] [PubMed]
- 58.Lurz P, Eitel I, Adam J, Steiner J, Grothoff M, Desch S, et al. Diagnostic Performance of CMR Imaging Compared With EMB in Patients With Suspected Myocarditis. J Am Coll Cardiol Img. 2012;5(5):513–24. [DOI] [PubMed]
- 59.Ferreira VM, Menger JS, Holmvang G, Kramer CM, Carbone L, Sechtem U, et al. Cardiovascular Magnetic Resonance in Nonischemic Myocardial Inflammation Expert Recommendations. J Am Coll Cardiol. 2018;18;72(24):3158-76. [DOI] [PubMed]
- 60.Gutberlet M, Spors B, Thoma T, Bertram H, Denecke T, Felix R, et al. Suspected Chronic Myocarditis at Cardiac MR: Diagnostic Accuracy and Association With Immunohistologically Detected Inflammation and Viral Persistence. Radiology 2008;246(2):401-9. [DOI] [PubMed]
- 61.Lauer B, Niederau C, Kühl U, Schannwell M, Pauschinger M, Strauer BE, Schultheiss HP. Cardiac Troponin T in Patients With Clinically Suspected Myocarditis. J Am Coll Cardiol. 1997;30(5):1354 –9. [DOI] [PubMed]
- 62.Montera MW, Pereira Y, Silva EL, Takiya C, Mesquita ET. Accuracy of noninvasive methods to diagnose Chronic Myocarditis in patients with dilated cardiomyophaty. Eur J Heart Fail. 2011;(Suppl 10):S162-S165.
- 63.Kociol RD, Cooper LT, Fang JC, Moslehi JJ, Pang PS, Sabe MA, et al. Recognition and Initial Management of Fulminant Myocarditis: A Scientific Statement From the American Heart Association. Circulation. 2020;141(6):e69-e92. [DOI] [PubMed]
- 64.Ammirati E, Veronese G, Bottiroli M, Wang DW, Cipriani M, Garascia A, et al. Update on acute myocarditis. Trends Cardiovasc Med. 2021;31(6):370-9. [DOI] [PMC free article] [PubMed]
- 65.Ammirati E, Cipriani M, Moro C, Raineri S, Pini D, Sormani P, et al. Clinical Presentation and Outcome in a Contemporary Cohort of Patients With Acute Myocarditis: Multicenter Lombardy Registry. Circulation. 2018 Sep 11;138(11):1088-99. [DOI] [PubMed]
- 66.Fabre A, Sheppard MN. Sudden adult death syndrome and other nonischaemic causes of sudden cardiac death: a UK experience. Heart. 2006;92(3):316-20. [DOI] [PMC free article] [PubMed]
- 67.Doolan A, Langlois N, Semsarian C. Causes of sudden cardiac death in young Australians. Med J Aust. 2004;180(3):110 –2. [DOI] [PubMed]
- 68.Magnani JW, Dec GW. Myocarditis: current trends in diagnosis and treatment. Circulation. 2006;113(6):876-90. [DOI] [PubMed]
- 69.Feldman AM, McNamara D. Myocarditis. N Engl J Med. 2000;343(19):1388–98. [DOI] [PubMed]
- 70.Baboonian C, Treasure T. Meta-analysis of the association of enteroviruses with human heart disease. Heart. 1997;78(6):539-43. [DOI] [PMC free article] [PubMed]
- 71.Sagar S, Liu PP, Cooper LT. Myocarditis. Lancet. 2012 February 25; 379(9817):738-47. [DOI] [PMC free article] [PubMed]
- 72.Bozkurt B, Colvin M, Cook J, Cooper LT, Doswal A, Fonarow GC, et al. Current Diagnostic and Treatment Strategies for Specific Dilated Cardiomyopathies: A Scientific Statement From the American Heart Association. Circulation. 2016;134(23):e579-e646. [DOI] [PubMed]
- 73.Angelini A, Calzolari V, Calabrese F, Boffa GM, Maddalena F, Chioin R, Thiene G. Myocarditis mimicking acute myocardial infarction: role of endomyocardial biopsy in the differential diagnosis. Heart. 2000;84(3):245–50. [DOI] [PMC free article] [PubMed]
- 74.Magnani JW, Danik HJ, Dec GW Jr, DiSalvo TG. Survival in biopsy-proven myocarditis: a long- term retrospective analysis of the histopathologic, clinical, and hemodynamic predictors. Am Heart J.2006;151(2):463-70. [DOI] [PubMed]
- 75.Imazio M, Brucato A, Mayosi BM, Derosa FG, Lestuzzi C, Macor A, et al. Medical therapy of pericardial diseases: part I: idiopathic and infectious pericarditis. J Cardiovasc Med (Hagerstown). 2010;11(10):712-22. [DOI] [PubMed]
- 76.Kato S, Morimoto S, Hiramitsu S, Nomura M, Ito T, Hishida H. Use of percutaneous cardiopulmonary support of patients with fulminant myocarditis and cardiogenic shock for improving prognosis. Am J Cardiol.1999;83(4):623–5. [DOI] [PubMed]
- 77.den Uil C A, Akin S, Jewbali L S, Dos Reis M D, Brugts J J, Constantinescu A A, et al. Short-term mechanical circulatory support as a bridge to durable left ventricular assist device implantation in refractory cardiogenic shock: a systematic review and meta-analysis. Eur J Cardiothorac Surg.2017;52(1):14-25. [DOI] [PubMed]
- 78.Diddle JW, Almodovar M C, Rajagopal S K, Rycus P T, Thiagarajan R R. Extracorporeal membrane oxygenation for the support of adults with acute myocarditis. Crit Care Med. 2015;43(5):1016–25. [DOI] [PubMed]
- 79.Tschöpe C, Van Linthout S, Klein O, Mairinger T, Krackhardt F, Potapov EV, et al. Mechanical Unloading by Fulminant Myocarditis: LV-IMPELLA, ECMELLA, BI-PELLA, and PROPELLA Concepts. J Cardiovasc Transl Res. 2019 Apr;12(2):116-123. doi: 10.1007/s12265-018-9820-2. [DOI] [PMC free article] [PubMed]
- 80.McNamara DM, Starling RC, Cooper LT, Boehmer JP, Mather PJ, Janosko KM, et al. for the IMAC Investigators. Clinical and demographic predictors of outcomes in recent onset dilated cardiomyopathy. Results of the IMAC (intervention in myocarditis and acute cardiomyopathy)-2 study. J Am Coll Cardiol. 2011;58(11):1112-8. [DOI] [PMC free article] [PubMed]
- 81.McCarthy RE, Boehmer JP, Hruban RH, Hutchins GM, Kasper EK, Hare JM, Baughman KL. Long-term outcome of fulminant myocarditis as compared with acute (non-fulminant) myocarditis. N Engl J Med. 2000;342(10):690–5. [DOI] [PubMed]
- 82.Morimoto S, Kato S, Hiramitsu S, Uemura A, Ohtsuki M, Kato Y, et al. Role of myocardial interstitial edema in conduction disturbances in acute myocarditis. Heart Vessels. 2006 Nov;21(6):356-60. [DOI] [PubMed]
- 83.Maisch B, Alter P. Treatment options in myocarditis and inflammatory cardiomyopathy: Focus on i. v. immunoglobulins. Herz. 2018 Aug;43(5):423- 30. [DOI] [PMC free article] [PubMed]
- 84.Heymans S. Myocarditis and heart failure: need for better diagnostic, predictive, and therapeutic tools. Eur Heart J. 2007;28(11):1279-80. [DOI] [PubMed]
- 85.Ukena C, Kindermann M, Mahfoud F, Geisel J, Lepper PM, Kandolf R, et al. Diagnostic and prognostic validity of different biomarkers in patients with suspected myocarditis. Clin Res Cardiol. 2014;103(9):743-51. [DOI] [PubMed]
- 86.Jensen J, Ma LP, Fu ML, Svaninger D, Lundberg PA, Hammarsten O. Inflammation increases NT-proBNP and the NT-proBNP/BNP ratio. Clin Res Cardiol. 2010;99(7):445-52. [DOI] [PubMed]
- 87.Mahfoud F, Gärtner B, Kindermann M, Ukena C, Gadomski K, Klingel K, et al. Virus serology in patients with suspected myocarditis: utility or futility. Eur Heart J. 2011;32(7):897-903. [DOI] [PubMed]
- 88.Baughman KL. Diagnosis of myocarditis: death of Dallas criteria. Circulation. 2006;113(4):593-5. [DOI] [PubMed]
- 89.Chow LH, Radio SJ, Sears TD, McManus BM. Insensitivity of right ventricular endomyocardial biopsy in the diagnosis of myocarditis. J Am Coll Cardiol. 1989;14(4):915-20. [DOI] [PubMed]
- 90.Schöpe CT, Cooper LT, Torre-Amione G, Van Linthout, S. Management of Myocarditis-Related Cardiomyopathy in Adults. Circ Res. 2019;124:1568-83. [DOI] [PubMed]
- 91.Oka E, Iwasaki Y-K, Maru Y, Fujimoto Y, Hagiwara K, Hayashi H, et al. Prevalence and Significance of an Early Repolarization Electrocardiographic Pattern and Its Mechanistic Insight Based on Cardiac Magnetic Resonance Imaging in Patients With Acute Myocarditis. Circ Arrhythm Electrophysiol. 2019 Mar;12(3):e006969. [DOI] [PubMed]
- 92.Ogunbayo GO, Elayi S-C, Ha LD, Olorunfemi O, Elbadawi A, Saheed D, et al. Outcomes of Heart Block in Myocarditis: A Review of 31,760 Patients. Heart Lung Circ. 2019 Feb;28(2):272–6. [DOI] [PubMed]
- 93.Wang Z, Wang Y, Lin H, Wang S, Cai X, Gao D. Early characteristics of fulminant myocarditis vs non-fulminant myocarditis: A meta-analysis. Medicine (Baltimore). 2019 Feb;98(8):e14697. [DOI] [PMC free article] [PubMed]
- 94.Ukena C, Mahfoud F, Kindermann I, Kandolf R, Kindermann M, Böhm M. Prognostic electrocardiographic parameters in patients with suspected myocarditis. Eur J Heart Fail. 2011 Apr;13(4):398–405. [DOI] [PubMed]
- 95.Adegbala O, Olagoke O, Akintoye E, Adejumo AC, Oluwole A, Jara C, et al. Predictors, Burden, and the Impact of Arrhythmia on Patients Admitted for Acute Myocarditis. Am J Cardiol. 2019;123(1):139-44. [DOI] [PubMed]
- 96.Steeds RP, Garbi M, Cardim N, Kasprzak JD, Sade E, Nihoyannopoulos P, et al. EACVI appropriateness criteria for the use of transthoracic echocardiography in adults: a report of literature and current practice review. Eur Heart J Cardiovasc Imaging. 2017;18(11):1191-204. [DOI] [PubMed]
- 97.Heymans S, Eriksson U, Lehtonen J, Cooper LT Jr. The Quest for New Approaches in Myocarditis and Inflammatory Cardiomyopathy. J Am Coll Cardiol. 2016 Nov 29;68(21):2348-64. [DOI] [PubMed]
- 98.Felker GM, Boehmer JP, Hruban RH, Hutchins GM, Kasper EK, Baughman KL, Hare JM. Echocardiographic findings in fulminant and acute myocarditis. J Am Coll Cardiol. 2000;36(1):227-32. [DOI] [PubMed]
- 99.Pinamonti B, Alberti E, Cigalotto A, Dreas L, Salvi A, Silvestri F, Camerini F. Echocardiographic findings in myocarditis. Am J Cardiol. 1988;62(4):285-91. [DOI] [PubMed]
- 100.Mendes LA, Dec GW, Picard MH, Palacios IF, Newell J, Davidoff R. Right ventricular dysfunction: an independent predictor of adverse outcome in patients with myocarditis. Am Heart J. 1994;128(2):301-7. [DOI] [PubMed]
- 101.Silvestry FE, Kerber RE, Brooke MM, Carroll JD, Eberman KM, Goldstein SA et al. Echocardiography-Guided Interventions. J Am Soc Echocardiogr.2009;22(3):213-31. [DOI] [PubMed]
- 102.Sara L, Szarf G, Tachibana A, Shiozaki AA, Villa AV, de Oliveira AC, et al. II Guidelines on Cardiovascular Magnetic Resonance and Computed Tomography of the Brazilian Society of Cardiology and the Brazilian College of Radiology. Arq Bras Cardiol. 2014;103(6 Suppl 3):1-86. [DOI] [PubMed]
- 103.Abdel-Aty H, Boye P, Zagrosek A, Wassmuth R, Kumar A, Messroghi D, et al. Diagnostic performance of cardiovascular magnetic resonance in patients with suspected acute myocarditis: comparison of different approaches. J Am Coll Cardiol. 2005;45(11):1815-22. [DOI] [PubMed]
- 104.Ferreira VM, Schulz-Menger J, Holmvang G, Kramer IC, Sechtem U, Kindermann I, et al. Cardiovascular Magnetic Resonance in Nonischemic Myocardial Inflammation: Expert Recommendations. J Am Coll Cardiol. 2018;72(24):3158-76. [DOI] [PubMed]
- 105.Friedrich MG, Sechtem U, Schulz-Menger J, Helmmang G, Alakija P, Cooper LT, et al. Cardiovascular magnetic resonance in myocarditis: A JACC White Paper. J Am Coll Cardiol. 2009;53(17):1475-87. [DOI] [PMC free article] [PubMed]
- 106.Friedrich MG, Strohm O, Schulz-Menger J, Marciniak H, Luft FC, Dietz R. Contrast media-enhanced magnetic resonance imaging visualizes myocardial changes in the course of viral myocarditis. Circulation. 1998;97(18):1802-9. [DOI] [PubMed]
- 107.Mahrholdt H, Goedecke C, Wagner A, et al. Cardiovascular magnetic resonance assessment of human myocarditis: a comparison to histology and molecular pathology. Circulation. 2004;109(10):1250-8. [DOI] [PubMed]
- 108.Mahrholdt H, Wagner A, Deluigi CC, Kispert E, Hager S, Meinhardt G, et al. Presentation, patterns of myocardial damage, and clinical course of viral myocarditis. Circulation. 2006;114(15):1581-90. [DOI] [PubMed]
- 109.Chopra H, Arangalage D, Bouleti C, Zarka S, Fayard F, Chilton S, et al. Prognostic value of the infarct- and non- infarct like patterns and cardiovascular magnetic resonance parameters on long- term outcome of patients after acute myocarditis. Int J Cardiol. 2016;212:63-9. [DOI] [PubMed]
- 110.De Cobelli F, Pieroni M, Esposito A, Chimenti C, Belloni E, Mellone R, et al. Delayed gadolinium-enhanced cardiac magnetic resonance in patients with chronic myocarditis presenting with heart failure or recurrent arrhythmias. J Am Coll Cardiol. 2006;47(8):1649-54. [DOI] [PubMed]
- 111.Messroghli DR, Moon JC, Ferreira VM, Grosse-Wortmann L, He T, Kellman P, et al. Clinical recommendations for cardiovascular magnetic resonance mapping of T1, T2, T2* and extracellular volume: A consensus statement by the Society for Cardiovascular Magnetic Resonance (SCMR) endorsed by the European Association for Cardiovascular Imaging (EACVI). J Cardiovasc Magn Reson. 2017;19(1):75. [DOI] [PMC free article] [PubMed]
- 112.Lagan J, Schmitt M, Miller CA. Clinical applications of multi-parametric CMR in myocarditis and systemic inflammatory diseases. Int J Cardiovasc Imaging. 2018;34(1):35-54. [DOI] [PMC free article] [PubMed]
- 113.Kotanidis CP, Bazmpani MA, Haidich AB, Karvounis C, Antoniades C, Karamitsos TD. Diagnostic Accuracy of Cardiovascular Magnetic Resonance in Acute Myocarditis: A Systematic Review and Meta-Analysis. JACC Cardiovasc Imaging. 2018;11(11):1583-90. [DOI] [PubMed]
- 114.Luetkens JA, Faron A, Isaak A, et al. Comparison of Original and 2018 Lake Louise Criteria for Diagnosis of Acute Myocarditis: Results of a Validation Cohort. Radiol Cardiothorac Imaging. 2019;1(3):e190010. [DOI] [PMC free article] [PubMed]
- 115.Aquaro GD, Ghebru Habtemicael Y, Camastra G, Monti L, Dellegrattaglie S, Moro C, et al. Prognostic Value of Repeating Cardiac Magnetic Resonance in Patients With Acute Myocarditis. J Am Coll Cardiol. 2019;74(20):2439-48. [DOI] [PubMed]
- 116.Blissett S, Chocron Y, Kovacina B, Afilalo J. Diagnostic and prognostic value of cardiac magnetic resonance in acute myocarditis: a systematic review and meta-analysis. Int J Cardiovasc Imaging. 2019;35(12):2221-9. [DOI] [PubMed]
- 117.Mewton N, Dernis A, Bresson D, Zouaghi O, Croisille P, Floard E, et al. Myocardial biomarkers and delayed enhanced cardiac magnetic resonance relationship in clinically suspected myocarditis and insight on clinical outcome. J Cardiovasc Med (Hagerstown). 2015;16(10): 696-703. [DOI] [PubMed]
- 118.O’Connell JB, Henkin RE, Robinson JA, Subramanian R, Scanlon PJ, Gunnar RM. Gallium-67 imaging in patients with dilated cardiomyopathy and biopsy- proven myocarditis. Circulation. 1984;70(1):58–62. [DOI] [PubMed]
- 119.Birnie DH, Sauer WH, Bogun F, Cooper JM, Culver DA, Duvernoy CS, et al. HRS expert consensus statement on the diagnosis and management of arrhythmias associated with cardiac sarcoidosis. Heart Rhythm . 2014;11(7):1304–23. [DOI] [PubMed]
- 120.Hung MY, Hung MJ, Cheng CW Use of Gallium 67 Scintigraphy. Texas Heart Inst J 2007;34(3):305–9. [PMC free article] [PubMed]
- 121.Kotani K, Kawabe J, Higashiyama S, Yoshida A, Shiomi S. Diffuse Gallium-67 Accumulation in the Left Atrial Wall Detected Using SPECT/CT Fusion Images. Case Rep Radiol. 2016;2016:6374584. [DOI] [PMC free article] [PubMed]
- 122.Kim SJ, Pak K, Kim K. Diagnostic performance of F-18 FDG PET for detection of cardiac sarcoidosis; A systematic review and meta-analysis. J Nucl Cardiol.2020;27(6):2103-15. doi.org/10.1007/s12350-018-01582-y [DOI] [PubMed]
- 123.Felix RCM, Gouvea CM, Reis CCW, dos Santos Miranda JS, Schtruk LBCE, Colafranceschi AS, et al. 18F-fluorodeoxyglucose use after cardiac transplant: A comparative study of suppression of physiological myocardial uptake. J Nucl Cardiol. 2018;27(1):173-81. [DOI] [PubMed]
- 124.Chareonthaitawee P, Beanlands RS, Chen W, Dorbala S, Miller EJ, Murthy VL, et al. Joint SNMMI-ASNC expert consensus document on the role of18F-FDG PET/CT in carDiac sarcoid detection and therapy monitoring writing group. J Nucl Med. 2017;58(8):1341–53. [DOI] [PMC free article] [PubMed]
- 125.Young L, Sperry BW, Hachamovitch R. Update on Treatment in Cardiac Sarcoidosis. Curr Treat Options Cardiovasc Med. 2017;19(6):47. [DOI] [PubMed]
- 126.Chen W, Jeudy J. Assessment of Myocarditis: Cardiac MR, PET/CT, or PET/MR? Curr Cardiol Rep. 2019;21(8):76. [DOI] [PubMed]
- 127.Hanneman K, Kadoch M, Guo HH, Jamali M, Quon A, Iaguru A, et al. Initial experience with simultaneous18F-FDG PET/MRI in the evaluation of cardiac sarcoidosis and myocarditis. Clin Nucl Med. 2017;42(7):e328–34. [DOI] [PubMed]
- 128.Perel-Winkler A, Bokhari S, Perez-Recio T, Zartoshti A, Askanase A, Geraldino-Pardilla L. Myocarditis in systemic lupus erythematosus diagnosed by 18 F-fluorodeoxyglucose positron emission tomography. Lupus Sci Med. 2018;5(1):1–8. [DOI] [PMC free article] [PubMed]
- 129.Arai H, Kuroda S, Yoshioka K, Mizukami A, Matsumura A. Images of atrial giant cell myocarditis. Eur Heart J Cardiovasc Imaging. 2018;19(2):243. [DOI] [PubMed]
- 130.Besenyi Z, Ágoston G, Hemelein R, Bakos A, Nagy FT, Varga A, et al. Detection of myocardial inflammation by18F-FDG-PET/CT in patients with systemic sclerosis without cardiac symptoms: a pilot study. Clin Exp Rheumatol. 2019;37(4):88–96. [PubMed]
- 131.Sathekge M, Stoltz A, Gheysens O. Rheumatic fever: a forgotten but still existing cause of fever of unknown origin detected on FDG PET/CT. Clin Nucl Med 2015;40(3):250–2. [DOI] [PubMed]
- 132.Muser D, Castro SA, Alavi A, Santangeli P. Potential Role of PET in Assessing Ventricular Arrhythmias. PET Clin. 2019;14(2):281–91. [DOI] [PubMed]
- 133.Danwade TA, Devidutta S, Shelke AB, Saggu DK, Yalagudri S, Sridevic C, et al. Prognostic value of fluorine-18 fluoro-2-deoxyglucose positron emission computed tomography in patients with unexplained atrioventricular block. Heart Rhythm. 2018;15(2):234–9. [DOI] [PubMed]
- 134.Tung R, Bauer B, Schelbert H, Lynch J, Auerbach M . Incidence of abnormal positron emission tomography in patients with unexplained cardiomyopathy and ventricular arrhythmias:the potencial role of occult inflammation in arrythmogenesis. . Heart Thythm. 2015;12(12):2488–98. [DOI] [PMC free article] [PubMed]
- 135.Miranda CH, Figueiredo AB, Maciel BC, Marin-Neto A, Simões MV. Sustained ventricular tachycardia is associated with regional myocardial sympathetic denervation assessed with 123I-metaiodobenzylguanidine in chronic chagas cardiomyopathy. J Nucl Med. 2011;52(4):504–10. [DOI] [PubMed]
- 136.Buggey J, El Amm CA. Myocarditis and cardiomyopathy. Curr Opin Cardiol. 2018;33(3):341–6. [DOI] [PubMed]
- 137.Caforio AL, Malipiero G, Marcolongo R, Iliceto S. Myocarditis: A Clinical Overview. Curr Cardiol Rep. 2017 Jul;19(7):63. [DOI] [PubMed]
- 138.Pasupathy S, Air T, Dreyer RP, Tavella R, Beltrame JF. Systematic review of patients presenting with suspected myocardial infarction and nonobstructive coronary arteries. Circulation. 2015 Mar 10;131(10):861–70. [DOI] [PubMed]
- 139.Manolis AS, Manolis AA, Manolis TA, Melita H. Acute coronary syndromes in patients with angiographically normal or near normal (non-obstructive) coronary arteries. Trends Cardiovasc Med. 2018;28(8):541–51. [DOI] [PubMed]
- 140.Baeßler B, Schmidt M, Lücke C, Blazek S, Ou P, Maintz D, et al. Modern Imaging of Myocarditis: Possibilities and Challenges. Rofo. 2016;188(10):915–25. [DOI] [PubMed]
- 141.Bouleti C, Baudry G, Iung B, Arangalage D, Abtan J, Ducrocq G, et al. Usefulness of Late Iodine Enhancement on Spectral CT in Acute Myocarditis. JACC Cardiovasc Imaging. 2017;10(7):826–7. [DOI] [PubMed]
- 142.Smulders MW, Kietselaer BLJH, Schalla S, Bucerius J, Jaarsma C, van Dieijen-Visser MP, et al. Acute chest pain in the high-sensitivity cardiac troponin era: A changing role for noninvasive imaging? Am Heart J. 2016;177:102–11. [DOI] [PubMed]
- 143.Singhal M, Gupta P, Singh S, Khandelwal N. Computed tomography coronary angiography is the way forward for evaluation of children with Kawasaki disease. Glob Cardiol Sci Pract. 2017(3):e201728. [DOI] [PMC free article] [PubMed]
- 144.Aretz, H T, Billingham ME, Edwards WD, Factor SM, Fallon JT,Fenoglio JJ Jr, et al. Myocarditis. A histopathologic definition and classification. Am J Cardiovasc Pathol.1987;1(1):3-14. [PubMed]
- 145.Pollack A, Kontorovich AR, Fuster V, Dec GW. Viral myocarditis--diagnosis, treatment options, and current controversies. Nat Rev Cardiol. 2015 Nov;12(11):670-80. [DOI] [PubMed]
- 146.Richardson P, McKenna W, Bristow M, Maisch B, Mautner B, O’Connell J, et al. Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of cardiomyopathies. Circulation. 1996;93(5):841-2. [DOI] [PubMed]
- 147.Dennert R, Crijns H J, Heymans S. Acute viral myocarditis. Eur. Heart J.2008;29(17):2073-82. [DOI] [PMC free article] [PubMed]
- 148.Schenk T, Enders M, Pollak S, Hahn R, Hugly D. High prevalence of human parvovirus B19 DNA in myocardial autopsy samples from subjects without myocarditis or dilative cardiomyopathy. J Clin Microbiol. 2009;47(1):106-10. [DOI] [PMC free article] [PubMed]
- 149.Kuehl U, Lassner D, Gast M, Stroux A, Rohde M, Siegismund C, et al. Differential cardiac microRNA expression predicts the clinical course in human enterovirus cardiomyopathy. Circ Heart Fail. 2015; 8(3):605–18. [DOI] [PubMed]
- 150.Van Linthout S, Tschöpe C. Viral myocarditis: a prime example for endomyocardial biopsy-guided diagnosis and therapy. Curr Opin Cardiol. 2018 May;33(3):325-33. [DOI] [PMC free article] [PubMed]
- 151.Cooper LT, Baughman KL, Feldman AM, Frustaci A, Jessup M, Kuhl U, et al. The role of endomyocardial biopsy in the management of cardiovascular disease: a scientific statement from the American Heart Association. Eur Heart J. 2007;28(24):3076-93. [DOI] [PubMed]
- 152.Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE Jr, Drazner MH, et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013;128(16): e240-e327. [DOI] [PubMed]
- 153.Sinagra G, Anzini M, Pereira NL, Bussani R, Finocchiaro G, Bartunek J, et al. Myocarditis in Clinical Practice. Mayo Clin Proc. 2016 Sep;91(9):1256-66. [DOI] [PubMed]
- 154.Chimenti C, Frustaci A. Contribution and risks of left ventricular endomyocardial biopsy in patients with cardiomyopathies: a retrospective study over a 28-year period. Circulation. 2013; 128(14):1531-41. [DOI] [PubMed]
- 155.Yilmaz A, Kindermann I, Kinderman C, Athanasiadis A, Mahfoud F, Ukena C, et al. Comparative evaluation of left and right ventricular endomyocardial biopsy: differences in complication rate and diagnostic performance. Circulation. 2010;122(9):900-9. [DOI] [PubMed]
- 156.Casella M, Dello Russo A, Vettor G, Lumia G, Catto V, Sommariva E, et al. Electroanatomical mapping systems and intracardiac echo integration for guided endomyocardial biopsy. Expert Rev Med Devices. 2017 Aug;14(8):609-19. [DOI] [PubMed]
- 157.Richardson PJ. Endomyocardial biopsy technique.In:Bolte HD.Myocardial biopsy: diagnostic significance. Berlin: Springer Verlag; 1982.
- 158.Aretz HT. Myocarditis: the Dallas criteria. Hum Pathol. 1987;18(6)::619-24. [DOI] [PubMed]
- 159.Cooper LT Jr, ElAmm C. Giant cell myocarditis. Diagnosis and treatment. Herz. 2012;37(6):632-6. [DOI] [PubMed]
- 160.Lassner D, Kuhl U, Siegismund CS, Rohde M, Elezkurtaj S, Escher F, et al. Improved diagnosis of idiopathic giant cell myocarditis and cardiac sarcoidosis by myocardial gene expression profiling. Eur Heart J. 2014;35(32):2186-95. [DOI] [PubMed]
- 161.Wojnicz R, Nowalany-Kozielska E, Wojciechowska C, Glanowska G, Niklewski T, Zambala M, et al. Randomized, placebo-controlled study for immunosuppressive treatment of inflammatory dilated cardiomyopathy: two-year follow-up results. Circulation. 2001;104(1):39-45. [DOI] [PubMed]
- 162.Frustaci A, Russo MA, Chimenti C. Randomized study on the efficacy of immunosuppressive therapy in patients with virus-negative inflammatory cardiomyopathy: the TIMIC study. Eur Heart J. 2009;30(16):1995-2002. [DOI] [PubMed]
- 163.Maisch B, Kölsch S, Hufnagel G. Resolution of Inflammation determines short- and longterm prognosis in myocarditis in ESETCID.Circulation. 2018;124(21Suppl):A15036.
- 164.Drucker NA, Colan SD, Lewis AB, Beiser AS, Wessel DL, Takahashi M, et al. Gammaglobulin treatment of acute myocarditis in the pediatric population. Circulation. 1994;89(1):252–7. [DOI] [PubMed]
- 165.McNamara DM, Rosenblum WD, Janosko KM, Trost MK, Villaneuva FS, Demetris AJ, et al. Intravenous immune gobulin in the therapy of myocarditis and acute cardiomyopathy. Circulation .1997;95(11):2476–8. [DOI] [PubMed]
- 166.McNamara DM, Holubkov R, Starling RC, Dec W, Loh E, Amione T, et al. Intervention in Myocarditis and Acute Cardiomyopathy(IMAC) Investigators. Controlled trial of intravenous immune globulin in recent-onset dilated cardiomyopathy. Circulation. 2001;103(18):2254- 9. [DOI] [PubMed]
- 167.Dennert R, Velthuis S, Schalla S, Rurlings L, van Swylen RJ, van Paasen P, et al. Intravenous immunoglobulin therapy for patients with idiopathic cardiomyopathy and endomyocardial biopsy- proven high PVB19 viral load. Antivir Ther. 2010;15(2):193-201. [DOI] [PubMed]
- 168.Klugman D, BergerJT, Sable CA, He J, Khandelwal SG, Slonim AD, et al. Pediatric patients hospitalized with myocarditis: a multiinstitutional analysis. Pediatr Cardiol. 2009;31(2):222-8. [DOI] [PubMed]
- 169.Maisch B, Haake H, Schlotmann N, Pankuweit S. Intermediate dose of pentaglobin eradicates effectively inflammation in parvo B19 and adenovirus positive myocarditis. [Abstract 1616] Circulation. 2007;116:II_338.
- 170.Maisch B, Pankuweit S, Funck R, Koelsch S. Effective CMVhyperimmunoglobulin treatment in CMVmyocarditis—a controled treatment trial. Eur Heart J Suppl. 2004;114:P674.
- 171.Schultheiss H-P, Piper C, Sowade O, Waagstein F, Kapp JF, Wegscheider K, et al. Betaferon in chronic viral cardiomyopathy(BICC) trial: Effect of interferon-ß treatment in patients with chronic viral cardiomyopathy. Clin Res Cardiol. 2016;105(9):763–73. [DOI] [PubMed]
- 172.Merken J, Hazebroek M, Van Paasen P, Verdonschot J, van Empel V, Knackstedt C, et al. Immunosuppressive Therapy Improves Both Short- and Long-Term Prognosis in Patients With Virus- Negative Nonfulminant Inflammatory Cardiomyopathy. Circ Heart Fail. 2018; 11(2): e004228. [DOI] [PubMed]
- 173.Bargout R, Kelly RF (2004) Sarcoid heart disease.Clinical course and treatment. Int J Cardiol.2004;97(2):173-82. [DOI] [PubMed]
- 174.Tai PC, Ackerman SJ, Spry CJ, Dunnette S, Olsen EG, Gleich GI. Deposits of eosinophil granule proteins in cardiac tissues of patients with eosinophilic endomyocardial disease. Lancet .1987(8534):643–7. [DOI] [PubMed]
- 175.Maisch B, Baandrup U, Moll R, Pankuweit S. Eosinophilic carditis is rare but not to be overlooked. [Abstract]. Eur Heart J.2009;30(Suppl 1).
- 176.Parrillo JE, Cunnion RE, Epstein SE, Parker MM, Suffredini AF, Brenner M, et al. Aprospective, randomized, controlled trial of prednisone for dilated cardiomyopathy. N Engl J Med. 1989;321(16):1061-8. [DOI] [PubMed]
- 177.Latham RD, Mulrow JP, Virmani R, Robinowitz M, Moody JM. Recently diagnosed idiopathic dilated cardiomyopathy: incidence of myocarditis and efficacy of prednisone therapy. Am Heart J. 1989;117(4):876-82. [DOI] [PubMed]
- 178.Mason JW, O’Connell JB, Herskowitz A, Rose NR, McManus BM, Billingham ME, et al. A clinical trial of immunosuppressive therapy for myocarditis. The Myocarditis Treatment Trial Investigators. N Engl J Med. 1995;333(5):269-75. [DOI] [PubMed]
- 179.Wojnicz R, Wilczek K, Nowalany-Kozielska E, Szygula-Jurkiewicz B, Nowak J, Polonski L, et al. Usefulness of atorvastatin in patients with heart failure due to inflammatory dilated cardiomyopathy and elevated cholesterollevels. Am J Cardiol. 2006;97(6):899-904. [DOI] [PubMed]
- 180.Donoso-Mantke O, Meyer R, Prosch S, Nitsche A, Leitmeyer K, Kallies R, et al. High prevalence of cardiotropic viroses in myocardial tissue from explanted hearts of heart transplant recipients and heart donor: a 3-year retrospective study from a German patients’ pool. J Heart Lung Transplant. 2005;24(10): 1632-8. [DOI] [PubMed]
- 181.Kuethe F, Lindner J, Matschke K, Wenzel JJ, Norja P, Ploetze K, et al. Prevalence of parvovirus B19 and human bocavirus DNA in the heart of patients with no evidence of dilated cardiomyopathy or myocarditis. Clin Infec Dis. 2009;49(11):1660-6. [DOI] [PubMed]
- 182.Kuhl U, Lassner D, Dorner A, Rhode M, Escher F, Seeberg B, et al. A distinct subgroup of cardiomyopathy patients characterized by transcriptionally active cardiotropic erythrovirus and altered cardiac gene expression. Basic Res Cardiol. 2013;108(5):372-82. [DOI] [PubMed]
- 183.Yazaki Y, Isobe M, Hiroe M, Morimoto S, Hiramitsu S, Nakano T, et al. Prognostic determinants of long-term survival in Japanese patients with cardiac sarcoidosis treated with prednisone. Am J Cardiol. 2001;88(9):1006–10. [DOI] [PubMed]
- 184.Hamzeh N, Steckman DA, Sauer WH, Judson MA. Pathophysiology and clinical management of cardiac sarcoidosis. Nat Rev Cardiol. 2015;12(5):278–88. [DOI] [PubMed]
- 185.Tincani A, Rebaioli CB, Taglietti M, Shoenfeld Y. Heart involvement in systemic lupus erythematosus, anti-phospholipid syndrome and neonatal lupus. Rheumatology. 2006;45(Suppl 4):iv 8-13. [DOI] [PubMed]
- 186.Pieroni M, De Santis M, Zizzo G. Recognizing and treating myocarditis in recent-onset systemic sclerosis heart disease: potential utility of immunosuppressive therapy in cardiac damage progression. Semin Arthritis Rheum. 2014;43(4):526-35. [DOI] [PubMed]
- 187.Moosig F, Bremer JP, Hellmich B, Holle JU, Holl-Ulrich K, Laudien M, et al. A vasculitis centre based management strategy leads to improved outcome in eosinophilic granulomatosis and polyangiitis (Churg-Strauss, EGPA): monocentric experiences in 150 patients. Ann Rheum Dis. 2013;72(6):1011–7. [DOI] [PubMed]
- 188.Comarmond C, Cacoub P. Myocarditis in auto-immune or auto-inflammatory diseases. Autoimmun Rev. 2017;16(8):811-6. [DOI] [PubMed]
- 189.Ekström K, Lehtonen J, Kandolin R, Räisänen-Sokolowski A, Salmenkivi K, Kupari M. Long-term outcome and its predictors in giant cell myocarditis. Eur J Heart Fail. 2016;18(12):1452-8. [DOI] [PubMed]
- 190.Suarez-Barrientos A, Wong J, Bell A, Lyster H, Karagiannis G, Banner NR.Usefulness of rabbit anti-thymocyte globulin in patients with giant cell myocarditis.Am J Cardiol. 2015;116(3):447–51. [DOI] [PubMed]
- 191.Menghini VV, Savcenko V, Olson LJ, Tazelaar HD, Dec GW, Kao A, Cooper LT Jr. Combined immunosuppression for the treatment of idiopathic giant cell myocarditis. Mayo Clin Proc. 1999;74(12):1221-6 [DOI] [PubMed]
- 192.Patel AD, Lowes B, Chamsi-Pasha MA, Radio SJ, Hyalen M, Zolty R. Sirolimus for Recurrent Giant Cell Myocarditis After Heart Transplantation: A Unique Therapeutic Strategy. Am J Ther. 2019;26(5):600-3. [DOI] [PubMed]
- 193.Brambatti M, Matassini MV, Adler ED, Klingel K, Camici PG, Ammirati E. Eosinophilic Myocarditis: Characteristics, Treatment, and Outcomes. J Am Coll Cardiol. 2017; 70(19):2363-75. [DOI] [PubMed]
- 194.Kuhl U, Pauschinger M, Seeberg B, Lassner D, Noutsias M, Poller W and Schultheiss HP. Viral persistence in the myocardium is associated with progressive cardiac dysfunction. Circulation. 2005;112(13):1965-70. [DOI] [PubMed]
- 195.Kuhl U, Schultheiss HP. Viral myocarditis. Swiss Med Wkly. 2014;144:w14010. [DOI] [PubMed]
- 196.Jensen LD, Marchant DJ. Emerging pharmacologic targets and treatments for myocarditis. Pharmacol Ther. 2016;161:40-51. [DOI] [PubMed]
- 197.Pauschinger M, Phan MD, Doerner A, Kuehl U, Schwimmbeck PL, Poller W, Kandolf R, et al. Enteroviral RNA replication in the myocardium of patients with left ventricular dysfunction and clinically suspected myocarditis. Circulation. 1999;99(7):889-95. [DOI] [PubMed]
- 198.Kuhl U, Lassner D, von Schlippenbach J, Poller W, Schultheiss HP. Interferon-Beta improves survival in enterovirus-associated cardiomyopathy. J Am Coll Cardiol. 2012;60(14):1295-6. [DOI] [PubMed]
- 199.Kuhl U, Pauschinger M, Schwimmbeck PL, Seeberg B, Lober C, Noutsias M, et al. Interferon-beta treatment eliminates cardiotropic viruses and improves left ventricular function in patients with myocardial persistence of viral genomes and left ventricular dysfunction. Circulation. 2003;107(22):2793-8. [DOI] [PubMed]
- 200.Kuhl U, Lassner D, Wallaschek N, Gross UM, Krueger GR, Seeberg B, et al. Chromosomally integrated human herpesvirus 6 in heart failure: prevalence and treatment. Eur J Heart Fail. 2015;17(1):9- 19. [DOI] [PubMed]
- 201.Schultheiss HP, Fruhwald F, Kuehl U, Bock T, Pietsch H, Aleshcheva G, et al. Nucleoside analogue reverse transcriptase inhibitors improve clinical outcome in transcriptional active erythroparvovirus-positive patients. J Clin Med. 2021;10(9):1928. [DOI] [PMC free article] [PubMed]
- 202.Gullestad L, Aass H, Fjeld JG, Wikebay L, Andreassen AK, Ihlen H, et al. Immunomodulating therapy with intravenous immunoglobulin in patients with chronic heart failure. Circulation. 2001;103(2):220–225 [DOI] [PubMed]
- 203.Aukrust P, Yndestad A, Ueland T, Damas JK, Froland SS, Gullestaal L. The role of intravenous immunoglobulin in the treatment of chronic heart failure. Int J Cardiol. 2006;112(1):40–5. [DOI] [PubMed]
- 204.Kishimoto C, Fujita M, Kinoshita M, Dec CW, Loh E, Torre-Amione G, et al. et al. Immunglobulin therapy for myocarditis an acute dilated cardiomyopathy. Circulation. 1999;100(18):1405-8.
- 205.Bozkurt B, Villaneuva FS, Holubkov R, Tokarczick T, Alvarez Jr RJ, MacGowan GA, et al. Intravenous immune globulin in the therapy of peripartum cardiomyopathy. J Am Coll Cardiol. 1999;34(18):177–80. [DOI] [PubMed]
- 206.Tedeschi A, Airaghi L, Giannini S, Ciceri L, Massari FM. High-dose intravenous immunoglobulin in the treatment of acute myocarditis. A case report and review of the literature. J Intern Med 2002;251:169–173. [DOI] [PubMed]
- 207.Robinson J, Hartling L, Crumley E, et al. A systematic review of intravenous gamma globulin for the therapy of acute myocarditis. BMC Cardiovasc Disord. 2005;5(1):12–8. [DOI] [PMC free article] [PubMed]
- 208.Goland S, Czer LS, Siegel RJ, Tabak S, Jordan S, Luthringer D, et al. Intravenous immunoglobulin treatment for acute fulminant inflammatory cardiomyopathy: series of six patients and review of literature. Can J Cardiol. 2008;24(7):571-4. [DOI] [PMC free article] [PubMed]
- 209.Kishimoto C, Shioji K, Hashimoto T, Nonogi H, Lee JD, Kato S, et al. Therapy with immunoglobulin in patients with acute myocarditis and cardiomyopathy: analysis of leukocyte balance. Heart Vessels. 2014 May;29(3):336-42. doi: 10.1007/s00380-013-0368-4. [DOI] [PubMed]
- 210.Kühl U, Noutsias M, Schultheiss HP. Immunohistochemistry in dilated cardiomyopathy. Eur Heart J. 1995;16(Suppl 0):100 –6. [DOI] [PubMed]
- 211.Caforio AL, Grazzini M, Mann JM, Keeling PJ, Bottazzo GF, McKenna WJ, et al. Identification of a- and b-cardiac myosin heavy chain isoforms as major autoantigens in dilated cardiomyopathy. Circulation. 1992;85(5):1734 –42. [DOI] [PubMed]
- 212.Limas CJ, Goldenberg IF, Limas C. Autoantibodies against b-adrenoceptors in human idiopathic dilated cardiomyopathy. Circ Res.1989;64(1):97–103. [DOI] [PubMed]
- 213.Magnusson Y, Wallukat G, Waagstein F, Hjalmarson A, Hoebeke J. Autoimmunity in idiopathic dilated cardiomyopathy: characterization of antibodies against the b1-adrenoceptor with positive chronotropic effect. Circulation. 1994;89(6):2760–7. [DOI] [PubMed]
- 214.Fu LX, Magnusson Y, Bergh CH, Liljeqvist JA, Waagstein F, Hjalmarson A, et al. Localization of a functional autoimmune epitope on the muscarinic acetylcholine receptor-2 in patients with idiopathic dilated cardiomyopathy. J Clin Invest. 1993;91(5):1964–8. [DOI] [PMC free article] [PubMed]
- 215.Dörffel WV, Felix SB, Wallukat G, et al. Short-term hemodynamic effects of immunoadsorption in dilated cardiomyopathy. Circulation. 1997;95:1994 – 1997. [DOI] [PubMed]
- 216.Felix S, Staudt A, Dörffel WV, et al. Hemodynamic effects of immunoadsorption and subsequent immunoglobulin substitution in dilated cardiomyopathy: three-month results from a randomized study. J Am Coll Cardiol. 2000;35:1590 –1598. [DOI] [PubMed]
- 217.Staudt A, Schaper F, Stangl V, Plagemann A, Bohm M, Merkel K, et al. Immunohistological changes in dilated cardiomyopathy induced by immunoadsorption therapy and subsequent immunoglobulin substitution. Circulation. 2001;103(22):2681–6. [DOI] [PubMed]
- 218.Felix SB, Beug D, Dorr M. Immunoadsorption therapy in dilated cardiomyopathy. Expert Rev. Cardiovasc Ther. 2014;13(2):145–52. [DOI] [PubMed]
- 219.Yoshikawa T, Baba A, Akaishi M, Wakabayashi Y, Monkawa T, Kitakaze M, et al. Randomized Controlled Trial. Immunoadsorption in dilated cardiomyopathy using tryptophan column-A prospective,multicenter, randomized . J Clin Apher.2016;31(6):535-44. [DOI] [PMC free article] [PubMed]
- 220.Marcondes-Braga FG, Moura LAZ, Issa VS, Vieira JL, Rohde LE, Simões MV, et al. Atualização de Tópicos Emergentes da Diretriz de Insuficiência Cardíaca – 2021. Arq Bras Cardiol. 2021;116(6):1174-212. [DOI] [PMC free article] [PubMed]
- 221.Comitê Coordenador da Diretriz de Insuficiência Cardíaca. Diretriz Brasileira de Insuficiência Cardíaca Crônica e Aguda. Arq Bras Cardiol. 2018; 111(3):436-539. [DOI] [PubMed]
- 222.Hein M, Roehl AB, Baumert JH, Scherer K, Steendijk P, Rossaint R. Anti-ischemic effects of inotropic agents in experimental right ventricular infarction. Acta Anaesthesiol Scand. 2009;53(7):941-8. doi:10.1111/j.1399-6576.2009.01994.x [DOI] [PubMed]
- 223.Parissis JT, Filippatos G. Levosimedan in viral myocarditis: not only an inadilator but also a cardioprotector? Eur J Clin Invest. 2009;39(10):839-40. [DOI] [PubMed]
- 224.Parissis JT, Andreadou I, Markantonis SL, Bistola V, Louka A, Pyriochou A et al. Effects of levosimendan on circulating markers of oxidative and nitrosative stress in patients with advanced heart failure. Atherosclerosis 2007;195:e210–5. [DOI] [PubMed]
- 225.Parissis JT, Adamopoulos S, Antoniades C, Kostakis G, Rigas A, Kyrzopoulos S, et al. Effects of levosimendan on circulating pro-inflammatory cytokines and soluble apoptosis mediators in patients with decompensated advanced heart failure. Am J Cardiol. 2004;93(19):1309–12. [DOI] [PubMed]
- 226.Finocchiaro G, Papadakis M, Robertus JL, Dhutia H, Steriotis AK, Tome M, et al. Etiology of sudden death in sports: insights from a United Kingdom Regional Registry. J Am Coll Cardiol. 2016;67(18):2108-15. [DOI] [PubMed]
- 227.Shah N, Phelan DM. Myocarditis in the athlete. Am Coll Cardiol. 2018 Jan 31:1-8.
- 228.Maron BJ, Doerer JJ, Haas TS, Tierney DM, Mueller FO. Sudden deaths in young competitive athletes: analysis of 1866 deaths in the United States, 1980–2006. Circulation. 2009;119(8):1085–92. [DOI] [PubMed]
- 229.Maron BJ, Udelson JE, Bonow RO, Nishimura RA, Ackerman MJ, Estes Nard, et al. Eligibility and disqualification recommendations for competitive athletes with cardiovascular abnormalities: Task Force 3: hypertrophic cardiomyopathy, arrhythmogenic right ventricular cardiomyopathy and other cardiomyopathies, and myocarditis: a scientific statement from the American Heart Association and American College of Cardiology. Circulation. 2015;132(8):e273–80. [DOI] [PubMed]
- 230.Piepoli MF, Conraads V, Corra U, Dickstein K, Francis DP, Jaarsma T, et al., et al. Exercise training in heart failure: from theory to practice: a consensus document of the Heart Failure Association and the European Association for Cardiovascular Prevention and Rehabilitation. Eur J Heart Fail. 2011;13(4):347–57. [DOI] [PubMed]
- 231.Wilson MG, Hull JH, Rogers J, Pollock N, Dodd M, Hainesm J, et al. Cardiorespiratory considerations for return-to-Play in elite athletes after COVID-19 infection: a practical guide for sport and exercise medicine physicians. Br J Sports Med. 2020;54(19):1157–61. [DOI] [PMC free article] [PubMed]
- 232.Mohseni H, Kiran A, Khorshidi R, Rahimi K. Influenza vaccination and risk for hospitalization in patients with heart failure: a self-controlled case series study. Eur Heart J. 2017;38(5):326–3. [DOI] [PMC free article] [PubMed]
- 233.Ciszewski A. Cardioprotective effect of influenza and pneumococcal vaccination in patients with cardiovascular diseases. Vaccine. 2016;36(2)202–6. [DOI] [PubMed]
- 234.Kuntz J, Crane B, Weinmann S, Naleway AL, Vaccine Safety Datalink Investigator Team.Myocarditis and pericarditis are rare following live viral vaccinations in adults. Vaccine. 2018 March 14; 36(12):1524E-1527E. [DOI] [PMC free article] [PubMed]
- 235.Engler RJ, Nelson MR, Collins LC Jr, Spooner C, Hemann BA, Gibbs BT, et al. A prospective study of the incidence of myocarditis/pericarditis and new onset cardiac symptoms following smallpox and influenza vaccination.PLoS One. 2015;10(3):e0118283. [DOI] [PMC free article] [PubMed]
- 236.Ammirati E, Veronese G, Cipriani M, Moroni F, Garascia A, Brambatti M, et al. Acute and Fulminant Myocarditis: a Pragmatic Clinical Approach to Diagnosis and Treatment. Curr Cardiol Rep. 2018;20(11):114. [DOI] [PubMed]
- 237.Veronese G, Ammirati E, Cipriani M, Frigerio M. Fulminant myocarditis: Characteristics, treatment, and outcomes. Anatol J Cardiol. 2018;19(4): 279-86. [DOI] [PMC free article] [PubMed]
- 238.Ammirati E, Cipriani M, Lilliu M, Sermani P, Varrenti M, Raineri C, et al. Survival and Left Ventricular Function Changes in Fulminant Versus Nonfulminant Acute Myocarditis. Circulation. 2017;136(6):529-45. [DOI] [PubMed]
- 239.Ammirati E, Veronese G, Brambatti M, Merlo M, Cipriani M, Potena L, et al . Fulminant Versus Acute Nonfulminant Myocarditis in Patients With Left Ventricular Systolic Dysfunction. J Am Coll Cardiol. 2019;74(3):299-311. [DOI] [PubMed]
- 240.Cooper L, Baughman KL, Feldman AM, Frustaci A, Jessup M, Kuhl U, et al. The role of endomyocardial biopsy in the management of cardiovascular disease: a scientific statement from the American Heart Association, the American College of Cardiology, and the European Society of Cardiology Endorsed by the Heart Failure Society of America and the Heart Failure Association of the European Society of Cardiology. . Circulation. 2007;116(19):2216-33. [DOI] [PubMed]
- 241.Pankuweit S, Maisch B. Etiology, diagnosis, management, and treatment of myocarditis. Position paper from the ESC Working Group on Myocardial and Pericardial Diseases. Herz. 2013;38(8):855-61. [DOI] [PubMed]
- 242.Tanawuttiwat T, Trachtenberg BH, Hershberger RE, Hare JM, Cohen MG. Dual percutaneous mechanical circulatory support as a bridge to recovery in fulminant myocarditis. ASAIO J. 2011;57(5):477-9. [DOI] [PubMed]
- 243.Montero S, Aissaoui N, Tadié JM, Bizouarn P, Scherrer V, Persichini R, et al. Fulminant giant-cell myocarditis on mechanical circulatory support: Management and outcomes of a French multicentre cohort. Int J Cardiol. 2018;253:105-112. [DOI] [PubMed]
- 244.Kusano KF, Satomi K.Diagnosis and treatment of cardiac sarcoidosis. Heart. 2016;102(3):184-90 [DOI] [PubMed]
- 245.Chamorro-Pareja N, Marin-Acevedo JA, Chirila RM. Cardiac Sarcoidosis: Case presentation and Review of the literature. Rom J Intern Med. 2019; 57(1):7-13. [DOI] [PubMed]
- 246.Viles-Gonzalez JF, Pastori L, Fischer A, Wisnivesky JP, Goldman MG, Mehta D. Supraventricular arrhythmias in patients with cardiac sarcoidosis prevalence, predictors, and clinical implications. Chest. 2013 Apr;143(4):1085-90. [DOI] [PubMed]
- 247.Terasaki F, Azuma A, Anzai T, Ishizaka N, Ishida Y, Isobe M, et al.
- 248.JCS 2016 Guideline on Diagnosis and Treatment of Cardiac Sarcoidosis―Digest Version Circulation. 83.11 (2019): 2329-88. [DOI] [PubMed]
- 249.Krasniqi N, Eriksson U. Gene expression profiling: time to file diagnostic uncertainty in inflammatory heart diseases?. Eur Heart J. 2014:35:2138–9. [DOI] [PubMed]
- 250.Kawai H, Sardi M, Kato Y, Naruse M, Watanabe A, Matsuyana T, et al. Diagnosis of isolated cardiac sarcoidosis based on new guidelines. ESC Heart Failure;2020;7(5):2662-71. [DOI] [PMC free article] [PubMed]
- 251.Birnie DH, Nery PB, Ha AC, Beanlands RS. Cardiac sarcoidosis. J Am Coll Cardiol.2016;68(4):411-21. [DOI] [PubMed]
- 252.Slart RHJA, Glaudemans AWJM, Lancellotti P5, Hyafil F, Blankstein R, Schwartz RG, et al. A joint procedural position statement on imaging in cardiac sarcoidosis: from the Cardiovascular and Inflammation & Infection Committees of the European Association of Nuclear Medicine, the European Association of Cardiovascular Imaging, and the American Society of Nuclear Cardiology. J Nucl Cardiol. 2018 Feb;25(1):298-319. [DOI] [PubMed]
- 253.Kopriva P, Griva M, Tüdös T. Management of cardiac sarcoidosis- A practical guide. Cor et Vasa.2018;60:e155-e164.
- 254.James WE, Baughman R. Treatment of sarcoidosis: grading the evidence. Expert Rev Clin Pharmacol. 2018;11(7):677–87 [DOI] [PubMed]
- 255.Sadek MM, Yung D, Birnie DH, Beanlands RS, Nery PB. Corticosteroid therapy for cardiac sarcoidosis: a systematic review. Can J Cardiol. 2013 Sep;29(9):1034-41. [DOI] [PubMed]
- 256.Al-Khatib SM, Stevenson WG, Ackerman MJ, Bryant WJ, Callans DJ, Curtis AB, et al. 2017 AHA/ACC/HRS guideline for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: Executive summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Heart Rhythm. 2018 Oct;15(10):e190-e252. Erratum in: Heart Rhythm. 2018 Sep 26. [DOI] [PubMed]
- 257.Kandolin R, Lehtonen J, Airaksinen J, Vihinen T, Miettinen H, Ylitalo K, et al. Cardiac sarcoidosis: epidemiology,characteristics, and outcome over 25 years in a nationwide study. Circulation. 2015;131(7):624–32. [DOI] [PubMed]
- 258.Yokoyama R, Miyagawa M, Okayama H, et al. Quantitative analysis of myocardial 18F-fluorodeoxyglucose uptake by PET/CT for detection of cardiac sarcoidosis. Int J Cardiol. 15 Sep 2015;195:180-7. [DOI] [PubMed]
- 259.Ning N, Guo HH, Iagaru A, Mittra E, Fowler M, Witteles R.Serial Cardiac FDG-PET for the Diagnosis and Therapeutic Guidance of Patients With Cardiac Sarcoidosis.J Card Fail. 2019 Apr;25(4):307-11. [DOI] [PubMed]
- 260.Nagai S, Yokomatsu T, Tanizawa K, Ikezoe K, Handa T, Ogino S, et al.
- 261.Treatment with methotrexate and low- dose corticosteroidsin sarcoidosis patients with cardiac lesions. Intern Med .2014;53(5):2761. [DOI] [PubMed]
- 262.Müller-Quernheim J, Kienast K, Held M.Treatment of chronic sarcoidosis with an azathioprine/prednisolone regimen. Eur Respir J 1999;14(5):1117–22. [DOI] [PubMed]
- 263.Demeter SL. Myocardial sarcoidosis unresponsive to steroids. Treatment with cyclophosphamide. Chest .1988;94(1):202–3. [DOI] [PubMed]
- 264.Judson MA, Baughman RP, Costabel U, Flavin S, Lo KH, Kavuru MS, et al. for the Centocor T48 Sarcoidosis Investigators.Efficacy of infliximab in extrapulmonary sarcoidosis:results from a randomised trial. Eur Respir J 2008;31(6):1189–96. [DOI] [PubMed]
- 265.Adler BL, Wang CJ, Bui TL, Wang CJ, Schilperoort HM, Hannah M, et al. Anti-tumor necrosis factor agents in sarcoidosis: A systematic review of efficacy and safety. Sem Arth Rheumat. 2019;48(6):1093-104. doi: 10.1016/j.semarthrit.2018.10.005. [DOI] [PubMed]
- 266.Greulich S, Deluigi CC, Gloekler S, Wahl A, Zurn C, Kramer U, et al. CMR imaging predicts death and other adverse events in suspected cardiac sarcoidosis. JACC Cardiovasc Imaging. 2013;6(4):501–11. [DOI] [PubMed]
- 267.Hulten E, Agarwal V, Cahill M, Cole G, Vita T, Parrish S, et al. Presence of late gadolinium enhancement by cardiac resonance among patients with suspected cardiac sarcoidosis is associated with adverse cardiovascular prognosis: a systematic review and meta- Circ Cardiovasc Img. 2016;9(9):e005001. [DOI] [PMC free article] [PubMed]
- 268.Blankstein R, Osborne M, Naya M, Waller A, Kim CK, Murthy VL, et al
- 269.Cardiac positron emission tomography enhances prognostic assessments of patients with suspected cardiac sarcoidosis.J Am Coll Cardiol. 2014;63(4):329–36. [DOI] [PMC free article] [PubMed]
- 270.Takaya Y, Kusano KF, Nakamura K, Ito H. Comparison of outcomes in patients with probable versus definite cardiac sarcoidosis. Am J Cardiol. 1 May 2015;115:1293–7. [DOI] [PubMed]
- 271.Ahmadian A, Pawar S, Govender P, Berman J, Ruberg FL, Miller EJ. The response of FDG uptake to immunosuppressive treatment on FDG PET/CT imaging for cardiac sarcoidosis. J Nucl Cardiol. 2017;24:413-24. [DOI] [PubMed]
- 272.Katsanos S, Debonnaire P, Kamperidis V, Bax JJ, Taube C, Delgado V, et al. Subclinical left ventricular dysfunction by echocardiographic speckle- tracking strain analysis relates to outcome in sarcoidosis. Joyce E, Ninaber MK, Eur J Heart Fail. 2015 Jan;17(1):51-62. [DOI] [PubMed]
- 273.Kiko T, Yoshihisa A, Kanno Y, Yokokawa T, Abe S, Miyata-Tatsumi M, et al. A Multiple Biomarker Approach in Patients with Cardiac Sarcoidosis.Int Heart J. 2018 Sep 26;59(5):996-1001. [DOI] [PubMed]
- 274.Kandolin R, Lehtonen J, Airaksinen J, Vihinen T, Miettinen H, Kaikkonen K, et al. Usefulness of Cardiac Troponins as Markers of Early Treatment Response in Cardiac Sarcoidosis.Am J Cardiol. 2015 Sep 15;116(6):960- 4 [DOI] [PubMed]
- 275.Xu J, Brooks EG. Giant Cell Myocarditis: A Brief Review. Arch Pathol Lab Med 2016 ;140(12):1429-34. [DOI] [PubMed]
- 276.Kasouridis I, Majo J, MacGowan G, Clark AL. Giant cell myocarditis presenting with acute heart failure. BMJ Case Rep. 2017 May 22;2017:bcr2017219574. [DOI] [PMC free article] [PubMed]
- 277.Chiu MH, Trpkov C, Rezazedeh S, Chew DS.Monomorphic Ventricular Tachycardia as a Presentation of Giant Cell Myocarditis. Case Rep Cardiol. 2019 Jun 19;2019:7276516. [DOI] [PMC free article] [PubMed]
- 278.Maleszewski JJ, Orellana VM, Hodge DO, Kuhl U, Schultheiss HP, Cooper LT. Long-term risk of recurrence, morbidity and mortality in giant cell myocarditis. Am J Cardiol. 2015;115(12):1733-8. [DOI] [PubMed]
- 279.Kandolin R, Lehtonen J, Salmenkivi K, Räisänen-Sokolowski A, Lommi J, Kupari M. Diagnosis, treatment, and outcome of giant-cell myocarditis in the era of combined immunosuppression. Circ Heart Fail. 2013;6(1):15-22. [DOI] [PubMed]
- 280.Vaideeswar P, Cooper LT. Giant cell myocarditis: clinical and pathological features in an Indian population. Cardiovasc Pathol. 2013;22(1):70-4. [DOI] [PubMed]
- 281.Ekström K, Lehtonen J, Kandolin R, Räisänen-Sokolowski A, Salmenkivi K, Kupari M. Incidence, Risk Factors, and Outcome of Life-Threatening Ventricular Arrhythmias in Giant Cell Myocarditis.Circ Arrhythm Electrophysiol. 2016;9(12): e004559. [DOI] [PubMed]
- 282.Dogan G, Hanke J, Puntigam J, Haverich A, Schmitto JD. Hemoadsorption in cardiac shock with bi ventricular failure and giant-cell myocarditis: A case report. Int J Artif Organs. 2018;41(8):474-9. [DOI] [PubMed]
- 283.Cooper LT Jr, Berry GJ, Rizeq M, Schroeder JS. Giant cell myocarditis. J Heart Lung Transplant. 1995;14(2):394-401. [PubMed]
- 284.Cooper LT Jr, Hare JM, Tazelaar HD, Edwards WD, Starling RC, Deng MC, et al. Giant Cell Myocarditis Treatment Trial Investigators. Usefulness of immunosuppression for giant cell myocarditis. Am J Cardiol. 2008 ;102(11):1535-9. [DOI] [PMC free article] [PubMed]
- 285.Scott RL, Ratliff NB, Starling RC, Young JB Recurrence of giant cell myocarditis in cardiac allograft. J Heart Lung Transplant. 2001;20:375-80. [DOI] [PubMed]
- 286.Elamm CA, Al-Kindi SG, Bianco CM, Dhakal BP, Oliveira GH. Heart Transplantation in Giant Cell Myocarditis: Analysis of the United Network for Organ Sharing Registry. J Card Fail. 2017;23(3):566-9. [DOI] [PubMed]
- 287.Leone O, Pieroni M, Rapezzi C, Olivotto I. The spectrum of myocarditis: from pathology to the clinics. Virchows Arch. 2019;475(3):279-301. [DOI] [PubMed]
- 288.Prata A. Clinical and epidemiological aspects of Chagas disease. Lancet Infect Dis. 2001;1(2):92-100. [DOI] [PubMed]
- 289.Pinto AY, Valente SA, Valente VC, Ferreira Junior AC, Coura JR. Fase aguda da doença de Chagas na Amazônia Brasileira. Estudo de 233 casos do Pará, Amapá e Maranhão observados entre 1988 e 2005. Rev Soc Bras Med Trop. 2008;41(6):602-14. [DOI] [PubMed]
- 290.Souza DS, Araújo MT, Santos PR, Furtado JC, Figueiredo MT, Póvoa RM. Aspectos Anátomo-patológicos da Miocardite Chagásica Aguda por Transmissão Oral. Arq Bras Cardiol. 2016;107(1):77-80. [DOI] [PMC free article] [PubMed]
- 291.Ortiz JV, Pereira BV, Couceiro KN, Silva MR, Doria SS, Silva PR, et al. Avaliação Cardíaca na Fase Aguda da Doença de Chagas com Evolução Pós-Tratamento em Pacientes Atendidos no Estado do Amazonas, Brasil. Arq Bras Cardiol. 2019;102(3):240-6.
- 292.Noya BA, Colmenares C, Díaz-Bello C, Ruiz-Guevara R, Medina K, Muñoz- Calderon A, et al. Orally-Transmitted Chagas disease: Epidemiological, clinical, serological and molecular outcomes of a school microepidemic in Chichiriviche de La Costa, Venezuela. Parasite Epidemiol Control. 2016;1(2):188-98. [DOI] [PMC free article] [PubMed]
- 293.Brasil.Minisério da Saúde. Recomendações sobre o diagnóstico parasitológico, sorológico e molecular para confirmação da doença de Chagas aguda e crônica. Brasilia: Departamento de Vigilância Epidemiológica; 2018
- 294.Schijman AG, Vigliano C, Burgos J, Favaloro R, Perrone S, Laguens R, Levin MJ. Early diagnosis of recurrence of Trypanosoma cruzi infection by polymerase chain reaction after heart transplantation of a chronic Chagas’ heart disease patient. J Heart Lung Transplant. 2000;19(11):1114-7. [DOI] [PubMed]
- 295.Qvarnstrom Y, Schijman AG, Veron V, Aznar C, Steurer F, da Silva AJ. Sensitive and specific detection of Trypanosoma cruzi DNA in clinical specimens using a multitarget real-time PCR approach. PLoS Negl Trop Dis. 2012;6(7):e1689. doi: 10.1371/journal.pntd.0001689. [DOI] [PMC free article] [PubMed]
- 296.Maldonado C, Albano S, Vettorazzi L, Salomone O, Zlocowski JC, Abiega C, et al. Using polymerase chain reaction in early diagnosis of re-activated Trypanosoma cruzi infection after heart transplantation. J Heart Lung Transplant. 2004 Dec;23(12):1345-8. [DOI] [PubMed]
- 297.Fiorelli AI, Santos RH, Oliveira JL Jr, Lourenço-Filho DD, Dias RR, Oliveira AS, da Silva MF, Ayoub FL, Bacal F, Souza GE, Bocchi EA, Stolf NA. Heart transplantation in 107 cases of Chagas’ disease. Transplant Proc. 2011;43(1):220-4. [DOI] [PubMed]
- 298.Kransdorf EP, Czer LS, Luthringer DJ, Patel JK, Montgomery SP, Velleca A, et al. Heart transplantation for Chagas cardiomyopathy in the United States. Am J Transplant. 2013;13(12):3262-8. [DOI] [PMC free article] [PubMed]
- 299.Andrade JP, Marin Neto JA, Paola AA, Vilas Boas F, Oliveira GM, Bacal F, Bocchi EA, et al. I Latin American Guideline for the diagnosis and treatment of Chagas’ heart disease: executive summary. Arq Bras Cardiol. 2011;96(2 Suppl 3):434-42. [DOI] [PubMed]
- 300.Dias JC, Ramos Jr AN, Gontijo ED, Luqueti A, Shikanai-Yasuda MA, Coura JR, Torres R, et al. 2nd Brazilian Consensus on Chagas disease, 2015. Rev Bras Med Trop. 2016:49(Suppl 1):1-59. [DOI] [PubMed]
- 301.Nunes MCP, Beaton A, Acquatella H, et al. Chagas cardiomyopathy: an update of current clinical and management. A scientific statement from the American Heart Association. Circulation. 2018;138(12):e169-e209. [DOI] [PubMed]
- 302.Moolani Y, Bukhman G, Hotez PJ. Neglected Tropical Diseases as Hidden Causes of Cardiovascular Disease. PLoS Negl Trop Dis. 6(6);e1499. [DOI] [PMC free article] [PubMed]
- 303.Nayak KC, Meena SL, Gupta BK, Kumar S, Pareek V. Cardiovascular involvement in severe vivax and falciparum malaria. J Vector Borne Dis. 2013;50(4):285–91. [PubMed]
- 304.Alencar-Filho AC, Marcos J, Luis J, Fabbri C, Marcelo W, Machado A, et al. Cardiovascular changes in patients with non-severe Plasmodium vivax malaria. Int J Cardiol. Heart Vasc. 2016;11(16):12–6. [DOI] [PMC free article] [PubMed]
- 305.Póvoa TF, Alves AMB, Oliveira CAB, Nuovo GJ, Chagas VLA, Paes MV. et al. The Pathology of Severe Dengue in Multiple Organs of Human Fatal Cases: Histopathology, Ultrastructure and Virus Replication. 2014; PLoS ONE 9(4): e83386. [DOI] [PMC free article] [PubMed]
- 306.Mirabel M, Vignaux O, Lebon P, Legmann P, Weber S, Meune C. Acute myocarditis due to Chikungunya virus assessed by contrast-enhanced MRI. Int J Cardiol. 2007;121(1):e7-8. [DOI] [PubMed]
- 307.Bonifay T, Prince C, Neyra C, Demar M, Rousset D, Kallel H, et al. Atypical and severe manifestations of chikungunya virus infection in French Guiana: A hospital-based study. PLoS One.2018;13(12):e0207406. [DOI] [PMC free article] [PubMed]
- 308.Aletti M, Lecoules S, Kanczuga V, Soler C, Maquart M, Simon F, et al. Transient Myocarditis Associated With Acute Zika Virus Infection. Clinical Infectious Diseases. 2016;64(5):678-9. [DOI] [PubMed]
- 309.Minhas AM, Nayab A, Iyer S, Narmeen M, Fatima K, Khan MS, et al. Association of Zika Virus with Myocarditis, Heart Failure, and Arrhythmias: A Literature Review. Cureus. 2017;9(6):e1399. [DOI] [PMC free article] [PubMed]
- 310.Paixão GMM, Nunes MCP, Beato B, Sable C, Beaton AZ, Oliveira KKB, et al. Cardiac Involvement by Yellow Fever(from the PROVAR+ Study). Am J Cardiol. 2019;123(5):833-8. [DOI] [PubMed]
- 311.Agrawal AS, Garron T, Tao X, Peng BH, Wakamiya M, Chan TS, et al. Generation of a transgenic mouse model of Middle East respiratory syndrome coronavirus infection and disease. J Virol. 2015;89(7):3659-70. [DOI] [PMC free article] [PubMed]
- 312.Schaecher SR, Stabenow J, Oberle C, Schriewer J, Buller RM, Sagartz JE, et al. Na immuno suppressed Syrian Golden hamster model for SARS-CoV infection. Virology. 2008;380(2):312-21. [DOI] [PMC free article] [PubMed]
- 313.Nakagawa K, Narayanan K, Wada M, Makino S. Inhibition of stress granule formation by Middle East respiratory syndrome coronavirus 4a accessory protein facilitates viral translation, leading to efficient virus replication. J Virol 2018;92(20):e00902-e00918. [DOI] [PMC free article] [PubMed]
- 314.Narayanan K, Huang C, Lokugamage K, Kamitami W, Ikegami T, Tsang CT, et al. Severe acute respiratory syndrome coronavirus nsp1 suppresses host gene expression, including that of type I interfer on, in infected cells. J Virol.2008;82(9):4471-9. [DOI] [PMC free article] [PubMed]
- 315.Chantreuil J, Favrais G, Soule N, Vermesse ZM, Chaillon A, Chantepie A, et al. Tachycardie atrial echaotique aucours d’une infection respiratoire _a coronavirus NL63. Arch Pediatr. 2013;20(3):278-81. [DOI] [PMC free article] [PubMed]
- 316.Xiong TY, Redwood S, Prendergas B, Chen M, Coronaviruses and the cardiovascular system: acute and long-term implications. Eur Heart J. 2020. 41(19):1798–800. [DOI] [PMC free article] [PubMed]
- 317.Riski H, Hovi T, Frick MH. Carditis associated with coronavirus infection. Lancet.1980;2(8185);100-1. [DOI] [PMC free article] [PubMed]
- 318.Atri D, Siddidi HK, Lang J, Nauffal V, Morrow DA, Bohula EA. COVID-19 for the Cardiologist: A Current Review of the Virology, Clinical Epidemiology, Cardiac and Other Clinical Manifestations and Potential Therapeutic Strategies. JACC Basic Trans Sci. 2020 Apr 10;5(5):518-36.doi: 10.1016/j.jacbts.2020.04.002. [DOI] [PMC free article] [PubMed]
- 319.Alhogbani T. Acute myocarditis associated with novel Middle East respiratory syndrome coronavirus. Ann Saudi Med.2016;36(1):78–80. [DOI] [PMC free article] [PubMed]
- 320.Booth CM, Matukas LM, Tomlinson GA, Rachlis AR, Rose DB, Dwos HA, et al. Clinical features and short-term outcomes of 144 patients with SARS in the greater Toronto area. JAMA. 2003 Jun 4;289 (21):2801-9. [DOI] [PubMed]
- 321.Siripanthong B, Nazarian S, Muser D, Deo R, Santangeli P, Khanji MY, et al. Recognizing COVID-19-related myocarditis: The possible pathophysiology and proposed guideline for diagnosis and management. Heart Rhythm. 2020;17(9):1463-71. doi: 10.1016/j.hrthm.2020.05.001. [DOI] [PMC free article] [PubMed]
- 322.Qian Z, Travanty EA, Oko L, Edeen K, Berglund A, Wang J, et al. Innate immune response of human alveolar type II cells infected with severe acute respiratory syndrome-coronavirus. Am J Respir Cell Mol Biol. 2013;48(6):742–8. [DOI] [PMC free article] [PubMed]
- 323.Goulter AB, Goddard MJ, Allen JC, Clark KL. ACE2 gene expression is upregulated in the human failing heart. BMC Med. 2004 May 19;2:19. [DOI] [PMC free article] [PubMed]
- 324.Guo J, Wei X, Li Q, Li l, Yang Z, Shi Y, et al. Single-cell RNA analysis on ACE2 expression provides insight into SARS-CoV-2 blood entry and heart injury.J cell Physiol.2020; Jun 8;235(12):9884-94. doi.org/10.1101/2020.03.31.20047621. [DOI] [PMC free article] [PubMed]
- 325.Ding Y, Wang H, Shen H, Liz Z, Geng J, Han H, et al. The clinical pathology of severe acute respiratory syndrome (SARS): a report from China. J Pathol. 2003 Jul;200(3):282-9. [DOI] [PMC free article] [PubMed]
- 326.Varga Z, Flammer AJ, Steiger P, Haberecker M, Andermatt R, Zinkernagel AS, et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020 May; 395(10234):1417-8. doi: 10.1016/S0140-6736(20)30937-5. [DOI] [PMC free article] [PubMed]
- 327.Hamming I, Timens W, Bulthuis ML, Lely AT, Navio GJ, van Goor H. Tissue distribution of ACE2protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol. 2004 Jun;203(2):631-7. [DOI] [PMC free article] [PubMed]
- 328.Pagnoux C, Cohen P, Guillevin L. Vasculitides secondary to infections. Clin Exp Rheumatol. 2006 Mar-Apr;24(2 Suppl 41):S71-81. [PubMed]
- 329.Yao XH, Li TY, He ZC, Ping YF, Liu HW, Yu SC, et al. [A pathological report of three covid-19 cases by minimally invasive autopsies]. Zhonghua Bing Li XueZaZhi. 2020;49(5):411-5. [DOI] [PubMed]
- 330.Driggin E, Madhavan MV, Bikdeli B, Chuich F, Laracy J, Biondi-Zoccai G, et al. et al. Cardiovascular considerations for patients, health careworkers, and health systems during the coronavirus disease2019 (COVID-19) pandemic. J Am Coll Cardiol. 2020;75(18):2352–71. [DOI] [PMC free article] [PubMed]
- 331.Kim D, Quinn J, Pinsky B, Shah NH, Brown I. Rates of co-infection between SARS –CoV2 and other respiratory pathogens. JAMA. 2020;:323(20):2085-6. Doi: 10.1001/jama.2020.6266 [DOI] [PMC free article] [PubMed]
- 332.Myers VD, Gerhard GS, McNamara DM, Tomar D, Madesh M, Kaniper S, et al. Association of variants in BAG3with cardiomyopathy outcomes in African American individuals. JAMA Cardiol. 2018;3(10):929-38. [DOI] [PMC free article] [PubMed]
- 333.Xu Z, Shi L, Wang Y, Zang J, Huang L,. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med. 2020;8(4):420-2. doi: 10.1016/S2213-2600(20)30076-X. [DOI] [PMC free article] [PubMed]
- 334.Inciardi RM, Lupi L, Zaccone G, Italiua L, Raffo M, Tomasoni D, et al. Cardiac involvement in a patient with coronavirus disease 2019 (COVID-19). JAMA Cardiol.5(7:1-6. doi:10.1001/jamacardio.2020.1096 [DOI] [PMC free article] [PubMed]
- 335.Hu H, Ma F, Wei X, Fang Y. Coronavirus fulminant myocarditis saved with glucocorticoid and human immunoglobulin. Eur Heart J. 2020;42(2):46. doi: 10.1093/eurheartj/ehaa190. [DOI] [PMC free article] [PubMed]
- 336.Esfandiarei M, McManus BM. Molecular biology and pathogenesis of viral myocarditis. Annu Rev Pathol. 2008;3:127–55. [DOI] [PubMed]
- 337.Skulstad H, Cosyns B, Popescu BA, Galderisi M, Salvo G Di, Donal E, et al. COVID-19 pandemic and cardiac imaging: EACVI recommendations on precautions, indications, prioritization, and protection for patients and health carepersonnel. Eur Heart J Cardiovasc Imaging. 2020;21(6):592-8. [DOI] [PMC free article] [PubMed]
- 338.Libby P, The Heart in COVID19: Primary Target or Secondary Bystander?JACC: Basic Transl Sci.2020;5(5):537-42. doi: doi.org/10.1016/j.jacbts.2020.04.001. [DOI] [PMC free article] [PubMed]
- 339.Shi S, Qin M, Shen B, Cai Y, Liu T, Yang F, et al. Association of Cardiac Injury With Mortality in Hospitalized Patients With COVID-19 in Wuhan, China. JAMA Cardiol. 2020,5(7):802-10 doi: 10.1001/jamacardio.2020.0950. [DOI] [PMC free article] [PubMed]
- 340.Araujo-Filho JAB, Dantas Júnior RN, Assunção Júnior NA, et al. COVID-19 e Imagem Cardiovascular: Vamos Além da Ecocardiografia? Arq Bras Cardiol: Imagem cardiovasc. 2020; 33(2):COV01.
- 341.Guo T, Fan Y, Chen M, Wu X, Zang L, He T, et al. Cardiovascular Implications of Fatal Outcomes of Patients With Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020;5(7):811-8. doi: 10.1001/jamacardio.2020.1017. [DOI] [PMC free article] [PubMed]
- 342.Januzzi JL. Troponin and BNP use in COVID-19. Cardiology Magazine. March 18 2020. Available from: www.acc.org/latest-in-cardiology/articles/ 2020/03/18 /15/25 /troponin-and-bnp- use-in-covid19.
- 343.Bangalore S, Sharma A, Slotwiner A, Yatskar L, Harari R, Shah B, et al. ST-Segment Elevation in Patients with Covid-19 - A Case Series. N Engl J Med. 2020;382:2478-80. doi: 10.1056/NEJMc2009020. [DOI] [PMC free article] [PubMed]
- 344.Cosyns B, Lochy S, Luchian ML, Gimelli A, Pontone G, Allard SD, et al. The role of cardiovascular imaging for myocardial injury in hospitalized COVID-19 patients. Eur Heart J Cardiovasc Imaging.2020 May 11;21(7):709-14. doi: 10.1093/ehjci/jeaa136. [DOI] [PMC free article] [PubMed]
- 345.Choi AD, Abbara S, Branch KR, Feuchtner GM, Ghoshhajra B, Nieman K, et al. Society of Cardiovascular Computed Tomography guidance for use of cardiac computed tomography amids tthe COVID-19 pandemic. J Cardiovasc Comput Tomogr. 2020;14(2):101-4. [DOI] [PMC free article] [PubMed]
- 346.Costa IBSS, Bittar, CS, Rizk SI, Araújo Filho AE, Santos KAQ, Machado TIV, et al. The heart and COVID-19: what cardiologists need to know. Arq Bras Cardiol. 2020 May 11;114(5):805-16. [DOI] [PMC free article] [PubMed]
- 347.Kalil Filho R, Hajjar LA, Bacal F, Hoff PM, Diz M del P, Galas FRBG, et al. I Diretriz Brasileira de Cardio-Oncologia da Sociedade Brasileira de Cardiologia. Arq Bras Cardiol. 2011; 96(2 supl.1): 1-52. [PubMed]
- 348.Cardinale DM, Barac A, Torbicki A, Khandheria BK, Lenihan D, Minotti G. Cardio-oncologicalmanagement of patients. Semin Oncol. 2019 Dec;46(6):408-13. [DOI] [PubMed]
- 349.Sturgeon KM, Deng L, Bluethmann SM, Zhou S, Trifiletti DM, Jiang C, et al. A population-based study of cardiovascular disease mortality risk in US cancer patients. Eur Heart J. 2019;40(48):3889-97. [DOI] [PMC free article] [PubMed]
- 350.Herrmann J. From trends to transformation: where cardio-oncology is to make a difference. Eur Heart J.2019;40(48):3898-900. [DOI] [PubMed]
- 351.Escudier M, Cautela J, Malissen N, Ancedy Y, Orabona M, Pinto J, et al. Clinical features, management, and outcomes of immune checkpoint inhibitor-related cardiotoxicity. Circulation. 2017;136(21):2085–7. [DOI] [PubMed]
- 352.Moslehi JJ, Salem JE, Sosman JA, Leson DB, Lebrun-Vignes B, Johnson DB, et al. Increased reporting of fatal immune checkpoint inhibitor-associated myocarditis. Lancet. 2018;391(10124):933. [DOI] [PMC free article] [PubMed]
- 353.Volkova M, Russell R. Anthracycline Cardiotoxicity: Prevalence, Pathogenesis and Treatment. Curr Cardiol Rev. 2011 Nov; 7(4): 214–20. [DOI] [PMC free article] [PubMed]
- 354.Henriksen PA. Anthracycline Cardiotoxicity: An Update on Mechanisms, Monitoring and Prevention. Heart .2017;104(12):971-7. [DOI] [PubMed]
- 355.Favreau-Lessard AJ, Sawyer DB, Francis AS. Anthracycline Cardiomyopathy. Circ Heart Fail. 2018;11(7): e005194 [DOI] [PubMed]
- 356.Dhesi S, Chu MP, Blevins G, Paterson I, Larrat L, Oudit GY, et al. Cyclophosphamide-Induced Cardiomyopathy A Case Report, Review, and Recommendations for Management. J Investig Med High Impact Case Rep. 2013; 1(1):1-2. [DOI] [PMC free article] [PubMed]
- 357.Haanen JB, Robert C. Immune Check point Inhibitors. Prog Tumor Res. 2015;42:55-66. [DOI] [PubMed]
- 358.Aoun F1, Kourie HR2, Sideris S2, Roumeguère T3, van Velthoven R1, Gil T2. Checkpoint inhibitors in bladder and renal cancers: results and perspectives. Immunotherapy. 2015;7(12):1259-71. [DOI] [PubMed]
- 359.Zhou YW, Zhu YJ, Wang MN, Xie Y, Chen CY, Zhang T, et al. Immune Checkpoint Inhibitor-Associated Cardiotoxicity: Current Understanding on Its Mechanism, Diagnosis and Management. Front Pharmacol. 2019 Nov 29;10:1350. [DOI] [PMC free article] [PubMed]
- 360.Postow MA, Sidlow R, Hellmann MD. Immune-Related Adverse Events Associated with Immune Checkpoint Blockade. N Engl J Med. 2018; 11;378(2):158- 68. [DOI] [PubMed]
- 361.Bonaca MP, Olenchock BA, Salem JE, Wiviott SD, Ederly S, Cohen A, et al. Myocarditis in the Setting of Cancer Therapeutics: Proposed Case Definitions for Emerging Clinical Syndromes in Cardio-Oncology Circulation. 2019 Jul 2;140(2):80-91. [DOI] [PMC free article] [PubMed]
- 362.Moslehi JJ, Brinkley DM, Meijers WC. Fulminant Myocarditis: Evolving Diagnosis, Evolving Biology, Evolving Prognosis. J Am Coll Cardiol. 2019 Jul 23;74(3):312-4 . [DOI] [PubMed]
- 363.Yeh ETH, Ewer MS, Moslehi J, Dlugosz-Danecka M, Banchs J, Chang HM, Minotti G. Mechanisms and clinical course of cardiovascular toxicity of cancer treatment I. Oncology. Semin Oncol. 2019 Dec;46(6):397-402. doi: 10.1053/j.seminoncol.2019.10.006. [DOI] [PubMed]
- 364.Hu JR, Florido R, Lipson EJ, Naidoo J, Ardehali R, Tocchetti CG, et al. Cardiovascular toxicities associated with immune checkpoint inhibitors. Cardiovasc Res. 2019 Apr 15;115(5):854-68. [DOI] [PMC free article] [PubMed]
- 365.Brahmer JR, Lacchetti C, Schneider BJ, Atkins NB, Brassil KJ, Caterino JM, et al. Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: American Society of Clinical Oncology Clinical Practice Guideline. J Clin. Oncol.2018;36(17):1714-68. doi:10.1200/jco.2017.77.6385. [DOI] [PMC free article] [PubMed]
- 366.Al-Kindi SG,Oliveira GH, Reporting of immune checkpoint inhibitor- associated myocarditis. Lancet.2018;392(10145):382-3. [DOI] [PubMed]
- 367.Awadalla M, Mahmood S, Groar JD, Hassan MZ, Nohria A, Rokicki A, et al. Global Longitudinal Strain and Cardiac Events in Patients With Immune Checkpoint Inhibitor-Related Myocarditis. J Am Coll Cardiol.2020;75 75, 467-478, doi:10.1016/j.jacc.2019.11.049(2020). [DOI] [PMC free article] [PubMed]
- 368.Arangalage, D. et al. Survival After Fulminant Myocarditis Induced by Immune-Checkpoint Inhibitors. Ann Intern Med. 2017;167(9):683-4.doi: 10.7326/l17-0396. [DOI] [PubMed]
- 369.Frigeri M, Meyer P, Banfic C, Giraud R, Hachulla AL, Spoere D, et al. Immune checkpoint inhibitor-associated myocarditis: a new challenge for cardiologists. Can J Cardiol. 2018;34(1):e91-e93. [DOI] [PubMed]
- 370.Zadok OIB, Avraham BB, Nohria A, Orvin K, Nassar M, Iakobishvili Z, et al. Immune-Checkpoint Inhibitor-Induced Fulminant Myocarditis and Cardiogenic Shock. JACC CardioOncol.2019;1(1):141-4. [DOI] [PMC free article] [PubMed]
- 371.Jain V, Mohebtash M, Rodrigo ME, Ruiz G, Atkins MB, Barac A. Autoimmune myocarditis caused by immune checkpoint inhibitors treated with antithymocyte globulin. J Immunother.2018;41(7):332-5. [DOI] [PubMed]
- 372.Tay RY, Blackley E, McLean C, Moore M, Bergin P, Sanjeev G, et al. Successful use of equine anti-thymocyte globulin (ATGAM) for fulminant myocarditis secondary to nivolumab therapy. Br J Cancer.2017;117(7):921-4. [DOI] [PMC free article] [PubMed]
- 373.Salem JE, Allenbach Y, Vozy A, Brecho TN, Johnson DB, Moslehi J, et al. Abatacept for Severe Immune Checkpoint Inhibitor– Associated Myocarditis. N Engl J Med. 2019;380(24):2377-9. doi:10.1056/NEJMc1901677. [DOI] [PubMed]
- 374.Esfahani K, Bulaiga N, Thebault P, Johnson NA, Lapainte R. Alemtuzumab for Immune-Related Myocarditis Due to PD- 1 Therapy. N Engl J Med.2019;380(24):2375-6. doi:10.1056/NEJMc1903064 [DOI] [PubMed]
- 375.Sharma M, Suero-Abreu G A, Kim BA. Case of Acute Heart Failure due to Immune Checkpoint Blocker Nivolumab. Cardiol Res.2019;10(2):120-3. doi:10.14740/cr838 [DOI] [PMC free article] [PubMed]
- 376.Simonaggio A, Michot JN, Voisin AL. Evaluation of Readministration of Immune Checkpoint Inhibitors After Immune-Related Adverse Events in Patients With Cancer. JAMA Oncol.2019;5(9):1310-7. doi:10.1001/jamaoncol.2019.1022 [DOI] [PMC free article] [PubMed]
- 377.Lee D H, Armanious M, Huang J, Jeong D, Druta M, Fradley MG. Case of pembrolizumab-induced myocarditis presenting as torsades de pointes with safe re-challenge. J Oncol Pharm. Pract. 2020;26(6):1544-8. doi:10.1177/1078155220904152. [DOI] [PubMed]
- 378.Reddy N, Moudgil R, Lopez-Maltei J, Karimzad K, Mouhayar EN, Somaiah N, et al. Progressive and Reversible Conduction Disease With Checkpoint Inhibitors. Can J Cardiol.2017;33(10):1013-35. 33, 1335.e1313-1335.e1315, doi:10.1016/j.cjca.2017.05.026(2017). [DOI] [PubMed]
- 379.Almuwaqqat Z, Meisel JL, Barac A, Parashar S. Breast Cancer and Heart Failure. Heart Fail Clin. 2019;15(1):65-75. [DOI] [PubMed]
- 380.Zamorano JL, Lancellotti P, Rodriguez Muñoz D, Aboyans V, Asteggiano R, Galderisi M, et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J. 2016;37(36):2768- 801. [DOI] [PubMed]
- 381.Swain SM, Whaley FS, Gerber MC, Weisberg S, York M, Spicer D, et al. Cardioprotection with dexrazoxane for doxorubicin-containing therapy in advanced breast cancer. J Clin Oncol. 1997;15(4):1318-32. [DOI] [PubMed]
- 382.Swain SM, Whaley FS, Gerber MC, Ewer MS, Bianchine JR, Gams RA. Delayed administration of dexrazoxane provides cardioprotection for patients with advanced breast cancer treated with doxorubicin-containing therapy. J Clin Oncol. 1997;15(4):1333-40. [DOI] [PubMed]
- 383.van Dalen EC, Caron HN, Dickinson HO, Kremer LC. Cardioprotective interventions for cancer patients receiving anthracyclines. Cochrane Database Syst Rev. 2008(2):CD003917. [DOI] [PubMed]
- 384.Asselin BL, Devidas M, Chen L, Franco VI, Pullen J, Borowitz MJ, et al. Cardioprotection and Safety of Dexrazoxane in Patients Treated for Newly Diagnosed T-Cell Acute Lymphoblastic Leukemia or Advanced-Stage Lymphoblastic Non-Hodgkin Lymphoma: A Report of the Children’s Oncology Group Randomized Trial Pediatric Oncology Group 9404. J Clin Oncol. 2016;34(8):854-62. [DOI] [PMC free article] [PubMed]
- 385.Venturini M, Michelotti A, Mastro L, Gallo L, Carnino F, Garrone O, et al. Multicenter randomized controlled clinical trial to evaluate cardioprotection of dexrazoxane versus no cardioprotection in women receiving epirubicin chemotherapy for advanced breast cancer. L Clin Oncol.1996;14(12):3112-20. [DOI] [PubMed]
- 386.Lipshultz SE, Rifai N, Dalton VM, Levy DE, Silverman LB, Lipsitz SR, et al. The effect of dexrazoxane on myocardial injury in doxorubicin-treated children with acute lymphoblastic leukemia. N Engl J Med. 2004;351(2):145-53. [DOI] [PubMed]
- 387.Marty M, Espié M, Llombart A, Monnier A, Rapoport B, Stahalova V. Multicenter randomized phase III study of the cardioprotective effect of dexrazoxane (Cardioxane) in advanced/metastatic breast cancer patients treated with anthracycline-based chemotherapy. Annals of oncology. l J Eur Soc Med Oncol. 2006; 17(4): 614-22. [DOI] [PubMed]
- 388.Tebbi CK, London WB, Friedman D, Villaluna D, De Alarcon PA, Constine LS, et al. Dexrazoxane-associated risk for acute myeloid leukemia/myelodysplastic syndrome and other secondary malignancies in pediatric Hodgkin’s disease. J Clin Oncol. 2007;25(5):493-500. [DOI] [PubMed]
- 389.Barry EV, Vrooman LM, Dahlberg SE, Neuberg DS, Asselin BL, Athale UH, et al. Absence of secondary malignant neoplasms in children with high-risk acute lymphoblastic leukemia treated with dexrazoxane. J Clin Oncol. 2008;26(7):1106- 11. [DOI] [PubMed]
- 390.Kalay N, Basar E, Ozdogru I, Er O, Cetinkaya Y, Dogan A, et al. Protective effects of carvedilol against anthracycline-induced cardiomyopathy. J Am Coll Cardiol. 2006;48(11):2258-62. [DOI] [PubMed]
- 391.Kaya MG, Ozkan M, Gunebakmaz O, Akkaya H, Kaya EG, Akpek M, et al. Protective effects of nebivolol against anthracycline-induced cardiomyopathy: a randomized control study. Int J Cardiol. 2013;167(5):2306-10. [DOI] [PubMed]
- 392.Seicean S, Seicean A, Alan N, Plana JC, Budd GT, Marwick TH. Cardioprotective effect of β-adrenoceptor blockade in patients with breast cancer undergoing chemotherapy: follow-up study of heart failure. Circ Heart Fail. 2013;6(3):420-6. [DOI] [PubMed]
- 393.Gulati G, Heck SL, Ree AH, Hoffmann P, Schulz-Menger J, Fagerland MW, et al. Prevention of cardiac dysfunction during adjuvant breast cancer therapy (PRADA): a 2 × 2 factorial, randomized, placebo-controlled, double-blind clinical trial of candesartan and metoprolol. Eur Heart J. 2016;37(21):1671-80. [DOI] [PMC free article] [PubMed]
- 394.Cardinale D, Colombo A, Sandri M, Lamantia G, Colombo N, Civelli M, et al. Prevention of high-dose chemotherapy-induced cardiotoxicity in high-risk patients by angiotensin-converting enzyme inhibition. Circulation.2006;114(23):2474-81. [DOI] [PubMed]
- 395.Cardinale D, Ciceri F, Latini R, Franzosi MG, Sandri MT, Civelli M, et al. Anthracycline-induced cardiotoxicity: A multicenter randomised trial comparing two strategies for guiding prevention with enalapril: The International CardioOncology Society-one trial. Eur J Cancer. 2018;94:126-37. [DOI] [PubMed]
- 396.Avila MS, Ayub-Ferreira SM, de Barros Wanderley MR, das Dores Cruz F, Goncalves Brandao SM, Rigaud VOC, et al. Carvedilol for Prevention of Chemotherapy-Related Cardiotoxicity: The CECCY Trial. J Am Coll Cardiol. 2018;71(20):2281-90. [DOI] [PubMed]
- 397.Pituskin E, Mackey J, Koshman S, Jassal D, Pitz M, Haykowsky M, et al. Multidisciplinary Approach to Novel Therapies in Cardio-Oncology Research (MANTICORE 101-Breast): a Randomized Trial for the Prevention of Trastuzumab- Associated Cardiotoxicity. J Clin Oncol. 2017;35(8):870-7. [DOI] [PubMed]
- 398.Guglin M, Krischer J, Tamura R, Fink A, Bello-Matricaria L, McCaskill-Stevens W, et al. Randomized Trial of Lisinopril Versus Carvedilol to Prevent Trastuzumab Cardiotoxicity in Patients With Breast Cancer. J Am Coll Cardiol. 2019;73(22):2859-68. [DOI] [PMC free article] [PubMed]
- 399.Lynce F, Barac A, Geng X, Dang C, Yu AF, Smith KL, et al. Prospective evaluation of the cardiac safety of HER2-targeted therapies in patients with HER2- positive breast cancer and compromised heart function: the SAFE-HEaRt study. Breast Cancer Res Treat. 2019;175(3):595-603. [DOI] [PMC free article] [PubMed]
- 400.Durani Y, Egan M, Baffa J, Selbst SM, Nager AL. Pediatric myocarditis: presenting clinical characteristics. Am J Emerg Med. 2009;27(8):942–7. [DOI] [PubMed]
- 401.Freedman SB, Haladyn K, Floh A, et al. Pediatric Myocarditis: Emergency Department Clinical Findings and Diagnostic Evaluation. Pediatrics 2007;120(6):1278-85. [DOI] [PubMed]
- 402.Howard A, Hasan A, Brownlee J, Mehmood N, Ali M, Mehta S, et al. Pediatric Myocarditis Protocol: An Algorithm for Early Identification and Management with Retrospective Analysis for Validation. Pediatr Cardiol. 2020; 41(2):316-26. [DOI] [PubMed]
- 403.Buntubatu S, Prawirohartono E, Arguni E. Myocarditis Prevalence in Paediatric Dengue Infection: A Prospective Study in Tertiary Hospital in Yogyakarta, Indonesia. J Trop Pediatr.2019;65(6):603-8. [DOI] [PubMed]
- 404.Sanna G, Serrau G, Bassareo PP, Neroni P, Fanos V, Marcialis MA. Children’s heart and COVID-19: Up- to-date evidence in the form of a systematic review. Eur J Pediatr.2020;179(7):1079-87. DOI: https://doi.org/10.1007/s00431-020-03699-0 [DOI] [PMC free article] [PubMed]
- 405.Ryan TD, Nagarajan R, Godown J. Cardiovascular Toxicities in Pediatric Cancer Survivors. Cardiol Clin 2019;37:533–544. [DOI] [PubMed]
- 406.Kuhl, U.; Schultheiss, H.P. Myocarditis in children. Heart Fail Clin. 2010, 6, (4):483–96. [DOI] [PubMed]
- 407.Chang Y-J, Hsiao H-J, Hsia S-H, Lin J-J, Hwang M-S, Chung H-T, et al. Analysis of clinical parameters and echocardiography as predictors of fatal pediatric myocarditis. PLoS ONE.2019;14(3):e02114087. [DOI] [PMC free article] [PubMed]
- 408.Foerster SR, Canter CE, Cinar A, Sleeper LA, Webber AS, Pahl E, et al. Ventricular remodeling and survival are more favorable for myocarditis than for idiopathic dilated cardiomyopathy inchildhood: an outcomes study from the Pediatric Cardiomyopathy Registry. Circ Heart Fail. 2010;3(6):689–97. [DOI] [PubMed]
- 409.Farinha IT, Miranda JO Myocarditis in Paediatric Patients: Unveiling the Progression to Dilated Cardiomyopathy and Heart Failure. J. Cardiovasc. Dev Dis. 2016;3(4):31. [DOI] [PMC free article] [PubMed]
- 410.Bejiqi R, Retkoceri R, Maloku A, Mustafa A, Bejiqi H, Bejiqi GR. The Diagnostic and Clinical Approach to Pediatric Myocarditis: A Review of the Current Literature. Maced J Med Sci. 2019 Jan 15; 7(1):163-74. [DOI] [PMC free article] [PubMed]
- 411.Neonatal EC Registry of the Extracorporeal Life Support Organization (ELSO). Ann Arbor(Mi;1995.
- 412.Heidendael JF, Den Boer SL, Wildenbeest J G, Dalinghaus M, Straver B, Pajkrt D. Intravenous immunoglobulins in children with new oset dilated cardiomyopathy. Cardiol Young.2017;28(1):46-54. [DOI] [PubMed]
- 413.Adler Y, Charron P, Imazio M, Badano L, Barón-Esquivias G, Bogaert J, et al. 2015 ESC Guidelines for the diagnosis and management of pericardial diseases: The Task Force for the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology (ESC) Endorsed by: The European Association of Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2015;36(42):2921-64. [DOI] [PMC free article] [PubMed]
- 414.Klein AL, Abbara S, Agler DA, Appleton CP, Asher CR, Hoit B, et al. American Society of Echocardiography clinical recommendations for multimodality cardiovascular imaging of patients with pericardial disease: endorsed by the Society for Cardiovascular Magnetic Resonance and Society of Cardiovascular Computed Tomography. J Am Soc Echocardiogr. 2013; 26(9):965-1012. [DOI] [PubMed]
- 415.Imazio M, Spodick DH, Brucato A, Trinchero R, Adler Y. Controversial issues in the management of pericardial diseases. Circulation. 2010;121(7):916-28. [DOI] [PubMed]
- 416.Imazio M, Cooper LT. Management of myopericarditis. Expert Rev Cardiovasc Ther. 2013;11(2):193-201. [DOI] [PubMed]
- 417.Imazio M, Cecchi E, Demichelis B, Chinaglia A, Ierna S, Demarie D, et al. Myopericarditis versus viral or idiopathic acute pericarditis. Heart. 2008;94(4):498-501. [DOI] [PubMed]
- 418.Imazio M, Trinchero R. Myopericarditis: etiology, management, and prognosis. Int J Cardiol. 2008;127(1):17-26. [DOI] [PubMed]
- 419.Imazio M, Brucato A, Barbieri A, Ferroni F, Maestroni S, Ligabue G, et al. Good prognosis for pericarditis with and without myocardial involvement: results from a multicenter, prospective cohort study. Circulation. 2013;128(1):42-9 [DOI] [PubMed]
- 420.Di Bella G, Imazio M, Bogaert J, Pizzino F, Camastra G, Monti L, et al. Clinical Value and Prognostic Impact of Pericardial Involvement in Acute Myocarditis. Circ Cardiovasc Imaging.2019;12(2):e008504. [DOI] [PubMed]
- 421.Dawson D, Rubens M, Mohiaddin R. Contemporary imaging of the pericardium. JACC Cardiovasc Imaging. 2011 Jun;4(6):680-4. [DOI] [PubMed]
- 422.Taylor AM, Dymarkowski S, Verbeken EK, Bogaert J. Detection of pericardial inflammation with late-enhancement cardiac magnetic resonance imaging: initial results. Eur Radiol. 2006 Mar;16(3):569-74. [DOI] [PubMed]
- 423.Rezkalla S, Khatib G, Khatib R. Coxsackievirus B3 murine myocarditis. Deleterious effects of non-steroidal anti-inflammatory agents. J Lab Clin Med. 1986;107(4):393–5. [PubMed]
- 424.Khatib, R., Reyes, M.P., Smith, F.E. Enhancement of Coxsackievirus B3 replication in Vero cells by indomethacin. J Infect Dis. 1990;162(4):997–8. [DOI] [PubMed]
- 425.Wu S, Yang YM, Zhu J, Wan HB, Wang J, Zhang H, Shao XH. Clinical characteristics and outcomes of patients with myocarditis mimicking ST- segment elevation myocardial infarction: Analysis of a case series. Medicine (Baltimore). 2017 May;96(19):e6863. [DOI] [PMC free article] [PubMed]
- 426.Zhang T, Miao W, Wang S, Wei M, Su G, Li Z. Acute myocarditis mimicking ST-elevation myocardial infarction: A case report and review of the literature. Exp Ther Med. 2015 Aug;10(2):459-64. [DOI] [PMC free article] [PubMed]
- 427.Tandon V, Kumar M, Mosebach CM, Tandon AA. Severe Coronary Artery Disease Disguised as Myocarditis. Cureus. 2019 Feb 28;11(2):e4159. [DOI] [PMC free article] [PubMed]
- 428.Buja LM, Zehr B, Lelenwa L, Ogechukwu E, Zhao B, Dasgupta A, Barth RF. Clinicopathological complexity in the application of the universal definition of myocardial infarction. Cardiovasc Pathol. 2020;44:107153. [DOI] [PubMed]
- 429.de Bliek EC. ST elevation: Differential diagnosis and caveats. A comprehensive review to help distinguish ST elevation myocardial infarction from nonischemic etiologies of ST elevation. Turk J Emerg Med. 2018 Feb 17;18(1):1-10. [DOI] [PMC free article] [PubMed]
- 430.Arnold JR, McCann GP. Cardiovascular magnetic resonance: applications and practical considerations for the general cardiologist. Heart. 2020;106(3):174-81. doi: 10.1136/heartjnl-2019-314856. [DOI] [PubMed]
- 431.Suthahar N, Meijers WC, Silljé HHW, de Boer RA. From Inflammation to Fibrosis-Molecular and Cellular Mechanisms of Myocardial Tissue Remodelling and Perspectives on Differential Treatment Opportunities. Curr Heart Fail Rep. 2017 Aug;14(4):235-50. [DOI] [PMC free article] [PubMed]
- 432.Ordunez P, Martinez R, Soliz P, Giraldo G, Mujica OJ, Nordet P. Rheumatic heart disease burden, trends, and inequalities in the Americas, 1990–2017: a population-based study. Lancet Glob Health. 2019;7(10):e1388-97. [DOI] [PubMed]
- 433.Veasy LG, Tani LY, Hill HR. Persistence of acute rheumatic fever in the intermountain area of the United States. J Pediatr. 1994 Jan;124(1):9-16. [DOI] [PubMed]
- 434.Branco CE, Sampaio RO, Bracco MM, Morhy SS, Vieira ML, Guilherme L, et al. Rheumatic Fever: a neglected and underdiagnosed disease. New perspective on diagnosis and prevention. Arq Bras Cardiol. 2016 Nov;107(5):482-4. [DOI] [PMC free article] [PubMed]
- 435.Kamblock J, Payot L, Lung B, Costes P, Gillet T, Le Goanvic C, et al. Does rheumatic myocarditis really exists? Systematic study with echocardiography and cardiac troponin I blood levels. Eur Heart J. 2003;24(9):855-62 [DOI] [PubMed]
- 436.Ribeiro AL, Duncan LC, Brant PA, Lotufo JG, Mill SM, Barreto SM. Cardiovascular health in Brazil: trends and perspectives, Circulation.2016;133(4):422-33. [DOI] [PubMed]
- 437.Watkins DA, Johnson CO, Colquhoun SM, Karthikejan G, Buchman G, et al. Global, regional, and national burden of rheumatic heart disease, 1990–2015. N Engl J Med. 2017; 377(8):713-22. [DOI] [PubMed]
- 438.Nascimento BR, Beaton AZ, Nunes MC, Diamantino AC, Carmo GA, Oliveira KK, et al. PROVAR (Programa de RastreamentO da VAlvopatia Reumática) investigators. Echocardiographic prevalence of rheumatic heart disease in Brazilian schoolchildren: Data from the PROVAR study. Int J Cardiol. 2016 Sep 15;219:439-45. [DOI] [PubMed]
- 439.Pereira BÁF, Belo AR, Silva NAD. Rheumatic fever: update on the Jones criteria according to the American Heart Association review - 2015. Rev Bras Reumatol.2017;57(4):364-8. [DOI] [PubMed]
- 440.Gewitz MH, Baltimore RS, Tani LY, Sable CA, Shulman ST, Carapetis J, et al. American Heart Association Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease of the Council on Cardiovascular Disease in the Young. Revision of the Jones Criteria for the diagnosis of acute rheumatic fever in the era of Doppler echocardiography: a scientific statement from the American Heart Association. Circulation. 2015 May 19;131(20):1806-18. [DOI] [PubMed]
- 441.Marijon E, Mirabel M, Celermajer DS, Jouven X. Rheumatic heart disease. Lancet. 2012 Mar 10;379(9819):953-64. [DOI] [PubMed]
- 442.Bitar FF, Hayek P, Obeid M, Gharzeddine W, Mikati M, Dbaibo GS. Rheumatic fever in children: a 15-year experience in a developing country. Pediatr Cardiol. 2000 Mar-Apr;21(2):119-22. [DOI] [PubMed]
- 443.Reményi B, Wilson N, Steer A, Ferreira B, Kado J, Kumar K, et al. World Heart Federation criteria for echocardiographic diagnosis of rheumatic heart disease--an evidence-based guideline. Nat Rev Cardiol. 2012 Feb 28;9(5):297-309. [DOI] [PMC free article] [PubMed]
- 444.Fabi M, Calicchia M, Miniaci A, Balducci A, Tronconi E, Bonetti S, et al. Carditis in Acute Rheumatic Fever in a High-Income and Moderate-Risk Country. J Pediatr. 2019 Dec;215:187-91. [DOI] [PubMed]
- 445.Ozdemir O, Oguz D, Atmaca E, Sanli C, Yildirim A, Olgunturk R. Cardiac troponin T in children with acute rheumatic carditis. Pediatr Cardiol. 2011 Jan;32(1):55-8. [DOI] [PubMed]
- 446.Carapetis JR, McDonald M, Wilson NJ. Acute rheumatic fever. Lancet. 2005;366(9480):155-68. [DOI] [PubMed]
- 447.Carapetis JR, Brown A, Walsh W; National Heart Foundation of Australia Cardiac Society of Australia and New Zealand. The diagnosis and management of acute rheumatic fever and rheumatic heart disease in Australia: an evidence-based review. Australia: Heart Foundation; 2006.
- 448.Barbosa PJB, Müller RE, Latado AL, Achutti AC, Ramos AIO, Weksler C, et al. Diretrizes Brasileiras para Diagnóstico, Tratamento e Prevenção da Febre Reumática da Sociedade Brasileira de Cardiologia, da Sociedade Brasileira de Pediatria e da Sociedade Brasileira de Reumatologia. Arq Bras Cardiol.2009;93(3 supl 4):1-18. [PubMed]
- 449.Calegaro JU, de Carvalho AC, Campos ER, Medeiros M, Gomes Ede F. Gálio 67 na febre reumática: experiência preliminar [Gallium-67 in rheumatic fever: preliminary report]. Arq Bras Cardiol. 1991 Jun ;56(6):487-92. [PubMed]
- 450.Soares Jr J - Cintilografia com Gálio-67 na doença reumática: contribuição ao diagnóstico de cardite nas fases aguda e crônica. (Tese) São Paulo: Faculdade de Medicina USP;1992.
- 451.Narula J, Malhotra A, Yasuda T, Talwar KK, Reddy KS, Chopra P, et al. Usefulness of antimyosin antibody imaging for the detection of active rheumatic myocarditis. Am J Cardiol. 1999 Oct 15;84(8):946-50, A7. [DOI] [PubMed]
- 452.Nagesh CM, Saxena A, Patel C, Karunanithi S, Nadig M, Malhotra A. The role of 18F fluorodeoxyglucose positron emission tomography (18F-FDG-PET) in children with rheumatic carditis and chronic rheumatic heart disease. Nucl Med Rev Cent East Eur. 2015;18(1):25-8. [DOI] [PubMed]
- 453.Mavrogeni S, Schwitter J, van Rossum A, Nijveldt R, Aletras A, Kolovou G, et al. Cardiac magnetic resonance imaging in myocardial inflammation in autoimmune rheumatic diseases: An appraisal of the diagnostic strengths and limitations of the Lake Louise criteria. Int J Cardiol. 2018 Feb 1;252:216-9. [DOI] [PubMed]
- 454.Barlow JB, Marcus RH, Pocock WA, Barlow CW, Essop R, Sareli P. Mechanisms and management of heart failure in active rheumatic carditis. S Afr Med J. 1990 Aug 18;78(4):181-6. [PubMed]
- 455.Atatoa-Carr P, Lennon D, Wilson N. Rheumatic fever diagnosis, management, and secondary prevention: a New Zealand guideline. N Z Med J. 2008 Apr 4;121(1271):590-69. [PubMed]
- 456.Cilliers AM, Manyemba J, Saloojee H. Anti-inflammatory treatment for carditis in acute rheumatic fever. Cochrane Database Syst Rev. 2003;2: CD003176. [DOI] [PubMed]
- 457.Illingworth RS, Lorber J, Holt KS, Rendle-Short J. Acute rheumatic fever in children: a comparison of six forms of treatment in 200 cases. Lancet. 1957 Oct 5; 273(6997):653-9. [DOI] [PubMed]
- 458.Herdy GV, Pinto CA, Olivaes MC, Carvalho EA, Tchou H, Cosendey R, et al. Rheumatic carditis treated with high doses of pulsetherapy methylprednisolone. Results in 70 children over 12 years. Arq Bras Cardiol. 1999;72(5):601-6. [DOI] [PubMed]
- 459.Camara EJ, Braga JC, Alves-Silva LS, Camara GF, da Silva Lopes AA. Comparison of an intravenous pulse of methylprednisolone versus oral corticosteroid in severe acute rheumatic carditis: a randomized clinical trial. Cardiol Young. 2002 Mar;12(2):119-24. [DOI] [PubMed]
- 460.Hillman ND, Tani LY, Veasy LG, Lambert LL, Di Russo GB, Doty DB, et al. Current status of surgery for rheumatic carditis in children. Ann Thorac Surg. 2004 Oct;78(4):1403-8. [DOI] [PubMed]
- 461.Finucane K, Wilson N. Priorities in cardiac surgery for rheumatic heart disease. Glob Heart. 2013 Sep;8(3):213-20. [DOI] [PubMed]
- 462.Mavrogeni S, Karabela G, Stavropoulos E, Gialafos E, Sfendouraki E, Kyrou L, Kolovou G. Imaging patterns of heart failure in rheumatoid arthritis evaluated by cardiovascular magnetic resonance. Int J Cardiol 2013;168(4):4333–5. [DOI] [PubMed]
- 463.Hachulla AL, Launay D, Gaxotte V, de Groote P, Lamblin N, Devos P, et al. Cardiac magnetic resonance imaging in systemic sclerosis: a cross-sectional observational study of 52 patients. Ann Rheum Dis. 2009;68(12):1878-84. [DOI] [PMC free article] [PubMed]
- 464.Caforio ALP, Adler Y, Agostini C, Allanore Y, Anartesakis A, Arads M, et al. Diagnosis and management of myocardial involvement in systemic immune-mediated diseases: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Disease. Eur Heart J. 2017; 38(35):2649-62. [DOI] [PubMed]
- 465.Peretto G, Sala S, Rizzo F, De Luca, Campochiaro C, Sartorelli S, et al. Arrhythmias in myocarditis: State of the art. Heart Rhythm. 2019;16(5):793-801. [DOI] [PubMed]
- 466.Calforio ALP, Pankuweit S, Arbustini H, Basso C, Gimeno-Blanes J, Felkix SB, et al. Current state of knowledge on aetiology,diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J.2013 ;34(33):2638-48. [DOI] [PubMed]
- 467.Steinberg JS, Varma N, Cygankiewicz I, Aziz P, Balsam P, Baranchuk A, et al. 2017 ISHNE-HRS expert consensus statement on ambulatory ECG and external cardiac monitoring/telemetry Heart Rhythm. 2017;14(7):e55–e96. [DOI] [PubMed]
- 468.-e420.Cronin E, Bogun FM, Maury P, Peichl P, Chen M, Namboodiri N, et al. 2019 HRS/EHRA/APHRS/LAHRS expert consensus statement on catheter ablation of ventricular arrhythmias. Heart Rhythm. 2020;17(1):e2-e154, [DOI] [PMC free article] [PubMed]
- 469.Pelargonio G, Pinnacchio G, Narducci ML, Pieroni Pernd F, Bencardino G, et al et al. Long-Term Arrhythmic Risk Assessment in Biopsy-Proven Myocarditis. JACC: Clin Electrophysiol. 2020;6(5):574-82. [DOI] [PubMed]
- 470.Al-Khgatib, Stevenson WG, Ackerman MJ, Bryant WJ, Callans DJ, Curtis AB, et al. 2017 ANA/ACC/HRS guideline for management of patients with ventricular arrhythmias and prevention of sudden cardiac death. Circulation. 2018;138(13):e272-e391.Erratum in Circulation.2018;138(13):e419-e420. [DOI] [PubMed]
- 471.Pavlicek V, Kindermann I, Wintrich J, Mahfoud F, Klingel K, Bohm M, et al. Ventricular arrhythmias and myocardial inflamation: long-term follow-up patients with suspected myocarditis. Int J Cardiol. 2019;274:132-7. [DOI] [PubMed]
- 472.Baksi AJ, Kanaganayagam GS, Prasad SKArrhythmias in viral myocarditis and pericarditis. Card Electrophysiol Clin. 2015;7(2):269-81. [DOI] [PubMed]
- 473.Thiene G, Basso C. Arrhythmogenic right ventricular cardiomyopathy: an update. Cardiovasc Pathol. 2001;10(3):109–17. [DOI] [PubMed]
- 474.Salerno F, Girerd N, Chalabreysse L, Billaud G, Lina B, Chevalier P, et al. Myocarditis and cardiac channelopathies: a deadly association? Int J Cardiol 2011;147(3):468–70. [DOI] [PubMed]
- 475.Subahi A, Akintoye E, Yassin AS, Abubakar H, Adegbala D, Mishra T, et al. Impact of atrial fibrillation on patients hospitalized for acute myocarditis: Insights from a nationally-representative United States cohort. Clin Cardiol. 2019;42(1):26-31. [DOI] [PMC free article] [PubMed]
- 476.Chen S, Hoss S, Zeniou V, Shauer A, Admon D, Zwas DR, et al. Electrocardiographic Predictors of Morbidity and Mortality in Patients with Acute Myocarditis: the Importance of QRS-T Angle. J Card Fail. 2018 ;24(1):3-8. [DOI] [PubMed]
- 477.White JA, Hansen R Abdelhaleem A, Mikami Y, Peng M, Rivest S, et al. Natural History of Myocardial Injury and Chamber Remodeling in Acute Myocarditis. Circ Cardiovasc Imaging. 2019 ;12(7):e008614. [DOI] [PubMed]